提高坛紫菜多糖生物活性的方法与流程
本发明属于化学化工技术领域,涉及一种通过酶解坛紫菜粗多糖使其生物活性得到增强的方法。
背景技术:
坛紫菜属红藻纲,红毛菜科,俗称紫菜、乌菜,主要在我国福建、浙江等南部沿海地区多有种植,富含蛋白质、多糖和维生素,是一种食用与药用价值很高的海藻植物,所以很受人们的欢迎。紫菜味美价廉,资源丰富,综合这些特性,紫菜成为了一个研究热点,因此将坛紫菜开发成功能食品有很好的前景。坛紫菜多糖是一种半乳聚糖硫酸酯,占紫菜干重的30%左右,不同种类、不同季节和不同生长地区提取出的紫菜多糖的化学组分不同。坛紫菜粗多糖的分子量较大,生物活性较低。
对多糖进行化学修饰和将其水解为分子量较小的组分都可使多糖的生物活性得到提高,但化学修饰可能会带来安全性问题。水解的方法虽然较多,其中酶法降解的优点是作用条件温和,且可避免硫酸基的脱落,缺点是不易得到水解效率高的酶。目前对坛紫菜多糖的酶法降解尚未见报道。
技术实现要素:
本发明要解决的技术问题是提出一种提高坛紫菜多糖生物活性的方法;
为解决上述技术问题,本发明提出一种提高坛紫菜多糖生物活性的方法,包括以下步骤:
将坛紫菜粗多糖(cph)溶解于ph为3.5~6.0的缓冲液中,加入水解酶,使多糖终浓度为2~10mg/ml,水解酶终浓度为20~60u/ml,之后进行酶解反应,获得降解液;
所述酶解反应的条件为:ph3.5~6.0,反应温度为30~70℃,反应时间为0.5~4h。
将降解液进行水浴处理(90±5℃,15±2min)使酶失活,离心,得上清液ⅰ。
将上清液ⅰ进行透析(截留分子量为3500da的透析袋透析72h),将所得透析液(留在透析袋内的液体)旋蒸(60~65℃)浓缩至原体积的20~30%,冷冻干燥(-50~-60℃,24±1h),得到坛紫菜降解多糖(dcph)。
作为本发明提高坛紫菜多糖生物活性的方法的改进:
所述多糖终浓度为4mg/ml,水解酶终浓度为50u/ml;
所述酶解反应的条件为:ph5.0,反应温度为47.5℃,反应时间为2h。
作为本发明提高坛紫菜多糖生物活性的方法的进一步改进:
所述水解酶为果胶酶;
所述缓冲液为乙酸-乙酸钠缓冲液。
作为本发明提高坛紫菜多糖生物活性的方法的进一步改进:
将所得坛紫菜降解多糖(dcph)进行分离纯化,包括以下步骤:
①、粗分:
向坛紫菜降解多糖(dcph)中加入去离子水,配制获得浓度为35~45mg/ml的坛紫菜降解多糖(dcph)溶液,离心(8000rpm的转速下离心10分钟),取上清液ⅱ,将上清液ⅱ均匀(2min时间内滴加完毕)的滴入deaecellulose-52层析柱中,依次用去离子水、浓度为0.1mol/l、0.3mol/l、0.5mol/l、0.7mol/l、0.9mol/l的nacl溶液进行洗脱,流速为1ml/min(当检测到洗脱剂对应的洗脱液中不含有多糖时,则换下一种洗脱剂进行洗脱;可采用硫酸-苯酚法隔管检测其在490nm处的紫外吸收值从而判断是否含有多糖);
分别收集并合并浓度为0.3mol/l、0.5mol/l、0.7mol/l的nacl溶液洗脱出的3种含多糖的洗脱液,分别旋蒸浓缩(60℃下浓缩至约为原体积的8~12%),透析(用截留分子量为3500da的透析袋透析72h)除盐,将所得透析液冷冻干燥(-50~-60℃浓缩干燥至恒重),得到坛紫菜酶解多糖的三个分离组分。
注:采用deaecellulose-52柱层析进行初步分离纯化,柱子规格为60cm×φ2.6cm,有效长度为50cm。
②、纯化:
将步骤①所得3种分离组分分别进行以下操作:
按照45~55mg:1ml的比例,将分离组分溶于去离子水中,离心(8000rpm的转速下离心10分钟),取上清液ⅲ,加于sephadexg-100凝胶柱的凝胶表面上,用去离子水进行洗脱,流速为0.25ml/min,自动收集器收集并合并含多糖的洗脱液,旋转蒸发浓缩(60℃的温度下浓缩至为原体积的8~12%),冷冻干燥(-50~-60℃浓缩干燥至恒重),获得对应分离组分的纯化多糖,即,p1、p2、p3。
注:采用sephadexg-100凝胶色谱柱,层析柱规格为60cm×φ1.6cm,柱子的有效体积为50cm×φ1.6cm;
作为本发明提高坛紫菜多糖生物活性的方法的进一步改进:
所述坛紫菜多糖生物活性包括抗氧化活性、胆酸结合活性及免疫调节活性。
为解决上述技术问题,本发明还提出一种如上述方法制备所得到的坛紫菜降解多糖、纯化多糖作为功能性食品基料的应用。
备注说明:本发明坛紫菜粗多糖按文献文献报道方法制备(jiexu,li-lixu,qin-weizhou,shu-xianhao,taozhou,hu-junxie.enhancedinvitroantioxidantactivityofpolysaccharidesfromenteromorphaproliferabyenzymaticdegradation.journaloffoodbiochemistry.doi:10.1111/jfbc.12218)。
本发明具有如下技术效果:
1.与坛紫菜粗多糖(cph)相比,本发明得到的坛紫菜降解多糖(dcph)的体外抗氧化活性、胆酸结合活性和免疫活性都得到显著提高。降解过程中对表现生物活性很重要的硫酸根基本没有受到影响。
2.与dcph相比,本发明得到的分离纯化多糖(p1、p2、p3)的体外抗氧化活性更强,对raw264.7巨噬细胞的增值、吞噬、no释放能力均显著提高,表明免疫活性增强。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细说明。
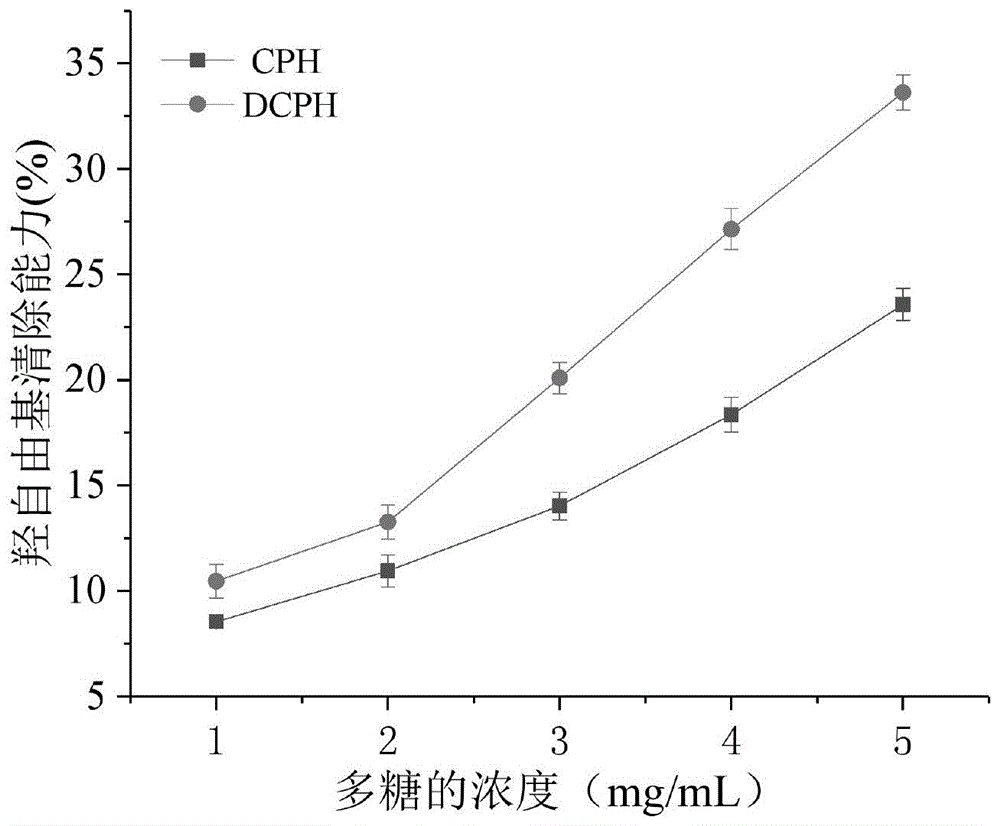
图1是由本发明实施例1-1得到的降解多糖(dcph)与粗多糖(cph)的羟自由基清除能力的测定结果。
图2是由本发明实施例1-1得到的降解多糖(dcph)与粗多糖(cph)的还原力的测定结果。
图3是由本发明实施例1-1得到的降解多糖(dcph)与粗多糖(cph)的胆汁酸结合能力的测定结果。
图4是由本发明实施例2-1的分离纯化多糖(p1、p2、p3)的dpph自由基清除能力的测定结果。
图5是由本发明实施例2-1的分离纯化多糖(p1、p2、p3)的羟自由基清除能力的测定结果。
图6是由本发明实施例2-1的分离纯化多糖(p1、p2、p3)还原力的测定结果。
图7是由本发明实施例1-1得到的降解多糖dcph与实施例2-1得到的p1、p2与p3对raw264.7巨噬细胞增殖能力的影响(图7上表示培养24h后的测试结果,图7下表示培养48h后的测试结果)。
图8是由本发明实施例1-1得到的降解多糖dcph与实施例2-1得到的p1、p2与p3对raw264.7巨噬细胞吞噬能力的影响(图8上表示培养24h后的测试结果,图8下表示培养48h后的测试结果)。
图9是由本发明实施例1-1得到的降解多糖dcph与实施例2-1得到的p1、p2与p3对raw264.7巨噬细胞释放no的能力的影响(图9上表示培养24h后的测试结果,图9下表示培养48h后的测试结果)。
具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此。
实施例1-1:提高坛紫菜多糖生物活性的方法,包括以下步骤:
将坛紫菜粗多糖溶解于乙酸-乙酸钠缓冲液(ph5.0)中,加入果胶酶(3万u/g),使所得的体系中多糖终浓度为4mg/ml,果胶酶终浓度为50u/ml,该体系在ph为5.0,温度为47.5℃的条件下进行酶解反应2h,获得降解液;
注:体系的ph由乙酸-乙酸钠缓冲液控制,即,选用ph5.0的乙酸-乙酸钠缓冲液,所得体系ph为5.0。
乙酸-乙酸钠缓冲液为现有常用的缓冲液,故无需告知其具体配制方法,相关领域的技术人员也能配制获得同ph值的乙酸-乙酸钠缓冲液。
将降解液置于90℃水浴锅中15分钟使酶失活,离心(6000r/min的转速下离心10分钟),得上清液ⅰ。所得上清液ⅰ对dpph自由基的清除率达81.2%。
将所得上清液ⅰ用截留分子量为3500da的透析袋透析72h,将所得透析液(保留在透析袋中的溶液)于60℃旋蒸浓缩至原体积的1/4,冷冻干燥(-60℃,24h),得到降解多糖dcph1-1。dcph1-1的组成及分子量见表1。
表1、坛紫菜降解多糖dcph1-1和粗多糖cph的组成和分子量比较
注:gal,glc,man,ara,fuc,xyl和rha分别代表半乳糖、葡糖糖、甘露糖、岩藻糖、木糖和鼠李糖。
实施例1-2、
将实施例1-1中果胶酶终浓度由“50u/ml”更改为“40u/ml”,反应时的温度由“47.5℃”更改为“50℃”,其余均等同于实施例1-1。
所得上清液ⅰ对dpph自由基的清除率达76.0%。
实施例1-3、
将实施例1-1中反应时的温度由“47.5℃”更改为“60℃”,其余均等同于实施例1-1。
所得上清液ⅰ对dpph自由基的清除率达74.2%。
实施例1-4、
将实施例1-1中果胶酶终浓度由“50u/ml”更改为“30u/ml”,反应时的ph值由“5”更改为“4.5”(即,采用ph为4.5的乙酸-乙酸钠缓冲液),温度由“47.5℃”更改为“50℃”,其余均等同于实施例1-1。
所得上清液ⅰ对dpph自由基的清除率为52.8%。
实施例1-5、
将实施例1-1中反应时的温度由“47.5℃”更改为“50℃”,反应时间由“2h”更改为“3h”,其余均等同于实施例1-1。
所得上清液ⅰ对dpph自由基的清除率达79.3%。
对比例1-1~1-6、将实施例1-1中酶解反应的参数更改为表2所示的参数,其余均等同于实施例1-1,各对比例所得上清液ⅰ对dpph自由基的清除率如表2所示。
注:对比例1-2~1-5实际为糖化酶、纤维素酶、淀粉酶、和脂肪酶在的终浓度为20u/ml时,在各自最适ph以及最适温度下进行酶解反应。
表2不同酶降解多糖的dpph清除率
实施例2-1、
①、deae-52离子交换柱层析分级纯化:
向实施例1-1制备获得的dcph1-1中加入去离子水,配制获得浓度为40mg/ml的dcph1-1溶液,离心(8000rpm的转速下离心10分钟),取上清液ⅱ,用滴管将上清液ⅱ缓慢且均匀(2min内滴加完毕)地滴入deaecellulose-52层析柱中,上样体积为10ml,待多糖溶液自然沉入填料里,依次用去离子水、浓度为0.1mol/l、0.3mol/l、0.5mol/l、0.7mol/l、0.9mol/l的nacl溶液这6种洗脱剂分别进行洗脱,流速为1ml/min,每9分钟收集1管,用硫酸-苯酚法跟踪检测洗脱液中多糖的含量,当检测到所得洗脱液中不含有多糖时,则换下一种洗脱剂进行洗脱,绘制洗脱曲线。
由于用去离子水、0.1mol/lnacl和0.9mol/lnacl进行洗脱所得的洗脱液中含糖量较低,故仅分别收集浓度为0.3mol/l、0.5mol/l、0.7mol/l的nacl溶液相对应的含多糖的洗脱液;
注:将所收集的洗脱液按照所用洗脱剂分别进行合并,即,将所收集的浓度为0.3mol/l的nacl溶液进行洗脱获得的含多糖的洗脱液进行合并、将所收集的浓度为0.5mol/l的nacl溶液进行洗脱获得的含多糖的洗脱液进行合并、将所收集的浓度为0.7mol/l的nacl溶液进行洗脱获得的含多糖的洗脱液进行合并;
将上述所得3种合并后的洗脱液分别进行如下处理:
用旋转蒸发仪旋蒸浓缩(60℃下浓缩至为原体积的10%),透析(用截留分子量为3500da的透析袋透析72h)除盐,将所得透析液(保留在透析袋中的溶液)冷冻干燥(-60℃干燥至恒重)备用,得到坛紫菜酶解多糖的三个分离组分。
②、sephadexg-100凝胶柱层析纯化:
将步骤①所得三个分离组分分别利用sephadexg-100凝胶柱层析纯化,纯化后分别得到p1、p2、p3三个多糖。
对每个分离组分具体进行如下步骤:
按照50mg:1ml的比例,将步骤①所得到的分离组分全部溶于去离子水中,离心(8000rpm的转速下离心10分钟),取上清液ⅲ,加于sephadexg-100凝胶柱的凝胶表面上,待样品溶液流入凝胶内,用去离子水进行洗脱,流速为0.25ml/min,自动收集器收集洗脱液,每试管收集5ml。用硫酸-苯酚法跟踪检测洗脱液中多糖的含量,直至无多糖检测出为止,合并含多糖的洗脱液,旋转蒸发仪浓缩(60℃的温度下浓缩至为原体积的10%),冻干(-50~60℃浓缩干燥至恒重),获得对应分离组分相对应的纯化多糖,将其分别命名为p1、p2、p3,如表3所示。
表3、坛紫菜降解多糖的三个纯化多糖组分的组成和分子量
注:gal,glc,man,ara,fuc,xyl和rha分别代表半乳糖、葡糖糖、甘露糖、岩藻糖、木糖和鼠李糖。
实验1、dpph自由基清除能力的测定:
采用文献(espinjc,soler-rivasc,wichershj,etal.anthocyanin-basednaturalcolorants:anewsourceofantiradicalactivityforfoodstuff[j].journalagriculturalfoodchemistry,2000,48(5):1588-1592.)报道方法,将实施例2-1得到的分离纯化多糖进行dpph自由基清除能力的测定。并与粗多糖进行比较。由图4可见,p1、p2、p3的dpph清除能力相差不是特别明显;
p1、p2、p3的ic50分别6.28mg/ml、5.82mg/ml、5.17mg/ml,与图1相吻合。与未降解多糖cph相比dpph清除能力得到显著提高(cph的ic50为17.55mg/ml),但仍小于维生素c(在0.02mg/ml时清除率已达近95%)。
实验2、羟自由基清除能力的测定:
采用文献(dengc,huz,fuh,etal.chemicalanalysisandantioxidantactivityinvitroofaβ-d-glucanisolatedfromdictyophoraindusiata[j].internationaljournalofbiologicalmacromolecules,2012,51(1-2):70-75.)报道方法,将实施例1-1得到的降解多糖与实施例2-1得到的分离纯化多糖进行羟自由基清除能力的测定,并与粗多糖进行比较。由图1可见,dcph的清除能力优于cph,cph、dcph的ic50分别12.32mg/ml、7.83mg/ml。
由图5可见,p1、p2、p3的羟自由基清除能力随着多糖浓度的增加而增强;p1、p2、p3的ic50分别7.05mg/ml、5.87mg/ml、6.53mg/ml,与图5相吻合,但总体的清除羟自由基的能力仍小于维生素c(ic50为0.31mg/ml)。
实验3、还原力的测定:
采用文献(yeng,chenh.antioxidantactivityofvariousteaextractsinrelationtotheirantimutagenicity[j].journalofagriculturalandfoodchemistry,1995,43:27-32.)报道方法,将实施例1-1得到的降解多糖与实施例2-1得到的分离纯化多糖进行还原力的测定,并与粗多糖做比较。由图2可见,cph的还原力弱于dcph。由图6可见,p1、p2、p3的还原力大小为:p3﹥p2﹥p1。
实验4、胆汁酸结合能力:
采用文献(何平伟.三种不同谷物可溶性(1→3)(1→4)-β-d-葡聚糖结构与束缚胆汁酸特性的对比研究[d].华南理工大学,2016.)报道方法,以消胆胺为阳性对照,纤维素为阴性对照,分别对多糖结合胆酸钠、鹅去氧胆酸钠、甘氨胆酸钠、牛磺胆酸钠、去氧胆酸钠的能力进行测定。将实施例1-1得到的降解多糖进行胆汁酸结合能力的测定,并与粗多糖进行比较。由图3可见,消胆胺对于各种胆酸盐的结合能力都很强,结合率都在80%以上,纤维素对各种胆酸盐的结合能力均在5%以下。实施例1-1得到的降解多糖dcph对各种胆酸盐的结合能力大于未降解多糖cph,表明降解后多糖具有更好的降血脂功能。
实验5-1、mtt法测定坛紫菜多糖对raw264.7细胞增殖能力的影响:
采用文献(李龙.坛紫菜和龙须菜多糖对巨噬细胞免疫调节作用的研究[d].集美大学,2015.)报道方法,将实施例1-1得到的降解多糖与实施例2-1得到的分离纯化多糖对raw264.7巨噬细胞增值能力的影响进行测定。
取处于对数生长期的raw264.7巨噬细胞,调整细胞浓度,以2×105个/ml、95μl/孔接种于96孔板中;
加入不同浓度的多糖溶液(cph、dcph、p1、p2、p3),终体积为100μl,各多糖的最终浓度分别为25μg/ml、50μg/ml、100μg/ml、200μg/ml、400μg/ml。空白对照组用pbs(磷酸盐缓冲液),阳性对照组为lps(脂多糖),其最终浓度为5μg/ml。
每组设置5个复孔。在37℃、5%co2下分别继续培养24h、48h。培养完成后,每孔加入10μl的mtt溶液(5mg/ml),轻轻混匀后,在37℃、5%co2细胞培养箱中继续孵育4h,吸净孔内培养液,每孔加入100μl甲瓒溶液(试剂盒中组分c),轻轻震荡使甲臜全部溶解,在酶标免疫检测仪570nm测定od值。
图7为mtt法测坛紫菜多糖分别作用raw2647巨噬细胞24h和48h对其增值能力的影响。结果表明,当坛紫菜多糖(cph、dcph、p1、p2、p3)浓度为100μg/ml时,促进细胞增值能力最强。另外,作用时间越长,细胞增值能力相对降低,但与空白对照组相比,仍然是具有促进细胞增值的能力。
实验5-2、中性红法检测坛紫菜多糖对raw264.7巨噬细胞的吞噬能力的影响:
采用文献(王慧.aeps对raw264.7细胞的免疫调控作用及其机制研究[d].浙江大学,2010.)报道方法,将实施例1-1得到的降解多糖与实施例2-1得到的分离纯化多糖组分对raw264.7巨噬细胞吞噬能力的影响进行测定。
取处于对数生长期的raw264.7巨噬细胞,调整细胞浓度,以1×106个/ml、95μl/孔接种于96孔板中;加入不同浓度的多糖溶液(cph、dcph、p1、p2、p3),终体积为100μl,各多糖的最终浓度分别为25μg/ml、50μg/ml、100μg/ml、200μg/ml、400μg/ml。空白对照组用pbs,阳性对照组为lps(最终浓度为5μg/ml);
每组设置5个复孔。在37℃、5%co2下分别继续培养24h、48h。培养完成后,弃去每孔中的细胞培养液,每孔中加入100μl0.0075%中性红溶液,37℃、5%co2分别继续培养2h。弃去中性红溶液,用预热的pbs缓冲液小心清洗每孔三次,每孔150μl,然后加入120μl细胞裂解液,静置10min。将96孔板置于酶标仪(540nm)测量吸光值。
由图8可见,随着多糖浓度、时间的增加,巨噬细胞吞噬能力逐渐提高,但作用48h的效果比作用24h的效果提高的程度不大,与空白对照组相比,各种多糖样品都表现出了促进raw264.7对中性红的吞噬能力。与坛紫菜粗多糖(cph)相比,对应多糖浓度下的坛紫菜降解多糖及纯化多糖(dcph、p1、p2、p3)促进raw264.7巨噬细胞的吞噬能力的活性均显著提高。
实验5-3、griess法测定坛紫菜多糖对raw264.7细胞分泌no的影响:
采用文献(李龙.坛紫菜和龙须菜多糖对巨噬细胞免疫调节作用的研究[d].集美大学,2015.)报道方法,将实施例1-1得到的降解多糖与实施例2-1得到的纯化多糖对raw264.7巨噬细胞分泌no能力的影响进行测定。
取处于对数生长期的raw264.7巨噬细胞,调整细胞浓度,以1×106个/ml、95μl/孔接种于96孔板中;
加入不同浓度的多糖溶液(cph、dcph、p1、p2、p3),终体积为100μl,各多糖的最终浓度分别为25μg/ml、50μg/ml、100μg/ml、200μg/ml、400μg/ml。空白对照组用pbs替代,阳性对照组为lps(最终浓度为5μg/ml);
每组设置5个复孔。在37℃、5%co2下分别继续培养24h、48h。培养完成后,将细胞培养上清液转移至另一96孔细胞培养板中,各孔加入100μl新配制的griess试剂(准确称取磺胺1.0g、萘乙二胺0.1g,用适量去离子水溶解,再加入4.71ml85%的磷酸,使磷酸终浓度为4%,最后定容于100ml的容量瓶中),置于普通培养箱中(37℃)反应20min,用酶标仪(570nm)测量吸光值。
由图9可见,no的释放量呈现出明显的剂量相关性,随着多糖浓度、时间的增加,no释放量呈现出上升的趋势。多糖浓度为400ug/ml时,与坛紫菜粗多糖(cph)相比,坛紫菜降解多糖及纯化多糖(dcph、p2、p3)促进raw264.7巨噬细胞释放no的活性显著增强。
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!