一种高分子量聚(γ-丁内酯)的制备方法与流程
本申请请求2018年10月23日向中国国家知识产权局提交的、申请号为201811239870.9的专利申请的优先权和权益,并且通过参照将其全文并入此处。
本发明涉及高分子材料领域,具体而言,本发明涉及一种高分子量聚(γ-丁内酯)的制备方法,以及通过该方法制备得到的聚(γ-丁内酯)。
背景技术:
聚(γ-丁内酯)是一类重要的脂肪族聚酯,具有良好的生物相容性和生物可降解性,在生物医药领域具有广阔的应用前景。聚(γ-丁内酯)在体内具有合适的降解速率,介于聚乙交酯和聚乳酸之间,并且与现有的生物材料相比,聚(γ-丁内酯)在降解时不会造成酸性物质在组织中的积累,不易引发炎症。聚(γ-丁内酯)可以通过生物发酵法和化学合成法两种方法得到。其中,生物发酵法得到的聚(γ-丁内酯)目前已经获得美国食品药品监督管理局(fda)的批准,可以作为手术缝合线和疝气补片在临床上使用。但是,生物发酵法具有工艺流程复杂,所得产物纯化困难,残留生物物质易引起机体免疫反应等缺点。
聚(γ-丁内酯)也可以通过化学合成法,利用γ-丁内酯的开环聚合反应得到。γ-丁内酯是一种来源广泛、价格低廉的生物基单体,可以从生物质原料,如玉米、小麦等作物得到,是一种可再生原材料。利用化学合成法得到的聚(γ-丁内酯)可以对其进行官能团修饰,并且没有生物物质残留,更加适合在组织工程支架等生物医药方面的应用。但γ-丁内酯具有五元环结构,环张力很小,长期以来被认为是一种不可聚合的单体,目前也仅有少数文献报道其化学合成。文献报道的能够合成聚(γ-丁内酯)的催化剂包括金属有机催化剂、有机磷腈碱催化剂以及n-杂环乙烯催化剂三种(naturechemistry,2016,8(1),42-49;polymerchemistry,2018,9(26),3674-3683.)其中,金属有机催化剂由于毒性较大,并且容易残留在所得产物聚(γ-丁内酯)中,因此不适合在生物医药领域应用。而有机磷腈碱催化剂和n-杂环乙烯催化剂则由于其活性较低,根据文献报道,难以制备得到高分子量的聚(γ-丁内酯),所得产物机械性能较差,不能满足生物医药方面实际应用的要求。
技术实现要素:
本发明旨在至少在一定程度上解决相关技术问题之一。为此,本发明的一个目的在于提出一种高分子量聚(γ-丁内酯)的制备方法,以及通过该方法制备得到的聚(γ-丁内酯)。该制备聚(γ-丁内酯)的方法可制备得到满足生物医药领域应用要求的高分子量聚(γ-丁内酯)产品。
在本发明的一个方面,本发明提出了一种制备聚(γ-丁内酯)的方法。根据本发明的实施例,该方法包括:
使γ-丁内酯在催化体系中进行聚合反应,得到聚(γ-丁内酯);所述催化体系包括:引发剂、催化剂和脲,所述催化剂为碱金属、碱金属化合物和有机磷腈化合物中的至少之一。
根据本发明实施例的制备聚(γ-丁内酯)的方法,以碱金属、碱金属化合物和有机磷腈化合物中的至少之一和引发剂、脲组成催化体系,所使用的催化剂和脲毒性低,很容易从产物中除去;同时,催化体系活性高,制备得到的聚(γ-丁内酯)产品分子量高,具有良好的机械性能。
另外,根据本发明上述实施例的制备聚(γ-丁内酯)的方法还可以具有如下附加的技术特征:
在本发明的一些实施例中,所述制备聚(γ-丁内酯)的方法包括:(1)将所述引发剂、所述催化剂和所述脲在有机溶剂中混合,得到所述催化体系;(2)将所述γ-丁内酯加入到所述催化体系中进行聚合反应,得到所述聚(γ-丁内酯)。
在本发明的一些实施例中,所述引发剂为一元醇或多元醇。
在本发明的一些实施例中,所述一元醇选自甲醇、乙醇、异丙醇、叔丁醇、苄醇、苯乙醇、苯丙醇、二苯基甲醇、2,2-二苯基乙醇、端羟基寡聚乙二醇单甲醚中的至少之一;所述多元醇选自2,2-二苯基乙醇、乙二醇、1,2-丙二醇、1,3-丙二醇,1,4-丁二醇、1,2-苯二甲醇、1,3-苯二甲醇、1,4-苯二甲醇、2,2’-联苯二甲醇、丙三醇和季戊四醇中的至少之一。
在本发明的一些实施例中,所述碱金属选自锂、钠和钾中的至少之一。
在本发明的一些实施例中,所述碱金属化合物选自氢化钾、氢化钠、萘钠、萘钾、联苯钠,二苯甲基钠和二苯甲基钾中的至少之一。
在本发明的一些实施例中,所述有机磷腈化合物选自六[三(二甲基胺)磷氮烯]三聚磷腈、磷腈配体p4-叔丁基和磷腈配体p2-叔丁基中的至少之一。
在本发明的一些实施例中,所述有机溶剂选自甲苯、四氢呋喃、二氯甲烷、三氯甲烷、二氧六环、乙腈和n,n-二甲基甲酰胺中的至少之一。
在本发明的一些实施例中,所述脲为式(i)所示化合物,
式(i)中,r1和r2分别独立为甲基、乙基、丙基、异丙基、环己基、苯基、4-氯苯基、4-甲氧基苯基、4-三氟甲基苯基、2,6-二甲基苯基、2,4-二甲氧基苯基或2,4,6-三甲氧基苯基。
在本发明的一些实施例中,所述脲具有以下其中之一所示的结构:
在本发明的一些实施例中,所述催化剂与所述引发剂的摩尔比例为(1~60):3,所述催化剂与所述脲的摩尔比例为1:(1~10),所述脲与所述γ-丁内酯的摩尔比例为1:(10~3000)。
在本发明的一些实施例中,将所述引发剂、所述催化剂和所述脲在有机溶剂中混合,并在-70~-10℃下搅拌10~30min,得到所述催化体系。
在本发明的一些实施例中,所述聚合反应在-70~-20℃进行0.5~48h完成。
在本发明的一些实施例中,所述γ-丁内酯在所述催化体系中的摩尔浓度为4~13mol/l。
在本发明的一些实施例中,步骤(2)包括:将所述γ-丁内酯加入到所述催化体系中进行聚合反应后,向反应体系中加入含活性官能团的化合物终止反应,并利用甲醇沉淀,得到所述聚(γ-丁内酯)。
在本发明的一些实施例中,所述含活性官能团的化合物选自酸、酰氯、酸酐、硫代异氰酸酯、异氰酸酯和卤代烃中的至少之一;优选地,所述含活性官能团的化合物选自乙酸、苯甲酸、丙烯酰氯、甲基丙烯酰氯、醋酸酐、丁二酸酐、马来酰亚胺基丁酰氯、环氧氯丙烷、3-氯丙烯、3-氯丙炔、4-甲氧基苯基硫代异氰酸酯和4-甲氧苄基异氰酸酯中的至少之一。
在本发明的一些实施例中,所述含活性官能团的化合物与所述脲的摩尔比例为(1~10):1。
在本发明的另一方面,本发明提出了通过上述实施例的制备聚(γ-丁内酯)的方法制备得到的聚(γ-丁内酯)产品。该聚(γ-丁内酯)产品中催化剂和脲的残留量极低或无残留,能够满足生物医药领域的应用要求,且分子量高、具有良好的机械性能。
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
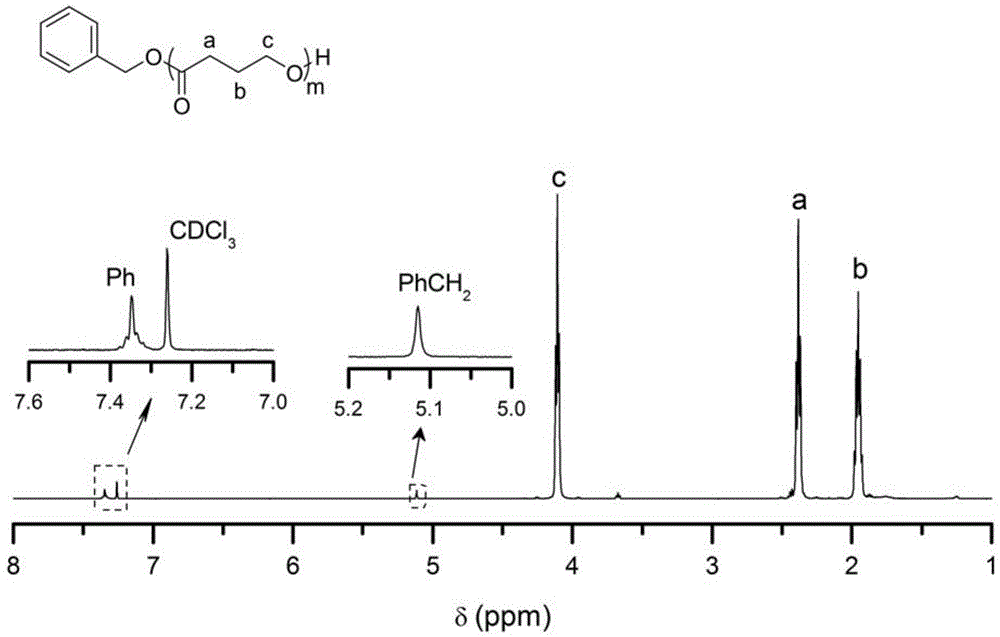
图1为实施例2中制得的聚(γ-丁内酯)的1hnmr谱图;
图2为实施例2中制得的聚(γ-丁内酯)的13cnmr谱图;
图3为对比实施例2和实施例2制得的聚(γ-丁内酯)的gpc谱图对比;
图4为对比实施例1和实施例3制得的聚(γ-丁内酯)的tga谱图对比;
图5为实施例3和实施例4制得的聚(γ-丁内酯)的拉伸曲线;
图6为实施例6制得的聚(γ-丁内酯)的gpc谱图;
图7为实施例7制得的聚(γ-丁内酯)的gpc谱图;
图8为实施例8制得的聚(γ-丁内酯)的gpc谱图;
图9为实施例8制得的聚(γ-丁内酯)的拉伸曲线;
具体实施方式
下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
在本发明的一个方面,本发明提出了一种制备聚(γ-丁内酯)的方法。根据本发明的实施例,该方法包括:使γ-丁内酯在催化体系中进行聚合反应,得到聚(γ-丁内酯);该催化体系包括:引发剂、催化剂和脲,催化剂为碱金属、碱金属化合物和有机磷腈化合物中的至少之一。
下面对根据本发明实施例的制备聚(γ-丁内酯)的方法进行进一步的详细描述。
根据本发明的实施例,该方法以碱金属、碱金属化合物和有机磷腈化合物中的至少之一和引发剂、脲组成催化体系。总的来说,催化体系中催化剂(碱金属、碱金属化合物和有机磷腈化合物中的至少之一)可以和脲发生相互作用将其脱质子化形成脲阴离子,而脲阴离子通过氢键相互作用同时活化聚合物增长链末端和单体,从而使催化体系表现出很高的聚合活性。另一方面,脲阴离子与增长链末端通过氢键结合后降低了增长链末端官能团的碱性,增大了增长链末端的空间位阻,从而降低了酯交换和链末端回咬的可能性,提高了聚合反应的可控性,利于制备得到高分子量的聚(γ-丁内酯)。具体而言,碱金属是一种强电子给体,在催化体系中很容易夺取脲基团中的质子氢,使其成为脲阴离子。碱金属化合物本身呈现强碱性,也可以夺取脲基团中的质子氢,使其成为脲阴离子。有机磷腈化合物除了本身是一种有机超强碱,可以夺取脲基团中的质子氢,使其成为脲阴离子外,有机磷腈化合物在有机溶剂中的溶解性比无机碱好,易于和脲形成均相催化体系。由此,该催化体系具有很高的催化活性,可以催化γ-丁内酯高转化率地聚合得到高分子量的聚(γ-丁内酯)。
另外,发明人在研究中发现,现有技术中虽然有涉及有机磷腈化合物与脲的催化体系制备聚酯的技术方案。但由于γ-丁内酯具有五元环结构、环张力很小,聚合过程中在热力学上是不利的,因而γ-丁内酯在聚合上与己内酯、戊内酯、丙交酯等常见环状内酯单体具有本质的不同,采用有机磷腈化合物与脲的催化体系通过γ-丁内酯开环聚合制备聚(γ-丁内酯)的研究未见报道。
根据本发明的一些实施例,本发明的制备聚(γ-丁内酯)的方法包括:(1)将引发剂、催化剂和脲在有机溶剂中混合,得到催化体系。(2)将γ-丁内酯加入到所述催化体系中进行聚合反应,得到所述聚(γ-丁内酯)。具体地,可以将引发剂、催化剂和脲溶于有机溶剂中,在低温下搅拌一段时间后,将γ-丁内酯加入上述混合溶液中,在一定温度下反应一段时间,得到聚(γ-丁内酯)。
根据本发明的实施例,上述引发剂可以为一元醇或多元醇。具体的,上述一元醇可以为选自甲醇、乙醇、异丙醇、叔丁醇、苄醇、苯乙醇、苯丙醇、二苯基甲醇、2,2-二苯基乙醇、端羟基寡聚乙二醇单甲醚中的至少之一;上述多元醇可以为选自2,2-二苯基乙醇、乙二醇、1,2-丙二醇、1,3-丙二醇,1,4-丁二醇、1,2-苯二甲醇、1,3-苯二甲醇、1,4-苯二甲醇、2,2’-联苯二甲醇、丙三醇和季戊四醇中的至少之一。以上醇类引发剂可以高效地引发γ-丁内酯的开环聚合反应,且原料来源广泛、廉价易得。另外,通过利用含端羟基的大分子醇作为引发剂,本发明的方法还可以用于制备含聚(γ-丁内酯)的嵌段共聚物。
根据本发明的实施例,上述碱金属可以为选自锂、钠和钾中的至少之一。根据本发明的实施例,上述碱金属化合物可以为选自氢化钾、氢化钠、萘钠、萘钾、联苯钠,二苯甲基钠和二苯甲基钾中的至少之一。以上碱金属和碱金属化合物均为超强碱,能够有效夺取脲基团的质子氢,且与碱金属醇盐不同,以上碱金属和碱金属化合物和脲之间的反应为不可逆反应,并且以上碱金属和碱金属化合物为非亲核性强碱,自身不会引发γ-丁内酯开环聚合,利于得到具有明确结构的高分子量聚(γ-丁内酯)。
根据本发明的实施例,上述有机磷腈化合物可以为选自六[三(二甲基胺)磷氮烯]三聚磷腈({[(nme2)3p=n]2p=n}3)、磷腈配体p4-叔丁基([(nme2)3p=n]3p=ntbu,tert-bu-p4)和磷腈配体p2-叔丁基([(nme2)3p=n](nme2)2p=ntbu,tert-bu-p2)中的至少之一。
在本发明的一些实施例中,所述脲为式(i)所示化合物,
式(i)中,r1和r2分别独立为甲基、乙基、丙基、异丙基、环己基、苯基、4-氯苯基、4-甲氧基苯基、4-三氟甲基苯基、2,6-二甲基苯基、2,4-二甲氧基苯基或2,4,6-三甲氧基苯基。
根据本发明的实施例,上述脲具有以下其中之一所示的结构:
根据本发明的实施例,上述有机溶剂选自甲苯、四氢呋喃、二氯甲烷、三氯甲烷、二氧六环、乙腈和n,n-二甲基甲酰胺中的至少之一。以上有机溶剂可以为引发剂、催化剂和γ-丁内酯单体提供良好的溶解性,且催化剂在以上有机溶剂中可以表现出强碱性,提高聚(γ-丁内酯)的收率。另外,由于催化剂和脲在甲醇中溶解性大,很容易将聚(γ-丁内酯)产品通过沉淀的方式从反应体系中分离出来,聚(γ-丁内酯)产品中催化剂和脲残留量极低或无残留(从图1和图2中可以看出),能够满足生物医药领域的应用要求。
根据本发明的一些实施例,在γ-丁内酯的聚合反应中,催化剂与引发剂的摩尔比例可以为(1~60):3,换言之,催化剂与引发剂的摩尔比例可以为1/3~20/1,例如1/3、1/1、3/1、5/1、10/1、20/1。催化剂与脲的摩尔比例可以为1:(1~10),换言之,催化剂与脲的摩尔比例可以为1/1~1/10,例如1/1、1/2、1/3、1/4、1/5、1/6、1/7、1/8、1/9或是1/10。脲与γ-丁内酯的摩尔比例可以为1:(10~3000),换言之,脲与γ-丁内酯的摩尔比例可以为1/10~1/3000,例如1/10、1/100、1/200、1/300、1/500、1/1000、1/1500、1/2000、1/2500或是1/3000。
根据本发明的一些实施例,γ-丁内酯在催化体系中的摩尔浓度为4~13mol/l,例如4mol/l、5mol/l、6mol/l、7mol/l、8mol/l、9mol/l、10mol/l、11mol/l、12mol/l或是13mol/l。需要说明的是,这里的γ-丁内酯浓度是指γ-丁内酯在引发剂、催化剂、脲和有机溶剂的催化体系中的浓度。如果γ-丁内酯的浓度过低,则聚合速率较慢,转化率较低,所得产物分子量较低。
根据本发明的一些实施例,将引发剂、催化剂和脲在有机溶剂中混合,并在-70~-10℃下搅拌10~30min,得到催化体系。其中,反应温度可以为-70℃、-60℃、-55℃、-50℃、-45℃、-40℃、-35℃、-30℃、-20℃或是-10℃。相对于直接将单体与引发剂、催化剂和脲混合进行反应,通过在上述条件下首先获得催化体系,再加入单体,可以进一步提高γ-丁内酯的转化率和所得聚(γ-丁内酯)的分子量。
根据本发明的一些实施例,γ-丁内酯在催化体系中的聚合反应在-70~-20℃进行0.5~48h完成。反应温度可以是-60℃、-55℃、-50℃、-45℃、-40℃、-35℃、-30℃或是-20℃。反应时间可以是0.5h、1h、2h、4h、8h、12h、16h、20h、24h、36h或是48h。发明人在实验中发现,反应温度过高,则γ-丁内酯无法聚合;反应时间过短,则γ-丁内酯的转化率较低,所得聚(γ-丁内酯)的分子量较低;而过多地延长反应时间,并不能进一步有效地提高γ-丁内酯的转化率和产物的分子量。
根据本发明的一些实施例,上述步骤(2)可以包括:将γ-丁内酯加入到催化体系中进行聚合反应后,向反应体系中加入含活性官能团的化合物终止反应,并利用甲醇沉淀,得到聚(γ-丁内酯)。根据本发明的实施例,终止反应后,可以简单地通过将反应体系加入到甲醇中来获得聚(γ-丁内酯)沉淀。由此,催化体系中未反应的引发剂、催化剂和脲等可留在溶剂中,分离得到的聚(γ-丁内酯)产品中催化剂和脲残留量极低或无残留,能够满足生物医药领域的应用要求。
根据本发明的一些实施例,上述含活性官能团的化合物可以包括选自酸、酰氯、酸酐、硫代异氰酸酯、异氰酸酯和卤代烃中的至少之一;优选地,上述含活性官能团的化合物选自乙酸、苯甲酸、丙烯酰氯、甲基丙烯酰氯、醋酸酐、丁二酸酐、马来酰亚胺基丁酰氯、环氧氯丙烷、3-氯丙烯、3-氯丙炔、4-甲氧基苯基硫代异氰酸酯和4-甲氧苄基异氰酸酯中的至少之一。
根据本发明的一些实施例,含活性官能团的化合物与脲的摩尔比例可以为(1~10):1。
在本发明的另一方面,本发明提出了通过上述实施例的制备聚(γ-丁内酯)的方法制备得到的聚(γ-丁内酯)产品。该聚(γ-丁内酯)产品中催化剂和脲的残留量极低或无残留,能够满足生物医药领域的应用要求,且分子量高、具有良好的机械性能。
需要说明的是,前文针对“制备聚(γ-丁内酯)的方法”所描述的特征和优点同样适用于该聚(γ-丁内酯)产品,在此不再一一赘述。
下面参考具体实施例,对本发明进行描述,需要说明的是,这些实施例仅仅是描述性的,而不以任何方式限制本发明。下述实施案例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
其中,六[三(二甲基胺)磷氮烯]三聚磷腈({[(nme2)3p=n]2p=n}3)根据文献(angewandtechemieinternationaledition,2017,56(42),12987-12990)报道的方法合成。以下实施例中报道的分子量均在四氢呋喃相凝胶渗透色谱(gpc)中测得,以窄分布的聚苯乙烯作为标样标定标准曲线。
实施例1
将(1mmol,74.1mg)叔丁醇,(1mmol,151.2mg)萘钠、(3mmol,432.4mg)1,3-二异丙基脲和46ml四氢呋喃加入反应瓶中,置于-50℃低温冷浴中搅拌10min,用注射器将(2000mmol,154ml)γ-丁内酯加入反应管中。反应在氮气保护下进行10h,加入2ml丙烯酰氯终止反应。将反应混合物溶于1l二氯甲烷中,倒入5l甲醇中,离心分离沉淀得到聚(γ-丁内酯)。
gpc测得数均分子量为86.1kg/mol,分子量分布为1.95。
实施例2
将(0.15mmol,16.2mg)苄醇、(0.15mmol,179.7mg)六[三(二甲基胺)磷氮烯]三聚磷腈、(0.45mmol,111.75mg)1-环己基-3-(4-甲氧基苯基)脲和1ml四氢呋喃加入反应管中,置于-50℃低温冷浴中搅拌10min,用注射器将(45mmol,3.46ml)γ-丁内酯加入反应管中。反应在氮气保护下进行4h,加入10滴醋酸终止反应。将反应混合物溶于15ml二氯甲烷中,倒入100ml甲醇中,离心分离沉淀得到聚(γ-丁内酯)。
gpc测得数均分子量为16.3kg/mol,分子量分布为1.80。所得产物核磁氢谱如图1所示,碳谱如图2所示。gpc曲线如图3所示,与不加脲的对比实施例2相比,其分子量明显增大。
实施例3
将(0.2mmol,21.6mg)苄醇、(0.8mmol,507mg)磷腈配体p4-叔丁基催化剂、(2.4mmol,668mg)1-环己基-3-(2,6-二甲氧基苯基)脲和4.6ml四氢呋喃加入反应管中,置于-50℃低温冷浴中搅拌10min,用注射器将(200mmol,15.4ml)γ-丁内酯加入反应管中。反应在氮气保护下进行12h,加入0.1ml丙烯酰氯终止反应。将反应混合物溶于30ml二氯甲烷中,倒入200ml甲醇中,离心分离沉淀得到聚(γ-丁内酯)。
gpc测得数均分子量为26.3kg/mol,分子量分布为1.60。所得产物热失重(tga)曲线如图4所示,与对比实施例1所得产物相比,其热稳定大大提高。所得产物拉伸曲线如图5所示。
实施例4
将(0.4mmol,54.5mg)苯丙醇、(1.6mmol,1.92g)六[三(二甲基胺)磷氮烯]三聚磷腈、(6.4mmol,1.97g)1-环己基-3-(2,6-二甲氧基苯基)脲和9.3ml四氢呋喃加入反应管中,置于-50℃低温冷浴中搅拌10min,用注射器将(400mmol,30.75ml)γ-丁内酯加入反应管中。反应在氮气保护下进行12h,加入0.2g醋酸酐终止反应。将反应混合物溶于50ml二氯甲烷中,倒入500ml甲醇中,离心分离沉淀得到聚(γ-丁内酯)。
gpc测得数均分子量为51.3kg/mol,分子量分布为1.80。所得产物拉伸曲线如图5所示。
实施例5
将(1.5mmol,90.2mg)异丙醇、(1.5mmol,60mg)氢化钾、(6mmol,1.68g)1-苯基-3-(4-三氟甲基苯基)脲和10ml四氢呋喃加入反应管中,置于-60℃低温冷浴中搅拌10min,用注射器将(450mmol,34.6ml)γ-丁内酯加入反应管中。反应在氮气保护下进行12h,加入1ml丁二酸酐终止反应。将反应混合物溶于50ml二氯甲烷中,倒入500ml甲醇中,离心分离沉淀得到聚(γ-丁内酯)。
gpc测得数均分子量为22.6kg/mol,分子量分布为1.76。
实施例6
将(0.2mmol,21.6mg)苄醇、(0.6mmol,14.4mg)氢化钠、(0.6mmol,130.9mg)1-环己基-3-苯基脲和4.6ml四氢呋喃加入反应管中,置于-40℃低温冷浴中搅拌10min,用注射器将(200mmol,15.4ml)γ-丁内酯加入反应管中。反应在氮气保护下进行4h,加入0.1ml醋酸终止反应。将反应混合物溶于30ml二氯甲烷中,倒入200ml甲醇中,离心分离沉淀得到聚(γ-丁内酯)。
gpc测得数均分子量为61.3kg/mol,分子量分布为2.17。所得产物gpc曲线如图6所示。
实施例7
将(0.2mmol,21.6mg)苄醇、(0.3mmol,6.9mg)钠、(0.6mmol,165.6mg)1-(4-氯苯基)-3-(4-甲氧基苯基)脲和2.53ml四氢呋喃加入反应管中,置于-50℃低温冷浴中搅拌10min,用注射器将(400mmol,30.8ml)γ-丁内酯加入反应管中。反应在氮气保护下进行4h,加入0.1ml醋酸酐终止反应。将反应混合物溶于100ml二氯甲烷中,倒入500ml甲醇中,离心分离沉淀得到聚(γ-丁内酯)。
gpc测得数均分子量为71.4kg/mol,分子量分布为1.99。所得产物gpc曲线如图7所示。
实施例8
将(2mmol,216mg)苄醇、(4mmol,160mg)氢化钾、(8mmol,2.02g)1-(4-氯苯基)-3-环己基脲和102ml四氢呋喃加入反应管中,置于-40℃低温冷浴中搅拌10min,用注射器将(3000mmol,231ml)γ-丁内酯加入反应管中。反应在氮气保护下进行8h,加入3ml丁二酸酐终止反应。将反应混合物溶于1.5l二氯甲烷中,倒入6l甲醇中,离心分离沉淀得到聚(γ-丁内酯)。
gpc测得数均分子量为88.3kg/mol,分子量分布为2.19。所得产物gpc曲线如图8所示。所得产物拉伸曲线如图9所示。
实施例9
将(0.1mmol,9.21mg)丙三醇、(0.3mmol,360mg)六[三(二甲基胺)磷氮烯]三聚磷腈、(0.9mmol,277mg)1-环己基-3-(2,6-二甲氧基苯基)脲和9.3ml四氢呋喃加入反应管中,置于-50℃低温冷浴中搅拌10min,用注射器将(400mmol,30.75ml)γ-丁内酯加入反应管中。反应在氮气保护下进行12h,加入0.2g甲基丙烯酰氯终止反应。将反应混合物溶于50ml二氯甲烷中,倒入500ml甲醇中,离心分离沉淀得到聚(γ-丁内酯)。
gpc测得数均分子量为115.3kg/mol,分子量分布为2.52。
对比实施例1
将(0.15mmol,10.52mg)甲醇钾、(0.45mmol,98.24mg)1-环己基-3-苯基脲和1ml四氢呋喃加入反应管中,置于-50℃低温冷浴中搅拌10min,用注射器将(45mmol,3.46ml)γ-丁内酯加入反应管中。反应在氮气保护下进行4h,加入10滴醋酸终止反应。将反应混合物溶于10ml二氯甲烷中,倒入100ml甲醇中,离心分离沉淀得到聚(γ-丁内酯)。
gpc测得数均分子量为12.1kg/mol,分子量分布为1.59。
对比实施例2
将(0.15mmol,16.2mg)苄醇、(0.15mmol,179.7mg)六[三(二甲基胺)磷氮烯]三聚磷腈和1ml四氢呋喃加入反应管中,置于-50℃低温冷浴中搅拌10min,用注射器将(45mmol,3.46ml)γ-丁内酯加入反应管中。反应在氮气保护下进行4h,加入10滴醋酸终止反应。将反应混合物溶于15ml二氯甲烷中,倒入100ml甲醇中,离心分离沉淀得到聚(γ-丁内酯)。
gpc测得数均分子量为7.9kg/mol,分子量分布为2.07。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!