一种治疗脓毒症的多肽及其应用的制作方法
本发明属于生物医药领域,具体涉及一种治疗脓毒症的多肽及其应用。
背景技术:
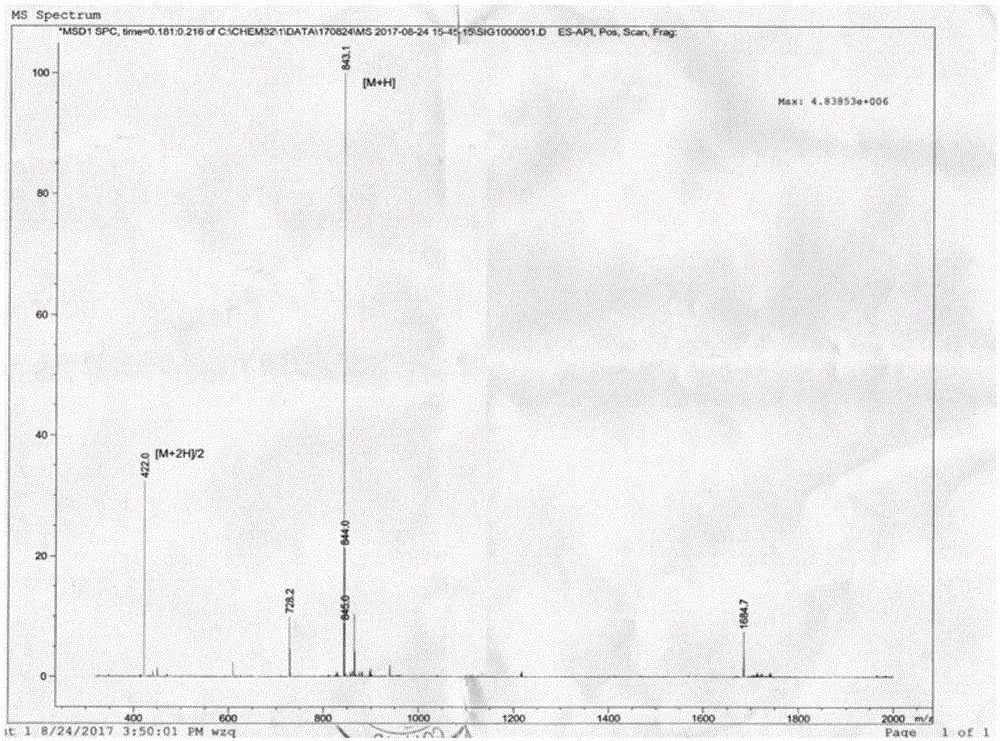
:脓毒症是指临床上由病菌感染引起的全身炎症反应综合征。虽然脓毒症是由感染引起,但是一旦发生后,其发生发展遵循其自身的病理过程和规律,故从本质上讲脓毒症是机体对感染性因素的反应。临床上,常见于手术创伤及免疫力低下等情况引起的细菌进入血液循环,在其中生长繁殖并产生毒素而引起的全身性严重感染,还可进一步发展为脓毒症休克和多器官功能衰竭。脓毒症的死亡率高达30%-70%,全球每年有超过1800万严重脓毒症病例,并且这一数字还以每年1.5%~8.0%的速度上升。脓毒症治疗花费高,医疗资源消耗大,严重影响人类的生活质量,已经对人类健康造成巨大威胁,且至今无有效的药物用于脓毒症的治疗,因此临床上迫切需要用于脓毒症治疗的防治药物。脓毒症涉及到复杂的全身炎症网络效应、免疫功能障碍、凝血功能异常以及宿主对不同病原物的异常反应等多方面的因素。近年来的研究发现,补体系统在脓毒症的发病机制中起重要的作用。在脓毒症起始阶段存在补体系统的过度激活,导致血浆c5a水平的升高,并诱导其受体c5ar在细胞上的表达异常,c5a-c5ar之间过度作用对机体产生损害,造成脓毒症休克等严重病症表现。在炎症介质的调节中c5a和c5ar起重要作用,因此以c5a及c5ar为靶向蛋白,筛选或者设计用于治疗脓毒症的分子抑制剂或抗体药物是非常有价值和前景的。多肽药物是近年来世界新药研究开发的热点,也是我国生物医药研究的重点方向之一。与传统药物相比,多肽药物具有以下明显的优势:(1)活性高,在很低的剂量和浓度下即可表现出显著的高活性;(2)分子量小,相对蛋白质而言易于人工化学合成,方便进行结构改造;(3)合成效率高。近年来技术的进步使多肽的固相合成变得简单,过程自动化,易于控制;(4)副作用小。由于许多多肽药物采用与人同源的序列,加之分子量小,无抗原性,不易引起免疫反应。开发特异性高、且耐受性好的治疗脓毒症的多肽药物,是临床上急需解决的问题。技术实现要素:针对现有技术缺乏针对脓毒症的专门治疗药物的状况,本发明提供一种针对特异蛋白靶点治疗脓毒症的多肽pep-c1。根据本发明的一个方面,本发明提供一种治疗脓毒症的多肽pep-c1,其氨基酸序列为:asp-ser-leu-trp-asn-ile-pro(seqidno:1)。根据本发明的另一个方面,本发明提供所述多肽在制备治疗脓毒症的药物中的应用。根据本发明的另一个方面,本发明提供一种药物组合物,该药物组合物包括活性成分多肽pep-c1和药学上可接受的载体。所述药物组合物包括但不限于注射剂、片剂、颗粒剂、胶囊剂、口服液、丸剂等。所述药学上可接受的载体包括药学领域常规的稀释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、表面活性剂、吸附载体、润滑剂等,必要时还可以加入香味剂、甜味剂等。本发明所述多肽作为活性成分时应为“有效量”的,所述“有效量”是指无毒性,但足够量的提供所需的作用的药物或药剂。在本发明的药物组合物中,一种成分的“有效量”是指该成分在和其他成分联合应用时有效提供所需效应的量。“有效量”会因受试者的不同而不同,依据年龄和个体的一般情况,特定的活性药物等等。因此,不可能总是指精确的“有效量”,然而,任何个体病例中合适的“有效量”可以由本领域普通技术人员应用常规的实验方法来测定。本发明所述多肽可以采用本领域技术人员已知的方法(例如固相合成方法)制备得到,以及可以采用本领域已知的分离纯化方法(例如高效液相色谱法)分离纯化。本发明的有益效果:目前研究发现脓毒症涉及的信号通路中,c5a和c5ar分子起着极为关键的作用,本发明基于c5a这个靶点蛋白,应用专有的多肽分子系统,通过模拟c5a蛋白分子立体结构,应用包括分子对接、同源模建、组合库设计、化学信息学、从头设计、结构生物学、生物大分子模拟、药效团、adme分析等分子模拟和药物设计方法,以c5a蛋白为靶向分子,设计出能够阻断c5a-c5ar结合的特异性多肽若干条。通过一系列的活性验证试验,筛选出一条对脓毒症有显著治疗作用的多肽pep-c1。本发明研究结果显示多肽pep-c1在治疗盲肠结扎穿孔模型(clp)脓毒症小鼠过程中显示出良好的效果,并且具有良好的稳定性。附图说明图1为多肽pep-c1的ms图谱;图2为多肽pep-c1的hplc图谱;图3为多肽对脓毒症小鼠细胞因子tnfα的影响;图4为多肽对脓毒症小鼠细胞因子il-1β的影响;图5为多肽对脓毒症小鼠细胞因子mip-2的影响。具体实施方式下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外,应理解,在阅读了本发明所记载的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本发明所限定的范围。实施例1多肽pep-c1的化学合成合成采用固相合成法从c-端到n-端合成多肽。合成采用化学合成仪(ams586multiplepeptidesynthesiser,abimed,germany)合成,用fmoc保护的氨基酸作为原料,以fmoc-rinklinkerresin树脂为附着基质,用hobt作为缩合剂,dic作为激活剂,逐层合成多肽。合成过程中用2%乙酸酐的dmf溶液做侧链封闭试剂;用20%哌啶做fmoc去除试剂,合成完毕经过tfa切割和侧链基团的去除操作。合成完毕的粗产物经离心收集,用r-hplc(waters741)和c18-column(watersdelta-paktm,40*100mm,15um,100埃)纯化得到纯度大于98%的多肽,冻干成粉末。多肽asp-ser-leu-trp-asn-ile-pro,其ms图谱和hplc图谱分别见图1、2。如附图所示,多肽在7.698min处有一特征峰,分子量为843.1(理论分子量为843.93)。hplc色谱条件为:流动相:流动相a:含0.1%三氟乙酸的水溶液;流动相b:含0.1%三氟乙酸的乙腈(80%)-水(20%)溶液;洗脱程序:0→20min,流动相b38%→58%;流速:1ml/min;检测波长:220nm;保留时间:20min。实施例2多肽pep-c1的活性试验目前脓毒症的动物实验研究主要基于诱导方法的脓毒症动物模型,其中小鼠盲肠结扎穿孔模型(clp),因动物价廉易操作、简单等优点被广泛应用。本研究将利用clp建立小鼠脓毒症模型,通过评价小鼠生存率、细胞炎症因子水平测定(tnfa、il-1β、mip-2)等指标的变化,对clp诱导脓毒症的致病机制进行研究,为后期开展抗炎药物筛选提供技术支撑。本研究采用这一模型进行多肽pep-c1对脓毒症的研究。1实验方法1.1盲肠结扎穿孔模型(clp)建立c57bl/6小鼠麻醉后仰卧于手术台上固定,75%酒精消毒腹部,剑突下一指沿腹中线位置用手术刀打开约2cm左右切口。小心分离盲肠,在盲肠长度1/2的位置用3号线结扎,结扎后使用8号针头在盲肠盲端以上约0.5cm处穿刺肠壁2次,挤出适量肠内容物,将肠内容物及盲肠按原位放回腹腔,逐层缝合。假手术组不进行肠结扎及穿孔,其余操作同手术组。术后皮下注射1ml生理盐水补充体液。1.2组别设置实验分为空白组、假手术组、模型组、阳性药(亚胺培南/西司他丁)组、多肽i组、多肽ii组共6个组。1.3药物用法用量阳性药(亚胺培南/西司他丁)333.33mg/kg,多肽i为目标多肽asp-ser-leu-trp-asn-ile-pro用量6mg/kg,多肽ii为目标多肽asp-ser-leu-trp-asn-ile-pro用量12mg/kg。术后3小时第一次给药,腹腔注射,模型组、假手术组注射等量生理盐水。以后每12h按组别给药或生理盐水一次。1.4观察指标1.4.1clp术后小鼠生存率:观察生存率指标时,药物用量不变,每12h一次,至小鼠死亡或给药满3天。观察术后7d每天每组小鼠的生存率。1.4.2clp术后小鼠细胞因子水平:术后36h断头取血各组存活小鼠,分离血清,elisa方法检测tnfα、il-1β、mip-2的含量。2实验结果2.1术后7天每天每组小鼠的存活数结果见表1。表1多肽对脓毒症小鼠存活率的影响表1结果显示,模型组脓毒症小鼠具有很高的死亡率(达到83%);使用阳性药干预后脓毒症小鼠的死亡率得到明显的控制;使用低剂量(6mg/kg)和高剂量(12mg/kg)的多肽pep-c1干预模型小鼠,脓毒症小鼠的死亡率都有明显下降,而且使用高剂量(12mg/kg)的多肽pep-c1干预的模型小鼠效果比阳性药的效果要好。2.2术后小鼠细胞因子水平2.2.1小鼠血清中tnfα的含量测定结果结果见表2、图3。表2多肽对脓毒症小鼠细胞因子tnfα的影响组别tnfαpg/ml空白组15.344±3.946假手术组15.549±5.697模型组175.007±26.469阳性药组82.945±26.778*多肽i组121.167±26.940*多肽ii组92.899±15.076*注:上述结果以每组每点10只小鼠计算。*与模型组相比,p<0.01;小鼠血清中tnfα含量测定结果显示,空白组和假手术组tnfα的含量处于低的正常水平;模型组tnfα的含量显著升高;使用阳性药干预后tnfα的含量得到明显的控制;使用低剂量(6mg/kg)和高剂量(12mg/kg)的多肽pep-c1干预模型小鼠,其tnfα的含量都有明显下降,而且使用高剂量(12mg/kg)的多肽pep-c1干预的模型小鼠效果和阳性药的效果相当。2.2.2小鼠血清中il-1β含量测定结果结果见表3、图4。表3多肽对脓毒症小鼠细胞因子il-1β的影响组别il-1βpg/ml空白组56.674±5.603假手术组59.163±7.531模型组99.136±7.55阳性药组60.468±5.393#多肽i组72.838±8.854#多肽ii组62.338±7.196#注:上述结果以每组每点10只小鼠计算。#:与模型组相比较,p<0.05小鼠血清中il-1β含量测定结果显示,空白组和假手术组il-1β的含量处于低的正常水平;模型组il-1β的含量显著升高;使用阳性药干预后il-1β的含量得到明显的控制;使用低剂量(6mg/kg)和高剂量(12mg/kg)的多肽pep-c1干预模型小鼠,其il-1β的含量都有明显下降,而且使用高剂量(12mg/kg)的多肽pep-c1干预的模型小鼠效果和阳性药的效果相当。2.2.3小鼠血清中mip-2含量测定结果结果见表4、图5。表4多肽对脓毒症小鼠细胞因子mip-2的影响组别mip-2pg/ml空白组8.266±3.217假手术组10.517±2.151模型组168.694±20.987阳性药组104.556±26.917*多肽i组136.203±24.679#多肽ii组109.019±19.92*注:上述结果以每组每点10只小鼠计算。#:与模型组相比较,p<0.05;*与模型组相比,p<0.01。小鼠血清中mip-2含量测定结果显示,空白组和假手术组mip-2的含量处于低的正常水平;模型组mip-2的含量显著升高;使用阳性药干预后mip-2的含量得到明显的控制;使用低剂量(6mg/kg)和高剂量(12mg/kg)的多肽pep-c1干预模型小鼠,其mip-2的含量都有明显下降,而且使用高剂量(12mg/kg)的多肽pep-c1干预的模型小鼠效果和阳性药的效果相当。3结论以上研究结果显示,使用了多肽pep-c1的脓毒症小鼠,主要的细胞炎症因子tnfa、il-1β、mip-2均比模型组有明显的降低,显示了pep-c1对小鼠脓毒症有较好的治疗作用;而且在高剂量的pep-c1(12mg/kg)干预下与阳性药(亚胺培南/西司他丁,333.33mg/kg)相比具有相当的效果,但是pep-c1使用剂量却低很多。从死亡率的数据上分析,与模型组相比,阳性药和pep-c1低剂量组(6mg/kg)、pep-c1高剂量组(12mg/kg)都有明显的下降,且pep-c1高剂量组(12mg/kg)降低死亡率的效果要高于阳性药组别。以上结果表明,在动物实验中c5a/c5ar阻断剂治疗脓毒症获得良好的效果,为治疗脓毒症新药提供了一种新的有效的候选药物。实施例3取多肽pep-c110g,加入注射剂(包括冻干粉针剂和无菌分装干粉针剂)适当辅料,按注射剂(包括冻干粉针剂和无菌分装干粉针剂)工艺制备成注射剂。实施例4取多肽pep-c110g,加入片剂(包括缓控释片、骨架片、包衣片、分散片等)适当辅料,按片剂(包括缓控释片、骨架片、包衣片、分散片等)工艺制备成片剂。实施例5取多肽pep-c110g,加入胶囊剂适当辅料,按胶囊剂工艺制备成胶囊剂。实施例6取多肽pep-c110g,加入乳剂(包括微乳、纳米乳等)适当辅料,按乳剂(包括微乳、纳米乳等)工艺制备成乳剂。实施例7取多肽pep-c110g,加入颗粒剂适当辅料,按颗粒剂工艺制备成颗粒剂。实施例8取多肽pep-c110g,加入缓释控释剂适当辅料,按缓释控释剂工艺制成缓释控释剂。实施例9取多肽pep-c110g,加入口服液适当辅料,按口服液工艺制备成口服液。实施例10取多肽pep-c110g,加入脂质体剂型适当辅料,按脂质体工艺制备成脂质体剂型。序列表<110>北京博肽未名生物技术有限公司<120>一种治疗脓毒症的多肽及其应用<160>1<170>patentinversion3.3<210>1<211>7<212>prt<213>人工序列<400>1aspserleutrpasnilepro7当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1