一种大球盖菇多糖及其制备方法和应用与流程
本发明属于真菌多糖应用技术领域,具体地说,涉及一种大球盖菇多糖及其制备方法和应用。
背景技术:
多糖(polysaccharides)是生物体普遍存在的一类生物大分子。近代生物化学研究发现,多糖能参与细胞骨架和一些生物活性分子;如维持细胞结构的纤维素、几丁质;提供能量来源的淀粉、糖元等物质。多糖的发展较晚,结构又复杂多样,因此对研究其结构、活性等都较困难。
近20年来,关于多糖生物活性的研究报道主要集中在免疫调节、抗肿瘤、抗病毒、抗氧化和降血糖等方面,其作用是多途径、多环节、多靶点的。
大球盖菇,拉丁学名Stropharia rugosoannulata,又称皱环球盖菇、皱球盖菇、酒红色球盖菇、斐氏球盖菇。菌盖肉质,近半球形,子实体单生、丛生或群生,子实体较大。幼嫩子实体初为白色,常有乳头状的小突起,随着子实体逐渐长大,菌盖渐变成红褐色至葡萄酒红褐色或暗褐色,老熟后褪为褐色至灰褐色。多生长于阔叶林下的落叶层上
目前,对大球盖菇多糖的精细结构与免疫调节活性研究及其应用尚未见任何报道。
技术实现要素:
本发明的目的在于克服上述技术存在的缺陷,提供一种大球盖菇多糖及其制备方法和应用。
其具体技术方案为:
本发明提供一种大球盖菇多糖,其为α-D-半乳糖、α-D-葡萄糖和β-D-葡萄糖组成的杂多糖,其中α-D-半乳糖与葡萄糖(包括α-D-葡萄糖与β-D-葡萄糖)的残基的摩尔比为3:1,α-D-葡萄糖与β-D-葡萄糖的残基的摩尔比为2:1。
进一步地,该多糖的重均分子量为8000-20000Da(如8000、10000、12000、13000、14000、15000、18000、20000Da);在本发明的一个实施例中,该多糖的重均分子量为13281Da。
进一步地,该多糖的化学结构中包含1,6-连接的α-D-半乳糖残基、1,4,6-连接的β-D-葡萄糖残基和2-连接的α-D-葡萄糖残基。
再进一步地,该多糖的化学结构中包含由1,6-连接的α-D-半乳糖残基组成的主链和由1,4,6-连接的β-D-葡萄糖残基和与其2-连接的α-D-葡萄糖残基组成的侧链。
在本发明的一个实施例中,该多糖具有如下结构式:
其中,n为3-10的整数(如3、4、5、6、7、8、9、10)。
上述多糖是自大球盖菇子实体依次通过水提醇沉、除蛋白、离子交换柱层析和透析浓缩得到的。
本发明还提供一种上述大球盖菇多糖的制备方法,其包括如下步骤:
(1)取大球盖菇子实体粉末,热水浸提,将所得水提物依次经浓缩、醇沉、除蛋白得到粗多糖;
(2)将步骤(1)所得粗多糖通过离子交换柱层析,洗脱,收集洗脱液;
(3)将步骤(2)所得洗脱液用透析袋进行透析浓缩。
优选地,(4)将步骤(3)完成后的透析袋内液体冷冻干燥。
进一步地,热水浸提步骤中,浸提温度为80-100℃(如80、85、90、95、100℃),在本发明的一个实施例中,该浸提温度为100℃。
进一步地,热水浸提步骤中,大球盖菇子实体粉末与水的料液比(W/V,mg/mL)为1:1-10(如1:1、1:2、1:3、1:5、1:8、1:10);在本发明的一个实施例中,该料液比为1:3。
进一步地,浸提次数为1次或多次(如2、3、4、5次);在本发明的一个实施例中,该浸提次数为3次。
进一步地,每次浸提时间为1-10小时(如1、3、5、8、10小时);在本发明的一个实施例中,每次浸提时间为3小时。
在本发明的一个实施例中,热水浸提步骤包括:取大球盖菇子实体粉末,与水混合,并置于水浴中煮沸。
进一步地,醇沉步骤中,醇与水提物的浓缩液的体积比为1-10:1(如1:1、3:1、4:1、5:1、10:1);在本发明的一个实施例中,该体积比为3:1。
在本发明的一个实施例中,醇沉步骤中,醇为乙醇。
在本发明的一个实施例中,除蛋白采用Sevage法。
进一步地,步骤(1)包括:取大球盖菇子实体粉末,热水浸提,收集上清液,浓缩,加入无水乙醇,收集沉淀,烘干,除去其中的蛋白质,得到粗多糖。
进一步地,离子交换柱为纤维素柱,该纤维素柱的填料如DEAE-纤维素。
进一步地,洗脱所用洗脱剂为NaCl溶液。
再进一步地,该洗脱为梯度洗脱,洗脱剂浓度为0.01-1.0mol/L(如0.01、0.1、0.2、0.3、0.4、0.5、0.6、0.8、1.0)mol/L。
进一步地,步骤(2)包括:将步骤(1)所得粗多糖的水溶液通过纤维素柱,梯度洗脱,收集洗脱液,浓缩。
进一步地,透析袋的截留分子量为5000-10000Da(如5000、7000、8000、10000Da);在本发明的一个实施例中,该截留分子量为7000Da。
进一步地,步骤(3)包括:将步骤(2)所得洗脱液置于透析袋中进行透析,持续3天,透析两天。
本发明还提供一种上述大球盖菇多糖在制备增强免疫的药物、保健品和食品中的应用。
本发明还提供一种上述大球盖菇多糖在制备用于预防和/或治疗肿瘤的药物、保健品和食品中的应用。
上述应用中,大球盖菇多糖可单独使用,可也与其他活性成分联合使用。
本发明自大球盖菇分离纯化得到多糖SR-1,其具有显著的免疫调节活性,在20μg/mL浓度时,B、T细胞和RAW264.7细胞促增殖率最高;该多糖同时还能促进B细胞分泌免疫球蛋白,提高RAW264.7细胞的吞噬活性。
附图说明
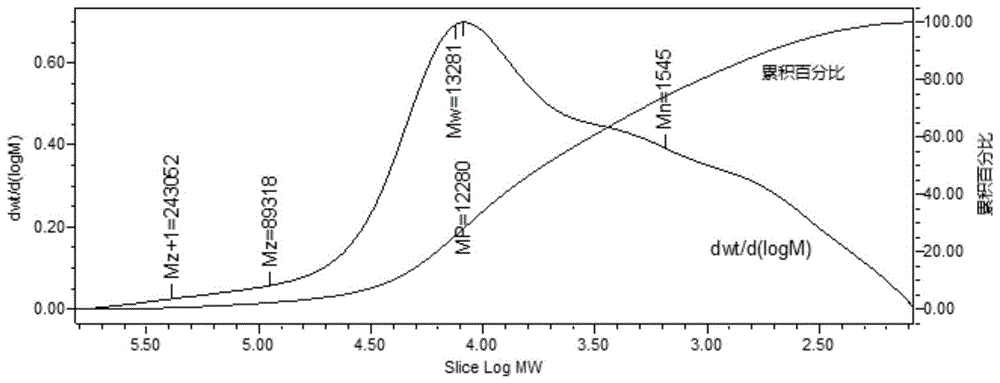
图1所示为SR-1的HPGPC谱图;
图2所示为SR-1的红外谱图;
图3所示为SR-1的HLPC谱图;
图4所示为SR-1的1H NMR谱图;
图5所示为SR-1的13C NMR谱图;
图6所示为SR-1的1H-1H-COSY谱图;
图7所示为SR-1的HMQC谱图;
图8所示为SR-1的化学结构;
图9所示为SR-1对B细胞增殖的影响的实验结果;
图10所示为SR-1对T细胞增殖的影响的实验结果;
图11所示为SR-1对RAW264.7细胞增殖的影响的实验结果;
图12所示为SR-1对RAW264.7吞噬功能的影响的实验结果。
具体实施方式
除非另有定义,本发明中所使用的所有科学和技术术语具有与本发明涉及技术领域的技术人员通常理解的相同的含义。
下面结合附图和具体实施例对本发明的技术方案作进一步详细地说明。
实施例1大球盖菇多糖SR-1的分离提取
1.1大球盖菇多糖SR-1的分离提取
1.1.1水提醇沉法提取大球盖菇粗多糖
将粉碎后的大球盖菇子实体粉末和蒸馏水以1:3的料液比(W/V)在100℃的水浴中煮沸3小时,煮沸3次,收集上清液浓缩至200mL。加入三倍体积的无水乙醇,形成絮状沉淀物,收集沉淀并干燥。用Sevage法除去提取液中的蛋白质而获得大球盖菇粗多糖。
1.1.2 DEAE-纤维素柱层析法分离纯化大球盖菇粗多糖
称取DEAE-纤维素50.00g,用蒸馏水搅拌均匀后,浸泡24h,以除去悬浮颗粒。然后经过0.5mol/L NaOH溶液浸泡4h,蒸馏水洗至中性→再用0.5mol/L HC1溶液浸泡4h,蒸馏水洗至中性→再次用0.5mol/L NaOH溶液浸泡4h,蒸馏水洗至中性。此时的纤维素就具有活性,可与多糖进行交换吸附而被分离纯化。
将活化的纤维素装柱后,经蒸馏水压柱平衡24h后即可进行粗多糖的分离纯化。将粗多糖稀释后的上清液(3mL)加入DEAE纤维素柱中,加入不同浓度的NaCl(0mol/L,0.1mol/L,0.2mol/L,0.3mol/L,0.4mol/L,0.5mol/L)洗脱。多糖用硫酸-苯酚法测定。将洗脱液浓缩至5mL,将样品在纤维素柱上纯化。用透析袋(Mw≥7kDa)透析,持续3天,除去小分子化合物,冻干,得到大球盖菇多糖,命名为SR-1。
1.2大球盖菇多糖SR-1的结构鉴定
运用水解、甲基化分析、气相色谱和质谱联用技术、红外谱技术、核磁共振技术、高效液相色谱,对大球盖菇多糖SR-1进行结构解析。
1.2.1分子量的测定
将5mg大球盖菇多糖SR-1样品用1mL ddH2O溶解,超声5min,进行HPGPC分析。
1.2.2大球盖菇多糖SR-1的红外谱分析
将2mg SR-1样品与KBr混合压片,通过红外分光光度计扫描4000cm-1-400cm-1范围。
1.2.3大球盖菇多糖SR-1单糖组成分析
将六种标准品和经TFA酸水解后的SR-1样品用流动相(75%乙腈)溶解后进行HLPC分析。
1.2.4大球盖菇多糖SR-1的核磁共振分析
取10mg SR-1样品溶于0.5mL重水(D2O)中,装入核磁管中,在核磁共振仪上检测。
1.2.5大球盖菇多糖SR-1的甲基化与硅烷化衍生后进行GC-MS分析
称取40mg SR-1样品,加入5mL饱和的氢氧化钠溶液使其充分溶解,然后逐渐加入硫酸二甲酯使其反应,反应后加水终止反应。用氯仿萃取产物,干燥后得甲基化多糖。甲基化多糖经TFA完全酸水解后,水洗三次,得甲基化完全酸水解产物。
将上述样品1mg依次加入无水吡啶(0.2mL)、六甲基二硅氮烷(0.2mL)和三甲基氯硅烷(0.1mL),50℃条件下反应20min,离心(10000rpm,20min),取上层溶液用于GC-MS分析。
1.3结果
1.3.1大球盖菇多糖SR-1的基本性质结果
SR-1的HPGPC谱图如图1所示,其显示SR-1的重均分子量为13,281Da。
1.3.2大球盖菇多糖SR-1的FTIR谱分析
采用傅里叶红外光谱手段对SR-1的初级结构进行表征,结果如图2所示,在波数3426.94处出现的一处宽峰,是糖类分子的羟基伸缩振动吸收峰;波数2922.89处有一处锐峰,是糖类分子C-H伸缩振动峰;波数1393.64处是C-H的变角振动吸收峰;波数1634.71处是糖类分子中结合水的吸收峰;波数1100.9.61在1200cm-1–1000cm-1区间,该区间出现的吸收峰表明SR-1中的糖环为吡喃型。此外,SR-1在1740波数处无明显吸收峰,表明SR-1不含有糖醛酸。波数607.99处为C-H的摇摆振动峰。
1.3.3大球盖菇多糖SR-1的单糖组成分析
将SR-1水解后,采用HPLC对其进行单糖组成分析,结果如图3所示,其中峰1为葡萄糖,保留时间为14.201,峰面积为263707,含量为0.1148(单位为g/L),峰2为半乳糖,保留时间为16.693,峰面积为700308,含量为0.2806(单位为g/L),其表明,SR-1主要由半乳糖和葡萄糖组成,根据内标法计算可知其组成摩尔比为3:1。
1.3.4大球盖菇多糖SR-1的NMR谱分析
SR-1的1H NMR谱图如图4所示,其中,SR-1具有四个异头氢信号(δ5.04、δ4.97、δ4.89和δ4.64),表明SR-1多糖一个重复单元至少含有5种糖残基。δ5.04、δ4.97和δ4.89处的质子信号属于α-吡喃糖,δ4.64处的质子信号为β-吡喃糖。δ4.70是水的质子信号。δ3.33-δ4.21之间的强信号被鉴定为糖基CH2O和CHO,可归因于H2-H5的质子信号分布。
SR-1的13C NMR谱图如图5所示,其中,δ101.60、δ101.40、δ98.22、δ97.74和δ92.10的信号为异质子信号峰,表明SR-1中单体存在α和β同种型。结果与IR和1H NMR的结果一致。在δ101.60处的信号归属于E残基的C1,δ101.40处信号归属于B残基的C1,δ98.22处信号归属于A残基的C1,δ97.74处信号归属于D残基的C1,δ92.10处信号归属于C残基的C1。
所有的碳和氢的化学位移都总结于表1中。
SR-1的1H-1H-COSY谱图如图6所示,表明H2的化学位移为3.81ppm、3.68ppm、3.57ppm、3.75ppm和3.98ppm。
SR-1的HMQC光谱图如图7所示,据其可以鉴定碳和氢之间的重叠信号。
表1 SR-1的1H NMR和13C NMR化学位移
1.3.5大球盖菇多糖SR-1的气相色谱与质谱分析
甲基化结果如表2所示,其表明SR-1的主要重复结构单元由(1→6)-α-D-吡喃半乳糖主链和(1→6,4)-β-D-吡喃葡萄糖侧链构成基的组成,且支链糖残基的4-O和6-O各连接一个2-Glu。综上可初步推断SR-1的结构如图8所示。
表2 SR-1甲基化分析结果
2大球盖菇多糖SR-1的免疫调节活性研究
在体外运用两种CCK-8法测定大球盖菇多糖SR-1的免疫调节活性。
2.1试剂
CCK-8试剂盒、RPIM1640、FBS、DMSO、双抗等,均为市售产品。
2.2仪器
酶标仪;流式细胞仪。
2.3方法
2.3.1 SR-1对免疫细胞(B细胞、T细胞和RAW264.7细胞)的增殖影响
通过CCK-8法测定B、T和RAW264.7细胞上SR-1增殖影响。将SR-1多糖溶解于培养基中,用0.22μm过滤器灭菌。取对数生长期的T、B、RAW264.7细胞,用新鲜培养基稀释至1×105个细胞/mL。将PBS缓冲液加入到围绕无菌水环境的96孔板中,并向剩余的孔中加入100μL细胞稀释液。在37℃,5%CO2培养箱中孵育24h后,加入100μL细胞培养,LPS和不同浓度的SR-1多糖溶液(最终质量浓度2.5、5、10、20μg/mL)。培养箱中培养24h后,向每个孔中加入5μL CCK-8溶液并孵育3h。测量450nm处的吸光度并记录结果。用横坐标绘制曲线,增值率为纵坐标,拍摄图像。
2.3.2 SR-1对RAW264.7细胞吞噬功能的影响
将RAW264.7细胞接种于96孔板中,每孔100μL,放置于37℃,5%CO2培养箱中培养24h后,加入不同浓度的SR-1培养液(最终质量浓度2.5、5、10、20μg/mL)同时设置脂多糖(LPS)阳性对照、空白对照组。将板放入培养箱接着培养24h后,去掉每孔中的细胞培养液,加入100μL 0.075%中性红溶液,培养箱中继续孵育,15min后取出去掉孔中液体,用PBS缓冲液洗涤未被吞噬的中性红,重复3次。洗毕后每孔分别加100μL细胞裂解液(无水乙醇:乙酸=1:1),在培养箱(37℃、5%CO2)中裂解2h,在酶标仪波长为540nm处测定OD殖。
2.4结果
2.4.1 SR-1对B细胞的增殖影响
B细胞效应如图9所示,以5μg/mL LPS作为阳性对照组。当SR-1浓度在2.5-20μg/mL之间时,B细胞增值效应极显著(P<0.01),浓度为20μg/mL时达到最大值,增值率高达72%。
2.4.2 SR-1对T细胞的增殖影响
SR-1对T细胞的刺激效果如图10所示。与对照组比较,在2.5-20μg/mL浓度范围内,SR-1显著促进T细胞增殖(p<0.01),且T细胞增殖呈正相关。当SR-1浓度为20μg/mL时,T细胞增殖最大,增值率为33.83%。值得注意的是,5μg/mL LPS诱导的细胞增殖活性显著。
2.4.3 SR-1对RAW264.7细胞的增殖影响
SR-1诱导RAW264.7细胞增殖的效果如图11所示,从图中可以明显看出,在一定浓度范围为内,SR-1能极显著地促进RAW264.7细胞的增殖(P<0.01)。浓度为20μg/mL时,SR-1对其促增殖作用是最强的,增殖率为47.22%。
2.4.4 SR-1对RAW264.7细胞吞噬功能的影响
采用中性红法评估SR-1是否具增强RAW264.7细胞吞噬活力的功效。在SR-1作用下,RAW264.7细胞的吞噬能力变化结果如图12所示。由图12可知,RAW264.7细胞在一定浓度的SR-1和LPS刺激下,吞噬中性红能力被显著提高。当SR-1质量浓度在2.5-20μg/mL之间,吞噬能力呈现逐渐上升趋势,在浓度为20μg/mL时,RAW264.7细胞吞噬能力最高,达到33.35%,与LPS(5μg/mL)处理组大体相当。
以上所述,仅为本发明较佳的具体实施方式,本发明的保护范围不限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,可显而易见地得到技术方案的简单变化或等效替换均落入本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!