无定型达格列净及其制备方法、应用、含其的药物组合物与流程
[0001]
本发明涉及医药化学领域,具体涉及一种无定型达格列净及其制备方法、应用、含其的药物组合物。
背景技术:
[0002]
(1s)-1,5-脱水-1-c-[4-氯-3-[(4-乙氧基苯基)甲基]苯基]-d-葡萄糖醇,又名达格列净,其化学结构式如式(i)所示,是由阿斯利康和百时美施贵宝公司联合开发的新型ii型糖尿病药物。2012年11月12日,欧盟委员会审批达格列净上市,是全球首个sglt2(选择性的可逆钠-葡萄糖协同转运蛋白2)抑制剂的新药,可独立于胰岛素外清除体内多余的葡萄糖。并且,达格列净于2014年1月8日获fda审批上市,是fda批准上市的第二个sglt2抑制剂。sglt有sglt1和sglt2两种亚型,分别分布于小肠黏膜和肾小管,能将葡萄糖转运进血液。达格列净可抑制sglt2活性,减少肾小管中的葡萄糖重吸收,从而降低血糖浓度。
[0003][0004]
据预测,未来10-20年糖尿病患病人数将居所有疾病之首,到2020年中国糖尿病患者人数将高达1.5亿,为全球糖尿病患者最多的国家。全球糖尿病市场总销售额已超过350亿美元,中国糖尿病市场规模已达150亿。因此,对达格列净进行进一步研究,以期达到更好的治疗效果、更便捷的临床应用显得尤为重要。
[0005]
达格列净上市的是晶型(s)-丙二醇一水合物(sc-3),其是溶剂合物,其中溶剂(s)-丙二醇是手性分子,对脑、消化系统、血液存在一定的毒性,而且价格昂贵,导致药物成本高。
[0006]
现有技术中也公开了达格列净的其他晶型形式,例如:专利cn101479287b公开了达格列净的几种固体形式,包含达格列净上市晶型(s)-丙二醇一水合物形式sc-3,其他醇类溶剂合物以及达格列净和氨基酸的共晶;专利cn102167715公开了达格列净和脯氨酸、色氨酸或苯丙氨酸的共晶。溶剂和氨基酸对人体都有一定的毒副作用,氨基酸价格较高,也增加了药物的成本。专利cn103958491a公开了达格列净的两个水合物晶型。但达格列净的水合物仍然存在在存储过程中易发生转晶的问题,导致药效发生改变,药品质量不可控。
[0007]
药物的固体形态除晶态外,还有无定型状态,药物的无定型状态作为固体物质的一种特殊形态,在药物制备中有着重要的用途。一般由于晶态物质分子的有序和周期性排列,降低了分子间相互作用的能量,能量较低,而无定型态的分子处于高度无序状态,物质的表面自由能更大,固体物质中的分子较晶态固体物质中的分子有更高的能量,更容易分散,增加其溶出度,提高药物的生物利用度。
[0008]
然而,由于无定型药物处于热力学不稳定状态,目前仍难以制得稳定的无定型达格列净。专利cn103889429公开了一种达格列净的无定型形式及其制备方法,但该专利指出tga显示该无定型物中明显含有水和溶剂,此无定型物含有较多的有机溶剂残留,不能作为药用形式的药物,且稳定性差,易转变为油状物质,难以成药。专利wo2015104658也提供了两种无定型达格列净的制备方法:喷雾干燥法和溶剂蒸发法。溶剂蒸发法无法实现大规模工业化生产,同时此无定型物含有较多的有机溶剂残留,不能作为药用形式的药物,且稳定性差,易转变为油状物质,难以成药。用喷雾干燥法可以得到低溶剂残留的无定型物,但需要使用到价格昂贵的喷雾干燥机,导致药物的制造成本大幅增加。
[0009]
因此,如何以简单的工艺制备得到一种物理和化学稳定性良好(存储过程中不发生转晶,从而避免药物溶解度、溶出率以及生物利用度改变)的无定型达格列净是本领域亟待解决的技术问题。
技术实现要素:
[0010]
本发明所要解决的技术问题在于克服现有技术中达格列净的溶剂共晶物存在毒副作用、在存储过程中易发生转晶,且现有的达格列净的无定型物稳定性差、难以成药的缺陷,从而提供了一种无定型达格列净及其制备方法、应用、含其的药物组合物。本发明所提供的无定型达格列净物理和化学稳定性良好,溶解度、引湿性符合药用要求;能稳定储存,避免了达格列净上市药物溶剂合物易转晶的风险,从而避免了药物制剂在存储过程中溶解度、溶出率和生物利用度发生改变,药品质量可控;不含(s)-丙二醇,溶剂残留量低,毒性小,质量符合药用标准。本发明所提供的无定型达格列净的制备方法工艺简单,能大大降低药物生产成本,且对环境友好,适合工业化生产,社会经济价值高。
[0011]
为了达到上述目的,本发明采用的技术方案如下:
[0012]
一种无定型达格列净,所述无定型达格列净的x-射线粉末衍射光谱在2θ角5.0~50.0度范围内无尖锐峰;优选地,所述无定型达格列净的x-射线粉末衍射光谱如图1或图2所示。
[0013]
本发明中,所述无定型达格列净稳定性良好,分别在温度40℃
±
2℃、温度60℃
±
2℃、湿度75%
±
5%、湿度90%
±
5%的条件下,放置0-10天,有关物质无显著改变,无达格列净结晶析出;在温度40℃
±
2℃,湿度75%
±
5%的条件下,放置6个月,有关物质无显著改变,无达格列净结晶析出。
[0014]
本发明还提供了一种无定型达格列净的制备方法,其包括下述步骤:将含有达格列净和溶剂i的溶液和溶剂ii混合,得悬浊液,即可;其中:
[0015]
所述溶剂i为酯类、醇类、醚类、酮类、腈类和卤代烃类溶剂中的一种或多种;
[0016]
所述溶剂ii为“烷烃类溶剂和/或环烷烃类溶剂”、或、水。
[0017]
本发明中,所述溶液可按本领域常规方法制得,例如,将所述达格列净和所述溶剂i混合、溶解,即得。
[0018]
本发明中,所述达格列净可为本领域常规的达格列净,例如达格列净结晶物和/或达格列净无定型物。
[0019]
本发明中,所述溶剂i优选为碳原子数<9的芳香烃类溶剂、酯类溶剂、醇类溶剂、醚类溶剂、酮类溶剂、腈类溶剂和卤代烃类溶剂中的一种或多种。
[0020]
其中,所述芳香烃类溶剂优选为碳原子数≤8的芳香烃类溶剂,例如乙苯。
[0021]
其中,所述酯类溶剂优选为碳原子数≤4的酯类溶剂,例如乙酸乙酯。
[0022]
其中,所述醇类溶剂优选为碳原子数≤4的醇类溶剂,例如乙醇。
[0023]
其中,所述醚类溶剂优选为碳原子数≤5的醚类溶剂,例如甲基叔丁基醚和/或四氢呋喃。
[0024]
其中,所述卤代烃类溶剂优选为碳原子数≤3的卤代烃类溶剂,例如二氯甲烷。
[0025]
其中,所述酮类溶剂优选为碳原子数≤4的酮类溶剂,例如丙酮。
[0026]
其中,所述腈类溶剂优选为碳原子数≤4的腈类溶剂,例如乙腈。
[0027]
其中,所述溶剂i优选为乙酸乙酯、甲基叔丁基醚、二氯甲烷、丙酮、乙醇、乙腈和四氢呋喃中的一种或多种,例如乙酸乙酯、甲基叔丁基醚、二氯甲烷、乙腈、乙醇、丙酮或四氢呋喃。
[0028]
本发明中,所述溶液中,所述达格列净的浓度优选为0.01~1.0g/ml,更优选为0.067~1.0g/ml,例如0.067g/ml、0.5g/ml、0.167g/ml或1.0g/ml。
[0029]
本发明中,所述溶剂ii优选为碳原子数<10的烷烃类溶剂和/或环烷烃类溶剂。
[0030]
其中,所述烷烃类溶剂优选为碳原子数≤7的烷烃类溶剂,例如正戊烷、正己烷和正庚烷中的一种或多种,再例如正戊烷、正己烷或正庚烷。
[0031]
其中,所述环烷烃类溶剂优选为碳原子数≤7的环烷烃类溶剂,例如甲基环己烷。
[0032]
其中,所述溶剂ii优选为“正戊烷、正己烷、正庚烷和甲基环己烷中的一种或多种”或水,例如正戊烷、正己烷、正庚烷、甲基环己烷或水。
[0033]
本发明中,当所述溶剂i为碳原子数<9的芳香烃类溶剂时,所述溶剂ii为碳原子数<10的烷烃类溶剂;例如,当所述溶剂i为碳原子数≤8的芳香烃类溶剂时,所述溶剂ii为碳原子数≤7的烷烃类溶剂;再例如,当所述溶剂i为乙苯时,所述溶剂ii为正戊烷。
[0034]
本发明中,当所述溶剂i为碳原子数<9的酯类溶剂时,所述溶剂ii优选为碳原子数<10的烷烃类溶剂;例如,当所述溶剂i为碳原子数≤4的酯类溶剂时,所述溶剂ii为碳原子数≤7的烷烃类溶剂;再例如,当所述溶剂i为乙酸乙酯时,所述溶剂ii为正己烷。
[0035]
本发明中,当所述溶剂i为碳原子数<9的醇类溶剂时,所述溶剂ii优选为水,例如,当所述溶剂i为乙醇时,所述溶剂ii为水。
[0036]
本发明中,当所述溶剂i为碳原子数<9的醚类溶剂时,所述溶剂ii优选为碳原子数<10的烷烃类溶剂;例如,当所述溶剂i为碳原子数≤5的醚类溶剂时,所述溶剂ii为碳原子数≤7的烷烃类溶剂;再例如,当所述溶剂i为甲基叔丁基醚时,所述溶剂ii为正庚烷;还例如,当所述溶剂i为四氢呋喃时,所述溶剂ii为正戊烷。
[0037]
本发明中,当所述溶剂i为碳原子数<9的卤代烃类溶剂时,所述溶剂ii优选为碳原子数<10的烷烃类溶剂;例如,当所述溶剂i为碳原子数≤3的卤代烃类溶剂时,所述溶剂ii为碳原子数≤7的烷烃类溶剂;再例如,当所述溶剂i为二氯甲烷时,所述溶剂ii为正庚烷。
[0038]
本发明中,当所述溶剂i为碳原子数<9的酮类溶剂时,所述溶剂ii优选为水,例如,当所述溶剂i为丙酮时,所述溶剂ii为水。
[0039]
本发明中,当所述溶剂i为碳原子数<9的腈类溶剂时,所述溶剂ii优选为碳原子数<10的环烷烃类溶剂,例如,当所述溶剂i为乙腈时,所述溶剂ii为甲基环己烷。
[0040]
本发明中,所述溶剂i和所述溶剂ii的体积比可为本领域常规的体积比,优选为1:(1~200),更优选为1:(5~30),例如1:15、1:13.33、1:8、1:5、1:30或1:20。
[0041]
本发明中,所述混合的温度优选为-80~30℃,更优选为-30~30℃,例如-15℃、-25℃、-30℃、-20℃、-10℃、20℃或30℃。
[0042]
在本发明一优选实施方式中,所述溶剂i为乙苯,所述溶剂ii为正戊烷,所述溶剂i和所述溶剂ii的体积比为1:15,所述混合的温度为-15℃。
[0043]
在本发明一优选实施方式中,所述溶剂i为乙酸乙酯,所述溶剂ii为正己烷,所述溶剂i和所述溶剂ii的体积比为1:13.33,所述混合的温度为-25℃。
[0044]
在本发明一优选实施方式中,所述溶剂i为甲基叔丁基醚,所述溶剂ii为正庚烷,所述溶剂i和所述溶剂ii的体积比为1:13.33,所述混合的温度为-30℃。
[0045]
在本发明一优选实施方式中,所述溶剂i为二氯甲烷,所述溶剂ii为正庚烷,所述溶剂i和所述溶剂ii的体积比为1:13.33,所述混合的温度为-20℃。
[0046]
在本发明一优选实施方式中,所述溶剂i为乙腈,所述溶剂ii为甲基环己烷,所述溶剂i和所述溶剂ii的体积比为1:8,所述混合的温度为20℃。
[0047]
在本发明一优选实施方式中,所述溶剂i为乙醇,所述溶剂ii为水,所述溶剂i和所述溶剂ii的体积比为1:5,所述混合的温度为20℃。
[0048]
在本发明一优选实施方式中,所述溶剂i为丙酮,所述溶剂ii为水,所述溶剂i和所述溶剂ii的体积比为1:30,所述混合的温度为30℃。
[0049]
在本发明一优选实施方式中,所述溶剂i为四氢呋喃,所述溶剂ii为正戊烷,所述溶剂i和所述溶剂ii的体积比为1:20,所述混合的温度为-10℃。
[0050]
本发明中,所述悬浊液可按本领域常规步骤进行后处理,例如将所述悬浊液经过滤、干燥,即得所述无定型达格列净。
[0051]
其中,所述干燥可为真空干燥。
[0052]
本发明还提供了一种上述制备方法制得的无定型达格列净。
[0053]
本发明还提供了一种所述无定型达格列净在制备治疗或延缓与sglt2活性有关的疾病或病症的进程或发作的药物中的应用。
[0054]
其中,所述与sglt2活性有关的疾病或病症优选为i型糖尿病、ii型糖尿病、葡萄糖耐量低减、胰岛素抵抗、肾病、视网膜病变、神经病、白内障、高血糖、高胰岛素血症、高胆固醇血症、血液中游离脂肪酸或甘油水平升高、高甘油三酯血症、肥胖、组织缺血、动脉粥样硬化、高血压或x综合征。
[0055]
本发明还提供了一种药物组合物,其含有所述的无定型达格列净和至少一种药学上可接受的载体。
[0056]
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0057]
本发明所用试剂和原料均市售可得。
[0058]
本发明的积极进步效果在于:
[0059]
(1)本发明中的无定型达格列净物理和化学稳定性良好(在高温、高湿以及加速试验(温度40℃
±
2℃,湿度75%
±
5%)条件下,有关物质无显著改变,无达格列净结晶析出),溶解度、引湿性符合药用要求;能稳定储存,避免了达格列净上市药物溶剂合物易转晶的风
险,从而避免了药物制剂在存储过程中溶解度、溶出率和生物利用度发生改变,药品质量可控。
[0060]
(2)本发明中的无定型达格列净不含(s)-丙二醇,毒性小;且溶剂残留量低,符合药用标准,符合ich的规定。
[0061]
(3)本发明中的无定型达格列净的制备工艺简单,适合工业化生产,能大大降低药物生产成本,对环境友好,具有很高的社会经济价值。
附图说明
[0062]
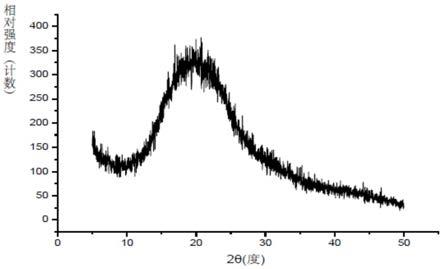
图1为本发明实施例1的达格列净无定型物的x-射线粉末衍射图。
[0063]
图2为本发明实施例2的达格列净无定型物的x-射线粉末衍射图。
具体实施方式
[0064]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0065]
下述实施例及对比例中:
[0066]
(1)x-射线粉末衍射图在ultima iv x-射线衍射仪上采集,x-射线粉末衍射的方法参数如下:
[0067]
x-射线粉末参数:cu-kα;
[0068]
kα1.5418;
[0069]
电压:40千伏;
[0070]
电流:40毫安;
[0071]
发散狭缝:自动;
[0072]
扫描模式:连续;
[0073]
扫描范围:自5.0至50.0度;
[0074]
取样步长:0.0200度;
[0075]
扫描速率:60度/分钟。
[0076]
(2)溶剂残留采用顶空毛细管气相色谱法测定,色谱柱:db-624,柱温:起始温度40℃,保温5分钟,以20℃/分钟的升温速率升至260℃,保持1分钟,分流比:3:1,进样口温度:180℃,检测器温度260℃。
[0077]
以下实施例及对比例中用于制备达格列净无定型物的达格列净是任何固体形式的式(i)的化合物。
[0078][0079]
实施例1
[0080]
将达格列净(50毫克)溶于乙酸乙酯(750微升),室温下搅拌溶清。将上述溶液加入到冷却到-25℃的正己烷(10毫升)中,搅拌下析出白色固体,过滤,真空干燥,得到白色固体45毫克,即达格列净的无定型物。气相色谱检测溶剂残留,乙酸乙酯:443ppm,正己烷:120ppm。x-射线粉末衍射图如图1所示,以度2θ表示的x-射线粉末衍射光谱中无尖锐的衍射峰。分别在温度40℃
±
2℃、温度60℃
±
2℃、湿度75%
±
5%、湿度90%
±
5%条件下,放置10天,未观察到明显的吸潮现象,经x-射线粉末衍射检测也未观察到转晶现象。
[0081]
实施例2
[0082]
将达格列净(50毫克)溶于甲基叔丁基醚(750微升)。将上述溶液加入到冷却到-30℃的正庚烷(10毫升)中,搅拌下析出白色固体,过滤,真空干燥,得到白色固体46毫克,即达格列净的无定型物。气相色谱检测溶剂残留,甲基叔丁基醚:158ppm,正庚烷:892ppm。x-射线粉末衍射图如图2所示,以度2θ表示的x-射线粉末衍射光谱中无尖锐的衍射峰。
[0083]
实施例3
[0084]
将达格列净(50毫克)溶于二氯甲烷(750微升)。将上述溶液加入到冷却到-20℃的正庚烷(10毫升)中,搅拌下析出白色固体,过滤,真空干燥,得到固体32毫克,即达格列净的无定型物。气相色谱检测溶剂残留,二氯甲烷:420ppm,正庚烷:1677ppm。分别在温度40℃
±
2℃、温度60℃
±
2℃、湿度75%
±
5%、湿度90%
±
5%条件下,放置10天,未观察到明显的吸潮现象,经x-射线粉末衍射检测也未观察到转晶现象。
[0085]
实施例4
[0086]
将达格列净(50毫克)溶于乙腈(100微升)。将上述溶液加入到20℃的甲基环己烷(800微升)中,搅拌下析出白色固体,过滤,真空干燥,得到白色固体38毫克,即达格列净的无定型物。气相色谱检测溶剂残留,乙腈:360ppm,甲基环己烷:872ppm。分别在温度40℃
±
2℃、温度60℃
±
2℃、湿度75%
±
5%、湿度90%
±
5%条件下,放置10天,未观察到明显的吸潮现象,经x-射线粉末衍射检测也未观察到转晶现象。
[0087]
实施例5
[0088]
将达格列净(50毫克)溶于乙醇(300微升)。将上述溶液加入到20℃水(1500微升)中,搅拌下析出白色固体,过滤,真空干燥,得到白色固体26毫克,即达格列净的无定型物。气相色谱检测溶剂残留,乙醇:1340ppm。分别在温度40℃
±
2℃、温度60℃
±
2℃、湿度75%
±
5%、湿度90%
±
5%条件下,放置10天,未观察到明显的吸潮现象,经x-射线粉末衍射检测也未观察到转晶现象。
[0089]
实施例6
[0090]
将达格列净(50毫克)溶于丙酮(50微升)。将上述溶液加入到30℃水(1500微升)中,搅拌下析出白色固体,过滤,真空干燥,得到固体31毫克,即达格列净的无定型物。气相色谱检测溶剂残留,丙酮:942ppm。分别在温度40℃
±
2℃、温度60℃
±
2℃、湿度75%
±
5%、湿度90%
±
5%条件下,放置10天,未观察到明显的吸潮现象,经x-射线粉末衍射检测也未观察到转晶现象。
[0091]
实施例7
[0092]
将达格列净(50毫克)溶于四氢呋喃(50微升)。将上述溶液加入到-10℃正戊烷(1000微升)中,搅拌下析出白色固体,过滤,真空干燥,得到固体42毫克,即达格列净的无定型物。气相色谱检测溶剂残留,四氢呋喃:367ppm,正戊烷:1163ppm。分别在温度40℃
±
2℃、
温度60℃
±
2℃、湿度75%
±
5%、湿度90%
±
5%条件下,放置10天,未观察到明显的吸潮现象,经x-射线粉末衍射检测也未观察到转晶现象。
[0093]
实施例8
[0094]
将达格列净(50毫克)溶于乙苯(50微升)。将上述溶液加入到-15℃正戊烷(750微升)中,搅拌下析出白色固体,过滤,真空干燥,得到固体41毫克,即达格列净的无定型物。气相色谱检测溶剂残留,乙苯:721ppm,正戊烷:1433ppm。分别在温度40℃
±
2℃、温度60℃
±
2℃、湿度75%
±
5%、湿度90%
±
5%条件下,放置10天,未观察到明显的吸潮现象,经x-射线粉末衍射检测也未观察到转晶现象。
[0095]
对比例1
[0096]
根据专利cn103889429实施例1制得的无定型达格列净。气相色谱检测溶剂残留,甲苯:2246ppm,正庚烷:7042ppm。该无定型的溶剂残留远高于药用标准。
[0097]
对比例2
[0098]
根据wo2015104658a2实施例3制得的无定型达格列净。气相色谱检测溶剂残留,乙酸乙酯:10096ppm。产物在温度为25℃、湿度为40%的条件下放置,10分钟内即可观察到吸潮现象,30分钟内完全形成油状物。该无定型的引湿性无法满足药用要求。
[0099]
效果实施例1达格列净无定型物的影响因素试验
[0100]
材料:实施例2制备的达格列净无定型物。
[0101]
实验条件:分别在温度40℃
±
2℃、温度60℃
±
2℃、湿度75%
±
5%、湿度90%
±
5%条件下,放置0~10天。
[0102]
检测方法:有关物质用hplc法检测,晶型用x-粉末衍射图检测,检测结果参见表1。
[0103]
表1:达格列净无定型物的影响因素试验结果
[0104][0105][0106]
由表1可知,本发明中的达格列净无定型物在高温、高湿条件下,放置10天,有关物质无显著改变,无达格列净结晶析出。
[0107]
效果实施例2达格列净无定型物的加速稳定性试验
[0108]
材料:实施例2制备的达格列净无定型物。
[0109]
实验条件:温度40℃
±
2℃,湿度75%
±
5%。
[0110]
检测方法:有关物质用hplc法检测,晶型用x-粉末衍射图检测,检测结果参见表2。
[0111]
表2:达格列净无定型物的加速稳定性试验结果
[0112][0113]
由表2可知,本发明中的达格列净无定型物在加速试验条件下,放置6个月,有关物质无显著改变,无达格列净结晶析出。
[0114]
结合实施例1~7以及效果实施例1、2可知:
[0115]
(1)本发明提供的达格列净无定型物,物理和化学稳定性良好,避免了上市药物溶剂合物易转晶的风险,不含(s)-丙二醇,毒性小,对环境友好,其制备工艺简单,能大大降低药物生产成本,适合工业化生产,具有很高的社会经济价值;
[0116]
(2)本发明提供的无定型物溶解度、引湿性符合药用要求,稳定性好,能稳定储存,避免药物在开发过程中发生转晶,从而避免药物溶解度、溶出率、生物利用度以及药效的改变。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1