检测布鲁氏菌减毒活疫苗株和野毒株的方法及应用与流程
本发明涉及生物技术领域,尤其是涉及一种检测布鲁氏菌减毒活疫苗株和野毒株的方法及应用。
背景技术:
当前使用的布鲁氏菌疫苗为减毒活疫苗,在当下布鲁氏菌病高度流行的时期,这些疫苗对布鲁氏菌病的防护提供了有力的保障。但减毒活疫苗的使用也存在一定的不足,主要表现为无法区分野毒感染与疫苗免疫,对人员存在感染风险。
基因标记疫苗是在原有疫苗菌株的基础上利用分子生物学技术对其进行核酸标记,通过体外制备其标记抗原,利用血清学技术、分子检测技术对疫苗菌株和野毒进行区分,进而达到鉴别。常规血清学检测技术是针对抗原所产生的抗体进行检测,但任何抗原所产生的抗体的持续时间均有一定的局限性。
有鉴于此,特提出本发明。
技术实现要素:
本发明的第一个目的在于提供一种检测布鲁氏菌减毒活疫苗株和野毒株的方法,以至少缓解现有技术中存在的技术问题之一。
本发明的第二个目的在于提供上述检测布鲁氏菌减毒活疫苗株和野毒株的方法的应用。
本发明提供了一种检测布鲁氏菌减毒活疫苗株和野毒株的方法,所述方法包括:根据布鲁氏菌减毒活疫苗株的缺失基因设计引物,采用所述引物对待测样品dna进行扩增,若检测扩增产物中含有特异性dna片段,则所述待测样品含有布鲁氏菌野毒株。
进一步地,所述布鲁氏菌减毒活疫苗株包括a19、s2、m5、s19或rev.1中的一种或多种。
进一步地,所述引物包括如下(a)-(c)中的一种或多种:
(a)a19-f:5’-gggaggagggcagttgtt-3';
a19-r:5'-gccaccgcattccgataa-3';
(b)s2-f:5-’ggcggcacaagaggaact-3’;
s2-r:5'-gcgggtacgccttgattg-3';
(c)m5-f:5’-attcccatgactgaagaaca-3’;
m5-r:5’-taacgcttccctcgattt-3’。
进一步地,(a)引物扩增产物的大小为254bp;和/或,
(b)引物扩增产物的大小为300bp;和/或,
(c)引物扩增产物的大小为207bp。
进一步地,所述扩增包括普通pcr扩增、qpcr扩增、rpa扩增或lamp扩增。
进一步地,采用多重pcr的方式进行检测。
进一步地,所述待测样品来源于布鲁氏菌减毒活疫苗株的被接种体,所述被接种体的接种时间为4-90天。
进一步地,所述被接种体包括牛、羊、猪、犬或人。
进一步地,所述待测样品为血液、奶样或组织。
另外,本发明还提供了上述的方法在如下(i)-(iii)中的应用:
(i)鉴别布鲁氏菌减毒活疫苗株和布鲁氏菌野毒株;
(ii)检测待测样品是否感染布鲁氏菌;
(iii)鉴别待测样品所感染的布鲁氏菌的类型。
本发明提供的检测布鲁氏菌减毒活疫苗株和野毒株的方法,根据布鲁氏菌减毒活疫苗株的缺失基因设计引物,再采用所述引物对待测样品dna进行pcr扩增,根据检测结果进行判断。该方法根据布鲁氏菌减毒活疫苗株的缺失基因设计引物,即设计得到的引物用于扩增的是缺失基因中的一部分或全部片段,因此,该引物在有效扩增出野毒株基因的基础上不会扩增到减毒活疫苗株基因,能够准确、有效地对布鲁氏菌减毒活疫苗株和野毒株进行区分,普适性广,特异性强,且准确率高。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明实施例1提供的针对布鲁氏菌减毒活疫苗a19-δvirb12株进行鉴定的结果图;
图2为本发明实施例2提供的针对布鲁氏菌减毒活疫苗s2-δvirb12株进行鉴定的结果图;
图3为本发明实施例3提供的针对布鲁氏菌减毒活疫苗m5-δvirb12株进行鉴定的结果图。
具体实施方式
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
除非本文另有定义,连同本发明使用的科学和技术术语应具有本领域普通技术人员通常理解的含义。术语的含义和范围应当清晰,然而,在任何潜在不明确性的情况下,本文提供的定义优先于任何字典或外来定义。在本申请中,除非另有说明,术语“包括”及其他形式的使用是非限制性的。
一般地,连同本文描述的细胞和组织培养、分子生物学、免疫学、微生物学、遗传学以及蛋白和核酸化学和杂交使用的命名法和其技术是本领域众所周知和通常使用的那些。除非另有说明,本发明的方法和技术一般根据本领域众所周知,且如各种一般和更具体的参考文献中所述的常规方法来进行,所述参考文献在本说明书自始至终引用和讨论。酶促反应和纯化技术根据制造商的说明书、如本领域通常实现的或如本文所述来进行。连同本文描述的分析化学、合成有机化学以及医学和药物化学使用的命名法、以及其实验室程序和技术是本领域众所周知和通常使用的那些。
减毒活疫苗是指病原体经过各种处理后,发生变异,毒性减弱,但仍保留其免疫原性。将其接种到身体内,不会引起疾病的发生,但病原体可以引发机体免疫反应,刺激机体产生特异性的记忆b细胞和记忆t细胞。起到获得长期或终生保护的作用。与灭活疫苗(死疫苗)相比,减毒活疫苗免疫力强、作用时间长,但具有潜在的致病危险。基于此,本发明提供了一种检测布鲁氏菌减毒活疫苗株和野毒株的方法,所述方法包括:根据布鲁氏菌减毒活疫苗株的缺失基因设计引物,采用所述引物对待测样品dna进行pcr扩增,若检测扩增产物中含有特异性dna片段,则所述待测样品含有布鲁氏菌野毒株,若检测扩增产物中不含有特异性dna片段,则所述待测样品不含有布鲁氏菌野毒株。
可以理解的是,减毒活疫苗的种类有多种,相应的对减毒活疫苗的病原体进行处理的方式也有多种,本发明中的减毒活疫苗指的是通过对野毒株的基因组dna进行基因缺失处理,使缺失后的基因组dna毒性减弱,但仍保留其免疫原性,以此作为减毒活疫苗株的基因组dna,以达到免疫目的。例如:缺失t4ss中virb基因、外膜蛋白基因omp等。
在此基础上,将减毒活疫苗株与相应的野毒株进行基因比对得到缺失位点,并根据该缺失位点的上下游处设计引物,设计得到的引物能够用于扩增的是缺失基因中的一部分或全部片段。
因此,本发明提供的方法根据布鲁氏菌减毒活疫苗株的缺失基因设计引物,并采用所述引物对待测样品dna进行pcr扩增,由于该引物在有效扩增出野毒株基因的基础上不会扩增到减毒活疫苗株基因,因此根据扩增产物中是否含有特异性的dna片段即能够准确、有效地对布鲁氏菌减毒活疫苗株和野毒株进行区分,普适性广,特异性强,且准确率高。
需要说明的是,对布鲁氏菌减毒活疫苗株的种类不做限定,凡是以缺失基因作为减毒方式的布鲁氏菌减毒活疫苗株均在本发明的保护范围之内。
需要说明的是,凡是能够通过引物扩增从而得出结果实现检测目的的检测手段均在本发明的保护范围之内。
在一些优选的实施方式中,所述布鲁氏菌减毒活疫苗株包括a19、s2、m5、s19或rev.1中的一种或多种。
在一些优选的实施方式中,所述引物包括如下(a)-(c)中的一种或多种:
(a)a19-f:5’-gggaggagggcagttgtt-3'(seqidno.1);
a19-r:5'-gccaccgcattccgataa-3'(seqidno.2);
(b)s2-f:5-’ggcggcacaagaggaact-3’(seqidno.3);
s2-r:5'-gcgggtacgccttgattg-3'(seqidno.4);
(c)m5-f:5’-attcccatgactgaagaaca-3’(seqidno.5);
m5-r:5’-taacgcttccctcgattt-3’(seqidno.6)。
当接种的布鲁氏菌减毒活疫苗株为a19时,采用本实施方式提供的引物对(a)进行检测,特异性更强,且准确率更高。当接种的布鲁氏菌减毒活疫苗株为s2时,采用本实施方式提供的引物对(b)进行检测,特异性更强,且准确率更高。当接种的布鲁氏菌减毒活疫苗株为m5时,采用本实施方式提供的引物对(c)进行检测,特异性更强,且准确率更高。
在一些优选的实施方式中,(a)引物扩增产物的大小为254bp;和/或,
(b)引物扩增产物的大小为300bp;和/或,
(c)引物扩增产物的大小为207bp。
通过对扩增产物的大小进行限定,能够进一步避免假阳性的检测结果,增强检测结果的准确性。
在一些优选的实施方式中,所述扩增包括普通pcr扩增、qpcr扩增、rpa扩增或lamp扩增。
普通pcr扩增、qpcr扩增、rpa扩增或lamp扩增均能够通过引物扩增从实现检测目的,对上述各扩增手段的具体操作不做限定,本领域技术人员能够实现的常规操作即可。
在一些优选的实施方式中,采用多重pcr的方式进行检测。
多重pcr的检测手段能够实现一次pcr检测即可同时鉴定布鲁氏菌菌株,又能区分野毒以及减毒活疫苗株。例如,在多重pcr检测的过程中同时使用seqidno.1+seqidno.2的引物对及seqidno.3+seqidno.4的引物对:若扩增结果条带为254bp,即可说明该待测样品感染了a19野毒株,且未感染s2野毒株;若扩增结果条带为300bp,即可说明该待测样品感染了s2野毒株,且未感染a19野毒株;若扩增结果条带为254bp和300bp,即可说明该待测样品既感染了s2野毒株,也感染了a19野毒株;从而实现鉴定布鲁氏菌菌株的目的。若未扩增出条带,即可判定为减毒活疫苗株,从而实现区分野毒以及减毒活疫苗株的目的。
需要说明的是,本实施例中的多重pcr为检测手段,而非扩增手段,因此对扩增方式没有限定,普通pcr扩增、qpcr扩增、rpa扩增或lamp扩增等扩增方式均可。
在一些优选的实施方式中,所述待测样品来源于布鲁氏菌减毒活疫苗株的被接种体,所述被接种体的接种时间为4-90天。
疫苗接种后需要一定的时间使布鲁氏菌减毒活疫苗株中的减毒菌株在机体内进行再增殖,以增加样本浓度,保证检测结果的准确性。在布鲁氏菌减毒活疫苗接种后4天再进行检测,能够保证被接种体的体内减毒菌株浓度,提高检测结果的准确性。
在一些优选的实施方式中,所述被接种体包括牛、羊、猪、犬或人。
在一些优选的实施方式中,所述待测样品为血液、奶样或组织。
血液、奶样或组织中均能够有效检测出布鲁氏菌,且以血液、奶样或组织作为待测样品,更易获得。
另外,本发明还提供了上述方法在如下(i)-(iii)中的应用:
(i)鉴别布鲁氏菌减毒活疫苗株和布鲁氏菌野毒株;
(ii)检测待测样品是否感染布鲁氏菌;
(iii)鉴别待测样品所感染的布鲁氏菌的类型。
对于应用(i),本发明提供的方法是根据布鲁氏菌减毒活疫苗株的缺失基因设计引物,由于该引物在有效扩增出野毒株基因的基础上不会扩增到减毒活疫苗株基因,因此根据扩增产物中是否含有特异性的dna片段即能够准确、有效地鉴别布鲁氏菌减毒活疫苗株和布鲁氏菌野毒株。
需要说明的是,应用(i)为非疾病的诊断和/或治疗目的,例如应用于动物疫苗开发研制等实验室科研需要。
对于应用(ii),基于本发明提供的方法是根据布鲁氏菌减毒活疫苗株的缺失基因设计引物,因此,若扩增出条带,即可判定检测待测样品感染了布鲁氏菌。
需要说明的是,应用(ii)为非疾病的诊断和/或治疗目的,例如应用于实验室研究。
对于应用(iii),当选用针对不同布鲁氏菌野毒株的引物进行多重pcr检测时,根据得到的扩增条带大小,即可实现鉴别待测样品所感染的布鲁氏菌的类型。
需要说明的是,应用(iii)为非疾病的诊断和/或治疗目的,例如仅为科研需要。
下面通过具体的实施例进一步说明本发明,但是,应当理解为,这些实施例仅仅是用于更详细地说明之用,而不应理解为用于以任何形式限制本发明。
本发明实施例中用到的主要试剂及仪器信息如下:
细菌核酸提取试剂盒购自天根生化科技有限公司;
牛外周血淋巴细胞分离液购自天津灏洋生物制品科技有限责任公司;
红细胞裂解液购自北京索莱宝科技有限公司;
pcrmix、dnamarker购自宝生物工程有限公司;
thermo离心机,countstar细胞计数仪,thermopcr仪。
实施例1布鲁氏菌减毒活疫苗(a19-δvirb12株)
选取布氏菌病抗体阴性犊牛10头,5头免疫接种布鲁氏菌减毒活疫苗(a19-δvirb12株),5头接种布氏菌强毒株2308,隔离饲养。分别于接种后4、12、21、35、45、60日采集全血,对血液样本分别进行细菌核酸提取及提取淋巴细胞后再进行核酸提取:
血样中细菌核酸提取按照天根商品化试剂盒操作即可。
外周血淋巴细胞提取操作规程如下:
1)采集抗凝血2ml;
2)往15ml离心管中注入2ml淋巴细胞分离液(常温放置淋巴细胞分离液),用5ml注射器吸取2ml生理盐水,再吸取2ml的抗凝血,混匀后,拔掉注射器针头,沿15ml离心管壁,将血液缓慢推到淋巴细胞分离液上,盖盖标记;
3)将15ml离心管放入离心机中,4000rpm/10min,离心;
4)用5ml注射器插入到中间液面白色环处,尽可能地吸取淋巴细胞,打入新的15ml离心管中,加生理盐水至8ml,震荡混匀,1000rpm/min,离心;
5)倒掉离心管中的液体,加8ml红细胞裂解液,充分震荡混匀,1000rpm/min,离心;
6)倒掉离心管中的液体,加8ml生理盐水,充分震荡混匀,1000rpm/min,离心;
7)倒掉离心管中的液体,沉淀即为淋巴细胞,核酸提取方式依据商品化试剂盒说明书进行。
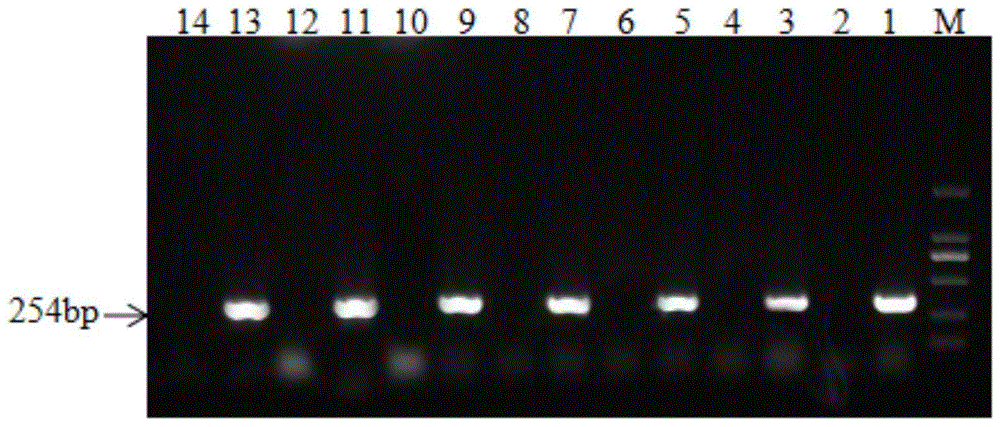
然后,以f:5’-gggaggagggcagttgtt-3';r:5'-gccaccgcattccgataa-3'做为扩增引物,对上述提取的核酸样本进行pcr扩增,条件为94℃10min,94℃45s,56℃30s,72℃45s,30个循环,72℃10min,分别对不同时间系列的样本进行检测。野毒菌株目的片段大小为254bp,标记疫苗菌株不能扩增出特异性片段,具体结果如图1所示,其中,1:阳性对照;2:阴性对照;3、5、7、9、11、13泳道分别为布氏菌强毒株2308接种后第4日、12日、21日、35日、45日、60日检测结果;4、6、8、10、12、14泳道分别为布氏菌病活疫苗(a19-δvirb12株)接种后第4日、12日、21日、35日、45日、60日检测结果。由图1可以看出,布氏菌病活疫苗(a19-δvirb12株)接种后在检测期内可以有效的与2308野毒株进行鉴别区分。
实施例2
选取布氏菌病抗体阴性犊牛10头,5头免疫接种布鲁氏菌减毒活疫苗(s2-δvirb12株),5头接种布氏菌强毒株2308,隔离饲养。分别于接种后4、12、21、35、45、60日采集全血,对血液样本分别进行细菌核酸提取及提取淋巴细胞后再进行核酸提取:
血样中细菌核酸提取按照天根商品化试剂盒操作即可。
外周血淋巴细胞提取操作规程如下:
1)采集抗凝血2ml;
2)往15ml离心管中注入2ml淋巴细胞分离液(常温放置淋巴细胞分离液),用5ml注射器吸取2ml生理盐水,再吸取2ml的抗凝血,混匀后,拔掉注射器针头,沿15ml离心管壁,将血液缓慢推到淋巴细胞分离液上,盖盖标记;
3)将15ml离心管放入离心机中,4000rpm/10min,离心;
4)用5ml注射器插入到中间液面白色环处,尽可能地吸取淋巴细胞,打入新的15ml离心管中,加生理盐水至8ml,震荡混匀,1000rpm/min,离心;
5)倒掉离心管中的液体,加8ml红细胞裂解液,充分震荡混匀,1000rpm/min,离心;
6)倒掉离心管中的液体,加8ml生理盐水,充分震荡混匀,1000rpm/min,离心;
7)倒掉离心管中的液体,沉淀即为淋巴细胞,核酸提取方式依据商品化试剂盒说明书进行。
然后,以f:5-’ggcggcacaagaggaact-3’,r:5'-gcgggtacgccttgattg-3';做为扩增引物,对上述提取的核酸样本进行pcr扩增,条件为94℃10min,94℃45s,56℃30s,72℃30s,30个循环,72℃10min,分别对不同时间系列的样本进行检测。野毒菌株目的片段大小为300bp,标记疫苗菌株不能扩增出特异性片段,具体结果如图1所示,其中,7:阳性对照;8:阴性对照;1、2、3、4、5、6泳道分别为布氏菌强毒株2308接种后第4日、12日、21日、35日、45日、60日检测结果;9、10、11、12、13、14泳道分别为布氏菌病活疫苗(s2-δvirb12株)接种后第4日、12日、21日、35日、45日、60日检测结果。由图2可以看出,布氏菌病活疫苗(s2-δvirb12株)接种后在检测期内可以有效的与2308野毒株进行鉴别区分。
实施例3
选取布氏菌病抗体阴性犊牛10头,5头免疫接种布鲁氏菌减毒活疫苗(m5-δbtp1株),5头接种布氏菌强毒株2308,隔离饲养。分别于接种后4、12、21、35、45、60日采集全血,对血液样本分别进行细菌核酸提取及提取淋巴细胞后再进行核酸提取:
血样中细菌核酸提取按照天根商品化试剂盒操作即可。
外周血淋巴细胞提取操作规程如下:
1)采集抗凝血2ml;
2)往15ml离心管中注入2ml淋巴细胞分离液(常温放置淋巴细胞分离液),用5ml注射器吸取2ml生理盐水,再吸取2ml的抗凝血,混匀后,拔掉注射器针头,沿15ml离心管壁,将血液缓慢推到淋巴细胞分离液上,盖盖标记;
3)将15ml离心管放入离心机中,4000rpm/10min,离心;
4)用5ml注射器插入到中间液面白色环处,尽可能地吸取淋巴细胞,打入新的15ml离心管中,加生理盐水至8ml,震荡混匀,1000rpm/min,离心;
5)倒掉离心管中的液体,加8ml红细胞裂解液,充分震荡混匀,1000rpm/min,离心;
6)倒掉离心管中的液体,加8ml生理盐水,充分震荡混匀,1000rpm/min,离心;
7)倒掉离心管中的液体,沉淀即为淋巴细胞,核酸提取方式依据商品化试剂盒说明书进行。
然后,以f:5’-attcccatgactgaagaaca-3’,r:5’-taacgcttccctcgattt-3’做为扩增引物,对上述提取的核酸样本进行pcr扩增,条件为94℃10min,94℃45s,56℃30s,72℃30s,30个循环,72℃10min,分别对不同时间系列的样本进行检测。野毒菌株目的片段大小为207bp,标记疫苗菌株不能扩增出特异性片段,具体结果如图1所示,其中,8:阳性对照;7:阴性对照;9、10、11、12、13、14泳道分别为布氏菌强毒株2308接种后第4日、12日、21日、35日、45日、60日检测结果;1、2、3、4、5、6泳道分别为布氏菌病活疫苗(m5-δbtp1株)接种后第4日、12日、21日、35日、45日、60日检测结果。由图3可以看出,布氏菌病活疫苗(m5-δbtp1株)接种后在检测期内可以有效的与2308野毒株进行鉴别区分。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
sequencelisting
<110>天康生物股份有限公司
<120>检测布鲁氏菌减毒活疫苗株和野毒株的方法及应用
<160>6
<170>patentinversion3.5
<210>1
<211>18
<212>dna
<213>人工序列
<400>1
gggaggagggcagttgtt18
<210>2
<211>18
<212>dna
<213>人工序列
<400>2
gccaccgcattccgataa18
<210>3
<211>18
<212>dna
<213>人工序列
<400>3
ggcggcacaagaggaact18
<210>4
<211>18
<212>dna
<213>人工序列
<400>4
gcgggtacgccttgattg18
<210>5
<211>20
<212>dna
<213>人工序列
<400>5
attcccatgactgaagaaca20
<210>6
<211>18
<212>dna
<213>人工序列
<400>6
taacgcttccctcgattt18
- 还没有人留言评论。精彩留言会获得点赞!