一种聚氨基酸、其制备方法及应用与流程
本发明涉及生物医用高分子材料技术领域,尤其涉及一种聚氨基酸、其制备方法及应用。
背景技术:
根据世界卫生组织最新发布的全球癌症报告,2018年全球新增1810万例癌症病例,其中死亡人数达960万(男性540万,女性420万),癌症依然是威胁人类健康的头号难题。尽管在过去的几十年里,癌症治疗已经发展出了多种技术手段,化疗仍然是最为重要的治疗方法之一,尤其是对于某些化疗敏感的癌症或者已经发生转移的癌症,化疗更是不可替代的有效疗法。然而,传统的化疗药物不具备对癌细胞的选择性,这种对正常组织的无差别作用将会带来很大的毒副作用,同时也降低了药物在体内的利用效率;此外,面对这些小分子化疗药物,癌细胞逐渐产生许多具有耐药性的表型,导致肿瘤治疗不彻底,进而引起复发或者转移;而且一些化疗药物本身就有导致继发性肿瘤的可能,例如烷基化试剂环磷酰胺的使用有引起骨髓性白血病的风险。因此,寻找选择性更高,不易引发耐药性,且安全性更好的广谱性抗癌药物显得尤为重要。
宿主防御肽(hdp)是一类由微生物以及动植物机体产生的具有抗菌、抗炎、抗病毒、创伤修复以及免疫调节活性的天然多肽的统称。近些年来,研究人员发现其中许多种类的多肽也表现出良好的抗癌活性。这是因为hdp一般由10-50个氨基酸组成,携带+2~+9个正电荷以及较高比例的疏水组分。其中阳离子的组分赋予了hdp和细胞膜表面负电荷较多的肿瘤细胞静电作用的能力,同时多肽的疏水组分可以吸附/插入到细胞膜的磷脂双分子层中,引起膜结构的扰动进而改变其通透性甚至引发膜裂解,导致癌细胞快速坏死。而对于正常组织的细胞,其细胞膜表面携带的负电荷较少,基本呈现电中性,因此对hdp较不敏感。此外,由于hdp作用靶点主要是细胞膜的脂双层,不依赖于特定的受体或者信号通路,因此对大部分肿瘤细胞包括耐药细胞株都具有很好的抑制效果,且很难引发耐药性的产生。然而,天然的多肽药物的临床应用面临着固有的一些问题,例如合成工艺复杂,成本较高,易吸附血浆蛋白,稳定性差等。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供一种聚氨基酸、其制备方法及应用,所述氨基酸具有广谱的抗肿瘤作用。
本发明提供了一种聚氨基酸,具有式(i)所示结构:
其中,5≤n≤50,r具有式(ⅱ)或式(ⅲ)所示结构:
其中,1≤m≤16。
优选的,5≤n≤35,1≤m≤16。
优选的,n为5、15、25、35或50;m为1、6、10、14或16。
本发明还提供了一种聚氨基酸的制备方法,包括以下步骤:
在第一引发剂的作用下,将具有式(ⅳ)结构的聚(γ-丙烯酯-谷氨酸酯)和巯基乙胺盐酸盐在第一溶剂中进行反应,得到具有式(i)结构的聚氨基酸;
其中,5≤n≤50,r具有式(ⅱ)或式(ⅲ)所示结构:
其中,1≤m≤16。
优选的,所述具有式(ⅳ)结构的聚(γ-丙烯酯-谷氨酸酯)按照以下步骤制备:
在第二引发剂的作用下,具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐在第二溶剂中开环聚合,得到具有式(iv)结构的聚(γ-丙烯酯-谷氨酸酯);所述第二引发剂为具有式(ⅵ)或式(ⅶ)所示结构的氨基化合物;所述第二溶剂为无水四氢呋喃、无水n,n-二甲基甲酰胺和n-甲基吡咯烷酮中的一种或几种;
优选的,所述具有式(ⅶ)所示结构的氨基化合物按照以下步骤制备:
在第一催化剂的作用下,将n-(2,3-二羟基丙基)氨基甲酸叔丁酯和脂肪酸在第三溶剂中反应,得到的产物在三氟乙酸和二氯甲烷的混合溶液中脱保护,得到具有式(ⅶ)所示结构的氨基化合物;
所述三氟乙酸和二氯甲烷的体积比为1:3~8;
所述脂肪酸包括乙酸、丙酸、丁酸、戊酸、己酸、庚酸、辛酸、壬酸、癸酸、十一烷酸、十二烷酸、十三烷酸、十四烷酸、十五烷酸、十六烷酸、十七烷酸和十八烷酸中的一种;
所述第三溶剂为二氯甲烷、二甲基亚砜和n,n-二甲基甲酰胺中的一种或几种;
所述第一催化剂包括1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和4-二甲氨基吡啶;
所述n-(2,3-二羟基丙基)氨基甲酸叔丁酯、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和4-二甲氨基吡啶的质量比为1~1.6:4~10:0.2~0.8;
所述n-(2,3-二羟基丙基)氨基甲酸叔丁酯和脂肪酸的摩尔比为1:2~2.5。
优选的,具有式(ⅳ)结构的聚(γ-丙烯酯-谷氨酸酯)和巯基乙胺盐酸盐的摩尔比为1:1~113;
所述第一溶剂包括四氢呋喃,二甲基亚砜或n,n-二甲基甲酰胺;
所述第一引发剂为irgacure2959、tpo-l或光引发剂184。
优选的,所述反应的温度为15~60℃;所述反应的时间为12~72h。
本发明还提供了一种聚氨基酸衍生物,具有式(ⅷ)所示结构:
其中,0≤x≤50,0≤y≤50,x+y=n,5≤n≤50;
r具有式(ⅱ)或式(ⅲ)所示结构:
其中,1≤m≤16。
本发明还提供了一种聚氨基酸衍生物的制备方法,包括以下步骤:
在第二催化剂的作用下,将聚氨基酸和2,3-二甲基马来酸酐在第四溶剂中反应,得到具有式(ⅷ)所示结构的聚氨基酸衍生物;
所述聚氨基酸具有式(i)所示结构或为权利要求4~9任意一项所述的制备方法制得的聚氨基酸;
其中,5≤n≤50,0≤x≤50,0≤y≤50,x+y=n;
r具有式(ⅱ)或式(ⅲ)所示结构:
其中,1≤m≤16。
优选的,所述第二催化剂为三乙胺、碳酸钾或n,n'-二异丙基乙胺;
所述第四溶剂为n,n-二甲基甲酰胺和/或二甲基亚砜。
优选的,所述反应的温度为10~40℃;所述反应的时间为4~24h。
优选的,所述聚氨基酸和2,3-二甲基马来酸酐的摩尔比为1:0.8~47。
本发明还提供了一种上文所述的聚氨基酸或上文所述的制备方法制得的聚氨基酸在制备抗肿瘤药物中的应用。
本发明还提供了一种上文所述的聚氨基酸衍生物或上文所述的制备方法制得的聚氨基酸衍生物在制备抗肿瘤药物中的应用。
本发明提供了一种聚氨基酸,具有式(i)所示结构:其中,5≤n≤50,r具有式(ⅱ)或式(ⅲ)所示结构;其中,1≤m≤16。本发明提供的聚氨基酸在水溶液中表现出明显的α-螺旋结构,可以通过静电作用结合到负电性的癌细胞膜表面,促使了聚氨基酸的疏水部分和膜磷脂疏水链间发生相互作用,导致细胞膜扰动并最终引起膜裂解使癌细胞坏死,它可以将多种癌细胞存活率抑制到20%以下。而修饰后的聚氨基酸衍生物具有式(ⅷ)所示结构,失去了螺旋结构呈现无规卷曲,但可在弱酸性微环境下响应性脱去阴离子侧基还原成具有式(i)所示结构的聚氨基酸,从而表现出和上述聚氨基酸相当的抗肿瘤效果。而在正常生理条件下(ph值为7.4),该修饰后的聚氨基酸衍生物不会被激活成阳离子形式,因此对正常的组织细胞表现出良好的生物相容性。
附图说明
图1为本发明实施例4制备得到的1,2-二软脂酰氧基-3-氨基丙烷的核磁共振氢谱图;
图2为本发明实施例13制备得到的dpap16-b-palg5的核磁共振氢谱图;
图3为本发明实施例33制备得到的dpap16-b-palg25的核磁共振氢谱图;
图4为本发明实施例57制备得到的阳离子聚氨基酸dpap16-b-patg5的核磁共振氢谱图;
图5为实施例57中b16-f10鼠源黑色素瘤细胞随着聚氨基酸浓度的增加对应的细胞存活率;
图6为实施例57中mcf-7人源乳腺癌细胞随着聚氨基酸浓度的增加对应的细胞存活率;
图7为实施例57中k7m2-wt骨肉瘤细胞随着聚氨基酸浓度的增加对应的细胞存活率;
图8为本发明实施例58制备得到的阳离子聚氨基酸da12-b-patg15的核磁共振氢谱图;
图9为实施例58中b16-f10鼠源黑色素瘤细胞随着聚氨基酸浓度的增加对应的细胞存活率;
图10为本发明实施例61制备得到的dpap16-b-patg25的核磁共振氢谱图;
图11为本发明实施例61制备得到的dpap16-b-patg25在水溶液中的圆二色谱图;
图12为实施例61中mcf-7人源乳腺癌细胞随着聚氨基酸浓度的增加对应的细胞存活率;
图13为实施例61中b16-f10鼠源黑色素瘤细胞随着聚氨基酸浓度的增加对应的细胞存活率;
图14为本发明实施例61制备得到的dpap16-b-patg25和4t1鼠源乳腺癌细胞共培养30min后的sem图;
图15为本发明实施例69制备得到的阳离子聚氨基酸衍生材料dpap16-b-dmma6/patg19的核磁共振氢谱图;
图16为本发明实施例58制备得到的阳离子聚氨基酸衍生材料dpap16-b-dmma13/patg12的核磁共振氢谱图;
图17为本发明实施例71制备得到的dpap16-b-dmma13/patg12在水溶液中的圆二色谱图;
图18为本发明实施例71制备得到的dpap16-b-dmma13/patg12在不同ph水溶液中(ph6.8或者7.4)的zeta电势随着时间的变化图;
图19为本发明实施例71中4t1鼠源乳腺癌细胞随着dpap16-b-dmma13/patg12浓度的增加对应的细胞存活率;
图20为本发明实施例71中huvec人脐静脉内皮细胞随着dpap16-b-dmma13/patg12浓度的增加对应的细胞存活率;
图21为本发明实施例71制备的dpap16-b-dmma13/patg12和b16-f10鼠源黑色素瘤细胞在ph=6.8的条件下共培养24h后的sem图;
图22为本发明实施例75制备得到的阳离子聚氨基酸衍生材料dpap16-b-dmma22/patg3的核磁共振氢谱图。
具体实施方式
下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明提供了一种聚氨基酸,具有式(i)所示结构:
其中,5≤n≤50,r具有式(ⅱ)或式(ⅲ)所示结构:
其中,1≤m≤16。
式(ⅱ)和式(ⅲ)所示结构中,所述波浪处对应的键为基团的连接键,与上述主体结构相连。
在本发明的某些实施例中,5≤n≤35,1≤m≤16。
在本发明的某些实施例中,n为5、15、25、35或50;m为1、6、10、14或16。
本发明提供的聚氨基酸在水溶液中形成完全的α-螺旋二级结构。可以通过静电作用结合到负电性的癌细胞膜表面,促使了聚氨基酸的疏水部分和膜磷脂疏水链间发生相互作用,导致细胞膜扰动并最终引起膜裂解使癌细胞坏死,它可以将多种癌细胞存活率抑制到20%以下。
本发明还提供了一种上文所述的聚氨基酸的制备方法,包括以下步骤:
在第一引发剂的作用下,将具有式(ⅳ)结构的聚(γ-丙烯酯-谷氨酸酯)和巯基乙胺盐酸盐在第一溶剂中进行反应,得到具有式(i)结构的聚氨基酸;
其中,5≤n≤50,r具有式(ⅱ)或式(ⅲ)所示结构:
其中,1≤m≤16。
在本发明的某些实施例中,5≤n≤35,1≤m≤16。
在本发明的某些实施例中,n为5、15、25、35或50;m为1、6、10、14或16。
在本发明的某些实施例中,所述具有式(ⅳ)结构的聚(γ-丙烯酯-谷氨酸酯)按照以下步骤制备:
在第二引发剂的作用下,具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐在第二溶剂中开环聚合,得到具有式(iv)结构的聚(γ-丙烯酯-谷氨酸酯);所述第二引发剂为具有式(ⅵ)或式(ⅶ)所示结构的氨基化合物;
其中,1≤m≤16。
在本发明的某些实施例中,1≤m≤16。在本发明的某些实施例中,m为1、6、10、14或16。
在本发明的某些实施例中,所述第二溶剂为无水四氢呋喃、无水n,n-二甲基甲酰胺和n-甲基吡咯烷酮中的一种或几种。在某些实施例中,当1≤m≤12,所述第二溶剂为无水n,n-二甲基甲酰胺和/或n-甲基吡咯烷酮;当12≤m≤16,所述第二溶剂为无水四氢呋喃。在本发明的某些实施例中,具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐和第二引发剂的质量总和与第二溶剂的用量比为2.0~20.0g:130ml。在某些实施例中,具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐和第二引发剂的质量总和与第二溶剂的用量比为2.0g:130ml、2.3g:130ml、2.1g:130ml、2.5g:130ml、2.2g:130ml、2.7g:130ml、2.9g:130ml、2.4g:130ml、5.7g:130ml、6.0g:130ml、5.8g:130ml、6.2g:130ml、5.9g:130ml、6.4g:130ml、6.6g:130ml、6.1g:130ml、9.5g:130ml、9.8g:130ml、9.6g:130ml、10.0g:130ml、9.7g:130ml、10.2g:130ml、10.4g:130ml、9.9g:130ml、13.3g:130ml、13.6g:130ml、13.4g:130ml、13.8g:130ml、13.5g:130ml、14.0g:130ml、14.2g:130ml、13.7g:130ml、18.9g:130ml、19.2g:130ml、19.0g:130ml、19.4g:130ml、19.1g:130ml、19.6g:130ml、19.8g:130ml或19.3g:130ml。
在本发明的某些实施例中,所述具有式(ⅶ)所示结构的氨基化合物按照以下步骤制备:
在第一催化剂的作用下,将n-(2,3-二羟基丙基)氨基甲酸叔丁酯和脂肪酸在第三溶剂中反应,得到的产物在三氟乙酸和二氯甲烷的混合溶液中脱保护,得到具有式(ⅶ)所示结构的氨基化合物。
在本发明的某些实施例中,所述脂肪酸包括乙酸、丙酸、丁酸、戊酸、己酸、庚酸、辛酸、壬酸、癸酸、十一烷酸、十二烷酸、十三烷酸、十四烷酸、十五烷酸、十六烷酸、十七烷酸和十八烷酸中的一种。
在本发明的某些实施例中,所述第三溶剂为二氯甲烷、二甲基亚砜和n,n-二甲基甲酰胺中的一种或几种。本发明对所述第三溶剂的用量并无特殊的限制。在本发明的某些实施例中,n-(2,3-二羟基丙基)氨基甲酸叔丁酯和第三溶剂的用量比为1.6g:100ml。
在本发明的某些实施例中,所述第一催化剂包括1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc·hcl)和4-二甲氨基吡啶(dmap)。
在本发明的某些实施例中,所述n-(2,3-二羟基丙基)氨基甲酸叔丁酯、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和4-二甲氨基吡啶的质量比为1~1.6:4~10:0.2~0.8。在某些实施例中,所述n-(2,3-二羟基丙基)氨基甲酸叔丁酯、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和4-二甲氨基吡啶的质量比为1.6:10:0.5。
在本发明的某些实施例中,所述n-(2,3-二羟基丙基)氨基甲酸叔丁酯和脂肪酸的摩尔比为1:2~2.5。
在本发明的某些实施例中,n-(2,3-二羟基丙基)氨基甲酸叔丁酯和脂肪酸在第三溶剂中反应的温度为10~40℃、15~30℃、20~25℃或25℃,时间为24~72h、36~60h或48h。
在本发明的某些实施例中,n-(2,3-二羟基丙基)氨基甲酸叔丁酯和脂肪酸在第三溶剂中反应完成后,还包括:将得到的反应产物依次用稀盐酸和去离子水洗涤,干燥后旋干除去有机溶剂,然后在三氟乙酸和二氯甲烷的混合溶液中脱保护,得到具有式(ⅶ)所示结构的氨基化合物。在本发明的某些实施例中,所述稀盐酸的ph值为1~3或2。在本发明的某些实施例中,所述洗涤的次数大于等于3次。
在本发明的某些实施例中,所述三氟乙酸和二氯甲烷的体积比为1:3~8。在某些实施例中,所述三氟乙酸和二氯甲烷的体积比为1:6。
在本发明的某些实施例中,所述脱保护在冰浴条件下进行,所述脱保护的时间为4~8h。在某些实施例中,所述脱保护的时间为8h。在本发明的某些实施例中,所述脱保护后,还包括:将脱保护后的反应产物在乙醚中沉降,用布氏漏斗抽滤得到白色固体,并在真空干燥器中抽干,得到具有式(ⅶ)所示结构的氨基化合物。
在本发明的实施例中,具有式(ⅵ)所示结构的氨基化合物的来源为一般市售。在本发明的某些实施例中,具有式(ⅵ)所示结构的氨基化合物可以为正丙胺(m=1)、正辛胺(m=6)、十二烷胺(m=10)、十六烷胺(m=14)、十八烷胺(m=16)。
本发明对所述具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐的来源并无特殊的限制,在本发明的某些实施例中,所述具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐按照肖春生等人发表的文献chunshengxiaoet.al,macromolrapidcomm,2010,31,991-997中记载的方法进行合成。
在本发明的某些实施例中,所述第二引发剂与具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐的摩尔比为1:5~60、1:5~35、1:25、1:5.6、1:16.5、1:27.6、1:38.8或1:55.3。
在本发明的某些实施例中,具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐在第二溶剂中开环聚合的温度为10~60℃,时间为1~7d。在某些实施例中,具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐在第二溶剂中开环聚合的温度为20~40℃、20~25℃或25℃,时间为3~5d或3d。
在本发明的某些实施例中,具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐在第二溶剂中开环聚合完成后,还包括:将反应后的产物进行透析和冻干,得到具有式(iv)结构的聚(γ-丙烯酯-谷氨酸酯)。本发明对所述透析和冻干的方法并无特殊的限制,采用本领域技术人员熟知的透析和冻干的方法即可。
得到具有式(iv)结构的聚(γ-丙烯酯-谷氨酸酯)后,在第一引发剂的作用下,将具有式(ⅳ)结构的聚(γ-丙烯酯-谷氨酸酯)和巯基乙胺盐酸盐在第一溶剂中进行反应,得到具有式(i)结构的聚氨基酸。
在本发明的某些实施例中,所述第一引发剂为光引发剂,具体的,可以为irgacure2959、tpo-l(2,4,6-三甲基苯甲酰基苯基膦酸乙酯)或光引发剂184(1-羟基环己基苯基甲酮)。在本发明的某些实施例中,在第一引发剂的作用下,通过紫外光照引发,将具有式(ⅳ)结构的聚(γ-丙烯酯-谷氨酸酯)和巯基乙胺盐酸盐在第一溶剂中进行反应,得到具有式(i)结构的聚氨基酸。
在本发明的某些实施例中,所述第一引发剂与具有式(ⅳ)结构的聚(γ-丙烯酯-谷氨酸酯)的质量比为79mg:0.8g。
在本发明的某些实施例中,所述第一溶剂包括四氢呋喃,二甲基亚砜或n,n-二甲基甲酰胺。本发明对所述第一溶剂的用量并无特殊的限制,能够将第一引发剂、具有式(ⅳ)结构的聚(γ-丙烯酯-谷氨酸酯)和巯基乙胺盐酸盐溶解即可。
本发明对所述巯基乙胺盐酸盐的来源并无特殊的限制,可以为一般市售。
在本发明的某些实施例中,所述具有式(ⅳ)结构的聚(γ-丙烯酯-谷氨酸酯)和巯基乙胺盐酸盐的摩尔比为1:1~113、1:1~2、1:2、1:11、1:12.9、1:32、1:30.8、1:53.3、1:50、1:72.7、1:80或1:112.7。
本发明中,具有式(ⅳ)结构的聚(γ-丙烯酯-谷氨酸酯)和巯基乙胺盐酸盐在第一溶剂中的反应为“巯基-双键”点击化学反应。在本发明的某些实施例中,所述“巯基-双键”点击化学反应的温度为15~60℃,时间为12~72h。在某些实施例中,所述“巯基-双键”点击化学反应的温度为15~30℃或20~25℃,时间为24~60h或48h。
在本发明的某些实施例中,“巯基-双键”点击化学反应包括:先在紫外光照下搅拌反应,然后避光在10~40℃下搅拌反应。在本发明的某些实施例中,紫外光照下搅拌反应的时间为40min,避光搅拌反应的温度为25℃,避光搅拌反应的时间为48h。
在本发明的某些实施例中,所述“巯基-双键”点击化学反应在无氧的环境中进行。具体的,可以在氮气气氛中进行。在本发明的某些实施例中,所述“巯基-双键”点击化学反应的同时进行搅拌。本发明对所述搅拌的方法并无特殊的限制,采用本领域技术人员熟知的搅拌方法即可。在本发明的某些实施例中,所述“巯基-双键”点击化学反应完成后,还包括:将反应后的产物溶液进行透析和冻干,得到具有式(i)结构的聚氨基酸。本发明对所述透析和冻干的方法并无特殊的限制,采用本领域技术人员熟知的透析和冻干的方法即可。
本发明还提供了一种聚氨基酸衍生物,具有式(ⅷ)所示结构:
其中,0≤x≤50,0≤y≤50,x+y=n,5≤n≤50;
r具有式(ⅱ)或式(ⅲ)所示结构:
其中,1≤m≤16。
式(ⅷ)所示结构中,r表示random,不表示基团,意思是侧链修饰的位置是随机的,具有式(ⅷ)所示结构的聚氨基酸衍生物为无规共聚物。
在本发明的某些实施例中,5≤n≤35,1≤m≤16。在本发明的某些实施例中,n为5、15、25、35或50;m为1、6、10、14或16。
在本发明的某些实施例中,0≤x≤35,0≤y≤35。在本发明的某些实施例中,x为3、6、13、19或22;y为22、19、12、6或3。
本发明提供的聚氨基酸衍生物在水溶液中形成无规卷曲结构,可以在弱酸性微环境下响应性脱去阴离子侧基还原成具有式(i)所示结构的聚氨基酸,从而表现出和上述聚氨基酸相当的抗肿瘤效果。在本发明的某些实施例中,所述弱酸环境的ph值为6.8。所述聚氨基酸衍生物在正常生理条件下不会被激活成阳离子形式,因此对正常的组织细胞表现出良好的生物相容性。在本发明的某些实施例中,所述正常生理条件的ph值为7.4。
本发明还提供了一种上文所述的聚氨基酸衍生物的制备方法,包括以下步骤:
在第二催化剂的作用下,将聚氨基酸和2,3-二甲基马来酸酐在第四溶剂中反应,得到具有式(ⅷ)所示结构的聚氨基酸衍生物;
所述聚氨基酸具有式(i)所示结构或上文所述的制备方法制得的聚氨基酸;
其中,5≤n≤50,0≤x≤50,0≤y≤50,x+y=n;
r具有式(ⅱ)或式(ⅲ)所示结构:
其中,1≤m≤16。
在本发明的某些实施例中,所述第二催化剂为三乙胺、碳酸钾或n,n'-二异丙基乙胺。
本发明对所述2,3-二甲基马来酸酐的来源并无特殊的限制,可以为一般市售。
在本发明的某些实施例中,所述第四溶剂为n,n-二甲基甲酰胺(dmf)和/或二甲基亚砜。
在本发明的某些实施例中,所述聚氨基酸和2,3-二甲基马来酸酐的摩尔比为1:0.8~47、1:1.6、1:6.3、1:13.1、1:12.7、1:27.5、1:27.3、1:40.6、1:40、1:46.9或1:46。
本发明对第四溶剂的用量并无特殊的限制,可以将聚氨基酸溶解即可。
在本发明的某些实施例中,所述第二催化剂与2,3-二甲基马来酸酐的用量比为0.1~1.0ml:0.1~0.9g。在本发明的某些实施例中,所述第二催化剂与2,3-二甲基马来酸酐的用量比为0.14ml:0.13g、0.13ml:0.12g、0.28ml:0.26g、0.61ml:0.56g、0.56ml:0.52g、0.89ml:0.82g、0.82ml:0.76g、1.03ml:0.95g或0.95ml:0.88g。
在本发明的某些实施例中,聚氨基酸和2,3-二甲基马来酸酐在第四溶剂中反应的温度为10~40℃,时间为4~24h。在某些实施例中,聚氨基酸和2,3-二甲基马来酸酐在第四溶剂中反应的温度为15~30℃、20~25℃或25℃,时间为6~20h或12h。
在本发明的某些实施例中,聚氨基酸和2,3-二甲基马来酸酐在第四溶剂中反应的同时进行搅拌。本发明对所述搅拌的方法并无特殊的限制,采用本领域技术人员熟知的搅拌方法即可。
在本发明的某些实施例中,聚氨基酸和2,3-二甲基马来酸酐在第四溶剂中反应完成后,还包括将反应后的产物溶液进行透析和冻干,得到具有式(ⅷ)所示结构的聚氨基酸衍生物。本发明对所述透析和冻干的方法并无特殊的限制,采用本领域技术人员熟知的透析和冻干的方法即可。
本发明对上文采用的原料的来源并无特殊的限制,可以为一般市售。
本发明还提供了一种上文所述的聚氨基酸或上文所述的制备方法制得的聚氨基酸在制备抗肿瘤药物中的应用;或者是,上文所述的聚氨基酸衍生物或上文所述的制备方法制得的聚氨基酸衍生物在制备抗肿瘤药物中的应用。
本发明提供的聚氨基酸在水溶液中表现出明显的α-螺旋结构,可以通过静电作用结合到负电性的癌细胞膜表面,促使了聚氨基酸的疏水部分和膜磷脂疏水链间发生相互作用,导致细胞膜扰动并最终引起膜裂解使癌细胞坏死,它可以将多种癌细胞存活率抑制到20%以下。而修饰后的聚氨基酸衍生物具有式(ⅷ)所示结构,失去了螺旋结构呈现无规卷曲,但可在弱酸性微环境下响应性脱去阴离子侧基还原成具有式(i)所示结构的聚氨基酸,从而表现出和上述聚氨基酸相当的抗肿瘤效果。而在正常生理条件下(ph值为7.4),该修饰后的聚氨基酸衍生物不会被激活成阳离子形式,因此对正常的组织细胞表现出良好的生物相容性。因而,本发明请求保护上文所述的聚氨基酸或上文所述的制备方法制得的聚氨基酸在制备抗肿瘤药物中的应用;或者是,上文所述的聚氨基酸衍生物或上文所述的制备方法制得的聚氨基酸衍生物在制备抗肿瘤药物中的应用。
为了进一步说明本发明,下面结合实施例对本发明提供的一种聚氨基酸、其制备方法及应用进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
以下实施例所用的原料均为一般市售。
所述模型肿瘤细胞选自b16-f10鼠源黑色素瘤细胞、mcf-7人源乳腺癌细胞、k7m2-wt骨肉瘤细胞、4t1鼠源乳腺癌细胞和huvec人脐静脉内皮细胞。b16-f10鼠源黑色素瘤细胞和mcf-7人源乳腺癌细胞购买自中科院上海细胞库,k7m2-wt骨肉瘤细胞购买自上海一研生物科技有限公司,4t1鼠源乳腺癌细胞和huvec人脐静脉内皮细胞购买自上海博谷生物科技有限公司。
实施例1
具有式(ⅶ)所示结构的氨基化合物(1,2-二丙酰氧基-3-氨基丙烷,m=1)的合成:
称取n-(2,3-二羟基丙基)氨基甲酸叔丁酯1.6g(0.0084mol),丙酸1.3g(0.018mol)溶解于100ml二氯甲烷中,再加入10g的edc·hcl和0.5g的dmap,在25℃下搅拌反应48h。停止反应后用30ml稀盐酸(ph=2)洗涤有机相两次,再用30ml去离子水洗涤有机相两次,收集有机相加入无水硫酸镁干燥过夜。过滤除去硫酸镁之后,旋蒸除去二氯甲烷得到白色粗产物。再将该白色固体溶于三氟乙酸/二氯甲烷(体积比1:6)混合溶液中,冰浴下搅拌反应8h,在乙醚中沉降,用布氏漏斗抽滤得到白色固体,在真空干燥器中抽干,得到最终脱保护的白色固体产物1,2-二丙酰氧基-3-氨基丙烷。
实施例2
具有式(ⅶ)所示结构的氨基化合物(1,2-二辛酰氧基-3-氨基丙烷,m=6)的合成:
称取n-(2,3-二羟基丙基)氨基甲酸叔丁酯1.6g(0.0084mol),辛酸2.5g(0.018mol)溶解于100ml二氯甲烷中,再加入10g的edc·hcl和0.5g的dmap,在25℃下搅拌反应48h。停止反应后用30ml稀盐酸(ph=2)洗涤有机相两次,再用30ml去离子水洗涤有机相两次,收集有机相加入无水硫酸镁干燥过夜。过滤除去硫酸镁之后,旋蒸除去二氯甲烷得到白色粗产物。再将该白色固体溶于三氟乙酸/二氯甲烷(体积比1:6)混合溶液中,冰浴下搅拌反应8h,在乙醚中沉降,用布氏漏斗抽滤得到白色固体,在真空干燥器中抽干,得到最终脱保护的白色固体产物1,2-二辛酰氧基-3-氨基丙烷。
实施例3
具有式(ⅶ)所示结构的氨基化合物(1,2-二(十二酰氧基)-3-氨基丙烷,m=10)的合成:
称取n-(2,3-二羟基丙基)氨基甲酸叔丁酯1.6g(0.0084mol),十二烷酸3.0g(0.018mol)溶解于100ml二氯甲烷中,再加入10g的edc·hcl和0.5g的dmap,在25℃下搅拌反应48h。停止反应后用30ml稀盐酸(ph=2)洗涤有机相两次,再用30ml去离子水洗涤有机相两次,收集有机相加入无水硫酸镁干燥过夜。过滤除去硫酸镁之后,旋蒸除去二氯甲烷得到白色粗产物。再将该白色固体溶于三氟乙酸/二氯甲烷(体积比1:6)混合溶液中,冰浴下搅拌反应8h,在乙醚中沉降,用布氏漏斗抽滤得到白色固体,在真空干燥器中抽干,得到最终脱保护的白色固体产物1,2-二(十二酰氧基)-3-氨基丙烷。
实施例4
具有式(ⅶ)所示结构的氨基化合物(1,2-二软脂酰氧基-3-氨基丙烷,m=14)的合成:
称取n-(2,3-二羟基丙基)氨基甲酸叔丁酯1.6g(0.0084mol),软脂酸4.5g(0.018mol)溶解于100ml二氯甲烷中,再加入10g的edc·hcl和0.5g的dmap,在25℃下搅拌反应48h。停止反应后用30ml稀盐酸(ph=2)洗涤有机相两次,再用30ml去离子水洗涤有机相两次,收集有机相加入无水硫酸镁干燥过夜。过滤除去硫酸镁之后,旋蒸除去二氯甲烷得到白色粗产物。再将该白色固体溶于三氟乙酸/二氯甲烷(体积比1:6)混合溶液中,冰浴下搅拌反应8h,在乙醚中沉降,用布氏漏斗抽滤得到白色固体,在真空干燥器中抽干,得到最终脱保护的白色固体产物1,2-二软脂酰氧基-3-氨基丙烷(dpap16)。
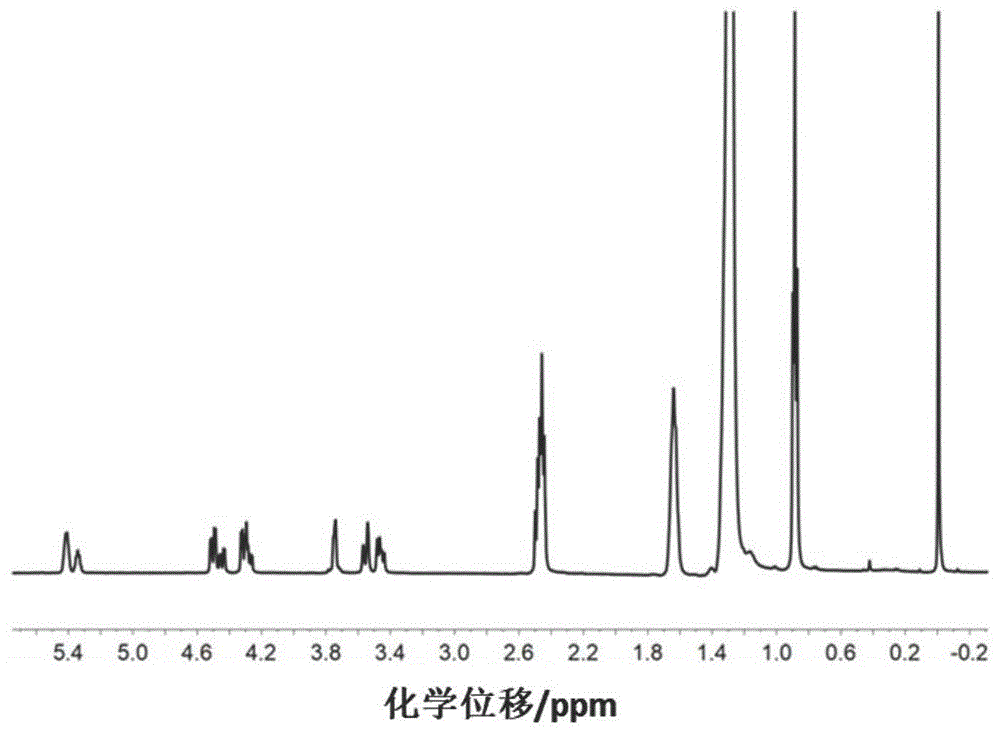
对上述得到的1,2-二软脂酰氧基-3-氨基丙烷进行检测,结果如图1所示。图1为本发明实施例4制备得到的1,2-二软脂酰氧基-3-氨基丙烷的核磁共振氢谱图。从图1可知,软脂酸成功键合到n-(2,3-二羟基丙基)氨基甲酸叔丁酯上,可以据此得出1,2-二软脂酰氧基-3-氨基丙烷具有式(ⅶ)所示的结构。
实施例5
具有式(ⅶ)所示结构的氨基化合物(1,2-二硬脂酰氧基-3-氨基丙烷,m=16)的合成:
称取n-(2,3-二羟基丙基)氨基甲酸叔丁酯1.6g(0.0084mol),硬脂酸5.0g(0.018mol)溶解于100ml二氯甲烷中,再加入10g的edc·hcl和0.5g的dmap,在25℃下搅拌反应48h。停止反应后用30ml稀盐酸(ph=2)洗涤有机相两次,再用30ml去离子水洗涤有机相两次,收集有机相加入无水硫酸镁干燥过夜。过滤除去硫酸镁之后,旋蒸除去二氯甲烷得到白色粗产物。再将该白色固体溶于三氟乙酸/二氯甲烷(体积比1:6)混合溶液中,冰浴下搅拌反应8h,在乙醚中沉降,用布氏漏斗抽滤得到白色固体,在真空干燥器中抽干,得到最终脱保护的白色固体产物1,2-二硬脂酰氧基-3-氨基丙烷。
实施例6
具有式(iv)结构的1-丙基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=5:
称取正丙胺0.1g(0.0017mol),加入100ml无水n,n-二甲基甲酰胺中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐1.9g(0.0095mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述正丙胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-丙基胺-聚(γ-丙烯酯-谷氨酸酯)pa3-b-palg5。
实施例7
具有式(iv)结构的1,2-二丙酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=5:
称取实施例1合成的1,2-二丙酰氧基-3-氨基丙烷0.4g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐1.9g(0.0095mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二丙酰氧基-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二丙酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)dpap3-b-palg5。
实施例8
具有式(iv)结构的1-辛基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=5:
称取正辛胺0.2g(0.0017mol),加入100ml无水n,n-二甲基甲酰胺中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐1.9g(0.0095mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述正辛胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-辛基胺-聚(γ-丙烯酯-谷氨酸酯)oa8-b-palg5。
实施例9
具有式(iv)结构的1,2-二辛酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=5:
称取实施例2合成的1,2-二辛酰氧基-3-氨基丙烷0.6g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐1.9g(0.0095mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二辛酰氧基-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二辛酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)doap8-b-palg5。
实施例10
具有式(iv)结构的1-十二烷基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=5:
称取十二烷胺0.3g(0.0017mol),加入100ml无水n,n-二甲基甲酰胺中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐1.9g(0.0095mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述十二烷胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-十二烷基胺-聚(γ-丙烯酯-谷氨酸酯)da12-b-palg5。
实施例11
具有式(iv)结构的1,2-二(十二酰氧基)-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=5:
称取实施例3合成的1,2-二(十二酰氧基)-3-氨基丙烷0.8g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐1.9g(0.0095mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二(十二酰氧基)-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二(十二酰氧基)-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)ddap12-b-palg5。
实施例12
具有式(iv)结构的1-十六烷基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=5:
称取十六烷胺0.4g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐1.9g(0.0095mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述十六烷胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-十六烷基胺-聚(γ-丙烯酯-谷氨酸酯)ha16-b-palg5。
实施例13
具有式(iv)结构的1,2-二软脂酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=5:
称取实施例4合成的1,2-二软脂酰氧基-3-氨基丙烷1.0g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐1.9g(0.0095mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二软脂酰氧基-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二软脂酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)dpap16-b-palg5。
对上述得到的dpap16-b-palg5进行检测,结果如图2所示。图2为本发明实施例13制备得到的dpap16-b-palg5的核磁共振氢谱图。从图2可知,1,2-二软脂酰氧基-3-氨基丙烷成功的引发了丙烯酯谷氨酸-n-羧基环内酸酐的聚合,并且可以得出其聚合度为5,所述dpap16-b-palg5具有式(iv)所示结构。
实施例14
具有式(iv)结构的1-十八烷基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=5:
称取十八烷胺0.5g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐1.9g(0.0095mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述十八烷胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-十八烷基胺-聚(γ-丙烯酯-谷氨酸酯)oda18-b-palg5。
实施例15
具有式(iv)结构的1,2-二硬脂酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=5:
称取实施例5合成的1,2-二硬脂酰氧基-3-氨基丙烷1.0g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐1.9g(0.0095mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二硬脂酰氧基-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二硬脂酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)dsap18-b-palg5。
实施例16
具有式(iv)结构的1-丙基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=15:
称取正丙胺0.1g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐5.6g(0.028mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述正丙胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-丙基胺-聚(γ-丙烯酯-谷氨酸酯)pa3-b-palg15。
实施例17
具有式(iv)结构的1,2-二丙酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=15:
称取实施例1合成的1,2-二丙酰氧基-3-氨基丙烷0.4g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐5.6g(0.028mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二丙酰氧基-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二丙酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)dpap3-b-palg15。
实施例18
具有式(iv)结构的1-辛基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=15:
称取正辛胺0.2g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐5.6g(0.028mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述正辛胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-辛基胺-聚(γ-丙烯酯-谷氨酸酯)oa8-b-palg15。
实施例19
具有式(iv)结构的1,2-二辛酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=15:
称取实施例2合成的1,2-二辛酰氧基-3-氨基丙烷0.6g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐5.6g(0.028mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二辛酰氧基-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二辛酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)doap8-b-palg15。
实施例20
具有式(iv)结构的1-十二烷基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=15:
称取十二烷胺0.3g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐5.6g(0.028mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述十二烷胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-十二烷基胺-聚(γ-丙烯酯-谷氨酸酯)da12-b-palg15。
实施例21
具有式(iv)结构的1,2-二(十二酰氧基)-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=15:
称取实施例3合成的1,2-二(十二酰氧基)-3-氨基丙烷0.8g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐5.6g(0.028mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二(十二酰氧基)-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二(十二酰氧基)-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)ddap12-b-palg15。
实施例22
具有式(iv)结构的1-十六烷基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=15:
称取十六烷胺0.4g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐5.6g(0.028mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述十六烷胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-十六烷基胺-聚(γ-丙烯酯-谷氨酸酯)ha16-b-palg15。
实施例23
具有式(iv)结构的1,2-二软脂酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=15:
称取实施例4合成的1,2-二软脂酰氧基-3-氨基丙烷1.0g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐5.6g(0.028mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二软脂酰氧基-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二软脂酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)dpap16-b-palg15。
实施例24
具有式(iv)结构的1-十八烷基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=15:
称取十八烷胺0.5g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐5.6g(0.028mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述十八烷胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-十八烷基胺-聚(γ-丙烯酯-谷氨酸酯)oda18-b-palg15。
实施例25
具有式(iv)结构的1,2-二硬脂酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=15:
称取实施例5合成的1,2-二硬脂酰氧基-3-氨基丙烷1.0g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐5.6g(0.028mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二硬脂酰氧基-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二硬脂酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)dsap18-b-palg15。
实施例26
具有式(iv)结构的1-丙基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=25:
称取正丙胺0.1g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐9.4g(0.047mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述正丙胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-丙基胺-聚(γ-丙烯酯-谷氨酸酯)pa3-b-palg25。
实施例27
具有式(iv)结构的1,2-二丙酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=25:
称取实施例1合成的1,2-二丙酰氧基-3-氨基丙烷0.4g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐9.4g(0.047mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二丙酰氧基-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二丙酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)dpap3-b-palg25。
实施例28
具有式(iv)结构的1-辛基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=25:
称取正辛胺0.2g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐9.4g(0.047mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述正辛胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-辛基胺-聚(γ-丙烯酯-谷氨酸酯)oa8-b-palg25。
实施例29
具有式(iv)结构的1,2-二辛酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=25:
称取实施例2合成的1,2-二辛酰氧基-3-氨基丙烷0.6g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐9.4g(0.047mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二辛酰氧基-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二辛酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)doap8-b-palg25。
实施例30
具有式(iv)结构的1-十二烷基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=25:
称取十二烷胺0.3g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐9.4g(0.047mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述十二烷胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-十二烷基胺-聚(γ-丙烯酯-谷氨酸酯)da12-b-palg25。
实施例31
具有式(iv)结构的1,2-二(十二酰氧基)-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=25:
称取实施例3合成的1,2-二(十二酰氧基)-3-氨基丙烷0.8g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐9.4g(0.047mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二(十二酰氧基)-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二(十二酰氧基)-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)ddap12-b-palg25。
实施例32
具有式(iv)结构的1-十六烷基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=25:
称取十六烷胺0.4g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐9.4g(0.047mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述十六烷胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-十六烷基胺-聚(γ-丙烯酯-谷氨酸酯)ha16-b-palg25。
实施例33
具有式(iv)结构的1,2-二软脂酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=25:
称取实施例4合成的1,2-二软脂酰氧基-3-氨基丙烷1.0g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐9.4g(0.047mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二软脂酰氧基-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二软脂酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)dpap16-b-palg25。
对上述得到的dpap16-b-palg25进行检测,结果如图3所示。图3为本发明实施例33制备得到的dpap16-b-palg25的核磁共振氢谱图。从图3可知,1,2-二软脂酰氧基-3-氨基丙烷成功的引发了丙烯酯谷氨酸-n-羧基环内酸酐的聚合,得到dpap16-b-palg25,并且可以得出其聚合度为25,具有(iv)所示结构。
实施例34
具有式(iv)结构的1-十八烷基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=25:
称取十八烷胺0.5g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐9.4g(0.047mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述十八烷胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-十八烷基胺-聚(γ-丙烯酯-谷氨酸酯)oda18-b-palg25。
实施例35
具有式(iv)结构的1,2-二硬脂酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=25:
称取实施例5合成的1,2-二硬脂酰氧基-3-氨基丙烷1.0g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐9.4g(0.047mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二硬脂酰氧基-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二硬脂酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)dsap18-b-palg25。
实施例36
具有式(iv)结构的1-丙基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=35:
称取正丙胺0.1g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐13.2g(0.066mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述正丙胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-丙基胺-聚(γ-丙烯酯-谷氨酸酯)pa3-b-palg35。
实施例37
具有式(iv)结构的1,2-二丙酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=35:
称取实施例1合成的1,2-二丙酰氧基-3-氨基丙烷0.4g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐13.2g(0.066mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二丙酰氧基-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二丙酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)dpap3-b-palg35。
实施例38
具有式(iv)结构的1-辛基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=35:
称取正辛胺0.2g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐13.2g(0.066mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述正辛胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-辛基胺-聚(γ-丙烯酯-谷氨酸酯)oa8-b-palg35。
实施例39
具有式(iv)结构的1,2-二辛酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=35:
称取实施例2合成的1,2-二辛酰氧基-3-氨基丙烷0.6g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐13.2g(0.066mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二辛酰氧基-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二辛酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)doap8-b-palg35。
实施例40
具有式(iv)结构的1-十二烷基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=35:
称取十二烷胺0.3g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐13.2g(0.066mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述十二烷胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-十二烷基胺-聚(γ-丙烯酯-谷氨酸酯)da12-b-palg35。
实施例41
具有式(iv)结构的1,2-二(十二酰氧基)-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=35:
称取实施例3合成的1,2-二(十二酰氧基)-3-氨基丙烷0.8g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐13.2g(0.066mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二(十二酰氧基)-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二(十二酰氧基)-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)ddap12-b-palg35。
实施例42
具有式(iv)结构的1-十六烷基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=35:
称取十六烷胺0.4g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐13.2g(0.066mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述十六烷胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-十六烷基胺-聚(γ-丙烯酯-谷氨酸酯)ha16-b-palg35。
实施例43
具有式(iv)结构的1,2-二软脂酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=35:
称取实施例4合成的1,2-二软脂酰氧基-3-氨基丙烷1.0g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐13.2g(0.066mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二软脂酰氧基-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二软脂酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)dpap16-b-palg35。
实施例44
具有式(iv)结构的1-十八烷基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=35:
称取十八烷胺0.5g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐13.2g(0.066mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述十八烷胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-十八烷基胺-聚(γ-丙烯酯-谷氨酸酯)oda18-b-palg35。
实施例45
具有式(iv)结构的1,2-二硬脂酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=35:
称取实施例5合成的1,2-二硬脂酰氧基-3-氨基丙烷1.0g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐13.2g(0.066mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二硬脂酰氧基-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二硬脂酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)dsap18-b-palg35。
实施例46
具有式(iv)结构的1-丙基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=50:
称取正丙胺0.1g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐18.8g(0.094mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述正丙胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-丙基胺-聚(γ-丙烯酯-谷氨酸酯)pa3-b-palg50。
实施例47
具有式(iv)结构的1,2-二丙酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=50:
称取实施例1合成的1,2-二丙酰氧基-3-氨基丙烷0.4g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐18.8g(0.094mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二丙酰氧基-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二丙酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)dpap3-b-palg50。
实施例48
具有式(iv)结构的1-辛基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=50:
称取正辛胺0.2g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐18.8g(0.094mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述正辛胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-辛基胺-聚(γ-丙烯酯-谷氨酸酯)oa8-b-palg50。
实施例49
具有式(iv)结构的1,2-二辛酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=50:
称取实施例2合成的1,2-二辛酰氧基-3-氨基丙烷0.6g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐18.8g(0.094mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二辛酰氧基-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二辛酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)doap8-b-palg50。
实施例50
具有式(iv)结构的1-十二烷基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=50:
称取十二烷胺0.3g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐18.8g(0.094mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述十二烷胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-十二烷基胺-聚(γ-丙烯酯-谷氨酸酯)da12-b-palg50。
实施例51
具有式(iv)结构的1,2-二(十二酰氧基)-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=50:
称取实施例3合成的1,2-二(十二酰氧基)-3-氨基丙烷0.8g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐18.8g(0.094mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二(十二酰氧基)-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二(十二酰氧基)-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)ddap12-b-palg50。
实施例52
具有式(iv)结构的1-十六烷基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=50:
称取十六烷胺0.4g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐18.8g(0.094mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述十六烷胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-十六烷基胺-聚(γ-丙烯酯-谷氨酸酯ha16-b-palg50。
实施例53
具有式(iv)结构的1,2-二软脂酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=50:
称取实施例4合成的1,2-二软脂酰氧基-3-氨基丙烷1.0g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐18.8g(0.094mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二软脂酰氧基-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二软脂酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)dpap16-b-palg50。
实施例54
具有式(iv)结构的1-十八烷基胺-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=50:
称取十八烷胺0.5g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐18.8g(0.094mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述十八烷胺溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1-十八烷基胺-聚(γ-丙烯酯-谷氨酸酯)oda18-b-palg50。
实施例55
具有式(iv)结构的1,2-二硬脂酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)的合成,式(iv)结构中,n=50:
称取实施例5合成的1,2-二硬脂酰氧基-3-氨基丙烷1.0g(0.0017mol),加入100ml无水四氢呋喃中溶解。再称取具有式(ⅴ)所示结构的丙烯酯谷氨酸-n-羧基环内酸酐18.8g(0.094mol),溶于30ml无水四氢呋喃,然后将其一次性加入上述1,2-二硬脂酰氧基-3-氨基丙烷溶液中,25℃下搅拌反应72h后,透析,冻干,得到白色粉末产物1,2-二硬脂酰氧基-3-氨丙基-聚(γ-丙烯酯-谷氨酸酯)dsap18-b-palg50。
实施例56:具有式(i)结构的聚氨基酸的合成
称取实施例12合成的ha16-b-palg50.8g(0.73mmol),巯基乙胺盐酸盐0.8g(8mmol)和79mg的光引发剂irgacure2959溶于dmf中,用氮气流鼓泡10min除去反应体系中的氧气,然后密封,在紫外光照下搅拌反应40min,之后避光在25℃下继续搅拌反应48h,反应结束后,将反应产物溶液透析、冻干,得到具有式(i)结构的阳离子聚氨基酸白色粉末ha16-b-patg5,其中n=5。
本实施例制备的阳离子聚氨基酸材料能作为抗肿瘤药物,且与实施例61的抗癌效果类似。
实施例57:具有式(i)结构的聚氨基酸的合成
称取实施例13合成的dpap16-b-palg51.0g(0.62mmol),巯基乙胺盐酸盐0.8g(8mmol)和79mg的光引发剂irgacure2959溶于dmf中,用氮气流鼓泡10min除去反应体系中的氧气,然后密封,在紫外光照下搅拌反应40min,之后避光在25℃下继续搅拌反应48h,反应结束后,将反应产物溶液透析、冻干,得到具有式(i)结构的阳离子聚氨基酸白色粉末dpap16-b-patg5,其中n=5。
对上述得到的阳离子聚氨基酸dpap16-b-patg5进行检测,结果如图4所示。图4为本发明实施例57制备得到的阳离子聚氨基酸dpap16-b-patg5的核磁共振氢谱图。从图4可知,聚合物dpap16-b-patg5侧基的双键成功的键合上了巯基乙胺盐酸盐,得到了具有式(i)结构的阳离子聚氨基酸。
阳离子聚氨基酸dpap16-b-patg5的抗肿瘤活性通过细胞毒性试验来检测:
将本发明实施例57制备得到的dpap16-b-patg5和b16-f10鼠源黑色素瘤细胞共培养,采用mtt实验进行评估:
首先在96孔板中以6000个细胞/孔的密度(悬浮于200微升dmem培养基)接种相应的细胞,在37℃下细胞培养箱中孵育24h。次日,用新鲜的dmem培养基溶解相应的阳离子聚氨基酸材料,并梯度稀释成不同的浓度,弃去前一天的培养基,加入含有不同浓度阳离子聚氨基酸材料的dmem,继续在37℃下细胞培养箱中孵育24h。之后在每个孔中加入mtt溶液(最终浓度0.5mg/ml),继续在37℃下孵育4h。弃去孔板中的液体,并分别向每个孔中加入150微升的dmso,溶解紫色甲瓒晶体。最后用酶标仪(tecan,switzerland)测定各个孔在570nm处的吸光度,用实验组的吸光度值和对照组相比即可计算出细胞的存活率。
图5为实施例57中b16-f10鼠源黑色素瘤细胞随着聚氨基酸浓度的增加对应的细胞存活率。从图5可知,阳离子聚氨基酸dpap16-b-patg5具有很强的抗黑色素瘤效果,将b16-f10鼠源黑色素瘤细胞存活率抑制到23.6%。
sem扫描电子显微镜观测细胞形态:
在共聚焦小皿中接种1.2×105个细胞/孔(悬浮于2ml的dmem),在37℃下细胞培养箱中孵育24小时。次日,用新鲜的dmem培养基溶解相应的阳离子聚氨基酸材料,并梯度稀释成不同的浓度,弃去前一天的培养基,加入含有不同浓度阳离子聚氨基酸的dmem,继续在37℃下细胞培养箱中孵育30分钟。之后弃去培养皿中的液体,用pbs洗涤2次并用4%的多聚甲醛和2.5%的戊二醛依次固定30分钟。接着用2.5%的单宁酸染色30分钟,2%的四氧化锇染色2小时。依次用10%、30%、50%、70%和100%的乙醇脱水,最终用扫描电子显微镜((zeissmerlin,germany)观测。结果表明,阳离子聚氨基酸dpap16-b-patg25处理后的癌细胞,细胞膜破裂,细胞内容物流出,细胞皱缩坍塌彻底坏死。
将本发明实施例57制备得到的dpap16-b-patg5和mcf-7人源乳腺癌细胞共培养,按照上述方法计算出细胞的存活率。如图6所示。图6为实施例57中mcf-7人源乳腺癌细胞随着聚氨基酸浓度的增加对应的细胞存活率。从图6可以看出,阳离子聚氨基酸dpap16-b-patg5具有很强的抗乳腺癌效果,将mcf-7人源乳腺癌细胞存活率抑制到19.1%。
将本发明实施例57制备得到的dpap16-b-patg5和k7m2-wt骨肉瘤细胞共培养24h后,按照上述方法计算出细胞的存活率。如图7所示。图7为实施例57中k7m2-wt骨肉瘤细胞随着聚氨基酸浓度的增加对应的细胞存活率。从图7可知,阳离子聚氨基酸dpap16-b-patg5具有很强的抗骨肉瘤效果,可以将k7m2-wt骨肉瘤细胞存活率抑制到18.3%。
实验结果表明,该阳离子聚氨基酸材料dpap16-b-patg5能够将癌细胞存活率降低到25%以下。
实施例58:具有式(i)结构的聚氨基酸的合成
称取实施例20合成的da12-b-palg150.65g(0.25mmol),巯基乙胺盐酸盐0.8g(8mmol)和79mg的光引发剂irgacure2959溶于dmf中,用氮气流鼓泡10min除去反应体系中的氧气,然后密封,在紫外光照下搅拌反应40min。之后避光在25℃下继续搅拌反应48h,反应结束后,将反应产物溶液透析、冻干,得到具有式(i)结构的阳离子聚氨基酸材料白色粉末da12-b-patg15,其中n=15。
对上述得到的阳离子聚氨基酸da12-b-patg15进行检测,结果如图8所示。图8为本发明实施例58制备得到的阳离子聚氨基酸da12-b-patg15的核磁共振氢谱图。从图8可知,da12-b-patg15侧基上的双键成功的键合了巯基乙胺盐酸盐,得到了具有式(i)结构的阳离子聚氨基酸。
阳离子聚氨基酸dpap16-b-patg5的抗肿瘤活性通过细胞毒性试验来检测,具体方法同上:
图9为实施例58中b16-f10鼠源黑色素瘤细胞随着聚氨基酸浓度的增加对应的细胞存活率。从图9可知,阳离子聚氨基酸da12-b-patg15具有很强的抗黑色素瘤效果,将b16-f10鼠源黑色素瘤细胞存活率抑制到5.4%。
本实施例制备的阳离子聚氨基酸材料能作为抗肿瘤药物,且与实施例57的抗癌效果类似。
实施例59:具有式(i)结构的聚氨基酸的合成
称取实施例23合成的dpap16-b-palg150.73g(0.26mmol),巯基乙胺盐酸盐0.8g(8mmol)和79mg的光引发剂irgacure2959溶于dmf中,用氮气流鼓泡10min除去反应体系中的氧气,然后密封,在紫外光照下搅拌反应40min。之后避光在25℃下继续搅拌反应48h,反应结束后,将反应产物溶液透析、冻干,得到具有式(i)结构的阳离子聚氨基酸材料白色粉末dpap16-b-patg15,其中n=15。
本实施例制备的阳离子聚氨基酸材料能作为抗肿瘤药物,且与实施例61的抗癌效果类似。
实施例60:具有式(i)结构的聚氨基酸的合成
称取实施例32合成的ha16-b-palg250.63g(0.15mmol),巯基乙胺盐酸盐0.8g(8mmol)和79mg的光引发剂irgacure2959溶于dmf中,用氮气流鼓泡10min除去反应体系中的氧气,然后密封,在紫外光照下搅拌反应40min。之后避光在25℃下继续搅拌反应48h,反应结束后,将反应产物溶液透析、冻干,得到具有式(i)结构的阳离子聚氨基酸材料白色粉末ha16-b-patg25,其中n=25。
本实施例制备的阳离子聚氨基酸材料能作为抗肿瘤药物,且与实施例57的抗癌效果类似。
实施例61:具有式(i)结构的聚氨基酸的合成
称取实施例33合成的dpap16-b-palg250.67g(0.16mol),巯基乙胺盐酸盐0.8g(8mmol)和79mg的光引发剂irgacure2959溶于dmf中,用氮气流鼓泡10min除去反应体系中的氧气,然后密封,在紫外光照下搅拌反应40min。之后避光在25℃下继续搅拌反应48h,反应结束后,将反应产物溶液透析、冻干,得到具有式(i)结构的阳离子聚氨基酸材料白色粉末dpap16-b-patg25,其中n=25。
图10为本发明实施例61制备得到的dpap16-b-patg25的核磁共振氢谱图。
利用圆二色谱来测定该阳离子聚氨基酸dpap16-b-patg25的二级结构,称取2mg阳离子聚氨基酸材料溶于10ml去离子水中配成0.2mg/ml的溶液,加入到石英比色皿中在圆二色谱仪(appliedphotophysicsltd.,leatherhead,uk)上测定其cd光谱。
图11为本发明实施例61制备得到的dpap16-b-patg25在水溶液中的圆二色谱图。从图11可以看出,208nm和222nm处的吸收峰表明dpap16-b-patg25具有完全的α-螺旋结构。
dpap16-b-patg25的抗肿瘤活性通过细胞毒性试验来检测,具体的方法同上。
将本发明实施例61制备得到的dpap16-b-patg25和mcf-7人源乳腺癌细胞共培养24h后,按照上述方法计算出细胞的存活率。如图12所示。图12为实施例61中mcf-7人源乳腺癌细胞随着聚氨基酸浓度的增加对应的细胞存活率。从图12可以看出,阳离子聚氨基酸dpap16-b-patg25具有很强的抗乳腺癌效果,将mcf-7人源乳腺癌细胞存活率抑制到17.4%。
将本发明实施例61制备得到的dpap16-b-patg25和b16-f10鼠源黑色素瘤细胞共培养24h后,按照上述方法计算出细胞的存活率。如图13所示。图13为实施例61中b16-f10鼠源黑色素瘤细胞随着聚氨基酸浓度的增加对应的细胞存活率。从图13可以看出,阳离子聚氨基酸dpap16-b-patg25具有很强的抗黑色素瘤效果,将b16-f10鼠源黑色素瘤细胞存活率抑制到19.9%。
实验结果表明该阳离子聚氨基酸材料dpap16-b-patg25能够将癌细胞存活率降低到20%以下。
通过sem观测阳离子聚氨基酸材料dpap16-b-patg25处理后细胞形态结构的变化,如图14所示。图14为本发明实施例61制备得到的dpap16-b-patg25和4t1鼠源乳腺癌细胞共培养30min后的sem图。从图14可以看出,4t1鼠源乳腺癌细胞的细胞膜被完全破坏,细胞膜产生许多孔,导致细胞内容物流出,细胞结构坍塌。
实施例62:具有式(i)结构的聚氨基酸的合成
称取实施例42合成的ha16-b-palg350.62g(0.11mmol),巯基乙胺盐酸盐0.8g(8mmol)和79mg的光引发剂irgacure2959溶于dmf中,用氮气流鼓泡10min除去反应体系中的氧气,然后密封,在紫外光照下搅拌反应40min。之后避光在25℃下继续搅拌反应48h,反应结束后,将反应产物溶液透析、冻干,得到具有式(i)结构的阳离子聚氨基酸材料白色粉末ha16-b-patg35,其中n=35。
本实施例制备的阳离子聚氨基酸材料能作为抗肿瘤药物,且与实施例61的抗癌效果类似。
实施例63:具有式(i)结构的聚氨基酸的合成
称取实施例43合成的dpap16-b-palg350.65g(0.1mmol),巯基乙胺盐酸盐0.8g(8mmol)和79mg的光引发剂irgacure2959溶于dmf中,用氮气流鼓泡10min除去反应体系中的氧气,然后密封,在紫外光照下搅拌反应40min。之后避光在25℃下继续搅拌反应48h,反应结束后,将反应产物溶液透析、冻干,得到具有式(i)结构的阳离子聚氨基酸材料白色粉末dpap16-b-patg35,其中n=35。
本实施例制备的阳离子聚氨基酸材料能作为抗肿瘤药物,且与实施例61的抗癌效果类似。
实施例64:具有式(i)结构的聚氨基酸的合成
称取实施例52合成的ha16-b-palg500.61g(0.071mmol),巯基乙胺盐酸盐0.8g(8mmol)和79mg的光引发剂irgacure2959溶于dmf中,用氮气流鼓泡10min除去反应体系中的氧气,然后密封,在紫外光照下搅拌反应40min。之后避光在25℃下继续搅拌反应48h,反应结束后,将反应产物溶液透析、冻干,得到阳离子聚氨基酸材料白色粉末ha16-b-patg50。其中n=50。
本实施例制备的阳离子聚氨基酸材料能作为抗肿瘤药物,且与实施例61的抗癌效果类似。
实施例65:具有式(i)结构的聚氨基酸的合成
称取实施例53合成的dpap16-b-palg500.63g(0.071mmol),巯基乙胺盐酸盐0.8g(8mmol)和79mg的光引发剂irgacure2959溶于dmf中,用氮气流鼓泡10min除去反应体系中的氧气,然后密封,在紫外光照下搅拌反应40min。之后避光在25℃下继续搅拌反应48h,反应结束后,将反应产物溶液透析、冻干,得到阳离子聚氨基酸材料白色粉末dpap16-b-patg50。其中n=50。
本实施例制备的阳离子聚氨基酸材料能作为抗肿瘤药物,且与实施例61的抗癌效果类似。
实施例66:具有式(ⅷ)结构的阳离子聚氨基酸衍生材料的合成
称取实施例60合成的阳离子聚氨基酸材料ha16-b-patg251.0g(0.16mmol)溶解于dmf中,再加入2,3-二甲基马来酸酐0.13g(1.0mmol)和三乙胺0.14ml,在25℃下搅拌反应12h。反应结束后,将反应产物溶液透析、冻干,得到具有式(ⅷ)结构的阳离子聚氨基酸衍生材料ha16-b-dmma3/patg22,其中,x=3,y=22。
本实施例制备的阳离子聚氨基酸衍生材料在ph=7.4条件下没有毒性,在ph=6.8条件下具有抗肿瘤活性。
实施例67:具有式(ⅷ)结构的阳离子聚氨基酸衍生材料的合成
称取实施例61合成的阳离子聚氨基酸材料dpap16-b-patg251.0g(0.15mmol)溶解于dmf中,再加入2,3-二甲基马来酸酐0.12g(0.95mmol)和三乙胺0.13ml,在25℃下搅拌反应12h。反应结束后,将反应产物溶液透析、冻干,得到具有式(ⅷ)结构的阳离子聚氨基酸衍生材料dpap16-b-dmma3/patg22,其中,x=3,y=22。
本实施例制备的阳离子聚氨基酸衍生材料在ph=7.4条件下没有毒性,在ph=6.8条件下具有抗肿瘤活性,且与实施例71的抗癌效果类似。
实施例68:具有式(ⅷ)结构的阳离子聚氨基酸衍生材料的合成
称取实施例60合成的阳离子聚氨基酸材料ha16-b-patg251.0g(0.16mmolmol)溶解于dmf中,再加入2,3-二甲基马来酸酐0.26g(2.1mmol)和三乙胺0.28ml,在25℃下搅拌反应12h。反应结束后,将反应产物溶液透析、冻干,得到具有式(ⅷ)结构的阳离子聚氨基酸衍生材料ha16-b-dmma6/patg19,其中,x=6,y=19。
本实施例制备的阳离子聚氨基酸衍生材料在ph=7.4条件下没有毒性,在ph=6.8条件下具有抗肿瘤活性,且与实施例71的抗癌效果类似。
实施例69:具有式(ⅷ)结构的阳离子聚氨基酸衍生材料的合成
称取实施例61合成的阳离子聚氨基酸材料dpap16-b-patg251.0g(0.15mmol)溶解于dmf中,再加入2,3-二甲基马来酸酐0.24g(1.9mmol)和三乙胺0.26ml,在25℃下搅拌反应12h。反应结束后,将反应产物溶液透析、冻干,得到具有式(ⅷ)结构的阳离子聚氨基酸衍生材料dpap16-b-dmma6/patg19,其中,x=6,y=19。
对上述得到的阳离子聚氨基酸衍生材料dpap16-b-dmma6/patg19进行检测,结果如图15所示。图15为本发明实施例69制备得到的阳离子聚氨基酸衍生材料dpap16-b-dmma6/patg19的核磁共振氢谱图。从图15可知,阳离子聚氨基酸材料dpap16-b-patg25的侧链上25个氨基,其中有6个成功的修饰上2,3-二甲基马来酰胺结构,得到了具有式(ⅷ)所示结构。
本实施例制备的阳离子聚氨基酸衍生材料在ph=7.4条件下没有毒性,在ph=6.8条件下具有抗肿瘤活性,且与实施例71的抗癌效果类似。
实施例70:具有式(ⅷ)结构的阳离子聚氨基酸衍生材料的合成
称取实施例60合成的阳离子聚氨基酸材料ha16-b-patg251.0g(0.16mmol)溶解于dmf中,再加入2,3-二甲基马来酸酐0.56g(4.4mmol)和三乙胺0.61ml,在25℃下搅拌反应12h。反应结束后,将反应产物溶液透析、冻干,得到具有式(ⅷ)结构的阳离子聚氨基酸衍生材料ha16-b-dmma13/patg12,其中,x=13,y=12。
本实施例制备的阳离子聚氨基酸衍生材料在ph=7.4条件下没有毒性,在ph=6.8条件下具有抗肿瘤活性,且与实施例71的抗癌效果类似。
实施例71:具有式(ⅷ)结构的阳离子聚氨基酸衍生材料的合成
称取实施例61合成的阳离子聚氨基酸材料dpap16-b-patg251.0g(0.15mmol)溶解于dmf中,再加入2,3-二甲基马来酸酐0.52g(4.1mmol)和三乙胺0.56ml,在25℃下搅拌反应12h。反应结束后,将反应产物溶液透析、冻干,得到具有式(ⅷ)结构的阳离子聚氨基酸衍生材料dpap16-b-dmma13/patg12,其中,x=13,y=12。
对上述得到的阳离子聚氨基酸衍生材料dpap16-b-dmma13/patg12进行检测,结果如图16所示。图16为本发明实施例58制备得到的阳离子聚氨基酸衍生材料dpap16-b-dmma13/patg12的核磁共振氢谱图。从图16可知,阳离子聚氨基酸材料dpap16-b-25的侧链上25个氨基,其中有13个成功的修饰上2,3-二甲基马来酰胺结构,得到了具有式(ⅷ)所示的结构。
利用圆二色谱来测定dpap16-b-dmma13/patg12的二级结构,称取2mg阳离子聚氨基酸衍生材料溶于10ml去离子水中配成0.2mg/ml的溶液,加入到石英比色皿中在圆二色谱仪(appliedphotophysicsltd.,leatherhead,uk)上测定其cd光谱。
图17为本发明实施例71制备得到的dpap16-b-dmma13/patg12在水溶液中的圆二色谱图。从图17可以看出,208nm和222nm处的吸收峰的消失表明dpap16-b-dmma13/patg12丧失了α-螺旋结构,呈现出无规结构。
该阳离子聚氨基酸衍生材料对于肿瘤微环境弱酸性的响应性通过zeta电势随着时间的变化来监测,图18为本发明实施例71制备得到的dpap16-b-dmma13/patg12在不同ph水溶液中(ph6.8或者7.4)的zeta电势随着时间的变化图。从图18可以看出,在中性ph条件下,该两性离子聚氨基酸比较稳定,zeta电势始终为负值。而在弱酸性条件下,阴离子侧基逐渐脱去,还原成初始的阳离子聚氨基酸结构。
dpap16-b-dmma13/patg12的抗肿瘤活性通过细胞毒性试验来检测,具体的方法同上:
将本发明实施例71制备得到的dpap16-b-dmma13/patg12和4t1鼠源乳腺癌细胞在ph6.8的条件下共培养24h后,按照上述方法计算出细胞的存活率。如图19所示。图19为本发明实施例71中4t1鼠源乳腺癌细胞随着dpap16-b-dmma13/patg12浓度的增加对应的细胞存活率。从图19可以看出,阳离子聚氨基酸衍生dpap16-b-dmma13/patg12在ph=6.8的条件下具有很强的抗乳腺癌效果,将4t1鼠源乳腺癌细胞存活率抑制到46.4%。
将本发明实施例71制备得到的dpap16-b-dmma13/patg12和huvec人脐静脉内皮细胞在ph7.4的条件下共培养24h后,按照上述方法计算出细胞的存活率。如图20所示。图20为本发明实施例71中huvec人脐静脉内皮细胞随着dpap16-b-dmma13/patg12浓度的增加对应的细胞存活率。从图20可以看出,阳离子聚氨基酸衍生dpap16-b-dmma13/patg12在ph=7.4的条件下具有很好的生物相容性,没有毒副作用,和huvec人脐静脉内皮细胞共培养后其存活率保持在90%以上。
实验结果表明,该阳离子聚氨基酸衍生材料dpap16-b-dmma13/patg12在弱酸性条件下可以有效地杀死癌细胞,而在生理中性条件下,对正常的内皮静脉细胞没有毒性,因此有望用于体内的肿瘤治疗。
通过sem观测在ph=6.8条件下,dpap16-b-dmma13/patg12处理后b16-f10细胞形态结构的变化,如图21所示。图21为本发明实施例71制备的dpap16-b-dmma13/patg12和b16-f10鼠源黑色素瘤细胞在ph=6.8的条件下共培养24h后的sem图。从图21可以看出,癌细胞的细胞膜被完全破坏,细胞膜产生许多孔,导致细胞内容物流出,细胞结构坍塌。
实施例72:具有式(ⅷ)结构的阳离子聚氨基酸衍生材料的合成
称取实施例60合成的阳离子聚氨基酸材料ha16-b-patg251.0g
(0.16mmol)溶解于dmf中,再加入2,3-二甲基马来酸酐0.82g(6.5mmol)和三乙胺0.89ml,在25℃下搅拌反应12h。反应结束后,将反应产物溶液透析、冻干,得到具有式(ⅷ)结构的阳离子聚氨基酸衍生材料ha16-b-dmma19/patg6,其中,x=19,y=6。
本实施例制备的阳离子聚氨基酸衍生材料在ph=7.4条件下没有毒性,在ph=6.8条件下具有抗肿瘤活性,且与实施例71的抗癌效果类似。
实施例73:具有式(ⅷ)结构的阳离子聚氨基酸衍生材料的合成
称取实施例61合成的阳离子聚氨基酸材料dpap16-b-patg251.0g(0.15mmol)溶解于dmf中,再加入2,3-二甲基马来酸酐0.76g(6.0mmol)和三乙胺0.82ml,在25℃下搅拌反应12h。反应结束后,将反应产物溶液透析、冻干,得到具有式(ⅷ)结构的阳离子聚氨基酸衍生材料dpap16-b-dmma19/patg6,其中,x=19,y=6。
本实施例制备的阳离子聚氨基酸衍生材料在ph=7.4条件下没有毒性,在ph=6.8条件下具有抗肿瘤活性,且与实施例71的抗癌效果类似。
实施例74:具有式(ⅷ)结构的阳离子聚氨基酸衍生材料的合成
称取实施例60合成的阳离子聚氨基酸材料ha16-b-patg251.0g(0.16mmol)溶解于dmf中,再加入2,3-二甲基马来酸酐0.95g(7.5mmol)和三乙胺1.03ml,在25℃下搅拌反应12h。反应结束后,将反应产物溶液透析、冻干,得到具有式(ⅷ)结构的阳离子聚氨基酸衍生材料ha16-b-dmma22/patg3,其中,x=22,y=3。
本实施例制备的阳离子聚氨基酸衍生材料在ph=7.4条件下没有毒性,在ph=6.8条件下具有抗肿瘤活性,且与实施例71的抗癌效果类似。
实施例75:具有式(ⅷ)结构的阳离子聚氨基酸衍生材料的合成
称取实施例61合成的阳离子聚氨基酸材料dpap16-b-patg251.0g(0.15mmol)溶解于dmf中,再加入2,3-二甲基马来酸酐0.88g(6.9mmol)和三乙胺0.95ml,在25℃下搅拌反应12h。反应结束后,将反应产物溶液透析、冻干,得到具有式(ⅷ)结构的阳离子聚氨基酸衍生材料dpap16-b-dmma22/patg3,其中,x=22,y=3。
对上述得到的阳离子聚氨基酸衍生材料dpap16-b-dmma22/patg3进行检测,结果如图22所示。图22为本发明实施例75制备得到的阳离子聚氨基酸衍生材料dpap16-b-dmma22/patg3的核磁共振氢谱图。从图22可知,阳离子聚氨基酸材料dpap16-b-patg25的侧链上25个氨基,其中有22个成功的修饰上2,3-二甲基马来酰胺结构,得到了具有式(ⅷ)所示的结构。
本实施例制备的阳离子聚氨基酸衍生材料在ph=7.4条件下没有毒性,在ph=6.8条件下具有抗肿瘤活性,且与实施例71的抗癌效果类似。
实施例76
检测实施例56~65制备的具有式(i)结构的聚氨基酸对不同癌细胞的细胞毒性,,采用mtt实验进行评估(具体步骤见实施例57),结果如表1所示。
表1实施例56~65制备的聚氨基酸对不同癌细胞的细胞毒性(ic50,μg/ml)
从表1可以看出,实施例56~65制备的阳离子聚氨基酸材料对b16-f10、mcf-7、k7m2-wt、4t1四种细胞系都具有抗肿瘤活性,其ic50在6~88μg/ml之间。其中,末端具有双链引发剂结构dpap的材料相比于同样的ha引发剂材料抗肿瘤效果要好一些。且当聚合度在15的时候要比其他几种聚合度抗肿瘤活性高。
检测实施例66~75制备的具有式(ⅷ)结构的阳离子聚氨基酸衍生材料对不同癌细胞的细胞毒性,采用mtt实验进行评估(在ph=6.8的条件下),结果如表1所示。
表2实施例66~75制备的聚氨基酸衍生物对不同癌细胞的细胞毒性(ic50,μg/ml)
从表2可以看出,实施例66~75制备的阳离子聚氨基酸衍生材料在ph=6.8的条件下,对b16-f10和4t1两种细胞系都具有抗肿瘤活性。其中,末端具有双链引发剂结构dpap的材料相比于同样的ha引发剂材料抗肿瘤效果要好一些。且侧链上修饰了2,3-二甲基马来酰胺结构越少的材料,相比于较多修饰了2,3-二甲基马来酰胺结构的材料,其抗肿瘤活性要高。
由以上实施例可知,本发明提供了一种阳离子聚氨基酸以及其阴离子修饰的阳离子聚氨基酸衍生材料,分别具有式(i)和(ⅷ)结构。该阳离子聚氨基酸材料可以通过静电作用选择性地结合到负电性的癌细胞膜表面,进而促使了聚氨基酸的疏水部分和细胞膜磷脂疏水链间发生相互作用,导致细胞膜穿孔或裂解使癌细胞坏死,它可以将多种癌细胞存活率抑制到20%以下。而修饰后的两性离子聚氨基酸前体可以在弱酸性条件下(ph为6.8)响应性脱去阴离子侧基还原成初始的阳离子聚氨基酸,从而表现出和上述阳离子聚氨基酸类似的抗肿瘤效果。而在正常生理条件下(ph[为7.4),该两性离子聚氨基酸前体则比较稳定,不会还原成阳离子活性形式,因此对正常的组织细胞表现出良好的生物相容性。
以上实施例的说明只是用于帮助理解本发明的方法及其核心思想。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!