检测Ⅰ型脊灰减毒活疫苗核酸突变的质谱检测引物组及其方法与流程
本发明属于单核苷酸多态性检测
技术领域:
,具体涉及一种检测ⅰ型脊灰减毒活疫苗核酸突变的质谱检测引物组及其方法。
背景技术:
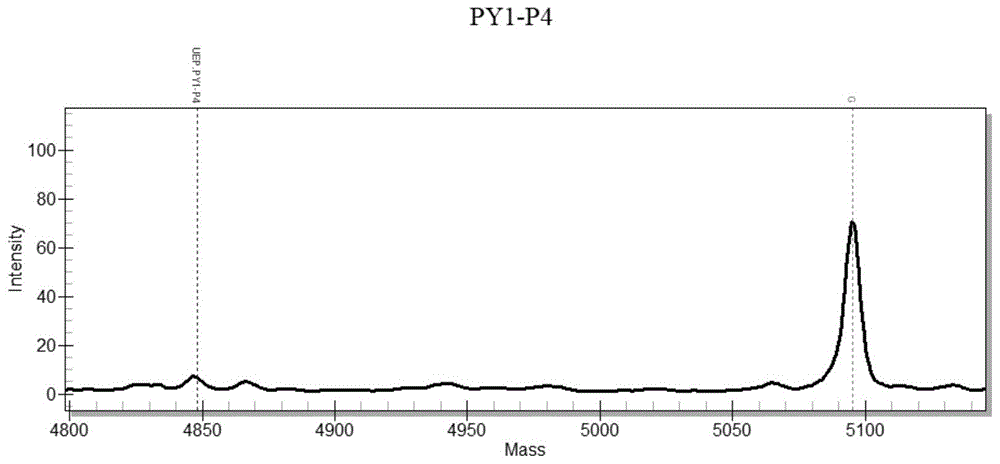
:ⅰ型脊髓灰质炎减毒活疫苗株—sabinⅰ株是将脊髓灰质炎病毒mahoney株通过不断传代和筛选纯化,选育出的免疫原性好,神经毒力低的病毒株。因为sabinⅰ株是活病毒,所以口服后会引起隐性感染,刺激人体在粘膜免疫和体液免疫的过程中产生保护性抗体。这些保护性抗体会在人体遇到野生病毒攻击时,对人体提供保护。此外,脊灰减毒疫苗株在人体内经过繁殖后会以活病毒形式通过肠道排出体外。不致病的减毒活疫苗病毒在环境中存活,可以刺激周围人群产生保护性抗体,从而形成保护屏障,阻断脊灰病毒在自然界的传播。减毒疫苗株是活病毒,在繁殖的过程中有可能产生突变,其中有很少部分会有恢复野毒毒性的倾向,其非编码区480位点和525位点核酸发生回复突变,可能导致毒力升高,并使接种疫苗的儿童发生疫苗相关麻痹性脊灰(vapp)。因此,在脊髓灰质炎减毒活疫苗生产和使用的过程中,通过监控脊灰病毒毒力突变情况,对脊灰减毒疫苗株及其衍生物的基因稳定性进行检测,是疫苗安全性评价的重要指标。疫苗毒力检测的经典方法为猴体神经毒力试验,后来又建立了转基因小鼠模型。这两种方法可以通过动物体征的改变对脊灰病毒的神经毒性进行直接观察和评估。但这两种方法分别存在需要使用特殊的动物,费用高昂、耗时很长,试验步骤繁琐、结果判断存在一定主观性等问题。随着分子生物学技术的发展,发现了ⅰ型脊髓灰质炎病毒的减毒性状相关的一些突变位点。对于这些位点的碱基突变进行检测,可以对疫苗的毒力等遗传稳定性进行评估。而现有技术中将聚合酶链反应和限制性酶切相结合,产生了maprec技术,即通过pcr引入非突变病毒上没有的限制性内切酶酶切位点,通过酶切后电泳分离的方法,鉴别突变病毒和未突变病毒。但是maprec试验需要放射性核素标记,对实验设施设备的要求较高,过程复杂。此外,用于基因突变的研究方法还有定量荧光pcr和基因测序等方法,但是都存在局限性,例如:定量荧光pcr是在pcr反应体系中加入荧光标记的特异性引物和探针,通过对探针荧光信号变化情况的实时监测,来分析样品中的基因突变情况,该方法对突变的检测通常只能是相对定量,在同一孔中同时检测多个突变位点时,需要使用不同的荧光通道;又如测序法包括waltergilbert化学法和sanger双脱氧链终止法。现在主要使用的是sanger测序法,该方法步骤繁琐,试验周期长(一般需2-3天),对操作人员技术水平要求高,更为重要的是,测序技术本身灵敏度不高,通常只能检测15%以上的突变。而sabinⅰ疫苗株非编码区480位点和525位点核酸突变往往是一种混合物,即在同一位点既有减毒核苷酸碱基,也出现少量返祖基因碱基。这时测序方法对于固定靶点出现的低频率突变分辨十分困难,存在较大的不确定性,往往需要非常大的样本量和反复检测来进行分析。基于现有技术中检测基因突变方法存在各种缺陷,本申请采用质谱检测法,建立脊灰减毒疫苗毒力相关位点突变的检测方法,具有准确、非放射性、非动物体内、直接定量的优点,一方面可以减少猴体等动物的使用,另一方面可以减少放射性物质的使用;此外由于可以对突变率进行准确定量,比测序方法更能全面了解突变情况。技术实现要素:本发明的一个目的是解决至少上述问题,并提供至少后面将说明的优点。本发明还有一个目的是提供一种ⅰ型脊灰减毒活疫苗非编码区480位点和525位点核酸质谱检测引物组。本发明还有一个目的是提供一种ⅰ型脊灰减毒活疫苗非编码区480位点和525位点核酸质谱检测方法,通过将pcr技术和质谱检测技术结合,可以特异、准确的测定ⅰ型脊灰减毒活疫苗特定位点核酸突变情况,为判断脊灰疫苗株毒力情况提供重要的数据支持。本发明还有一个目的是提供一种质谱检测引物组及质谱检测方法在检测ⅰ型脊灰减毒活疫苗非编码区480位点和525位点核酸突变中的应用。为了实现本发明的这些目的和其它优点,提供了一种ⅰ型脊灰减毒活疫苗非编码区480位点和525位点核酸质谱检测引物组,所述引物组包括四条引物或与其同源性为90%的核苷酸序列;所述四条引物具体为::特异性上游引物s5:5’-gcctacctatggctaacgcc-3’;特异性下游引物a5:5’-cacactcaatggagcgaatcc-3’;通用性上游引物s2-2:5’-aatcctccggcccctgaatg-3’;通用性下游引物a2y:5’-gtcaccataagcagccacaataaaataaaag-3’;延伸引物py1-p4:5’-gtttgtgaccacctgc-3’;延伸引物py1-p1:5’-tcgtaacgcgcaag-3’。本发明提供一种ⅰ型脊灰减毒活疫苗非编码区480位点和525位点核酸质谱检测方法,包括以下步骤:步骤1:从检测样品中获得脊髓灰质炎病毒,并提取rna;步骤2:采用所述的特异性上游引物s5、特异性下游引物a5、通用性上游引物s2-2及通用性下游引物a2y,利用模板rna逆转录成cdna,再以cdna为模板进行rt-pcr扩增,得到含有ⅰ型脊灰减毒非编码区480位点和525位点的片段;rt-pcr扩增采取一步法或两步法完成;步骤3:对步骤2所得的片段进行去磷酸化处理,得到脱磷酸片段;步骤4:利用所述的延伸引物py1-p4和延伸引物py1-p1对步骤3所得脱磷酸片段进行单碱基延伸反应;步骤5:对步骤4延伸后的样品进行脱盐纯化处理;步骤6:脱盐处理后用核酸质谱仪检测分析目标基因特定位点的基因序列。优选的是,一步法rt-pcr采用25μl扩增反应体系,其包括以下组分:2×buffer12.5μl、酶1.0μl、上游引物(s5或s2-2)3.0μl,下游引物(a5或a2y)3.0μl,模板rna1.0μl,depc水4.5μl;一步法扩增反应条件:50℃30min;95℃5min;95℃30s,56-70℃10s,72℃10-20s,25-40个循环;72℃1min;4℃恒温。优选的是,两步法rt-pcr中逆转录采用50μl反应体系,其包括以下组分:dntp1.0μl、depc水28.0μl、下游引物(a2-2或a5)1.0μl、5×buffer10.0μl、dtt2.0μl、rna抑制剂1.0μl,mlv2.0μl;逆转录反应条件:37℃50min;95℃5min;pcr扩增反应体系包括以下组分:dna聚合酶2×buffer12.5μl、上游引物(s5或s2-2)3.0μl,下游引物(a5或a2y)3.0μl,cdna5.0μl、depc水1.5μl;pcr扩增反应条件:95℃30s,56-70℃10s,72℃10-20s,25-40个循环;72℃1min;4℃恒温。优选的是,步骤3中的去磷酸化用的2μl反应体系包括如下组分:高压灭菌纯化水1.53μl、磷酸消化酶缓冲液0.17μl、磷酸消化酶0.30μl;去磷酸化反应条件:37℃40min,85℃5min;12℃恒温。优选的是,步骤4中单碱基延伸用的2μl反应体系包括如下组分:高压灭菌纯化水0.169μl、延伸缓冲液0.200μl、延伸引物混合液0.940μl、测序酶0.041μl;反应条件:95℃30s;[95℃5s,(52℃5s,80℃5s)5个循环]40个循环;72℃3min;12℃恒温。优选的是,步骤5中脱盐纯化处理包括以下步骤:s1:在树脂板上均匀填充树脂,45℃恒温风干4-5min;s2:向样本板的反应孔中加入待测样品,每孔补充15μl超纯水,用封口膜密封,于2000-2500rpm瞬时离心;s3:打开封口膜,将所述样本板倒扣在所述树脂板上固定,将固定好的样本板和树脂板整体翻转,以使树脂板中的树脂完全落入样本板的样本孔中,用封口膜密封,于2000-2500rpm瞬时离心;s4:将样本树脂混合物摇匀,在旋转器上慢速旋转30min后,于5000rpm高速离心5-10min,然后点样上机进行质谱检测。优选的是,步骤6中特定位点为ⅰ型脊灰减毒非编码区480位点和525位点。本发明还提供一种所述的质谱检测引物组在检测ⅰ型脊灰减毒活疫苗非编码区480位点和525位点核酸突变中的应用。本发明还提供一种所述的质谱检测方法在检测ⅰ型脊灰减毒活疫苗非编码区480位点和525位点核酸突变中的应用。本发明至少包括以下有益效果:本发明通过从脊灰疫苗相关样品中提取rna,利用针对ⅰ型脊灰减毒活疫苗非编码区480位点和525位点核酸突变设计的特异性引物和通用性引物,经rt-pcr扩增得到含有snp位点的基因片段,再通过磷酸消化酶对扩增产物去磷酸化,防止dna分子5’端和3’端连接,之后经延伸引物对单碱基进行延伸后,用质谱检测法检测突变位点碱基突变类型,以判断ⅰ型脊灰减毒活疫苗是否发生突变。本发明相比现有技术中的猴体神经毒力试验、转基因小鼠模型、maprec试验、定量荧光法以及测序法,具有简单易操作、准确、非放射性、非动物体内、直接定量检测等优点,一方面可以减少猴体等动物的使用,另一方面可以减少放射性物质的使用;此外,由于可以对突变率进行准确定量,比测序方法更能全面了解突变情况。本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。附图说明图1为经延伸引物py1-p4延伸的未突变产物质谱检测结果;图2为经延伸引物py1-p1延伸的未突变产物质谱检测结果;图3为经延伸引物py1-p4延伸的回复突变产物质谱检测结果;图4为经延伸引物py1-p1延伸的回复突变产物质谱检测结果。具体实施方式下面对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不排除一个或多个其它元件或其组合的存在或添加。本发明提供一种ⅰ型脊灰减毒活疫苗非编码区480位点和525位点核酸质谱检测引物组,所述引物组包括四条引物或与其同源性为90%的核苷酸序列;所述四条引物具体为:特异性上游引物s5:5’-gcctacctatggctaacgcc-3’;特异性下游引物a5:5’-cacactcaatggagcgaatcc-3’;通用性上游引物s2-2:5’-aatcctccggcccctgaatg-3’;通用性下游引物a2y:5’-gtcaccataagcagccacaataaaataaaag-3’;延伸引物py1-p4:5’-gtttgtgaccacctgc-3’;延伸引物py1-p1:5’-tcgtaacgcgcaag-3’。在上述方案中,所述引物组是基于ⅰ型脊灰减毒活疫苗非编码区480位点和525位点核酸进行设计的,由于现有技术中sabinⅰ株主要是通过口服形式使用,而sabinⅰ株是活病毒,口服后刺激人体在粘膜免疫和体液免疫的过程中产生保护性抗体,可以在人体遇到野病毒攻击时,对人体进行保护。而在脊灰减毒疫苗株在人体内经过繁殖后,会以活病毒形式通过肠道排出体外,其在繁殖的过程中有可能产生突变,其中有很少部分会有恢复野毒毒性的倾向,而非编码区480位点和525位点核酸发生回复突变,可能导致毒力升高,并使接种疫苗的儿童发生疫苗相关麻痹性脊灰(vapp),因此,特异性针对突变几率最高非编码区480位点和525位点核酸设计引物,对于判断ⅰ型脊灰减毒活疫苗的毒力具有重要意义。本发明提供一种ⅰ型脊灰减毒活疫苗非编码区480位点和525位点核酸质谱检测方法,包括以下步骤:步骤1:从检测样品中获得脊髓灰质炎病毒,并提取rna;步骤2:采用所述的特异性上游引物s5、特异性下游引物a5、通用性上游引物s2-2及通用性下游引物a2y,利用模板rna逆转录成cdna,再以cdna为模板进行rt-pcr扩增,得到含有ⅰ型脊灰减毒非编码区480位点和525位点的片段;rt-pcr扩增采取一步法或两步法完成;步骤3:对步骤2所得的片段进行去磷酸化处理,得到脱磷酸片段;步骤4:利用所述的延伸引物py1-p4和延伸引物py1-p1对步骤3所得脱磷酸片段进行单碱基延伸反应;步骤5:对步骤4延伸后的样品进行脱盐纯化处理;步骤6:脱盐处理后用核酸质谱仪检测分析目标基因特定位点的基因序列。在上述方案中,基于rt-pcr技术,首先通过pcr引物对含待检测snp的目标片段进行扩增,pcr结束后通过磷酸消化酶对扩增产物去磷酸化,防止dna分子的5’端和3’端连接,再通过延伸引物对单碱基进行延伸,根据不同snp延伸模板可得到不同的延伸产物,然后经过脱盐纯化后,利用核酸质谱检测方法进行检测,基于核酸质谱检测的原理,利用核酸质谱检测方法仅在目的区域snp位点延伸一个具有多态性的碱基,不需要检测整个特异性扩增的基因片段,可以大大缩短检测时间、成本,还能直接定量检测,相比现有检测手段可大大提高检测率。一个优选方案中,一步法rt-pcr采用25μl扩增反应体系包括以下组分:2×buffer12.5μl、酶1.0μl、上游引物(s5或s2-2)3.0μl,下游引物(a5或a2y)3.0μl,模板rna1.0μl,depc水4.5μl;一步法扩增反应条件:50℃30min;95℃5min;95℃30s,56-70℃10s,72℃10-20s,25-40个循环;72℃1min;4℃保温。一个优选方案中,两步法rt-pcr中逆转录采用50μl反应体系,其包括以下组分:dntp1.0μl、depc水28.0μl、下游引物(a2-2或a5)1.0μl、5×buffer10.0μl、dtt2.0μl、rna抑制剂1.0μl,mlv2.0μl;逆转录反应条件:37℃50min;95℃5min;pcr扩增反应体系包括以下组分:dna聚合酶2×buffer12.5μl、上游引物(s5或s2-2)3.0μl,下游引物(a5或a2y)3.0μl,cdna5.0μl、depc水1.5μl;pcr扩增反应条件:95℃30s,56-70℃10s,72℃10-20s,25-40个循环;72℃1min;4℃恒温。一个优选方案中,步骤3中的去磷酸化用的2μl反应体系包括如下组分:高压灭菌纯化水1.53μl、磷酸消化酶缓冲液0.17μl、磷酸消化酶0.30μl;去磷酸化反应条件:37℃40min,85℃5min;12℃恒温。一个优选方案中,步骤4中单碱基延伸用的2μl反应体系包括如下组分:高压灭菌纯化水0.169μl、延伸缓冲液0.200μl、延伸引物混合液0.940μl、测序酶0.041μl;反应条件:95℃30s;[95℃5s,(52℃5s,80℃5s)5个循环]40个循环;72℃3min;12℃恒温。一个优选方案中,步骤5中脱盐纯化处理包括以下步骤:s1:在树脂板上均匀填充树脂,45℃恒温4-5min;s2:向样本板的反应孔中加入待测样品,每孔补充15μl超纯水,用封口膜密封,于2000-2500rpm离心;s3:打开封口膜,将所述样本板倒扣在所述树脂板上固定,将固定好的样本板和树脂板整体翻转,以使树脂板中的树脂完全落入样本板的样本孔中,用封口膜密封,于2000-2500rpm离心;s4:将样本树脂混合物摇匀,在旋转器上慢速旋转30min后,于5000rpm高速离心5-10min,然后点样上机进行质谱检测。一个优选方案中,步骤6中特点位点为ⅰ型脊灰减毒非编码区480位点和525位点。本发明还提供一种所述的质谱检测引物组在检测ⅰ型脊灰减毒活疫苗非编码区480位点和525位点核酸突变中的应用。本发明还提供一种所述的质谱检测方法在检测ⅰ型脊灰减毒活疫苗非编码区480位点和525位点核酸突变中的应用。在上述方案中,采用质谱检测引物组,利用rt-pcr和质谱检测方法相结合,可以改变现有技术中进行ⅰ型脊灰减毒活疫苗基因突变检测费用高昂、耗时很长,试验步骤繁琐、结果判断存在一定主观性等问题,对于准确判断ⅰ型脊灰减毒活疫苗毒力提供技术支持。实施例1ⅰ型脊灰减毒活疫苗非编码区480位点和525位点核酸质谱检测方法1、rna提取利用rna提取试剂盒(invitrogentm试剂盒)从口服脊髓灰质病毒疫苗(萨宾)株或疫苗衍生物中获取脊髓灰质炎病毒(ⅰ型脊灰病毒)rna。2、引物设计针对ⅰ型脊灰病毒非编码区480位点和525位点核酸进行snp位点引物设计,所设计的引物包括特异性上游引物s5、特异性下游引物a5、通用性上游引物s2-2、通用性下游引物a2y、延伸引物py1-p4、延伸引物py1-p1,具体如下表1所示:表1引物3、逆转录和rt-pcr扩增反应利用模板rna逆转录成cdna,再以cdna为模板进行pcr扩增,得到含有ⅰ型脊灰减毒非编码区480位点和525位点的片段,可以通过一步法或两步法完成,以下分别对一步法和两步法的条件进行了具体的说明。3.1、一步法rt-pcrrt-pcr反应体系如表2所示:表2一步法rt-pcr反应体系组分用量(μl)2×buffer12.5rna1.0上游引物(s2-2或s5)3.0下游引物(a2y或a5)3.0depc水4.5酶1.0总体积25一步法rt-pcr反应条件如表3所示:表3rt-pcr扩增的反应条件3.2、两步法rt-pcr(1)逆转录反应体系如表4所示:表4逆转录反应体系表5逆转录反应条件温度时间37℃50min95℃5min(2)两步法pcr扩增反应体系如表6所示:表6pcr扩增的反应体系rt-pcr扩增的反应条件如表7所示:表7rt-pcr扩增的反应条件4、去磷酸化反应对扩增的目的片段进行去磷酸化处理,得到脱磷酸片段。去磷酸化反应体系如表8所示:表8去磷酸化反应体系组分反应体积1×(μl)高压灭菌纯化水1.53磷酸酶缓冲液0.17磷酸消化酶0.30反应体系总量2.00去磷酸化反应条件如表9所示:表9去磷酸化反应条件温度时间37℃40min85℃5min12℃恒温5、单碱基延伸反应利用延伸引物py1-p4和延伸引物py1-p1对所得脱磷酸片段进行单碱基延伸反应。(1)延伸引物配制(稀释成500p)如表10所示:表10延伸引物配制(2)延伸引物反应体系如表11所示:表11延伸引物反应体系组分反应体积1×(μl)高压灭菌纯化水0.619延伸缓冲液0.200延伸终止混合液0.200延伸引物混合物0.940反应催化酶0.041反应体系总量2.000(3)延伸引物反应条件如表12所示:表12延伸引物反应条件6、延伸后的产物进行脱盐纯化处理,具体为:s1:在树脂板上均匀填充树脂,45℃恒温风干4-5min;s2:向样本板的反应孔中加入待测样品,每孔补充15μl超纯水,用封口膜密封,于2000-2500rpm瞬时离心;s3:打开封口膜,将所述样本板倒扣在所述树脂板上固定,将固定好的样本板和树脂板整体翻转,以使树脂板中的树脂完全落入样本板的样本孔中,用封口膜密封,于2000-2500rpm瞬时离心;s4:将样本树脂混合物摇匀,在旋转器上慢速旋转30min后,于5000rpm高速离心5-10min,然后点样上机进行质谱检测,并通过核酸质谱仪上机及软件数据进行分析。按照上机操作规程进行检测,待样品检测完毕,对检测结果进行软件处理分析,最终得到检测结果。实施例2鉴定单个核苷酸多态性试验利用实施例1的质谱检测方法分别对以下样品核酸进行检测,结果如图1-图4所示。从图1可以看出,样品核酸的扩增产物经py1-p4延伸后,脊髓灰质炎疫苗(sabin株)或疫苗衍生物样品核酸质谱在480(分子量为5095.31)位置出现明显峰值g,没有其他碱基(a、c、t对应分子量)峰出现,说明是样品中该基因位点均为g碱基。从图2可以看出,脊髓灰质炎疫苗(sabin株)或疫苗衍生物样品核酸的扩增产物经py1-p1延伸后,样品核酸质谱在525(分子量为4599.88)位置出现明显峰值t,没有其他碱基(a、c、g对应分子量)峰出现,说明是样品中该基因位点均为t碱基。从图3可以看出,样品核酸的扩增产物经py1-p4延伸后,脊灰病毒野毒株样品核酸质谱在480(分子量为5175.21)位置出现明显峰值a,没有其他碱基(c、g、t对应分子量)峰出现,说明是样品中该基因位点均为野毒株a碱基。从图4可以看出,样品核酸的扩增产物经py1-p1延伸后,脊灰病毒野毒株样品核酸质谱在525(分子量为4519.98)位置出现明显峰值c,没有其他碱基(a、t、g对应分子量)峰出现,说明是样品中该基因位点均为野毒株c碱基。以上实施方式仅用于说明本发明,而非对本发明的限制。尽管参照实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,对本发明的技术方案进行各种组合、修改或者等同替换,都不脱离本发明技术方案的精神和范围,均应涵盖在本发明的权利要求范围当中。序列表<110>中国食品药品检定研究院<120>检测i型脊灰减毒活疫苗核酸突变的质谱检测引物组及其方法<160>6<170>siposequencelisting1.0<210>1<211>20<212>dna<213>人工序列(artificialsequence)<400>1gcctacctatggctaacgcc20<210>2<211>21<212>dna<213>人工序列(artificialsequence)<400>2cacactcaatggagcgaatcc21<210>3<211>20<212>dna<213>人工序列(artificialsequence)<400>3aatcctccggcccctgaatg20<210>4<211>31<212>dna<213>人工序列(artificialsequence)<400>4gtcaccataagcagccacaataaaataaaag31<210>5<211>16<212>dna<213>人工序列(artificialsequence)<400>5gtttgtgaccacctgc16<210>6<211>14<212>dna<213>人工序列(artificialsequence)<400>6tcgtaacgcgcaag14当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1