一种得到高纯度异源抗体的方法与流程
1.本发明属于抗体工程领域,具体涉及一种得到高纯度异源抗体的方法,所述异源抗体含有两条氨基酸序列不同的重链。
背景技术:
2.双特异性抗体有多种构建方式,其中igg型双特异性抗体具有和普通抗体相似的结构、理化性质和fc段功能。通常igg型双特异性抗体由两条氨基酸序列不同的重链(即抗抗原a的重链和抗抗原b的重链)和两条氨基酸序列不同的轻链(即抗抗原a的轻链和抗抗原b的轻链)组成。当4条多肽链组合时,会产生8种不同的组合方式,其中只有一种为所需要的目标抗体分子。而从8种分子中分离纯化得到目标分子效率极低且非常困难。
3.作为解决该问题的方法,文献1报道了使用共同重链和两条不同轻链组合的方法。但该方法的局限性在于,要筛选得到氨基酸序列完全相同的抗抗原a的重链和抗抗原b的重链非常困难。文献2、3报道了使用共同轻链和两条不同重链组合的方法。但该方法的局限性在于,2条不同的重链会有3种组合方式,包括一种异源抗体(双特异性抗体)和两种同源抗体(杂质),其中目标双特异性抗体的比例理论上通常只有约50%。如果提高2条重链异源缔合的效率,则可将目标双特异性抗体的表达效率提高到90-95%(文献4)。为了进一步去除两种同源抗体,文献5报道了下述方法:通过在两种重链的可变区引入氨基酸突变赋予两种同源抗体和目标双特异性抗体不同的等电点,从而通过离子交换层析纯化得到目标双特异性抗体。然而需要注意的是,在igg型抗体商业化制备过程中,离子交换层析并非必需的纯化步骤,增加离子交换层析固然可以提高目标抗体的纯度,但也降低了最终的产率,导致制备成本增加。
4.蛋白a亲和层析作为igg型抗体必需的纯化步骤,如何通过蛋白a亲和层析得到高纯度的双特异性抗体成为研究的新方向。文献6报道了一种方法:使用由小鼠igg2a的重链(可与蛋白a结合)和大鼠igg2b的重链(不与蛋白a结合)组成双特异性抗体,仅利用蛋白a纯化即可将目标双特异性抗体纯化至95%的纯度。但该方法的局限性在于,小鼠和大鼠的重链恒定区免疫原性极高(文献7),而且利用该方法制备的抗体卡妥索单抗(catumaxomab)在人体内半衰期为约2.1天,与通常的人igg半衰期2-3周相比极短(文献8)。文献9报道了另一种利用蛋白a纯化得到高纯度的双特异性抗体的方法:在构成双特异性抗体的其中一条重链恒定区上引入突变。具体来说,将eu编号第435位的his突变为arg,从而改变与蛋白a的结合力,能将目标抗体纯化至93-99.6%不等的纯度。
5.文献1:fischer,n.,et al.(2015).nat commun 6:6113.
6.文献2:wo98050431
7.文献3:wo2006109592
8.文献4:wo2006106905
9.文献5:wo2007114325
10.文献6:wo95033844
11.文献7:clin cancer res 2007 13:3899-3905
12.文献8:j clin oncol 26:2008(may 20suppl;abstr 14006)
13.文献9:wo2011078332
技术实现要素:
14.本发明的目的在于克服现有技术中的不足,提供一种仅利用蛋白a亲和层析即可得到高纯度异源抗体的方法。本发明通过在重链恒定区引入新的突变,改变与蛋白a的结合力,进而通过蛋白a亲和层析,即可获得纯度>99%的双特异性抗体。
15.本发明的第一个方面是提供一种得到高纯度异源抗体的方法,所述异源抗体含有两条氨基酸序列不同的重链,在其中一条重链恒定区的i253引入突变,进而通过蛋白a亲和层析纯化,即可获得高纯度的双特异性抗体,其中,以上所述的氨基酸的位置根据kabat编号的eu索引确定。
16.本发明中的氨基酸的位置均根据kabat编号的eu索引确定。
17.优选地,所述突变为i253n,即ile253被替换为天冬酰胺(n)。
18.其中,所述异源抗体包括但不限于为双特异性抗体、一价抗体、fc融合蛋白等。即本发明中所述异源抗体可以为双特异性抗体、一价抗体、或fc融合蛋白等。
19.本发明的第二个方面是提供一种异源抗体所述异源抗体含有两条氨基酸序列不同的重链,其中一条重链恒定区的i253发生突变。
20.优选地,所述突变为i253n,即ile253被替换为天冬酰胺(n)。
21.其中,所述异源抗体包括但不限于为双特异性抗体、一价抗体、fc融合蛋白等。即本发明中所述异源抗体可以为双特异性抗体、一价抗体、或fc融合蛋白等。
22.本发明的第三个方面是提供一种编码本申请第二个方面所述异源抗体中i253发生突变的重链的核苷酸序列。
23.本发明的第四个方面是提供含有本发明第三个方面所述的核苷酸序列的重组载体。
24.其中,上述各重组载体所使用的表达载体为本领域常规的表达载体,是指包含适当的调控序列,例如启动子序列、终止子序列、多腺苷酰化序列、增强子序列、标记基因和/或序列以及其他适当的序列的表达载体。所述表达载体可以是病毒或质粒,如适当的噬菌体或者噬菌粒,更多技术细节请参见例如sambrook等,molecular cloning:a laboratory manual,第二版,cold spring harbor laboratory press,1989。许多用于核酸操作的已知技术和方案请参见current protocols in molecular biology,第二版,ausubel等编著。本发明对此不作特别限定。
25.本发明的第五个方面是提供含有本发明第四个方面所述重组载体的重组宿主细胞。
26.本发明所述的重组宿主细胞的原始宿主细胞可以为本领域常规的各种宿主细胞,只要能满足使上述重组载体稳定地自行复制,且所携带所述的核苷酸可被有效表达即可。其中所述原始宿主细胞可以原核表达细胞或真核表达细胞,所述宿主细胞较佳地包括:cos、cho(中国仓鼠卵巢,chinese h amster ovary)、ns0、sf9、sf21、dh5α、bl21(de3)或tg1,更佳地为e.coli tg1、bl21(de3)细胞(表达单链抗体或fab抗体)或者cho-k1细胞(表
达全长igg抗体)。将前述表达载体转化至宿主细胞中,即可得本发明优选的重组宿主细胞。其中所述转化方法为本领域常规转化方法,较佳地为化学转化法,热激法或电转法。
27.作为优选的方案,所述重组宿主细胞的原始宿主细胞优选为真核细胞,进一步优选为cho细胞或293e细胞。
28.本发明的第六个方面是提供一种组合物,其含有:(1)本发明第二个方面所述的异源抗体,以及(2)药学上可接受的载体和/或稀释剂和/或赋形剂。
29.通常,蛋白a亲和层析是igg型抗体商业化制备过程中必需的纯化步骤。然而,为了制备高纯度的双特异性抗体,往往需要追加离子交换层析的纯化步骤,这增加了制备的复杂性和成本。本发明的发明人发现,仅在抗体的重链引入一个突变,将重链恒定区中的eu编号第253位的ile突变为asn,即可仅通过蛋白a亲和层获得高纯度双特异性抗体。更进一步的,该方法同样适用于仅通过蛋白a亲和层析纯化得到高纯度的其它异源抗体,所指的异源抗体指抗体含有两条氨基酸序列不同的重链,包括而不局限于双特异性抗体、一价抗体、fc融合蛋白等。
30.与现有技术相比,本发明的有益效果:
31.本发明仅在重链引入一个突变,将重链恒定区中的eu编号第253位的ile突变为asn,即可只通过一步蛋白a亲和层就能将异源抗体的纯度提高到99%以上,大大简化了纯化步骤,降低制备成本,具有广阔的商业应用前景。
附图说明
32.图1为抗体fc与蛋白a和fcrn的结合位点。上划线标记的是抗体fc上与蛋白a相互作用的氨基酸,下划线标记的是抗体fc上与fcrn相互作用的氨基酸。
33.图2为抗体fc与蛋白a复合物晶体结构图,下划线标记的是抗体fc上的i253。
34.图3为抗体fc与fcrn复合物晶体结构图,下划线标记的是抗体fc上的i253。
35.图4为异源抗体和同源抗体示意图。
36.图5为i253q、i253k和i253r突变抗体的sds-page检测结果。直接用ph2.0的洗脱液洗脱,从左至右分别为marker、#0202、#0204、#0208、#0205、#0209、#0203、#0207、#0201。
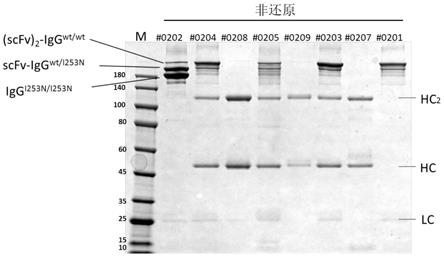
37.图6为#0202的sds-page检测结果。(scfv)
2-igg
wt/wt
分子量为198kd,scfv-igg
wt/i253n
分子量为169kd,igg
i253n/i253n
分子量为144kd,scfv-hc
wt
分子量为75kd,hc
i253n
分子量为50kd,lc分子量为25kd。control为直接用ph2.0的洗脱液洗脱的组分,5.5-2.0分别为ph5.5-ph2.0洗脱的组分。
38.图7为#0501、#0502的sds-page检测结果。泳道从左至右分别为#0501直接用ph3.5洗脱组分、#0502直接用ph3.5洗脱组分(对照)、#0502用ph5-ph3.5洗脱组分和marker。
39.图8为#0503、#0504的sds-page检测结果。泳道从左至右分别为#0503直接用ph3.5洗脱组分、#0504直接用ph3.5洗脱组分(对照)、#0504用ph5-ph3.5洗脱组分和marker。
40.图9为#0505、#0506的sds-page检测结果。泳道从左至右分别为#0505直接用ph3.5洗脱组分、#0506直接用ph3.5洗脱组分(对照)、#0506用ph5-ph3.5洗脱组分和marker。
41.图10为#0601、#0602的sds-page检测结果。泳道从左至右分别为#0601直接用ph3.5洗脱组分、#0601用ph5.0-ph4.0洗脱组分、marker、#0602直接用ph3.5洗脱组分、#0602用ph5.0-ph4.0洗脱组分。
具体实施方式
42.以下实施例、实验例是对本发明进行进一步的说明,不应理解为是对本发明的限制。实施例不包括对传统方法的详细描述,如那些用于构建载体和质粒的方法,将编码蛋白的基因插入到这样的载体和质粒的方法或将质粒引入宿主细胞的方法.这样的方法对本领域中具有普通技术的人员是众所周知的,并且在许多出版物中都有所描述,包括sambrook,j.,fritsch,e.f.and maniais,t.(1989)molecular cloning:a laboratory manual,2
nd edition,cold spring harbor laboratory press.
43.以下实施例中使用的实验材料和来源以及实验试剂的配制方法具体说明如下。
44.1、实验材料:
45.293e细胞:来自nrc biotechnology research institute。
46.2、实验试剂:
47.pbs:购自生工生物工程(上海)股份有限公司,货号b548117。
48.柠檬酸:购自国药集团化学试剂有限公司。
49.prime star hs dna polymerase:购自takara公司,货号r010a。
50.无内毒素质粒大提试剂盒:购自tiangen公司,货号dp117。
51.3、实验仪器:
52.hitrap mabselectsure柱:购自ge公司。
53.akta-fplc快速蛋白液相色谱系统:购自ge公司。
54.c1000 touch thermal cycler pcr仪:购自bio-rad公司。
55.chemidoc mp凝胶成像仪:购自bio-rad公司。
56.离心机:购自eppendorf公司。
57.g1600ax毛细管电泳仪:购自安捷伦公司。
58.实施例1.重链恒定区氨基酸修饰的设计
59.抗体fc段与蛋白a和fcrn结合的位点如图1所示。图2显示了fc与蛋白a的复合物晶体结构(pdb code:4wwi),抗体fc段上的m252、i253、s254、l309、h310、q311、l314、n315、k317、h433、n434、h435、y436(eu编号)位于fc和蛋白a相互作用界面上。图3显示了fc与fcrn的复合物晶体结构(pdb code:4n0u),m252、i253、s254、t256、l309、h310、q311、l314、n315、k317、h433、n434、h435、y436(eu编号)位于fc和fcrn相互作用界面上。本发明创造性的提出,将i253突变成带正电荷的氨基酸,如lys、arg,或者将i253突变成极性氨基酸如asn、gln,可能会使fc与蛋白a的相互作用产生极性-输水排斥,从而改变fc与蛋白a的亲和力。
60.实施例2.抗体表达载体的构建和表达
61.由实施例1可知,将抗体重链的i253突变成带正电荷的氨基酸,如lys、arg,或极性氨基酸如asn、gln,有可能减弱抗体与蛋白a的相互作用,同时尽可能减少对抗体与fcrn结合的影响。因此,本实施例构建一系列带有i253突变的pd1
×
her2双特异性抗体分子。如图4所示,该双特异性抗体的一条重链带有i253突变;另一条重链不带i253突变,并且在重链的n端串联单链抗体片段。这样使得双特异性抗体和2种同源抗体的分子量得到区分。本实施例中所描述的异源抗体或异源二聚体即指的是双特异性抗体,同源抗体或同源二聚体则为非目的抗体或杂质。
62.cd3
×
her2双特异性抗体构建如下。抗体轻链可变区使用下述可变区:travl(抗人
her2抗体trastuzumab的轻链可变区),cd3vl(抗人cd3抗体的轻链可变区)。抗体重链可变区使用下述可变区:travh(抗人her2抗体trastuzumab的重链可变区),cd3vh(抗人cd3抗体的重链可变区)。
63.将cd3抗体重链可变区vh和轻链可变区vl通过连接接头(ggggs)4连接起来,得到单链可变区cd3scfv,将cd3scfv和抗人her2抗体trastuzumab的重链n端通过连接接头(ggggs)3连接起来,得到序列zy2(seq id no:1)。
64.将trastuzumab重链引入i253n点突变(eu编号),得到抗体重链zy3,将trastuzumab重链引入i253q点突变(eu编号),得到抗体重链zy4,将trastuzumab重链引入i253k点突变(eu编号),得到抗体重链zy5,将trastuzumab重链引入i253r点突变(eu编号),得到抗体重链zy6;trastuzumab轻链为zy7(seq id no:2)。各抗体基因表记如下:
65.表1:
66.编号分子形式cd3scfvcd3vh-(ggggs)
4-cd3vlzy1cd3scfv-(ggggs)
3-travhzy2scfv-hc
wt
zy3hc
i253n
zy4hc
i253q
zy5hc
i253k
zy6hc
i253r
zy7travl-cκ
67.将各抗体基因插入动物细胞表达载体中,顺转到293细胞中表达。各抗体基因的组合如下表2所示,转染比例为重链1:重链2:轻链=1:1:1。
68.表2:
[0069][0070]
实施例3.蛋白a亲和层析洗脱条件的研究
[0071]
抗体基因顺转到293e细胞中,细胞培养7天后,将培养液通过高速离心、微孔滤膜抽真空过滤后上样至hitrap mabselectsure柱(购自ge公司),阶段性的使用表3所示的清洗1、洗脱1-5对表2中的抗体蛋白进行纯化,洗脱后用ph9.0的tris缓冲液中和ph。收集洗脱组分并浓缩,分别加入还原型蛋白电泳上样缓冲液和非还原型蛋白电泳上样缓冲液,煮沸后进行sds-page检测。
[0072]
表3
[0073]
平衡化pbs清洗1pbs洗脱1100mm柠檬酸,ph5.5洗脱2100mm柠檬酸,ph5.0洗脱3100mm柠檬酸,ph4.5洗脱4100mm柠檬酸,ph4.0洗脱5100mm柠檬酸,ph2.0
[0074]
如图5所示,用ph2.0的洗脱液洗脱,对洗脱组分进行非还原sds-page检测,发现#0202包含了三种不同分子量的抗体分子,分子量从大到小分别为同源抗体(scfv)
2-igg
wt/wt
、异源抗体scfv-igg
wt/i253n
和同源抗体igg
i253n/i253n
。#0201作为同源抗体(scfv)
2-igg
wt/wt
的对照品。然而,#0203、#0204、#0205只得到了同源抗体(scfv)
2-igg
wt/wt
,并且有重链二聚
体、未配对的重链和轻链等抗体片段出现,提示zy4、zy5、zy6中引入的i253q、i253k和i253r点突变可能影响了轻重链的组装。进一步纯化#0207、#0208、#0209发现,确实只得到了重链二聚体和未配对的重链,表明i253q、i253k和i253r的确影响了轻重链的组装。
[0075]
如图6所示,对#0202用梯度ph的洗脱液洗脱,并对各组分进行sds-page检测,发现随着洗脱条件从洗脱1变成洗脱5,即随着洗脱液的ph逐渐降低,洗脱成分由同源抗体igg
i253n/i253n
变成异源抗体scfv-igg
wt/i253n
,再变成同源抗体(scfv)
2-igg
wt/wt
。更具体的说,洗脱顺序取决于洗脱成分与蛋白a的结合强弱,即同源抗体igg
i253n/i253n
结合力最弱因此在高ph条件下(ph5.5-ph4.5)最先洗脱;同源抗体(scfv)
2-igg
wt/wt
结合力最强因此在低ph条件下(ph4.0-ph2.0)最晚洗脱;异源抗体scfv-igg
wt/i253n
结合力位于前两者之间,因此在中等ph条件下(ph4.5-ph4.0)洗脱。这表明i253n点突变的确破坏了fc段与蛋白a的结合,使得igg
i253n/i253n
与蛋白a结合位点为0个,scfv-igg
wt/i253n
与蛋白a结合位点为1个,(scfv)
2-igg
wt/wt
与蛋白a结合位点为2个。蛋白a结合位点越多则结合能力越强,需要低ph的洗脱液洗脱;蛋白a结合位点越少则结合能力越弱,高ph的洗脱液就可以洗脱。
[0076]
实施例4.提高重链异源二聚体的缔合率能进一步提高异源抗体的纯度
[0077]
本实施例中所描述的异源抗体或异源二聚体即指的是双特异性抗体,同源抗体或同源二聚体则为非目的抗体或杂质。
[0078]
通过实施例3发现,对#0202中各组分利用梯度ph洗脱液洗脱,可以仅通过蛋白a纯化步骤,就能分离得到cd3
×
her2双特异性抗体zy2/zy3/zy7,但同源抗体zy2/zy7和zy3/zy7仍占据了抗体总量的很大比重。理论上,在没有任何修饰的情况下制备由两条不同的重链和一条共同的轻链组装成的双特异性抗体时,双特异性抗体只占抗体总量的约50%。另外,实施例3中双特异性抗体zy2/zy3/zy7主要在ph4.0的洗脱液中洗脱,但洗脱组分中会夹杂少量同源抗体zy3/zy7。如果能提高重链异源二聚体的缔合率,则能大幅度提高异源抗体在抗体总量中的比例,同时提高双特异性抗体的纯度。
[0079]
构建并使用以下抗体基因:将travh和igg1恒定区连接,得到抗体重链zy8;在zy8恒定区引入y349c、t366s、l368a、y407v点突变(eu编号),得到抗体重链zy9;在zy8恒定区引入i253n、y349c、t366s、l368a、y407v点突变(eu编号),得到抗体重链zy10;在zy2恒定区引入s354c、t366w点突变(eu编号),得到抗体重链zy11;在zy8恒定区引入e357k、d399k、y349c、t366s、l368a、y407v点突变(eu编号),得到抗体重链zy12;在zy8恒定区引入i253n、e357k、d399k、y349c、t366s、l368a、y407v点突变(eu编号),得到抗体重链zy13;在zy2恒定区引入k370e、k409d、s354c、t366w点突变(eu编号),得到抗体重链zy14;在zy8恒定区引入e357s、s364r点突变(eu编号),得到抗体重链zy15;在zy8恒定区引入i253n、e357s、s364r点突变(eu编号),得到抗体重链zy16;在zy2恒定区引入k370d、k409f、f405e点突变(eu编号),得到抗体重链zy17。本实施例所需抗体基因见表4。
[0080]
表4
[0081]
编号分子形式zy7travl-cκzy8hc
wt
zy9hc
y349c,t366s,l368a,y407v
zy10hc
i253n,y349c,t366s,l368a,y407v
zy11scfv-hc
s354c,t366w
zy12hc
e357k,d399k,y349c,t366s,l368a,y407v
zy13hc
i253n,e357k,d399k,y349c,t366s,l368a,y407v
zy14scfv-hc
k370e,k409d,s354c,t366w
zy15hc
e357s,s364r
zy16hc
i253n,e357s,s364r
zy17scfv-hc
k370d,k409f,f405e
[0082]
将各抗体基因插入动物细胞表达载体中,顺转到293细胞中表达。各抗体基因的组合如下表5所示,转染比例为重链1:重链2:轻链=1:1:1。
[0083]
表5
[0084][0085][0086]
细胞培养7天后,将培养液通过高速离心、微孔滤膜抽真空过滤后上样至hitrap mabselectsure柱(购自ge公司),对测试样品#0502、#0504、#0506阶段性的使用表6所示的清洗1、洗脱1-4进行纯化,对照样品#0501、#0503、#0505使用清洗1、洗脱4进行纯化。在实施例3中,用ph2.0的柠檬酸洗脱液洗脱的蛋白存在一定的降解,因此在本实施例中最后采用ph3.5的柠檬酸洗脱液洗脱。洗脱后用ph9.0的tris缓冲液中和ph。收集洗脱组分并浓缩,分别加入非还原型蛋白电泳上样缓冲液,煮沸后进行sds-page检测。洗脱组分用非还原毛细管凝胶电泳分析,并计算各产物组分峰面积的百分比例。
[0087]
表6
[0088]
平衡化pbs清洗1pbs洗脱1100mm柠檬酸,ph5.0洗脱2100mm柠檬酸,ph4.5洗脱3100mm柠檬酸,ph4.0洗脱4100mm柠檬酸,ph3.5
[0089]
样品#0501采用了knob-into-hole技术来提高重链异源二聚体的缔合率。在重链zy2恒定区引入t366w点突变(eu编号),获得带有knob结构的重链zy11,在重链zy8恒定区引入t366s、l368a、y407v点突变(eu编号),获得带有hole结构的重链zy9。更进一步,将重链zy11上eu编号为354位的ser突变为cys,将重链zy9上eu编号为349位的tyr突变为cys,使得zy11和zy9之间的配对通过二硫键得到稳固。表7和图7显示,利用knob-into-hole技术使得异源抗体scfv-igg(zy9/zy11/zy7)占抗体总量比例提高到72.85%。knob-into-hole技术主要的副产物来自于hole-hole同源二聚体,在样品#0501中,该部分副产物占到抗体总量的27.15%。如果在带有hole结构的重链zy9上引入i253n点突变(eu编号)获得重链zy10,则可以利用梯度ph洗脱液阶段性洗脱的方法去除hole-hole同源二聚体。如图7显示,样品#0502中hole-hole同源二聚体zy11/zy7在ph5.0和ph4.5的洗脱液洗脱下被去除,图7和表7显示,ph4.0的洗脱组分中异源抗体scfv-igg(zy10/zy11/zy7)纯度提高到99.63%。
[0090]
样品#0503在knob-into-hole技术的基础上引入静电相互作用来进一步提高重链异源二聚体的缔合率。具体来说,在重链zy9恒定区引入e357k、d399k点突变(eu编号),获得带有hole结构和正电荷的重链zy12,在重链zy11恒定区引入k370e、k409d点突变(eu编号),获得带有knob结构和负电荷的重链zy14。表7和图8显示,hole-hole同源二聚体zy12/zy7比例下降到5.35%,而异源抗体scfv-igg(zy12/zy14/zy7)比例提高到94.55%。在重链zy12上引入i253n点突变(eu编号)获得重链zy13,利用梯度ph洗脱液阶段性洗脱的方法进一步去除hole-hole同源二聚体。如图8显示,样品#0504中hole-hole同源二聚体zy13/zy7在ph5.0和ph4.5的洗脱液洗脱下被去除,图8和表7显示,ph4.0的洗脱组分中异源抗体scfv-igg(zy13/zy14/zy7)纯度提高到99.02%。
[0091]
样品#0505在重链zy2恒定区引入e357s、s364r点突变(eu编号),获得带有正电荷的重链zy15,在重链zy恒定区引入k370d、k409f、f405e点突变(eu编号),获得带有负电荷的重链zy17。表7和图9显示,经ph3.5的柠檬酸洗脱液一步洗脱,异源抗体scfv-igg(zy15/zy17/zy7)的纯度即占到完整抗体总量的95.24%。#0505的主要副产物为同源二聚体zy15/zy7和半抗体zy15/zy7,为了进一步去除这两种副产物,在重链zy15恒定区引入i253n点突变(eu编号),获得重链zy16,利用梯度ph洗脱液阶段性洗脱的方法进一步去除同源二聚体zy16/zy7和半抗体zy16/zy7。如图9显示,样品#0506中同源二聚体zy16/zy7和半抗体zy16/zy7在ph5.0和ph4.5的洗脱液洗脱下被去除,图9和表7显示,ph4.0的洗脱组分中异源抗体scfv-igg(zy16/zy17/zy7)纯度提高到99.61%。
[0092]
综上所述,在制备由两条不同的重链和一条共同的轻链组装成的双特异性抗体时,提高重链异源二聚体的缔合率能显著提高异源抗体,即双特异性抗体的比例。当副产物主要为两种同源抗体中的一种时,通过在该同源抗体恒定区引入i253n点突变(eu编号),利用梯度ph洗脱液阶段性洗脱的方法可以高效方便的去除同源抗体。该方法仅通过蛋白a纯化即可提高双特异性抗体的纯度至99%以上。
[0093]
表7
[0094][0095]
实施例5.通过一步蛋白a纯化获得一价抗体
[0096]
本实施例中所描述的异源抗体或异源二聚体即指的是一价抗体,同源抗体或同源二聚体则为非目的抗体或杂质。
[0097]
普通抗体的2条重链各包含一个可变区,以二价形式与抗原结合。本实施例研究以一价形式与抗原结合的抗体制作。为了制备一价抗体,要求2条重链其中的一条是普通重链,另一条是缺失了可变区和ch1结构域的重链fc片段,因此涉及两条不同重链异源缔合以及纯化。
[0098]
所需抗体基因见表8。采用与实施例4相同的方法,向igg1重链fc区(e u编号第221位的asp到447位的lys)内引入k370d、k409f、f405e点突变(eu编号),得到抗体重链片段zy18。
[0099]
表8
[0100]
编号分子形式zy7travl-cκzy15hc
e357s,s364r
zy16hc
i253n,e357s,s364r
zy18fc
k370d,k409f,f405e
[0101]
将各抗体基因插入动物细胞表达载体中,按表9所示的组合方案顺转到293e细胞中表达。为了尽量减少副产物zy18/zy7,转染比例为重链1:重链2:轻链=1.5:1:1。
[0102]
表9
[0103][0104]
细胞培养7天后,将培养液通过高速离心、微孔滤膜抽真空过滤后上样至hitrap mabselectsure柱(购自ge公司),对样品#0602阶段性的使用表6所示的清洗1、洗脱1-4进行纯化,对样品#0601使用清洗1、洗脱4进行纯化。洗脱后用ph9.0的tris缓冲液中和ph。收集洗脱组分并浓缩,分别加入非还原型蛋白电泳上样缓冲液,煮沸后进行sds-page检测。洗脱组分用非还原毛细管凝胶电泳分析,并计算各产物组分峰面积的百分比例。
[0105]
如图10所示,样品#0601的主要副产物为同源二聚体igg(zy15/zy7)和半抗体(zy15/zy7),未观察到副产物fc(zy18/zy7)。由于同源二聚体igg(zy15/zy7)和异源抗体zy15/zy18/zy7有相同的蛋白a结合位点个数,因此利用梯度ph洗脱液阶段性洗脱的方法不能有效去除同源二聚体igg(zy15/zy7)和半抗体(zy15/zy7)。在重链zy15恒定区引入i253n点突变(eu编号),获得重链zy16,利用梯度ph洗脱液阶段性洗脱的方法去除同源二聚体(zy16/zy7)和半抗体(zy16/zy7)。如图10显示,样品#0602中同源二聚体zy16/zy7和半抗体zy16/zy7在ph5.0和ph4.5的洗脱液洗脱下被去除,图10和表10显示,ph4.0的洗脱组分中异源抗体fab-fc(zy16/zy18/zy7)纯度提高到99.53%。
[0106]
表10
[0107][0108]
本领域技术人员应该理解,一价抗体不局限于本实施介绍的fab-fc一种形式,其它形式的一价抗体例如scfv-fc融合蛋白也适用于利用本发明方法进行制备。更广泛的说,凡是其中一条重链为仅包含ch2和ch3结构域的抗体或fc融合蛋白,均可利用本发明方法进行制备。
[0109]
以上对本发明的具体实施例进行了详细描述,但其只是作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1