基于超声原理且可调节频率的动植物组织消融仪的制作方法
本实用新型属于rna、dna或蛋白质提取技术领域,具体涉及基于超声原理且可调节频率的动植物组织消融仪。
背景技术:
核糖核酸(英语:ribonucleicacid,缩写:rna)存在于生物细胞以及部分病毒、类病毒中的遗传信息载体。由至少几十个核糖核苷酸通过磷酸二酯键连接而成的一类核酸,因含核糖而得名,简称rna。每个rna分子都由核苷酸单元长链组成,每个核苷酸单元含有一个含氮碱基、一个核糖和一个磷酸基。rna是具有细胞结构的生物的遗传信息中间载体,并参与蛋白质合成;还参与基因表达调控。对一部分病毒而言,rna是其唯一的遗传物质。rna存在于大多数已知的植物病毒和部分动物病毒以及一些噬菌体中。而在生物实验中所需的rna和蛋白往往需要通过提取获得。
常规的组织rna和蛋白提取的方法如下:预处理:将组织样品在离体后应迅速冷冻在液氮中,若是比较大块的组织,要尽量把组织剪切成黄豆大小的块,使液氮迅速渗透到组织内部而防止组织内部的rna和蛋白降解。
组织rna提取操作:1、在抽提rna前,先把研钵预冷,往研钵内反复加入液氮,至少4-5次,使研钵充分预冷。从液氮罐中取出样本组织后,把组织块放入已预冷的研钵中进行研磨,边研磨边加液氮,整个过程都不要使液氮挥干。2、研磨到组织样品成粉末状后(一般需要8-10min的研磨过程),在液氮基本挥发完时,在每个研钵中加2-3mltrizol试剂。由于此时研钵很冷,trizol加入后会冻结成固体状。可以继续研磨此固体成粉末,随着研钵温度回升到室温,固体状的trizol逐步回复到液体状态,此时,若发现液体很粘,研杵能牵起丝状物,说明trizol的量太少,需在此步继续补加trizol。若trizol的量过少,会导致抽提的rna中有较多的基因组dna污染。3、把trizol试剂转移到1.5ml离心管中,后续可以按照trizol试剂的标准操作抽提总rna。
组织蛋白提取操作:1、按照20mg组织与200μlripa裂解液的比例分别称取,在称重后将组织与ripa裂解液混合。2、将组织和裂解液倒入提前预冷的玻璃匀浆器中,反复匀浆3-5min,直至充分匀浆。3、把ripa试剂转移到1.5ml离心管中,后续可以按照ripa试剂的标准操作抽提总蛋白。
组织dna的提取操作:1、取离体组织0.5g,加入0.5ml生理盐水,使用剪刀剪碎或使用组织匀浆器、研钵等器材制备成组织匀浆;2、取适量的组织液,采用传统的苯酚抽提法对dna进行抽提。
上述常规技术存在如下缺陷:1、一个组织从组织块到组织匀浆需要10min,耗时较长;2、操作过程中需要提供液氮,研钵和组织匀浆器,耗材需求量大且操作繁琐;3、若是一次需要匀浆大量的组织,需要提前灭菌准备大量的研钵和组织匀浆器,工作量大;4、研磨组织块大小要求不能太小,这样相应的trizol试剂和ripa试剂添加量也会加大,造成试剂的浪费。
为了提高提取效率,简化操作,美国thermo公司出品的一款组织破碎机的原理:利用磁珠在电磁场中的不规则高速运动将组织研磨成组织匀浆,但机器昂贵,且仅可将组织匀浆成较小组织团块;美国的pr0*pr0200手持、台式两用均质器和bioprep-24生物样品均质器高通量生物样品均质仪器,同样存在机器昂贵,且仅可将组织匀浆成较小组织团块。
技术实现要素:
为了解决现有技术存在的上述问题,本实用新型目的在于提供基于超声原理且可调节频率的动植物组织消融仪。
本实用新型所采用的技术方案为:
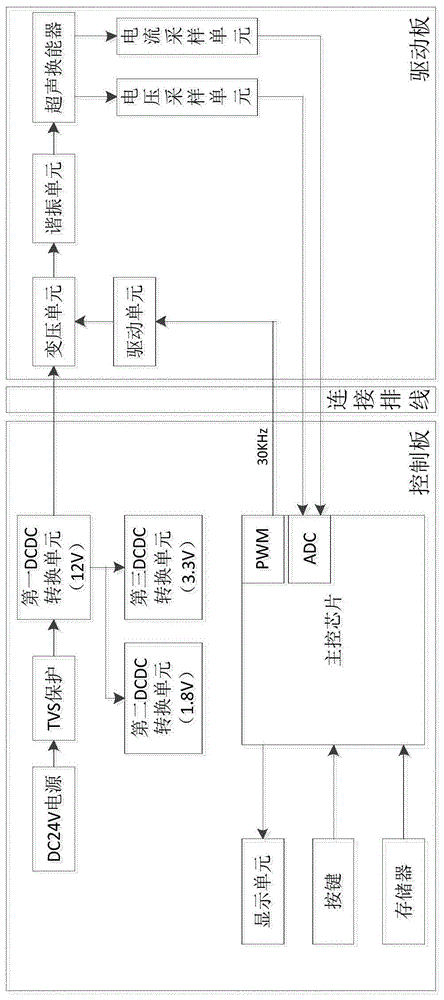
基于超声原理且可调节频率的动植物组织消融仪,包括:电源、dcdc转换单元、主控单元、驱动单元、变压单元、谐振单元和超声振子;
所述电源,通过dcdc转换单元转换电压后给动植物组织消融仪使用;主控单元,输出两路占空比互补的pwm信号至驱动单元并经过变压单元变压,然后通过设于变压单元的输出端回路中的谐振单元调节谐振点到超声振子的共振点,使得设于变压单元的输出端回路中的超声振子工作在谐振状态。
作为优选,所述动植物组织消融仪还包括采集变压单元的输出端回路电压和电流的采样单元,主控单元通过采样单元的反馈,输出两路占空比互补且变化的pwm信号至驱动单元并经过变压单元变压。
作为优选,所述动植物组织消融仪的超声频率为20~200khz。
作为优选,所述驱动单元包括第一驱动单元和第二驱动单元,第一驱动单元的pwm信号接收端n接收主控单元发送的第一路pwm信号,第一驱动单元的输出端连接变压单元的原边线圈的同名端,第二驱动单元的pwm信号接收端p接收主控单元发送的另第一路pwm信号,第二驱动单元的输出端连接变压单元的原边线圈的异名端,通过pwm信号接收端n接收的第一路pwm信号控制第一驱动mos管q6导通/截止,通过pwm信号接收端p接收的另第一路pwm信号控制第二驱动mos管q2截止/导通。
作为优选,所述变压单元为推挽变压器,dcdc转换单元的输出端连接推挽变压器的原边第一线圈的异名端和第二线圈的同名端;
所述第一驱动单元包括串联于地与pwm信号接收端n之间的电阻r10和r14,栅极连接电阻r10和r14之间的节点、源极接地且漏极为第一驱动单元的输出端并连接推挽变压器的原边第一线圈的同名端的第一驱动mos管q6;
所述第二驱动单元包括串联于地与pwm信号接收端p之间的电阻r5和r13,栅极连接电阻r5和r13之间的节点、源极接地且漏极为第二驱动单元的输出端并连接推挽变压器的原边第二线圈的异名端的第二驱动mos管q2。
当pwm信号接收端n接收的第一路pwm信号为h且pwm信号接收端p接收的第二路pwm信号为l时,控制第一驱动mos管q6导通,第二驱动mos管q2截止,原边第一线圈的输入端回路接通并且输入电流方向为原边第一线圈的异名端至同名端,原边第二线圈的输入端回路截止,副边线圈的输出端回路的输出电流方向为副边线圈的同名端至异名端。
当pwm信号接收端n接收的第一路pwm信号为l且pwm信号接收端p接收的第二路pwm信号为h时,控制第一驱动mos管q6截止,第二驱动mos管q2导通,原边第二线圈的输入端回路接通并且输入电流方向为原边第二线圈的同名端至异名端,原边第一线圈的输入端回路截止,副边线圈的输出端回路的输出电流方向为副边线圈的异名端至同名端,将输入的直流电压转换成频率30khz、电压上百伏特的交流波形,为后级谐振单元提供条件。
作为优选,所述谐振单元为lc串联谐振,lc串联谐振包括串联于变压单元的输出端回路中的电感t1和电容c1。
作为优选,所述超声振子通过接口j2设于变压单元的输出端回路中。
作为优选,所述采样单元包括采集变压单元的输出端回路电压的电压采样单元和采集变压单元的输出端回路电流的电流采样单元,相应地,变压单元的输出端回路设有多个串联的采样电阻;通过连接在多个采样电阻之间节点的电压采样端采集电压信号然后发送至电压采样单元进行滤波和放大,然后发送至主控单元做谐振调节;通过串联在变压单元的输出端回路的电流采样端采集电流信号发送至电流采样单元进行滤波和放大,然后发送至主控单元做谐振调节。
作为优选,所述主控单元包括主控芯片u2和主控芯片外围电路,主控芯片u2通过采集变压单元的输出端回路电压和电流的采样单元的反馈,输出两路占空比互补的pwm信号至驱动单元。
作为优选,所述主控单元还包括辅助芯片u1和辅助芯片外围电路,主控单元的主控芯片u2通过采集变压单元的输出端回路电压和电流的采样单元的反馈,向辅助芯片u1发送指令,辅助芯片u1接收主控芯片u2的指令,输出两路占空比互补的pwm信号至驱动单元,同时,两路占空比互补的pwm信号还反馈至主控芯片u2。
作为优选,所述两路占空比互补的pwm信号还分别通过第一信号放大输出电路和第二信号放大输出电路进行放大后发送至驱动单元。
作为优选,所述动植物组织消融仪还包括与主控芯片u2连接的显示单元,显示单元包括显示芯片j8和与显示芯片j8连接的lcd显示屏。
作为优选,所述动植物组织消融仪还包括与主控芯片u2连接的按键。
作为优选,所述动植物组织消融仪还包括与主控芯片u2连接的存储器。
作为优选,所述动植物组织消融仪还包括与主控芯片u2连接的usb接口单元,usb接口单元包括与主控芯片u2连接的usb芯片esd1和与usb芯片esd1连接的接口j7。
作为优选,所述动植物组织消融仪还包括与主控芯片u2连接的触摸单元。
本实用新型的有益效果为:
1、本实用新型解决了现有生物组织中快速提取rna、dna或蛋白质的设备价格昂贵的且提取操作过程繁琐、操作条件高、浪费、耗时、工作量大的问题,采用本实用新型的消融仪,利用采集变压单元的输出端回路电压和电流的采样单元的反馈,输出两路占空比互补的pwm信号至驱动单元,使谐振超声频率为20~200khz可调,调节谐振点到超声振子的共振点,使得超声振子工作在谐振状态,输出能量最大、振幅最强,利用低赫兹超声的方法,达到快速、简便地将组织块消融成细胞悬液的目的,方便后续进行组织rna、dna或蛋白质的提取,同时价格低廉。
附图说明
图1是本实用新型-实施例的系统框图。
图2是本实用新型-实施例控制板的电源和dcdc转换单元的电路原理图。
图3是本实用新型-实施例控制板的主控单元的电路原理图。
图4是本实用新型-实施例控制板的采样单元、显示单元和辅助芯片的电路原理图。
图5是本实用新型-实施例控制板的接口的电路原理图。
图6是本实用新型-实施例驱动板的驱动单元、变压单元和谐振单元的电路原理图。
图7为本实用新型的细胞悬液图。
图8为通过现有组织匀浆器处理得到的组织匀浆图。
具体实施方式
下面结合附图及具体实施例对本实用新型作进一步阐述。
实施例1:
如图1-6所示,本实施例的基于超声原理且可调节频率的动植物组织消融仪,包括电源、dcdc转换单元、主控单元、驱动单元、变压单元、谐振单元、超声振子和采样单元。
电源,通过dcdc转换单元转换电压后给动植物组织消融仪使用;主控单元,通过采集变压单元的输出端回路电压和电流的采样单元的反馈,输出两路占空比互补的pwm信号至驱动单元并经过变压单元变压,然后通过设于变压单元的输出端回路中的谐振单元调节谐振点到超声振子的共振点,使得设于变压单元的输出端回路中的超声振子工作在谐振状态。
对动植物组织消融仪做进一步的阐述。
电源为dc24v电源,dcdc转换单元包括第一dcdc转换单元、第二dcdc转换单元和第三dcdc转换单元。
其中,第一dcdc转换单元包括tvs保护、第一电压输入滤波、第一电压转换芯片和第一电压输出滤波,dc24v电源依次通过tvs保护、第一电压输入滤波、第一电压转换芯片和第一电压输出滤波转换为12v输出电压,供给主控单元和驱动单元使用。
详细阐述第一dcdc转换单元的电路原理:dc24v电源依次经过保护二极管tvs1进行tvs保护,经过三个并联在dc24v电源端的电容c59、c60和c57进行电压输入滤波,然后经过串联在dc24v电源端的分压电阻r48和r51进行电压采样输入第一电压转换芯片u6的使能管脚en,第一电压转换芯片u6的型号为tps54340,第一电压转换芯片u6的上管驱动信号参考点管脚sw通过储能电感l2连接到12v输出电压端,串联在12v输出电压端的分压电阻r88和r89进行电压采样输入到第一电压转换芯片u6的参考电压管脚fb,经过连接在12v输出电压端的电容c72对电压输出滤波,第一电压转换芯片u6的上管驱动信号参考点管脚sw还连接有续流二极管d4,使能管脚en还连接有软启动电容c79,电阻器时序/外部时钟管脚rt/clk还连接有频率分压电阻r50,频率补偿管脚comp还连接有用于调节环路、稳定电压输出的电容c61、c62和电阻r52,其中,电容c62与串联的电容c61和电阻r52并联。
第二dcdc转换单元包括第二电压输入滤波、第二电压转换芯片和第二电压输出滤波,12v输入电压依次通过第二电压输入滤波、第二电压转换芯片和第二电压输出滤波转换为1.8v输出电压,供给主控单元使用。
详细阐述第二dcdc转换单元的电路原理:12v输入电压依次经过两个并联在12v输入电压端的电容c84和c85进行电压输入滤波,第二电压转换芯片u9的型号为tlv62130argtr,第二电压转换芯片u9的mos管驱动信号参考点管脚sw通过储能电感l3连接到1.8v输出电压端,串联在1.8v输出电压端的分压电阻r90和r91进行电压采样输入到第二电压转换芯片u9的参考电压管脚fb,经过并联在1.8v输出电压端的电容c80和c83对电压输出滤波,第二电压转换芯片u9的内部功率电源管脚pvin、内部控制电路供电管脚avin、使能管脚en还连接12v输入电压端,软启动/跟踪管脚ss/tr还连接有软启动电容c86,调节输出管脚def和频率配置管脚fsw均接地,输出电压采集管脚vos与1.8v输出电压端连接。
第三dcdc转换单元包括第三电压输入滤波、第三电压转换芯片和第三电压输出滤波,12v输入电压依次通过第三电压输入滤波、第三电压转换芯片和第三电压输出滤波转换为3.3v输出电压,供给主控单元和采样单元使用。
详细阐述第三dcdc转换单元的电路原理:12v输入电压依次经过两个并联在12v输入电压端的电容c89和c90进行电压输入滤波,第三电压转换芯片u10的型号为tlv62130argtr,第三电压转换芯片u10的mos管驱动信号参考点管脚sw通过储能电感l4连接到3.3v输出电压端,串联在3.3v输出电压端的分压电阻r92和r94进行电压采样输入到第三电压转换芯片u10的参考电压管脚fb,经过并联在3.3v输出电压端的电容c87和c88对电压输出滤波,第三电压转换芯片u10的内部功率电源管脚pvin和内部控制电路供电管脚avin还连接12v输入电压端,经过串联在12v输入电压端的分压电阻r93和r102进行电压采样输入第三电压转换芯片u10的使能管脚en,第三电压转换芯片u10的使能管脚en还连接到第二电压转换芯片u9的输出正常指示信号管脚pg,当第二dcdc转换单元不正常工作时,第三dcdc转换单元则停止工作,软启动/跟踪管脚ss/tr还连接有软启动电容c91,调节输出管脚def和频率配置管脚fsw均接地,输出电压采集管脚vos与3.3v输出电压端连接。
驱动单元包括第一驱动单元和第二驱动单元,其中,第一驱动单元包括第一驱动mos管q6,第二驱动单元包括第二驱动mos管q2。第一驱动单元的pwm信号接收端n接收主控单元发送的第一路pwm信号,第一驱动单元的输出端连接变压单元的原边线圈的同名端,第二驱动单元的pwm信号接收端p接收主控单元发送的另第一路pwm信号,第二驱动单元的输出端连接变压单元的原边线圈的异名端,通过pwm信号接收端n接收的第一路pwm信号控制第一驱动mos管q6导通/截止,通过pwm信号接收端p接收的另第一路pwm信号控制第二驱动mos管q2截止/导通。
详细阐述驱动单元和变压单元的电路原理:变压单元为推挽变压器,dcdc转换单元的输出端连接推挽变压器的原边第一线圈的异名端和第二线圈的同名端,电阻r10和r14串联于地与pwm信号接收端n之间,第一驱动mos管q6的栅极连接电阻r10和r14之间的节点,源极接地,漏极为第一驱动单元的输出端并连接推挽变压器的原边第一线圈的同名端;电阻r5和r13串联于地与pwm信号接收端p之间,第二驱动mos管q2的栅极连接电阻r5和r13之间的节点,源极接地,漏极为第二驱动单元的输出端并连接推挽变压器的原边第二线圈的异名端。
当pwm信号接收端n接收的第一路pwm信号为h且pwm信号接收端p接收的另第一路pwm信号为l时,控制第一驱动mos管q6导通,第二驱动mos管q2截止,原边第一线圈的输入端回路接通并且输入电流方向为原边第一线圈的异名端至同名端,原边第二线圈的输入端回路截止,副边线圈的输出端回路的输出电流方向为副边线圈的同名端至异名端。
当pwm信号接收端n接收的第一路pwm信号为l且pwm信号接收端p接收的另第一路pwm信号为h时,控制第一驱动mos管q6截止,第二驱动mos管q2导通,原边第二线圈的输入端回路接通并且输入电流方向为原边第二线圈的同名端至异名端,原边第一线圈的输入端回路截止,副边线圈的输出端回路的输出电流方向为副边线圈的异名端至同名端,将输入的直流电压转换成频率30khz、电压上百伏特的交流波形,为后级谐振单元提供条件。
谐振单元设于推挽变压器的输出端回路中,谐振单元为lc串联谐振,包括串联于推挽变压器的输出端回路中的电感t1和电容c1。电感t1采用efd20。
超声振子设于推挽变压器的输出端回路中,本实施例中,通过接口j2连接超声振子。
采样单元采集推挽变压器的输出端回路电压和电流,采样单元包括电压采样单元和电流采样单元。
电压采样单元采集推挽变压器的输出端回路电压,推挽变压器的输出端回路设有串联的采样电阻r1、r2、r3、r4和r15,电压采样端连接在电阻r4和r15之间节点,并将采集的电压信号发送至电压采样单元进行滤波、放大,然后发送至主控单元做谐振调节。
详细阐述电压采样单元的电路原理:采集的电压信号依次通过rc滤波进行滤波、电容c67进行隔直后输入到第一运放u7b的同相输入端,第一运放u7b的反相输入端与输出端之间连接负反馈电阻r63,第一运放u7b的输出端通过rc滤波进行滤波后,然后通过电阻r72输入到第一比较器u8a的同相输入端,串联于3.3v电压与地之间的分压电阻r77和r76进行电压采样输入到第一比较器u8a的反相输入端,第一比较器u8a的输出端通过电阻r71连接主控单元,电阻r72连接第一比较器u8a的同相输入端的另一端还通过电阻r70连接主控单元,其中,电阻r61和电容c65组成rc滤波对采集的电压信号进行滤波,电阻r62和电容c66组成rc滤波对第一运放u7b的输出端输出的信号进行滤波,第一运放u7b的反相输入端还串联有电阻r64和电容c70,第一运放u7b的同相输入端还连接有直流3.3v电压,该直流3.3v电压通过分压电阻r56、r58和r57分压后产生分压输入到第一运放u7b的同相输入端,分压还通过电容c64滤波,其中,电阻r58的一端连接第一运放u7b的同相输入端且另一端连接电阻r56,电阻r56连接3.3v电压,电阻r57的一端连接电阻r56和r58之间的节点且另一端接地,第一比较器u8a的正极电压端连接3.3v电压,该3.3v电压通过并联的电容c76和c77滤波。
电流采样单元采集推挽变压器的输出端回路电流,电流采样端串联在推挽变压器的输出端回路,并将采集的电流信号发送至电流采样单元进行滤波、放大,然后发送至主控单元做谐振调节。
详细阐述电流采样单元的电路原理:采集的电流信号依次通过rc滤波进行滤波、电容c75进行隔直后输入到第二运放u7a的同相输入端,第二运放u7a的反相输入端与输出端之间连接负反馈电阻r73,第二运放u7a的输出端通过rc滤波进行滤波后,然后通过电阻r81输入到第二比较器u8b的同相输入端,串联于3.3v电压与地之间的分压电阻r82和r83进行电压采样输入到第二比较器u8b的反相输入端,第二比较器u8b的输出端通过电阻r80连接主控单元,电阻r81连接第二比较器u8b的同相输入端的另一端还通过电阻r79连接主控单元,其中,电阻r65和电容c68组成rc滤波对采集的电流信号进行滤波,电阻r69和电容c69组成rc滤波对第二运放u7a的输出端输出的信号进行滤波,第二运放u7a的反相输入端还串联有电阻r74和电容c78,第二运放u7a的同相输入端还连接有直流3.3v电压,该直流3.3v电压通过分压电阻r78、r66、r67和r68分压后产生分压输入到第二运放u7a的同相输入端,分压通过电容c71滤波,其中,电阻r68的一端连接第二运放u7a的同相输入端且另一端连接串联于3.3v电压端的电阻r78和r66,电阻r67的一端连接电阻r66和r68之间的节点且另一端接地,第二比较器u8b的正极电压端通过电阻r78连接3.3v电压,该3.3v电压通过并联的电容c73和c74滤波。
主控单元,通过采集变压单元的输出端回路电压和电流的采样单元的反馈,输出两路占空比互补的pwm信号至驱动单元的第一驱动mos管q6和第二驱动mos管q2。
主控单元包括主控芯片u2和主控芯片外围电路,其中,主控芯片u2的型号为n32905u1dn,采用arm9内核,主频200mhz,主控芯片外围电路包括系统时钟、复位等。
n32905u1dnn3290x基于arm926ej-scpu内核,集成了jpeg编解码器,cmos传感器接口,32通道spu(声音处理单元),adc,dac,可满足各种应用需求,同时节省bom成本。arm926@200mhz,同步dram,2dbitblt加速器,cmos图像传感器接口,lcd面板接口。n32905u1dnn3290x最大分辨率为xvga(1,024x768)@tftlcd面板。2dbitblt加速器加速图形计算,使渲染平滑,卸载cpu,以节省功耗。
为了满足整体系统bom成本的不同要求,不同尺寸的dram与n3290x主soc堆叠成一个封装,即多芯片封装(mcp)。n32905u1dnn3290x特别采用1mbitx163.3vsdram设计。n32905u1dnn3290x特别采用4mbitx161.8vddrsdram设计。一个16mbitx161.8vddr2sdram堆叠在n32905u1dnn3290x内部,以确保更高的性能并最大限度地减少系统设计工作,如emi和噪声耦合。通过采用双层pcb以及消除阻尼电阻,emi防护组件等,可以降低总bom成本。
以上技术方案已经充分公开并可实施,本实用新型解决了现有生物组织中快速提取rna、dna或蛋白质的设备价格昂贵的且提取操作过程繁琐、操作条件高、浪费、耗时、工作量大的问题,采用本实用新型的消融仪,利用采集变压单元的输出端回路电压和电流的采样单元的反馈,输出两路占空比互补的pwm信号至驱动单元,使谐振超声频率为20~200khz可调,调节谐振点到超声振子的共振点,使得超声振子工作在谐振状态,输出能量最大、振幅最强,利用低赫兹超声的方法,达到快速、简便地将组织块消融成细胞悬液的目的,方便后续进行组织rna、dna或蛋白质的提取。
实施例2:
在实施例1的基础上,本实施例进一步公开了基于超声原理且可调节频率的动植物组织消融仪,在具体应用时,本实用新型的主控单元还包括辅助芯片u1和辅助芯片外围电路,辅助芯片u1的型号为stm32f031g4u6。
stm32f031g4u6的特征是:内核:
主控单元的主控芯片u2通过采集变压单元的输出端回路电压和电流的采样单元的反馈,向辅助芯片u1发送指令,辅助芯片u1接收主控芯片u2的指令,输出两路频率为30khz,占空比互补的pwm信号至驱动单元的第一驱动mos管q6和第二驱动mos管q2,同时,两路频率为30khz,占空比互补的pwm信号还反馈至主控芯片u2。同时,第一比较器u8a的输出端和第二比较器u8b的输出端输出的信号发送至辅助芯片u1。
两路频率为30khz,占空比互补的pwm信号还分别通过第一信号放大输出电路和第二信号放大输出电路进行放大后发送至驱动单元的第一驱动mos管q6和第二驱动mos管q2。
详细阐述第一信号放大输出电路的电路原理:pwm信号通过串联的分压电阻r49和r53输入第一放大三极管q5的基极进行放大,第一放大三极管q5的集电极通过电阻r34连接12v电压,第一放大三极管q5的发射极接地,第一放大三极管q5的集电极与第一输出三极管q2和第二输出三极管q4的基极连接,第一输出三极管q2为p型三极管,第二输出三极管q4为n型三极管,第一输出三极管q2的集电极连接12v电压,放大后的第一路pwm信号从第一输出三极管q2的发射极与第二输出三极管q4的发射极连接节点处输出至第一驱动mos管q6的pwm信号接收端n。
当pwm信号输入为h时,第一输出三极管q2导通,第二输出三极管q4截止;当pwm信号输入为l时,第一输出三极管q2截止,第二输出三极管q4导通,由此输出放大后的方波第一路pwm信号。
详细阐述第二信号放大输出电路的电路原理:pwm信号通过串联的分压电阻r86和r87输入第二放大三极管q8的基极进行放大,第二放大三极管q8的集电极通过电阻r84连接12v电压,第二放大三极管q8的发射极接地,第二放大三极管q8的集电极与第三输出三极管q6和第四输出三极管q7的基极连接,第三输出三极管q6为p型三极管,第四输出三极管q7为n型三极管,第三输出三极管q6的集电极连接12v电压,放大后的另第一路pwm信号从第三输出三极管q6的发射极与第四输出三极管q7的发射极连接节点处输出至第二驱动mos管q2的pwm信号接收端p。
当pwm信号输入为h时,第三输出三极管q6导通,第四输出三极管q7截止;当pwm信号输入为l时,第三输出三极管q6截止,第四输出三极管q7导通,由此输出放大后的方波另第一路pwm信号。
主控芯片u2还连接有显示单元,显示单元包括显示芯片j8和与显示芯片j8连接的lcd显示屏,该显示芯片j8的型号为fpc050,显示芯片j8连接3.3v电压,主控芯片u2的信号lcd_bl通过mos管q1放大后发送至显示芯片j8。
主控芯片u2还连接有按键,本实施例包括四个按键,分别为第一按键、第二按键、第三按键和第四按键,第一按键为左按键,第二按键为右按键,第三按键为中按键,第四按键为ok按键。其中,第一按键包括上拉电阻r4和下拉电阻r11,上拉电阻r4连接3.3v电压,上拉电阻r4和下拉电阻r11之间的节点连接按键s2的一端,按键s2的另一端接地,下拉电阻r11的另一端连接主控芯片u2,当按下按键s2,下拉电阻r11只有1k,第一按键输出低电平,当松开按键s2,输出被上拉电阻r4和下拉电阻r11上拉,第一按键输出高电平;第二按键包括上拉电阻r6和下拉电阻r19,上拉电阻r6连接3.3v电压,上拉电阻r6和下拉电阻r19之间的节点连接按键s3的一端,按键s3的另一端接地,下拉电阻r19的另一端连接主控芯片u2,当按下按键s3,第二按键输出低电平,当松开按键s3,输出被上拉电阻r6和下拉电阻r19上拉,第二按键输出高电平;第三按键包括上拉电阻r8和下拉电阻r20,上拉电阻r8连接3.3v电压,上拉电阻r8和下拉电阻r20之间的节点连接按键s4的一端,按键s4的另一端接地,下拉电阻r20的另一端连接主控芯片u2,当按下按键s4,第三按键输出低电平,当松开按键s4,输出被上拉电阻r8和下拉电阻r20上拉,第三按键输出高电平;第四按键包括上拉电阻r10和下拉电阻r26,上拉电阻r10连接3.3v电压,上拉电阻r10和下拉电阻r26之间的节点连接按键s5的一端,按键s5的另一端接地,下拉电阻r26的另一端连接主控芯片u2,当按下按键s5,第四按键输出低电平,当松开按键s5,输出被上拉电阻r10和下拉电阻r26上拉,第四按键输出高电平。
主控芯片u2还连接有存储器,存储器采用spi-flash器件,用于存储参数,包括谐振参数、设置参数等。
主控芯片u2还连接有usb接口单元,usb接口单元包括与主控芯片u2连接的usb芯片esd1和与usb芯片esd1连接的接口j7,usb芯片esd1的型号为usblc6,接口j7的型号为sip254。
主控芯片u2还连接有触摸单元,触摸单元包括串联在3.3v电压与地之间的分压电阻r99和r101,连接电阻r99和r101之间节点的电阻r100以及基极连接电阻r99和r101之间节点的三极管q10,三极管q10的集电极与3.3v电压之间串联有分压电阻r98和r96,分压电阻r98和r96之间的节点连接mos管q9的栅极,mos管q9的源极连接3.3v电压,mos管q9的漏极连接触摸接口j1,触摸接口j1与主控芯片u2连接,触摸接口j1连接有触摸板,主控芯片u2发送的电源使能信号tp_pwen通过电阻r100至三极管q10的基极,当电源使能信号tp_pwen为h时,三极管q10导通,mos管q9导通。
主控芯片u2还连接有外部接口j4。
主控芯片u2还连接有蜂鸣器。
实施例3:
利用实施例1或实施例2的基于超声原理且可调节频率的动植物组织消融仪快速提取rna、dna或蛋白质的方法,包括步骤:a、制备细胞悬液;b、提取rna、dna或蛋白质;步骤a包括将组织样品与溶液混合后,基于超声原理且可调节频率的动植物组织消融仪进行超声消融,得到细胞悬液的步骤。
本实用新型利用低赫兹超声的方法,达到快速、简便地将组织块消融成细胞悬液的目的,进而方便后续进行组织rna、dna或蛋白质的提取。本实用新型仅需要使用很少的组织就能达到从组织中提取rna、dna或蛋白质,尤其是rna和蛋白质的目的,同时操作简单,节省提取时间,大大缩短了从组织块到细胞悬液的时间;全部操作仅需一人就能完成,大大缩减了人力物力,提升了工作效率。
为了使组织达到最佳的匀浆效果,选择超声消融的条件:超声频率为20~200khz。
步骤a的溶液为rna提取液、蛋白质提取液、dna提取液、生理盐水或缓冲液。
在超声消融过程中,为了便于后续流程的处理,可以针对不同的后续流程选择不同的溶液,从而缩减操作步骤,节省提取时间;当后续需要进行rna、dna或蛋白质的提取时,相应的选择rna提取液、dna提取液、蛋白质提取液可在保证提取效果的前提下,极大的缩减提取时间。从一般的角度来讲,本实用新型在通过超声消融得到细胞悬液时,可以采用生理盐水或缓冲液。
一种实施方式,当步骤a的溶液为rna提取液、蛋白质提取液或dna提取液时,步骤b包括按照rna提取液、蛋白质提取液或dna提取液的常规操作方式分别提取rna、蛋白质或dna的步骤。
当使用rna提取液、蛋白质提取液或dna提取液作为溶液通过超声消融得到细胞悬液时,在后续的具体的rna、dna或蛋白质提取步骤中,可以采用与使用的rna提取液、dna提取液或蛋白质提取液相对应的试剂的操作说明书进行后续的提取操作,也可以采用现有的其它常规的适合提取的提取方式操作。
另一种实施方式,当步骤a的溶液为生理盐水或缓冲液时,步骤b包括将细胞悬液与提取量的rna提取液、蛋白质提取液或dna提取液混合后分别按照常规操作方式提取rna、蛋白质或dna的步骤。
当使用生理盐水或缓冲液作为溶液时,在后续的具体的rna、dna或蛋白质提取步骤中,可以在细胞悬液中加入提取量的rna提取液、dna提取液或蛋白质提取液进行后续的提取操作,同样地,后续的提取操作可以参考相应的rna提取液、dna提取液或蛋白质提取液中的试剂的操作说明书进行后续的提取操作,也可以采用现有的其它常规的适合提取的提取方式操作。所述提取量为能够将细胞悬液中的rna、dna或蛋白质提取出的量为准。
步骤a的组织样品与溶液的比例为10mg~100mg:100~1000μl。
为了更便于后续的提取流程,增强提取效果,优选地,组织样品与溶液的比例为10mg~100mg:100~1000μl。
当溶液为缓冲液时,缓冲液为pbs缓冲液。
当溶液使用缓冲液时,优选地,所述缓冲液为pbs缓冲液。
实施例4:
利用基于超声原理且可调节频率的动植物组织消融仪快速提取rna、dna或蛋白质的方法,包括步骤:a、制备细胞悬液;b、提取rna、dna或蛋白质;步骤a包括将组织样品与溶液混合后,基于超声原理且可调节频率的动植物组织消融仪进行超声消融,得到细胞悬液的步骤。
步骤a的超声消融的条件:功率为200w,超声频率为20khz。
步骤a的组织样品与溶液的比例为10mg:100μl。
实施例5:
利用基于超声原理且可调节频率的动植物组织消融仪快速提取rna、dna或蛋白质的方法,包括步骤:a、制备细胞悬液;b、提取rna、dna或蛋白质;步骤a包括将组织样品与溶液混合后,基于超声原理且可调节频率的动植物组织消融仪进行超声消融,得到细胞悬液的步骤。
步骤a的超声消融的条件:功率为200w,超声频率为100khz。
步骤a的组织样品与溶液的比例为100mg:1000μl。
步骤a的溶液为rna提取液、蛋白质提取液、dna提取液、生理盐水或缓冲液。
实施例6:
利用基于超声原理且可调节频率的动植物组织消融仪快速提取rna、dna或蛋白质的方法,包括步骤:a、制备细胞悬液;b、提取rna、dna或蛋白质;步骤a包括将组织样品与溶液混合后,基于超声原理且可调节频率的动植物组织消融仪进行超声消融,得到细胞悬液的步骤。
步骤a的超声消融的条件:功率为200w,超声频率为45khz。
步骤a的组织样品与溶液的比例为25mg:350μl。
步骤a的溶液为rna提取液、蛋白质提取液、dna提取液、生理盐水或缓冲液。
一种实施方式,步骤a的溶液为rna提取液、蛋白质提取液或dna提取液时,步骤b包括按照rna提取液、蛋白质提取液或dna提取液的常规操作方式分别提取rna、蛋白质或dna的步骤。
实施例7:
利用基于超声原理且可调节频率的动植物组织消融仪快速提取rna、dna或蛋白质的方法,包括步骤:a、制备细胞悬液;b、提取rna、dna或蛋白质;步骤a包括将组织样品与溶液混合后,基于超声原理且可调节频率的动植物组织消融仪进行超声消融,得到细胞悬液的步骤。
步骤a的超声消融的条件:功率为200w,超声频率为40khz。
步骤a的组织样品与溶液的比例为40mg:500μl。
步骤a的溶液为rna提取液、蛋白质提取液、dna提取液、生理盐水或缓冲液。
当步骤a的溶液为生理盐水或缓冲液时,步骤b包括将细胞悬液与提取量的rna提取液、蛋白质提取液或dna提取液混合后分别按照常规操作方式提取rna、蛋白质或dna的步骤。
实施例8:
利用基于超声原理且可调节频率的动植物组织消融仪快速提取rna、dna或蛋白质的方法,包括步骤:a、制备细胞悬液;b、提取rna、dna或蛋白质;步骤a包括将组织样品与溶液混合后,基于超声原理且可调节频率的动植物组织消融仪进行超声消融,得到细胞悬液的步骤。
步骤a的超声消融的条件:功率为200w,超声频率为80khz。
步骤a的组织样品与溶液的比例为65mg:800μl。
当溶液为缓冲液时,所述缓冲液为pbs缓冲液。
实施例9:
利用基于超声原理且可调节频率的动植物组织消融仪快速提取rna、dna或蛋白质的方法,包括步骤:a、制备细胞悬液;b、提取rna、dna或蛋白质;步骤a包括将组织样品与溶液混合后,基于超声原理且可调节频率的动植物组织消融仪进行超声消融,得到细胞悬液的步骤。
步骤a的所述超声消融的条件:功率为200w,超声频率为80khz。
步骤a的所述组织样品与溶液的比例为65mg:800μl。
本实用新型的细胞悬液定义:完全消融后,单细胞的个数占单细胞和细胞团总数大于95%的悬液。
对比例
实施例3-9得到的细胞悬液如图7所示,采用传统的组织匀浆器得到的组织匀浆液如图8所示。对比图7和图8可知,利用本实用新型快速提取rna、dna或蛋白质的方法处理生物组织后得到了细胞悬液,而采用现有的通过组织匀浆器得到的组织匀浆中存在大量的细胞团块,显然,利用本实用新型快速提取rna、dna或蛋白质的方法相比较传统的组织处理方式具有处理速度快,单细胞化彻底的优势。
本实用新型不局限于上述可选实施方式,任何人在本实用新型的启示下都可得出其他各种形式的产品,但不论在其形状或结构上作任何变化,凡是落入本实用新型权利要求界定范围内的技术方案,均落在本实用新型的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!