眼细胞的分化方法及其用途与流程
本申请要求于2018年4月20日提交的美国临时专利申请号62/660,899的权益,该申请的全部内容通过引用并入本文。
背景
1.技术领域
本公开总体上涉及干细胞生物学领域。更特别地,它涉及将多能性干细胞分化成各种眼细胞(包括光感受器前体(prp)细胞)的方法。
2.
背景技术:
视网膜是组织的光敏层,其内衬在眼睛的内表面。视网膜中的光感受器细胞(视杆细胞或视锥细胞)对光直接敏感,并将化学光信号转变为触发神经冲动的电事件。光感受器细胞的功能受损或全部丧失是视网膜疾病中不可逆致盲的病因之一,视网膜疾病诸如遗传性视网膜变性和年龄相关性黄斑变性(amd)。在青光眼中视网膜神经节细胞(rgc)死亡也导致视力的不可逆丧失。挽救变性的视网膜是主要的挑战,细胞替代是最有前景的方式之一(pearson等人,2012)。
在2006年从成年小鼠体细胞产生诱导性多能干细胞(ipsc)对干细胞研究、药物开发、疾病模型和细胞疗法提供了重大突破(takahashi等人,2006)。人ipsc可以分化为特定的细胞类型,并且具有用于再生医学的患者特异性、免疫匹配的细胞的潜力(yu等人,2007)。人多能干细胞、胚胎干(es)细胞和ipsc的使用对于治疗人视网膜变性疾病打开了新的路径。
在培养中具有无限扩增能力同时保留其多能状态的人es(hes)和ips(hips)细胞可以用作用于组织移植的光感受器细胞的不受限制的来源(comyn等人,2010)。不断增长的大量收敛数据证明了在胚状体形成后hes细胞的神经视网膜形成潜力,以及进一步分化成表达光感受器标志物的细胞的能力(zhong等人,2014;meyer等人,2009)。以前开发的不同方法,尽管确实有进展,但仍然存在一般与多能干细胞分化成高度特化细胞类型相关的缺点。这些用于hes或hips细胞的光感受器细胞定向分化的实验方案需要几个步骤,添加几种分子,并且效率相当差。目前用于分化成光感受器细胞谱系的方法需要形成胚状体和/或需要从培养物中人工选择视网膜细胞。因此,在本领域中存在着对用于获得特定的人神经上皮谱系细胞,特别是光感受器前体(prp)细胞的基本上纯的培养物的有效和可靠的大规模方法的需求。
技术实现要素:
本实施方案提供了用于产生眼细胞的方法和组合物及其用途。在第一个实施方案中,提供了用于产生神经视网膜祖细胞(nrp)的方法,该方法包括获得人诱导性多能干细胞(ipsc)的起始群体;将ipsc培养在视网膜诱导培养基(rim)中以启动将所述细胞分化成前神经外胚层细胞;将所述细胞进一步培养在包含bmp抑制剂的第一视网膜分化培养基(rd1)中以进一步将所述细胞分化成前神经外胚层细胞;通过将所述细胞培养在基本上不含bmp抑制剂的第二视网膜分化培养基(rd2)中诱导所述前神经外胚层细胞的视网膜分化,从而形成视网膜祖细胞(rpc);以及将所述rpc培养在视网膜成熟(rm)培养基中以产生nrp。在进一步的实施方案中,提供了产生nrp群体的方法,包括获得人ipsc的起始群体;将所述细胞培养在包含bmp抑制剂的rd1中以进一步将所述细胞分化成前神经外胚层细胞;通过将所述细胞培养在基本上不含bmp抑制剂的rd2中诱导所述前神经外胚层细胞的视网膜分化,从而形成rpc;以及将所述rpc培养在rm培养基中以产生nrp。在具体的方面,所述培养进一步限定为贴壁二维培养。
在一些方面,所述方法进一步包括在将所述ipsc培养在rd1中之前将所述细胞培养在视网膜诱导培养基(rim)中以启动所述细胞分化成前神经外胚层细胞。在某些方面,所述方法进一步包括将nrp群体作为悬浮聚集体培养在包含γ-分泌酶抑制剂和rock抑制剂的培养基中。
在上述实施方案的一些方面,所述方法进一步包括将所述nrp在包含γ-分泌酶抑制剂和fgf的fdsc培养基中培养以产生nrp群体的时间段。
在某些方面,所述rim包含bmp抑制剂、tgfβ抑制剂,和/或igf-1。在某些方面,所述rim包含bmp抑制剂、tgfβ抑制剂、wnt抑制剂和/或igf-1。在具体的方面,所述rim基本上不含激活素a。在具体的方面,所述rim基本上不含wnt抑制剂,诸如cki-7。在一些方面,将ipsc在rim中培养1-3天,诸如1、2或3天。
在一些方面,所述rd1培养基进一步包含tgfβ抑制剂、wnt抑制剂、igf-1和mek抑制剂。在某些方面,所述rd1培养基进一步包含tgfβ抑制剂、wnt抑制剂、igf-1和mek抑制剂。在某些方面,所述rd1培养基不包含cki-7。在一些方面,在rd1中的培养持续1-3天,诸如1、2或3天。
在一些方面,所述rd2培养基包含tgfβ抑制剂、wnt抑制剂、igf-1和mek抑制剂。在某些方面,对于分化潜能,测量前神经外胚层细胞的vsx2表达增加。在具体的方面,所述rd2培养基基本上不含ldn193189。在一些方面,在rd2中的培养持续5-9天,诸如5、6、7、8或9天。在某些方面,在rd2中的培养后至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的细胞表达pmel17。在某些方面,在rd2中的培养后至少30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、45%、50%、55%、60%、70%、80%、90%、95%或100%的细胞表达vsx2。在具体的方面,所述rpc表达pax6、mitf和/或pmel。在一些方面,所述rpc不表达或基本上不表达tryp1、cralbp和/或best1。
在一些方面,从获得ipsc至在rm中培养的培养进一步限定为贴壁二维培养。在一些方面,从获得ipsc至在rm中培养的培养基本上不含聚集体。
在一些方面,所述rm培养基包含烟酰胺和抗坏血酸。在某些方面,所述rm培养基进一步包含fgf和tgfβ抑制剂。在一些方面,所述rm培养基进一步包含fgf、sb431542、cki-7和igf-1。在一些方面,所述rm培养基进一步包含γ-分泌酶抑制剂。在某些方面,在rm培养基中培养产生nrp持续3-7天。在一些方面,所述nrp表达pax6和vsx2。在某些方面,在rm培养基中培养以产生nrp后至少70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、85%、90%、95%,或100%的细胞表达pax6和vsx2。在具体的方面,所述rpc表达pax6、mitf和/或pmel。
在另一个实施方案中,提供了产生光感受器前体细胞(prp)群体的方法,包括根据所述实施方案获得nrp的起始群体;以及将所述nrp进一步在包含γ-分泌酶抑制剂和fgf的光感受器前体诱导培养基(fdsc)中培养足以产生prp群体的时间段。在一些方面,所述培养进一步限定为贴壁二维培养。
在一些方面,所述nrp在包含γ-分泌酶抑制剂和fgf的fdsc培养基中培养足以产生prp群体的时间段为10-20、20-30、30-40或40-50天,诸如11、12、13、14、15、16、17、18或19天或更多。fdsc进一步包含tgfβ抑制剂和wnt抑制剂。在一些方面,所述rm培养基进一步包含fgf和tgfβ抑制剂。
在一些方面,用于产生prp的方法进一步包括使所述prp群体作为悬浮聚集体在rm培养基或光感受器成熟(pm)培养基中成熟,由此产生成熟prp聚集体的群体,其中所述rm培养基或光感受器成熟(pm)培养基包含烟酰胺。在一些方面,成熟持续6-10天,诸如6、7、8、9或10天。在另外的方面,所述方法进一步包括冷冻保存所述成熟prp聚集体。在一些方面,所述pm培养基进一步包含γ-分泌酶抑制剂。
在某些方面,用于产生prp的方法进一步包括将所述成熟prp聚集体在pm培养基中解离成基本上单个细胞。在一些方面,所述方法包括将所述成熟prp作为单个细胞冷冻保存。
在一些方面,所述prp作为贴壁细胞在pm培养基中培养5-12天,诸如5、6、7、8、9、10、11或12天。在某些方面,所述pm培养基进一步包含γ-分泌酶抑制剂。在某些方面,解离的细胞被再聚集。在一些方面,所述pm培养基进一步包含cdk抑制剂。在具体的方面,至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、90%、95%或100%的所述细胞表达恢复蛋白(rcvrn)。
在一些方面,所述进一步包括纯化所述prp。在某些方面,纯化包括选择cd171阳性的细胞,由此提供纯化的prp细胞群体。在一些方面,纯化包括选择cd171和/或susd2阳性的细胞,由此提供纯化的prp细胞群体。在具体的方面,纯化包括选择cd171、susd2、cd56(ncam)、cd57(lamp-3)、cd81、cd111(nectin1)、cd133、cd147、cd184(cxcr4)、cd200、cd230、cd276、cd298、cd344(卷曲)、psa-ncam、和/或ptk7阳性的细胞,由此提供纯化的prp细胞群体。在特定的方面,纯化包括选择cd111、cd133、cd230和/或cd344阳性的细胞,由此提供纯化的prp细胞群体。在一些方面,纯化包括选择cd344阳性的细胞,由此提供纯化的prp细胞群体。在一些方面,纯化在第65天或第75天进行。在某些方面,纯化包括耗竭选自由下列各项组成的组的两种或更多种标志物阳性的细胞:cd9、cd49f、cd340、平足蛋白(podoplanin)、cd29、cd63和cd298。
在一些方面,在纯化的prp细胞群体中至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的细胞表达iii类β-微管蛋白(tubb3)。在某些方面,在纯化的prp细胞群体中至少50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、65%、70%、75%、80%、85%、90%、95%或100%的细胞表达rcvrn。在一些方面,在纯化的prp细胞群体中至少70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、85%、90%、95%或100%的细胞表达rcvrn。在一些方面,所述prp表达选自由下列各项组成的组的一种或多种标志物:otx2、crx、blimp1、neurod1、rcvrn、tubb3和cd171/l1cam。在某些方面,所述prp不表达或基本上不表达tryp1、cralbp、best1、ki67、mitf和/或pmel17。在一些方面,所述细胞低表达或基本上不表达pax6、chx10(在本文中也称作vsx2;两个术语在本文中可互换使用)和/或onecut1。在具体的方面,在纯化的prp群体中少于15%、10%或5%(例如,少于4%、3%、2%或1%)的细胞表达pax6。
进一步的实施方案提供了产生prp群体的方法,包括根据所述实施方案获得nrp的起始群体;以及进一步将所述nrp在包含周期蛋白依赖性激酶抑制剂的prp成熟培养基(pm)中培养足以产生prp群体的时间段。
在一些方面,在pm培养基中培养前,至少70%(例如71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、85%、90%、95%,或100%)的所述细胞是pax6和chx10阳性的。在某些方面,所述nrp作为聚集体在γ-分泌酶抑制剂和rock抑制剂的存在下培养。在一些方面,所述pm进一步包含γ-分泌酶抑制剂。在具体的方面,所述pm进一步包含mek抑制剂。
在另外的方面,所述方法进一步包括在pm培养基中将所述prp解离为基本上单个细胞。在一些方面,所述prp作为贴壁细胞在pm培养基中培养。
在一些方面,所述方法进一步包括通过选择cd171、susd2、cd56(ncam)、cd57(lamp-3)、cd81、cd111(nectin1)、cd133、cd147、cd184(cxcr4)、cd200、cd230、cd276、cd298、cd344(卷曲)、psa-ncam和/或ptk7阳性的细胞,和/或去除cd9、cd49f、cd340、平足蛋白cd29、cd63和/或cd298阳性的细胞来富集prp。在一些方面,至少90%(例如,91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)的细胞是tubb3阳性的和/或至少70%(例如,71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、85%、90%、95%或100%)的细胞是rcvrn阳性的。
还在其他实施方案中,提供了产生视泡(ov)群体的方法,包括根据所述实施方案获得prp的起始群体;以及进一步将所述prp作为悬浮聚集体在rm培养基或prp成熟(pm)培养基中培养足以产生ov群体的时间段。
在一些方面,将prp作为悬浮聚集体在rm培养基或prp成熟(pm)培养基中培养足以产生ov群体的时间段为至少20天,诸如至少21、22、23、24、25、26、27、28、29、30、35、40、45、50或更多天。在一些方面,所述rm培养基进一步包含γ-分泌酶抑制剂。在某些方面,所述rm培养基进一步包含fgf和sb431542。在一些方面,所述ov群体中至少50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、65%、70%、75%、80%、85%、90%、95%或100%的细胞表达vsx2。在一些方面,所述ov群体中至少10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、40%、50%、60%或更多的细胞表达rcvrn。在一些方面,所述ov表达γ-突触核蛋白(sncg)、视蛋白、rcvrn和视紫红质。在某些方面,所述fdsc进一步包含tgfβ抑制剂和wnt抑制剂。
在一些方面,将nrp在包含γ-分泌酶抑制剂和fgf的rm培养基中培养足以产生prp群体的时间段为10-20天,诸如11、12、13、14、15、16、17、18、19、20或更多天。在一些方面,所述prp群体中至少65%、70%、75%、80%、85%、90%、95%或更多的细胞表达tubb3。在一些方面,所述prp群体中至少30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、45%、50%、55%、60%、70%、80%、90%、95%或100%的细胞表达rcvrn。
在另外的方面,所述方法进一步包括将所述nrp群体作为悬浮聚集体培养在包含γ-分泌酶抑制剂和rock抑制剂的培养基中。在一些方面,所述培养基进一步包括抗坏血酸和烟酰胺。在某些方面,所述nrp中至少75%、76%、77%、78%、79%、80%、85%、90%、95%或100%的细胞表达vsx2。
在另一些实施方案中,提供了药物组合物,所述药物组合物包含根据所述实施方案产生的prp、根据所述实施方案产生的ov或根据所述实施方案产生的nrp,以及药学上可接受的载体。
进一步的实施方案提供了治疗受试者中视网膜神经元的损伤或变性的方法,包括向所述受试者的眼施用有效量的所述实施方案的药物组合物(例如,其中产生的prp、ov或nrp)。在一些方面,所述视网膜神经元是光感受器。
通过本文所述的方法产生的眼细胞(诸如prp细胞)可以在本领域中目前已知的用于光感受器细胞的任何方法和应用中使用。例如,可以提供评估化合物的方法,包括测定所述化合物对光感受器细胞的药理学或毒理学特性。还可以提供评估化合物对prp细胞的效应的方法,包括:a)使本文提供的prp细胞与所述化合物接触;以及b)评估所述化合物对所述prp细胞的效应。
在上述实施方案的特定方面,所述rim包含ldn193189、sb431542、cki-7和igf-1。在一些方面,所述rd1培养基进一步包含tgfβ抑制剂、wnt抑制剂、igf-1和mek抑制剂。在某些方面,所述rd2培养基包含tgfβ抑制剂、wnt抑制剂、igf-1i和mek抑制剂。在一些方面,所述bmp抑制剂是ldn193189。在一些方面,所述tgfβ进一步限定为i型受体激活素受体样激酶(alk5)抑制剂。在某些方面,所述tgfβ抑制剂是sb431542、6sb525334、sb-505124、lefty、a83-01、d4476、gw788388、ly364847、r268712或repsox。在一些方面,所述wnt抑制剂是cki-7、iwp2、iwp4、pnu74654xav939、tak715、dkk1或sfrp1。在具体的方面,所述mek抑制剂是pd0325901。在一些方面,rd2培养基包含sb431542、cki-7、igf-1和pd0325901。在具体的方面,所述rm培养基进一步包含fgf、sb431542、cki-7和igf-1。在一些方面,所述γ-分泌酶抑制剂是dapt、begacestat、化合物w、jlk6、l-685,485、左旋氟比洛芬(flurizan)、dbz、mrk560、pf3084014氢溴酸盐或bms299897。在一些方面,周期蛋白依赖性激酶(cdk)抑制剂是cdk4/6抑制剂,诸如pd0332291(帕博西尼(palbociclib))。
在另一实施方案中,提供了包含nrp群体的组合物,其中所述nrp群体中至少90%(例如,91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)的细胞表达pax6,所述nrp群体中至少90%(例如,91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)的细胞表达pmel17,和/或所述nrp群体中至少70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、85%、90%、95%或100%的细胞表达vsx2。在一些方面,所述nrp群体中至少95%的细胞表达pax6,所述nrp群体中至少90%(例如,91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)的细胞表达pmel17,和/或所述nrp群体中至少75%的细胞表达vsx2。在某些方面,所述nrp群体中至少95%的细胞表达pax6,所述nrp群体中至少90%(例如,91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)的细胞表达pmel17,以及所述nrp群体中至少75%的细胞表达vsx2。在一些方面,所述nrp群体中的细胞进一步表达ki67。
在另一实施方案中,提供了包含prp群体的组合物,其中所述prp群体中至少90%(例如,91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)的细胞表达tubb3,所述prp群体中至少50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、65%、70%、75%、80%、85%、90%、95%或100%的细胞表达rcvrn,和/或所述prp群体中少于15%的细胞表达pax6。在一些方面,所述prp群体中至少70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、85%、90%、95%或100%的细胞表达rcvrn。在某些方面,所述prp群中少于10%或5%的细胞表达pax6。在一些方面,所述prp群体中至少90%的细胞表达tubb3,所述prp群体中至少50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、65%、70%、75%、80%、85%、90%、95%或100%的细胞表达rcvrn,以及所述prp群体中少于15%的细胞表达pax6。在一些方面,所述prp群体中至少90%的细胞表达tubb3,所述prp群体中至少70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、85%、90%、95%或100%的细胞表达rcvrn,和/或所述prp群体中少于5%的细胞表达pax6。在某些方面,所述prp表达选自由下列各项组成的组的一种或多种标志物:otx2、irbp、susd2、crx、blimp1、neurod1、rcvrn、tubb3和cd171/l1cam。在一些方面,所述prp不表达或基本上不表达tryp1、cralbp、best1、ki67、mitf和/或pmel17。
进一步的实施方案提供了包含ov群体的组合物,其中至少50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、65%、70%、75%、80%、85%、90%、95%或100%的细胞表达vsx2和/或至少20%的细胞表达rcvrn。在一些方面,至少65%的细胞表达vsx2和/或至少30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、45%、50%、55%、60%、70%、80%、90%、95%或100%的细胞表达rcvrn。在某些方面,至少65%的细胞表达vsx2以及至少30%的细胞表达rcvrn。
另一实施方案提供了一种提供富集的prp细胞群体的方法,包括获得包含prp细胞的起始细胞群体;以及通过选择cd171、susd2、cd56(ncam)、cd57(lamp-3)、cd81、cd111(nectin1)、cd133、cd147、cd184(cxcr4)、cd200、cd230、cd276、cd298、cd344(卷曲)、psa-ncam和/或ptk7阳性的细胞,和/或从所述起始细胞群体中去除cd9、cd49f、cd340、平足蛋白、cd29、cd63和/或cd298阳性的细胞来富集所述起始细胞群体中的prp细胞,由此提供与所述起始细胞群体相比富集了prp细胞的富含prp的细胞群体。在一些方面,所述方法进一步包括确定所述富含prp的细胞群体中所述prp细胞的富集水平。在一些方面,所述富集水平通过使用选自由下列各项组成的组的细胞标志物来确定:tubb3、rcvrn、otx2、irbp、susd2、crx、blimp1、neurod1和cd171/l1cam。在某些方面,如通过rcvrn分选测定,与所述起始细胞群体相比,所述富含prp的细胞群体富含prp细胞。在一些方面,所述富含prp的细胞群体为至少50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、65%、70%、75%、80%、85%、90%、95%或100%的prp细胞。在某些方面,所述富含prp的细胞群体为至少70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、85%、90%、95%或100%的prp细胞。在一些方面,所述富含prp的细胞群体为基本上纯的prp细胞。在具体的方面,所述prp细胞为人prp细胞。在一些方面,所述起始细胞群体由ipsc制备。在一些方面,选择和/或去除通过基于磁珠的分选或基于荧光的分选来进行。在一些方面,所述方法包括选择cd171、susd2、cd111、cd133、cd230和/或cd344阳性的细胞。
另一实施方案提供了在产生nrp细胞制品期间进行质量控制的方法,包括检测选自由下列各项组成的组的细胞标志物的表达:pax6、chx10(vsx2)、ki67和pmel。在一些方面,至少70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、85%、90%、95%,或100%的细胞是pax6、chx10(vsx2)、ki67和pmel阳性的。在某些方面,至少90%的细胞是pax6、chx10(vsx2)、ki67和pmel阳性的。
在进一步的实施方案中,提供了在产生prp细胞制品期间进行质量控制的方法,包括检测选自由下列各项组成的组的脱靶细胞标志物的表达:pax6、onecut1、hnchf6、chx10和ki67。在一些方面,所述脱靶细胞是pax6和isl1阳性的。在一些方面,质量控制合格的prp细胞制品包含少于10%或5%的pax6-阳性细胞。在某些方面,质量控制合格的prp细胞制品包含少于10%的pax6-阳性细胞、少于0.05%的ki67-阳性细胞、少于30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、45%、50%、55%、60%、70%、80%、90%、95%或100%的chx10-阳性细胞、和/或少于2%的onecut1-阳性细胞。在一些方面,质量控制合格的prp细胞制品包含少于5%的pax6-阳性细胞、少于0.04%的ki67-阳性细胞、少于15%的chx10-阳性细胞,和/或少于1%的onecut1-阳性细胞。在某些方面,质量控制合格的prp细胞制品包含少于5%的pax6-阳性细胞、少于0.04%的ki67-阳性细胞、少于15%的chx10-阳性细胞和少于1%的onecut1-阳性细胞。
进一步的实施方案提供了在产生ov细胞制品期间进行质量控制的方法,包括检测选自由下列各项组成的组的一种或多种细胞标志物的表达:rcvrn、chx10、pax6和ki67。在某些方面,所述细胞标志物为rcvrn和chx10。在具体的方面,所述ov细胞制品中至少60%的细胞是rcvrn阳性的,且所述ov细胞制品中至少30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、45%、50%、55%、60%、70%、80%、90%、95%或100%的细胞是chx10阳性的。在一些方面,所述细胞标志物为pax6和ki67。在一些方面,所述方法进一步包括检测tyrp1的不存在。在一些方面,所述方法进一步包括检测选自由下列各项组成的组的一种或多种标志物的表达:mitf、cralbp、best1、otx2、crx、blimp1、neurod1、tubb3、onecut1和cd171/l1cam。
根据以下详细描述,本发明的其他目的、特征和优点将变得明显。然而,应该理解的是,尽管指出了本发明的优选实施方案,但是详细描述和特定实施例仅仅是以示例的方式给出的,因为在本发明的精神和范围内的各种改变和修改根据此详细描述对于本领域技术人员将变得明显。
附图说明
以下附图形成本说明书的一部分并且被包括以进一步说明本发明的某些方面。通过参考这些附图中的一个或多个附图并结合在本文给出的具体实施方案的详细描述,可以更好地理解本发明。
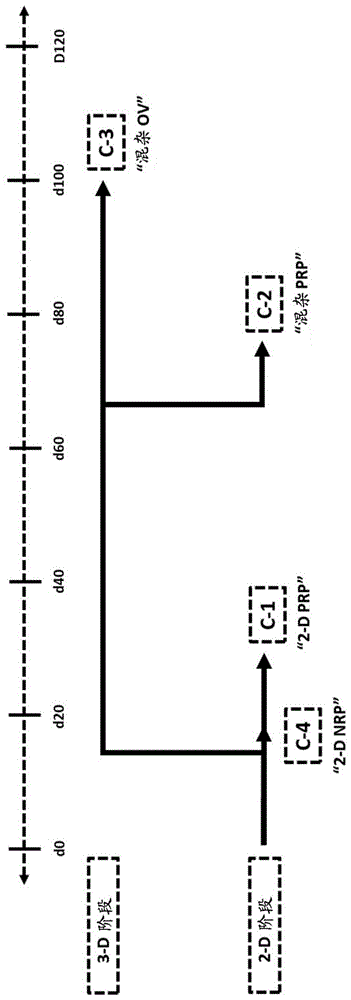
图1:候选物概述。ipsc-衍生的眼细胞分化的示意图,包括神经视网膜祖细胞(nrp)、光感受器前体细胞(prp)和视泡(ov)。候选物1(c-1)代表了在贴壁二维(2-d)条件下分化的prp(2-dprp)。候选物2(c-2)代表了在2-d和悬浮聚集体三维(3-d)两种条件下分化的prp(混杂prp)。候选物3(c-3)代表在2-d和3-d两种条件下分化的ov(混杂ov)。候选物4(c-4)代表在2-d条件下分化的nrp。
图2:2-dprp分化过程的示意图,包括培养基阶段持续时间。
图3a-3c:2-dprpmacs富集。对macs富集前(图3a)和富集后2-d(图3b)两种情况下2-dprp的βiii-微管蛋白(tubb3)和恢复蛋白(rcvrn)表达的流式细胞分析。(图3c)对macs前后2-dprp分化的流式细胞分析总结(n=5)。
图4a-4d:2-dprp表征。(图4a)解冻后第2天2-dprp聚集体(10x物镜)的图像。(图4b)对解冻后第1天2-dprp的tubb3和rcvrn的免疫荧光染色(20x物镜)。(图4c)对解冻后第1天2-dprp的crx和rcvrn的免疫荧光染色(20x物镜)。(图4d)对解冻后第2天的2-dprp聚集体的单细胞基因表达分析。
图5:混杂prp分化过程的示意图。
图6:输入ipsc密度优化。对第15天混杂prp分化的pax6和vsx2的流式细胞分析,输入密度范围为6孔板每孔1x104(10k)至1x106(1000k)个细胞。
图7:rm培养基优化。对在添加或不添加fgf2和sb431542的rm培养基中生长的第18天rpc的流式细胞分析。
图8a-8b:pm培养基优化。(图8a)在添加或不添加pd0332991或激活素a的pm培养基中晚期接种的prp的形态学。(图8b)对在添加或不添加pd0332991或激活素a的pm培养基中晚期接种的c-2prp的流式细胞分析。
图9:混杂prpmacs富集。对macs富集前后两种情况下混杂prp的tubb3、nestin和rcvrn表达的流式细胞分析。
图10a-10d:混杂prp表征。(图10a)解冻后第2天混杂prp聚集体的图像(10x物镜)。(图10b)对解冻后第1天混杂prp的tubb3和rcvrn的免疫荧光染色(20x物镜)。(图10c)对解冻后第1天混杂prp的crx和rcvrn的免疫荧光染色(20x物镜)。(图10d)对解冻后第2天混杂prp聚集体的单细胞基因表达分析。
图11:混杂ov分化过程的示意图。
图12a-12d:混杂ov形态学和表征。(图12a)第68天分化中的混杂ov的图像。(图12b)分化中的混杂ov的vsx2和rcvrn的免疫荧光染色时程。(图12c)对晚期混杂ov的γ-突触核蛋白(sncg;视网膜神经节细胞标志物)、rcvrn(prp和光感受器标志物)、绿色敏感视蛋白(opn1mw;视锥细胞标志物)、视锥-抑制蛋白(arr3;视锥细胞标志物)和视紫红质(rho;视杆细胞标志物)的免疫荧光染色。(图12d)对分化中的混杂ov的vsx2和rcvrn的流式细胞术时程分析。
图13:2-dnrp分化过程的示意图。
图14a-14c:2-dnrp表征。(图14a)解冻后第2天nrp聚集体的图像。(图14b)对解冻后第1天贴壁的nrp的pax6(左)和vsx2(右)的免疫荧光染色。(图14c)对解冻后第2天nrp的pax6、pmel17和vsx2的流式细胞术分析。
图15a-15b:在利用恢复蛋白和针对各个表面抗原的抗体双标记后使用四象限流式图测定对应于表4的表面抗原和恢复蛋白共表达的流式分析。另外,评价仅表达恢复蛋白(fitc,x-轴)或仅表达表面抗原(apc,y-轴)的细胞群体的百分比。将所有流式图针对未染色的(空)细胞和相应的同种型对照(reaigg1、msigg1、msigg2a、msigg2b、msigm)设门控。
图16:在利用表面抗原富集后恢复蛋白表达的时程。在d65对于cd344富集的prp,恢复蛋白表达最高。与富集前(macs前)细胞相比,利用cd111和cd230的富集也产生了最高百分比的恢复蛋白表达。
图17:在d55利用表面抗原cd111、cd230和cd344富集后评价靶上prp和脱靶视网膜细胞的富集后表达。
图18:在d65利用表面抗原cd111、cd230和cd344富集后评价靶上prp和脱靶视网膜细胞的富集后表达。
图19:在d75利用表面抗原cd111、cd230和cd344富集后评价靶上prp和脱靶视网膜细胞的富集后表达。
图20:在d75利用cd133富集后评价靶上prp和脱靶视网膜细胞的富集后表达。
图21:耗竭标志物的流式分析。
图22:在prp分化的第15天和第25天在存在或不存在cki-7的情况下对pax6和chx10表达的流式细胞分析。
图23:在prp分化的第15天和第25天在存在或不存在cki-7的情况下pax6和chx10表达的百分比。
图24a-24b:(图24a)在prp分化的第15天和第25天在存在或不存在cki-7的情况下对ki67和chx10表达的流式细胞分析。*使用缀合的chx10使流式图迁移(更高)但在此情况下降低了表达水平;可能是由于空间位阻导致抗体不能标记最大量的表位。(图24b)在prp分化的第15天和第25天在存在或不存在cki-7的情况下ki67和chx10表达的百分比。
图25a-25b:(图25a)在prp分化的第15天和第25天在存在或不存在cki-7的情况下对tyrp1和pmel表达的流式细胞分析。(图25b)在prp分化的第15天和第25天在存在或不存在cki-7的情况下tyrp1和pmel表达的百分比。
图26a-26b:在存在rim(图26a)和不存在rim(图26b)的情况下早期视野和rpe标志物的比较。
图27a-27d:根据pax6(图27a)、chx10(图27b)、tryp10(图27c)和pmel(图27d)的表达,相比没有rim,有rim对各细胞系早期(d15)神经视网膜分化的作用。
图28a-28d:根据pax6(图28a)、chx10(图28b)、tryp10(图28c)和pmel(图28d)的表达,在存在或不存在rim的情况下prp的中期分化(~d30)的比较。
图29a-29b:在存在rim(图29a)或不存在rim(图29b)的情况下第75天靶上prp表征标志物的表达。
图30:在存在或不存在rim的情况下第75天脱靶视网膜细胞标志物的表达。
图31a-31b:与cd171相比,利用susd2富集的prp细胞中恢复蛋白表达大于90%。(图31a)susd2-富集的rcvrn-阳性细胞群体。(图31b)cd171-富集的rcvrn-阳性细胞群体。
图32a-32e:在分化d55–d65天之间观察到最大恢复蛋白(图32a)和susd2(图32b)表达,恢复蛋白峰在susd2后很快出现。恢复蛋白和susd2共表达(图32c)类似于susd2单独表达,表明表达susd2的细胞还表达恢复蛋白,而不是所有恢复蛋白-阳性细胞都表达susd2。三张图重叠清晰地证明了相比单一susd2株,双重恢复蛋白/susd2的平行表达(图32d)。利用后固定的恢复蛋白标记的susd2-标记。从早期d55至晚期d105对恢复蛋白和susd2共表达的独立时程研究(图32e)支持了d65前后的峰值susd2表达,而且也显示在d55同等升高的表达。
图33a-33c:在d65、d75和d85,susd2-富集后恢复蛋白表达百分比进一步增加(图33a),显示在d65时的最高表达,这也对应于早期峰值susd2和恢复蛋白表达时间。尽管恢复蛋白-阳性细胞群体百分比从d65至d75至d85减少(b),但在d85时与cd171-富集相比,susd2-富集仍提高了恢复蛋白-阳性细胞百分比(图33b)。然而,susd2-富集的限制是低细胞输出,在富集后回收<25%的初始细胞输入(图33c)。这对于在d85利用susd2或cd171富集的细胞均如此,而利用susd2仅富集总输入细胞的3%,通过cd171仅富集总输入细胞的18%。流通(标记为susd2-和cd171-)似乎包含了大部分细胞,表明在较晚的分化期时两种表面标志物表达都可能减少。
图34a-34e:在d65,macssusd2前以及macs前后恢复蛋白表达的高度,chx10表达最低,但到d75和d85时显著增加(图34a)。在d65恢复蛋白-chx10的共表达<3%,并分别在d75和d85升高和下将,表明短命的双极细胞群体(图34b)。与d75和d85相比,在富集前后在d65neurod1表达最高(图34c),在d65时neurod1共表达也最高,且在susd2富集后进一步提高(图34d)。另外的实验(图34e)证实在d55时chx10低,还显示在d75在susd2macs富集后chx10的大幅降低。
具体实施方式
i.示例性实施方案的描述
在某些实施方案中,本公开提供了产生眼细胞的方法,所述眼细胞包括光感受器前体(prp)细胞群体。prp细胞可以来源于在限定2d细胞培养中的多能干细胞,诸如es细胞或ips细胞,不需要形成胚状体或选择细胞集落。备选地,所述prp细胞可以来源于混杂贴壁2-d和悬浮聚集体3-d培养。简言之,psc可以分化成前神经外胚层细胞,所述前神经外胚层细胞短期培养在包含bmp抑制剂的视网膜分化培养基中,然后进一步在不含bmp抑制剂的视网膜分化培养基中培养。有趣的是,发明人发现去除bmp抑制剂增强了前神经外胚层细胞的神经视网膜分化潜能。然后所述细胞可以在存在烟酰胺和不存在激活素a的情况下进一步分化成视网膜祖细胞(rpc),从而指引细胞朝向光感受器谱系而非其他视网膜谱系,诸如视网膜色素上皮细胞。最后,rpc可以在tgfβ抑制剂、wnt抑制剂、碱性fgf和γ-分泌酶抑制剂的存在下分化以产生神经视网膜祖(nrp)细胞,然后所述神经视网膜祖细胞可以分化成prp细胞。因此,本公开提供了将psc分化成prp细胞的高效的、可再现的方法。
本公开还提供了通过2d和3d聚集体培养的组合来产生prp细胞或视泡的方法。rpc可以作为聚集体在不含激活素a的视网膜成熟培养基中培养持续以产生prp聚集体的时间段,然后prp聚集体可以被解离并作为单层培养。备选地,rpc可以在不含激活素a的视网膜成熟培养基中培养持续以延长的时间段,从而产生prp聚集体并且最终产生视泡。
本公开的进一步实施方案提供了纯化通过上述方法获得的prp细胞群体的方法。所述纯化方法可以包括阳性和/或阴性选择。例如,表达cd171的细胞可以通过细胞分选选择。因此,所述纯化过程产生比从rpc分化后获得的群体具有更高百分比的prp细胞的富含prp的细胞群体。
因此,本发明的方法是更加时间有效和成本有效的,并且可以允许从可更新的来源(即干细胞)以临床规模制备富含prp的细胞群体用于治疗。它们可以用于揭开对光感受器细胞的发育、分化、维持、生存和功能重要的机制、新基因、可溶性或膜结合的因子。
本文提供的prp细胞和光感受器细胞可以用于各种各样的体内和体外方法。例如,所述prp细胞可以用于在体内治疗视网膜的病症,包括但不限于黄斑变性和视网膜色素变性。prp细胞和光感受器细胞还可以在体外用在筛选测定中以鉴定假定的治疗或预防治疗候选物。本发明的更多实施方案和优势在下文中描述。
i.定义
术语“纯化”不需要绝对纯度;相反,它只是一个相对术语。因此,纯化的细胞群体是大于约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%纯的,或最优选地,基本上不含其他细胞类型。
如本文所用,就特定组分而言,“基本上”或“基本上不含”在本文中用于意指特定组分未被有目的地配制到组合物中和/或仅作为污染物或以痕量存在。因此,由组合物的任何意外污染导致的特定组分的总量远低于0.05%,优选低于0.01%。最优选的是其中所述特定组分的量用标准分析方法检测不到的组合物。
如在本说明书中所使用的,“一种”或“一个”可以意指一种或多种/一个或多个。如本文权利要求中所使用的那样,当与词语“包含”一起使用时,单词“一种”或“一个”可以意指一种/一个或多于一种/一个。
在权利要求中使用术语“或”用于表示“和/或”,除非明确指出仅指替代方案或者替代方案是相互排斥的,尽管本公开内容支持仅指替代方案和“和/或”的定义。如本文所用,“另一个”可以表示至少第二个或更多个。
贯穿本申请,术语“约”用于指示值包括用于测定该值的装置、方法的固有误差变化或存在于研究对象之间的变化。
术语“细胞群体”在本文中用于指代一组细胞,通常为常见类型的细胞。细胞群体可以衍生自共同的祖先或可以包含多于一种的细胞类型。“富集的”细胞群体是指源自起始细胞群体(例如,未分级的,异质性细胞群体)的细胞群体,其含有比起始群体中特定细胞类型的百分比更大百分比的该特定细胞类型。细胞群体可以就一种或多种细胞类型被富集并耗竭一种或多种细胞类型。
术语“干细胞”在本文中指在合适的条件下能够分化成多种范围的特化细胞类型而在其他合适的条件下能够自我更新并保持基本上未分化的多能状态的细胞。术语“干细胞”还包括多能细胞、多潜能细胞、前体细胞和祖细胞。示例性的人干细胞可以从获自骨髓组织的造血或间充质干细胞、获自胚胎组织的胚胎干细胞或获自胎儿的生殖组织的胚胎生殖细胞获得。示例性多能干细胞还可以通过与多能性相关的某些转录因子的表达将体细胞重编程为多能状态而由体细胞产生;这些细胞被称为“诱导性多能干细胞”或“ipsc”。
术语“多能”是指细胞在生物体内分化成所有其他细胞类型(除了胚外或胎盘细胞)的性质。即使在延长培养之后,多能干细胞也能够分化成所有三种胚层(例如,外胚层,中胚层和内胚层细胞类型)的细胞类型。多能干细胞是源自胚泡的内细胞团的胚胎干细胞。在其他实施方案中,多能干细胞是通过重编程体细胞衍生的诱导性多能干细胞。
术语“分化”是指未特化的细胞变成具有结构和/或功能特性变化的更特化类型的过程。成熟细胞通常具有改变的细胞结构和组织特异性蛋白。
如本文所用,“未分化的”是指显示未分化细胞的特征性标志物和形态特征(其将它们与胚胎或成人来源的终末分化的细胞清楚地区分开来)的细胞。
“胚状体(eb)”是可以经历分化成内胚层、中胚层和外胚层的细胞的多能干细胞的聚集体。当使多能干细胞在非贴壁培养条件下聚集并因此形成悬浮的eb时,形成球体结构。
“分离的”细胞已经基本上从生物体或培养物中的其他细胞中分离或纯化。分离的细胞可以是例如至少99%、至少98%纯的、至少95%纯的或至少90%纯的。
“胚胎”是指通过受精卵或具有人工重编程核的活化卵母细胞的一次或多次分裂获得的细胞团。
“胚胎干(es)细胞”是未分化的多能细胞,其从早期阶段的胚胎(诸如胚泡阶段的内细胞团)获得,或者通过人工方式(例如核转移)产生,并且可以在胚胎或成人中产生任何分化的细胞类型,包括生殖细胞(例如精子和卵子)。
“诱导多能干细胞(ipsc)”是通过表达因子(本文中称为重编程因子)的组合或诱导因子组合的表达重编程体细胞而产生的细胞。可以使用胎儿、出生后、新生儿、幼年或成人体细胞产生ipsc。在某些实施方案中,可用于将体细胞重编程为多能干细胞的因子包括例如oct4(有时称为oct3/4)、sox2、c-myc和klf4、nanog和lin28。在一些实施方案中,体细胞通过表达至少两种重编程因子、至少三种重编程因子或四种重编程因子来重编程,从而将体细胞重编程为多能干细胞。
“等位基因”是指基因的两种或更多种形式中的一种。二倍体生物如人含有每个染色体的两个拷贝,因此每个染色体携带一个等位基因。
术语“纯合”被定义为在特定基因座处含有两个相同的等位基因。术语“杂合”是指在特定基因座处含有两个不同的等位基因。
“单倍型”是指沿着单个染色体在多个基因座处的等位基因的组合。单倍型可以基于单个染色体上的一组单核苷酸多态性(snp)和/或主要组织相容性复合体中的等位基因。
如本文所用,术语“单倍型匹配的”被定义为细胞(例如ipsc细胞)和被治疗的受试者共有一种或多种主要组织相容性基因座单倍型。受试者的单倍型可以使用本领域公知的测定容易地确定。单倍型匹配的ips细胞可以是自体的或同种异体的。在组织培养中生长并分化为prp细胞的自体细胞固有地与该受试者单倍型匹配。
“基本上相同的hla类型”表示供体的人白细胞抗原(hla)类型与患者的类型匹配达到这样的程度:通过诱导来自供体体细胞的ipsc的分化而获得的移植细胞在被植入患者时能够被移植。
“超级供体”在本文中被称为对某些mhci类和ii类基因纯合的个体。这些纯合个体可以作为超级供体,并且它们的细胞(包括组织和包含其细胞的其他物质)可以被移植到该单倍型纯合或杂合的个体中。超级供体可以分别对于hla-a、hla-b、hla-c、hla-dr、hla-dp或hla-dq的一种或多种基因座等位基因是纯合的。
本文使用“无饲养细胞”或“不依赖饲养细胞”来指补充有细胞因子和生长因子(例如tgfβ、bfgf、lif)作为饲养细胞层的替代物的培养物。因此,可以使用“无饲养细胞”或不依赖饲养细胞的培养系统和培养基来培养和维持未分化和增殖状态的多能细胞。在一些情况下,无饲养细胞培养物利用基于动物的基质(例如matrigeltm)或生长在诸如纤连蛋白、胶原蛋白或玻连蛋白的基质上。这些方法允许人干细胞保持基本上未分化的状态,而不需要小鼠成纤维细胞“饲养层”。
“饲养层”在本文中定义为细胞的包被层,例如在培养皿的底部上。饲养细胞可以将营养素释放到培养基中并提供其他细胞如多能干细胞可以附着的表面。
当与培养基、细胞外基质或培养条件相关地使用时,术语“确定成分的”或“完全确定成分的”是指其中化学组成和几乎所有组分的量都是已知的培养基、细胞外基质或培养条件。例如,确定成分培养基不含未确定的因子,诸如在胎牛血清、牛血清白蛋白或人血清白蛋白中的未确定的因子。通常,确定成分培养基包括补充有重组白蛋白、化学确定的脂质和重组胰岛素的基础培养基(例如含有氨基酸、维生素、无机盐、缓冲剂、抗氧化剂和能源的dulbecco改良的eagle培养基(dmem)、f12或roswellparkmemorialinstitutemedium(rpmi)1640)。完全确定成分的培养基的实例是essential8tm培养基。
对于与人细胞一起使用的培养基、细胞外基质或培养系统,术语“无异源(xf)”是指其中使用的材料不是非人动物来源的条件。
“汇合前”是指其中细胞覆盖的培养表面的比例为约60-80%的细胞培养物。通常,汇合前是指其中约70%的培养表面被细胞覆盖的培养物。
术语“视网膜祖细胞”,也称“视网膜前体细胞”或“rpc”,包括有能力生成视网膜的所有细胞类型(包括神经视网膜细胞,诸如视杆细胞、视锥细胞、光感受器前体细胞)的细胞,以及可以分化成rpe的细胞。
术语“神经视网膜祖细胞”或“nrp”是指其分化潜能限于神经视网膜细胞类型的细胞。
术语“光感受器前体细胞”和“prp”细胞是指从胚胎干细胞或诱导性多能干细胞分化来的细胞,其可以分化成光感受器细胞,所述光感受器细胞表达细胞标志物视紫红质或三种视锥视蛋白中的任一种,以及任选地表达视杆或视锥cgmp。光感受器可以是视杆和/或视锥光感受器。
术语“视泡”或“ov”是指细胞聚集体或类器官,包括prp细胞聚集体,具有包括视泡结构的形态学。
“视网膜色素上皮细胞”是指脉络膜(充满血管的层)和神经视网膜之间的一层色素细胞。
“视网膜诱导培养基(rim)”在本文中是指包含wnt途径抑制剂和bmp途径抑制剂并且可以导致psc向视网膜谱系细胞分化的生长培养基。rim还包含tgfβ途径抑制剂,并且可以包含igf-1和抗坏血酸。
“视网膜分化培养基(rd)”在本文中定义为包含wnt抑制剂、tgfβ抑制剂和mek抑制剂并分化前神经外胚层细胞的培养基。rdm可以包含(即,rd1)或不包含(即,rd2)bmp抑制剂,并且可以包含igf-1和抗坏血酸。
“视网膜成熟培养基(rm)”定义为用于培养视网膜细胞的包含烟酰胺和抗坏血酸的生长培养基。rm优选地不含激活素a。rm可以包含(即,rm1)或不包含(即,rm2)γ分泌酶抑制剂,诸如dapt,或tgfβ抑制剂,诸如sb431542,并且可以包含igf-1和抗坏血酸。
“prp成熟培养基(pm)”在本文中是指用于培养prp细胞的包含烟酰胺和γ分泌酶抑制剂(诸如dapt)的生长培养基。pm可以包含(即,pm1)或不包含(即,pm2)cdk抑制剂,诸如pd0332291,tgf-β途径激活物,诸如激活素a,或有丝分裂原,诸如维甲酸。
“光感受器前体诱导培养基(fdsc)”是指包含tgfβ抑制剂、wnt抑制剂和γ-分泌酶抑制剂的生长培养基。fdsc可以包含碱性fgf和抗坏血酸。
术语“视网膜变性相关疾病”意在指由先天性或后天性视网膜变性或异常引起的任何疾病。视网膜变性相关疾病的实例包括视网膜发育不良、视网膜变性、年龄相关黄斑变性、糖尿病视网膜病变、视网膜色素变性、先天性视网膜营养不良、leber先天性黑朦、视网膜脱离、青光眼、视神经病变和创伤。
本文使用的“治疗有效量”是指当向受试者施用以治疗疾病或病症时足以影响此类治疗的化合物的量。
ii.多能干细胞
a.胚胎干细胞
es细胞来源于胚泡的内细胞团并具有高的体外分化能力。可以通过除去发育胚胎的外滋养层,然后在非生长细胞的饲养层上培养内细胞团来分离es细胞。重新铺板的细胞可以继续增殖并产生新的es细胞集落,其可以被移出、解离、再次重新铺板并使其生长。这种“传代培养”未分化es细胞的过程可以重复许多次以产生含有未分化es细胞的细胞系(美国专利号5,843,780;6,200,806;7,029,913)。
产生小鼠es细胞的方法是众所周知的。在一种方法中,将来自129小鼠品系的植入前胚泡用小鼠抗血清处理以除去滋养外胚层,并将内细胞团在含有胎牛血清的培养基中在化学灭活的小鼠胚胎成纤维细胞的饲养细胞层上培养。在胎牛血清存在下,在小鼠胚胎成纤维细胞饲养层上将发育的未分化es细胞的集落传代培养以产生es细胞群体。在一些方法中,通过将细胞因子白血病抑制因子(lif)加入含血清培养基,可以在没有饲养层的情况下使小鼠es细胞生长(smith,2000)。在其他方法中,小鼠es细胞可以在骨形态发生蛋白和lif的存在下在无血清培养基中生长(ying等人,2003)。
人es细胞可以由受精卵或胚泡阶段的哺乳动物胚胎产生或衍生,所述哺乳动物胚胎如下产生:通过先前描述的方法(thomson和marshall,1998;reubinoff等人,2000),融合精子和卵细胞、核转移、孤雌生殖(pathogenesis)或染色质重编程以及随后将重编程的染色质掺入到质膜中以产生胚胎细胞。在一种方法中,将人胚泡暴露于抗人血清,将滋养外胚层细胞裂解并将其从内细胞团中除去,将内细胞团在小鼠胚胎成纤维细胞的饲养层上培养。此外,来自内细胞团的细胞块被化学或机械解离、重新铺板,并且通过微量移液器选择具有未分化形态的集落,将其解离并重新铺板(美国专利号6,833,269)。在一些方法中,通过在碱性成纤维细胞生长因子存在下在成纤维细胞的饲养层上培养es细胞,可以在没有血清的情况下生长人es细胞(amit等人,2000)。在其他方法中,通过在包含碱性成纤维细胞生长因子的“条件化”培养基的存在下在蛋白质基质例如matrigeltm或层粘连蛋白上培养细胞,可以在没有饲养细胞层的情况下生长人es细胞(xu等人,2001)。
通过先前描述的方法(thomson和marshall,1998;thomson等人,1995;thomson和odorico,2000),es细胞也可以来源于其他生物,包括恒河猴和绒猴,以及来源于已建立的小鼠和人细胞系。例如,已建立的人es细胞系包括maoi、ma09、act-4、hi、h7、h9、h13、h14和act30。作为另一个实例,已经建立的小鼠es细胞系包括从小鼠品系129胚胎的内细胞团建立的cgr8细胞系,并且cgr8细胞的培养物可以在没有饲养层的情况下在lif的存在下生长。
es干细胞可以通过蛋白质标志物来检测,包括转录因子oct4、碱性磷酸酶(ap)、阶段特异性胚胎抗原ssea-1、阶段特异性胚胎抗原ssea-3、阶段特异性胚胎抗原ssea-4、转录因子nanog、肿瘤排斥抗原1-60(tra-1-60)、肿瘤排斥抗原1-81(tra-1-81)、sox2或rex1。
b.诱导性多能干细胞
多能性的诱导最初是在2006年使用小鼠细胞(yamanaka等人,2006)和2007年使用人细胞(yu等人,2007;takahashi等人,2007)通过引入与多能性相关的转录因子重编程体细胞来实现的。多能干细胞可以保持未分化状态并可以分化成任何成体细胞类型。
除了生殖细胞之外,任何体细胞都可以用作ipsc的起点。例如,细胞类型可以是角质形成细胞、成纤维细胞、造血细胞、间充质细胞、肝细胞或胃细胞。t细胞也可以用作重编程的体细胞来源(美国专利号8,741,648)。对细胞分化的程度或收集细胞的动物的年龄没有限制;甚至未分化的祖细胞(包括成体干细胞)和最终分化的成熟细胞可以用作本文公开的方法中的体细胞的来源。在一个实施方案中,体细胞本身是prp细胞,诸如人prp细胞。prp细胞可以是成人或胎儿prp细胞。ipsc可以在已知将人es细胞分化成特定细胞类型的条件下生长,并表达人es细胞标志物,所述标志物包括:ssea-1、ssea-3、ssea-4、tra-1-60和tra-1-81。
可以使用本领域技术人员已知的方法将体细胞重编程以产生诱导性多能干细胞(ipsc)。本领域技术人员可以容易地产生诱导性多能干细胞,参见例如公开的美国专利申请号20090246875,公开的美国专利申请号2010/0210014;公布的美国专利申请号20120276636;美国专利号8,058,065;美国专利号8,129,187;美国专利号8,278,620;pct公开号wo2007/069666a1和美国专利号8,268,620,它们通过引用并入本文。通常,核重编程因子用于从体细胞产生多能干细胞。在一些实施方案中,利用klf4、c-myc、oct3/4、sox2、nanog和lin28中的至少两种、至少三种或至少四种。在其他实施方案中,利用oct3/4、sox2、c-myc和klf4。
用核重编程物质处理细胞,所述核重编程物质通常是能够从体细胞诱导ipsc的一种或多种因子或编码这些物质的核酸(包括整合入载体中的形式)。核重编程物质通常至少包括oct3/4、klf4和sox2或编码这些分子的核酸。p53的功能性抑制剂,l-myc或编码l-myc的核酸,和lin28或lin28b或编码lin28或lin28b的核酸,可用作另外的核重编程物质。nanog也可以用于核重新编程。如公开的美国专利申请号20120196360中所公开的,用于产生ipsc的示例性重编程因子包括:(1)oct3/4、klf4、sox2、l-myc(sox2可以被sox1、sox3、sox15、sox17或sox18替换;klf4可用klf1、klf2或klf5替换);(2)oct3/4、klf4、sox2、l-myc、tert、sv40大t抗原(sv40lt);(3)oct3/4、klf4、sox2、l-myc、tert、人乳头瘤病毒(hpv)16e6;(4)oct3/4、klf4、sox2、l-myc、tert、hpv16e7;(5)oct3/4、klf4、sox2、l-myc、tert、hpv16e6、hpv16e7;(6)oct3/4、klf4、sox2、l-myc、tert、bmil;(7)oct3/4、klf4、sox2、l-myc、lin28;(8)oct3/4、klf4、sox2、l-myc、lin28、sv40lt;(9)oct3/4、klf4、sox2、l-myc、lin28、tert、sv40lt;(10)oct3/4、klf4、sox2、l-myc、sv40lt;(11)oct3/4、esrrb、sox2、l-myc(esrrb可用esrrg替换);(12)oct3/4、klf4、sox2;(13)oct3/4、klf4、sox2、tert、sv40lt;(14)oct3/4、klf4、sox2、tert、hpvi6e6;(15)oct3/4、klf4、sox2、tert、hpv16e7;(16)oct3/4、klf4、sox2、tert、hpv16e6、hpv16e7;(17)oct3/4、klf4、sox2、tert、bmil;(18)oct3/4、klf4、sox2、lin28;(19)oct3/4、klf4、sox2、lin28、sv40lt;(20)oct3/4、klf4、sox2、lin28、tert、sv40lt;(21)oct3/4、klf4、sox2、sv40lt;或(22)oct3/4、esrrb、sox2(esrrb可用esrrg替换)。在一个非限制性实例中,使用oct3/4、klf4、sox2和c-myc。在其他实施方案中,使用oct4、nanog和sox2,参见例如美国专利号7,682,828,其通过引用并入本文。这些因子包括但不限于oct3/4、klf4和sox2。在其他实例中,这些因子包括但不限于oct3/4、klf4和myc。在一些非限制性实例中,使用oct3/4、klf4、c-myc和sox2。在其他非限制性实例中,使用oct3/4、klf4、sox2和sal4。类似nanog、lin28、klf4或c-myc的因子可以提高重编程效率,并且可以从几种不同的表达载体表达。例如,可以使用整合载体诸如基于ebv元件的系统(美国专利号8,546,140)。在进一步的方面,重编程蛋白质可通过蛋白质转导直接导入体细胞。重编程可以进一步包括使细胞与一种或多种信号传导受体接触,所述信号传导受体包括糖原合酶激酶3(gsk-3)抑制剂、促分裂原活化蛋白激酶激酶(mek)抑制剂、转化生长因子β(tgf-β)受体抑制剂或信号传导抑制剂、白血病抑制因子(lif)、p53抑制剂、nf-κb抑制剂或其组合。那些调节剂可以包括小分子、抑制性核苷酸、表达盒或蛋白质因子。预期的是几乎可以使用任何ips细胞或细胞系。
这些核重编程物质的小鼠和人cdna序列可参考wo2007/069666中提及的ncbi登录号获得,该专利申请通过引用并入本文。用于引入一种或多种重编程物质或编码这些重编程物质的核酸的方法是本领域已知的,并且公开于例如公布的美国专利申请号2012/0196360和美国专利号8,071,369中,两者均通过引用并入本文。
一经获得,可以在足以维持多能性的培养基中培养ipsc。如美国专利号7,442,548和美国专利公开号2003/0211603中所述,ipsc可与被开发用来培养多能干细胞(更具体而言胚胎干细胞)的各种培养基和技术一起使用。在小鼠细胞的情况下,通过向普通培养基中加入作为分化抑制因子的白血病抑制因子(lif)进行培养。在人细胞的情况下,期望加入碱性成纤维细胞生长因子(bfgf)来代替lif。可以使用本领域技术人员已知的用于培养和维持ipsc的其他方法。
在某些实施方案中,可以使用未限定的条件;例如,多能细胞可以在成纤维细胞饲养细胞或已暴露于成纤维细胞饲养细胞的培养基上培养,以保持干细胞处于未分化状态。在一些实施方案中,将细胞在用辐射或抗生素处理以终止细胞分裂的小鼠胚胎成纤维细胞(作为饲养细胞)的共存下培养。可选地,可以使用确定成分的不依赖饲养细胞的培养系统(诸如tesrtm培养基(ludwig等人,2006a;ludwig等人,2006b)或e8tm培养基(chen等人,2011))培养多能细胞并维持于基本上未分化的状态。
在一些实施方案中,可以修饰ipsc以表达外源核酸,诸如以包括与启动子可操作连接的增强子和编码第一标志物的核酸序列。合适的启动子包括但不限于,在光感受器细胞中表达的任何启动子,诸如视紫红质激酶启动子。构建体还可以包括其他元件,诸如用于翻译起始的核糖体结合位点(内部核糖体结合序列)和转录/翻译终止子。通常,用构建体转染细胞是有利的。用于稳定转染的合适载体包括但不限于逆转录病毒载体、慢病毒载体和仙台病毒。
在一些实施方案中,编码标志物的质粒由以下组成:(1)高拷贝数复制起点,(2)选择性标志物,诸如但不限于用卡那霉素进行抗生素选择的neo基因,(3)转录终止序列,包括酪氨酸酶增强子和(4)用于掺入各种核酸盒的多克隆位点;和(5)编码与酪氨酸酶启动子可操作连接的标志物的核酸序列。本领域已知许多质粒载体用于诱导编码蛋白质的核酸。这些包括但不限于美国专利号6,103,470;美国专利号7,598,364;美国专利号7,989,425;和美国专利号6,416,998中公开的载体,它们通过引用并入本文。
病毒基因递送系统可以是基于rna或基于dna的病毒载体。游离基因递送系统可以是质粒,基于epstein-barr病毒(ebv)的游离型载体,基于酵母的载体,基于腺病毒的载体,基于猿猴病毒40(sv40)的游离型载体,基于牛乳头瘤病毒(bpv)的载体或慢病毒载体。
标志物包括但不限于荧光蛋白(例如,绿色荧光蛋白或红色荧光蛋白),酶(例如辣根过氧化物酶或碱性磷酸酶或萤火虫/海肾荧光素酶或nanoluc)或其他蛋白质。标志物可以是蛋白质(包括分泌的、细胞表面或内部蛋白质;合成的或被细胞摄取的);核酸(诸如mrna或酶活性核酸分子)或多糖。包括可通过抗体、凝集素、探针或核酸扩增反应检测到的对感兴趣的细胞类型的标志物特异的任何此类细胞组分的决定子。标志物也可以通过取决于基因产物功能的生物化学或酶测定或生物反应来鉴定。编码这些标志物的核酸序列可以与酪氨酸酶增强子可操作地连接。此外,还可以包括其他基因,诸如可能影响干细胞向prp的分化或光感受器功能或生理学或病理学的基因。
1.mhc单倍型匹配
主要组织相容性复合体(mhc)是同种异体器官移植物的免疫排斥的主要原因。有三种主要的i类mhc单倍型(a,b和c)和三种主要的mhcii类单倍型(dr,dp和dq)。hla基因座具有高度多态性,并且分布在第6号染色体上的4mb长度上。在该区域内对hla基因进行单倍型分型的能力在临床上很重要,因为该区域与自身免疫疾病和感染性疾病相关并且供体和受体之间hla单倍型的相容性可以影响移植的临床结果。对应于mhci类的hla从细胞内呈递肽,对应于mhcii类的hla从细胞外呈递抗原至t淋巴细胞。mhc单倍型在移植物和宿主之间的不相容性引发针对移植物的免疫应答并导致其排斥。因此,可以用免疫抑制剂治疗患者以防止排斥反应。hla匹配的干细胞系可以克服免疫排斥的风险。
由于hla在移植中的重要性,hla基因座通常通过血清学和聚合酶链式反应(pcr)分型,以鉴定有利的供体-受体对。使用利用纯化的t或b淋巴细胞的补体介导的淋巴细胞毒性试验可以完成hlai类和ii类抗原的血清学检测。该程序主要用于匹配hla-a和-b基因座。基于分子的组织分型通常比血清学检测更准确。低分辨率分子方法诸如ssop(序列特异性寡核苷酸探针)方法(其中pcr产物针对一系列寡核苷酸探针进行测试)可用于鉴定hla抗原,并且目前这些方法是用于ii类-hla分型的最常用方法。高分辨率技术如ssp(序列特异性引物)方法(其使用等位基因特异性引物进行pcr扩增)可鉴定特定的mhc等位基因。
如果供体细胞是hla纯合的,即含有每个抗原呈递蛋白质的相同的等位基因,则供体和接受者之间的mhc相容性显著增加。大多数个体对于mhci类和ii类基因是杂合的,但是某些个体对于这些基因是纯合的。这些纯合个体可以作为超级供体,由其细胞产生的移植物可以移植到所有对该单倍型纯合或杂合的个体中。此外,如果纯合供体细胞具有群体中高频率的单倍型,则这些细胞可用于大量个体的移植治疗。
因此,可以从待治疗的受试者的体细胞或具有与患者的hla类型相同或基本相同的hla类型的另一个受试者产生ipsc。在一种情况下,供体的主要hla(例如hla-a、hla-b和hla-dr的三个主要基因座)与受体的主要hla相同。在一些情况下,体细胞供体可能是超级供体;因此,来源于mhc纯合超级供体的ipsc可用于产生prp细胞。因此,来自超级供体的ipsc可以被移植到对该单倍型纯合或杂合的受试者中。例如,ipsc可以在两个hla等位基因(例如hla-a和hla-b)上是纯合的。如此,由超级供体产生的ipsc可用于本文所公开的方法中,以产生可潜在地“匹配”大量潜在接受者的prp细胞。
2.游离型载体
在某些方面,重编程因子从包含在一种或多种外源游离型遗传元件中的表达盒表达(参见美国专利公开2010/0003757,通过引用并入本文)。因此,ipsc可以基本上不含外源遗传元件,诸如不含来自逆转录病毒或慢病毒载体的元件。这些ipsc通过使用染色体外复制载体(即游离型载体)来制备,所述载体是能够游离地复制以使ipsc基本上不含外源载体或病毒元件(参见美国专利号8,546,140,通过引用并入本文;yu等人,2009)。许多dna病毒,诸如腺病毒、猿猴空泡病毒40(sv40)或牛乳头瘤病毒(bpv)或包含出芽酵母ars(自主复制序列)的质粒在哺乳动物细胞中在染色体外或游离地复制。这些游离型质粒固有地没有与整合载体相关的所有这些缺点(bode等人,2001)。例如,如上定义的基于淋巴疱疹病毒(包括epsteinbarr病毒(ebv))的那些质粒可以在染色体外复制并帮助将重编程基因递送到体细胞。有用的ebv元件是orip和ebna-1,或其变体或功能等同物。游离型载体的另一个优点是外源性元件在被引入细胞后会随着时间流逝而丢失,导致自我维持的ipsc基本上不含这些元件。
其他染色体外载体包括其他基于淋巴疱疹病毒的载体。淋巴疱疹病毒是在淋巴母细胞(例如人b淋巴母细胞)中复制并成为持续其天然生命周期的一部分的质粒的疱疹病毒。单纯疱疹病毒(hsv)不是“嗜淋巴的”疱疹病毒。示例性的淋巴疱疹病毒包括但不限于ebv,卡波西肉瘤疱疹病毒(kshv);松鼠猴疱疹病毒(hs)和马立克氏病病毒(mdv)。还设想了基于游离体的载体的其他来源,如酵母ars、腺病毒、sv40或bpv。
c.体细胞核转移
多能干细胞可以通过体细胞核转移的方法制备。体细胞核移植涉及将供体细胞核转移至无纺锤体卵母细胞中。在一种方法中,通过电融合将来自恒河猴的皮肤成纤维细胞的供体成纤维细胞核引入无纺锤体的成熟中期ii恒河猕猴卵母细胞的细胞质中(byrne等人,2007)。融合的卵母细胞通过暴露于伊屋诺霉素而被激活,然后孵育直至胚泡阶段。然后培养选定胚泡的内细胞团以产生胚胎干细胞系。胚胎干细胞系显示正常的es细胞形态,表达各种es细胞标志物,并在体外和体内分化成多种细胞类型。
iii.光感受器前体细胞
在一些实施方案中,在本文公开的方法中产生了神经视网膜祖(nrp)细胞、光感受器前体(prp)细胞或视泡(ov)。视网膜中对光直接敏感的细胞是光感受器细胞。光感受器是视网膜外部的感光神经元,其可以是视杆细胞或视锥细胞。在光转导的过程中,光感受器细胞将由晶体聚焦的入射光能量转换为电信号,然后电信号通过视神经送入脑。脊椎动物有两种类型的光感受器细胞,包括视锥和视杆细胞。视锥细胞适用于检测细节、中央和色彩视觉,并在亮光下正常工作。视杆细胞负责周边和昏暗的光视觉。来自视杆和视锥细胞的神经信号经过视网膜的其他神经元处理。
prp细胞可以表达诸如下列的标志物:otx2、crx、prdm1(blimp1)、neurod1、rcvrn、tubb3和l1cam(cd171)。prp细胞表达的几种蛋白质可以用作用于通过使用诸如免疫细胞化学、western印迹分析、流式细胞术或酶联免疫测定(elisa)的方法检测的标志物。例如,一种特征性的prp标志物是rcvrn。prp细胞可以不表达(在任何可检测的水平上)胚胎干细胞标志物oct-4、nanog或rex-1。具体而言,当通过定量rt-pcr评估时,这些基因在es细胞或ipsc细胞中的表达比在prp细胞中的表达低约100-1000倍。
可以例如通过逆转录酶聚合酶链式反应(rt-pcr)、northern印迹分析或点印迹杂交分析在标准扩增方法中使用序列特异性引物利用公共可用的序列数据
光感受器细胞的功能障碍、损伤和丧失是许多眼病和病症(包括年龄相关性黄斑变性(amd)、遗传性黄斑变性(包括贝斯特病)和视网膜色素变性)的因素。对这些疾病的潜在治疗是将prp细胞或光感受器细胞移植到需要这种治疗的人的视网膜中。据推测,通过移植补充prp细胞或光感受器细胞可以延迟、阻止或逆转退化,改善视网膜功能并防止由这些状况引起的失明。然而,直接从人供体和胚胎获得prp细胞或光感受器细胞是个挑战。
在一些实施方案中,提供了从psc诸如人ipsc的基本上单个细胞的悬液产生prp细胞的方法。在一些实施方案中,将psc培养至汇合前以防止任何细胞聚集体。在某些方面,通过与如乙二胺四乙酸(versene)、胰蛋白酶、accutasetm或trypletm所例示的细胞解离溶液或酶孵育来解离psc。通过移液管抽吸也可将psc解离成基本上单个细胞的悬液。
另外,可以将blebbistatin(例如,约2.5μm)加入培养基中以在解离成单个细胞后增加psc存活,同时细胞不粘附于培养容器。替代blebbistatin的rock抑制剂可以替代地用于在解离成单个细胞后增加psc存活。
为了有效区分prp细胞与单细胞psc,输入密度的准确计数可以增加prp分化效率。因此,psc的单细胞悬液通常在接种之前计数。例如,通过血细胞计数器或自动化细胞计数器(诸如
一旦在已知的细胞密度下获得了psc的单细胞悬液,通常将细胞接种在合适的培养容器中,诸如组织培养板如烧瓶,6孔板、24孔板或96孔板。用于培养细胞的培养容器可以包括但不限于:烧瓶,用于组织培养的烧瓶,皿,皮氏培养皿,用于组织培养的皿,多皿(multidish),微量板,微孔板,多板(multiplate),多孔板,微型载玻片,腔室载玻片,管,托盘,
在某些方面,psc诸如ipsc以适于有效分化的细胞密度铺板。通常,细胞以约1,000至约75,000个细胞/cm2,诸如约5,000至约40,000个细胞/cm2的细胞密度铺板。在6孔板中,细胞可以以每孔约50,000至约400,000个细胞的细胞密度接种。在示例性方法中,细胞以每孔约100,000、约150,000、约200,000、约250,000、约300,000或约350,000个细胞的细胞密度接种,诸如每孔约200,000个细胞。
通常将psc诸如ipsc培养在用一种或多种细胞粘附蛋白包被的培养板上以促进细胞粘附,同时维持细胞活力。例如,优选的细胞粘附蛋白包括细胞外基质蛋白,诸如玻连蛋白、层粘连蛋白、胶原蛋白和/或纤连蛋白,其可用于包被培养表面,作为为多能细胞生长提供固体支持物的手段。术语“细胞外基质(ecm)”在本领域中是公知的。它的组分可以包括但不限于以下蛋白质中的一种或多种:纤连蛋白、层粘连蛋白、玻连蛋白、生腱蛋白、巢蛋白(entactin)、血小板反应蛋白、弹性蛋白、明胶、胶原蛋白、原纤蛋白、分层蛋白(merosin)、锚蛋白、软骨粘连蛋白、连接蛋白、骨涎蛋白、骨钙蛋白、骨桥蛋白、epinectin、透明质粘连蛋白、粗纤维调节素(undulin)、表皮整联配体蛋白(epiligrin)和缰蛋白(kalinin)。其他ecm组分可以包括用于粘附的合成肽(例如,rgd或ikvav基序),合成水凝胶(例如,peg、plga等)或天然水凝胶,诸如藻酸盐。在示例性的方法中,psc生长在包被有玻连蛋白的培养板上。在一些实施方案中,所述细胞粘附蛋白是人蛋白。
细胞外基质蛋白可以是天然来源的并且从人或动物组织纯化,或者,备选地,ecm蛋白可以是遗传改造的重组蛋白或天然合成的。ecm蛋白可以是完整的蛋白质或以天然或工程化的肽片段的形式。可用于细胞培养基质中的ecm蛋白的实例包括层粘连蛋白、胶原蛋白i、胶原蛋白iv、纤连蛋白和玻连蛋白。在一些实施方案中,基质组合物是无异源的。例如,在培养人细胞的无异源基质中,可以使用人源的基质组分,其中可以排除任何非人动物组分。
在一些方面,基质组合物中的总蛋白质浓度可以是约1ng/ml至约1mg/ml。在一些优选的实施方案中,基质组合物中的总蛋白质浓度为约1μg/ml至约300μg/ml。在更优选的实施方案中,基质组合物中的总蛋白质浓度为约5μg/ml至约200μg/ml。
诸如prp细胞或psc的细胞可以与支持每种特定细胞群体生长所必需的营养素一起培养。通常,细胞在包括碳源、氮源和缓冲液的生长培养基中培养以保持ph。培养基还可以含有脂肪酸或脂质、氨基酸(如非必需氨基酸)、维生素、生长因子、细胞因子、抗氧化物质、丙酮酸、缓冲剂、ph指示剂和无机盐。示例性的生长培养基包含补充有各种营养素(诸如非必需氨基酸和维生素)以增强干细胞生长的极限必需培养基,诸如dulbecco改良eagle培养基(dmem)或essential8tm(e8tm)培养基。极限必需培养基的实例包括但不限于极限必需培养基eagle(mem)alpha培养基、dulbecco改良eagle培养基(dmem)、rpmi-1640培养基、199培养基和f12培养基。备选地,极限必需培养基可补充添加剂,诸如马、小牛或胎牛血清。备选地,培养基可以不含血清。在其他情况下,生长培养基可以含有“敲除血清替代物”,在本文中是指经过优化以在培养物中生长和维持未分化细胞诸如干细胞的无血清制剂。例如,在美国专利申请号2002/0076747中公开了knockouttm血清替代物,该申请通过引用并入本文。优选地,psc在完全确定成分的和无饲养层的培养基中培养。
因此,单细胞psc通常在铺板后在完全确定成分的培养基中培养。在某些方面,接种后约18-24小时,吸出培养基并将新鲜培养基诸如e8tm培养基加入到培养物中。在某些方面,在铺板后将单细胞psc在完全确定成分的培养基中培养约1天、2天或3天。优选地,在继续进行分化过程之前,将单细胞psc在完全确定成分的培养基中培养约2天。
在一些实施方案中,培养基可以含有或可以不含有血清的任何替代物。血清的替代物可以包括适当含有白蛋白的材料(诸如富含脂质的白蛋白,白蛋白替代物诸如重组白蛋白,植物淀粉,葡聚糖和蛋白质水解物),转铁蛋白(或其他铁转运蛋白),脂肪酸,胰岛素,胶原前体,微量元素,2-巯基乙醇,3'-硫代甘油或其等同物。例如,血清的替代物可以通过国际公开号wo98/30679中公开的方法制备。备选地,可以更方便地使用任何市售材料。市售材料包括knockouttm血清替代物(ksr),化学确定的浓缩脂质(gibco)和glutamaxtm(gibco)。
其他培养条件可以被适当地限定。例如,培养温度可以是约30至40℃,例如,至少或约31、32、33、34、35、36、37、38、39℃,但是不特定地限制于此。在一个实施方案中,细胞在37℃培养。co2浓度可以是约1至10%,例如,约2至5%,或者其中可衍生的任何范围。氧张力可以是至少,至多,或约1、2、3、4、5、6、7、8、9、10、20%或其中可衍生的任何范围。
a.分化培养基
视网膜诱导培养基
在单细胞psc粘附于培养板之后,优选将细胞在视网膜诱导培养基(rim)中培养以开始分化为视网膜谱系细胞的过程。rim包含wnt途径抑制剂并可导致psc向视网膜谱系细胞分化。rim另外包含tgfβ途径抑制剂和bmp途径抑制剂。表1中示出了一种示例性的rim培养基。
rim可以包括约1:1比例的dmem和f12。在示例性方法中,rim中包含wnt途径抑制剂,诸如cki-7,包含bmp途径抑制剂,诸如ldn193189,并包含tgfβ途径抑制剂,诸如sb431542。例如,rim包含约5nm至约50nm,诸如约10nm的ldn193189,约0.1μm至约5μm,诸如约0.5μm的cki-7和约0.5μm至约10μm,诸如约1μm的sb431542。另外,rim可包含敲除血清替代物,诸如约1%至约5%的mem非必需氨基酸(neaa)、丙酮酸钠、n-2补充剂、b-27补充剂、抗坏血酸和胰岛素生长因子1(igf1)。优选地,igf1是无动物igf1(af-igf1)并且以约0.1ng/ml至约10ng/ml,诸如约1ng/ml包含在rim中。培养基每天吸出,并更换为新鲜的rim。通常将细胞在rim中培养约1至约5天,诸如约1、2、3、4或5天,诸如约2天以产生前神经外胚层细胞。
视网膜分化培养基
然后可以在视网膜分化培养基(rd)中培养前神经外胚层细胞以进一步分化。rd包含wnt途径抑制剂、tgfβ途径抑制剂和mek抑制剂。在一个实施方案中,rd包含wnt途径抑制剂诸如cki-7,任选地包含bmp途径抑制剂诸如ldn193189,tgfβ途径抑制剂诸如sb431542,和mek抑制剂诸如pd0325901。通常,与rim相比,rdm中wnt途径抑制剂、bmp途径抑制剂和tgfβ途径抑制剂的浓度更高,诸如是rim中的浓度的约9至约11倍,诸如约10倍。在示例性方法中,rd包含约50nm至约200nm,诸如约100nm的ldn193189,约1μm至约10μm,诸如约5μm的cki-7,约1μm至约50μm,诸如约10μm的sb431542,和约0.1μm至约10μm,诸如约1μm、2μm、3μm、4μm、5μm、6μm、7μm、8μm或9μm的pd0325901。表1中示出了示例性的rd。
在一些方面,细胞可以首先在bmp抑制剂诸如ldn1913189的存在下分化持续一段时间,然后在缺少bmp抑制剂的条件下分化。首先,将前神经外胚层细胞培养在包含bmp途径抑制剂,诸如ldn193189的rd1中持续约1-3天,诸如2天。下一步,将细胞培养在不包含bmp途径抑制剂的rd2中。第二步可以持续约5-10天,诸如约7天,以继续分化前神经外胚层细胞。发现此方法增加了在后续产生的prp细胞中vsx2的表达。vsx2是视泡和视杯内神经rpc的最早特异性标志物(rowan,等人,2004)。vsx2+视网膜祖细胞可以产生神经视网膜的全部细胞类型:视锥细胞、视杆细胞、神经节细胞、无长突细胞、双极细胞、水平细胞和muller胶质细胞(mullerglia)。
通常,rd包含约1:1比例的dmem和f12、敲除血清替代物(例如约1%至约5%,诸如约1.5%)、memneaa、丙酮酸钠、n-2补充剂、b-27补充剂、抗坏血酸和igf1(例如,约1ng/ml至约50ng/ml,诸如约10ng/ml)。在特定的方法中,吸出前一天的培养基后每天给予细胞新鲜的rd。通常,将细胞在rdm中培养约2、3、4、5、6、7、8、9、10、11、12、13、14、15或16天,诸如约7天以使前神经外胚层细胞朝向rpc分化。
视网膜成熟培养基
下一步,前神经外胚层细胞可以通过将细胞培养在视网膜成熟培养基(rm)中进一步分化和扩增以产生rpc。rm可以包含烟酰胺。rm可以包含约1mm至约50mm,诸如约10mm的烟酰胺。rm可以进一步包含抗坏血酸,诸如50-500μm,特别是约100-300μm,诸如约200μm。优选地,rm不含或基本上不含激活素a。在表1中示出了示例性的rm培养基。rm(例如,rm2)可以进一步包含γ-分泌酶抑制剂,诸如dapt,碱性fgf,和/或tgfβ通路抑制剂,诸如sb431542。
rm可以包含约1:1比例的dmem和f12、约1%至约5%诸如约1.5%的敲除血清替代物、mem非必需氨基酸(neaa)、丙酮酸钠、n-2补充剂、b-27补充剂和抗坏血酸。培养基可以以室温rm每天更换一次。通常将细胞在rm中培养约8、9、10、11、12、13、14、15、16或17天,诸如约10天以得到扩增的rpc。
prp成熟培养基(pm)
prp可以在prp成熟培养基(pm)中成熟。表1中示出了示例性的pm培养基。pm培养基包含抗坏血酸、烟酰胺和γ-分泌酶抑制剂,诸如dapt(例如,约1μm至约10μm,诸如约5μm的dapt)。pm(例如,pm2)还可以包含cdk抑制剂,诸如cdk4/6抑制剂,诸如pd0332991(例如,约1μm至约50μm,诸如约10μm的pd0332991)。
pm培养基可以包含约1:1比例的dmem和f12、约1%至约5%诸如约1.5%的敲除血清替代物、mem非必需氨基酸(neaa)、丙酮酸钠、n-2补充剂、b-27补充剂和抗坏血酸。培养基可以以室温pm培养基每天更换一次。通常将细胞在pm培养基中培养约4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天,诸如约10天以得到成熟的prp细胞。
光感受器前体诱导培养基(fdsc)
为进一步分化rpc,细胞优选地在fdsc培养基中培养。表1中示出了示例性的fdsc培养基。fdsc培养基包含wnt途径抑制剂、γ-分泌酶抑制剂和tgfβ途径抑制剂。在一个实施方案中,fdsc包含wnt途径抑制剂,诸如cki-7,tgfβ途径抑制剂,诸如sb431542,和γ-分泌酶抑制剂,诸如dapt。在示例性的方法中,fdsc培养基包含约1μm至约10μm,诸如约5μm的cki-7,约1μm至约50μm,诸如约10μm的sb431542,和约1μm至约10μm,诸如约5μm的dapt。fdsc还可以包含碱性fgf。
fdsc培养基可以包含约1:1比例的dmem和f12、约1%至约5%诸如约1.5%的敲除血清替代物、mem非必需氨基酸(neaa)、丙酮酸钠、n-2补充剂、b-27补充剂和抗坏血酸。另外,培养基可以包含碱性fgf,诸如约5ng/ml至约15ng/ml,诸如约10ng/ml。培养基可以以室温fdsc培养基每天更换一次。通常将细胞在fdsc中培养约10、11、12、13、14、15、16、17、18、19或20天,诸如约15天以得到prp细胞。
表1:示例性的培养基组分
另外,可以将blebbistatin(例如,约2.5μm)加入至培养基以增加prp存活率并通过促进聚集体形成而维持纯度。可以备选地使用rock抑制剂代替blebbistatin以增加prp解离成单一细胞后的存活率,诸如通过使用trypletm。
可以培养prp聚集体以产生混杂光感受器细胞或视泡。
b.prp细胞的冷冻保存
通过本文公开的方法产生的光感受器前体细胞可以冷冻保存,参见例如pct公开号2012/149484a2,其通过引用并入本文。细胞可以用或不用基底进行冷冻保存。在几个实施方案中,储存温度的范围为约-50℃至约-60℃,约-60℃至约-70℃,约-70℃至约-80℃,约-80℃至约-90℃,约-90℃至约-100℃,以及其重叠的范围。在一些实施方案中,较低温度用于冷冻保存的细胞的储存(例如维持)。在几个实施方案中,使用液氮(或其他类似的液体冷却剂)来储存细胞。在进一步的实施方案中,细胞储存持续大于约6小时。在另外的实施方案中,细胞储存约72小时。在几个实施方案中,细胞储存48小时至约一周。在其他实施方案中,细胞储存持续约1、2、3、4、5、6、7或8周。在进一步的实施方案中,细胞储存持续1、2、3、4、5、6、7、8、9、10、11或12个月。细胞也可以储存持续更长的时间。可以将细胞分开冷冻保存或冷冻保存在基底上,诸如本文公开的任何基底。
在一些实施方案中,可以使用额外的冷冻保护剂。例如,细胞可以在包含一种或多种冷冻保护剂诸如dm80、血清白蛋白诸如人或牛血清白蛋白的冷冻保存溶液中冷冻保存。在某些实施方案中,所述溶液包含约1%、约1.5%、约2%、约2.5%、约3%、约4%、约5%、约6%、约7%、约8%、约9%或约10%的dmso。在其它实施方案中,所述溶液包含约1%至约3%、约2%至约4%、约3%至约5%、约4%至约6%、约5%至约7%、约6%至约8%、约7%至约9%或约8%至约10%的二甲基亚砜(dmso)或白蛋白。在具体实施方案中,所述溶液包含2.5%dmso。在另一个具体实施方案中,所述溶液包含10%dmso。
例如,可以在冷冻保存过程中以约1℃/分钟冷却细胞。在一些实施方案中,冷冻保存温度为约-80℃至约-180℃,或约-125℃至约-140℃。在一些实施方案中,将细胞冷却至4℃,然后以约1℃/分钟冷却。冷冻保存的细胞可以在解冻使用前转移到液氮的气相中。在一些实施方案中,例如,一旦细胞达到约-80℃,它们被转移到液氮储存区域。冷冻保存也可以使用控制速率的冷冻机完成。可以将冷冻保存的细胞解冻,例如在约25℃至约40℃的温度下,通常在约37℃的温度下。
备选地,细胞可以作为聚集体冷冻保存,无需解离为单细胞悬液。例如,在prp富集后,可以使单细胞在组织培养瓶中在极限培养基(rmn)中重新聚集两天。可以汇集聚集体并获取样品等分试样用于细胞计数。在一系列洗涤后,聚集体可以重新悬浮在cryostorcs10冷冻培养基中,并且可以将聚集体悬液转移到液氮储存瓶中,诸如以25x10^6个聚集细胞制品/瓶。
c.抑制剂
wnt途径抑制剂
wnt是一种高度保守的分泌的信号传导分子家族,其调节细胞与细胞的相互作用并且与果蝇区段极性基因wingless相关。在人中,wnt基因家族编码38至43kda的富含半胱氨酸的糖蛋白。wnt蛋白具有疏水性信号序列,保守的天冬酰胺连接的寡糖共有序列(参见例如shimizu等人,cellgrowthdiffer8:1349-1358(1997))和22个保守的半胱氨酸残基。由于其促进细胞质β-连环蛋白稳定的能力,wnt蛋白可以充当转录激活剂并抑制细胞凋亡。已经证明特定wnt蛋白的过表达与某些癌症有关。
本文中的wnt抑制剂(也称作wnt途径抑制剂)指一般性的wnt抑制剂。因此,wnt抑制剂是指包括wnt1、wnt2、wnt2b、wnt3、wnt4、wnt5a、wnt6、wnt7a、wnt7b、wnt8a、wnt9a、wnt10a、wnt11和wnt16的wnt家族蛋白成员的任何抑制剂。本发明方法的某些实施方案涉及分化培养基中的wnt抑制剂。本领域已知的合适的wnt抑制剂的实例包括n-(2-氨基乙基)-5-氯异喹啉-8-磺酰胺二盐酸盐(cki-7)、n-(6-甲基-2-苯并噻唑基)-2-[(3,4,6,7-四氢-4-氧代-3-苯基噻吩并[3,2-d]嘧啶-2-基)硫代]-乙酰胺(iwp2)、n-(6-甲基-2-苯并噻唑基)-2-[(3,4,6,7-四氢-3-(2-甲氧基苯基)-4-氧代噻吩并[3,2-d]嘧啶-2-基)硫代]-乙酰胺(iwp4)、2-苯氧基苯甲酸-[(5-甲基-2-呋喃基)亚甲基]酰肼(pnu74654)2,4-二氨基-喹唑啉、槲皮素、3,5,7,8-四氢-2-[4-(三氟甲基)苯基]-4h-噻喃并[4,3-d]嘧啶-4-酮(xav939)、2,5-二氯-n-(2-甲基-4-硝基苯基)苯磺酰胺(fh535)、n-[4-[2-乙基-4-(3-甲基苯基)-5-噻唑基]-2-吡啶基]苯甲酰胺(tak715)、dickkopf相关蛋白1(dkk1)和分泌型卷曲相关蛋白1(sfrp1)。此外、wnt抑制剂可以包括wnt的抗体、wnt的显性阴性变体和抑制wnt表达的sirna和反义核酸。使用rna介导的干扰(rnai)也可以实现对wnt的抑制。
bmp途径抑制剂
骨形态发生蛋白(bmp)是属于转化生长因子β(tgfβ)超家族的多功能生长因子。bmp被认为构成一组关键的形态发生信号,其协调整个身体的架构。bmp信号在生理学中的重要功能由病理过程中失调的bmp信号传导的多种作用突出显示。
bmp途径抑制剂(在本文中也称作bmp抑制剂)可以包括一般性的bmp信号传导的抑制剂或对bmp1、bmp2、bmp3、bmp4、bmp5、bmp6、bmp7、bmp8a、bmp8b、bmp10或bmp15特异的抑制剂。示例性bmp抑制剂包括4-(6-(4-(哌嗪-1-基)苯基)吡唑并[1,5-a]嘧啶-3-基)喹啉盐酸盐(ldn193189)、6-[4-[2-1-哌啶基)乙氧基]苯基]-3-(4-吡啶基)-吡唑并[1,5-a]嘧啶二盐酸盐(dorsomorphin)、4-[6-[4-[1-甲基乙氧基]苯基]吡唑并[1,5-a]嘧啶-3-基]-喹啉(dmh1)、4-[6-[4-[2-(4-吗啉基)乙氧基]苯基]吡唑并[1,5-a]嘧啶-3-基]喹啉(dmh-2)和5-[6-(4-甲氧基苯基)吡唑并[1,5-a]嘧啶-3-基]喹啉(ml347)。
tgfβ途径抑制剂
转化生长因子β(tgfβ)是控制大多数细胞中增殖、细胞分化和其他功能的分泌蛋白。它是一种在免疫、癌症、支气管哮喘、肺纤维化、心脏病、糖尿病和多发性硬化中起作用的细胞因子。tgf-β以至少三种异构体存在,称为tgf-β1、tgf-β2和tgf-β3。tgf-β家族是被称为转化生长因子β超家族的蛋白超家族的一部分,其包括抑制素、激活素、抗苗勒管激素、骨形态发生蛋白、decapentaplegic和vg-1。
tgfβ途径抑制剂(在本文中也称作tgfβ抑制剂)可包括一般而言tgfβ信号传导的任何抑制剂。例如,tgfβ途径抑制剂是4-[4-(1,3-苯并间二氧杂环戊烯-5-基)-5-(2-吡啶基)-1h-咪唑-2-基]苯甲酰胺(sb431542)、6-[2-(1,1-二甲基乙基)-5-(6-甲基-2-吡啶基)-1h-咪唑-4-基]喹喔啉(sb525334)、2-(5-苯并[1,3]间二氧杂环戊烯-5-基-2-ieri-丁基-3h-咪唑-4-基)-6-甲基吡啶盐酸盐水合物(sb-505124)、4-(5-苯并[1,3]二氧杂环戊烯-5-基-4-吡啶-2-基-1h-咪唑-2-基)-苯甲酰胺水合物、4-[4-(1,3-苯并间二氧杂环戊烯-5-基)-5-(2-吡啶基)-1h-咪唑-2-基]-苯甲酰胺水合物、左右测定因子(lefty)、3-(6-甲基-2-吡啶基)-n-苯基-4-(4-喹啉基)-1h-吡唑-1-硫代甲酰胺(a83-01)、4-[4-(2,3-二氢-1,4-苯并二噁英-6-基)-5-(2-吡啶基)-1h-咪唑-2-基]苯甲酰胺(d4476)、4-[4-[3-(2-吡啶基)-1h-吡唑-4-基]-2-吡啶基]-n-(四氢-2h-吡喃-4-基)-苯甲酰胺(gw788388)、4-[3-(2-吡啶基)-1h-吡唑-4-基]-喹啉(ly364847)、4-[2-氟-5-[3-(6-甲基-2-吡啶基)-1h-吡唑-4-基]苯基]-1h-吡唑-1-乙醇(r268712)或2-(3-(6-甲基吡啶-2-基)-1h-吡唑-4-基)-1,5-二氮杂萘(repsox)。
mek抑制剂
mek抑制剂是抑制促分裂原活化蛋白激酶mek1或mek2的化学物质或药物。它们可以用来影响mapk/erk途径。例如,mek抑制剂包括n-[(2r)-2,3-二羟基丙氧基]-3,4-二氟-2-[(2-氟-4-碘苯基)氨基]-苯甲酰胺(pd0325901)、n-[3-[3-环丙基-5-(2-氟-4-碘苯胺基)-6,8-二甲基-2,4,7-三氧代吡啶并[4,3-d]嘧啶-1-基]苯基]乙酰胺(gsk1120212)、6-(4-溴-2-氟苯胺基)-7-氟-n-(2-羟基乙氧基)-3-甲基苯并咪唑-5-甲酰胺(mek162)、n-[3,4-二氟-2-(2-氟-4-碘苯胺基)-6-甲氧基苯基]-1-(2,3-二羟基丙基)环丙烷-1-磺酰胺(rdea119)和6-(4-溴-2-氯苯胺基)-7-氟-n-(2-羟基乙氧基)-3-甲基苯并咪唑-5-甲酰胺(azd6244)。
γ-分泌酶抑制剂
γ-分泌酶是多亚基蛋白酶复合物,该酶本身是一种整合膜蛋白,其在跨膜结构域内的残基处裂解单次跨膜蛋白。此种类型的蛋白酶已知是膜内蛋白酶。γ-分泌酶的最众所周知的底物是淀粉样前体蛋白,淀粉样前体蛋白是一种大的整合膜蛋白,当被γ-分泌酶和β-分泌酶两者裂解时,产生称为淀粉样蛋白β的短氨基酸肽,淀粉样蛋白β的异常折叠的纤维状形式是在阿尔兹海默病患者的脑中发现的淀粉样蛋白斑块的主要组分。
gamma分泌酶抑制剂在本文中通常称作γ-分泌酶抑制剂。例如,γ-分泌酶抑制剂包括,但不限于n-[(3,5-二氟苯基)乙酰基]-l-丙氨酰基-2-苯基]甘氨酸-1,1-二甲基乙基酯(dapt)、5-氯-n-[(1s)-3,3,3-三氟-1-(羟甲基)-2-(三氟甲基)丙基]-2-噻吩磺酰胺(begacestat)、mdl-28170,3,5-二(4-硝基苯氧基)苯甲酸(化合物w)、7-氨基-4-氯-3-甲氧基-1h-2-苯并吡喃(jlk6)、(5s)-(叔丁氧羰基氨基)-6-苯基-(4r)-羟基-(2r)-苄基己酰基)-l-亮氨酰-l-苯丙氨酰胺(l-685,485)、(r)-2-氟-α-甲基[1,1'-联苯基]-4-乙酸((r)-氟比洛芬;flurizan)、n-[(1s)-2-[[(7s)-6,7-二氢-5-甲基-6-氧代-5h-二苯并[b,d]氮杂环庚烷-7-基]氨基]-1-甲基-2-氧代乙基]-3,5-二氟苯乙酰胺(二苯并氮杂环庚烷(dibenzazepine);dbz),n-[顺-4-[(4-氯苯基)磺酰基]-4-(2,5-二氟苯基)环己基]-1,1,1-三氟甲磺酰胺(mrk560)、(2s)-2-[[(2s)-6,8-二氟-1,2,3,4-四氢-2-萘基]氨基]-n-[1-[2-[(2,2-二甲基丙基)氨基]-1,1-二甲基乙基]-1h-咪唑-4-基]戊酰胺二氢溴化物(pf3084014氢溴化物)和2-[(1r)-1-[[(4-氯苯基)磺酰基](2,5-二氟苯基)氨基]乙基-5-氟苯丁酸(bms299897)。
细胞周期蛋白依赖性激酶抑制剂
细胞周期蛋白依赖性激酶(cdk)是糖激酶家族,首先发现其在调控细胞周期中起作用。它们还参与调解神经细胞的转录、mrna加工和分化。在许多人类癌症中,cdk是活性过高的或cdk-抑制蛋白无功能。cdk抑制剂可以是cdk1、cdk2、cdk3、cdk4、cdk5、cdk6、cdk7、cdk8和/或cdk9抑制剂。在具体的方面,cdk抑制剂是cdk4/6抑制剂。
cdk抑制剂可以包括,但不限于,帕博西尼(pd-0332991)hcl、roscovitine(seliciclib,cyc202)、sns-032(bms-387032)、dinaciclib(sch727965)、flavopiridol(alvocidib)、msc2530818、jnj-7706621、azd5438、mk-8776(sch900776)、pha-793887、bs-181hcl、a-674563、abemaciclib(ly2835219)、bms-265246、pha-767491或milciclib(pha-848125)。
iv.光感受器前体细胞的用途
某些方面提供了产生可用于许多重要研究、开发和商业目的的prp或富含prp的细胞群体的方法。
在一些方面,本文公开的方法导致至少或约106、107、108、5x108、109、1010个细胞(或其中可衍生的任何范围)的细胞群体包含至少或约50%(例如,至少或约60%、70%、80%、85%、90%、95%、96%、97%、98%、99%、99.5%或其中可衍生的任何范围)的prp细胞。
在某些方面,用于本发明方法的起始细胞可以包括使用至少或约104、105、106、107、108、109、1010、1011、1012、1013个细胞或其中可衍生的任何范围。起始细胞群体可具有至少或约101、102、103、104、105、106、107、108个细胞/ml或其中可衍生的任何范围的接种密度。
通过本文公开的方法产生的prp细胞或光感受器细胞可以用于本领域目前已知的prp细胞或光感受器细胞的任何方法和应用。例如,可以提供评估化合物的方法,包括测定该化合物对prp细胞或光感受器细胞的药理学或毒理学性质。还可以提供评估化合物对prp细胞的作用的方法,其包括:a)使本文提供的prp细胞与该化合物接触;和b)测定该化合物对prp细胞的作用。
prp细胞或由prp细胞衍生的细胞可以用于移植诸如细胞挽救疗法或全组织替代疗法。本发明实施方案的细胞还可以产生视网膜疾病模型以研究病理生理学和用于药物筛选。
a.测试化合物筛选
prp细胞可以商业用于筛选影响这些细胞及其各种子代的特征的因子(如溶剂,小分子药物,肽,寡核苷酸)或环境条件(如培养条件或操作)。例如,测试化合物可以是化学化合物,小分子,多肽,生长因子,细胞因子或其他生物剂。
在一个实施方案中,方法包括使prp细胞与测试药剂接触并测定所述测试药剂是否调节群体内prp细胞的活性或功能。在一些应用中,筛选测定用于鉴定调节prp细胞增殖、改变prp细胞分化或影响细胞活力的药剂。筛选测定可以在体外或体内进行。筛选和鉴定眼剂或prp剂的方法包括适用于高通量筛选的那些。例如,可以将prp细胞定位或放置在培养皿、烧瓶、滚瓶或培养板(例如,单个多孔培养皿或皿诸如8、16、32、64、96、384和1536孔多孔培养板或皿),任选地在确定的位置,用于鉴定潜在的治疗性分子。可筛选的文库包括例如小分子文库,sirna文库和腺病毒转染载体文库。
其他筛选应用涉及测试药物化合物对视网膜组织维持或修复的影响。因为化合物被设计为对细胞具有药理学作用,或者因为设计为具有其它效果的化合物可能对这种组织类型的细胞具有预料不到的副作用,所以可以进行筛选。
b.治疗和移植
其他实施方案还可以提供prp细胞增强对有需要的任何病症(包括视网膜变性或显著损伤)的眼组织维持和修复的用途。视网膜变性可以与年龄相关黄斑变性(amd)、stargardt黄斑营养不良、视网膜色素变性、青光眼、视网膜血管病、眼的病毒感染和其他视网膜/眼部疾病。光感受器前体祖细胞可以在培养物中包含至少50%、至少75%、至少85%、至少95%、至少99%或约100%的细胞。
在另一方面,本公开提供了治疗有需要的个体的方法,包括向所述个体施用包含光感受器前体细胞的组合物。所述组合物可以施用于眼、视网膜下腔,或经静脉内施用。此类个体可以患有黄斑变性,包括年龄相关黄斑变性,并且此类黄斑变性可以是早期的或晚期的。此类个体可以患有视网膜色素变性、stargardt病、视网膜发育不良、视网膜变性、糖尿病视网膜病变、先天性视网膜营养不良、leber先天性黑朦、视网膜脱离、青光眼或视神经病变。
为了测定细胞组合物对治疗剂施用的适合性,可以首先在合适的动物模型中测试细胞。在一个方面,评估prp细胞在体内存活和维持其表型的能力。将细胞组合物施用于免疫缺陷动物(例如,化学地或通过辐射导致免疫缺陷的裸鼠或动物)。生长一段时间后收获组织,并评估多能干细胞衍生细胞是否仍存在。
许多动物可用于测试prp细胞组合物的适用性。例如,royalcollegeofsurgeon’s(rcs)大鼠是众所周知的视网膜营养不良的模型(lund等人,2006)。另外,在免疫缺陷动物诸如nog小鼠中可以通过在基质胶中移植(例如皮下或视网膜下)测定prp细胞适合性和存活率(kanemura等人,2014)。可以使用的其他模型包括,但不限于,视网膜变性的s334ter大鼠模型和nihrowett裸(rnu)大鼠模型。
本文所述的人prp细胞或包含这些细胞的药物组合物可用于制造治疗有需要的患者的病症的药物。prp细胞可以预先冷冻保存。在某些方面,所公开的prp细胞来源于ipsc,因此可用于为患有眼病的患者提供“个性化药物”。在一些实施方案中,可以对从患者获得的体细胞进行基因工程改造以矫正引起疾病的突变,分化成prp并工程化以形成prp组织。这种prp组织可用于替代同一患者的内源性的退化的prp。备选地,可以使用由健康供体或hla纯合“超级供体”产生的ipsc。
通过引入使用本文公开的方法获得的prp细胞可以治疗或预防各种眼部病症。所述病症包括视网膜疾病或通常与视网膜功能障碍或降解、视网膜损伤和/或视网膜色素上皮细胞丧失相关的病症。可以治疗的病症包括但不限于,视网膜变性疾病,如stargardt黄斑营养不良、视网膜色素变性、黄斑变性(如年龄相关黄斑变性)、青光眼和糖尿病视网膜病变。其他病症包括lebers先天性黑朦、先天性或获得性黄斑变性、贝斯特病、视网膜脱离、回旋状萎缩、无脉络膜症、图形状营养不良、光感受器细胞的其他营养不良,以及由于光、激光、炎症、感染性、辐射、新生血管或创伤性损伤中的任何一种引起的视网膜损伤。在某些实施方案中,提供了用于治疗或预防以视网膜变性为特征的病症的方法,其包括向有需要的受试者施用有效量的包含prp细胞的组合物。这些方法可以包括选择具有这些病症中的一种或多种的受试者,并施用治疗有效量的足以治疗所述病症和/或改善所述病症症状的prp细胞。prp细胞可以以各种形式移植。例如,prp细胞可以以细胞悬液的形式引入靶部位,或者以单层的形式粘附到基质、细胞外基质或基底(如生物可降解聚合物)上,或其组合。prp细胞也可以与其他视网膜细胞一起移植(共移植),诸如与视网膜色素上皮细胞一起移植。在一些实施方案中,prp细胞由来自待治疗受试者的ipsc产生,因此是自体的。在其他实施方案中,prp细胞由mhc匹配的供体产生。
有利地,本公开的药物制剂可以用来代偿光感受器细胞功能的缺少或减小。可以通过本发明的视网膜细胞群体和方法治疗的视网膜功能障碍的实例包括但不限于:光感受器变性(如在例如视网膜色素变性、视锥细胞营养不良、视锥-视杆和/或视杆-视锥营养不良以及黄斑变性中发生);视网膜脱离和创伤;由激光或阳光引起的光射伤害;黄斑裂孔;黄斑水肿;夜盲和色盲;如由糖尿病或血管闭塞引起的缺血性视网膜病变;因早产儿/早产引起的视网膜病变;感染性疾病,诸如cmv、视网膜炎和弓形体病;炎性病症,诸如葡萄膜炎;肿瘤,诸如视网膜母细胞瘤和眼部黑色素瘤;和用于替代在眼部神经病变中受累及的内视网膜神经元,所述眼部神经病变包括青光眼、外伤性视神经病变,和放射性视神经病变和视网膜病变。
在一个方面,所述细胞可以治疗或减轻需要所述治疗的患者中的视网膜色素变性的症状。在另一个方面,所述细胞可以治疗或减轻需要这种治疗的患者中的黄斑变性的症状,所述黄斑变性诸如年龄相关黄斑变性(湿或干)、stargardt病、近视性黄斑变性或类似疾病。对于所有这些治疗,所述细胞可以是患者自体的或同种异体的。在进一步的方面,本公开的细胞可以与其他治疗组合施用。
在一些实施方案中,prp细胞可用于适于接受再生医学的那些受试者的自体prp移植物。可以将prp细胞与其他视网膜细胞如光感受器联合移植。通过所公开的方法产生的prp细胞的移植可以通过本领域已知的各种技术来进行。根据一个实施方案,通过玻璃体切割手术,随后通过小视网膜开口将细胞递送至视网膜下腔或通过直接注射进行移植。prp细胞可以以细胞悬液、细胞聚集体、粘附在基质如细胞外基质上或者提供在基底如生物可降解聚合物上的形式引入靶部位。prp细胞也可以与其他细胞一起移植(共移植),诸如prp细胞与视网膜色素上皮(rpe)细胞一起。因此,提供了包含通过本文公开的方法获得的prp细胞的组合物。
prp细胞,和任选地由其分化的光感受器细胞可以用来生成感觉神经视网膜结构。例如,本公开考虑了生成由rpe细胞和光感受器细胞(或prp细胞)组成的多层细胞结构。这些结构可以用于药物筛选,作为疾病模型,或作为药物制剂或在药物制剂中。在后一种情况,所述药物制剂可以是rpe-光感受器移植物,其可以布置在生物相容性固相载体或基质(优选生物可吸收基质或载体)上,所述固相载体或基质可以像“贴片”那样进行移植。
为了进一步说明,用于所述细胞的生物相容性载体可以是用于视网膜祖细胞的可生物降解的合成物质,诸如聚酯,膜载体。所述可生物降解的聚酯可以是适合于用作用于支持视网膜祖细胞的增殖和分化的基底或支架的任何可生物降解的聚酯。聚酯应当能够形成薄膜,优选有微小织纹的膜,并且如果用于组织或细胞移植则应当是可生物降解的。用于本发明中的合适的可生物降解的聚酯包括聚乳酸(pla),聚丙交酯,聚羟基脂肪酸酯的均聚物和共聚物两者,诸如聚羟基丁酸酯(phb)、聚羟基丁酸酯-羟基戊酸酯共聚物(phbv)、聚羟基丁酸酯-羟基己酸酯共聚物(phbhx)、聚羟基丁酸酯-羟基辛酸酯共聚物(phbo)和聚羟基丁酸酯-羟基十八酸酯共聚物(phbod)、聚己内酯(pcl)、聚酰胺酯(pea),脂肪族共聚酯,诸如聚琥珀酸丁二醇酯(pbs)和聚琥珀酸丁二醇酯/己二酸酯(pbsa),芳香族共聚酯。可以使用高分子量和低分子量聚酯,取代的和未取代的聚酯,嵌段、支化或无规的聚酯,以及聚酯混合物和共混物。优选可生物降解的聚酯是聚己内酯(pcl)。
通过本文公开的方法产生prp细胞的药物组合物。这些组合物可以包括至少约1×103个prp细胞,约1×104个prp细胞,约1×105个prp细胞,约1×106个prp细胞,约1×107个prp细胞,约1×108个prp细胞或约1×109个prp细胞。在某些实施方案中,组合物是包含通过本文公开的方法产生的分化的prp细胞的基本上纯(相对于非prp细胞)的制剂。还提供了包含支架(诸如聚合物载体和/或细胞外基质)和有效量的通过本文公开的方法产生的prp细胞的组合物。例如,细胞作为单层细胞提供。基质材料通常是生理上可接受的并且适合用于体内应用。例如,生理上可接受的材料包括但不限于,可吸收和/或不可吸收的固体基质材料,诸如小肠粘膜下层(sis),交联或未交联的藻酸盐,水胶体,泡沫,胶原凝胶,胶原海绵,聚乙醇酸(pga)网,羊毛和生物粘合剂。
合适的聚合物载体还包括由合成或天然聚合物形成的多孔网状物或海绵以及聚合物溶液。例如,基质是聚合物网状物或海绵,或聚合物水凝胶。可以使用的天然聚合物包括蛋白质诸如胶原蛋白、白蛋白和纤维蛋白;和多糖如藻酸盐以及透明质酸的聚合物。合成聚合物包括可生物降解和不可生物降解的聚合物。例如,可生物降解聚合物包括羟基酸的聚合物如聚乳酸(pla)、聚乙醇酸(pga)和聚乳酸-乙醇酸(pgla)、聚原酸酯、聚酸酐、聚磷腈及其组合。不可生物降解的聚合物包括聚丙烯酸酯、聚甲基丙烯酸酯、乙烯乙酸乙烯酯和聚乙烯醇。
可以使用可以形成可延展的离子或共价交联的水凝胶的聚合物。水凝胶是当(天然或合成的)有机聚合物通过共价键、离子键或氢键交联以形成三维开放晶格结构时形成的物质,所述三维开放晶格结构俘获水分子形成凝胶。可用于形成水凝胶的材料的实例包括分别通过离子交联的多糖如海藻酸盐、聚磷嗪和聚丙烯酸盐,或嵌段共聚物如pluron1cstm或tetron1cstm,通过温度或h交联的聚环氧乙烷-聚丙二醇嵌段共聚物。其他材料包括蛋白质如纤维蛋白,聚合物如聚乙烯吡咯烷酮,透明质酸和胶原蛋白。
可任选地将药物组合物包装在合适的容器中,其具有用于期望目的的书面说明书,诸如重建prp细胞功能以改善视网膜组织的疾病或异常。在一些实施方案中,通过本公开的方法产生的prp细胞可以用于代替有需要的受试者的退化的光感受器细胞。
c.商业、治疗和研究目的的分配
在一些实施方案中,提供了试剂系统,其包括含有在制造、分配或使用过程中的任何时间存在的prp或富含prp的细胞群体的细胞集合或细胞组合。细胞集合包含本文所述的细胞群体与未分化的多能干细胞或其他分化的细胞类型的任何组合,通常共有相同的基因组。每个细胞类型可以在相同或不同的时间,在同一设施或不同地点,在共有商业关系的相同或不同实体的控制下包装在一起,或包装在不同容器中。
可任选将药物组合物包装在合适的容器中,并具有用于期望目的书面说明书,诸如重建prp细胞功能以改善眼部组织的疾病或损伤。
v.试剂盒
在一些实施方案中,提供了可以包括例如用于产生prp细胞的一种或多种培养基和组分的试剂盒。这种制剂可以包含处于适合于与光感受器前体或光感受器细胞组合的形式的视网膜分化和/或营养因子的混合物。适当时,试剂系统可以以水性培养基或冻干形式包装。试剂盒的容器装置通常将包括至少一个小瓶、试管、烧瓶、瓶子、注射器或其他容器装置,组分可以放置在其中,并且优选合适地以等分式样放置在其中。当试剂盒中有一个以上组分时,试剂盒通常还会包含第二、第三或其他额外的容器,其他组分可以单独放入其中。然而,组分的各种组合可以包含在小瓶中。试剂盒的组分可以作为干粉提供。当试剂和/或组分作为干粉提供时,可以通过添加合适的溶剂来重构粉末。可以设想,溶剂也可以在另一个容器装置中提供。这些试剂盒通常还包括一个装置,用于将试剂盒组分紧密封闭以用于商业销售。这样的容器可以包括注塑或吹塑成型的塑料容器,其中保留了所需的小瓶。试剂盒还可以包含使用说明,诸如印刷或电子格式,如数字格式。
vi.实施例
包括以下实施例以说明本发明的优选实施方案。本领域技术人员应该理解,在下面的实施例中公开的技术代表发明人发现的在本发明的实践中发挥良好作用的技术,并且因此可以认为构成其实践的优选模式。然而,根据本公开内容,本领域技术人员应该理解,可以在所公开的具体实施方式中做出许多改变,并且仍然获得相似或类似的结果,而不偏离本发明的精神和范围
实施例1–起始多能干细胞群体的制备
为将ipsc分化成不同阶段的光感受器前体(prp)开发了一种方法(图1)。简言之,从ipsc衍生视网膜祖细胞(rpc)的群体,然后将rpc进一步分化成神经视网膜祖细胞(nrp),然后分化成prp细胞。
首先,使ipsc在完全确定成分的培养基如essential8tm(e8tm)培养基中在没有小鼠或人饲养层的情况下在由玻连蛋白包被的平板上生长。将玻连蛋白母液在不含钙或镁的dpbs中以1:200稀释,培养板用稀释的玻连蛋白溶液包被并在室温下孵育约1小时。ipsc在汇合前被分开并且不允许过度生长以防止不健康和/或分化的细胞。
为了衍生rpc,首先将ipsc解离成单细胞悬液。为了获得单细胞悬液,将细胞用dpbs(不含钙和镁)洗涤并在37℃下在细胞解离酶如trypletm中孵育约10分钟。然后通过用血清移液管移液将细胞分离,并将细胞悬液收集在锥形管中。如果细胞没有通过轻轻吸取被分离,则将培养物孵育更长时间,如另外孵育2-3分钟。为了收集所有细胞,用室温e8tm培养基洗涤培养容器,然后将培养基加入含有细胞悬液的管中。此外,将blebbistatin(例如2.5μm)加入到e8tm培养基中以在解离成单细胞后增加psc存活,同时细胞未粘附于培养容器。为了收集细胞,将它们以400×g离心约5分钟,吸出上清液并将细胞重悬于适当体积的e8tm培养基中。
为了有效区分prp细胞与单细胞ipsc,通过自动化细胞计数器如vicelltm准确计数单细胞ipsc的输入密度,并在室温e8tm培养基中稀释至约1×105个细胞/ml的细胞悬液。一旦以已知的细胞密度(例如,通过血球计)获得了ipsc的单细胞悬液,将细胞铺板在合适的培养容器中,诸如用玻连蛋白包被的6孔板。将细胞以每孔约200,000个细胞的细胞密度接种并置于5%co2和37℃的潮湿培养箱中。约18-24小时后,吸出培养基并将新鲜的e8tm培养基加入培养物中。接种后将细胞在e8tm培养基中培养约2天以适当地粘附和ipsc扩增。
实施例2-将ipsc分化成rpc
一旦如实施例1中那样以适当的细胞密度接种的单细胞ipsc被培养约2天,将它们在各种分化培养基中培养以衍生rpc。吸出e8tm培养基并加入室温视网膜诱导培养基(rim)(例如表1)。简言之,rim包含约1:1比例的dmem和f12、敲除血清替代物、mem非必需氨基酸(neaa)、丙酮酸钠、n-2补充剂、b-27补充剂和抗坏血酸。此外,rim包含wnt途径抑制剂、bmp途径抑制剂、tgfβ途径抑制剂和胰岛素生长因子1(igf1)。每天吸出培养基并将新鲜的rim加入细胞中。细胞在rim中培养约2天以生成前神经外胚层细胞。
然后将细胞在视网膜分化培养基1(rd1)中培养约1至4天,特别是约2天。简言之,rd1(表1)包含约1:1比例的dmem和f12、敲除血清替代物、memneaa、丙酮酸钠、n-2补充剂、b-27补充剂和抗坏血酸。另外,rd1包含wnt途径抑制剂(例如cki-7)、bmp途径抑制剂(例如ldn193189)、tgfβ途径抑制剂(例如sb431542)和mek抑制剂(例如pd325901)和igf-1。rdm中wnt途径抑制剂、bmp途径抑制剂和tgfβ途径抑制剂的浓度是rim中浓度的10倍。每天吸出培养基并将室温rd1加入细胞以产生分化的视网膜细胞。具体地,可以在前几天去除bmp抑制剂,诸如2天后,以增强prp细胞中vsx2的表达。rdm1培养基可以用rd2(表1)替换,rd2不包含bmp抑制剂,诸如ldn193189。细胞可以在rd2中培养约5-10天,诸如约7天。
为了衍生nrp细胞,随后将细胞在视网膜成熟培养基(rm1或rm2)(表1)中培养约5天以将rpc细胞分化成nrp。rm1包含约1:1比例的dmem和f12、敲除血清替代物、memneaa、丙酮酸钠、n-2补充剂、b-27补充剂和抗坏血酸。另外,rm1包含烟酰胺,但不含激活素a以防止朝向rpe细胞的分化。rm1培养基可以进一步包含γ-分泌酶抑制剂,诸如dapt。rm2可以进一步包含tgfβ抑制剂,诸如sb431542,和/或bfgf。用室温rm1每天更换培养基一次。然后从第15-18天将rpc在光感受器前体诱导培养基(fdsc)培养基中培养以产生nrp细胞。为了分析nrp细胞,将它们解冻到解冻后培养基中,并测定pax6和vsx2的表达(图14)。发现nrp细胞几乎100%呈pax6阳性,约90%呈pmel17阳性,以及约80%呈vsx2阳性(图14)。
实施例3–rpc至prp细胞的分化
为了完成至prp细胞的分化过程,将实施例2的rpc细胞在fdsc培养基(表1)中培养。简言之,fdsc培养基包含约1:1比例的dmem和f12、敲除血清替代物、memneaa、丙酮酸钠、n-2补充剂、b-27补充剂和抗坏血酸。另外,fdsc培养基可以包含碱性fgf、dapt、sb431542和cki-7以使nrp朝向prp细胞分化。将细胞在fdsc培养基中培养约10-20天,特别是15天。分析prp细胞的标志物tuj1/巢蛋白(nestin)和rcvrn的表达(图4a-4c)。
在此阶段,衍生的prp细胞可以使用trypletm解离,并在xenofreecs10培养基中冷冻保存。备选地,衍生的prp细胞可以在包含rock抑制剂或blebbistatin的培养基中培养1-5天以促进聚集体形成,诸如培养3天以促进更好的细胞生存和移植。因此,本发明公开的方法提供了来自多能细胞的prp细胞,其可以大规模地一致性地再现用于临床应用。
实施例4–视泡的产生
将实施例2的rpc细胞作为聚集体在rm1或rm2培养基中培养持续延长的时期以产生视泡。使用blebbistatin来促进聚集体形成。rm1培养基包含dmem/f12、敲除血清替代物、丙酮酸钠、抗坏血酸和烟酰胺。在第30天、第40天、第50天和第60天评价视泡的标志物表达。rcvrn表达增加,从第40天的3.3%到第78天超过30%(图12d)。
实施例5–产生prp细胞的替代方法
实施例2的rpc细胞作为聚集体在rm1或rm2培养基(表1)中培养约40-70天。在聚集体形成期间使用blebbistatin。rm2培养基除了rm1培养基的组分以外还包含dapt。细胞保留在聚集体中直至约第68天,在该时间点将它们解离,用
实施例6–nrp或prp的冷冻保存
为了分化的nrp或prp的冷冻保存,吸出培养基并用dulbecco磷酸盐缓冲盐水(dpbs)洗涤细胞。然后将细胞与细胞解离酶一起孵育,并将细胞悬液移液至锥形管中。将细胞离心,吸出上清液并将细胞重新悬浮于室温培养基中。然后通过
备选地,细胞可以作为聚集体冷冻保存,而不是解离成单细胞悬液。例如,在d75prp的clinimacs富集后,使单细胞在组织培养瓶中在极限培养基(rmn)中重新聚集2天。在d77汇集聚集体,并获得样品等分试样用于细胞计数。在一系列洗涤后,将聚集体重悬于cryostorcs10冷冻培养基中,并将1ml聚集体悬液以25x10^6个聚集细胞产物/瓶转移到液氮储存瓶中。
在形态上,留在培养物中的解冻的聚集体不同于解冻后2天由单细胞形成的聚集体。与解冻的单细胞的37%细胞活力相比,解冻的聚集体的细胞活力为67%。对rcvrn(靶上prp标志物)、chx10(早期眼视野细胞)、rcvrn+、chx10(脱靶双极细胞)、ki67(脱靶增殖细胞)和pax6(脱靶神经外胚层/早期眼视野)表达测试四种条件:解冻冷冻保存的单细胞并使其在rmn培养基中再聚集2天(scd77解冻后2天的聚集体);在不冷冻保存的条件下,在富集后使单细胞在rmn中聚集2天(d77冷冻前培养的聚集体);解冻后立即获得的冷冻保存的聚集体(d77解冻时的聚集体);和解冻冷冻保存的聚集体并在rmn培养基中培养2天(d79培养2天的解冻的聚集体)。在四种条件之间,rcvrn表达无差异。在所有条件下早期眼视野的脱靶标志物(chx10+和pax6+)仍然很低,并且增殖的细胞(ki67+)是可忽略不计的。
表2.聚集的单细胞与解冻的冷冻保存的聚集体相比靶上和脱靶标志物的平均百分比(报告为平均数±sem)。
因此,显示不仅可以成功地冷冻保存聚集体,而且在冷冻保存或解冻阶段期间富集的prp不受损。靶上prp标志物恢复蛋白的相似高表达证明了这点。类似地,脱靶标志物和增殖细胞标志物在所有条件下仍然是同样地低。冷冻保存的聚集体使得产品以最小的“中间”处置从实验室到达患者,因为移植的产品将为聚集体的形式。消除了2天的“中间”培养步骤将污染和细胞损失的问题最小化。
实施例7–prp细胞的macs纯化
prp细胞群体可以具有残留的污染性非prp细胞,诸如rpe细胞或其他非神经元细胞类型(统称为“污染细胞”),两者都可以被分离并除去以产生prp富集的细胞群体。可以通过各种方法诸如,例如,磁激活细胞分选
对prp细胞的阳性macs选择可以包括分离表达神经元标志物cd171的细胞。为了执行对prp细胞的阳性macs选择,将来自实施例3或6的prp细胞的总群体解离成单细胞悬液。吸取培养基,用dpbs洗涤细胞,加入trypletm以解离细胞。然后收集细胞并离心。细胞在prp培养基中洗涤,并使用20μmsteriflip细胞过滤器过滤。使用vicell对细胞悬液计数,并向1x107个细胞/ml的细胞悬液加入macs缓冲液。下一步,用1:25稀释度的一抗cd171-生物素(miltenyi)对细胞悬液染色。孵育后,加入20mlmacs缓冲液,并将细胞以400xg离心5分钟。将细胞沉淀重悬于20mlmacs缓冲液中,剧烈混合,并以400xg离心5分钟以除去任何未结合的抗体。将细胞沉淀重悬于macs缓冲液(例如,1.11x108个细胞/ml)中,加入用稀释(1:10)的第二抗体(例如,抗-生物素)包被的微珠,并将细胞在4℃孵育20分钟。孵育后,用macs缓冲液洗涤细胞以除去未结合的微珠,并将高达1.25×108个细胞重悬于500μlmacs缓冲液中。将细胞悬液转移到置于强磁场中的ls柱中,附着于微珠的表达抗原cd171的细胞保留在柱中。ls柱用macs缓冲液洗涤两次。然后从ls柱洗掉富集的细胞群体并评价进行分选后纯度分析。在图3和9中显示了对rcvrn的细胞染色图像,显示了macs富集导致了prp细胞的显著富集。
进行进一步研究以鉴定用于富集prp细胞的其他表面蛋白。使用miltenyi标志物筛选板进行表面蛋白评价将susd2鉴定为富集光感受器前体(prp)产物的表面蛋白靶标。含sushi结构域蛋白-2(susd2)是促进细胞和细胞以及细胞和基质粘附的一种i型跨膜蛋白。在癌细胞中观察到susd2的过表达,并且susd2是各种间充质干细胞的已明确的富集标志物。测定d75prp2.3cbp的表面蛋白揭示了在标记恢复蛋白阳性的细胞上susd2表达升高,恢复蛋白是主要在光感受器中表达的神经元特异性钙结合蛋白。利用这个发现,susd2被测试用作富集标志物。
susd2与恢复蛋白具有高的共表达,恢复蛋白是注定成为光感受器的细胞所表达的标志物。另外,与cd171富集后得到~83%恢复蛋白阳性细胞相比,susd2富集了~95%的恢复蛋白阳性-阳性细胞(图31)。对用dapt预处理并在dapt的存在下在含有pd033的ln521上铺板的细胞进行研究。与chx10(对早期神经视网膜祖细胞有高度选择性的转录因子)偶联的恢复蛋白可以被认为是(视锥)双极细胞的标志性特征标志物(图34)。双极细胞是晚出现的视网膜神经元,其与光感受器和神经节细胞互连以促进信号转导。chx10-阳性(恢复蛋白-阴性)细胞还可以在muller胶质细胞亚组中表达。
在macs富集前对于从d55至d105的分化终点,研究与rcvrn表达同时的susd2表达(图32)。susd2仅靶向prp而不靶向其他视网膜神经元的精确性对于最终产物的纯度很重要。尽管susd2富集后细胞产量低,但在每个时间均检验到susd2标志物富集的表达恢复蛋白的细胞(表3),表明susd2是恢复蛋白-阳性的可能prp的高度特异性标志物。图33进一步证明了susd2-靶向特异性。
如前面所讨论的,chx10和恢复蛋白是(视锥)双极细胞的标志性特征标志物。chx10早期在视网膜祖细胞中表达并在有丝分裂后prp中表达下调,但在有丝分裂后双极细胞和一些muller胶质细胞中仍然高表达。研究显示在较早(d65)时间点,在susd2macs富集前后chx10均很低。另外,恢复蛋白-chx10表达在此时可忽略不计,表明在此时在susd2-富集后产物中没有双极细胞。
相反,恢复蛋白和神经元分化因子1(neurod1,nd1,在光感受器的终末分化中起作用的一种暂时表达的转录因子)的共标记显示在d65时在susd2macs-富集前后的高表达水平。经过d65,观察到表达rcvrn-chx10的双极细胞(和/或可能一些表达chx10的muller胶质细胞)。与d65和d75相比,rcvrn-nd1-表达逐渐下调并且在少于一半的富集的d85细胞中表达该组合,这可能与nd1的暂时表达相一致。
表3:在几个时间点进行macs显示susd2一致性地提高了所述群体的恢复蛋白表达,并在分化终点第55-65天时得到了高细胞产率。高产率进一步说明在这些时间点时的高susd2表达。
这些研究,结合峰值susd2表达时间,表明在早期时间点,诸如d65,susd2是良好的富集标志物。此外,在d65,susd2对表达rcvrn-和nd1的细胞具有高度选择性,但对表达chx10(脱靶或祖细胞)的细胞没有选择性。susd2的选择属性通过富集高恢复蛋白阳性纯度群体而得到显现,即使富集后的细胞产率很小。总之,susd2是用于prp富集的有价值的靶标标志物,条件是在susd2高表达的早期时间点,诸如d55和d65时制造最终产品。
除了susd2和cd171以外,指出了可替代的潜在prp富集标志物。这些表面标志物也与恢复蛋白一起共定位,尽管程度较小,恢复蛋白是主要在光感受器和视锥双极细胞中表达的神经元特异性钙结合蛋白(gunhan等人,2003;haverkamp等人,2003)。表4列举了15种另外的潜在prp富集标志物,不包括cd171和susd2。
表4:被评价用于prp富集的表面蛋白。
对这些表面分子的研究主要集中于发育中或成体的视网膜内的细胞表达和/或功能。表4分别列举了在脱靶分化的细胞上共表达表面抗原与恢复蛋白或专门表达表面抗原的细胞群体的百分比。通过对双重染色的d75prp产品的流式细胞术分析确定表达两种标志物中任一种的群体百分比(图15)。另外,评价仅表达恢复蛋白(fitc,x-轴)或仅表达表面抗原(apc,y-轴)的细胞群体的百分比。将所有流式图针对未染色的(空)细胞和相应的同种型对照(reaigg1、msigg1、msigg2a、msigg2b、msigm)设门控。具有高恢复蛋白共表达然而低脱靶表达(<20%)的表面分子包括cd11、cd133、cd230和cd344。
此类型的流式细胞术流式图增加了在数量较大的prp细胞和数量较少的脱靶细胞上表达的抗原的可能性。为了确定情况是否如此,使用针对cd111、cd230、cd344和cd133表面抗原的抗体富集来自多个实验的分化细胞中的prp。图16显示了在d55、d65和d75时的恢复蛋白表达。对于所有条件(包括macs前(cd133-富集仅对d75prp进行,单个时间点,菱形)),恢复蛋白表达在d65处于峰值,并到d75下降。数据表明d65可能是利用这些特异性表面抗原(不包括cd133)进行prp富集的最佳时间点。
图17-22展示了恢复蛋白(靶上prp标志物)与脱靶细胞标志物pax6(由视网膜祖细胞-rpc、无长突细胞-ac和视网膜神经节细胞-rgc表达)、onecut1(由rpc和水平细胞表达)、ki67(由增殖细胞表达)和chx10(由rpc表达和在双极细胞上与恢复蛋白共表达)的表达百分比的表格和图形表示。利用cd344富集获得了最高的恢复蛋白表达。每次富集的洗脱级分显示了一些恢复蛋白-阳性细胞,但总体上分数比富集的部分小,同时显示了较高百分比的脱靶标志物onecut1。在评价的细胞群体中基本上没有增殖细胞或chx10+rpc/双极脱靶细胞。再次,cd344-富集的细胞显示了最大百分比的恢复蛋白-阳性表达以及低的pax6和onecut1表达。在这些细胞群体中没有增殖细胞。
到d75时发现靶上和脱靶细胞整体减少,表明到这个时间点靶标志物的表达可能已经显著减少。有趣的是,chx10表达高,提示可能有双极脱靶细胞和/或可能有第二波祖细胞。
对于所有研究,在cd344富集后,恢复蛋白表达是最高的,在cd230富集后次之。与macs前相比,cd344富集还减少了pax6-阳性和chx10-阳性脱靶细胞标志物。对于所有三种富集的洗脱物或流通物似乎含有大部分pax6+和chx10+细胞,表明富集是靶向恢复蛋白+prp,而非脱靶细胞诸如视网膜神经节细胞(rgc)或无长突细胞(ac),,rgc和ac两者均表达pax6。由于在第75天时富集的部分表达中等水平的chx10,因此一部分恢复蛋白-标记的细胞也可以在chx10-标记的细胞上共定位,表明在富集的级分中存在双极细胞(bp)的群体。
对不同的细胞系(31538.102)使用cd133进行富集以测试该细胞系是否朝向prp分化。cd133富集恢复蛋白+细胞,且与macs前相比富集后脱靶细胞标志物表达整体减少。尽管富集后ki67也减少,但pd0332991处理去除了富集的级分中存在的任何残留的增殖细胞。
因此,标志物cd71、susd2、cd111、cd133、cd230和cd344可以用于富集prp细胞群体和去除脱靶细胞。
实施例8–使用
进行进一步研究以评估以较高通量规模进行prp富集的可行性,诸如使用
实施例9–材料和方法
通过将20mlfbs或人血清白蛋白加入到1000mldpbs(即不含钙和镁)中来制备流式细胞术洗涤缓冲液。缓冲液经过过滤灭菌,可以在4℃下保存多达4周。
通过将20mlfbs加入到1000mldpbs(即不含钙和镁)中来制备流式细胞术透化缓冲液。加入1克皂素并充分混合。缓冲液经过过滤灭菌,可以在4℃下保存多达4周。
通过在dpbs(即不含钙和镁)中1:1000稀释live-dead染色剂来制备流式细胞术live-deadred染色剂。每2×106个待测定的细胞制备1ml染色剂。使用前新鲜制备染色剂。
通过将110μl的36.5%的甲醛添加至880μl的dpbs(即不含钙和镁)来制备流式细胞术固定缓冲液。每2×106个待测定的细胞制备1ml染色剂。缓冲液在使用前新鲜制备。
实施例10–prp富集的耗竭标志物
另外,鉴定可以用作耗竭标志物以相反地富集prp细胞群体的表面分子。这些分子不显示与恢复蛋白共表达,但能够标记脱靶细胞,使得它们成为不期望的细胞类型的良好耗竭标志物。表5列举了4种可能的耗竭候选物,它们显示与恢复蛋白共表达非常少(<15%),但标记其他细胞类型(>30%)。通过流式分析评价恢复蛋白针对耗竭抗体的表达谱。图21显示了低表达或几乎不表达的耗竭候选物表面抗原与恢复蛋白共表达。
表5:用于prp富集的耗竭标志物。
实施例11–prp分化的优化
对于在第0天和第1天使用wnt激活剂,诸如cki-7,进一步评价prp分化方法。在缺少cki-7的情况下分化细胞并在分化过程的第15天和第25天表征pax6、chx10、ki67和pmel表达。发现在第0天和第1天在不存在cki-7的情况下,细胞群体在第15天和第25天的pax6、chx10、ki67和pmel表达相似(图22-25)。因此,prp细胞可以在第0天和第1天在缺少cki-7的情况下进行分化。
备选地,在不使用rim的情况下进行该分化方法。替代地,细胞在补充有ldn193189的rd1培养基中培养持续第0天至第1天,然后在不含ldn193189的rd2培养基中培养(图26-30)。
修改实施例1-3的方法,去除在rim培养基中的两天培养,并评价早期神经视网膜分化。细胞直接在含有高浓度的ldn193189、sb431542和cki-7的rd1培养基中培养持续第0天至第1天,接着从第2天至第10天在不含ldn193189的rd2培养基中培养。细胞在第15天聚集,在聚集的时间、在第30天发育过程中期和第75天发育过程结束处理样品进行流式分析,
d15过程中流式分析显示尽管表达pax6,但早期人神经外胚层细胞命运决定子在cbp2.3(采用rim)相比于cbp2.5(不采用rim)条件下相似,在rim条件下早期眼视野标志物chx10的表达很低(图26)。去除rim步骤使用含有ldn的rd1,观察到增加了chx10表达。类似地,与含有rim的条件相比,去除rim减少了几乎50%的rpe标志物tyrp1的表达(图27和28)。
测试多个细胞系以确定去除rim是否跨各个细胞系均促进prp分化。细胞系31536.102、31538.101和31538.102是在d15过程中分析一致性地低表达chx10的细胞系,但当去除rim步骤时两个细胞系中chx10表达显著增加(图27)。图27比较了在rim的存在下(cbp)或缺少rim的情况下(-rim)跨4个细胞系神经外胚层标志物pax6、眼视野标志物chx10和rpe标志物tyrp1和pmel的表达。在存在或缺少rim的情况下,跨细胞系pax表达相似。当去除rim时跨细胞系chx10表达增加,但在细胞系8.101和8.102中大幅增加,在两个细胞系中提高达约80%。顺便地,在去除rim后tyrp1表达减少。
色素细胞特异性蛋白(pmel)通常与rpe色素沉着有关。在本分化系统中,显示在d15时pmel表达仍然很高,在d15时的低pmel表达通常导致不佳的prp分化。在细胞系6.102或细胞系a中rim的去除不中断pmel表达,但在细胞系8.101和8.102中大幅增加pmel表达。这证明去除rim不妨碍prp发育过程但有益于需要外部推力朝向prp发育的细胞系。总之,数据提示rim的去除可以减少d15细胞分化成rpe的潜力,同时增加分化成prp的可能性。
基于历史数据,在中期(过程中)prp发育(~d30)期间,pax6和chx10的表达达到峰值,而tyrp1和pmel表达进一步减少。尽管发育过程天然地驱动蛋白表达的这些变化,但在分化的早期阶段去除rim对以前被认为不能接受用于prp分化的细胞系提供了额外的支持。早期去除rim在细胞系8.101和8.102中通过增加pax6和chx10表达水平并减少tryp1和pmel表达水平而影响d30中期prp发育。
随着视网膜发育,视网膜细胞的异质群体以年代次序生成,并且基于靶向由脱靶细胞类型表达的抗原的特定组抗体对这些细胞群体进行表征。目前用于鉴定靶上prp细胞的组包括与neurod1(神经元分化因子1,nd1;图29a)或与chx10(图29b)偶联的恢复蛋白(rcvrn)。恢复蛋白是主要在光感受器中表达的神经元特异性钙结合蛋白,neurod1是在光感受器的终末分化中起作用的暂时表达的转录因子。与rcvrn偶联的chx10是(视锥)双极细胞的标志性表征标志物。尽管chx10早期在视网膜祖细胞中表达,但在有丝分裂后prp中表达下调,但在有丝分裂后双极细胞和一些muller胶质细胞中仍然高表达。双极细胞表达chx10和rcvrn两者,而prp为仅rcvrn+(阳性)和chx10-(阴性)的。因此,使用rcvrn和chx10进行双重标记来验证在细胞群体中不存在或很少存在双极细胞,并且证明了rcvrn+细胞是主要分化的prp。
在细胞系a中缺少rim对d75prp的影响最显著,其中随着去除rim,rcvrn和nd1表达增加。此数据表明rim的去除影响prp发育。此外,随着rim的去除,跨细胞系chx10表达减少或仍然≤10%,也导致rcvrn+/chx10+双阳性细胞的减少。
脱靶细胞标志物包括用于视网膜神经节细胞(rgc)的pax6-isl1双阳性,用于水平细胞的hnf6,以及ki67(一种pan增殖细胞标志物)。pax6也在其他成熟视网膜细胞上表达,如下所述(图30)。pax6是用于神经诱导的可靠标志物,但在视网膜中,几种有丝分裂后脱靶细胞表达pax6,诸如rgc、muller胶质细胞和无长突细胞亚群。同样,isl1也由多种成熟的脱靶视网膜细胞表达,诸如on双极细胞、rgc和无长突细胞亚群上。在此发育阶段,除了脱靶标志物表达稍有减少以外,无rim条件没有造成多少影响。双阳性isl1/pax6群体代表了一小部分(≤10%)驻留的rgc或无长突细胞亚群,无论何种培养基条件。另外,跨各种细胞系和条件,存在可忽略不计的hnf6+水平细胞和几乎不存在增殖细胞。
因此,本研究显示从用于分化的培养基次序中去除rim显著地影响prp分化和发育,特别是在早期发育阶段。rim的存在在d15时减少了所有细胞系的chx10表达,在d30时减少一些细胞系的chx10表达。去除rim似乎在d15时对多个细胞系“挽救了”减少的chx10表达,且在d30时在细胞系8.101和8.102中观察到表达显著提高。最重要的是,去除rim在一些情况下增加了rcvrn和nd1表达水平,并减少了chx10水平,但在观察的任何时间点均没有不利效应。
****
根据本公开内容,可以在没有过度实验的情况下制作和执行本文公开和要求保护的所有方法。虽然本发明的组合物和方法已经根据优选实施方案进行了描述,但是对于本领域技术人员来说明显的是,可以在不脱离本发明的构思、精神和范围的情况下对本文所述方法以及步骤或者本文所述方法的步骤顺序进行变化。更具体地说,明显的是,化学和生理学上相关的某些试剂可以代替本文所述的试剂,而获得相同或相似的结果。对于本领域技术人员明显的所有这些类似的替代和修改被认为是在由所附权利要求限定的本发明的精神、范围和概念内。
参考文献
以下参考文献,就其提供的示例性程序性补充或其他细节补充到本文中阐述的那些的程度,通过引用具体地并入本文。
amit等人,dev.bio.,227:271-278,2000.
buchholz等人,stemcells,27:2427-2434,2009.
byrne等人,nature,450(7169):497-502,2007.
comyn等人,curr.opin.neurol.1,4-9,2010.
gunhan等人,jneurosci.23(4)1383-1389,2003.
haverkamp等人,jcompneurol.455(4):463-476,2003.
hirami等人,neurosci.lett.,48:126-131,2009.
kanemura等人,plosone,9,2014.
ludwig等人,nat.biotechnol.,24:185-187,2006b.
ludwig等人,nat.methods,3:637-646,2006a.
meyer等人,pnas,106(39):16698-16703,2009.
pct公开号wo2007/069666a1.
pct公开号wo2014/121077.
pearson等人,nature485,99-103,2012.
smith,见:originsandpropertiesofmouseembryonicstemcells,2000.
strauss等人,physiologicalreviews,85:845-881,2005.
takahashi等人,cell,126,663-676,2006.
takahashi等人,cell,131,861-872,2007.
thomson和marshall,curr.top.dev.biol.,38:133-165,1998.
thomson和odorico,trendsbiotechnol.,18(2):53-57,2000.
thomson等人proc.natl.acad.scie.usa,92:7844-7848,1995.
美国专利申请号2002/0076747.
美国专利申请号2009/0246875.
美国专利申请号2010/0210014.
美国专利申请号2012/0196360.
美国专利申请号2012/0276636.
美国专利号5,843,780.
美国专利号6,103,470.
美国专利号6,200,806.
美国专利号6,416,998.
美国专利号6,833,269.
美国专利号7,029,913.
美国专利号7,442,548.
美国专利号7,598,364.
美国专利号7,682,828.
美国专利号7,989,425.
美国专利号8,058,065.
美国专利号8,071,369.
美国专利号8,129,187.
美国专利号8,268,620.
美国专利号8,278,620.
美国专利号8,546,140.
美国专利号8,546,140.
美国专利号8,741,648.
美国专利公开号2003/0211603.
美国专利公开号2010/0003757.
xu等人,nat.biotechnol.,19:971-974,2001.
ying等人,cell,115:281-292,2003.
yu等人,science,318:1917-1920,2007.
zhong等人,naturecommunications,5:4047,2014.
- 还没有人留言评论。精彩留言会获得点赞!