用于产生甲基丙烯酸酯的方法与流程
用于产生甲基丙烯酸酯的方法
1.引言
2.甲基丙烯酸甲酯(methyl methacrylate,mma)是化学工业中的重要单体。mma的主要用途是生产多种应用的塑料;然而,mma也可以用于在骨科手术中使用的骨水泥(bone cement)。最重要的聚合应用是聚甲基丙烯酸甲酯(pmma)的铸造、模塑或挤出(extrusion),以生产高光学透明度塑料。pmma的全球消耗估计为每年约210万吨。
3.虽然最广泛使用的甲基丙烯酸酯是mma,但是也可以使用甲基丙烯酸或mma分别通过直接酯化或通过酯交换产生其他甲基丙烯酸酯。实例是2-甲基丙-2-烯酸丁酯(bma,具有化学式c8h
14
o2的甲基丙烯酸酯)、甲基丙烯酸异丁酯(ibma)、甲基丙烯酸乙酯(ema)和甲基丙烯酸2-乙基己酯(2ehma)。bma由mma与丁醇进行酯交换产生。所有这些酯和pmma都具有许多的应用,即在制造纺织品、涂料和粘合剂、包装、润滑剂、汽车设备、lcd屏幕、医疗设备和家用物品中的应用。
4.mma目前仅通过化学手段产生,并且目前用于产生mma的方法包括丙酮氰醇(ach)途径和从多种c
2-c4前体开始的其他途径。用于产生mma的最成功的方法之一是
‘
alpha方法’,其中mma通过丙酸甲酯这种酯与甲醛的无水反应获得。在alpha方法中,丙酸甲酯通过乙烯的羰基化产生。这种乙烯原料来源于化石燃料。与mma产生中常用的其他方法相比,alpha方法提供了许多优势。这些优势包括危险化学物质使用减少、高得多的产物选择性以及降低的对原油来源的原料的依赖。然而,原料的定价与汽油的成本相关。因此,开发克服这些缺陷的用于产生mma的替代方法将是期望的。
5.可以使用微生物经由发酵而不是通过化学合成产生高价值的化学品。重组dna技术和这样的微生物的合成代谢工程已经允许朝着产生特定化学品来重建代谢途径。最近正在开发朝着丙烯酸酯的生物产生的若干可持续途径。这些方法通常集中于经由微生物发酵从可再生原料产生丙烯酸酯。例如,wo2016/185211描述了用于使用重组微生物产生甲基丙烯酸和/或其衍生物的方法。
6.然而,在一定浓度,丙烯酸酯诸如mma和bma在发酵期间的积累通常对生物催化剂是有毒性的,抑制细胞生长和/或导致细胞死亡。特别地,甲基丙烯酸高级烷基酯(诸如甲基丙烯酸丁酯(bma))比甲基丙烯酸低级烷基酯(诸如mma)有更多毒性。因此,这可能是使用微生物(特别是工业大规模)生物产生甲基丙烯酸烷基酯的限制因素。
7.已知,细菌能够适应环境刺激,特别地通过适应控制基因表达的调节网络适应环境刺激。存在若干种这样的网络,包括氧化应激响应和多药耐药系统。
8.鉴于甲基丙烯酸烷基酯对微生物的毒性作用,以及鉴于与目前用于产生mma的化学方法相关的缺点,提供具有改进的对甲基丙烯酸酯的耐受性的微生物用于在产生甲基丙烯酸烷基酯的方法中使用将是有利的。
9.因此,本发明的目的是消除或减轻这些问题中的一个或更多个,提供用于产生甲基丙烯酸酯,特别地bma和/或mma的改进方法,并且提供具有改进的对甲基丙烯酸酯的耐受性的微生物。
10.概述
25113在具有0%(
□
)、0.01%(
◇
)、0.05%(δ)和0.1%(x)v/v的bma时在m9基本培养基中在37℃和200rpm生长。b)高浓度的bma的影响。使用具有50ml培养基的250ml锥形瓶使大肠杆菌bw25113在具有0%(
□
)、0.5%(
◇
)、1.0%(δ)、5.0%(
○
)、10.0%(x)和20.0%(+)v/v的bma时在m9基本培养基中生长。c)大肠杆菌对bma的固有耐受性的测试。使用具有50ml培养基的250ml锥形瓶使大肠杆菌bw 25113在具有0%(
□
)、0.1%(x)、0.5%(*)、传代培养后0.1%(
◇
)、传代培养后0.5%(δ)v/v的bma时在m9基本培养基中在37℃和200rpm生长(一式三份)。d)ade-1。随着bma浓度的顺序增加,连续分批培养中的适应性进化。大肠杆菌在具有10ml培养基的50ml管(在3个平行管中,管1(实线)、管2(点线)和管3(虚线))中在具有10g l-1葡萄糖和bma的m9基本培养基中在37℃和200rpm生长。使用最佳生长培养物作为3个管中各自的起始培养物,在每次连续转移中以0.1%bma(x)、0.5%bma(
□
)、1%bma(
◇
)、5%(δ)、10%(
○
)和20%(+)增加bma浓度。e)ade-3。连续分批培养中的适应性进化,每个bma浓度中有5个连续培养。大肠杆菌在具有10ml培养基的50ml管(在3个平行管中,管1(实线)、管2(点线)和管3(虚线))中在具有10g l-1葡萄糖和bma的m9基本培养基中在37℃和200rpm生长。bma浓度从0.1%v/v(x)增加至0.5%v/v(
□
)、1%v/v(
◇
)、5%v/v(δ)、10%v/v(*)和20%v/v(
○
),使用每个单独的管作为随后转移的起始培养物。f)ade-3。连续分批培养中的适应性进化,1个连续培养在0.1%v/v bma,2个连续转移在10%v/v bma,并且45个连续转移在20%v/v bma。大肠杆菌在具有10ml培养基的50ml管(在3个平行管中,管1(实线)、管2(点线)和管3(虚线))中在具有10g l-1葡萄糖和bma的m9基本培养基中在37℃和200rpm生长。bma浓度从0.1%v/v(x)增加至10%v/v(
□
)和20%v/v(
◇
),使用最佳生长培养物作为3个管中各自的起始培养物。g)ade-4,恒化器中bma耐受大肠杆菌的适应性进化和选择。微型生物反应器(55ml工作体积)中的大肠杆菌的恒化器培养物在具有1g l-1葡萄糖的m9基本培养基中在37℃和~0.3l h-1的通气速率生长,其中bma浓度(
◆
)从0逐渐增加至20%v/v,并且稀释速率(υ)从0变化至0.55h-1。细胞浓度(
●
)以细胞干重g l-1报告。h)使用具有50ml培养基的250ml锥形瓶使来自ade-1和ade-2的分离株在具有20%v/v bma的m9基本培养基中在37℃和200rpm生长(一式三份)。分离株2(δ)、3(
◇
)、5(*)、6(-)、7(
○
)和没有bma的野生型(
─
点线)。i)使用具有50ml培养基的250ml锥形瓶使来自ade-3的分离株在具有20%v/v bma的m9基本培养基中在37℃和200rpm生长(一式三份)。分离株14(
□
)、15(
◇
)、16(δ)、17(x)、18(
○
)和没有bma的野生型(
─
点线)。j)使用具有50ml培养基的250ml锥形瓶使来自ade-4的分离株以0.33h-1的稀释速率在具有20%v/v bma的m9基本培养基中在37℃和200rpm生长(一式三份)。分离株8(
□
)、9(
◇
)、10(δ)和没有bma的野生型(
─
点线)。k)使用具有50ml培养基的250ml锥形瓶使来自ade-4的分离株以0.46h-1的稀释速率在具有20%v/v bma的m9基本培养基中在37℃和200rpm生长(一式三份)。分离株19(
□
)、20(
◇
)、21(δ)和没有bma的野生型(
─
点线)。
20.图6.使用具有50ml培养基的250ml锥形瓶使来自适应性进化研究的分离株以0.55h-1的稀释速率在具有20%v/v bma的m9基本培养基中在37℃和200rpm生长(一式三份)。分离株22(
◇
)、23(
○
)和没有bma的野生型(
─
点线)。
21.详述
22.现在将进一步描述本发明。在以下段落中,更详细地定义了本发明的不同方面。除非另有明确相反指示,否则如此定义的每个方面可以与任何其他一个方面或更多个方面组
合。特别地,被指示为优选或有利的任何特征可以与被指示为优选或有利的任何其他一个特征或更多个特征组合。
23.除非另有指示,否则本发明的实践采用以下的常规技术:微生物学、组织培养、分子生物学、化学、生物化学和重组dna技术,所述常规技术在本领域技术内。这样的技术在文献中被充分地说明,例如,green和sambrook:molecular cloning:a laboratory manual,第4版,2014.
24.用于产生甲基丙烯酸酯、赋予微生物对甲基丙烯酸酯的耐受性和使甲基丙烯酸酯耐受性微生物生长的方法
25.在第一方面,本发明涉及一种用于产生甲基丙烯酸酯的方法,该方法包括
26.a)在发酵培养基中提供与野生型微生物相比具有增加的对甲基丙烯酸c
3-c
12
酯的耐受性的遗传修饰的微生物,和
27.b)使微生物在产生甲基丙烯酸c
3-c
12
酯的条件下生长。
28.在第二方面,本发明涉及一种用于使微生物在甲基丙烯酸酯的存在下生长或维持的方法,所述方法包括在产生甲基丙烯酸c
3-c
12
酯的条件下,在发酵培养基中提供与野生型微生物相比具有增加的对甲基丙烯酸c
3-c
12
酯的耐受性的遗传修饰的微生物。
29.本发明还涉及一种用于赋予或增加微生物对甲基丙烯酸酯的耐受性的方法,所述方法包括将突变引入编码氧化应激响应和细菌多药耐药系统的蛋白组分和/或调节物的核酸中。
30.如本文使用的,术语“耐受性(tolerance)”或“抗性(resistance)”是指微生物在甲基丙烯酸酯存在下,特别地在甲基丙烯酸c
3-c
12
酯存在下存活的能力。因此,在一种实施方案中,可以将耐受性微生物维持在对野生型微生物有毒性的浓度的甲基丙烯酸酯下。例如,与野生型微生物相比,在甲基丙烯酸丁酯的存在下,微生物可以存活且生长至少约2.5小时更长,优选地至少约5小时更长,更优选地至少约10小时更长,最优选地至少约20小时更长。微生物的存活和生长可以通过本领域已知的任何合适的方法来确定。优选地,微生物的存活和生长可以通过测量微生物的光密度来确定,更优选地,微生物的光密度在约600nm的波长处测量(od600)。例如,与野生型微生物相比,在甲基丙烯酸丁酯的存在下,本发明的微生物可以具有至少0.5的od600持续2.5小时更长,优选地持续至少约5小时更长,更优选地持续至少约10小时更长,最优选地持续至少约20小时更长。在另一个实例中,od从0.01-0.1增加到0.15至3.0指示生物体正在生长。合适地,od600在合适的发酵培养基中测量。本领域技术人员会理解,微生物的光密度可以在不同的波长处测量,这取决于使用的发酵培养基。
31.在另一种实施方案中,耐受性微生物能够在引起野生型微生物死亡或生长停滞的浓度的甲基丙烯酸酯下生长。
32.术语“耐受性(tolerance)”或“抗性(resistance)”和“耐受性(tolerant)”或“抗性(resistant)”在本文可互换使用。与不包含一个或更多个遗传修饰的野生型微生物相比,如本文描述的遗传修饰的生物体的特征在于增加的对甲基丙烯酸酯,特别是甲基丙烯酸c
3-c
12
酯的“耐受性”或“抗性”。
33.在本发明的方面的一种实施方案中,微生物在液体培养基中在约37℃生长时,对至少10%v/v至30%v/v,例如10%v/v、11%v/v、12%v/v、13%v/v、14%v/v、15%v/v、16%
v/v、17%v/v、18%v/v、19%v/v、20%v/v的甲基丙烯酸c
3-c
12
酯耐受。因此,根据多种实施方案,微生物可以维持在在至少10%v/v至30%v/v,例如10%v/v、11%v/v、12%v/v、13%v/v、14%v/v、15%v/v、16%v/v、17%v/v、18%v/v、19%v/v、20%v/v的浓度的甲基丙烯酸c
3-c
12
酯的存在下。
34.术语“增加”、“改进”或“增强”或“增加的”、“改进的”、“增强的”或“增加的”在本文可互换使用。
35.如本文使用的术语微生物是指一个或更多个原核细胞或真核细胞。在一种实施方案中,微生物是原核细胞。在一种实施方案中,微生物是细菌。
36.在一种实施方案中,修饰的微生物在调节氧化应激响应和细菌多药耐药系统或形成氧化应激响应和细菌多药耐药系统的一部分的一种或更多种蛋白(和编码这样的蛋白的核酸)中具有突变,所述一种或更多种蛋白包括例如外排泵的成员或调节物,例如在大肠杆菌中鉴定的acrab tolc外排泵复合物和arac家族成员。氧化应激响应和细菌多药耐药系统的组分和调节物已在大肠杆菌中得到表征,并且在其他生物体中,包括在许多革兰氏阴性物种中发现了同源复合物。
37.在一种实施方案中,微生物是革兰氏阴性细菌。在一种实施方案中,革兰氏阴性细菌属于肠杆菌科(enterobacteriaceae)。
38.在一种实施方案中,在本发明范围内的合适细菌的实例包括属于变形菌门(proteobacteria)的以下属的肠杆菌:埃希氏菌属(escherichia)、肠杆菌属(enterobacter)、泛菌属(pantoea)、克雷伯氏菌属(klebsiella)、沙雷氏菌属(serratia)、欧文氏菌属(erwinia)、沙门氏菌属(salmonella)、摩根氏菌属(morganella)等,属于以下属的所谓棒状杆菌:短杆菌属(brevibacterium)、棒状杆菌属(corynebacterium)或微杆菌属(microbacterium),以及属于以下属的细菌:脂环酸芽孢杆菌属(alicyclobacillus)、芽孢杆菌属(bacillus)、氢杆菌属(hydrogenobacter)、甲烷球菌属(methanococcus)、醋杆菌属(acetobacter)、不动杆菌属(acinetobacter)、土壤杆菌属(agrobacterium)、固氮根瘤菌属(axorhizobium)、固氮菌属(azotobacter)、无形体属(anaplasma)、拟杆菌属(bacteroides)、巴尔通体属(bartonella)、鲍特菌属(bordetella)、疏螺旋体属(borrelia)、布鲁氏菌属(brucella)、伯克霍尔德菌属(burkholderia)、荚膜杆菌属(calymmatobacterium)、弯曲菌属(campylobacter)、衣原体属(chlamydia)、嗜衣原体属(chlamydophila)、梭菌属(clostridium)、柯克斯体属(coxiella)、贪铜菌属(cupriavidus)、埃立克体属(ehrlichia)、肠球菌属(enterococcus)、弗朗西斯氏菌属(francisella)、梭杆菌属(fusobacterium)、加德纳菌属(gardnerella)、嗜血杆菌属(haemophilus)、螺杆菌属(helicobacter)、克雷伯氏菌属、甲烷杆菌属(methanobacterium)、微球菌属(micrococcus)、莫拉菌属(moraxella)、分支杆菌属(mycobacterium)、支原体属(mycoplasma)、奈瑟菌属(neisseria)、巴斯德菌属(pasteurella)、消化链球菌属(peptostreptococcus)、卟啉单胞菌属(porphyromonas)、普氏菌属(prevotella)、假单胞菌属(pseudomonas)、根瘤菌属(rhizobium)、立克次氏体属(rickettsia)、罗沙利马体属(rochalimaea)、罗氏菌属(rothia)、志贺菌属(shigella)、葡萄球菌属(staphylococcus)、寡养单胞菌属(stenotrophomonas)、链球菌属(streptococcus)、密螺旋体属(treponema)、弧菌属(vibrio)、沃尔巴克氏体属
(wolbachia)、耶尔森菌属(yersinia)等。
39.示例性细菌包括选自以下的物种:大肠杆菌(escherichia coli)、产酸克雷伯氏菌(klebsiella oxytoca)、产琥珀酸厌氧螺菌(anaerobiospirillum succiniciproducens)、产琥珀酸放线杆菌(actinobacillus succinogenes)、产琥珀酸曼氏杆菌(mannheimia succiniciproducens)、菜豆根瘤菌(rhizobium etli)、枯草芽孢杆菌(bacillus subtilis)、谷氨酸棒状杆菌(corynebacterium glutamicum)、氧化葡糖杆菌(gluconobacter oxydans)、运动发酵单胞菌(zymomonas mobilis)、乳酸乳球菌(lactococcus lactis)、植物乳杆菌(lactobacillus plantarum)、天蓝色链霉菌(streptomyces coelicolor)、丙酮丁醇梭菌(clostridium acetobutylicum)、荧光假单胞菌(pseudomonas fluorescens)、嗜热氢杆菌(hydrogenobacter thermophilus)、詹氏甲烷球菌(methanococcus jannaschii)和恶臭假单胞菌(pseudomonas putida)。
40.优选地,该细菌属于以下属:埃希氏菌属、棒状杆菌属或假单胞菌属。优选地,细菌是大肠杆菌、谷氨酸棒状杆菌、荧光假单胞菌或恶臭假单胞菌。
41.示例性酵母或真菌包括属于以下的属的那些:酵母属(saccharomyces)、裂殖酵母属(schizosaccharomyces)、假丝酵母属(candida)、克鲁维酵母属(kluyveromyces)、曲霉属(aspergillus)、毕赤酵母属(pichia)、隐球菌属(crytpococcus)等。示例性酵母或真菌物种包括选自以下的那些:酿酒酵母(saccharomyces cerevisiae)、粟酒裂殖酵母(schizosaccharomyces pombe)、乳酸克鲁维酵母(kluyveromyces lactis)、马克斯克鲁维酵母(kluyveromyces marxianus)、土曲霉(aspergillus terreus)、黑曲霉(aspergillus niger)、巴斯德毕赤酵母(pichia pastoris)等。
42.在一种实施方案中,合适的微生物选自埃希氏菌属、欧文氏菌属、普鲁威登菌菌属(providencia)和沙雷氏菌属。在埃希氏菌属中,可以使用大肠杆菌物种。示例性菌株包括大肠杆菌b、大肠杆菌c、大肠杆菌w等。在一种实施方案中,微生物是大肠杆菌,例如商购可得的和/或完全表征的大肠杆菌菌株,诸如k-12mg1655、bw25113或w3110。
43.虽然本文中与细菌细胞相关的方面和实施方案通常是指根据其在大肠杆菌中的命名的基因或蛋白,但对于另一个科或物种的细菌细胞,鉴定其他科或物种中的对应基因或蛋白,例如同源物、种间同源物和/或种内同源物,是在本领域技术水平内的,通常通过鉴定与大肠杆菌序列具有中等(通常≥30%)或高(通常≥50%)同一性的序列,优选地考虑由基因组中的基因和/或基因的基因座表达的蛋白的功能。下文的表1a和1b列出了由每个特定基因编码的蛋白的功能、其在大肠杆菌bw25113基因组中的基因座和编码序列的seq id号。本文提供了野生型核酸及编码的蛋白的序列。
44.因此,本领域技术人员会理解,本发明的多个方面扩展至其他微生物中的突变体蛋白和核酸序列,优选地细菌例如大肠杆菌菌株中的突变体蛋白和核酸序列。因此,还提及是大肠杆菌蛋白和核酸的同源物的氧化应激响应和细菌多药耐药系统的调节物和组分及其调节物。如本文使用的,核酸序列或氨基酸序列的同源物与野生型核酸或氨基酸序列具有至少25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、
84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的总体序列同一性。
[0045]“同一性”是测量序列的相似性或相关性的序列特性。如本公开内容中使用的术语“序列同一性”或“同一性”意指本公开内容的多肽序列与所讨论的序列进行(同源)比对后成对相同残基相对于这两个序列中较长序列中的残基数量的百分比。通过将相同氨基酸残基的数量除以残基总数量,并且将乘积乘以100来测量序列同一性。
[0046]
术语“同源性”在本文中以其通常的含义使用,并且包括在本公开内容的多肽的线性氨基酸序列中的等同位置处的相同氨基酸以及被认为是保守取代(例如,谷氨酸残基被天冬氨酸残基替代)的氨基酸。
[0047]
合适的同源物或种间同源物可以使用数据库诸如本领域技术人员已知的ncbi和paint ensemble和比对程序通过序列比较和保守结构域的鉴定来进行鉴定。例如,序列同源性或序列同一性的百分比可以在本文使用blastp程序来确定。
[0048]
可以使用合适的计算机程序诸如代表基本局部比对搜索工具(basic local alignment search tool)的blast2.0或clustalw或适合生成序列比对的任何其他合适程序进行比对。因此,野生型核酸或氨基酸序列可以用作“主题序列”或“参考序列”,而突变体核酸的氨基酸序列或者与本文描述的野生型不同的氨基酸序列用作“查询序列”。术语“参考序列”和“野生型序列”在本文可互换使用。
[0049]
术语“遗传修饰”或“遗传工程”广泛地指对微生物的基因组或核酸的操纵。同样,术语“遗传工程化”或“遗传修饰的”是指包含与野生型微生物的基因组或核酸不同的基因组或核酸的微生物。例如,可以使用遗传修饰的方法操纵基因组或核酸,所述遗传修饰的方法诸如异源基因表达、基因或启动子插入或缺失、核酸突变、改变的基因表达或失活、酶工程、随机诱变方法、基因改组或密码子优化。在一种实施方案中,“遗传工程化”或“遗传修饰的”微生物是指包含与野生型微生物不同的基因组或核酸的分离的菌株,例如分离的细菌菌株。
[0050]
为了本发明的目的,“突变体”或“遗传修饰的”微生物是与天然存在的野生型(wt)微生物相比已经被改变的微生物。
[0051]
如本文使用的,“突变的”是指与野生型微生物相比,在本发明的多方面的微生物中被修饰的核酸或蛋白。核酸序列或氨基酸序列中的突变可以是一个或更多个残基的缺失、插入或取代。核酸序列中的突变可以导致错义突变,导致蛋白中单个氨基酸的取代。可选地,核酸序列中的突变可以引入提前终止密码子(premature stop codon),产生截短的蛋白或后续氨基酸序列中的改变。敲除突变是消除蛋白功能的突变。
[0052]“突变体”或“遗传修饰的”微生物从其自然环境中分离。在一种实施方案中,“突变体”或“遗传修饰的”微生物不存在于自然界中。
[0053]
如本文使用的,词语“核酸”、“核酸序列”、“核苷酸”、“核酸分子”或“多核苷酸”意在包括dna分子(例如,cdna或基因组dna)、rna分子(例如,mrna)、天然存在的、突变的、合成的dna或rna分子,以及使用核苷酸类似物产生的dna或rna的类似物。它可以是单链或双链的。这样的核酸或多核苷酸包括但不限于结构基因的编码序列、反义序列和不编码mrna或蛋白产物的非编码调节序列。这些术语也包括基因。术语“基因”或“基因序列”广泛用于指与生物功能相关的dna核酸。因此,基因可以包括如基因组序列中的内含子和外显子,或者
可以仅包括如cdna中的编码序列,和/或可以包括与调节序列组合的cdna。
[0054]
术语“肽”、“多肽”和“蛋白”在本文可互换使用,并且是指通过肽键连接在一起的任何长度的聚合形式的氨基酸。
[0055]
为了本发明的目的,“转基因的”、“转基因”或“重组体”意指,关于例如核酸序列、包含核酸序列的表达盒、基因构建体或载体,或用本文描述的核酸序列、表达盒或载体转化的微生物,编码可用于本发明的方法的蛋白的核酸序列不位于其天然遗传环境中或者已通过重组方法修饰。天然遗传环境被理解为意指原始微生物中的天然基因组的或染色体的基因座。
[0056]
术语“异源”核酸序列或基因构建体指通常不可能天然存在于生物体中的基因构建体的核酸序列。
[0057]
根据本发明的多个方面,突变体或修饰的基因中的突变可以驻留在编码氧化应激响应和细菌多药耐药系统的蛋白组分或调节物及其调节物的基因中,例如编码acrab tolc外排泵的组分或调节物或arac蛋白家族的成员的基因中。例如,根据本发明的多个方面的突变体或修饰的基因中的突变可以驻留在编码转录调节物的arac家族蛋白的基因中。特别地,突变可以驻留在产生突变体soxr蛋白的soxr核酸序列、产生突变体acrr蛋白的acrr核酸序列、产生突变体rob蛋白的rob核酸序列和/或产生突变体marr蛋白的marr核酸序列或其组合中。特别地,本发明人已经表明吖啶黄抗性调节物(acrr)的突变体特别地在与选自marr、soxr或rob的全局调节物之一组合时赋予对甲基丙烯酸酯的耐受性。
[0058]
氧化还原敏感转录激活物(soxr)
[0059]
在一种实施方案中,遗传修饰的微生物在soxr核酸序列中包含突变。因此,与野生型soxr核酸序列相比,遗传修饰的微生物包含突变体soxr核酸序列。突变体soxr核酸序列编码突变体soxr蛋白。
[0060]
soxr编码merr家族的调节物。在氧化应激信号不存在下,soxr同二聚体与soxs的启动子区域结合,并且防止增强的转录。当soxr簇被氧化时,soxr成为soxs转录的激活物。
[0061]
大肠杆菌soxr核酸序列示于seq id no.1中。这编码如seq id no.2中示出的蛋白。17-kda soxr蛋白由154个氨基酸残基组成,并且形成同二聚体,其包含[2fe-2s]簇。它具有dna结合结构域(残基1-80)、二聚化螺旋(残基81-118)和fe-s簇结合结构域(残基119-154)。soxr激活通过其fe-s簇的氧化来介导,导致增强的soxs转录。
[0062]
在一种实施方案中,野生型soxr核酸序列包括seq id no.1或其同源物。
[0063]
soxr核酸序列或soxr氨基酸序列的同源物与分别由seq id no.1和seq id no.2代表的野生型核酸或氨基酸序列具有至少25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的总体序列同一性。优选地,总体序列同一性是85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。使用本领域已知的全局比对算法,诸如gap程序(gcg wisconsin package,accelrys)中的needleman wunsch算法确定总体序列同一性。
[0064]
在一种实施方案中,soxr中的突变促进氧化和/或dna结合,从而增加soxr调节子(包括soxs)的转录。
[0065]
在一种实施方案中,微生物包含编码突变体soxr蛋白的突变体soxr核酸序列,该突变体soxr蛋白在dna结合结构域(残基1-80)或在fe-s簇结构域(残基119-154)中具有突变。
[0066]
在一种实施方案中,soxr蛋白中的突变选自以下之一:参考seq id no.2,r20被另一种氨基酸的取代、r20被另一种氨基酸的取代、残基146的缺失(核酸残基435、436、437的缺失)或残基139处的截短。在一种实施方案中,r20被h取代。在一种实施方案中,r20被l取代。在除了大肠杆菌之外的微生物中的soxr同源物中的等同位置处的修饰也在本发明的范围内。
[0067]
在一种实施方案中,突变不是敲除突变。在一种实施方案中,突变是功能突变的获得。改变的蛋白能够赋予对甲基丙烯酸酯的耐受性。
[0068]
吖啶黄抗性调节物(acrr)
[0069]
在一种实施方案中,遗传修饰的微生物在acrr核酸序列中包含突变。因此,与野生型acrr序列相比,遗传修饰的微生物包含突变体acrr核酸序列。突变体acrr核酸序列编码突变体acrr蛋白。
[0070]
acrr调节与acrab-tolc多药外排泵相关的acrrab基因的表达。acrr同二聚体通过与acrab操纵子区域结合充当acrab操纵子的阻遏物,并且当激活物结合到其c末端配体结合结构域时,acrr同二聚体被释放,允许acrab的转录。acrab操纵子编码acra和acrb,其与tolc合作形成主要的多药外排泵复合物acrab-tolc。
[0071]
acrr是二聚双结构域分子,具有完全螺旋结构,类似于转录调节物tetr家族的成员。在大肠杆菌中,acrr基因编码215个氨基酸的acrr蛋白,该蛋白包含n末端dna结合结构域(残基7-51)和c末端配体结合结构域(残基55-204)。
[0072]
在一种实施方案中,野生型acrr核酸序列包含seq id no.3或其编码seq id no.4的同源物。
[0073]
acrr核酸序列或acrr氨基酸序列的同源物与分别由seq id no.3和seq id no.4代表的野生型核酸或氨基酸序列具有至少25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的总体序列同一性。优选地,总体序列同一性是85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。总体序列同一性使用本领域已知的全局比对算法,诸如gap程序(gcg wisconsin package,accelrys)中的needleman wunsch算法来确定。
[0074]
在一种实施方案中,微生物包含编码突变体acrr蛋白的突变体acrr核酸序列,该突变体acrr蛋白在dna结合结构域(残基7-51)或在配体结合结构域(残基55-204)中具有突变。
[0075]
在一种实施方案中,acrr中的突变选自以下之一:参考seq id no.4,v29被另一种
氨基酸的取代、y49处的移码突变、a191处的移码突变或t32处的移码突变。在一种实施方案中,v29被g取代。在除了大肠杆菌之外的微生物中的acrr同源物中的等同位置处的修饰也在本发明的范围内。
[0076]
在一种实施方案中,突变不是敲除突变。在一种实施方案中,突变是功能突变的获得,即产生与野生型相比功能改变的功能蛋白。改变的蛋白能够赋予对甲基丙烯酸酯的耐受性。
[0077]
右起点结合(rob)
[0078]
在一种实施方案中,遗传修饰的微生物在rob核酸序列中包含突变。因此,与野生型rob序列相比,遗传修饰的微生物包含突变体rob核酸序列。突变体rob核酸序列编码突变体rob蛋白。
[0079]
大肠杆菌中的rob蛋白由289个氨基酸组成,具有n末端dna结合结构域(残基1-120)和c末端结构域(残基121-189)。c末端结构域被认为是防止其被lon蛋白酶降解及其活化-失活机制所必需的。
[0080]
在一种实施方案中,野生型rob核酸序列包含seq id no.5或其同源物,所述同源物编码具有seq id no.6的蛋白。
[0081]
rob核酸序列或rob氨基酸序列的同源物与分别由seq id no.5和seq id no.6代表的野生型核酸或氨基酸序列具有至少25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的总体序列同一性。优选地,总体序列同一性是85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。总体序列同一性使用本领域已知的全局比对算法,诸如gap程序(gcg wisconsin package,accelrys)中的needleman wunsch算法来确定。
[0082]
在bma耐受性菌株中发现的突变引起氨基酸残基70和156处的氨基酸取代,这些氨基酸残基远离rob的dna结合位点,但可能影响参与自我隔离(self-sequestration)的蛋白-蛋白相互作用或激活物的特异性。这样的突变增加游离/活性rob的量,或增加rob对bma的亲和力以允许激活,或增加由bma的激活。然后增加的rob活性导致在其调节控制下增加的多药耐药基因的表达,这可能有助于获得对bma的耐受性。
[0083]
在一种实施方案中,微生物包含编码突变体rob蛋白的突变体rob核酸序列,该突变体rob蛋白在n-末端dna结合结构域(残基1-120)和c-末端结构域(残基121-189)中具有突变。
[0084]
在一种实施方案中,rob中的突变选自以下之一:参考seq id no.6,在rob中a70被另一种氨基酸的取代、或r156被另一种氨基酸的取代。在一种实施方案中,a70被v或t取代。在一种实施方案中,r156被h取代。在除了大肠杆菌之外的微生物中的rob同源物中的等同位置处的修饰也在本发明的范围内。
[0085]
多重抗生素抗性蛋白(marr)
[0086]
在一种实施方案中,遗传修饰的微生物在marr核酸序列中包含突变。因此,与野生
型marr序列相比,遗传修饰的微生物包含突变体marr核酸序列。突变体marr核酸序列编码突变体marr蛋白。
[0087]
在大肠杆菌中,marr基因的蛋白产物marr由144个氨基酸残基组成,并且包含n-末端结构域、c-末端结构域、dna结合位点(残基55-100)和水杨酸结合位点(残基70-86)。marr作为同二聚体,通过与marab操纵子的启动子区域结合而充当marab操纵子的阻遏物。marr的dna结合/阻遏物活性被小分子诸如水杨酸、白花丹素(plumbagin)、2,4-二硝基酚和甲萘醌的存在和结合所抑制,这允许mara、marb和marr的转录。
[0088]
在一种实施方案中,野生型marr核酸序列包含seq id no.7或其编码具有seq id no.8的蛋白的同源物。
[0089]
marr核酸序列或marr氨基酸序列的同源物与分别由seq id no.7和seq id no.8代表的野生型核酸或氨基酸序列具有至少25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的总体序列同一性。优选地,总体序列同一性是85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。总体序列同一性使用本领域已知的全局比对算法,诸如gap程序(gcg wisconsin package,accelrys)中的needleman wunsch算法来确定。
[0090]
在一种实施方案中,微生物包含编码突变体marr蛋白的突变体marr核酸序列,该突变体marr蛋白在dna结合和水杨酸结合结构域(残基55-100)中具有突变。例如,突变可能导致dna结合亲和力降低和/或对作为激活物的bma的亲和力增强。
[0091]
在一种实施方案中,marr中的突变是参考seq id no.8,v84被另一种氨基酸的取代。在一种实施方案中,v84被g取代。在除了大肠杆菌之外的微生物中的marr同源物中的等同位置处的修饰也在本发明的范围内。
[0092]
在一种实施方案中,微生物具有在编码突变体acrr蛋白(例如在dna结合结构域(残基7-51)或在配体结合结构域(残基55-204)中具有突变的蛋白)的acrr核酸序列中的突变,与soxr、rob或marr中任一种的核酸序列中的突变的组合。例如,微生物可以在acrr和soxr;acrr和rob或acrr和marr核酸序列中包含突变。另外的突变,即在其他基因中的突变,可能存在或可能不存在。
[0093]
在一种实施方案中,微生物可以包含在编码突变体acrr蛋白的acrr核酸序列中的突变与soxr中的突变的组合,所述突变体acrr蛋白在dna结合结构域(残基7-51)或配体结合结构域(残基55-204)中具有突变,所述acrr核酸序列中的突变包括以下之一:参考seq id no:4,v29被另一种氨基酸的取代、y49处的移码突变、a191处的移码突变或t32处的移码突变,所述soxr中的突变选自以下任一种:参考seq id no.2,r20被另一种氨基酸的取代、r20被另一种氨基酸的取代、残基146的缺失(核酸残基435、436、437的缺失)或残基139处的截短。在一种实施方案中,r20被h取代。在一种实施方案中,r20被l取代。例如,微生物可以包含含有以下突变组合之一的核酸序列:
[0094]
·
acrr(v29)和soxr(r20l)
[0095]
·
acrr(y49fs)和soxr(r20l)
[0096]
·
acrr(a191fs)和soxr(r20l)
[0097]
·
acrr(t32fs)和soxr(r20l)
[0098]
·
acrr(v29)和soxr(r20h)
[0099]
·
acrr(y49fs)和soxr(r20h)
[0100]
·
acrr(a191fs)和soxr(r20h)
[0101]
·
acrr(t32fs)和soxr(r20h)
[0102]
·
acrr(v29)和soxr(146del)
[0103]
·
acrr(y49fs)和soxr(146del)
[0104]
·
acrr(a191fs)和soxr(146del)
[0105]
·
acrr(t32fs)和soxr(146del)
[0106]
·
acrr(v29)和soxr(leu139x)
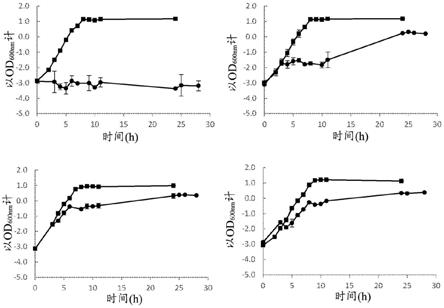
[0107]
·
acrr(y49fs)和soxr(leu139x)
[0108]
·
acrr(a191fs)和soxr(leu139x)
[0109]
·
acrr(t32fs)和soxr(leu139x)
[0110]
在一种实施方案中,微生物可以包含在编码突变体acrr蛋白的acrr核酸序列中的突变与marr中的突变的组合,所述突变体acrr蛋白在dna结合结构域(残基7-51)或配体结合结构域(残基55-204)中具有突变,所述acrr核酸序列中的突变包括以下之一:参考seq id no:4,v29被另一种氨基酸的取代、y49处的移码突变、a191处的移码突变或t32处的移码突变,所述marr中的突变选自:参考seq id no.8,v84被另一种氨基酸的取代。在一种实施方案中,v84被g取代。例如,微生物可以包含含有以下突变组合之一的核酸序列:
[0111]
·
acrr(v29)和marr(v84g)
[0112]
·
acrr(y49fs)和marr(v84g)
[0113]
·
acrr(a191fs)和marr(v84g)
[0114]
·
acrr(t32fs)和marr(v84g)
[0115]
在一种实施方案中,微生物可以包含在编码突变体acrr蛋白的acrr核酸序列中的突变与rob中的突变的组合,所述突变体acrr蛋白在dna结合结构域(残基7-51)或配体结合结构域(残基55-204)中具有突变,所述acrr核酸序列中的突变包括以下之一:参考seq id no:4,v29被另一种氨基酸的取代、y49处的移码突变、a191处的移码突变或t32处的移码突变,所述rob中的突变选自:参考seq id no.6,rob中a70被另一种氨基酸的取代,或r156被另一种氨基酸的取代。在一种实施方案中,a70被v或t取代。在一种实施方案中,r156被h取代。例如,微生物可以包含含有以下突变组合之一的核酸序列:
[0116]
·
acrr(v29)和rob(156h)
[0117]
·
acrr(y49fs)和rob(156h)
[0118]
·
acrr(a191fs)和rob(156h)
[0119]
·
acrr(t32fs)和rob(156h)
[0120]
·
acrr(v29)和rob(a70t)
[0121]
·
acrr(y49fs)和rob(a70t)
[0122]
·
acrr(a191fs)和rob(a70t)
[0123]
·
acrr(t32fs)和rob(a70t)
[0124]
·
acrr(v29)和rob(a70v)
[0125]
·
acrr(y49fs)和rob(a70v)
[0126]
·
acrr(a191fs)和rob(a70v)
[0127]
·
acrr(t32fs)和rob(a70v)
[0128]
对于以上实施方案,参考是针对某些突变作出的。如本文解释的,这些是指提及的基因/蛋白的大肠杆菌蛋白序列中的位置(蛋白序列分别参见seq id no 2、4、6和8)。
[0129]
在一种实施方案中,微生物可以包含以上描述的两种或更多种突变体核酸序列的组合。例如,微生物可以在选自soxr、rob、acrr和marr核酸序列的至少两种核酸序列或其同源物中具有突变。因此,微生物可以在soxr和rob核酸序列、soxr和acrr核酸序列、soxr和marr核酸序列、rob和acrr核酸序列、rob和marr核酸序列或者acrr和marr核酸序列或其同源物中包含突变。
[0130]
在另一种实施方案中,微生物可以在选自soxr、rob、acrr和marr核酸序列的至少两种核酸序列或其同源物中包含突变。因此,微生物可以在soxr、acrr和rob核酸序列或其同源物中包含突变。因此,微生物可以在soxr、acrr和marr核酸序列或其同源物中包含突变。因此,微生物可以在rob、acrr和marr核酸序列或其同源物中包含突变。
[0131]
在另一种实施方案中,微生物可以在选自soxr、rob、acrr和marr核酸序列的四种核酸序列或其同源物中包含突变。
[0132]
在一种实施方案中,微生物可以包含选自表1a中示出的那些的一种或更多种遗传突变。
[0133]
表1a赋予增加的对甲基丙烯酸酯的耐受性的突变
no 9)、yohj(seq id no 11)、tory(seq id no 13)、ipxm(seq id no 15)、dnak(seq id no 17)、grol(seq id no 19)、ilvn(seq id no 21)、phop(seq id no 31)、ygbk(seq id no 23)或其同源物。在另一种实施方案中,不存在对氧化应激响应或多药耐药系统的蛋白组分或调节物的另外的修饰。
[0137]
在一种实施方案中,一个或更多个另外的突变选自表1b中列出的遗传突变。
[0138]
表1b
[0139]
[0140]
[0141][0142]
在一种实施方案中,微生物选自具有如以下列出的一个或更多个遗传突变的微生物:
[0143]-rob(r156h)rpoc(l361r)ilvn(c41y)ygbk(a294e)ipxm(168_185del);
[0144]-rob(r156h)i/vn(c41y)phop(l11f)acrb(v448l);
[0145]-soxr(leu139x)580116(g>t);
[0146]-ssoxr(a146 del));
[0147]-rob(a70v);
[0148]-rob(r156h)rpob(t1037p)tory(a87t)acrr(49yfs);
[0149]-rob(a70t)yohj(l109r)dnak(v377g)927777(c>t)acrr(a191fs);
[0150]-marr(v84g)rpoc(r1075c)ompr(r15s)acrb(t379i);
[0151]-marr(v84g)rpoc(r1075c)ompr(r15s);
[0152]-marr(v84g)rpoc(r1075c)rpoc(a787v)ompr(r15s)acrb(v901i);
[0153]-rob(r156h)rpob(t1037p)grol(p279l)acrr(49yfs)1197659(c>a)或
[0154]-soxr(r20l)rpoc(r1075c)2133236(t>a)3915915(t>g)。
[0155]
如本文解释的,可以在野生型生物体中引入上文示出的突变,以赋予对甲基丙烯酸酯的耐受性。本文描述的核酸可以通过一个或更多个核苷酸的插入、取代或缺失来突变。
[0156]
用于靶基因操纵(包括失活或敲除)的技术是本领域熟知的。这些技术包括使用靶向感兴趣基因并且允许整合允许转基因在特定位点处的整合的载体的基因靶向。靶向构建体被工程化为与靶基因重组,这通过将来自基因本身的序列掺入到构建体中来实现。然后
重组发生在基因中该序列的区域中,产生外来序列的插入以破坏基因。随着其序列的中断,改变的基因被翻译成非功能蛋白,如果它被翻译的话。其他技术包括如下文描述的基因组编辑(靶向基因组工程)。也可以通过将微生物暴露于诱变剂来引入突变。诱变剂可以是快中子辐射或化学诱变剂,例如选自以下非限制性清单的化学诱变剂:甲磺酸乙酯(ems)、甲磺酸甲酯(mms)、n-乙基-n-亚硝基脲(enu)、三乙基密胺(triethylmelamine)(1
′
eμ)、n-甲基-n-亚硝基脲(mnu)、丙卡巴肼、苯丁酸氮芥、环磷酰胺、硫酸二乙酯、丙烯酰胺单体、美法仑、氮芥(nitrogen mustard)、长春新碱、二甲基亚硝胺、n-甲基-n'-硝基-亚硝基胍(mnng)、亚硝基胍、2-氨基嘌呤、7,12二甲基-苯并蒽(dmba)、环氧乙烷、六甲基磷酰胺、白消安(bisulfan)、二环氧烷烃(diepoxyalkanes)(二环氧辛烷(deo)、二环氧丁烷(beb)等)、2-甲氧基-6-氯-9[3-(乙基-2-氯乙基)氨基丙基氨基]吖啶二盐酸盐(icr-170)或甲醛。
[0157]
最近,基因组编辑技术已经作为常规诱变方法(诸如物理和化学诱变)或使用转基因在植物中的表达来产生具有改进的表型(在农业中是重要的)的突变体植物的方法的替代方法出现。这些技术采用序列特异性核酸酶(ssn),包括锌指核酸酶(zfn)、转录激活物样效应物核酸酶(talen)和rna指导的核酸酶cas9(crispr/cas9),所述序列特异性核酸酶(ssn)产生靶向的dna双链断裂(dsb),然后靶向的dna双链断裂(dsb)主要通过易错非同源末端连接(nhej)或高保真同源重组(hr)进行修复。靶向基因组修饰或靶向基因组编辑是使用靶向的dna双链断裂(dsb)通过同源重组(hr)介导的重组事件刺激基因组编辑的基因组工程技术。为了经由位点特异性dna dsb的引入实现有效的基因组编辑,可以使用四大类可定制的dna结合蛋白:来源于微生物可移动遗传元件的兆核酸酶(meganuclease)、基于真核转录因子的zf核酸酶、来自黄单胞菌属(xanthomonas)细菌的转录激活物样效应物(tale),和来自ii型细菌适应性免疫系统crispr(成簇规律间隔短回文重复序列)的rna指导的dna内切核酸酶cas9。兆核酸酶、zf和tale蛋白都通过蛋白-dna相互作用识别特异性dna序列。尽管兆核酸酶使其核酸酶结构域和dna结合结构域成为一体,但zf和tale蛋白由分别靶向3个或1个核苷酸(nt)的dna的个体模块组成。zf和tale可以以期望的组合组装,并且附接至fokl的核酸酶结构域,以将溶核活性导向特定的基因组基因座。经由细菌iii型分泌系统递送到宿主细胞后,tal效应物进入核,与宿主基因启动子中的效应物特异性序列结合并激活转录。它们的靶向特异性由串联的33-35个氨基酸重复序列的中央结构域决定。这之后是20个氨基酸的单个截短重复序列。大多数经检查的天然存在的tal效应物具有12个和27个之间的完全重复序列。
[0158]
这些重复序列彼此仅有两个相邻的氨基酸(其重复序列可变双残基(rvd))差异。rvd决定tal效应物识别哪种单核苷酸:一种rvd对应于一种核苷酸,其中四种最常见的rvd各自优先与四种碱基中的一种缔合。天然存在的识别位点前面统一有tal效应物活性所需的t。tal效应物可以与fokl核酸酶的催化结构域融合以产生tal效应物核酸酶(talen),tal效应物核酸酶(talen)在体内产生靶向的dna双链断裂(dsb)用于基因组编辑。该技术在基因组编辑中的使用在本领域中被充分描述,例如在us 8,440,431、us 8,440,432和us 8,450,471中被充分描述。定制的质粒,可以与golden gate克隆方法一起使用,以组装多个dna片段。golden gate方法使用iis型限制性内切核酸酶,该iis型限制性内切核酸酶在其识别位点外裂解,以产生独特的4bp突出端(overhang)。由于正确的组装消除了酶识别位点,因此通过在同一反应混合物中消化和连接来加速克隆。定制talen或tal效应物构建体
的组装包括两个步骤:(i)将重复序列模块组装成1-10个重复序列的中间阵列,以及(ii)将中间阵列连接成骨架,以形成最终的构建体。
[0159]
根据本发明的多个方面,可以使用的另一种基因组编辑方法是crispr。该技术在基因组编辑中的使用在本领域中被良好描述,例如在us 8,697,359和本文引用的参考文献中被良好描述。简言之,crispr是参与防御入侵噬菌体和质粒的微生物核酸酶系统。微生物宿主中的crispr基因座包含crispr相关(cas)基因以及能够编程crispr介导的核酸裂解的特异性的非编码rna元件(sgrna)的组合。三种类型(i-iii)的crispr系统已在许多的细菌宿主中被鉴定。每个crispr基因座的一个关键特征是存在由非重复序列的短链段(间隔物)间隔开的重复序列(同向重复序列)的阵列。非编码crispr阵列在同向重复序列中被转录和裂解成包含个体间隔物序列的短crrna,其将cas核酸酶导向靶位点(前间区(protospacer))。ii型crispr是最良好表征的系统之一,并且以四个连续步骤进行靶向的dna双链断裂。第一,两个非编码rna前crrna阵列和tracrrna,由crispr基因座转录。第二,tracrrna与前crrna的重复序列区域杂交,并且介导将前crrna加工成包含个体间隔物序列的成熟crrna。第三,成熟的crrna:tracrrna复合物经由crrna上的间隔物和邻近前间区相邻基序(pam)的靶dna上的前间区之间的watson-crick碱基配对将cas9导向靶dna,这是靶识别的附加要求。最后,cas9介导靶dna的裂解,以在前间区内产生双链断裂。
[0160]
因此,cas9是ii型crispr-cas系统的标志蛋白,并且是一种大单体dna核酸酶,通过两个非编码rna:cripsr rna(crrna)和反式激活crrna(tracrrna)的复合物指导至与pam(前间区相邻基序)序列基序相邻的dna靶序列。cas9蛋白包含与ruvc和hnh核酸酶同源的两个核酸酶结构域。hnh核酸酶结构域裂解互补dna链,而ruvc样结构域裂解非互补链,结果,在靶dna中引入了平端切割(blunt cut)。cas9与sgrna一起异源表达可以将位点特异性双链断裂(dsb)引入来自多种生物体的活细胞的基因组dna中。对于在真核生物体中的应用,已经使用cas9的密码子优化形式,cas9最初来自细菌酿脓链球菌(streptococcus pyogenes)。
[0161]
单指导rna(sgrna)是crispr/cas系统的第二组分,与cas9核酸酶形成复合物。sgrna是合成的rna嵌合体,通过将crrna与tracrrna融合而产生。位于其5’末端的sgrna指导序列赋予dna靶特异性。因此,通过修饰指导序列,可能产生具有不同靶特异性的sgrna。指导序列的典型长度通常是20bp。
[0162]
可选地,全局转录机器工程(global transcription machinery engineering,gtme)可以为菌株改进提供替代且有用的方法。
[0163]
在一种实施方案中,通过用bma施加选择压力从微生物群体中选择耐受性突变体来分离突变体。已知,微生物群体包含以低频率(<106中的1个)自发出现的突变体,并且施加选择压力引起最适突变体的过度生长。例如,通过逐渐增加bma的浓度或通过从开始添加高浓度(10%-30%)的bma来施加选择压力。选择压力可以包括(a)分批培养,直至观察到生长;(b)2次或更多次转移的连续分批培养;(c)恒化器培养物随着递增的bma浓度和递增的稀释速率的生长;(4)ph-auxostat或恒浊器培养物随着递增的bma浓度的生长。
[0164]
甲基丙烯酸c
3-c
12
酯
[0165]
术语甲基丙烯酸c
3-c
12
酯通常意指包含c
3-c
12
烷基、羟烷基、烯基、烷基芳基或烯基芳基基团的甲基丙烯酸酯,包括其结构异构体。c
3-c
12
基团可以是环状的、无环的或部分环
状的、直链的或支链的、脂肪族的、芳族的或部分芳族/脂肪族的。优选地,本发明的甲基丙烯酸c
3-c
12
酯可以包括例如甲基丙烯酸正丙酯、甲基丙烯酸异丙酯、甲基丙烯酸异丁酯、甲基丙烯酸正丁酯、甲基丙烯酸叔丁酯、甲基丙烯酸异戊酯、甲基丙烯酸己酯、甲基丙烯酸环己酯、甲基丙烯酸2-乙基己酯、甲基丙烯酸癸酯、甲基丙烯酸十二烷基酯、甲基丙烯酸羟乙酯、甲基丙烯酸羟丙酯、甲基丙烯酸异冰片酯、甲基丙烯酸烯丙酯或甲基丙烯酸肉桂酯。
[0166]
优选地,甲基丙烯酸c
3-c
12
酯是甲基丙烯酸c
3-c
12
烷基酯,更优选地甲基丙烯酸c
3-c8烷基酯,例如甲基丙烯酸正丙酯、甲基丙烯酸异丙酯、甲基丙烯酸异丁酯、甲基丙烯酸正丁酯、甲基丙烯酸异戊酯、甲基丙烯酸己酯、甲基丙烯酸环己酯、甲基丙烯酸庚酯、甲基丙烯酸辛酯、甲基丙烯酸2-乙基己酯、甲基丙烯酸癸酯或甲基丙烯酸十二烷基酯。
[0167]
优选地,甲基丙烯酸羟烷基酯是甲基丙烯酸羟乙酯或甲基丙烯酸羟丙酯。
[0168]
在实施方案中,甲基丙烯酸c
3-c
12
酯是甲基丙烯酸c
3-c
12
烯基芳基酯,例如甲基丙烯酸肉桂酯。
[0169]
更优选地,甲基丙烯酸c
3-c
12
烷基酯是甲基丙烯酸c
3-c6烷基酯,诸如甲基丙烯酸丙酯、甲基丙烯酸丁酯或甲基丙烯酸己酯,包括例如其结构异构体。更优选地,甲基丙烯酸c
3-c6烷基酯是甲基丙烯酸丙酯或甲基丙烯酸丁酯,特别地甲基丙烯酸异丙酯或甲基丙烯酸正丁酯。
[0170]
在一种实施方案中,甲基丙烯酸c
3-c
12
酯是甲基丙烯酸丁酯(bma)。
[0171]
为了产生mma,本文描述的方法可以包括另外的步骤:c)从发酵培养基中取出甲基丙烯酸c
3-c
12
酯,并将所取出的甲基丙烯酸c
3-c
12
酯与甲醇进行酯交换,以产生甲基丙烯酸甲酯。
[0172]
在本发明的方面和实施方案中,微生物可以被遗传修饰以产生比野生型更多的甲基丙烯酸c
3-c
12
酯。因此,微生物具有与本文描述的野生型相比使其对甲基丙烯酸酯更耐受的并且与野生型相比被修饰以增加甲基丙烯酸c
3-c
12
酯的产量的突变,例如,微生物携带表达甲基丙烯酸c
3-c
12
酯生物合成途径的酶的转基因构建体。
[0173]
因此,如本文描述的用于产生甲基丙烯酸酯的方法可以包括a)提供与野生型相比具有增加的对甲基丙烯酸c
3-c
12
酯的耐受性并且被进一步修饰以与野生型相比在发酵培养基中增加甲基丙烯酸c
3-c
12
酯产量的遗传修饰的微生物,和
[0174]
b)使微生物在产生甲基丙烯酸c
3-c
12
酯的条件下生长。
[0175]
与野生型微生物相比,增强甲基丙烯酸c
3-c
12
酯的产生可以包括通过使用本领域已知的多种遗传工程技术对现有的细胞代谢过程、核酸和/或蛋白进行修饰。增强甲基丙烯酸c
3-c
12
酯的产生还可以包括修饰一种或更多种微生物以在一种或更多种微生物中表达一个或更多个异源基因。这些可以包括编码从碳基原料至甲基丙烯酸c
3-c
12
酯的期望途径的酶的基因,或者可以包括直接或间接促进这样的途径中的酶的功能和表达的其他辅助基因。因此,在一种实施方案中,可以修饰微生物以增强甲基丙烯酸c
3-c
12
酯的产生。可以在微生物中表达使得其被修饰以产生甲基丙烯酸c
3-c
12
酯,优选地甲基丙烯酸c
3-c
12
烷基酯的一个或更多个基因,包括编码以下任何酶的基因。异源基因可以通过用包含异源基因的载体转化微生物来表达。
[0176]
在实施方案中,微生物可以表达能够将异丁酰coa转化为甲基丙烯酰coa的一种或更多种酶,例如氧化酶、脱氢酶或氧化还原酶。
[0177]
氧化酶可以是ec编号1.3.x.x下的作用于ch-ch键的氧化酶,更优选地ec编号ec 1.3.3.x下的使用氧作为电子受体作用于ch-ch键的氧化酶。仍更优选地,氧化酶是合适地在ec编号ec 1.3.3.6下的酰基coa氧化酶。更优选地,酰基coa氧化酶选自以下酶中任一种:来自拟南芥(arabidopsis thaliana)的acx4、来自烟草节杆菌(arthrobacter nicotianae)的短链酰基coa氧化酶、来自绿豆(vigna radiata)的过氧化物酶体酰基coa氧化酶、来自假丝酵母属物种(candida sp.)的酰基coa氧化酶和来自热带假丝酵母(candida tropicalis)的酰基coa氧化酶4。最优选地,酰基coa氧化酶是来自拟南芥的acx4。
[0178]
氧化还原酶可以是ec组编号1.x.x.x下的氧化还原酶。优选地,氧化还原酶是合适地在ec组1.3.x.x下的作用于电子供体的ch-ch基团的氧化还原酶。更优选地,作用于供体的ch-ch基团的氧化还原酶是fad依赖性氧化还原酶,仍更优选地,氧化还原酶是ec组1.3.8.x下的coa脱氢酶。仍更优选地,氧化还原酶是合适地在ec组1.3.8.1下的短链酰基coa脱氢酶、合适地在ec组1.3.8.4组下的异戊酰coa脱氢酶、合适地在ec组1.3.8.5下的2-甲基支链酰基coa脱氢酶或合适地在ec组1.3.8.-下的酰基coa脱氢酶,诸如异丁酰coa脱氢酶。最优选地,氧化还原酶选自以下酶中的任一种:来自恶臭假单胞菌的短/支链酰基coa脱氢酶、来自智人(homo sapiens)的异丁酰coa脱氢酶和来自拟南芥的异戊酰coa脱氢酶。
[0179]
coa脱氢酶通常需要相关的电子传递系统来将底物的氧化与泛醌的还原偶联,然后泛醌被再生。这样的电子传递系统由电子转移黄素蛋白(etf)和电子转移黄素蛋白泛醌氧化还原酶(etfqo)组成。etf必须与酰基coa脱氢酶和etfqo二者相容。因此,在使用酰基coa脱氢酶的实施方案中,优选地采用以下再生系统之一:
[0180]
·
表达对异丁酰coa具有活性的内源coa脱氢酶及其相关的电子传递系统(诸如在例如恶臭假单胞菌的情况下)的宿主微生物;
[0181]
·
表达异源coa脱氢酶伴有来自与该异源coa脱氢酶相同生物体的电子传递系统的蛋白的宿主微生物。例如,来自智人、恶臭假单胞菌、脱氮副球菌(paracoccus denitrificans)或来自拟南芥的coa脱氢酶和电子传递系统组分,都在大肠杆菌(或另一种宿主生物)中表达;或者
[0182]
·
表达异源coa脱氢酶伴有也来自不同微生物的电子传递系统组分的宿主微生物,其中这些组分彼此相容并与coa脱氢酶相容。例如,来自智人的coa脱氢酶与野猪(sus scrofa)的电子转移黄素蛋白相容,继而与来自类球红细菌(rhodobacter sphaeroides)的电子转移黄素蛋白泛醌氧化还原酶相容。可选地,由于拟南芥(a.thaliana)的etf-泛醌氧化还原酶与类球红细菌(r.sphaeroides)的etf-泛醌氧化还原酶具有良好的序列同源性,拟南芥的异戊酰coa脱氢酶和etf可以与来自类球红细菌的etf-泛醌氧化还原酶形成功能系统,用于异丁酰coa的氧化。最后,由于脱氮副球菌(p.denitrificans))etf与人类和猪etf的相似性,预测来自脱氮副球菌的etf和etf-泛醌氧化还原酶与来自另一种来源的异丁酰coa脱氢酶,诸如来自智人(h.sapiens)的异丁酰coa脱氢酶或来自不同生物体的同源物相容。
[0183]
在实施方案中,微生物可以表达能够将甲基丙烯酰coa转化为甲基丙烯酸c
3-c
12
酯的一种或更多种酶,例如醇酰基转移酶。
[0184]
优选地,醇酰基转移酶在醇,更优选地c
3-c
12
醇,最优选地c
3-c8醇的存在下起作用,仍更优选在丙醇或丁醇,诸如正丙醇、异丙醇、正丁醇、异丁醇、仲丁醇、叔丁醇、戊醇、己醇、
庚醇或辛醇的存在下起作用。最优选地,醇酰基转移酶在异丙醇或正丁醇的存在下起作用。
[0185]
本文的术语醇意指具有羟基基团(-oh基团)并且能够与甲基丙烯酸酯形成酯基团的物质。
[0186]
优选地,醇酰基转移酶来源于植物起源,更优选地,植物属于选自由以下组成的组的任何目:姜目(zingiberales)、蔷薇目(rosales)、杜鹃花目(ericales)、葫芦目(cucurbitales)、十字花目(brassicales)和樟目(laurales);更优选地,植物属于选自由以下组成的组的任何科:芭蕉科(musaceae)、蔷薇科(rosaceae)、杜鹃花科(ericaceae)、猕猴桃科(actinidiaceae)、葫芦科(cucurbitaceae)、番木瓜科(caricaceae)和樟科(lauraceae);仍更优选地,植物属于选自由以下组成的组的属:芭蕉属(musa)、草莓属(fragaria)、苹果属(malus)、李属(prunus)、梨属(pyrus)、越橘属(vaccinium)、猕猴桃属(actinidia)、黄瓜属(cucumis)、番木瓜属(carica)和鳄梨属(persea);仍更优选地,植物是选自由以下组成的组的任何一种:香蕉、草莓、苹果、梅花(prunus mume)、西洋梨(pyrus communis)、蓝莓、猕猴桃、甜瓜、番木瓜和鳄梨组成的组的任何一种。最优选地,醇酰基转移酶来源于水果起源,诸如苹果、甜瓜或番茄起源,合适地苹果起源。
[0187]
在本发明的实施方案中,微生物可以表达用于将异丁酰coa转化为甲基丙烯酸c
3-c
12
酯的氧化酶和醇酰基转移酶。上文概述了合适的氧化酶和醇酰基转移酶。如果氧化酶是来自拟南芥的acx4,则是特别优选的。
[0188]
在实施方案中,微生物可以表达能够将2-酮异戊酸转化为异丁酰coa的一种或更多种酶。在实施方案中,一种或更多种酶可以是酶复合物,诸如支链酮酸脱氢酶酶复合物,支链酮酸脱氢酶酶复合物由α亚基组分、硫辛酰胺酰基转移酶组分和硫辛酰胺脱氢酶组分组成。最优选地,脱氢酶选自以下酶中的任何一种:来自恶臭假单胞菌(p.putida)的支链酮酸脱氢酶(bckd)、来自枯草芽孢杆菌的bckd、来自铜绿假单胞菌的bckd、来自拟南芥的bckd、来自天蓝色链霉菌的bckd和来自嗜热栖热菌(thermus thermophilus)的bckd。
[0189]
可选地,可以通过以下催化2-酮异戊酸转化为异丁酰coa:合适地在ec组1.x.x.x下的氧化还原酶,优选地合适地在ec组1.2.x.x下的作用于供体的醛或氧代基团的氧化还原酶,更优选地合适地在ec组1.2.7.x下的使用铁-硫蛋白作为电子受体作用于供体的醛或氧代基团的氧化还原酶,最优选地合适地在ec组编号1.2.7.7下的2-酮异戊酸铁氧还蛋白还原酶(也称为酮缬氨酸铁氧还蛋白氧化还原酶),是由α、β、γ和δ亚基组成的四聚体。这样的酶的实例是来自强烈火球菌(pyrococcus furiosis)的2-酮异戊酸铁氧还蛋白还原酶;来自火球菌属物种(pyrococcus sp.)的2-酮异戊酸铁氧还蛋白还原酶;来自热球菌属物种(thermococcus sp.)的2-酮异戊酸铁氧还蛋白还原酶;来自thermococcus litoralis的2-酮异戊酸铁氧还蛋白还原酶;来自thermococcus profundus的2-酮异戊酸铁氧还蛋白还原酶和来自热自养甲烷杆菌(methanobacterium thermoautotrophicum)的2-酮异戊酸铁氧还蛋白还原酶。
[0190]
可选地,微生物可以表达能够将异丁酸转化为异丁酰coa的一种或更多种酶,例如连接酶。连接酶合适地在ec组编号6.x.x.x下,优选地在ec组6.2.x.x下的碳-硫键形成连接酶,更优选地在ec组6.2.1.x下的酸-硫醇形成连接酶,更优选地gdp形成、adp形成或amp形成连接酶,诸如合适地在ec组6.2.1.1下的amp形成乙酸-coa连接酶,合适地在ec组6.2.1.2下的丁酸-coa连接酶,合适地在ec组6.2.1.10下的羧酸-coa连接酶,合适地在ec组
6.2.1.13下的adp形成乙酸-coa连接酶,合适地在ec组6.2.1.17下的丙酸-coa连接酶或在ec组6.2.1.-下的酸-硫醇连接酶。最优选地,连接酶选自以下酶中任一种:来自绿针假单胞菌(pseudomonas chlororaphis)的acsa、来自拟青霉(paecilomyces varioti)的丁酰-coa合成酶、来自牛心脏线粒体的丁酰-coa合成酶。
[0191]
可选地,微生物可以表达能够将异丁酸(isobutyrate)转化为异丁酰coa的一种或更多种酶。例如,异丁酸可以通过激酶转化为异丁酰-磷酸酯,并且异丁酰-磷酸酯可以通过转移酶转化为异丁酰-coa。
[0192]
优选地,异丁酸通过以下转化为异丁酰基-磷酸酯:合适地在ec组编号ec 2.x.x.x下的激酶,优选地在ec 2.7.x.x下的激酶,更优选地在ec组编号ec 2.7.2.x下的激酶,最优选地合适地在ec组2.7.2.1下的乙酸激酶,在ec 2.7.2.6下的甲酸激酶,在ec 2.7.2.7下的丁酸激酶,在ec 2.7.2.14下的支链脂肪酸激酶或在ec 2.7.2.15下的丙酸激酶。最优选地,激酶选自以下酶的任何一种:来自螺旋体(spirochete)ma-2的支链脂肪酸激酶、来自丁酸梭菌(c.butyricum)的丁酸激酶。
[0193]
优选地,异丁酰-磷酸酯通过以下转化为异丁酰-coa:通过在ec组编号2.x.x.x下的转移酶的作用,更优选地通过在ec组编号2.3.x.x下的酰基转移酶的作用,仍更优选地通过在ec组编号2.3.1.x下的转移除氨基-酰基基团以外的基团的酰基转移酶的作用。仍更优选地分别在ec组编号2.3.1.8和2.3.1.19下的磷酸乙酰转移酶或磷酸丁酰基转移酶。更优选地,转移酶是来自丙酮丁醇梭菌(clostridium acetobutylicum)atcc824的磷酸丁酰基转移酶或来自枯草芽孢杆菌、谷氨酸棒杆菌(corynebacterium glutamicum)atcc13032、海栖热袍菌(thermotoga maritima)和克氏梭菌(clostridium kluyveri)的磷酸乙酰转移酶。这些酶的其他来源包括其他厌氧细菌,特别地,梭菌属物种,诸如巴氏梭菌(clostridium pasteurianum)或拜氏梭菌(clostridium beijerinckii)。
[0194]
微生物可以表达能够将异丁酸转化为异丁酰coa的一种或更多种酶,例如合酶,优选地异丁酰coa合酶,最优选地来自绿针假单胞菌(p.chloraphis)b23的异丁酰coa合酶(acsa)。
[0195]
使用的合适的修饰和构建体还在wo2016/185211中公开,该文献通过引用并入本文。
[0196]
发酵培养基和发酵
[0197]
在另一方面,本发明涉及一种发酵培养基,该发酵培养基包含与野生型微生物相比具有增加的对甲基丙烯酸酯的耐受性的分离的遗传修饰的微生物。具体增加的耐受性的遗传修饰的微生物包含如以上描述的氧化应激响应或多药耐药系统的蛋白组分或调节物的修饰。
[0198]
在一种实施方案中,在一种或更多种微生物将产生甲基丙烯酸c
3-c
12
酯的条件下将所述微生物提供在发酵培养基中。
[0199]
本发明的多个方面和实施方案包括将野生型或遗传修饰的微生物在所述发酵培养基中培养。合适地,培养(culturing)或培养(cultivation)需要碳基原料,微生物可以在该原料上获得能量并生长。因此,优选地,在碳基原料上培养一种或更多种微生物。
[0200]
发酵培养基可以是围绕一种或更多种微生物的周围培养基。优选地,碳基原料存在于培养基中,任选地溶解或悬浮在培养基中,鼓入通过(bubbled through)培养基和/或
与培养基混合。因此,优选地,培养基包含一种或更多种微生物和碳基原料连同任何缓冲剂和盐。
[0201]
发酵培养基可以是适于微生物需要的商购可得的任何培养基。发酵培养基合适地包含碳基原料和氮源,以及一种或更多种微生物的生长和/或形成甲基丙烯酸c
3-c
12
酯所需的另外的化合物。
[0202]
本领域已知的合适的碳基原料的实例包括葡萄糖、麦芽糖、麦芽糖糊精、蔗糖、水解淀粉、淀粉、木质素、芳烃(aromatics)、合成气或其组分、甲烷、乙烷、丙烷、丁烷、糖蜜和油、二氧化碳。优选地,碳基原料来源于生物质。还可以使用混合物以及废弃物,诸如城市废弃物、食品废弃物和来自食品加工、林业或农业的木质纤维素废弃物。
[0203]
本领域已知的合适氮源的实例包括大豆粉、玉米浆、酵母提取物、氨、铵盐、硝酸盐、尿素、氮气或其他含氮源。
[0204]
一种或更多种微生物的生长可能需要(并且因此可能存在于发酵培养基中)的另外的化合物的实例包括抗生素、抗真菌剂、抗氧化剂、缓冲剂、磷酸盐(phosphate)、硫酸盐(sulphate)、镁盐、微量元素和/或维生素。
[0205]
可以以不同类别的微生物之间,即真菌、酵母和细菌之间不同的量添加一种或更多种微生物的生长和/或产生甲基丙烯酸c
3-c
12
酯所需的另外的化合物,如磷酸盐、硫酸盐或微量元素。此外,待添加的另外的化合物的量可以由何种途径用于形成甲基丙烯酸c
3-c
12
酯来决定。
[0206]
待添加至培养基中的碳基原料和氮源的量可以根据一种或更多种微生物的需要和/或微生物培养的时长而变化。培养基中碳基原料与氮源的比例可以显著不同。
[0207]
通常,微生物的生长所需的每种发酵培养基组分的量通过测量营养物上的生长量(growth yield)确定,并且根据培养过程中使用的碳基原料的量来进一步评估,因为形成的生物质的量主要由使用的碳基原料的量和在任何给料方案期间施加的营养物限制来决定。
[0208]
在碳基原料来源于生物质的实施方案中,生物质优选地包含大量碳水化合物。特别优选的是作为c5或c6糖、碳基气体或芳烃的来源,优选地作为c5或c6糖的来源,更优选地作为葡萄糖的来源的碳水化合物,诸如但不限于淀粉、木质素、纤维素、糖原、阿拉伯木聚糖、壳多糖或果胶。
[0209]
可选地,生物质可以包含大量脂肪,特别优选的是作为甘油和脂肪酸的来源的脂肪或油,具体地甘油三酯。合适的甘油三酯包括可容易从植物或动物来源获得的任何油或脂肪。这样的油和脂肪的实例包括棕榈油、亚麻籽油、菜籽油、猪油、黄油、鲱鱼油、椰子油、植物油、向日葵油、蓖麻油、大豆油、橄榄油、可可脂、酥油(ghee)、鲸脂(blubber)等。
[0210]
生物质可以由一种或更多种不同的生物质来源组成。合适的生物质来源的实例包括原生木材(virgin wood)、能源作物、农业残余物、食品弃废物、城市废弃物和工业废弃物或副产品。
[0211]
原生木材生物质来源可以包括但不限于木屑、树皮、残枝(brash)、原木、锯屑、木屑颗粒或木块。
[0212]
能源作物生物质来源可以包括但不限于短轮伐期矮林或森林、非木本草类诸如芒属植物(miscanthus)、大麻柳枝稷、芦苇或黑麦、农业作物诸如糖、淀粉或油料作物、或水生
植物诸如微藻或大型藻类;和杂草。
[0213]
农业残余物可以包括但不限于皮壳、秸秆、玉米秸秆、面粉、谷物、家禽褥草(poultry litter)、粪肥、泥浆、合成气或青贮饲料。
[0214]
食品废弃物可以包括但不限于外皮/皮、壳、皮壳、核、果仁/果核(stones)、动物或鱼的不可食用部分、来自果汁和油提取的肉质部分、来自酿造的废糟(spent grain)或酒花、家庭厨房废弃物、猪油或油或脂肪。
[0215]
工业废弃物可以包括但不限于未处理的木材(包括颗粒)、处理的木材、页岩气、包括mdf/osd的木质复合材料、木质层压板、纸浆/碎料/废弃物、包括纤维/纱线/流出物(effluent)的纺织品或污水污泥。
[0216]
微生物可以按分批、重复分批、补料分批、重复补料分批或连续培养(恒化器、恒浊器或auxostat)方法来培养。
[0217]
培养方法优选地以工业规模进行。工业规模的方法被理解为包括在体积规模≥0.01m3、优选地≥0.1m3、优选地≥0.5m3、优选地≥5m3、优选地≥10m3、更优选地≥25m3、更优选地≥50m3、更优选地≥100m3、最优选地≥200m3的一个或更多个发酵罐中的培养方法。
[0218]
在实施方案中,培养在生物反应器中进行。生物反应器通常被理解为意指对微生物进行工业培养的容器。生物反应器可以是任何尺寸、数目和形式,并且可以包括用于提供营养物、用于生长的另外的化合物、新鲜培养基、碳基原料、气体添加剂(诸如但不限于空气、氮气、氧气或二氧化碳)的入口。生物反应器还可以包括用于取出大量培养基以从发酵培养基中收集甲基丙烯酸c
3-c
12
酯的出口。生物反应器还可以具有用于对培养物进行取样的出口。生物反应器可以具有用于测量和控制ph的系统。这种ph控制系统用于控制在ph-auxostat培养中的培养基添加。在一些实施方案中,可以使用培养瓶培养。
[0219]
生物反应器通常可以被配置成例如,通过搅拌、摇动、振荡、倒置、将气体鼓入通过培养物等来混合发酵培养基。可选地,一些连续培养物不需要混合,例如使用塞流系统的微反应器系统。生物反应器是本领域常见且熟知的,并且实例可以见于标准教科书中,诸如“biotechnology:a textbook of industrial microbiology,第二版(1989)作者:wulf cruegar和annelise crueger,由thomas d.brock sinauer associates,inc.,sunderland,ma翻译。本发明还涉及包含如本文描述的遗传修饰的生物体的培养基。此外,本发明涉及包含含有如本文描述的遗传修饰的生物体的发酵培养基或培养基的容器。此外,本发明涉及包含含有如本文描述的遗传修饰的生物体的发酵培养基或培养基的试剂盒。
[0220]
突变体生物体及其用途
[0221]
在另一方面,本发明还涉及用于产生甲基丙烯酸酯(例如甲基丙烯酸c
3-c
12
酯)的甲基丙烯酸酯耐受的(特别地甲基丙烯酸c
3-c
12
酯耐受的)分离的遗传修饰的微生物。此外,本发明涉及甲基丙烯酸酯耐受的(特别地甲基丙烯酸c
3-c
12
酯耐受的)分离的遗传修饰的微生物在产生甲基丙烯酸酯(例如甲基丙烯酸c
3-c
12
酯)中的用途。遗传修饰的微生物可以是如以上详细描述的。
[0222]
在另外的方面,本发明涉及甲基丙烯酸酯耐受的(特别地甲基丙烯酸c
3-c
12
酯耐受的)分离的遗传修饰的微生物,所述微生物在marr(seq id no.7)中包含突变,其中参考seq id no.8,所述突变体marr核酸编码具有v84被另一种氨基酸例如g取代的蛋白。在另外的方
面,本发明涉及甲基丙烯酸酯耐受的(特别地甲基丙烯酸c
3-c
12
酯耐受的)分离的遗传修饰的微生物,所述微生物在rob(seq id no.5)中包含突变,其中参考seq id no.6,所述突变体rob核酸编码具有rob中a70被另一种氨基酸取代、r156被另一种氨基酸取代的蛋白。在另外的方面,本发明涉及甲基丙烯酸酯耐受的(特别地甲基丙烯酸c
3-c
12
酯耐受的)分离的遗传修饰的微生物,所述微生物在acrr(seq id no.3)中包含突变,其中参考seq id no:4,所述突变体acrr核酸编码具有t32处的移码突变的蛋白。在另外的方面,本发明涉及甲基丙烯酸酯耐受的(特别地甲基丙烯酸c
3-c
12
酯耐受的)分离的遗传修饰的微生物,所述微生物在soxr(seq id no.1)中包含突变,其中参考seq id no.2,所述突变体soxr核酸编码具有r20被另一种氨基酸取代、残基146的缺失或残基139处的截短的蛋白。
[0223]
在另外的方面,本发明涉及甲基丙烯酸酯耐受的(特别地甲基丙烯酸c
3-c
12
酯耐受的)分离的遗传修饰的微生物,所述微生物在选自以下的两种或更多种核酸中包含突变:soxr、acrr、marr和/或rob核酸或其同源物,其中所述核酸编码突变体蛋白。
[0224]
在另外的方面,本发明涉及甲基丙烯酸酯耐受的(特别地甲基丙烯酸c
3-c
12
酯耐受的)分离的遗传修饰的微生物,所述微生物包含acrr中的突变和在选自以下的核酸中的突变:soxr、marr和/或rob核酸或其同源物,其中所述核酸编码突变体蛋白。
[0225]
根据本发明的多个方面,微生物如以上描述,并且在一种实施方案中,微生物是大肠杆菌。
[0226]
在一种实施方案中,突变体soxr核酸序列编码在dna结合结构域(残基1-80)或在fe-s簇结构域(残基119-154)中具有突变的突变体soxr蛋白。在一种实施方案中,soxr中的突变选自以下之一:参考seq id no.2,r20被另一种氨基酸的取代、r20被另一种氨基酸的取代、残基146的缺失或残基139处的截短。在一种实施方案中,r20被h取代。在一种实施方案中,r20被l取代。在除大肠杆菌之外的微生物中的soxr同源物中的等同位置处的修饰也在本发明的范围内。
[0227]
在一种实施方案中,acrr核酸序列编码在dna结合结构域(残基7-51)或在配体结合结构域(残基55-204)中具有突变的突变体acrr蛋白。在一种实施方案中,acrr中的突变选自以下之一:参考seq id no:3,v29被另一种氨基酸的取代、t32处的移码突变、y49处的移码突变、a191处发生的移码突变、残基146的缺失或残基139处的截短。在一种实施方案中,v29被g取代。在除大肠杆菌之外的微生物中的aerr同源物中的等同位置处的修饰也在本发明的范围内。
[0228]
在一种实施方案中,突变体rob核酸序列编码在n-末端dna结合结构域(残基1-120)和c-末端结构域(残基121-189)中具有突变的突变体rob蛋白。在一种实施方案中,rob中的突变选自以下之一:参考seq id no.6,在rob中a70被另一种氨基酸的取代、或r156被另一种氨基酸的取代。在一种实施方案中,a70被v或t取代。在一种实施方案中,r156被h取代。在除大肠杆菌之外的微生物中的rob同源物中的等同位置处的修饰也在本发明的范围内。
[0229]
在一种实施方案中,突变体marr核酸序列编码在dna结合结构域(残基55-100)中具有突变的突变体marr蛋白。在一种实施方案中,marr中的突变是参考seq id no.8,v84被另一种氨基酸取代。在一种实施方案中,v84被g取代。在除大肠杆菌之外的微生物中的marr同源物中的等同位置处的修饰也在本发明的范围内。
[0230]
在一种实施方案中,存在如表1a中示出的两个或更多个突变。在一种实施方案中,微生物选自具有如以下列出的遗传突变的微生物:
[0231]-rob(r156h)rpoc(l361r)ilvn(c41y)ygbk(a294e)ipxm(168_185del);
[0232]-rob(r156h)i/vn(c41y)phop(l11f)acrb(v448l);
[0233]-soxr(leu139x)580116(g>t);
[0234]-soxr(a146del);
[0235]-rob(a70v);
[0236]-rob(r156h)rpob(t1037p)tory(a87t)acrr(49yfs);
[0237]-rob(a70t)yohj(l109r)dnak(v377g)927777(c>t)acrr(a191fs);
[0238]-marr(v84g)rpoc(r1075c)ompr(r15s)acrb(t3791);
[0239]-marr(v84g)rpoc(r1075c)ompr(r15s);
[0240]-marr(v84g)rpoc(r1075c)rpoc(a787v)ompr(r15s)acrb(v901i);
[0241]-rob(r156h)rpob(t1037p)grol(p279l)acrr(49yfs)1197659(c>a)或
[0242]-soxr(r20l)moc(r1075c)2133236(t>a)3915915(t>g)。
[0243]
在一种实施方案中,soxr中的突变与acrr中的突变组合。如实施例中展示的,本发明人惊讶地发现,将两个基因中的突变组合导致累加的耐受性效应。在一种实施方案中,soxr中的突变与marr中的突变组合。在一种实施方案中,soxr中的突变与rob中的突变组合。
[0244]
在一种实施方案中,微生物还包含例如在编码氧化应激响应的蛋白组分或调节物的基因中的一个或更多个另外的突变。在一种实施方案中,突变处于rpo核酸序列中,例如,rpob(seq id no 25)或rpoc(seq id no 27)、ompr(seq id no 29)、acrb(seq id no 9)、yohj(seq id no 11)、tory(seq id no 13)、ipxm(seq id no 15)、dnak(seq id no 17)、grol(seq id no 19)、ilvn(seq id no 21)、phop(seq id no 31)、ygbk(seq id no 23)。在另一种实施方案中,不存在对氧化应激响应或多药耐药系统的蛋白组分或调节物的另外的修饰。
[0245]
在一种实施方案中,acrr中的突变与marr、rob或soxr之一中的一个或更多个突变组合。这是基于令人惊讶的发现,即发现acrr中的突变与marr、rob或soxr组合(参见实施例2)。
[0246]
在一种实施方案中,acrr中的突变与marr中的一个或更多个突变组合。在一种实施方案中,acrr中的突变与rob中的一个或更多个突变组合。在一种实施方案中,一个或更多个另外的突变选自表1b中列出的突变。
[0247]
用于制造突变体生物体的方法
[0248]
本发明还涉及一种用于分离甲基丙烯酸酯耐受性微生物的方法,该方法包括:
[0249]
a)在发酵培养基中提供微生物
[0250]
b)使微生物与甲基丙烯酸酯接触;和
[0251]
c)分离步骤(b)的存活微生物
[0252]
其中所述存活微生物在约37℃在液体培养基中生长时耐受至少20%v/v的甲基丙烯酸酯。
[0253]
微生物选自如以上描述的微生物,诸如大肠杆菌。在一种实施方案中,该方法采用
适应性进化方法,该适应性进化方法包括将生物体在含有依次递增浓度的甲基丙烯酸酯例如bma的培养基中培养。例如,在第一个步骤中,使微生物与0.1%浓度的甲基丙烯酸酯接触。在随后的步骤中,将浓度从0.1%逐步增加至例如0.5%、1%、5%、10%和20%,并且将微生物暴露于该浓度一定时间段。在另一种实施方案中,将浓度逐步增加至10%和20%。使微生物与每种浓度的甲基丙烯酸酯接触可以是约(0.1h至144小时)1次至45次。在另一种实施方案中,培养温度可以在该方法期间改变。培养温度可以维持在4℃至50℃。在另一种实施方案中,该方法包括将一种培养物与bma一起孵育,直至生长发生,然后分离突变体。
[0254]
例如,适应性进化可以通过以下方式进行:大肠杆菌在恒化器中的适应性进化可以在约0.33h-1
的起始稀释速率建立。然后bma浓度以逐步方式以恒定的稀释速率从0%v/v逐渐增加至20%v/v。在达到约20%v/v bma的稳定细胞浓度后,培养物的稀释速率可以在约0.33h-1
和约0.55h-1
之间调节,其中bma浓度保持恒定在约20%v/v。另外的适应性进化实验通过以下实现:逐步将温度从37℃增加至44℃,同时将bma浓度维持在约20%v/v,并且初始稀释速率约为0.41h-1
。使用ph-auxostat的适应性进化可以使用ph反馈控制系统实现,在该系统中,仅当ph变得低于设定值时,营养物、碱和其他添加剂才会开始流入。生物反应器中培养基的酸化指示培养物中细胞的生长,以其速率控制营养物的添加,并且从而控制稀释速率。稀释速率调节为与施加的条件下培养物的生长速率匹配,并且允许自动选择,其中生长快速的菌株保留在生物反应器中并且生长较慢的菌株被清洗掉。大肠杆菌在ph-auxostat中的进化实验可以在生物反应器中最初没有添加bma的情况下开始。bma浓度可以从0逐渐增加至0.1%v/v、0.5%v/v、1.0%v/v、5.0%v/v、10%v/v和20%v/v。
[0255]
微生物在如以上描述的合适的发酵培养基中在约37℃生长,例如以约200rpm生长。
[0256]
甲基丙烯酸酯是如本文别处描述的。
[0257]
本发明还涉及通过以上描述的方法分离的微生物。
[0258]
本说明书中提及的所有文件,包括基因和蛋白数据库中所有对seq id no的提及,均通过引用以其整体并入本文。除非另有指定,否则序列形式是形式1。
[0259]
在本文中使用的“和/或”被认为是两个指定的特征或组分中的每一个与或不与另一个一起的具体公开。例如“a和/或b”被认为是(i)a、(ii)b和(iii)a和b中的每一个的具体公开,如同每一个在本文中单独列出一样。除非上下文另有指示,否则上文列出的特征的描述和定义不限于本发明的任何特定方面或实施方案,并且同样适用于所描述的所有方面和实施方案。
[0260]
在以下非限制性实施例中进一步描述本发明。
实施例
[0261]
实施例1:bma耐受性突变体菌株的分离和表征
[0262]
在这些实验中使用大肠杆菌k12mg1655。这是常见的实验室菌株,并且该菌株的完整基因组序列是可得的(ncbi参考序列:nc_000913.3)。该菌株可以例如从大肠杆菌遗传保藏中心(the coli genetic stock center)(cgsc)(菌株7636)或atcc获得。
[0263]
我们分离出对bma耐受的大肠杆菌mg1655变体。使大肠杆菌mg1655在含有20%(v/v)bma的msx培养基中在30ml瓶中在37℃、250rpm生长72小时。72h后观察生长。将来自该培
养物的样品划线到lb琼脂板上,并且在37℃孵育过夜。然后分离菌落,并且使用illumina ngs技术根据制造商的指导进行全基因组深度测序分析,以表征突变体。分析了与mg1655参考基因组(登记号nc_00913.1)相比的变体的fastq输出文件。测序分析鉴定出以下突变:
[0264]
大肠杆菌mg1655 soxr(r20h)
[0265]
大肠杆菌mg1655 soxr(r20h)acrr(v29g)
[0266]
大肠杆菌mg1655 soxr(r20h)acrr(t32fs)
[0267]
在随后的筛选实验中,将如以上描述地分离的野生型大肠杆菌mg1655和突变体(大肠杆菌mg1655 soxr(r20h)、大肠杆菌mg1655 soxr(r20h)acrr(v29g)、大肠杆菌mg1655 soxr(r20h)acrr(t32fs))在限定培养基(msx)中在不存在或存在接种后立即添加的20%(v/v)bma的情况下生长(图1)。培养物在250ml摇瓶中在37℃和250rpm生长。wt菌株不能够在20%(v/v)bma的存在下生长,但所有突变体能够在20%(v/v)bma的存在下生长,证明突变赋予对bma的耐受性。我们还观察到双突变体大肠杆菌mg1655 soxr(r20h)acrr(v29g)和大肠杆菌mg1655 soxr(r20h)acrr(t32fs)能够比具有soxr突变的单突变体生长得更好,表明soxr和acrr中的突变的组合提供加性效应并增强耐受表型。
[0268]
然后大肠杆菌mg1655、大肠杆菌mg1655 soxr(r20h)、大肠杆菌mg1655 soxr(r20h)acrr(v29g)和大肠杆菌mg1655 soxr(r20h)acrr(t32fs)在具有指数中期期间添加的20%(v/v)bma的msx培养基中生长(图2)。使培养物在250ml摇瓶中在37℃和250rpm生长。这些结果再次表明,与单独的soxr(r20h)突变相比,突变的基因acrr(v29g)和acrr(t32fs)与soxr(r20h)组合改善了细胞的适应性并且赋予增强的对bma的耐受性。
[0269]
然后我们产生了其中分别使用标准方案敲除soxr和acrr的菌株。使敲除菌株大肠杆菌bw25113δsoxr和大肠杆菌bw25113δacrr在不存在或存在接种后立即添加的20%(v/v)bma的情况下生长(图3)。培养物在msx培养基中在30ml瓶中在37℃和250rpm摇动生长。尽管敲除菌株能够在没有bma的培养基中生长,但敲除菌株都不能够在bma的存在下生长。这表明acrr和soxr功能的丧失并不赋予bma耐受性。因此,soxr(r20h)编码能够调节其他基因的转录的功能性soxr。同样,突变的基因acrr(v29g)和acrr(t32fs)可以编码能够赋予bma耐受性的功能蛋白。
[0270]
制备具有单突变的菌株以了解acrr(v29g)和acrr(t32fs)本身是否可以赋予bma耐受性并且因此编码功能蛋白。然后使大肠杆菌mg1655 acrr(v29g)和大肠杆菌mg1655 acrr(t32fs)在具有或不具有接种后立即添加的20%(v/v)bma的情况下生长(图4)。培养物在msx培养基中在30ml瓶中在37℃和250rpm摇动生长。大肠杆菌mg1655 acrr(v29g)和大肠杆菌mg1655 acrr(t32fs)都能够在bma的存在下生长。这表明这些突变编码能够充当转录因子、赋予对bma的耐受性的功能性acrr。
[0271]
总之,结果表明,与野生型大肠杆菌相比,soxr或acrr中的突变赋予对bma的耐受性,并且包含soxr或acrr二者中的突变的双突变体显示出增强的耐受性。
[0272]
实施例2:通过适应性进化对bma耐受突变体菌株的分离和表征
[0273]
我们使用适应性进化方法鉴定bma耐受性菌株。总之,适应性进化包括使微生物菌株在期望的选择压力的影响下扩展繁殖(extended propagation)。具有增强的生长速率的突变体由于增加的耐受性偶尔会随时间在群体中出现并扩增。因此,通过对这些突变体分离株的重复分离、鉴定和测序,获得增强的菌株。
[0274]
实验使用大肠杆菌菌株bw25113。这是常见的实验室菌株,并且该菌株的完整基因组序列是可得的(ncbi参考序列:nz_cp009273.1,参见grenier等人:complete genome sequence of escherichia coli bw25113,genome announc.2014sep-oct;2(5):e01038-14)。该菌株可以例如从大肠杆菌遗传保藏中心(cgsc)(菌株7636)或atcc获得。
[0275]
首先通过使微生物在0.01%至20.0%v/v的浓度范围的bma的存在下生长来研究bma对其生长的影响(图5a和图5b)。大肠杆菌在0.01%v/v的bma浓度的生长(图5.1),与其在bma不存在时的生长非常相似。然而,随着bma浓度进一步增加至0.05%v/v和0.1%v/v,观察到更长的滞后期和更低的生长速率(图5a和表2.1)。因此,高于0.05%v/v的浓度的bma抑制大肠杆菌的生长。
[0276]
随着bma浓度进一步增加至20%v/v(图5b),在孵育24-36小时后才观察到细胞生长,并且生长不一致。
[0277]
表2.1大肠杆菌在不同bma浓度的生长动力学参数
[0278][0279]
将在具有0.1%v/v和0.5%v/v bma时生长的培养物传代培养(图5.3),以了解大肠杆菌的bma耐受性极限。从在具有0.1%v/v bma时生长的培养物中取出等分试样,转移至新鲜培养基中,并且在相同条件下生长。传代培养物群体的生长模式与先前的培养物非常相似(图5c),表明在0.1%v/v bma观察到的耐受性可能是由于大肠杆菌的固有耐受性。在另一方面,从在0.5%v/v bma生长的培养物中取出的传代培养物在接种仅12小时后显示出显著的生长,这比在相同条件下生长的原始培养物(progenitor culture)要早得多(图5c)。原始培养物和传代培养物的生长模式差异表明大肠杆菌在传代培养物中的生长不是由于固有的耐受性,而是在暴露于0.5%v/v bma后获得的。
[0280]
传代培养物实验的结果表明大肠杆菌对bma的固有耐受性是至少0.1%v/v,但不多于0.5%v/v。
[0281]
使用多种适应性进化实验来产生bma耐受性大肠杆菌。在第一实验(ade-1;图5d)中,使三种平行培养物在包含对于每次连续转移具有从0.1%分别增加至0.5%、1.0%、5.0%、10.0%和20%v/v的递增bma浓度的10ml m9基本培养基的50ml管中生长。使用来自先前培养物的0.15ml等分试样,并且转移至具有较高bma浓度的新鲜培养基中。最佳生长培养物用作下一次连续转移的起始培养物。
[0282]
在第二适应性进化实验(ade-2;图5e)中,在增加bma浓度前,允许细胞在相同bma浓度经历五(5)次连续转移。在该实验中,三种培养物各自用作在单独的管中连续转移的起始培养物。
[0283]
第三适应性进化实验(ade-3;图5f)通过使大肠杆菌在具有0.1%v/v bma时生长一次,然后在具有10%v/v bma时生长两次,并且最后在具有20%v/v bma时生长45次来进行。
[0284]
第四适应性进化实验使用恒化器培养物实现(ade-4;图5g)。bma浓度以逐步方式以恒定的稀释速率从0%v/v逐渐增加至20%v/v。在达到在20%v/v bma的稳定细胞浓度后,培养物的稀释速率在0.33h-1
和0.55h-1
之间调整,bma浓度保持恒定在20%v/v。
[0285]
在适应性进化实验后,将存活培养物的等分试样铺板到lb琼脂中,并且挑取一定数目的(至少6个)个体菌落并在液体培养基中再生长,以保存每种分离的菌株的储备培养物。为了评估和比较bma如何影响每种分离的菌株的生长,确定它们在20%v/v bma存在下的生长动力学。用于确定菌株生长动力学的标准生长条件是在配备有suba-密封件的250ml锥形瓶中,在37℃和200rpm使用摇瓶培养箱,在含有10g l-1
葡萄糖和20%v/v bma的50ml m9培养基中的~0.025的起始光密度(o.d.)。通过测量其o.d.持续36小时来监测生长,并且在接种后的第一个13-18小时、24小时和36小时每小时获取样品。分离的菌株的细胞生长动力学参数的总结列于表2.2中。分离的菌株的生长曲线还示于图5中。
[0286]
表2.2从多种分批和连续培养物在20%v/v bma的适应性进化中分离的bma耐受性菌株的生长动力学参数。
[0287][0288]
菌株来源:a=图5.2,b=ade-1,c=ade-2,d=ade-3,e=ade-4。f至g取自不同稀释速率(h-1
)的ade-4,其中f=0.46,并且g=0.54。ncbi参考序列:nz_cp009273.1
[0289]
参考亲本菌株大肠杆菌bw25113分析和比较从ade-1、ade-2、ade-3和ade-4产生的多种bma耐受性菌株的基因组dna序列(表2.3、表2.4和表2.55)。使用具有作为洗脱液的tris-hcl(10mm;ph=7.5)的geneelute
tm
细菌基因组dna试剂盒从选择的分离株在lb肉汤中的过夜培养物制备用于dna测序的基因组dna样品。使用miseq v2 150pe分析dna序列,以产生至少11m+11m个读段/运行。使用cutadapt版本1.12,为了质量,使用30的阈值和nextera xt试剂盒的衔接子序列(seq id no.33:ctgtctcttata),在3’末端处将读段
修剪至36的最小长度。基因组比对和变体判定(variant calling)通过snippy流水线(pipeline)进行,以鉴定分离的菌株和亲本菌株/参考基因组之间的基因组dna序列差异(大肠杆菌菌株bw25113,组装asm75055v1,来自ensembl的注释形式34)。使用snippy版本3,最小10个读段覆盖每个位置,并且0.9作为与参考必须有差异的读段的最小分数。
[0290]
表2.3编码基因表达调节蛋白的来自多种分批培养物适应性进化的bma耐受分离株的基因组dna中的改变的总结。
[0291]
[0292][0293]
注:细胞定位;cyt-细胞质,per-周质,im-内膜,uk-未知
[0294]
表2.4编码非调节功能蛋白的来自多种分批培养物适应性进化的bma耐受分离株的基因组dna中的改变的总结。
[0295]
[0296][0297]
注:细胞定位;cyt-细胞质,per-周质,im-内膜,uk-未知
[0298]
表2.5来自多种分批培养物适应性进化的bma耐受分离株的基因组dna中的在非编码区中的改变的总结。
[0299][0300]
注:细胞定位;cyt-细胞质,per-周质,im-内膜,uk-未知,插入/缺失-插入或缺失
[0301]
如从表2.3和表2.4可以推断的,每种菌株在acrr中都具有突变。此外,每个菌株还在soxr、marr或rob中具有突变。
[0302]
实施例3
–
转录组数据
[0303]
使用标准方法进行转录组分析以表征突变体微生物中的转录活性。
[0304]
rna提取方案
[0305]
材料:
[0306]
··
rneasy保护细菌微型试剂盒(50)-qiagen 74524
[0307]
··
无rna酶的dna酶组(50)-qiagen 79254
[0308]
··
rna酶zap-用于去除rna酶的清理剂-sigma-aldrich r2020-250ml
[0309]
··
无rna酶eppenford和15ml falcon管
[0310]
··
无rna酶吸头
[0311]
在无rna酶“环境”中进行所有的提取,用rna酶zap清理所有事物,一直使用手套并经常更换手套。
[0312]
1.msx培养基
[0313]
制备1l:
[0314]
vishniac微量元素
[0315]
将edta二钠盐(50g)与水(800ml)组合,通过添加koh团粒(pellet)(每次2-3个)溶解。按以下顺序添加化学物质;znso4(2.2g)、cacl2(5.54g)、mncl2.4h2o(5.06g)、feso4.7h2o(5g)、(nh4)6mo7o
24
.4h2o(1.1g)、cuso4.5h2o(1.57g)和cocl2.6h2o(1.61g)。
[0316]
使用1m koh调节至ph 6,使用水补足至1l,并且在4℃储存直至使用。
[0317]
msa
[0318]
·
水(700ml)中的kh2po4(6g)和vishniac微量元素(2ml)
[0319]
使用1m koh调节至ph 7。用水补足至760ml。
[0320]
msb
[0321]
·
水(200ml)中的nh4cl(3g)和mgso4.7h2o(0.4g)。
[0322]
将msa和msb灭菌,然后混合并添加40ml的12.5%葡萄糖的储备溶液。制备总计1l的msx。
[0323]
2.样品制备
[0324]
1)将菌株直接从冷冻储备物(cryostock)划线到新鲜msx琼脂(15g/l)板上,并且在37℃孵育过夜
[0325]
2)分离单个菌落,并且使用50ml摇瓶在msx中接种预培养物。在37℃和250rpm孵育过夜。
[0326]
3)使用具有24/29颈连接的250ml pyrex摇瓶,将培养物接种在msx中至0.05的初始od600。在37℃和250rpm孵育。进行4次生物学重复(3次重复用于测序,加一次备份)-每种菌株4个烧瓶。
[0327]
4)用无菌suba密封件密封摇瓶。为了监测od,在首先用70%乙醇擦拭suba密封件后,使用无菌注射器和针头获取样品。监测od。
[0328]
5)当od达到0.3时,收集用于rna提取的第一样品(“前”样品)到预冷的falcon中。将样品保持在冰上。
[0329]
6)紧接着,添加20%(v/v)bma。再孵育培养物。
[0330]
7)根据rneasy试剂盒方案快速处理样品,直至方案1的步骤6。始终将样品保持在冰上,并且在-80℃储存,直至进一步使用,如果可能,在液氮中快速冷冻,然后储存。
[0331]
8)第一次样品收集/bma添加后一小时,收集用于rna提取的第二样品(“后”样品)。按照前面解释的进行。
[0332]
9)继续监测od,直至培养物达到24h。
[0333]
总之,测试的每种菌株具有6个样品送去测序,在添加前收集3个,并且在添加后一小时收集3个,加上前和后的1个“备份”,以防提取期间出现问题(总计8个样品)。除了添加了bma的wt菌株之外,在达到0.3的od后一小时还从没有bma的wt培养物中收集样品,作为对
照。
[0334]
3.rna提取
[0335]
根据rneasy试剂盒说明进行。方案1和7-针对在基本培养基上生长的革兰氏阴性细菌-加上附录b“使用无rna酶的dna酶组进行柱上dna酶消化”。
[0336]
将最后的样品分成3个等分试样。仅使用一个等分试样检查浓度和是否存在gdna污染。不将该等分试样用于测序,因为解冻和冷冻样品可能使rna降解。
[0337]
使用tapestation检查rna浓度和rin数量。
[0338]
将双突变体和野生型在bma存在和不存在下的转录相对于野生型在bma不存在下的水平进行比较。为免生疑问,表格中的水平是在bma暴露下的菌株中的水平相对于不存在添加的bma的野生型中的水平的比率。在bma不存在下acra和acrb的转录水平增强,然而这是非常可变的。对于野生型菌株,暴露于bma实际上降低了全局调节物的表达水平。这表明主要的多药耐药泵在这些菌株中强过表达。结果示于下文表2.6中。
[0339]
表2.6 acrab基因表达
[0340][0341]
bma强烈增强或降低了一些关键基因的转录水平。相对于不具有bma暴露的bw25113,bma引起的“前27项”增强示于表2.7中。为了进行比较,将未暴露于bma的相同基因示于表2.8中。将双突变体和野生型在bma存在和不存在下的转录相对于野生型在bma不存在下的水平进行比较。为免生疑问,表格中的水平是在bma暴露下的菌株中的水平相对于不存在添加的bma的野生型中的水平的比率。
[0342]
表2.7:与野生型和6个其他菌株比较的双突变体在具有添加的bma时的转录组数据。
[0343][0344]
表2.8-与野生型和6个其他菌株比较的双突变体在不具有添加的bma时的转录组数据。
[0345][0346]
在未供给bma的情况下,不存在转录水平的一致趋势。在bma存在下,ibpa、ibpb、ynfm、yibt、pspa、bssr、ybfa、raia、ldha、pspb、pspc和pspd在菌株中均增强大于
×
10,但在野生型菌株中均降低。在bma不存在下,在菌株中ibpa、ibpb、ynfm、yibt、pspa、bssr、ybfa、raia、ldha、pspb和pspc没有一个被增强。这些基因的功能列于表2.9中。
[0347]
表2.9
–
当未供给bma时,未被增强的基因的功能。
[0348]
[0349]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1