一种低成本提取干燥植物叶片DNA的方法与应用与流程
本发明属于分子生物学技术领域,特别涉及一种低成本提取干燥植物叶片dna的方法与应用。
背景技术:
dna是遗传信息的载体,是最重要的生物信息分子,获得高质量dna的是分子生物学实验最关键的第一步。与动物相比植物细胞除有细胞壁外,还含有较多的多糖、多酚等多种不易与dna分离的次生代谢物,使得植物dna提取的难度较大、成功率低,在植物dna提取中dna的溶液常出现黏度大乃至呈胶状,主要是由于多糖、酚类在提取过程中与dna共沉淀,形成包裹dna的黏稠胶状物,难以溶解或产生褐变,严重影响了dna质量和纯度,而且用于dna提取的组织(如叶片)的成熟度也常常难以控制。
目前常用的植物dna提取方法有:ctab(十六烷基三甲基溴化铵)法、sds(十二烷基硫酸钠)法和试剂盒法,采用ctab法和sds法这两种方法可从几乎所有植物较为幼嫩的叶片中提取植物dna,费用低廉,但是这两种方法存在以下不足:一是需要采用春季幼嫩未完全展开的叶片进行提取,取样时间受限,增加了叶片保鲜保存工作量;二是提取时间长;三是多数情况下要使用有毒的有机物进行提取,氯仿、苯酚被用于抽提以除去蛋白质和多糖,β-巯基乙醇被用于防止多酚类物质的氧化,异丙醇用于沉淀dna。其中氯仿和β-巯基乙醇极易挥发,经呼吸系统或皮肤吸收入人体后可引起中毒,且为高毒;异丙醇有一定挥发性,对人体表现为低毒,但在常温下可引火燃烧,其蒸汽与空气的混合易形成爆炸混合物;苯酚虽无挥发性但可燃,对人体表现为高毒。这些有机溶剂不仅会对人体产生伤害,而且对自然环境造成严重危害。使用试剂盒提取方法,简单快速且无有机抽提,但是价格昂贵,适用范围小。
技术实现要素:
本发明的目的在于提供一种低成本提取干燥植物叶片dna的方法与应用,从而克服背景技术中的缺陷。
为实现上述目的,本发明提供了一种低成本提取干燥植物叶片dna的方法,包括以下步骤:
(1)取植物叶片放入装有钢珠的离心管中,干燥后通过研磨仪研磨成粉;
(2)向步骤(1)中的离心管内加入裂解缓冲液和rnasea,混匀,50~60℃水浴15~20min;
(3)向步骤(2)中的离心管内加入醋酸钠溶液,混匀,冰浴4~6min,室温下离心,取上清液;
(4)将步骤(3)取得的上清液加入装有硅粉-dna吸附液的离心管中,混匀,室温放置15~20min后离心,弃上清液;
(5)加入洗脱液,混匀,室温下离心,弃上清液;
(6)重复步骤(5)1~2次;
(7)室温下离心,置于超净台上晾干30~40min;
(8)加入tebuffer溶解dna,混匀,室温放置5~8min后离心,取上清液,即为提取的植物dna,-20℃下保存备用。
优选的,上述提取干燥植物叶片dna的方法中,将sds溶于10*te缓冲液得到裂解缓冲液,所述sds质量与所述10*te缓冲液体积比为5g:1l。
优选的,上述提取干燥植物叶片dna的方法中,所述步骤(4)中硅粉-dna吸附液制备方法为:
s1.将硅粉加入离心管中;
s2.向步骤s1中离心管加入dh2o,涡旋混匀15~20min,弃去液体,所述dh2o体积与步骤s1中硅粉的质量比为30ml:800mg;
s3.重复步骤s2两次;
s4.加入dh2o,充分混匀得到硅粉悬浮液,所述硅粉悬浮液中硅粉与dh2o体积比为1:1;
s5.取步骤s4得到的硅粉悬浮液于离心管,加dh2o涡旋混匀,11000~13000rpm离心10~20sec,弃上清液,所述硅粉悬浮液与dh2o的体积比为0.05:1;
s6.加入ki溶液,充分混匀得到硅粉-dna吸附液,所述ki溶液溶度为6mol/l,所述ki溶液与步骤s5中硅粉悬浮液的体积比为700:50。
优选的,上述提取干燥植物叶片dna的方法中,采用95%乙醇将nacl溶液稀释100倍得到洗脱液,所述nacl溶液浓度为5mol/l,所述洗脱液现配现用。
优选的,上述提取干燥植物叶片dna的方法中,所述醋酸钠溶液浓度为2~3mol/l,ph为5.2;所述rnasea浓度为10mg/ml。
优选的,上述提取干燥植物叶片dna的方法中,每100mg所述植物叶片,所需的所述裂解缓冲液体积为800μl,所需的所述rnasea体积为15μl,所需的所述醋酸钠溶液体积为200μl,所需的所述硅粉-dna吸附液体积为700μl,所需的所述洗脱液体积为500μl,所需的所述te缓冲液体积为150μl。
优选的,上述提取干燥植物叶片dna的方法中,所述混匀为漩涡混匀;所述步骤(1)研磨转速为1500r/min,研磨时间2min;所述步骤(3)、(4)或(8)中离心条件为:11000~13000rpm,5~8min;所述步骤(5)离心条件为:11000~13000rpm,3~5min;所述步骤(7)离心条件为:11000~13000rpm,0.5~1min。
优选的,上述提取干燥植物叶片dna的方法中,所述离心管包括管体和管盖,所述管体上端开口,上部为圆柱体部、下部为圆锥体部,所述上部和下部连接并呈一体结构;在所述管体上部内壁设置凸起的竖直条状结构,所述竖直条状结构与所述管体衔接处为圆角过渡;所述管盖匹配盖于所述管体顶端,所述管盖上开设有用于注入溶液的加液孔和用于抽取溶液的吸液孔,所述加液孔和吸液孔上配有弹性橡胶盖。
上述提取干燥植物叶片dna的方法在百香果、甘蔗、红薯、木薯或荸荠植物总dna提取的应用。
优选的,上述应用中,所述百香果或荸荠植物总dna用于遗传多样性scot分子标记。
与现有的技术相比,本发明具有如下有益效果:
1.本发明中的提取干燥植物叶片dna的方法可用于百香果、甘蔗、红薯、木薯、荸荠等单子叶和双子叶植物叶片总dna提取,可从植物的幼叶、中等成熟叶片以及成熟叶片中提取,取样不受时间限制,可进行大批量样品常温采集,减少样品保鲜保存工作量,适用范围广。
2.本发明的提取方法避免采用氯仿、苯酚等有毒有机物,对操作者的健康无损害,对环境的污染程度很小。采用的试剂均为常规的化学试剂,价格低廉,未使用离心柱等昂贵耗材,降低了提取成本。
3.本发明提供的提取干燥植物叶片dna的方法提取dna的纯度高,完整性好,产率高,可满足pcr反应对dna的质量要求。且提取工艺简单,适合大规模的推广和应用。
附图说明
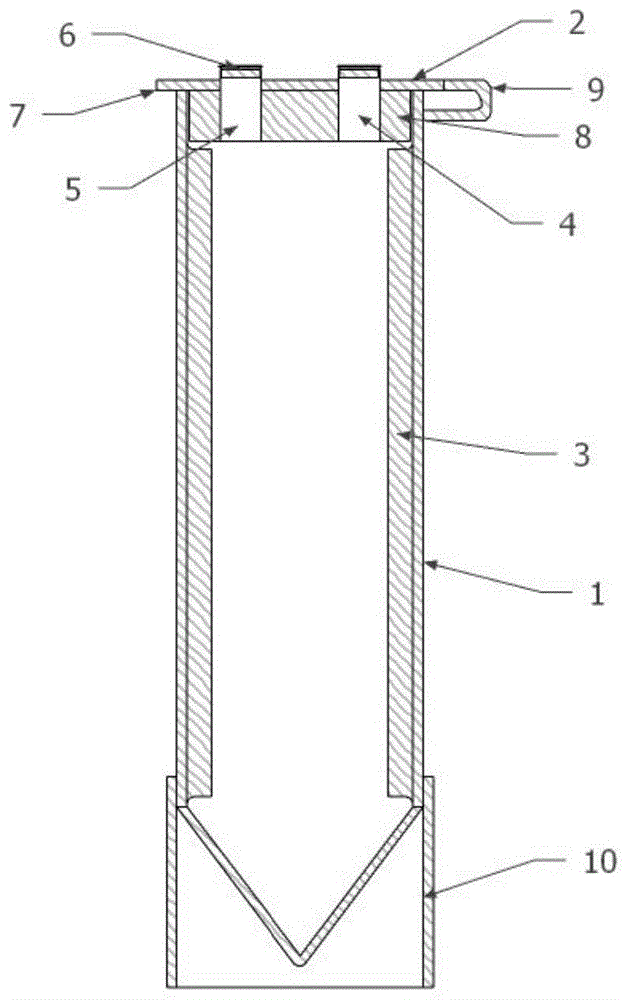
图1是本发明的实施例2中离心管的剖视结构图,其中1-管体,2-管盖,3-竖直条状结构,4-加液孔,5-吸液孔,6-弹性橡胶盖,7-盖板,8-密封扣,9-软连接带,10-圆柱状环形支撑结构。
图2是本发明的实验例1中百香果叶片总dna琼脂糖检测电泳图,其中m为dnamarkerdl5000,泳道1~9为实施例1方法提取得到的总dna样品,泳道10~18为试剂盒提取得到的总dna样品。
图3是本发明的实验例1中甘蔗叶和红薯叶片总dna琼脂糖检测电泳图,其中m为dnamarkerdl5000,泳道1~5为实施例1方法提取得到的甘蔗叶总dna样品,泳道6~10为试剂盒提取得到的甘蔗叶总dna样品,泳道a~e为实施例1方法提取得到的红薯叶总dna样品,泳道f~j为试剂盒提取得到的红薯叶总dna样品。
图4是本发明的实验例1中荸荠叶片总dna琼脂糖检测电泳图,其中m为dnamarkerdl5000,泳道1~10为实施例1方法提取得到的总dna样品,泳道11~20为试剂盒提取得到的总dna样品。
图5是本发明的实验例2中木薯叶片总dna琼脂糖检测电泳图,其中m为dnamarkerdl5000,泳道6~8为实施例1方法提取得到的总dna样品,泳道1~5为实施例2方法提取得到的总dna样品,泳道9~16为试剂盒提取得到的总dna样品。
图6是本发明的实验例3中的百香果scot-pcr扩增结果图:其中m为dnamarkerdl5000,1~3为大果黄金a,4为黄金果,5为大果黄金b,6为满天星,7为台农1号,8为紫香1号,9为特甜黄金果。
图7是本发明的实验例4中的荸荠scot-pcr扩增结果图:其中m为dnamarkerdl5000,1~10为荸荠叶片。
具体实施方式
下面对本发明的具体实施方式进行详细描述,但应当理解本发明的保护范围并不受具体实施方式的限制。
实施例1
本实施例提供一种低成本提取干燥植物叶片dna的方法,具体包括以下步骤:
(1)称取100mg去除叶柄的植物叶片放入装有3颗钢珠的2ml离心管中,置于装有二氧化硅的干燥器中干燥5天,然后通过研磨仪1500转/min研磨2min成粉,钢珠能够增加摩擦力达到粉碎研磨作用;
(2)向步骤(1)的离心管内加入800μl裂解缓冲液和15μlrnasea(核糖核酸酶a),涡旋混匀2min,55℃水浴15min;rnasea的浓度为10mg/ml,裂解缓冲液的制备过程为:将0.5gsds(十二烷基磺酸钠)溶于100ml10*te缓冲液得到裂解缓冲液;
(3)向步骤(2)中的离心管内加入200μl醋酸钠溶液,醋酸钠溶液溶度为3mol/l,ph为5.2,颠倒混匀,冰浴5min后12000rpm离心6min,取上清液;
(4)将步骤(3)取得的上清液转至装有700μl硅粉-dna吸附液的2ml离心管中,涡旋混匀,室温放置15min后12000rpm离心6min,弃上清液;
(5)加入500μl洗脱液,涡旋混匀,室温下12000rpm离心3min,弃上清液;洗脱液制备方法为:取5mol/lnacl溶液1ml,加95%乙醇定容至100ml混匀得到,洗脱液现配现用;
(6)重复步骤(5)1次;
(7)室温下12000rpm离心30sec,去除剩余的乙醇,置于超净台上晾干30min;
(8)加500μl1*tebuffer(te缓冲液)溶解dna,涡旋混匀,室温放置5min后12000rpm离心6min,取上清液转至新的1.5ml离心管,即为提取的植物dna,-20℃下保存备用。
其中,步骤(4)中硅粉-dna吸附液的制备方法为:
s1.取800mg硅粉加入50ml离心管中;
s2.加入30mldh2o涡旋混匀15min,弃去液体;
s3.重复步骤s2两次;
s4.加dh2o充分混匀得到硅粉悬浮液,硅粉悬浮液中硅粉与dh2o体积比为1:1;
s5.取步骤s4中的硅粉悬浮液50μl于2ml离心管,加1mldh2o涡旋混匀,12000rpm离心20sec,弃去上清液;
s6.加入700μlki溶液,充分混匀得到硅粉-dna吸附液,ki溶液溶度为6mol/l。
裂解缓冲液裂解细胞、使核苷酸充分暴露出来,将组织蛋白、多糖和多酚等杂质与dna分离,rnase的作用去除组织中rna,结合醋酸钠溶液进一步去除杂质,防止杂质对dna提取的影响。硅粉-dna吸附液对dna具有强的吸附作用,提高dna提取纯度。
实施例2
本实施例提供的提取干燥植物叶片dna的方法,其中提取步骤和条件参数与实施例1相同,与实施例1不同之处在于:所使用的离心管不同,实施例1中离心管为常规的离心管,本实施例中的离心管如图1所示,包括管体1、管盖2、竖直条状结构3、加液孔4、吸液孔5、圆柱状环形支撑结构10,管体1上端开口,上部为圆柱体部、下部为圆锥体部,上部和下部连接并呈一体结构,能够在离心时使得固态物质沉积汇聚在底部便于收集固态物质。管体1上部的内壁上对称设置2条凸起的竖直条状结构3,竖直条状结构3横截面为矩形,矩形一边为弧形,与管体1内壁相贴合,物质在漩涡作用下快速运动的同时,还受到凸起的竖直条状结构3的剪切作用,使动能的一部分用在提供剪切的动力上,很好地将漩涡振荡的能量引入到有效的物料剪切和混合上,在快速旋转运动力和剪切力的共同作用下,离心管中的物质能显著加速分散或溶解的过程,使物质混合更加均匀、溶解更加充分。竖直条状结构3与管体1衔接处为圆角过渡,防止离心过程中沉淀物聚集在衔接处。提取干燥植物叶片dna的方法中包括多次漩涡混匀,混匀程度关系到提取dna的浓度和纯度,本实例中的离心管使物质混合均匀,使提取效果更好。
管盖2匹配盖于管体1顶端,包括盖板7、离心管管口配合的密封扣8。管盖2通过软连接带9连接管体1,对于软连接带9与管盖2的连接方式,可以有多种形式,如软连接带9一端与管盖2一侧固定连接,另一端连接套环,通过套环套在管体1的外围,使软连接带9与管体1形成可拆卸连接,也可以是软连接带9的两端分别于管盖2和管体1固定连接;通过软连接带9的设置可防止管盖2丢失。加液孔4和洗液孔5开设在管盖2上,加液孔4和吸液孔5上配有弹性橡胶盖6。通过加液孔4和吸液孔5分别进行多次溶液加入和溶液抽取,在实验过程中无需打开管盖,方便操作,使管体内物质不容易受到污染。
管体1圆柱体部的底部外侧设置有外螺纹,设有圆柱状环形支撑结构10内侧设有匹配的内螺纹,圆柱状环形支撑结构10通过螺纹套接在管体外侧,管体1的下部能匹配插于圆柱状环形支撑结构10内,圆柱状环形支撑结构10底部边缘低于圆锥体部底端,离心管通过圆柱状环形支撑结构10能够直接放置在水平实验台上,无需管架,方便操作使用;不需要正立放置时,取下圆柱状环形支撑结构10,便于离心。
实验例1百香果、甘蔗、红薯和荸荠叶片dna提取试验
试验材料:百香果叶、甘蔗叶、红薯叶和荸荠叶
试验方法:采用实施例1提供的提取干燥植物叶片dna的方法以及市售试剂盒(北京全式金生物技术(transgenbiotech)有限公司,
试验结果:百香果叶片总dna琼脂糖检测电泳图如图2所示,甘蔗叶片和红薯叶片总dna琼脂糖检测电泳图如图3所示,从图中可以看出采用本发明的方法提取得到的百香果叶片、甘蔗叶片和红薯叶片总dna电泳谱带型单一、清晰、无弥散拖尾现象,而市面出售试剂盒提取的总dna带型有弥散拖尾现象。图4为荸荠叶片总dna琼脂糖检测电泳图,本发明的方法提取得到的荸荠叶片总dna电泳谱带型单一、清晰、亮度高、无弥散拖尾现象,市面出售试剂盒提取的荸荠叶片总dna浓度较低,而且带型有严重的弥散拖尾现象。采用本发明提供的方法提取dna杂质去除彻底、纯度好、完整性好、得率相对较高,试剂盒提取dna未能很好地去除杂质。
实验例2木薯叶dna提取试验
试验材料:木薯叶
试验方法:分别采用实施例1、实施例2提供的提取干燥植物叶片dna的方法以及市售试剂盒对木薯叶进行dna提取,对提取的dna进行琼脂糖凝胶电泳检测。
试验结果:图5为木薯叶总dna琼脂糖检测电泳图,其中,泳道6~8为实施例1方法提取得到的总dna样品,泳道1~5为实施例2方法提取得到的总dna样品,泳道9~16为试剂盒提取得到的总dna样品。从图中可以看出,采用本发明实施例1和实施例2的方法提取的总dna电泳谱带型单一、清晰、无弥散拖尾现象,说明采用本发明方法提取的dna纯度高、完整性好。实施例2方法提取得到的总dna电泳谱带亮度相对实施例1方法提取得到的总dna电泳谱带要高一些,说明实施例方法2提取得到的dna产率相对高。市面出售试剂盒提取的木薯叶片总dna浓度较低,而且带型有严重的弥散拖尾现象。
实验例3百香果scot-pcr扩增试验
试验材料:9份百香果叶材料:1、2、3:大果黄金a,4:黄金果,5:大果黄金b,6:满天星,7:台农1号,8:紫香1号,9:特甜黄金果。
试验方法:通过实施例1的提取方法提取dna,采用scot分子标记引物sp10、sp18、sp34和sp46分别对9份百香果叶材料中提取的总dna进行pcr扩增,扩增反应体系(20μl)为:10μl2×extaqmix,2.0μl10μmol/lprimer,1.0μl20-30ng/μl模板dna,7.0μlddh2o,扩增程序为:94℃预变性3min,94℃变性1min,50℃退火1min;然后72℃延伸2min,共进行35个循环,最后72℃延伸10min,4℃条件下保存。扩增反应结束后,用1.5%的琼脂糖凝胶电泳检测,最后置于凝胶成像系统下观察结果。
试验结果:结果如图6所示,从图中可以看出,采用本发明提取的百香果dna进行pcr扩增,获得的扩增条带具有多态性高、特异性强、背景清楚等优点,说明本发明的提取方法提取的dna可作为pcr反应模板,满足pcr反应dna质量需求。
实验例4荸荠scot-pcr扩增试验
试验材料:10份荸荠叶材料
试验方法:采用scot分子标记引物sp14、sp15和sp30分别对10份荸荠叶片材料中提取的总dna进行pcr扩增,扩增反应体系与程序同实验例3。
试验结果:图7为荸荠scot-pcr扩增结果图,从图中可以看出,采用本发明提取的dna进行pcr扩增,获得的扩增条带具有多态性高、特异性强、背景清楚等优点,说明本发明的提取方法提取的dna可作为pcr反应模板,满足pcr反应dna质量需求。
前述对本发明的具体示例性实施方案的描述是为了说明和例证的目的。这些描述并非想将本发明限定为所公开的精确形式,并且很显然,根据上述教导,可以进行很多改变和变化。对示例性实施例进行选择和描述的目的在于解释本发明的特定原理及其实际应用,从而使得本领域的技术人员能够实现并利用本发明的各种不同的示例性实施方案以及各种不同的选择和改变。本发明的范围意在由权利要求书及其等同形式所限定。
- 还没有人留言评论。精彩留言会获得点赞!