RNA转录载体及其用途的制作方法
本申请是中国专利申请cn201480071159.0的分案申请。
发明领域
本发明总的来说涉及一种改进的rna转录载体,其非常适合用于产生用于体内治疗目的的mrna。载体中的改进特别地在于翻译增强子和核保留元件的存在。
发明背景
虽然我们的免疫系统能够区分健康细胞与肿瘤细胞和感染原,但它有时无法适当识别该问题并对其作出反应。因此,医学已经聚焦于开发几种帮助免疫系统监视和消除肿瘤细胞和感染原的策略。树突状细胞(dc)是已知为免疫应答刺激中的关键参与者的抗原提呈细胞(apc)并且已付出许多努力来在免疫疗法中开发dc。例如在癌症的情况下,目标是通过诱发可以特异性降低肿瘤负荷并诱导免疫记忆以控制肿瘤复发的效应t细胞来诱导和保持肿瘤特异性免疫应答。一旦可靶向的肿瘤相关抗原(taa)已被识别,它们可用于在体内或离体加载专职apc,即树突状细胞。
已关于dc就体内或离体免疫疗法评估了不同的抗原形式,例如肽、蛋白质、全肿瘤细胞提取物、质粒dna或mrna。在这些方法中,编码抗原的mrna正作为为特别有前景的方法出现。相对于使用肽的传统疫苗接种的优点是mrna编码整个抗原的遗传信息。全长抗原是经加工的并且所有可用的表位提呈在患者的mhc分子中,而不需要确定hla特异性肽。没有患者需要因可用的肽不匹配其hla类型而被从治疗中排除。此外,mrna不构成基因组整合的风险,从而使其相较于dna或病毒载体具有有利的安全性特征。由于它的瞬时性质,mrna仅在短时期过程中表达,并最终降解成天然产物。另外,mrna用作其自身的佐剂,促进共刺激信号,这在基于mrna的免疫疗法的情况下是有利的。已应用了用于外源mrna递送到dc中的两条路径:离体使用经转染的dc的后续过继转移或通过mrna的直接施用和体内摄取。
由diken等人(2011)进行的研究突出显示成熟刺激和/或其递送的时间选择必须仔细选择,因为mrna的摄取依赖于巨胞饮,其是未成熟dc的功能,一旦dc成熟则丢失。因此,传统成熟刺激例如脂多糖(lps)与taamrna的共递送对抗原的生物利用度具有负面影响,抗原的生物利用度是共同决定抗原特异性t细胞应答的诱导的参数(vanlint2012;diken2011)。迄今为止,已研究了两种不同的策略来用taamrna同时加载dc并在体内激活它们。
fotin-mleczek等人(2011)描述了含有游离mrna和与鱼精蛋白复合的mrna的双组分系统,从而提供用于适应性免疫的抗原来源以及增强的病原体识别受体tlr7的触发。这种免疫策略导致强抗肿瘤免疫应答的诱导和持久的记忆应答,这是重要的,因为记忆t细胞应防止肿瘤的再现。
bonehill等人,2008评估了mrna的特定组合用于佐剂目的的用途,最初用于活化离体产生的dc,但也同样适用于直接施用和体内摄取(bonehill,2008)。这已导致了专利申请(wo2009034172),其中发明人描述了抗原性肽脉冲的抗原提呈细胞或用编码taa的mrna(共)电穿孔的抗原提呈细胞的t细胞刺激能力可通过对其提供不同的分子佐剂(通过使用编码两种或更多种免疫刺激因子的mrna或dna分子的混合物电穿孔)来极大增强。提供的概念证明是这样的用靶特异性肽脉冲的或用编码靶特异性抗原的mrna共电穿孔的经修饰的抗原提呈细胞在体外和疫苗接种后均能刺激抗原特异性t细胞,从而形成有前景的用于抗肿瘤、抗病毒、抗细菌或抗真菌免疫疗法的新方法。用于该发明的免疫刺激因子的优选组合是cd40l和catlr4,或cd40l和cd70。在其它优选的实施方案中,使用cd40l、cd70和catlr4免疫刺激分子的组合,其在下文被称为“trimix”。
本发明涉及含有5'翻译增强子序列和3'核保留序列的rna转录载体。与空puc载体或者含有翻译增强子或核保留序列的载体相比,根据本发明的载体显示了在由体外转录的mrna编码的蛋白质的表达方面出人意料的改进。这些改进特别地是由于两种组分(翻译增强子和rna稳定序列)在载体中的同时存在和其在由此得到的表达产物中的并入。此外,获自本发明的载体的trimixmrna在小鼠癌症模型中的体内应用导致肿瘤生长更慢和所述小鼠预期寿命增加。
发明概述
在第一方面,本发明提供了一种核酸载体,其包含与seqidn°1具有至少80%序列同一性的翻译增强子(te)序列、可转录的核酸序列和由seqidn°4表示的核保留序列。
在具体的实施方案中,可转录的核酸序列选自包含编码cd40l、cd70、catlr4的mrna或抗原/疾病特异性mrna的列表。
在优选的实施方案中,翻译增强子由seqidn°1、2或3中的任一种表示,更特别地由seqidn°1表示。
在其它方面,本发明提供了增加体外转录的rna的稳定性和/或翻译效率的方法;所述方法包括以下步骤:
(i)提供根据本发明的载体,其中所述可转录的核酸序列是可转录的dna序列,其对应于待转录的所述rna;和
(ii)体外转录所述可转录的dna序列。
在其它实施方案中,本发明提供了一种rna分子,其包含与seqidn°1具有至少80%序列同一性的翻译增强子(te)、可转录的核酸序列和由seqidn°4表示的核保留序列。
所述rna分子可进一步包括多聚-a尾。
在本发明的rna分子的上下文中,所述可翻译的核酸序列可选自包含编码cd40l、cd70、catlr4的mrna或抗原/疾病特异性mrna的列表。
在rna分子的优选的实施方案中,翻译增强子由seqidn°1、2或3中的任一种表示;更特别地由seqidn°1表示。
本发明还提供了包含根据本发明的一种或多种rna分子的组合物;更特别地所述一种或多种rna分子代表编码cd40l、cd70和catlr4的mrna分子。
根据本发明的组合物还可以包含编码抗原/疾病特异性mrna的mrna。
本发明进一步提供了所述rna分子和/或包含一种或多种所述rna分子的组合物用于多种目的的用途,诸如例如用于在体内或体外引入宿主细胞中;或用于医学。
本发明的一个方面还提供包含根据本发明的一种或多种载体、一种或多种rna分子、或组合物的试剂盒。
本发明还提供了用于使用根据本发明的一种或多种rna分子或组合物治疗有此需要的患者的方法;其中所述rna分子可以同时或以一定间隔依次施用。
根据本发明的rna分子或组合物可以通过任何合适的施用途径(例如结内、皮内、淋巴管内和瘤内)施用至有此需要的患者。此外,当治疗例如癌症患者时,根据本发明的rna分子或组合物的施用可以与用于从患者中的肿瘤释放肿瘤mrna的方法(例如消融或声致穿孔)组合使用。
本发明的编号陈述
1.一种核酸载体,其包含与seqidn°1具有至少80%序列同一性的翻译增强子(te)序列、可转录的核酸序列和由seqidn°4表示的核保留序列。
2.权利要求1的核酸载体,其中所述可转录的核酸序列选自包含编码cd40l、cd70、catlr4的mrna或抗原/疾病特异性mrna的列表。
3.权利要求1-2中任一项的核酸载体,其中所述翻译增强子由seqidn°1、2或3中的任一种表示;更特别地由seqidn°1表示。
4.增加体外转录的rna的稳定性和/或翻译效率的方法,所述方法包括以下步骤:
(i)提供权利要求1-3中任一项的载体,其中所述可转录的核酸序列是可转录的dna序列,其对应于待转录的所述rna;和
(ii)体外转录所述可转录的dna序列。
5.一种rna分子,其包含与seqidn°1具有至少80%序列同一性的翻译增强子(te)、可转录的核酸序列和由seqidn°4表示的核保留序列。
6.权利要求5的rna分子,其还包含多聚-a尾。
7.权利要求5或6中任一项的rna分子,其中所述可转录的核酸序列选自包含编码cd40l、cd70、catlr4的mrna或抗原/疾病特异性mrna的列表。
8.权利要求5-7中任一项的rna分子,其中所述翻译增强子由seqidn°1表示。
9.一种组合物,其包含权利要求5-8中任一项的一种或多种rna分子。
10.权利要求9的组合物,其中所述一种或多种rna分子代表编码cd40l、cd70和catlr4的mrna分子。
11.权利要求10的组合物,其还包含编码抗原/疾病特异性mrna的mrna。
12.权利要求5-8中任一项的rna分子或权利要求9-11中任一项的组合物用于引入宿主细胞中的用途。
13.权利要求5-8中任一项的rna分子或权利要求9-11中任一项的组合物,其用于医学用途。
14.一种试剂盒,其包含权利要求1-3中任一项的一种或多种载体;权利要求5-8中任一项的一种或多种rna分子;或权利要求9-11中任一项的组合物。
附图简述
通过具体参考附图,应强调的是所显示的细节是通过举例的方式示出的并仅用于本发明的不同实施方案的举例说明性讨论的目的。它们是为了提供本发明原理和概念方面的最有用和容易的描述而呈现的。在这方面,没有试图以比基本理解本发明所必需的更详细地显示本发明的结构细节。结合附图的描述使得本领域技术人员明显地知晓如何在实践中体现本发明的几种形式。
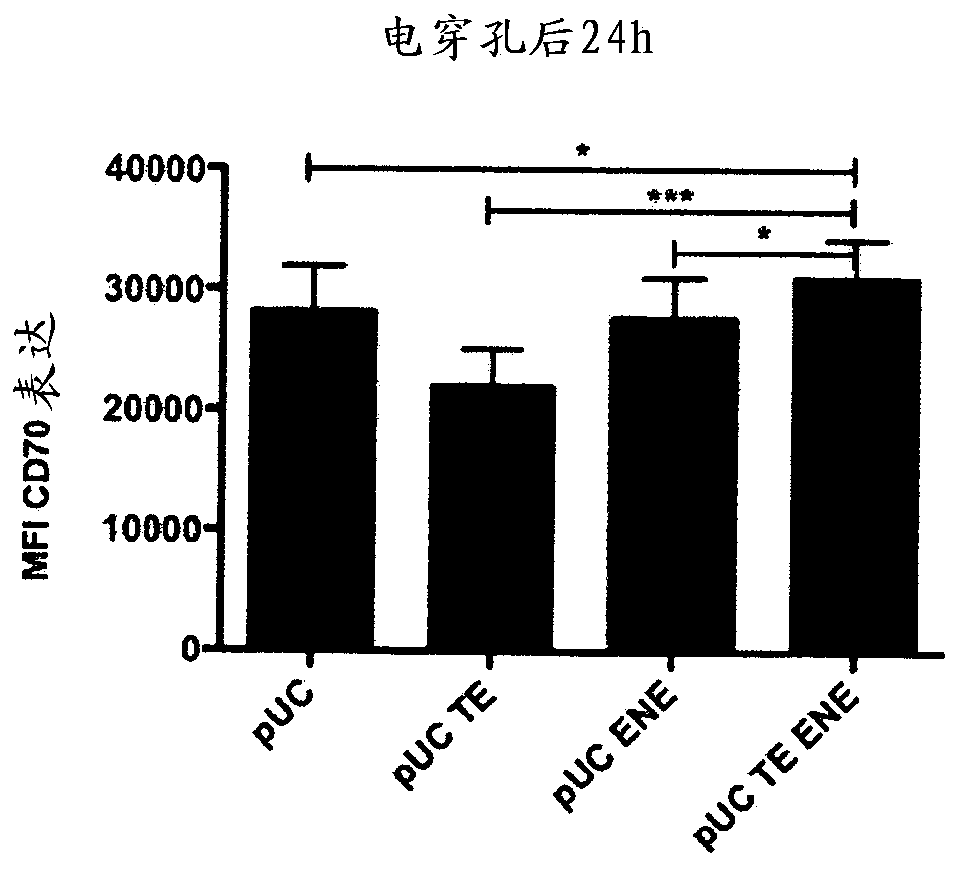
图1:用由puc-载体、puc-te载体、puc-ene载体或pucteene-载体编码的trimixmrna电穿孔idc。显示了阳性dc群的mfi(平均荧光强度)值。数据表示为平均值±sem。(配对t检验,*p<0.05)。npuc=6;npuc-te=15;npuc-ene=15;npucteene=19
图2:用wt1mrna电穿孔的dc中的wt1表达。用由不同载体编码的wt1mrna电穿孔idc并在电穿孔后4h、24h和48h通过细胞内染色分析其wt1表达。显示了使用不同wt1编码载体电穿孔idc后的mfi值比较。数据表示为平均值±sem。(配对t检验,*p<0.05;**p<0.01;***p<0.001)。n=6
图3:dc的egfp表达动力学。用egfp和由puc-载体或pucteene-载体编码的trimixmrna共电穿孔idc。在电穿孔后的几个时间点分析egfp表达。分析egfp阳性dc群的mfi值。数据表示为平均值±sem。(配对t检验,*p<0.05;**p<0.01;***p<0.001)。n=9
图4:未成熟和成熟dc的表型。在idc电穿孔后24小时研究所示分子的mfi值。数据表示为平均值±sem。(配对t检验,*p<0.05;**p<0.01;***p<0.001)。cd40n=9;cd70n=19;cd80n=12;cd83n=12;ccr7n=12。
图5:p815的双侧肿瘤模型:使用tngfr作为对照或使用pucteenetrimix单独处理一个肿瘤。将对侧、未处理的肿瘤用来评估全身抗肿瘤免疫应答。显示了每组的每只个体小鼠(n=6)的肿瘤生长,随后显示了平均肿瘤体积的概览。以kaplan-meier曲线可视化存活率。存活率的差异通过对数秩检验来分析。
图6:p815的双侧肿瘤模型:使用tngfr或0.8体积的hartman溶液作为对照来单独处理一个肿瘤。将对侧、未处理的肿瘤用来评估全身抗肿瘤免疫应答。显示了每组的每只个体小鼠(n=6)的肿瘤生长,随后显示了平均肿瘤体积的概览。以kaplan-meier曲线可视化存活率。存活率的差异通过对数秩检验来分析。
图7:具有其最重要的元件的pucteene-载体。
图8:显示如通过clustal2.1从embl创建的3个可变te序列(seqidn°1、2和3)的序列比较。
图9:(a)用wt1mrna电穿孔的dc中的wt1表达。用由不同载体编码的10μgwt1mrna电穿孔idc,并且通过电穿孔后4小时、24小时和48小时的细胞内染色来分析其wt1表达。显示了用不同wt1编码载体电穿孔idc后mfi值的比较。n=3(b)用egfpmrna电穿孔的dc中的egfp表达。用由不同载体编码的10μgegfpmrna电穿孔idc,并且通过电穿孔后4小时、24小时和48小时的细胞内染色来分析其egfp表达。显示了用不同wt1编码载体电穿孔idc后mfi值的比较。n=3
发明详述
在第一个方面,本发明提供了包含翻译增强子(te)和核保留序列的核酸载体。更具体地,所述核酸载体包含与seqidn°1具有至少80%序列同一性的翻译增强子(te)序列、可转录的核酸序列和由seqidn°4表示的核保留序列。
术语“载体”在这里以其最一般的意义使用,并且包括核酸的任何中间媒介物,其例如使得所述核酸能够被引入原核和/或真核宿主细胞中,并在合适的情况下被整合到基因组中。这样的载体优选在细胞中复制和/或表达。载体包括质粒、噬菌粒或病毒基因组。如本文所使用的,术语“质粒”一般涉及染色体外遗传物质的构建体,通常为环状dna双链体,其可以独立于染色体dna复制。
根据本发明,核酸分子或核酸序列是指一种核酸,其优选是脱氧核糖核酸(dna)或核糖核酸(rna)。根据本发明,核酸包括基因组dna、cdna、mrna、重组制备的和化学合成的分子。根据本发明,核酸可以是单链或双链以及线性或共价闭合环状分子的形式。术语“核酸”另外还包括在核苷酸碱基、糖或磷酸上化学衍生的核酸,以及含有非天然核苷酸及核苷酸类似物的核酸。
根据本发明所描述的核酸优选是分离的。根据本发明的术语“分离的核酸”意指核酸已被(1)体外扩增,例如通过聚合酶链反应(pcr)(2)通过克隆重组产生,(3)纯化,例如通过切割和凝胶电泳分级分离,或(4)合成,例如通过化学合成。分离的核酸是可通过重组dna技术操作的核酸。
5'翻译增强子(te)
翻译的转录后调控主要在翻译起始阶段来控制。起始因子的复合物结合到5'cap结构并招募核糖体亚单位。此复合物随后开始沿着mrna扫描移动,直到遇到合适背景下的aug密码子。此过程的效率可以通过mrna的5'和3'utr(非翻译区)中的多种结构特征来控制。这些特征包括在5'utr中的top(末端寡嘧啶段)区域、ires(内部核糖体进入位点)和上游的orf(开放阅读框)。在3’utr中已描述了cite(cap非依赖性翻译增强子)基序。还已显示多聚-a尾的长度在翻译起始中起重要作用,因为pabp(多聚-a结合蛋白)需要缔合至多聚-a尾和cap位点上的eif4复合物两者。
ires是能够独立于与5'cap结构的相互作用而招募核糖体的基序。第一个ires元件描述于小核糖核酸病毒(例如,emcv,脑心肌炎病毒)中。在感染期间,cap依赖性翻译被关闭,从而获得病毒蛋白的cap非依赖性翻译的优势。几种真核ires序列已经在最近几年被描述。在应激情况下,cap依赖性翻译被下调,而一些必需基因的cap非依赖性翻译可以持续。更具体地,通过例如lps在toll样受体4上的连接活化的树突状细胞也关闭cap依赖性翻译,而一些基因的cap非依赖性翻译保护细胞免于凋亡。
hu等人研究了编码小鼠gtx同源异形域蛋白的mrna的5'前导物中的序列。他们描述了与18s核糖体rna中的序列互补的序列。他们发现此基序对翻译的效率具有显著的影响(hu等人,1999)。
后来,已显示该基序作为内部核糖体进入位点(ires)发挥功能,并显示此5'前导物的较短的非重叠区段可以增强双顺反子mrna中的第二顺反子的翻译。这些区段之一为9个核苷酸长,并且当此ires模块的多个拷贝连接在一起时,ires活性大大增强。被人β珠蛋白5’utr的9n片段间隔的相同9n区段的串联重复序列被显示当位于mrna的5'末端在orf之前时,作为单顺反子mrna中的翻译增强子(te)发挥功能。
因此,在本发明的上下文中,可使用任何作为mrna的翻译增强子发挥功能的序列,例如本文上述的那些元件。特别地,翻译增强子是转录的rna中促进翻译的序列。一个可能的作用模式是通过增强核糖体与mrna的5'末端的结合。
在具体的实例中,根据本发明的载体可产生含有来自gtx前导序列的野生型9n序列ccggcgggt的10×串联重复序列的rna。这些基序通过从人β珠蛋白的5’utr衍生的9n序列ttctgacat连接。此dna片段可被克隆在质粒中位于噬菌体启动子序列和orf(开放阅读框)之间。
在具体的实施方案中,根据本发明的翻译增强子与seqidn°1具有至少80%的序列同一性。如从图8中明显看出的,seqidn°2和3相比于seqidn°1具有至少80%的序列同一性,并因此适合于与本发明相关使用。更优选地,根据本发明的翻译增强子与seqidn°1具有至少85%、86%、87%、88%或89%的序列同一性。如从图8中明显看出的,seqidn°2和3相比于seqidn°1具有至少85%的序列同一性。甚至更优选地,根据本发明的翻译增强子与seqidn°1具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性。如从图8中明显看出的,seqidn°3相比于seqidn°1具有至少90%的序列同一性。甚至更优选地,翻译增强子由seqidn°1、2或3中的任一种表示;最优选由seqidn°1表示。
核保留序列
转录后基因控制过程的重要性近年来已经变得越来越明显。在这些过程中,开始受到相当大的关注的一个是mrna稳定性的控制。随着日益认识到mrna降解对基因表达具有显著影响以及mrna衰减的速率可响应于环境和发育的信号而进行调节,现正进行着旨在理解此过程的轰轰烈烈的研究工作。已经取得显著进展,并且过去20年的研究已阐明了mrna降解的许多一般性特征。
细胞的和病毒的mrna均经受强力的rna衰减途径。病毒已经开发出不同的方法来保护它们的mrna免于宿主的脱腺苷酸化机制。卡波西肉瘤相关疱疹病毒(kshv)的多腺苷酸化的非翻译rna(pan)在感染细胞的核中非常丰富。这种rna对脱腺苷酸化和降解具有抗性。pan的累积取决于在3'区中的79个核苷酸的rna元件的活性,该元件被称为ene(表达和核保留元件)。conrad等人在2005年发表了涉及ene的第一篇文章,将其描述为产生无内含子转录物的增加的核丰度的卡波西肉瘤病毒rna元件(conrad,2005)。该ene片段含有与多聚-a尾相互作用的特定富含u的发夹结构。像这样,获得导致rna保留在核中和因而核保留元件的名称的二级结构。第二作用是富含u的发夹结构与mrna的多聚-a尾相互作用从而导致免于宿主降解的“屏蔽”作用,这是在产生用于免疫治疗目的的mrna中具有特别利益的性状。
多腺苷酸化的核(pan)rna(也称为t1.1或nut-1rna)是由致癌性γ疱疹病毒卡波西肉瘤相关疱疹病毒(kshv)产生的incrna(sun等人,1996)。panrna在裂解性感染期间累积到非常高的水平(~500,000个拷贝/细胞)并且是产生晚期病毒蛋白和感染性病毒所需的(sun等人,1996)。位于panrna的多腺苷酸化位点上游~120nt的表达和核保留元件(ene)对于在核中的这样的高累积是必不可少的(conrad和steitz,2005)。该ene通过阻断脱腺苷酸化抑制panrna的快速衰减(conrad等人,2006)。panrna不产生蛋白表达。核保留保持rna远离在细胞质中的翻译机器,而多聚-a尾的屏蔽阻止结合到pabp(多聚a结合蛋白),其是有效翻译所必不可少的。因此,将此序列用于转染是非显而易见的。
kshvene是长79个核苷酸的rna元件,包括具有不对称的内部富含u的环的茎环结构,其与相邻的碱基对结合构成ene的功能核心。结合至寡(a)9的ene核心的晶体结构揭示了在富含u的环和寡(a)9之间形成的5个连续u-a-u碱基三元体(mitton-fry等人,2010),其通过与茎下部的三个g-c碱基对的较少相互作用的a延伸。遗传和生化分析显示了panrna的多聚(a)尾和ene之间相似的体内相互作用(mitton-fry等人,2010)。
因此,在本发明的上下文中,可以使用任何功能为mrna的核保留元件的序列,例如本文上述的那些元件。具体地,核保留元件是具有保护mrna避免胞质衰减的能力的顺式作用序列。
在具体的实施方案中,核保留元件还作为rna稳定序列发挥功能。
在具体的实例中,核保留元件是kshv的表达和核保留元件。将从pan(多腺苷酸化的非翻译的)rna分离的79bp序列置于rna生产质粒中的a124序列段的上游。该ene形成与多聚a尾缔合和保护其免受降解的富含u的环。
在具体的实施方案中,根据本发明的核保留元件由seqidn°4表示。
本发明的载体中的其它元件
在其它实施方案中,本发明的核酸载体可以含有选自包含噬菌体启动子、可转录的核酸序列和多聚-a尾的列表的其它元件。
信使rna或核糖核酸(mrna)由4种核苷酸(腺苷、鸟苷、胞苷和尿苷一磷酸)的单链聚合物组成。翻译起始复合物对mrna的识别、mrna与核糖体的恰当附接以及保护避免5'外切核酸酶需要5'末端修饰或5'cap。该修饰由添加到第一转录核苷酸的7-甲基鸟苷核苷酸组成。编码区开始于起始密码子(通常为aug)且结束于终止密码子(通常是uaa、uag或uga)。在起始密码子之前和终止密码子之后,成熟的mrna含有5'非翻译区(utr)和3’utr。这些区域对mrna稳定性或不稳定性和翻译效率起作用。
可转录的核酸序列(特别是编码肽或蛋白质的核酸)和表达控制序列是彼此“功能性”连接的,只要它们以这样的方式彼此共价连接:可转录的核酸和尤其是编码核酸的转录或表达在表达控制序列的控制下或在表达控制序列的影响下。
本文所指定的核酸,特别是可转录的核酸和编码核酸,可以与任何表达控制序列特别是启动子组合,所述表达控制序列与所述核酸可以是同源的或异源的,术语“同源”是指这样的事实:核酸还天然地功能性连接至表达控制序列,并且术语“异源”是指这样的事实:核酸不天然地功能性连接至表达控制序列。
术语“表达控制序列”包括根据本发明的启动子、核糖体结合序列和其它控制元件,其控制基因的转录或衍生的rna的翻译。在本发明的具体实施方案中,表达控制序列可以被调控。表达控制序列的精确结构可取决于物种或细胞类型而变化,但通常包括分别牵涉起始转录和翻译的5'-非转录和5'-和3-非翻译序列,例如tata框、加帽序列、caat序列等。更具体地,5'-非转录表达控制序列包括启动子区,其涵盖用于功能性连接的基因的转录控制的启动子序列。表达控制序列还可以包括增强子序列或上游激活子序列。
在具体的实施方案中,核酸根据本发明功能性连接至表达控制序列,其相对于所述核酸可以是同源或异源的。
术语“启动子”或“启动子区”是指基因的编码序列的上游(5')的dna序列,其通过提供rna聚合酶的识别和结合位点控制所述编码序列的表达。启动子区可以包括针对牵涉调节所述基因的转录的其它因子的其它识别或结合位点。启动子可以控制原核或真核基因的转录。启动子可以是“诱导型”的并且可响应诱导剂起始转录,或者如果转录不通过诱导剂控制,其可以是“组成型”的。如果诱导剂不存在,诱导型启动子仅被表达至非常小的程度或根本不表达。在诱导剂的存在下,基因被“开启”或转录水平增加。这通常通过特定转录因子的结合介导。
在具体的实施方案中,可转录的核酸序列选自包含编码cd40l(nm_000074)、cd70(nm_001252)、catlr4((人tlr4基因的截短形式,其仅含有基因的跨膜和胞质区以及在其之前的lamp1(溶酶体相关膜蛋白)的信号肽)的mrna或抗原/疾病特异性mrna的列表。
根据本发明的噬菌体启动子可以是用于rna转录的任何合适的启动子,并且优选选自包含t7启动子、sp6启动子和t3启动子的列表;更特别地为t7启动子。
如本发明的上下文中使用的多聚-a尾优选由约100-150个腺苷,更特别地120-125个腺苷,优选约124个腺苷组成。
术语“多腺苷酸盒”或“多聚-a序列”是指通常位于rna分子的3'末端的腺苷酸残基的序列。本发明提供了在rna转录过程中通过dna模板的方式在与编码链互补的链中的重复胸苷酸残基的基础上附接的这样的序列,然而所述序列通常不在dna中编码而是在核中通过模板依赖性rna聚合酶在转录后被附接至rna的游离3'末端。根据本发明,这种类型的多聚(a)序列被理解为意指至少20,优选至少40,优选至少为80,优选至少100并优选至多500,优选至多400,优选至多300,优选至多200,特别是至多150个连续a核苷酸的核苷酸序列,并且特别是约120个连续a核苷酸的核苷酸序列,其中术语“a核苷酸”是指腺苷酸残基。
本发明进一步提供了可通过根据本发明的核酸载体的转录获得的rna分子。
在其它方面,本发明提供了增加体外转录的rna的稳定性和/或翻译效率的方法;所述方法包括以下步骤:
(i)提供根据本发明的载体,其中所述可转录的核酸序列是可转录的dna序列,其对应于待转录的所述rna;和
(ii)体外转录所述可转录的dna序列;
以及由所述方法获得的rna分子。
根据本发明,术语“转录”包括“体外转录”,其中术语“体外转录”涉及其中在体外以无细胞的方式合成rna特别是mrna的方法。转录物的制备优选利用克隆载体,其通常被称为转录载体并且其包括在根据本发明的术语“载体”中。
术语“从核酸序列转录的核酸序列”是指rna(在合适的情况下作为完整的rna分子的一部分),其是前者核酸序列的转录产物。
术语“可以被转录以产生共同的转录物的核酸”意指所述核酸以这样的方式彼此功能性连接,以使得在合适的情况下在线性化例如含有所述核酸的核酸分子(特别是封闭的环状核酸分子)的限制性内切酶切割之后,在启动子控制下的转录导致包含彼此共价连接的所述核酸的转录物的rna分子,在合适的情况下由位于其间的序列分开。
根据本发明,术语“表达”以其最一般的意义使用,并且包括rna和/或蛋白质的产生。它还包括核酸的部分表达。此外,表达可以是瞬时的或稳定的。对于rna而言,术语“表达”或“翻译”特别地是指肽或蛋白质的产生。
术语“具有活性以增加核酸序列的翻译效率和/或稳定性的核酸序列”意指第一核酸能够以这样的方式修饰(在与第二核酸的共同转录物中)所述第二核酸翻译效率和/或稳定性,以使得所述翻译效率和/或稳定性与所述第二核酸在没有所述第一核酸的情况下的翻译效率和/或稳定性相比增加。在此背景下,术语“翻译效率”涉及在特定时间段内由rna分子提供的翻译产物的量,并且术语“稳定性”涉及rna分子的半衰期。
在具体的实施方案中,本发明提供了包含翻译增强子(te)和核保留元件(ene)的rna分子;或包含一种或多种所述rna分子的组合物。更具体地,本发明提供了包含与seqidn°1具有至少80%序列同一性的翻译增强子(te)、可转录的核酸序列和由seqidn°4表示的核保留序列的rna分子;或包含所述rna分子的组合物。
所述rna分子可以进一步包括选自包含可翻译的核酸序列和多聚-a尾的列表中的一种或多种元件;其中所述可翻译的核酸序列可以选自包含编码cd40l、cd70、catlr4的mrna或抗原/疾病特异性mrna的列表。
在本发明的上下文中,te元件优选位于可转录/可翻译的rna分子的5'末端,并且核保留序列(ene)优选位于3'末端。
“核酸的3'末端”根据本发明是指具有游离羟基的那个末端。“核酸的5'末端”根据本发明是指具有游离磷酸基团的那个末端。
在本发明的上下文中,“mrna”意指“信使rna”,并且是指使用dna作为模板产生的并且其本身编码肽或蛋白质的转录物。mrna通常包含5'-非翻译区、蛋白编码区和3'-非翻译区。mrna在细胞中具有有限的半衰期。根据本发明,mrna可以通过体外转录从dna模板制备。除了根据本发明的修饰以外,它还可以通过进一步稳定修饰和加帽来进行修饰。
在具体的实施方案中,根据本发明的组合物包含与编码抗原/疾病特异性mrna的mrna组合或不组合的编码cd40l、cd70和catlr4的mrna。
根据本发明的抗原/疾病特异性mrna可以选自包含肿瘤抗原、病原体衍生的抗原、变应原等的非限制性列表。
本发明进一步提供了rna分子和/或包含一种或多种所述rna分子的组合物用于多种目的的用途,诸如例如用于在体内或体外引入宿主细胞中;或用于医学。
本发明一个方面还提供包含根据本发明的一种或多种载体、一种或多种rna分子或组合物的试剂盒。
本发明还提供了用于使用根据本发明的一种或多种rna分子或组合物治疗有此需要的患者的方法;其中,所述rna分子可以同时或以一定间隔依次施用。
本发明提供了待施用给患者的核酸特别是rna。核酸可以通过离体方法施用,即通过从患者取出细胞,遗传修饰所述细胞(例如通过转染)和将经修饰的细胞重新引入到患者内。转染和转导方法是本领域技术人员已知的。本发明还提供了待体内施用的核酸。
根据本发明,术语“转染”是指将一种或多种核酸引入生物体或宿主细胞。可以使用各种方法来将根据本发明的核酸体外或体内引入细胞。这样的方法包括核酸-cap04沉淀转染,与deae有关的核酸转染,用携带目标核酸的病毒感染的转染,脂质体介导的转染等。在具体的实施方案,优选将核酸导入至特定细胞。在这样的实施方案中,用于将核酸施用至细胞的载体(例如,逆转录病毒或脂质体)可具有结合的靶向分子。例如,可以将分子(例如特异于靶细胞上的表面膜蛋白的抗体,或针对靶细胞上的受体的配体)掺入或结合至核酸载体。如果期望通过脂质体施用核酸,则可以将结合至与胞吞作用相关的表面膜的蛋白质掺入脂质体制剂中,以使得能够靶向和/或吸收。这样的蛋白质包括特异于特定细胞类型的衣壳蛋白或其片段,针对被内化的蛋白质的抗体,靶向胞内位点的蛋白质等。
根据本发明的rna分子或组合物可以通过任何合适的施用途径施用给有此需要的患者,例如结内、皮内、淋巴管内和瘤内施用途径。此外,当治疗例如癌症患者时,根据本发明的rna分子或组合物的施用可以与用于从患者中的肿瘤释放肿瘤mrna的方法(例如消融或或声致穿孔)组合使用。
根据本发明,标准方法可以用于制备重组核酸,培养细胞,尤其是电穿孔和脂质体转染。酶促反应按照生产商的说明书或以本身已知的方式进行。
根据本发明,“来源于核酸序列的核酸序列”是指与其所来源于的核酸相比,含有单个或多个核苷酸取代、缺失和/或添加并且优选与其所来源于的核酸互补(即在所述核酸之间存在一定程度的同源性并且所述核酸的核苷酸序列以显著直接或互补的方式对应)的核酸。
根据本发明,来源于核酸的核酸具有其所来源于的核酸的功能性质。这样的功能性质特别地包括通过功能性连接至可以被转录成rna的核酸(可转录的核酸序列),增加从此核酸产生的rna在完整rna分子中的稳定性和/或翻译效率的能力。
如果两个序列能够彼此杂交并形成稳定的双链体,则核酸与另一核酸是“互补”的,所述杂交优选在允许多核苷酸之间特异性杂交的条件(严格条件)下进行。严格条件描述于例如molecularcloning:alaboratorymanual,jsambrook等人中。
根据本发明,互补的核酸具有至少60%,至少70%,至少80%,至少90%,并且优选至少95%,至少98%或至少99%相同的核苷酸。
根据本发明,如果第一多核苷酸区的5’末端是最靠近第二多核苷酸区的3’末端的所述第一多核苷酸区的部分,所述第一多核苷酸区被认为位于所述第二多核苷酸区的下游。
3'非翻译区通常从翻译产物的终止密码子延伸至通常在转录过程后附接的多聚a序列。哺乳动物mrna的3'-非翻译区通常具有被称为aauaaa六核苷酸序列的同源性区域。该序列推测是多聚-a附接信号,并且常常位于多聚-a附接位点上游10至30个碱基的位置。
3'-非翻译区可以含有一个或多个可折叠以产生茎-环结构的反向重复序列,其用作针对外切核糖核酸酶的屏障或与已知增加rna稳定性的蛋白质(例如rna结合蛋白)相互作用。
5'-和/或3'-非翻译区可以根据本发明功能性地连接至可转录的核酸和特别是编码核酸,从而这些区域与核酸以这样的方式相关联,以使得从所述可转录的核酸转录的rna的稳定性和/或翻译效率增加。
根据本发明,术语“基因”是指特定的核酸序列,其负责产生一个或多个细胞产物和/或实现一个或多个细胞产物和/或实现一个或多个细胞间或细胞内功能。更具体而言,所述术语涉及dna区段,其包含编码特定蛋白或功能性或结构性rna分子的核酸。
根据本发明,术语“宿主细胞”是指可用外源核酸转化或转染的任何细胞。根据本发明的术语“宿主细胞”包括原核细胞(例如大肠杆菌)或真核细胞(例如酵母细胞和昆虫细胞)。特别优选的是哺乳动物细胞,例如来自人、小鼠、仓鼠、猪、山羊和灵长类动物的细胞。细胞可以来源于多样的组织类型,并且包括原代细胞和细胞系。具体实例包括角质形成细胞,外周血白细胞,骨髓干细胞和胚胎干细胞。在其它实施方案中,宿主细胞是抗原提呈细胞,特别是树突细胞、单核细胞或巨噬细胞。核酸可以单个拷贝或多个拷贝存在于宿主细胞中并且在一个实施方案中,在宿主细胞中表达。
根据本发明,由核酸编码的肽或蛋白质可以是位于细胞质中、核中、膜中、细胞器中或分泌形式的肽或蛋白质。它们包括结构蛋白,调节蛋白,激素,神经递质,生长调节因子,分化因子,基因表达调控因子,dna相关蛋白,酶,血清蛋白,受体,药物,免疫调节剂,癌基因,毒素,肿瘤抗原或抗原。所述肽或蛋白质可具有天然存在的序列或突变的序列以增强、抑制、调节或消除其生物活性。
术语“肽”是指包含经由肽键彼此连接的2个或更多,优选3个或更多,优选4个或更多,优选6个或更多,优选8个或更多,优选10个或更多,优选13个或更多,优选16个或更多,优选100个或优选150个连续氨基酸的物质。术语“蛋白质”是指大的肽,优选是具有至少151个氨基酸的肽,但术语“肽”和“蛋白质”在本文中通常被用作同义词。术语“肽”和“蛋白质”根据本发明包括不仅含有氨基酸组分还含有非氨基酸组分(诸如糖和磷酸结构)的物质,并且还包括含有键(诸如酯键、硫醚键或二硫键)的物质。
“报告因子”涉及一种分子,通常是肽或蛋白质,其由报告基因编码,并且在报告因子测定法中测量。常规的系统通常使用酶报告因子和测量所述报告因子的活性。
根据本发明,两个元件(诸如核苷酸或氨基酸)如果彼此直接相邻而没有任何中断,则它们是连续的。
“限制性内切酶”或“限制性酶”是指一类在特定碱基序列内切割dna分子的两条链中的磷酸二酯键的酶。它们识别双链dna分子上的特异性结合位点(被称为识别序列)。dna中的所述磷酸二酯键被所述酶切割的位点被称为切割位点。在iis型酶的情况下,切割位点位于离dna结合位点确定距离的位置。
应用领域
本发明的应用领域是疫苗接种,即经修饰的mrna用于接种的用途或包含经修饰的mrna药物组合物作为接种剂的用途,或经修饰的mrna用于制备用于接种目的的药物组合物的用途。疫苗接种基于将抗原引入生物体或受试者,特别是引入生物体或受试者的细胞。在本发明的上下文中,编码抗原的遗传信息以编码抗原和/或不同的trimixmrna链的经修饰的mrna的形式被引入到生物体或受试者中。药物组合物中所含有的经修饰的“抗原”mrna被翻译成抗原,即表达由经修饰的mrna编码的多肽或抗原性肽并刺激针对所述多肽或抗原性肽的免疫应答。对于针对病原生物体(例如,病毒、细菌或原生动物)的疫苗接种,可将这样的生物体的表面抗原用作针对其引发免疫应答的抗原。在本发明的上下文中,包含编码这样的表面抗原的经修饰的mrna的药物组合物可以用作疫苗。在其中基因疫苗用于治疗癌症的应用中,通过产生编码肿瘤抗原(特别是专一表达在癌细胞上的蛋白质)的经修饰的mrna来使免疫应答针对肿瘤抗原。这样的编码肿瘤抗原的经修饰的mrna可以单独地或作为根据本发明的药物组合物的组分使用,其中经修饰的mrna或其组合物的施用导致生物体中癌抗原的表达。针对这样的疫苗的免疫应答从而会给接种疫苗的受试者赋予一定程度的针对与免疫接种的癌抗原相关的癌症的保护性免疫。可替代地,可以将这样的措施用于使用编码表达在患者的癌细胞上的肿瘤抗原的经修饰的mrna接种癌症患者以刺激癌症患者的免疫应答来攻击表达所编码的抗原的任何癌细胞。
对于基因治疗应用,例如其中使用本发明的药物组合物的基因治疗应用,其中的经修饰的mrna编码至少一种生物活性肽或多肽,在待治疗的患者中不形成或仅不充分或有缺陷性地形成所述生物活性肽或多肽。因此,给这样的患者施用编码所述至少一种生物活性肽或多肽的经修饰的mrna或其组合物,至少部分地恢复所述至少一种生物活性肽或多肽在患者中的表达和/或活性和从而补充了患者的遗传缺陷。将正常、功能性基因直接引入至活动物中已被研究作为用于替换有缺陷的遗传信息的手段。在这样的研究中,核酸序列被直接引入活动物的细胞中。因此,由本发明的经修饰的mrna编码的多肽的实例包括但不限于肌营养不良蛋白,在囊性纤维化中被缺陷性地改变的氯离子通道,在代谢障碍例如苯丙酮尿症、半乳糖血症、同型胱氨酸尿症、腺苷脱氨酶缺乏症等中是缺乏或缺陷性的酶;以及牵涉神经递质例如多巴胺、去甲肾上腺素和gaba的合成的酶,尤其是酪氨酸羟化酶和dopa脱羧酶,以及α-1-抗胰蛋白酶等。本发明的药物组合物还可以用于实现细胞表面受体和/或细胞表面受体的结合伴侣的表达,包含在其中的经修饰的mrna编码这样的生物活性蛋白质或肽。以细胞外方式的或结合至细胞表面受体的这样的蛋白质的实例包括例如组织纤维蛋白溶酶原活化剂(tpa),生长激素,胰岛素,干扰素,粒细胞-巨噬细胞集落刺激因子(gm-cfs)和促红细胞生成素(epo)等。
通过选择合适的生长因子,可以例如将本发明的药物组合物用于组织再生,或用于与干细胞相互作用。通过这种方式,可以治疗例如特征在于组织变性的疾病,其包括神经变性疾病例如阿尔茨海默氏病、帕金森氏病等,以及其它退化性病况,例如关节炎。在这些情况下,经修饰的mrna,特别是本发明的药物组合物中所含有的经修饰的mrna,优选编码(但不限于)tgf-β家族成员,神经营养因子,诸如ngf、神经营养素等。
治疗方法
因此,本发明还提供了用于预防和/或治疗选自包含癌症、变态反应和感染性疾病例如细菌、病毒或真菌感染例如hiv感染或肝炎的非限制性列表的至少一种疾病或病症的方法。
在整个说明书中使用的术语“癌症”和/或“肿瘤”并不旨在限制于可能已例举的癌症或肿瘤类型。因此,该术语包括所有增生性疾病,例如赘生物,发育异样,恶化前或癌前病变,异常细胞生长,良性肿瘤,恶性肿瘤,癌症或转移,其中所述癌症选自:白血病,非小细胞肺癌,小细胞肺癌,cns癌,黑素瘤,卵巢癌,肾癌,前列腺癌,乳腺癌,神经胶质瘤,结肠癌,膀胱癌,肉瘤,胰腺癌,结肠直肠癌,头颈癌,肝癌,骨癌,骨髓癌,胃癌,十二指肠癌,食管癌,甲状腺癌,血液学癌症,和淋巴瘤。癌症的特异性抗原可以例如是melana/mart1,癌-种系抗原,gp100,酪氨酸酶,cea,psa,her-2/neu,存活蛋白,端粒酶。
在整个说明书中使用的术语“感染性疾病”或“感染”并不旨在限制于可能已例举的感染类型。因此,该术语包括针对其的免疫接种对受试者会是有益的所有感染原。非限定性实例是下述病毒引起的感染或病症:获得性免疫缺陷综合征-腺病毒感染-甲病毒感染-虫媒病毒感染-贝尔麻痹-博尔纳病-布尼亚病毒感染-杯状病毒感染-水痘-感冒-尖锐湿疣-冠状病毒感染-柯萨奇病毒感染-巨细胞病毒感染-登革热-dna病毒感染-传染性脓疱,-脑炎-脑炎,虫媒病毒-脑炎,单纯疱疹病毒-eb病毒感染-传染性红斑-幼儿急疹-疲劳综合征,慢性-汉坦病毒感染-出血热,病毒性-肝炎,病毒性,人-唇疱疹-单纯疱疹-带状疱疹-耳部带状疱疹-疱疹病毒感染-hiv感染-传染性单核细胞增多症-禽流感-流感,人-拉沙热-麻疹-脑膜炎,病毒性-传染性软疣-猴痘-腮腺炎-脊髓炎-乳头瘤病毒感染-副粘病毒感染-白蛉热-脊髓灰质炎-多瘤病毒感染-脊髓灰质炎后综合征-狂犬病-呼吸道合胞病毒感染-裂谷热-rna病毒感染-风疹-严重急性呼吸系统综合征-慢病毒病-天花-亚急性硬化性全脑炎-蜱传播疾病-肿瘤病毒感染-疣-西尼罗热-病毒病-黄热病-人畜共患病-等等。针对病毒的特异性抗原可以是hiv-gag、-tat、-rev或-nef,或丙型肝炎抗原。
其它非限制性实例是下述细菌或真菌引起的感染或病症:脓肿-放线菌病-微粒孢子虫病-炭疽-关节炎,反应性-曲霉病-菌血症-细菌感染和真菌病-巴尔通体感染-肉毒中毒-脑脓肿-布氏杆菌病-伯霍尔德杆菌感染-弯曲杆菌感染-念珠菌病-念珠菌病,外阴阴道-猫抓病-蜂窝织炎-中枢神经系统感染-软下疳-衣原体感染-衣原体科感染-霍乱-梭菌感染-球孢子菌病-角膜溃疡-交叉感染-隐球菌病-皮肤真菌病-白喉-埃里希体病-脓胸,胸膜-心内膜炎,细菌性-眼内炎-小肠结肠炎,伪膜性-丹毒-大肠杆菌感染-筋膜炎,坏死性-富尼埃坏疽-疖病-梭杆菌感染-气性坏疽-淋病-革兰阴性菌感染-革兰阳性菌感染-腹股沟肉芽肿-化脓性汗腺炎-组织胞浆菌病-睑腺炎-脓疱疮-克雷伯氏菌感染-军团杆菌病-麻风-钩端螺旋体病-李斯特菌感染-路德维希咽峡炎-肺脓肿-莱姆病-性病性淋巴肉芽肿-马杜拉分支菌病-类鼻疽-脑膜炎,细菌性-分枝杆菌感染-支原体感染-真菌病-诺卡氏菌感染-甲癣-骨髓炎-甲沟炎-盆腔炎症性疾病-瘟疫-肺炎球菌感染-假单胞菌感染-鹦鹉热-产褥感染-q热-鼠咬热-回归热-呼吸道感染-咽后脓肿-风湿热-鼻硬结病-立克次体感染-洛矶山斑疹热-沙门氏菌感染-猩红热-恙虫病-败血症-性传播疾病,细菌性-性传播疾病,细菌性-休克,脓毒性-皮肤疾病,细菌性-皮肤疾病,传染病-葡萄球菌感染-链球菌感染-梅毒-梅毒,先天性-破伤风-蜱传播疾病-癣-花斑癣-沙眼-结核病-结核病,脊髓-土拉菌病-伤寒-斑疹伤寒,流行性虱传-泌尿道感染-惠普尔病-百日咳-弧菌感染-雅司病-耶尔森氏菌感染-人畜共患病-接合菌病-等等。
如本文所用且除非另有说明,术语“溶剂化物”包括可以由本发明的rna分子与合适的无机溶剂(例如,水合物)或有机溶剂形成的任何组合,诸如但不限于注射用水,哈特曼溶液,pbs,0.9%nacl,无血清培养基。
通常,对于药物用途,本发明的rna分子可被配制成药物制剂或药物组合物,其包含本发明的至少一种rna分子和至少一种药学上可接受的载体、稀释剂或赋形剂和/或佐剂,和任选地一种或多种另外的药学活性产品。
通过非限制性实例的方式,这样的制剂可以是适于口服施用、胃肠外施用(例如通过淋巴管内、肿瘤内、静脉内、肌内或皮下注射或静脉内输注)、局部施用(包括眼部)、通过吸入施用、通过皮肤贴剂、通过植入物、通过栓剂等的形式。这样的合适的施用形式(取决于施用的方式,其可以是固体、半固体或液体的)-以及用于制备其的方法和载体、稀释剂和赋形剂对于本领域技术人员将是清楚;再次参考例如us-a-6,372,778、us-a-6,369,086、us-a-6,369,087和us-a-6,372,733,以及标准手册,例如最新版的remington’spharmaceuticalsciences。
这样的制剂的一些优选、但非限制性的实例包括片剂,丸剂,粉剂,锭剂,囊剂,扁囊剂,酏剂,悬浮剂,乳剂,溶液,糖浆,气雾剂,软膏,乳膏剂,洗剂,软和硬明胶胶囊,栓剂,滴眼剂,无菌注射液和无菌包装粉剂(其通常在使用前重构),其用于作为推注施用和/或用于连续施用,其可与载体、赋形剂和稀释剂进行配制,所述载体、赋形剂和稀释剂本身适合用于这样的制剂,例如为乳糖,葡萄糖,蔗糖,山梨醇,甘露醇,淀粉,阿拉伯树胶,磷酸钙,藻酸盐,黄蓍胶,明胶,硅酸钙,微晶纤维素,聚乙烯吡咯烷酮,聚乙二醇,纤维素,(无菌)水,甲基纤维素,甲基-和丙基羟苯酸酯,滑石,硬脂酸镁,食用油,植物油和矿物油或其合适的混合物。该制剂可任选含有其它药学活性物质(其可以或可以不导致与本发明的产品的协同效应)以及通常用于药物制剂的其它物质,诸如润滑剂,湿润剂,乳化剂和悬浮剂,分散剂,崩解剂,增量剂,填充剂,防腐剂,甜味剂,调味剂,流动调节剂,脱模剂,等等。该组合物还可以配制以提供其中含有的活性产物的快速、持续或延迟释放,例如使用基于天然凝胶或合成聚合物的脂质体或亲水性聚合物基质。为了提高根据本发明的药物组合物的产品的溶解性和/或稳定性,可有利的是使用α-、β-或γ-环糊精或它们的衍生物。
更具体地,组合物可以在包含治疗有效量的由本发明的产品的固体分散体组成的颗粒和一种或多种药学上可接受的水溶性聚合物的药物制剂中进行配制。
术语“固体分散体”定义包含至少两种组分的固体状态(相对于液体或气体状态)下的系统,其中一种组分几乎均匀分散在整个其它组分中。当组分的所述分散体使得系统在整个如热力学所定义的一个相上是化学和物理均匀或同质的或由如热力学所定义的一个相组成,则这样的固体分散体被称为“固体溶液”。固体溶液是优选的物理系统,因为其中的组分通常是它们所施用至的生物体可容易生物利用的。
可以进一步方便的是以纳米颗粒的形式配制产品,所述纳米颗粒具有以足以保持小于1000nm的有效平均颗粒尺寸的量吸附在其表面上的表面改性剂。合适的表面改性剂可优选选自已知的有机和无机药用赋形剂。这样的赋形剂包括各种聚合物,低分子量寡聚物,天然产物和表面活性剂。优选的表面改性剂包括非离子和阴离子表面活性剂。
配制根据本发明的产物的另一个有趣的方式涉及一种药物组合物,据此产品被掺入在亲水性聚合物中并将此混合物作为涂层膜施加在许多小珠上,从而得到具有良好的生物利用度的组合物,其可以方便地制造并且适于制备用于口服施用的药物剂型。适合用作珠粒中的芯的材料是多样的,只要所述物质是药学上可接受的并且具有适当的尺寸和硬度。这样的材料的实例是聚合物,无机物质,有机物质,和糖类及其衍生物。
制剂可以本身已知的方式来制备,这通常涉及将根据本发明的至少一种产物与一种或多种药学上可接受的载体混合,并且,如果需要的话,与其它药物活性产物组合,必要时在无菌操作下条件。再次参考us-a-6,372,778、us-a-6,369,086、us-a-6,369,087和us-a-6,372,733和上面提到的其它现有技术,以及标准手册,例如最新版本的remington’spharmaceuticalsciences。
本发明的药物制剂优选是单位剂量形式,并可以适当地包装,例如在盒、泡(blister)、小瓶、瓶、小袋、安瓿中或在任何其它合适的单剂量或多剂量固定器或容器(其可适当地标记)中;任选地具有包含产品信息和/或使用说明的一个或多个传单。一般地,这样的单位剂量将含有0.1-1000mg。
产品可以通过多种途径施用,包括淋巴管内、肿瘤内、口服、直肠、眼、经皮、皮下、静脉内、肌内或鼻内途径,主要取决于所用的特定制剂和待治疗或预防的病况。本发明的至少一种产品通常将以“有效量”施用,这是指产品一旦适当施用则足以在它所施用至的个体中实现期望的治疗或预防效果。通常,取决于待预防或治疗的病况和施用途径,这样的有效量将通常是0.01-1000mg/千克患者体重/天,其可以作为单次每日剂量施用、划分在一个或多个每日剂量上或基本上连续地施用例如使用点滴输注。待施用的量、施用的途径和进一步的治疗方案可以由治疗医师确定,这取决于各种因素,例如患者的年龄、性别和一般状况以及待治疗的疾病/症状的性质和严重程度。再次参考us-a-6,372,778、us-a-6,369,086、us-a-6,369,087和us-a-6,372,733和上面提到的其它现有技术,以及标准手册,例如最新版本的remington’spharmaceuticalsciences。
按照本发明的方法,所述药物组合物可以在治疗过程中在不同的时间分开施用,或以分开或单一组合形式同时施用。本发明因此应理解为包括所有这样的同时或交替治疗方案,并且应相应地解释术语“施用”。
对于口服施用形式,本发明的组合物可以与适当的添加剂例如赋形剂、稳定剂或惰性稀释剂混合,并通过常规方法形成合适的施用形式,例如片剂、包衣片剂、硬胶囊、水性溶液、醇溶液或油性溶液。合适的惰性载体的实例是阿拉伯胶、氧化镁、碳酸镁、磷酸钾、乳糖、葡萄糖或淀粉,特别是玉米淀粉。在这种情况下,配制可以作为干颗粒和作为湿颗粒进行。合适的油性赋形剂或溶剂是植物油或动物油,例如葵花油或鳕鱼肝油。用于水性或醇溶液的合适的溶剂是水、乙醇、糖溶液,或它们的混合物。聚乙二醇和聚丙二醇也可用作用于其它施用形式的其它助剂。作为立即释放片剂,这些组合物可含有微晶纤维素、磷酸二钙、淀粉、硬脂酸镁和乳糖和/或本领域中已知的其它赋形剂、粘合剂、增量剂、崩解剂、稀释剂和润滑剂。
当通过鼻腔气雾剂或吸入剂施用时,这些组合物可以根据药物制剂领域中众所周知的技术制备,并且可以作为盐水中的溶液来制备,使用苄醇或其它合适的防腐剂、吸收促进剂以提高生物利用度、氟碳化合物和/或本领域已知的其它增溶剂或分散剂。以气雾剂或喷雾剂形式施用的合适的药物制剂是例如本发明的产品的溶液、悬浮液或乳液或它们在药学上可接受的溶剂(例如乙醇或水,或这样的溶剂的混合物)中的生理学上可耐受的盐。如果需要的话,制剂还可以另外含有其它药物助剂例如表面活性剂、乳化剂和稳定剂,以及推进剂。
对于皮下施用,如果需要的话,可以将根据本发明的产品与由此常规的物质例如增溶剂、乳化剂或其它助剂带入溶液、悬浮液或乳液中。本发明的产品还可以被冷冻干燥,所获得的冻干物例如用于产生注射或输注制剂。合适的溶剂是例如水、生理盐水溶液以及糖溶液诸如葡萄糖或甘露醇溶液,或可替代地所提及的各种溶剂的混合物。可注射的溶液或悬浮液可根据已知技术进行配制,使用适合的无毒、肠胃外可接受的稀释剂或溶剂,诸如甘露醇、水、林格氏溶液或等渗氯化钠溶液,或适合的分散剂或湿润剂和悬浮剂,例如无菌的、无刺激性的、非挥发性油类,包括合成的单或二甘油酯,和脂肪酸,包括油酸。
当以栓剂形式直肠施用时,这些制剂可以通过将根据本发明的产品与适合的非刺激性赋形剂例如可可脂、合成甘油酯或聚乙二醇(其在常温下是固体的,但在直肠腔中是液化和/或溶解的以释放药物)混合来制备。
在优选的实施方案中,本发明的产品和组合物被局部使用,例如表面的或在吸收和非吸收的应用中。
所述组合物在兽医领域是具有价值的,其在本文中的目的不仅包括预防和/或治疗动物中的疾病,而且还对于经济上重要的动物诸如牛、猪、羊、鸡、鱼等提高了动物的生长和/或重量和/或从动物获得的肉或其它产品的量和/或质量。因此,在另一个方面,本发明涉及用于兽医用途的含有本发明的至少一种产品和至少一种合适的载体(即,适合于兽医用途的载体)的组合物。本发明还涉及本发明的产品在这样的组合物的制备中的用途。
实施例
一般材料和方法
体外实验:单核细胞衍生的dc的产生
外周血单核细胞(pbmc)被用作dc前体的来源,并从白细胞去除术产物中分离。如下在体外从有适应性的(plastic)贴壁级分产生临床级dc。在第0天,pbmc以10×106个细胞/ml的密度铺板在适于造血细胞培养的补充有2%自体血浆(ap)的培养基中。静置细胞2小时,以允许在37℃下单核细胞的有适应性的贴壁。通过洗涤除去非贴壁细胞,并将贴壁细胞在细胞工厂(cellfactory)中在补充有1%ap、1,000u/mlgm-csf和500u/mlil-4的培养基中培养。在第2和4天,将含有第0天的细胞因子量的培养基添加至dc培养物。dc培养的第6天,将细胞收获并冷冻保存。
体外实验:dc的电穿孔
如所指示,在第6天,用mrna对4–8×106个dc进行电穿孔。电穿孔之前,将dc洗涤两次,第一次用无补充剂的pbs且第二次用减少血清的无酚红培养基。在第二洗涤步骤后,将dc重悬于含有该mrna的终体积200μl的减少血清培养基中。在4-mm间隙电穿孔杯中进行电穿孔。以下列条件使用指数衰减脉冲:电压,300v;电容,150μf,电阻,∞ω,产生≈11ms的脉冲时间。在电穿孔后立即将dc在补充有1%huab血清和ps/l-glu的培养基中稀释并在37℃下在湿润的5%co2气氛中培养。电穿孔后,没有额外的细胞因子被添加至dc。
体内实验:小鼠
雌性、6至12周龄的dba/2小鼠。
体内实验:小鼠细胞系
肥大细胞瘤细胞系p815获自c.uyttenhove(universitécatholiquedelouvain,louvain-la-neuve,belgium)。
体内实验:肿瘤细胞接种和mrna的原位递送
如在实验中所指示,为了生长可触知的肿瘤,用5×105个p815肿瘤细胞两胁皮下注射小鼠。对于mrna的瘤内递送,将小鼠用异氟烷(abbott)麻醉。将肿瘤在它们达到约100mm3的体积时用在50μl0.8哈特曼溶液/注射肿瘤的最终体积中的含有10μgtrimixmrna的各自组分的混合物进行注射。在不同组之间使用相同量的mrna。从pgem载体产生的编码tngfr的mrna用作对照。
实施例1
具体材料和方法
如在上文的一般材料和方法部分中所述,进行idc产生和电穿孔。用5μgtrimix各成分电穿孔idc,以使dc成熟。所有流式细胞染色在pbs/bsa/叠氮化物中进行。为了分析cd70的表达,使用抗cd70异硫氰酸荧光素(fitc)。在facsfortessa流式细胞仪(bd)上进行数据采集,并使用facsdiva软件进行分析。
结果:
电穿孔后二十四小时,将dc就其cd70表面表达进行染色。这些结果表明,用trimix电穿孔idc后,当与puc–载体(pucteene质粒的基础)、pucte-载体和pucene-载体相比较时,cd70表达的强度(平均荧光强度(mfi))在用由含有两种调控元件(te+ene)的pucteene质粒(seqidn°5)编码的trimix电穿孔后显著更高。在用由pucteene质粒编码的trimix电穿孔后,cd70表达显著更高,而与缺乏这些元件的puc相比,pucte和pucene的使用均导致降低的或最多相等的cd70表达水平(图1)。因此,两种元件(te和ene)在载体中的存在似乎在用由pucteene质粒编码的trimix电穿孔后增加cd70表达方面具有意料不到的协同作用。
实施例2
具体材料和方法:
如在上文的一般材料和方法部分中所述,进行idc产生和电穿孔。分别用20μg编码wt1的mrna电穿孔idc,以使抗原加载。为了分析细胞内wt1的表达,将细胞固定和透化,并用抗wt1单克隆抗体(克隆6f-h2;dakocytomation,carpinteria,ca)细胞内染色。将igg同种型匹配的pe标记的抗小鼠抗体(becton&dickinson,erembodegem,belgium)用作第二抗体。非反应性同种型匹配的抗体(ebioscience,vienna,austria)用作对照。在facsfortessa流式细胞仪(bd)上进行数据采集,并使用facsdiva软件进行分析。
结果:
这些结果表明,与其它wt1mrna编码载体相比,在用由pucteene载体编码的wt1电穿孔idc后,观察到更持久的wt1表达(图2)。这些数据很好地显示了5’te和3’ene区段的不同作用方式。虽然puc-te载体mrna的表达在4小时后较高,但它很快下降。在整个周期中,来自含有ene的rna的翻译比所有其它的翻译更低。pucteene-载体具有te的高可翻译性和ene序列的长久效应。wt1的表达水平以比在其它载体中显著更慢的速率减少。
实施例3
具体的材料和方法:
如在上文的一般材料和方法部分中所述,进行idc产生和电穿孔。用5μg编码egfp的mrna和trimix(每种成分5μg)共电穿孔idc,以使dc抗原加载和成熟。在几个时间点通过流式细胞仪评估egfp的表达。
结果:
在电穿孔后的几个时间点监测egfp的表达(图3)。这些结果显示,在电穿孔后4小时,来自两种载体的egfp的表达水平是可比较的。然而,在较晚的时间点,来自pucteene来源的mrna的表达明显显著更高。这再次指出了转基因的更稳定和长久的表达。
实施例4
具体材料和方法:
如在上文的一般材料和方法部分中所述,进行idc产生和电穿孔。用5μg的trimix各成分电穿孔idc,以使dc成熟。所有流式细胞染色在pbs/bsa/叠氮化物中进行。为了分析dc的细胞表面上的表面分子的表达,使用以下的单克隆抗体:cd40-apc(别藻蓝蛋白),cd70-fitc,cd80-pe,cd83-pe(藻红蛋白),cd86-pe和ccr7-apc。在facsfortessa流式细胞仪(bd)上进行数据采集,并使用facsdiva软件进行分析。
结果:
使用由pucteene载体编码的trimixmrna的电穿孔idc能够诱导dc的成熟(图4)。
实施例5:p815的双侧肿瘤模型:单独治疗一个肿瘤
具体的材料和方法:
为了生长可触知的肿瘤,用5×105个p815肿瘤细胞两胁皮下注射小鼠。当两个肿瘤达到约100mm3的可注射体积时开始治疗。通过使用其中仅一个肿瘤被治疗的双侧肿瘤模型,我们旨在评估疫苗接种策略的全身效应。因此,只有左侧肿瘤用溶解在0.8×哈特曼溶液中的对照mrna或pucteenetrimixmrna(10μg的各mrna组分)注射。通过测量处理的和未处理的对侧肿瘤的大小和通过存活率评估全身抗肿瘤免疫应答。
结果:
通过使用双侧肿瘤模型,我们可以评估免疫接种策略的全身效应。pucteenetrimixmrna的单瘤内递送导致处理的和未处理的对侧肿瘤的肿瘤生长显著降低(图5)。疫苗接种对远处肿瘤的效果可以是单瘤内trimix注射可用于治疗多种肿瘤病变的指示。
实施例6:p815的双侧肿瘤模型:单独治疗一个肿瘤,哈特曼溶液案和tngfr作为对照
具体的材料和方法:
为了生长可触知的肿瘤,用5×105个p815肿瘤细胞两胁皮下注射小鼠。当两个肿瘤达到约100mm3的可注射体积时开始治疗。通过使用其中仅一个肿瘤被治疗的双侧肿瘤模型,我们旨在评估疫苗接种策略的全身效应。因此,只有左侧肿瘤用溶解在0.8×哈特曼溶液中的对照mrna或pucteenetrimixmrna(10μg的各mrna组分)注射,所有均为50μl/注射瘤的总体积。通过测量处理的和未处理的对侧肿瘤的大小和通过存活率评估全身抗肿瘤免疫应答。
结果:
通过使用双侧肿瘤模型,我们可以评估免疫接种策略的全身效应。
本实验证实了之前的观察,即
1.pucteenetrimixmrna的单瘤内递送导致处理的和未处理的对侧肿瘤的肿瘤生长显著降低。
2.pucteenetrimixmrna的单瘤内递送导致荷瘤小鼠的存活延长。
3.疫苗接种对所治疗肿瘤的效果更加显著。
另外,通过利用使用媒介物处理肿瘤的组,我们可以显示mrna本身的佐剂效应。
实施例7:不同te序列的比较
具体材料及方法:
关于此处的具体测定方法的细节可以在如上所述的实施例2和3中找到。
结果:使用wt1或egfp对idc的电穿孔
使用由包含seqidn°1、seqidn°2或seqidn°3表示的te元件的pucteene载体编码的wt1(图9a)或egfp(图9b)分别电穿孔idc不导致wt1或egfp表达的显著差异。
这些数据清楚地表明,与seqidn°1具有至少80%的序列同一性的序列,诸如例如seqidn°1、seqidn°2或seqidn°3,可以互换地用作根据本发明的载体中的翻译增强子元件。
参考文献
bonehilla,tuyaertss,vannuffelam,heirmanc,bostj,fostierk,neynsb,thielemansk-enhancingthet-cellstimulatorycapacityofhumandendriticcellsbyco-electroporationwithcd40l,cd70andconstitutivelyactivetlr4encodingmrna.-molther.2008jun;16(6):1170-80.
conradnk,steitzja-akaposi'ssarcomavirusrnaelementthatincreasesthenuclearabundanceofintronlesstranscripts.-emboj.2005may18;24(10):1831-41.
conradnk,milis,marshallel,shumd,steitzja-identificationofarapidmammaliandeadenylation-dependentdecaypathwayanditsinhibitionbyaviralrnaelement.molcell.2006;24:943–953.
dikenm,kreiters,selmia,brittencm,huberc,türeci
fotin-mleczekm,duchardtkm,lorenzc,pfeifferr,
humc,tranquep,edelmangm,maurovp.-rrna-complementarityinthe5'untranslatedregionofmrnaspecifyingthegtxhomeodomainprotein:evidencethatbase-pairingto18srrnaaffectstranslationalefficiency.-procnatlacadsciusa.1999feb16;96(4):1339-44.
mitton-fryrm,degregoriosj,wangj,steitzta,steitzja.-poly(a)tailrecognitionbyaviralrnaelementthroughassemblyofatriplehelix.-science.2010;330:1244–1247.
sunr,linsf,gradovillel,millerg.-polyadenylylatednuclearrnaencodedbykaposisarcoma-associatedherpesvirus.-procnatlacadsciusa.1996;93:11883–11888.
vanlintsandra,goyvaertscleo,maenhoutsarah,等人-preclinicalevaluationoftrimixandantigenmrna-basedantitumortherapy-cancerres2012;72:1661-1671.
序列表
<110>vrije布鲁塞尔大学
<120>rna转录载体及其用途
<130>etr-003
<150>epep13192555.4
<151>2013-11-12
<160>5
<170>bissap1.2
<210>1
<211>204
<212>dna
<213>人工序列
<220>
<221>来源
<222>1..204
<223>/organism="人工序列"
/note="翻译增强子"
/mol_type="未指定的dna"
<400>1
ggccggcgggtttctgacatccggcgggtttctgacatccggcgggtttctgacatccgg60
cgggtttctgacatccggcgggtgaattcttctgacatccggcgggtttctgacatccgg120
cgggtttctgacatccggcgggtttctgacatccggcgggtttctgacatccggcgggtg180
actcacaaccaggcctccacaacc204
<210>2
<211>238
<212>dna
<213>人工序列
<220>
<221>来源
<222>1..238
<223>/organism="人工序列"
/note="翻译增强子"
/mol_type="未指定的dna"
<400>2
aagctttaatacgactcactatagggccggcgggtttctgacatccggcgggtttctgac60
atccggcgggtttctgacatccggcgggtttctgacatccggcgggtttctgacatccgg120
cgggtttctgacatccggcgggtttctgacatccggcgggtttctgacatccggcgggtt180
tctgacatccggcgggtttctgacattcacaaccaggcctccacaaccatggctcgag238
<210>3
<211>238
<212>dna
<213>人工序列
<220>
<221>来源
<222>1..238
<223>/organism="人工序列"
/note="翻译增强子"
/mol_type="未指定的dna"
<400>3
aagctttaatacgactcactatagggccggcggaattctgacatccggcggaattctgac60
atccggcggaattctgacatccggcggaattctgacatccggcggaattctgacatccgg120
cggaattctgacatccggcggaattctgacatccggcggaattctgacatccggcggaat180
tctgacatccggcggaattctgacattcacaaccaggcctccacaaccatggctcgag238
<210>4
<211>85
<212>dna
<213>人工序列
<220>
<221>来源
<222>1..85
<223>/organism="人工序列"
/note="核保留元件"
/mol_type="未指定的dna"
<400>4
tcgagtgttttggctgggtttttccttgttcgcaccggacacctccagtgaccagacggc60
aaggtttttatcccagtgtatattg85
<210>5
<211>3102
<212>dna
<213>人工序列
<220>
<221>来源
<222>1..3102
<223>/organism="人工序列"
/note="空pucteene载体"
/mol_type="未指定的dna"
<400>5
taatacgactcactatagggccggcgggtttctgacatccggcgggtttctgacatccgg60
cgggtttctgacatccggcgggtttctgacatccggcgggtttctgacatccggcgggtt120
tctgacatccggcgggtttctgacatccggcgggtttctgacatccggcgggtttctgac180
atccggcgggtttctgacattcacaaccaggcctccacaaccctcgagtgttttggctgg240
gtttttccttgttcgcaccggacacctccagtgaccagacggcaaggtttttatcccagt300
gtatattgtcgacaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaa360
aaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaa420
aaaaaaaaaaaaaaaaagcaggtgtgtctctctccacctgcgaattcactggccgtcgtt480
ttacaacgtcgtgactgggaaaaccctggcgttacccaacttaatcgccttgcagcacat540
ccccctttcgccagctggcgtaatagcgaagaggcccgcaccgatcgcccttcccaacag600
ttgcgcagcctgaatggcgaatggcgcctgatgcggtattttctccttacgcatctgtgc660
ggtatttcacaccgcatatggtgcactctcagtacaatctgctctgatgccgcatagtta720
agccagccccgacacccgccaacacccgctgacgcgccctgacgggcttgtctgctcccg780
gcatccgcttacagacaagctgtgaccgtctccgggagctgcatgtgtcagaggttttca840
ccgtcatcaccgaaacgcgcgagacgaaagggcctcgtgatacgcctatttttataggtt900
aatgtcatgataataatggtttcttagacgtcaggtggcacttttcggggaaatgtgcgc960
ggaacccctatttgtttatttttctaaatacattcaaatatgtatccgctcatgagacaa1020
taaccctgataaatgcttcaataatattgaaaaaggaagagtatgagtattcaacatttc1080
cgtgtcgcccttattcccttttttgcggcattttgccttcctgtttttgctcacccagaa1140
acgctggtgaaagtaaaagatgctgaagatcagttgggtgcacgagtgggttacatcgaa1200
ctggatctcaacagcggtaagatccttgagagttttcgccccgaagaacgttttccaatg1260
atgagcacttttaaagttctgctatgtggcgcggtattatcccgtattgacgccgggcaa1320
gagcaactcggtcgccgcatacactattctcagaatgacttggttgagtactcaccagtc1380
acagaaaagcatcttacggatggcatgacagtaagagaattatgcagtgctgccataacc1440
atgagtgataacactgcggccaacttacttctgacaacgatcggaggaccgaaggagcta1500
accgcttttttgcacaacatgggggatcatgtaactcgccttgatcgttgggaaccggag1560
ctgaatgaagccataccaaacgacgagcgtgacaccacgatgcctgtagcaatggcaaca1620
acgttgcgcaaactattaactggcgaactacttactctagcttcccggcaacaattaata1680
gactggatggaggcggataaagttgcaggaccacttctgcgctcggcccttccggctggc1740
tggtttattgctgataaatctggagccggtgagcgtgggtctcgcggtatcattgcagca1800
ctggggccagatggtaagccctcccgtatcgtagttatctacacgacggggagtcaggca1860
actatggatgaacgaaatagacagatcgctgagataggtgcctcactgattaagcattgg1920
taactgtcagaccaagtttactcatatatactttagattgatttaaaacttcatttttaa1980
tttaaaaggatctaggtgaagatcctttttgataatctcatgaccaaaatcccttaacgt2040
gagttttcgttccactgagcgtcagaccccgtagaaaagatcaaaggatcttcttgagat2100
cctttttttctgcgcgtaatctgctgcttgcaaacaaaaaaaccaccgctaccagcggtg2160
gtttgtttgccggatcaagagctaccaactctttttccgaaggtaactggcttcagcaga2220
gcgcagataccaaatactgttcttctagtgtagccgtagttaggccaccacttcaagaac2280
tctgtagcaccgcctacatacctcgctctgctaatcctgttaccagtggctgctgccagt2340
ggcgataagtcgtgtcttaccgggttggactcaagacgatagttaccggataaggcgcag2400
cggtcgggctgaacggggggttcgtgcacacagcccagcttggagcgaacgacctacacc2460
gaactgagatacctacagcgtgagctatgagaaagcgccacgcttcccgaagggagaaag2520
gcggacaggtatccggtaagcggcagggtcggaacaggagagcgcacgagggagcttcca2580
gggggaaacgcctggtatctttatagtcctgtcgggtttcgccacctctgacttgagcgt2640
cgatttttgtgatgctcgtcaggggggcggagcctatggaaaaacgccagcaacgcggcc2700
tttttacggttcctggccttttgctggccttttgctcacatgttctttcctgcgttatcc2760
cctgattctgtggataaccgtattaccgcctttgagtgagctgataccgctcgccgcagc2820
cgaacgaccgagcgcagcgagtcagtgagcgaggaagcggaagagcgcccaatacgcaaa2880
ccgcctctccccgcgcgttggccgattcattaatgcagctggcacgacaggtttcccgac2940
tggaaagcgggcagtgagcgcaacgcaattaatgtgagttagctcactcattaggcaccc3000
caggctttacactttatgcttccggctcgtatgttgtgtggaattgtgagcggataacaa3060
tttcacacaggaaacagctatgaccatgattacgccaagctt3102
- 还没有人留言评论。精彩留言会获得点赞!