16,17-双羟基甾体化合物的制备方法和应用与流程
1.本发明涉及化学合成技术领域,尤其是涉及一种16,17-双羟基甾体化合物的制备方法和应用。
背景技术:
2.甾体激素类药物(steroid hormone drugs),是指分子结构中含有甾体结构的激素类药物,临床应用较广,主要包括肾上腺皮质激素和性激素两大类。其中肾上腺皮质激素具有抗炎、抗过敏、抑制免疫、增强应激反应、抗内毒素和抗休克等多种药理作用,临床上可用于治疗许多病症,是临床上不可缺少的一类重要药物,例如氟轻松和奈德皮质激素类药物。性激素包括孕激素、雌激素和雄激素,例如苯甲孕酮孕酮是高效孕激素,在临床上主要用于短效避孕和长效避孕。
3.具有16,17-双羟基结构的甾体化合物是一个重要的中间体,可用来制备醋酸氟轻松、氟轻松、奈德类药物以及苯甲孕酮等。目前报道的制备该类化合物的方法主要是使用含17位羟基的底物经脱水,氧化反应制得。现有技术中一般先将含17位羟基的底物在醋酸盐作用下或在三氯氧磷作用下或在酸性离子液体作用下或在双子表面活性剂作用下脱水,得到具有16,17位双键的脱水产物。脱水产物在高锰酸钾作用下或在双氧水作用下或在锇类催化剂作用下氧化上双羟基,得到16,17-双羟基甾体化合物。现有的脱水反应中醋酸盐、酸性离子液体或双子表面活性剂均需要在较高温度(100℃以上)下反应,对于工业化生产能源成本较高;而三氯氧磷操作不当可能会引起中毒。氧化反应中高锰酸钾在氧化16,17位双键的同时,会导致分子中11位羟基也被氧化,造成杂质多,难纯化;双氧水氧化不易于实现和重复;而锇类催化剂会使用重金属,应用前景较差。
4.有鉴于此,特提出本发明。
技术实现要素:
5.本发明的主要目的在于提供一种16,17-双羟基甾体化合物的制备方法和应用,以期至少部分地解决上述技术问题中的至少之一。
6.作为本发明的第一个方面,本发明提供了一种16,17-双羟基甾体化合物的制备方法,包括如下步骤:
7.(b)式ii化合物、环状酰基过氧化物和水反应,然后在碱性条件下水解,得到式iii化合物;反应式如下:
[0008][0009]
其中,式ii化合物和式iii化合物结构式中所示的r1、r2、r3和r4彼此独立地选择,且:
[0010]
r1=h、甲基或卤素,卤素=f、cl、br或i;
[0011]
r2=h或卤素,卤素=f、cl、br或i;
[0012]
r3=h或羟基;
[0013]
r4=h、oh或ocor5,r5为六个碳以内的烷基;
[0014]
虚线为单键或双键。
[0015]
本发明提供的16,17-双羟基甾体化合物的制备方法,式ii化合物、环状酰基过氧化物和水反应,然后在碱性条件下水解,得到式iii化合物。本发明将环状酰基过氧化物用于式ii化合物的氧化反应中,相对于现有技术中的高锰酸钾、双氧水或锇类催化剂,原子经济性好,副反应少,产品中不会带入过多杂质,易于实现和重复,没有重金属参与,绿色环保,更为安全,应用前景好。
[0016]
进一步的,式ii化合物和式iii化合物结构式中所示的r1、r2、r3和r4彼此独立地选择,且:
[0017]
r1=h或f;
[0018]
r2=h或f;
[0019]
r3=h或羟基;
[0020]
r4=h、oh或ococh3;
[0021]
虚线为单键或双键。
[0022]
进一步的,包括如下步骤:
[0023]
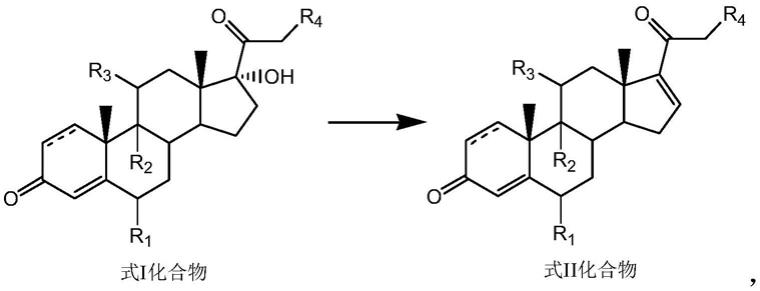
(b)将式ii化合物、环状酰基过氧化物、水和相转移催化剂加入第二有机溶剂中反应,然后在碱性条件下水解,得到式iii化合物。
[0024]
进一步的,包括如下步骤:
[0025]
(b)将式ii化合物、环状酰基过氧化物、水和相转移催化剂加入第二有机溶剂中,在0-30℃反应,然后在0-60℃碱性条件下水解,得到式iii化合物。
[0026]
在本发明中,所述步骤(b)中,反应的典型但非限制性的温度例如可以为0℃、1℃、2℃、3℃、4℃、5℃、6℃、7℃、8℃、9℃、10℃、11℃、12℃、13℃、14℃、15℃、16℃、17℃、18℃、19℃、20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃或30℃。
[0027]
在本发明中,所述步骤(b)中,水解的典型但非限制性的温度例如可以为0℃、2℃、4℃、6℃、8℃、10℃、12℃、14℃、16℃、18℃、20℃、22℃、24℃、26℃、28℃、30℃、32℃、34℃、36℃、38℃、40℃、42℃、44℃、46℃、48℃、50℃、52℃、54℃、56℃、58℃或60℃。
[0028]
进一步的,包括如下步骤:
[0029]
(b)将式ii化合物、环状酰基过氧化物、水和相转移催化剂加入第二有机溶剂中,在0-10℃反应,然后在40-60℃碱性条件下水解,得到式iii化合物。
[0030]
进一步的,所述步骤(b)中,所述环状酰基过氧化物选自5,6-二氧杂螺[2.4]庚烷-4,7-二酮、6,7-二氧杂螺[3.4]辛烷-5,8-二酮、2,3-二氧杂螺[4.4]壬烷-1,4-二酮或(1s,4r)-螺[双环[2.2.1]庚烷-2,4'-[1,2]二氧戊环]-3',5'-二酮中的一种或几种的组合。
[0031]
进一步的,所述步骤(b)中,所述环状酰基过氧化物选自5,6-二氧杂螺[2.4]庚烷-4,7-二酮和/或6,7-二氧杂螺[3.4]辛烷-5,8-二酮。
[0032]
进一步的,所述步骤(b)中,所述相转移催化剂选自四甲基溴化铵、四丙基氯化铵、四丁基溴化铵、四丁基碘化铵、三乙基苄基溴化铵或三乙基己基溴化铵中的一种或几种的组合。
[0033]
本发明中的式ii化合物和环状酰基过氧化物均能够溶于第二有机溶剂中,而水不溶于第二有机溶剂中,本发明采用相转移催化剂可促使水在第二有机溶剂中与式ii化合物和环状酰基过氧化物充分接触,提高反应速率。
[0034]
进一步的,所述步骤(b)中,所述水解采用碱试剂,所述碱试剂选自氢氧化钠、氢氧化钾、碳酸氢钠、碳酸氢钾、碳酸钠或碳酸钾中的一种或几种的组合。
[0035]
进一步的,所述步骤(b)中,所述环状酰基过氧化物、水和式ii化合物的摩尔比为(1.1-1.5):(1.1-1.5):1。
[0036]
在本发明中,所述步骤(b)中,环状酰基过氧化物、水和式ii化合物的典型但非限制性的摩尔比例如可以为1.1:1.1:1、1.1:1.2:1、1.1:1.3:1、1.1:1.4:1、1.1:1.5:1、1.2:1.1:1、1.2:1.2:1、1.2:1.3:1、1.2:1.4:1、1.2:1.5:1、1.3:1.1:1、1.3:1.2:1、1.3:1.3:1、1.3:1.4:1、1.3:1.5:1、1.4:1.1:1、1.4:1.2:1、1.4:1.3:1、1.4:1.4:1、1.4:1.5:1、1.5:1.1:1、1.5:1.2:1、1.5:1.3:1、1.5:1.4:1或1.5:1.5:1。
[0037]
进一步的,所述步骤(b)中,所述第二有机溶剂选自氯仿、甲苯、2-甲基四氢呋喃或二氯甲烷中一种或几种的组合。
[0038]
进一步的,还包括如下步骤:
[0039]
(a)式i化合物、路易斯酸和氮唑类化合物反应,得到式ii化合物;
[0040][0041]
其中,式i化合物和式ii化合物结构式中所示的r1、r2、r3和r4彼此独立地选择,且:
[0042]
r1=h、甲基或卤素,卤素=f、cl、br或i;
[0043]
r2=h或卤素,卤素=f、cl、br或i;
[0044]
r3=h或羟基;
[0045]
r4=h、oh或ocor5,r5为六个碳以内的烷基;
[0046]
虚线为单键或双键。
[0047]
进一步的,式i化合物和式ii化合物结构式中所示的r1、r2、r3和r4彼此独立地选择,且:
[0048]
r1=h或f;
[0049]
r2=h或f;
[0050]
r3=h或羟基;
[0051]
r4=h、oh或ococh3;
[0052]
虚线为单键或双键。
[0053]
本发明以式i化合物为起始原料,在路易斯酸和氮唑类化合物作用下反应,得到式ii化合物。本发明将路易斯酸和氮唑类化合物用于式i化合物的脱水反应中,相对于现有技术中的醋酸盐或三氯氧磷或酸性离子液体或双子表面活性剂,操作简单,反应条件温和,能源成本低,安全系数高。
[0054]
进一步的,包括如下步骤:
[0055]
(a)将式i化合物、路易斯酸和氮唑类化合物加入第一有机溶剂中,在0-80℃反应,得到式ii化合物。
[0056]
在本发明中,所述步骤(a)中,反应的典型但非限制性的温度例如可以为0℃、2℃、4℃、6℃、8℃、10℃、12℃、14℃、16℃、18℃、20℃、22℃、24℃、26℃、28℃、30℃、32℃、34℃、36℃、38℃、40℃、42℃、44℃、46℃、48℃、50℃、52℃、54℃、56℃、58℃、60℃、62℃、64℃、66℃、68℃、70℃、72℃、74℃、76℃、78℃或80℃。
[0057]
进一步的,包括如下步骤:
[0058]
(a)将式i化合物、路易斯酸和氮唑类化合物加入第一有机溶剂中,在30-60℃反应,得到式ii化合物。
[0059]
进一步的,所述步骤(a)中,所述氮唑类化合物选自1-(吡啶-2-基)-1h-苯并[d][1,2,3]三唑、1,2,3-苯并三氮唑、1,2,4-三氮唑、1,2,3-三氮唑、1-甲基苯并三唑、1-(1h-苯并[d][1,2,3]三唑-1-基)-n,n-二甲基甲胺、2-(1h-四唑-1-基)吡啶、1-(4-氨基苄基)咪唑、4-氮杂苯并咪唑、(5-氨基-1h-[1,2,4]噻唑-3-基)-甲醇或2-(1h-苯并[d][1,2,3]三唑-1-基)乙-1-醇中的一种或几种的组合。
[0060]
进一步的,所述步骤(a)中,所述氮唑类化合物选自所述氮唑类化合物选自1-(吡啶-2-基)-1h-苯并[d][1,2,3]三唑、1,2,3-苯并三氮唑、1-甲基苯并三唑、1-(1h-苯并[d][1,2,3]三唑-1-基)-n,n-二甲基甲胺、2-(1h-四唑-1-基)吡啶、1-(4-氨基苄基)咪唑中的一种或几种的组合。
[0061]
进一步的,所述步骤(a)中,所述氮唑类化合物选自1,2,3-苯并三氮唑。
[0062]
进一步的,所述步骤(a)中,所述路易斯酸选自氯化铝、氯化铁、溴化铁、三乙酰丙酮铁、氯化亚铁、氯化钴、氯化镍、醋酸铁、氯化锌或氯化铜中的一种或几种的组合。
[0063]
进一步的,所述步骤(a)中,所述路易斯酸选自氯化铝。
[0064]
进一步的,所述步骤(a)中,所述氮唑类化合物、路易斯酸和式i化合物的摩尔比为(0.3-0.8):(0.1-0.5):1。
[0065]
在本发明中,所述步骤(a)中,氮唑类化合物、路易斯酸和式i化合物的典型但非限
制性的摩尔比例如可以为0.3:0.1:1、0.3:0.2:1、0.3:0.3:1、0.3:0.4:1、0.4:0.5:1、0.4:0.1:1、0.4:0.2:1、0.4:0.3:1、0.4:0.4:1、0.4:0.5:1、0.5:0.1:1、0.5:0.2:1、0.5:0.3:1、0.5:0.4:1、0.5:0.5:1、0.6:0.1:1、0.6:0.2:1、0.6:0.3:1、0.6:0.4:1、0.6:0.5:1、0.7:0.1:1、0.7:0.2:1、0.7:0.3:1、0.7:0.4:1、0.7:0.5:1、0.8:0.1:1、0.8:0.2:1、0.8:0.3:1、0.8:0.4:1或0.8:0.5:1。
[0066]
进一步的,所述步骤(a)中,所述第一有机溶剂选自c1-c4的醇类溶剂、二氯甲烷、丙酮、四氢呋喃、甲苯、氯仿或乙腈中的一种或几种的组合。
[0067]
进一步的,所述步骤(a)中,所述c1-c4的醇类溶剂选自甲醇、乙醇、异丙醇或正丁醇。
[0068]
作为本发明的第二个方面,本发明还提供了上述制备方法在制备皮质激素类药物中的应用。
[0069]
进一步的,所述皮质激素类药物选自曲安奈德、布地奈德、环索奈德、氟轻松、醋酸氟轻松或苯甲孕酮。
[0070]
本发明中可用于制备的皮质激素类药物包括但不限于上述药物。
[0071]
与现有技术相比,本发明具有以下有益效果:
[0072]
(1)本发明提供的16,17-双羟基甾体化合物的制备方法,以式i化合物为起始原料,在路易斯酸和氮唑类化合物作用下反应,得到式ii化合物;式ii化合物、环状酰基过氧化物和水反应,然后在碱性条件下水解,得到式iii化合物。本发明将路易斯酸和氮唑类化合物用于式i化合物的脱水反应中,相对于现有技术中的醋酸盐或三氯氧磷或酸性离子液体或双子表面活性剂,操作简单,反应条件温和,能源成本低,安全系数高。本发明将环状酰基过氧化物用于式ii化合物的氧化反应中,相对于现有技术中的高锰酸钾、双氧水或锇类催化剂,原子经济性好,副反应少,产品中不会带入过多杂质,易于实现和重复,没有重金属参与,绿色环保,更为安全,应用前景好。
[0073]
(2)本发明将上述制备方法用于制备皮质激素类药物,可大大缩短反应步骤,节约生产成本,有利于工业化生产。
具体实施方式
[0074]
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0075]
为了有助于更清楚的理解本发明,下面将结合实施例对本发明的技术方案进行进一步地说明。
[0076]
式ii化合物的制备
[0077]
实施例1
[0078][0079]
实施例1-1
[0080]
室温下在反应瓶中依次加入1.1g氯化铝、1.7g 1,2,3-苯并三氮唑、10g式i-1化合物和200ml二氯甲烷,在40℃保温反应,tlc至无式i-1化合物,过滤除去不溶物,减压浓缩有机溶剂,用丙酮精制,得式ii-1化合物8.3g,收率为86.6%,hplc纯度为97.8%。
[0081]
实施例1-2
[0082]
室温下在反应瓶中依次加入2.0g三乙酰丙酮铁、2.2g1-(吡啶-2-基)-1h-苯并[d][1,2,3]三唑、10g式i-1化合物和300ml丙酮,在30℃保温反应,tlc至无式i-1化合物,过滤除去不溶物,减压浓缩有机溶剂,用丙酮精制,得式ii-1化合物8.2g,收率为85.5%,hplc纯度为97.5%。
[0083]
实施例1-3
[0084]
室温下在反应瓶中依次加入1.8g氯化铁、2.2g 1-甲基苯并三唑、10g式i-1化合物和100ml乙醇,在60℃保温反应,tlc至无式i-1化合物,过滤除去不溶物,减压浓缩有机溶剂,用丙酮精制,得式ii-1化合物8.1g,收率为84.5%,hplc纯度为97.5%。
[0085]
实施例1-4
[0086]
室温下在反应瓶中依次加入0.4g氯化锌、1.5g 1-(1h-苯并[d][1,2,3]三唑-1-基)-n,n-二甲基甲胺、10g式i-1化合物和150ml四氢呋喃,在0℃保温反应,tlc至无式i-1化合物,过滤除去不溶物,减压浓缩有机溶剂,用丙酮精制,得式ii-1化合物7.5g,收率为78.2%,hplc纯度为97.1%。
[0087]
实施例1-5
[0088]
室温下在反应瓶中依次加入1.9g氯化铜、1.6g 2-(1h-四唑-1-基)吡啶、1.9g1-(4-氨基苄基)咪唑、10g式i-1化合物和甲苯250ml,在80℃保温反应,tlc至无式i-1化合物,过滤除去不溶物,减压浓缩有机溶剂,用丙酮精制,得式ii-1化合物7.8g,收率为81.4%,hplc纯度为97.3%。
[0089]
实施例1-6
[0090]
本实施例与实施例1-1的区别在于,将1.1g氯化铝替换为1.1g氯化锌,其余条件均相同,经后处理,得ii-1化合物8.1g,收率为84.5%,hplc纯度为97.7%。
[0091]
实施例1-7
[0092]
本实施例与实施例1-1的区别在于,将1.1g氯化铝替换为4.5g氯化铁,其余条件均相同,经后处理,得ii-1化合物7.9g,收率为82.4%,hplc纯度为96.9%。
[0093]
实施例1-8
[0094]
本实施例与实施例1-1的区别在于,将1.1g氯化铝替换为1.1g氯化亚铁,其余条件均相同,经后处理,得ii-1化合物7.8g,收率为81.4%,hplc纯度为96.8%。
[0095]
实施例1-9
[0096]
本实施例与实施例1-1的区别在于,将1.1g氯化铝替换为0.1g氯化钴0.4g和0.7g氯化镍,其余条件均相同,经后处理,得ii-1化合物7.9g,收率为82.4%,hplc纯度为97.0%。
[0097]
实施例1-10
[0098]
本实施例与实施例1-1的区别在于,将反应温度40℃替换为0℃,其余条件均相同,经后处理,得ii-1化合物7.6g,收率为79.3%,hplc纯度为97.3%。
[0099]
实施例1-11
[0100]
本实施例与实施例1-1的区别在于,将反应温度40℃替换为80℃,其余条件均相同,经后处理,得ii-1化合物7.8g,收率为81.4%,hplc纯度为97.0%。
[0101]
实施例1-12
[0102]
本实施例与实施例1-1的区别在于,将反应温度40℃替换为30℃,其余条件均相同,经后处理,得ii-1化合物8.2g,收率为85.5%,hplc纯度为97.7%。
[0103]
实施例1-13
[0104]
本实施例与实施例1-1的区别在于,将反应温度40℃替换为60℃,其余条件均相同,经后处理,得ii-1化合物8.3g,收率为86.6%,hplc纯度为97.6%。
[0105]
实施例2
[0106][0107]
实施例2-1
[0108]
室温下在反应瓶中依次加入1.4g醋酸铁、1.5g 1,2,3-苯并三氮唑、10g式i-2化合物和200ml氯仿,在40℃保温反应,tlc至无式i-2化合物,过滤除去不溶物,减压浓缩有机溶剂,用丙酮精制,得式ii-2化合物8.2g,收率为85.3%,hplc纯度为97.9%。
[0109]
实施例2-2
[0110]
室温下在反应瓶中依次加入0.6g氯化亚铁、1.2g 4-氮杂苯并咪唑、10g式i-2化合物和300ml甲醇,在30℃保温反应,tlc至无式i-2化合物,过滤除去不溶物,减压浓缩有机溶剂,用丙酮精制,得式ii-2化合物7.9g,收率为82.2%,hplc纯度为97.7%。
[0111]
实施例2-3
[0112]
室温下在反应瓶中依次加入1.3g氯化钴、1.7g(5-氨基-1h-[1,2,4]噻唑-3-基)-甲醇、10g式i-2化合物和100ml异丙醇,在60℃保温反应,tlc至无式i-2化合物,过滤除去不溶物,减压浓缩有机溶剂,用丙酮精制,得式ii-2化合物7.9g,收率为82.2%,hplc纯度为97.7%。
[0113]
实施例2-4
[0114]
室温下在反应瓶中依次加入0.3g氯化镍、1.2g 2-(1h-苯并[d][1,2,3]三唑-1-基)乙-1-醇、10g式i-2化合物和150ml乙腈,在0℃保温反应,tlc至无式i-2化合物,过滤除
去不溶物,减压浓缩有机溶剂,用丙酮精制,得式ii-2化合物7.6g,收率为79.1%,hplc纯度为97.1%。
[0115]
实施例2-5
[0116]
室温下在反应瓶中依次加入2.7g溴化铁、3.5g 1-(4-氨基苄基)咪唑、10g式i-2化合物和250ml正丁醇,在80℃保温反应,tlc至无式i-2化合物,过滤除去不溶物,减压浓缩有机溶剂,用丙酮精制,得式ii-2化合物7.7g,收率为80.1%,hplc纯度为97.5%。
[0117]
实施例2-6
[0118]
本实施例与实施例2-1的区别在于,将1.5g 1,2,3-苯并三氮唑替换为2.5g1-(吡啶-2-基)-1h-苯并[d][1,2,3]三唑,其余条件均相同,经后处理,得ii-2化合物8.0g,收率为83.2%,hplc纯度为98.0%。
[0119]
实施例2-7
[0120]
本实施例与实施例2-1的区别在于,将1.5g 1,2,3-苯并三氮唑替换为1.7g 1-甲基苯并三唑,其余条件均相同,经后处理,得ii-2化合物8.1g,收率为84.3%,hplc纯度为97.9%。
[0121]
实施例2-8
[0122]
本实施例与实施例2-1的区别在于,将1.5g 1,2,3-苯并三氮唑替换为2.2g 1-(1h-苯并[d][1,2,3]三唑-1-基)-n,n-二甲基甲胺,其余条件均相同,经后处理,得ii-2化合物8.0g,收率为83.2%,hplc纯度为97.6%。
[0123]
实施例2-9
[0124]
本实施例与实施例2-1的区别在于,将1.5g 1,2,3-苯并三氮唑替换为1.3g 2-(1h-四唑-1-基)吡啶0.7g/1-(4-氨基苄基)咪唑,其余条件均相同,经后处理,得ii-2化合物8.0g,收率为83.2%,hplc纯度为97.8%。
[0125]
实施例2-10
[0126]
本实施例与实施例2-1的区别在于,将1.5g 1,2,3-苯并三氮唑替换为0.6g 4-氮杂苯并咪唑和0.9g(5-氨基-1h-[1,2,4]噻唑-3-基)-甲醇,其余条件均相同,经后处理,得ii-2化合物7.7g,收率为80.1%,hplc纯度为96.3%。
[0127]
实施例2-11
[0128]
本实施例与实施例2-1的区别在于,将1.5g 1,2,3-苯并三氮唑替换为2.0g 2-(1h-苯并[d][1,2,3]三唑-1-基)乙-1-醇,其余条件均相同,经后处理,得ii-2化合物7.6g,收率为79.7%,hplc纯度为96.1%。
[0129]
实施例2-12
[0130]
本实施例与实施例2-1的区别在于,将1.5g 1,2,3-苯并三氮唑替换为0.7g1,2,4-三氮唑和1.0g1,2,3-三氮唑,其余条件均相同,经后处理,得ii-2化合物7.6g,收率为79.7%,hplc纯度为96.3%。
[0131]
实施例3
[0132][0133]
实施例3-1
[0134]
室温下在反应瓶中依次加入1.2g氯化铝、1.8g 1,2,3-苯并三氮唑、10g式i-3化合物和200ml二氯甲烷,在40℃保温反应,tlc至无式i-3化合物,过滤除去不溶物,减压浓缩有机溶剂,用丙酮精制,得式ii-3化合物8.1g,收率为86.4%,hplc纯度为97.8%。
[0135]
实施例3-2
[0136]
室温下在反应瓶中依次加入1.1g三乙酰丙酮铁、0.6g 1,2,4-三氮唑、10g式i-3化合物和300ml丙酮,在0℃保温反应,tlc至无式i-3化合物,过滤除去不溶物,减压浓缩有机溶剂,用丙酮精制,得式ii-3化合物7.2g,收率为76.8%,hplc纯度为97.3%。
[0137]
实施例3-3
[0138]
室温下在反应瓶中依次加入2.4g氯化铁、1.7g 1,2,3-三氮唑、10g式i-3化合物和100ml甲苯,在80℃保温反应,tlc至无式i-3化合物,过滤除去不溶物,减压浓缩有机溶剂,用丙酮精制,得式ii-3化合物7.4g,收率为78.9%,hplc纯度为97.2%。
[0139]
实施例4
[0140][0141]
实施例4-1
[0142]
室温下在反应瓶中依次加入1.0g氯化铝、1.4g1,2,3-苯并三氮唑、10g式i-4化合物和200ml氯仿,在40℃保温反应,tlc至无式i-4化合物,过滤除去不溶物,减压浓缩有机溶剂,用丙酮精制,得式ii-4化合物8.1g,收率为84.4%,hplc纯度为97.6%。
[0143]
实施例4-2
[0144]
室温下在反应瓶中依次加入0.3g氯化锌、0.5g 1,2,4-三氮唑、10g式i-4化合物和300ml乙腈,在0℃保温反应,tlc至无式i-4化合物,过滤除去不溶物,减压浓缩有机溶剂,用丙酮精制,得式ii-4化合物7.1g,收率为74.0%,hplc纯度为97.3%。
[0145]
实施例4-3
[0146]
室温下在反应瓶中依次加入1.5g氯化铜、1.3g1,2,3-三氮唑、10g式i-4化合物和100ml甲苯,在80℃保温反应,tlc至无式i-4化合物,过滤除去不溶物,减压浓缩有机溶剂,用丙酮精制,得式ii-4化合物7.2g,收率为75.1%,hplc纯度为97.2%。
[0147]
式iii化合物的制备
[0148]
实施例5
[0149][0150]
实施例5-1
[0151]
室温下在反应瓶中依次加入1.9g四丁基溴化铵、0.68g水、5.4g6,7-二氧杂螺[3.4]辛烷-5,8-二酮、10g式ii-1化合物和100ml二氯甲烷,在0℃保温反应,tlc至无式ii-1化合物,将反应液加入1000ml5%硫代硫酸钠水溶液搅拌0.5h,再用乙酯萃取,分液,将有机相减压浓缩。残留物加入850ml 1mol/l碳酸钠溶液和850ml甲醇的混合液在55℃搅拌14h,结束后调节ph至中性,减压浓缩至除去大部分有机溶剂,过滤,水洗,干燥,得式iii-1化合物10.1g,收率为92.5%,hplc纯度为98.4%。
[0152]
实施例5-2
[0153]
室温下在反应瓶中依次加入0.4g四甲基溴化铵、0.78g水、4.1g5,6-二氧杂螺[2.4]庚烷-4,7-二酮、10g式ii-1化合物和50ml氯仿,在10℃保温反应,tlc至无式ii-1化合物,将反应液加入1000ml 5%硫代硫酸钠水溶液搅拌0.5h,再用乙酯萃取,分液,将有机相减压浓缩。残留物加入850ml 1mol/l碳酸氢钠溶液和850ml乙醇的混合液在60℃搅拌14h,结束后调节ph至中性,减压浓缩至除去大部分有机溶剂,过滤,水洗,干燥,得式iii-1化合物9.9g,收率为90.7%,hplc纯度为97.5%。
[0154]
实施例5-3
[0155]
室温下在反应瓶中依次加入3.2g四丙基氯化铵、0.57g水、6.8g2,3-二氧杂螺[4.4]壬烷-1,4-二酮、10g式ii-1化合物和150ml 2-甲基四氢呋喃,在15℃保温反应,tlc至无式ii-1化合物,将反应液加入1000ml 5%硫代硫酸钠水溶液搅拌0.5h,再用乙酯萃取,分液,将有机相减压浓缩。残留物加入850ml 1mol/l碳酸钾溶液和850ml氯仿的混合液在40℃搅拌14h,结束后调节ph至中性,减压浓缩至除去大部分有机溶剂,过滤,水洗,干燥,得式iii-1化合物9.7g,收率为88.9%,hplc纯度为97.2%。
[0156]
实施例5-4
[0157]
室温下在反应瓶中依次加入2.4g三乙基苄基溴化铵、0.73g水、7.4g(1s,4r)-螺[双环[2.2.1]庚烷-2,4'-[1,2]二氧戊环]-3',5'-二酮、10g式ii-1化合物和80ml甲苯,在30℃保温反应,tlc至无式ii-1化合物,将反应液加入1000ml 5%硫代硫酸钠水溶液搅拌0.5h,再用乙酯萃取,分液,将有机相减压浓缩。残留物加入850ml 1mol/l碳酸氢钾溶液和850ml二氯甲烷的混合液在45℃搅拌14h,结束后调节ph至中性,减压浓缩至除去大部分有机溶剂,过滤,水洗,干燥,得式iii-1化合物9.6g,收率为87.9%,hplc纯度为97.1%。
[0158]
实施例5-5
[0159]
本实施例与实施例3-1的区别在于,将5.4g 6,7-二氧杂螺[3.4]辛烷-5,8-二酮替换为4.8g 5,6-二氧杂螺[2.4]庚烷-4,7-二酮,其余条件均相同,经后处理,得iii-1化合物10.0g,收率为91.6%,hplc纯度为98.2%。
[0160]
实施例5-6
[0161]
本实施例与实施例3-1的区别在于,将5.4g 6,7-二氧杂螺[3.4]辛烷-5,8-二酮替换为5.9g 2,3-二氧杂螺[4.4]壬烷-1,4-二酮,其余条件均相同,经后处理,得iii-1化合物9.6g,收率为87.9%,hplc纯度为97.5%。
[0162]
实施例5-7
[0163]
本实施例与实施例3-1的区别在于,将5.4g 6,7-二氧杂螺[3.4]辛烷-5,8-二酮替换为6.9g(1s,4r)-螺[双环[2.2.1]庚烷-2,4'-[1,2]二氧戊环]-3',5'-二酮,其余条件均相同,经后处理,得iii-1化合物9.7g,收率为88.9%,hplc纯度为97.2%。
[0164]
实施例5-8
[0165]
本实施例与实施例3-1的区别在于,将5.4g 6,7-二氧杂螺[3.4]辛烷-5,8-二酮替换为2.5g 6,7-二氧杂螺[3.4]辛烷-5,8-二酮和2.6g 5,6-二氧杂螺[2.4]庚烷-4,7-二酮,其余条件均相同,经后处理,得iii-1化合物10.0g,收率为91.6%,hplc纯度为98.1%。
[0166]
实施例6
[0167][0168]
实施例6-1
[0169]
室温下在反应瓶中依次加入1.9g四丁基碘化铵、0.61g水、4.8g6,7-二氧杂螺[3.4]辛烷-5,8-二酮、10g式ii-2化合物和100ml二氯甲烷,在0℃保温反应,tlc至无式ii-2化合物,将反应液加入1000ml5%硫代硫酸钠水溶液搅拌0.5h,再用乙酯萃取,分液,将有机相减压浓缩。残留物加入850ml 1mol/l碳酸钠溶液和850ml甲醇的混合液在45℃搅拌14h,结束后调节ph至中性,减压浓缩至除去大部分有机溶剂,过滤,水洗,干燥,得式iii-2化合物8.7g,收率为88.9%,hplc纯度为97.6%。
[0170]
实施例6-2
[0171]
室温下在反应瓶中依次加入0.7g三乙基己基溴化铵、0.51g水、3.7g 5,6-二氧杂螺[2.4]庚烷-4,7-二酮、10g式ii-2化合物和50ml氯仿,在10℃保温反应,tlc至无式ii-2化合物,将反应液加入1000ml5%硫代硫酸钠水溶液搅拌0.5h,再用乙酯萃取,分液,将有机相减压浓缩。残留物加入850ml 1mol/l碳酸氢钠溶液和850ml乙醇的混合液在40℃搅拌14h,结束后调节ph至中性,减压浓缩至除去大部分有机溶剂,过滤,水洗,干燥,得式iii-2化合物8.5g,收率为86.8%,hplc纯度为97.2%。
[0172]
实施例6-3
[0173]
室温下在反应瓶中依次加入2.3g四丙基氯化铵、0.70g水、6.1g2,3-二氧杂螺[4.4]壬烷-1,4-二酮、10g式ii-2化合物和150ml 2-甲基四氢呋喃,在15℃保温反应,tlc至无式ii-2化合物,将反应液加入1000ml 5%硫代硫酸钠水溶液搅拌0.5h,再用乙酯萃取,分液,将有机相减压浓缩。残留物加入850ml 1mol/l碳酸钾溶液和850ml氯仿的混合液在60℃
搅拌14h,结束后调节ph至中性,减压浓缩至除去大部分有机溶剂,过滤,水洗,干燥,得式iii-2化合物8.5g,收率为86.8%,hplc纯度为97.1%。
[0174]
实施例6-4
[0175]
室温下在反应瓶中依次加入四甲基溴化铵2.0g、0.56g水、5.7g(1s,4r)-螺[双环[2.2.1]庚烷-2,4'-[1,2]二氧戊环]-3',5'-二酮、10g式ii-2化合物和80ml甲苯,在30℃保温反应,tlc至无式ii-2化合物,将反应液加入1000ml 5%硫代硫酸钠水溶液搅拌0.5h,再用乙酯萃取,分液,将有机相减压浓缩。残留物加入850ml 1mol/l碳酸氢钾溶液和850ml二氯甲烷的混合液在55℃搅拌14h,结束后调节ph至中性,减压浓缩至除去大部分有机溶剂,过滤,水洗,干燥,得式iii-2化合物8.4g,收率为85.8%,hplc纯度为97.3%。
[0176]
实施例6-5
[0177]
本实施例与实施例4-1的区别在于,将反应温度0℃替换为10℃,其余条件均相同,经后处理,得iii-1化合物8.7g,收率为88.9%,hplc纯度为97.8%。
[0178]
实施例6-6
[0179]
本实施例与实施例4-1的区别在于,将反应温度0℃替换为15℃,其余条件均相同,经后处理,得iii-1化合物8.5g,收率为86.8%,hplc纯度为97.1%。
[0180]
实施例6-7
[0181]
本实施例与实施例4-1的区别在于,将反应温度0℃替换为30℃,其余条件均相同,经后处理,得iii-1化合物8.4g,收率为85.8%,hplc纯度为97.1%。
[0182]
实施例7
[0183][0184]
实施例7-1
[0185]
室温下在反应瓶中依次加入2.1g四丁基溴化铵、0.75g水、6.0g6,7-二氧杂螺[3.4]辛烷-5,8-二酮、10g式ii-3化合物和120ml二氯甲烷,在0℃保温反应,tlc至无式ii-3化合物,将反应液加入1000ml5%硫代硫酸钠水溶液搅拌0.5h,再用乙酯萃取,分液,将有机相减压浓缩。残留物加入850ml 1mol/l碳酸钠溶液和850ml甲醇的混合液在55℃搅拌14h,结束后调节ph至中性,减压浓缩至除去大部分有机溶剂,过滤,水洗,干燥,得式iii-3化合物9.9g,收率为89.2%,hplc纯度为97.8%。
[0186]
实施例7-2
[0187]
室温下在反应瓶中依次加入0.5g四甲基溴化铵、0.86g水、4.5g5,6-二氧杂螺[2.4]庚烷-4,7-二酮、10g式ii-3化合物和50ml氯仿,在20℃保温反应,tlc至无式ii-3化合物,将反应液加入1000ml 5%硫代硫酸钠水溶液搅拌0.5h,再用乙酯萃取,分液,将有机相减压浓缩。残留物加入850ml 1mol/l碳酸氢钠溶液和850ml乙醇的混合液在45℃搅拌14h,结束后调节ph至中性,减压浓缩至除去大部分有机溶剂,过滤,水洗,干燥,得式iii-3化合物9.7g,收率为87.5%,hplc纯度为97.6%。
[0188]
实施例7-3
[0189]
室温下在反应瓶中依次加入3.5g四丙基氯化铵、0.63g水、7.5g2,3-二氧杂螺[4.4]壬烷-1,4-二酮、10g式ii-3化合物和150ml 2-甲基四氢呋喃,在30℃保温反应,tlc至无式ii-3化合物,将反应液加入1000ml 5%硫代硫酸钠水溶液搅拌0.5h,再用乙酯萃取,分液,将有机相减压浓缩。残留物加入850ml 1mol/l氢氧化钠溶液和850ml二氯甲烷的混合液在10℃搅拌14h,结束后调节ph至中性,减压浓缩至除去大部分有机溶剂,过滤,水洗,干燥,得式iii-3化合物9.5g,收率为85.7%,hplc纯度为97.5%。
[0190]
实施例8
[0191][0192]
实施例8-1
[0193]
室温下在反应瓶中依次加入1.9g四丁基溴化铵、0.56g水、4.4g6,7-二氧杂螺[3.4]辛烷-5,8-二酮、10g式ii-4化合物和100ml二氯甲烷,在0℃保温反应,tlc至无式ii-4化合物,将反应液加入1000ml5%硫代硫酸钠水溶液搅拌0.5h,再用乙酯萃取,分液,将有机相减压浓缩。残留物加入850ml 1mol/l碳酸钾溶液和850ml甲醇的混合液在60℃搅拌14h,结束后调节ph至中性,减压浓缩至除去大部分有机溶剂,过滤,水洗,干燥,得式iii-4化合物8.7g,收率为88.6%,hplc纯度为97.7%。
[0194]
实施例8-2
[0195]
室温下在反应瓶中依次加入0.4g四甲基溴化铵、0.65g水、3.4g5,6-二氧杂螺[2.4]庚烷-4,7-二酮、10g式ii-4化合物和50ml氯仿,在15℃保温反应,tlc至无式ii-4化合物,将反应液加入1000ml 5%硫代硫酸钠水溶液搅拌0.5h,再用乙酯萃取,分液,将有机相减压浓缩。残留物加入850ml 1mol/l碳酸氢钾溶液和850ml乙醇的混合液在40℃搅拌14h,结束后调节ph至中性,减压浓缩至除去大部分有机溶剂,过滤,水洗,干燥,得式iii-4化合物8.5g,收率为86.6%,hplc纯度为97.6%。
[0196]
实施例8-3
[0197]
室温下在反应瓶中依次加入3.2g四丙基氯化铵、0.48g水、5.6g2,3-二氧杂螺[4.4]壬烷-1,4-二酮、10g式ii-4化合物和150ml 2-甲基四氢呋喃,在30℃保温反应,tlc至无式ii-4化合物,将反应液加入1000ml 5%硫代硫酸钠水溶液搅拌0.5h,再用乙酯萃取,分液,将有机相减压浓缩。残留物加入850ml 1mol/l氢氧化钾溶液和850ml氯仿的混合液在0℃搅拌14h,结束后调节ph至中性,减压浓缩至除去大部分有机溶剂,过滤,水洗,干燥,得式iii-4化合物8.3g,收率为84.6%,hplc纯度为97.6%。
[0198]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进
行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1