一种基于咔唑和蒽的可自主体发光的蓝色主体材料的制作方法
本发明属于有机电致发光材料技术领域,涉及一种基于咔唑和蒽的可自主发光的蓝色主体材料,本发明还涉及使用该化合物制作的有机电致发光器件。
背景技术:
有机磷光电致发光器件(pholed:phosphorescentorganic-lightemittingdevice)可以同时捕获三线态和单线态激子,故其内量子效率打破了传统荧光oled的25%的理论极限,使100%的内量子效率成为可能。在pholed中,由于客体材料——磷光发光材料的淬灭效应,只能掺杂在主体材料中作为发光层。与其它材料相比,深蓝色磷光主体材料的缺乏已严重制约了oled的发展,成为oled实现产业化的瓶颈,亟待发展高效率的蓝色磷光主体材料。
造成这种局面的原因主要有:一方面蓝色磷光主体材料的三线态能级不够高,造成客体到主体的能量回传,从而降低了器件的发光效率;另一方面深蓝色磷光主体材料的载流子传输性能不佳,使电子和空穴复合几率减小,器件效率下降。
应用于有机电致磷光器件的主体材料应具有如下性质:(1)具备良好的电荷传输特性;(2)主客体间具有较好的能级匹配,一般要求主体能隙大于客体能隙,使激子能量有效地转移至客体分子上发射磷光,或者将电荷直接陷在客体上形成激子辐射衰减发射磷光;(3)通常必须具备一定的磷光特性,在低温下其磷光峰值波长比客体磷光材料的磷光峰值波长短,即要求主体材料三线态能级(t1)大于客体t1能级,且具有较长的磷光寿命。其中,主体材料与客体材料的能级结构匹配是制约器件发光效率的关键因素。为了保证能级匹配和防止主体对磷光客体的三线态激子猝灭,通常选用宽禁带的发光材料作为主体材料。
由于价格便宜、易于获得且具有良好的热学、电学以及光物理性能,咔唑及其衍生物在有机电子学领域有着广泛的应用前景。咔唑分子是一种典型的含n芳香杂环化合物,具有多个化学反应的活性位点,如3,6,9位等,并且便于拓展其π共轭体系。咔唑基团在紫外区有较强的吸收,其能隙约为3.2ev,常被用来设计合成蓝色的材料。咔唑在具有良好的空穴传输能力同时也有较高的三线态能级,通过在不同位置修饰引入具有电子传输能力的基团,可以构建出具有双极性传输性质的主体发光材料。此外,咔唑还具有较强给电子能力,通过在不同位点引入吸电子基团来调节其homo/lumo轨道的重叠程度,进而改变其能隙大小,可以合成出具有不同发光颜色的有机材料。咔唑基团中n原子上孤对电子的存在,使得这类材料的三线态和单线态之间的交换能通常很小,因此三线态和单线态能级差别少,导致较高的三线态能级。较高的三线态能级,对磷光材料的掺杂非常有利,可以有效地将三线态激子限制在磷光材料上,防止三线态能量流失,其t1能级高于有机磷光发光材料的t1能级,实现其三线态的磷光发射。
蒽分子化学修饰性强,在其9、10位或其他碳原子上进行取代修饰,可以有效减少蒽分子之间的聚集。大量的研究表明,蒽的衍生物具有较好的成膜性、稳定性和适当的载流子传输特性,同时又具有较好的光电性能,使得蒽类衍生物备受关注,在有机电致发光器件中的具有实际应用价值。
技术实现要素:
本发明的目的是提供一种基于咔唑和蒽的可自主发光的蓝色主体材料,该化合物具有良好的双极性传输性能,可以作为一种磷光主体材料。
本发明所采用的技术方案如下。
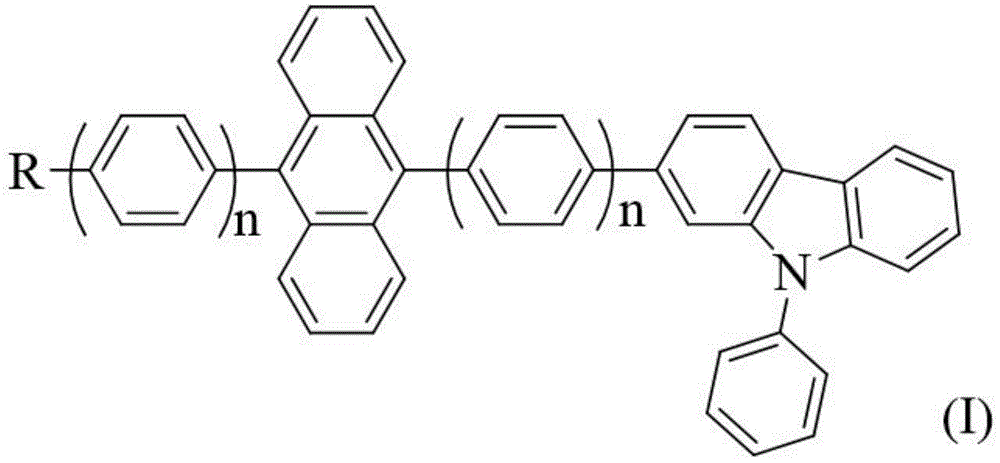
一种基于咔唑和蒽基团结构的蓝色主体发光材料,具有式(i)表示的结构通式:
式中:r为二环或三环类稠环芳香烃,或3,5-二苯基苯基,或碳原子数为1~10的直链或支链亚烷基中的一种。
上述通式(i)表示的有机电致发光化合物可以简写为xnapcz。
本发明所述的有机电致发光化合物可由化学计量比的通式(ii)表示的蒽基衍生物与(9-苯基-9h-咔唑-2-基)硼酸以下述方程式表示的方法制备得到:
式中:r为二环或三环类稠环芳香烃,或3,5-二苯基苯基,或碳原子数为1~10的直链或支链亚烷基中的一种。
本发明所述有机电致发光化合物的具体制备方法是:将化学计量比的通式(ii)表示的蒽基衍生物与(9-苯基-9h-咔唑-2-基)硼酸溶解在甲苯溶剂中,在氮气保护和四(三苯基膦)钯(pd(pph3)4)催化剂存在下,加入碱金属盐溶液回流反应,得到通式(i)表示的化合物。
其中,所述的碱金属盐优选碳酸钠,更为优选的方案为优选浓度2mol/l的碳酸钠溶液。
本发明采用蒽基衍生物与(9-苯基-9h-咔唑-2-基)硼酸为原料,合成了基于咔唑和蒽的可自主发光的蓝色主体材料,合成方法简单,且分子结构通过1hnmr和13cnmr表征得以验证。
本发明测定了主体材料的热稳定性能。使用法国setaram公司的热重/差热联用仪,以5~10℃/min的升温速率进行热稳定性分析,测试得出主体材料的玻璃化温度为106~120℃,相对于经典的磷光主体材料cbp提高了44~60℃,且热分解温度376~400℃,具有优异的热稳定性。
本发明同时也测定了主体材料的紫外吸收特性和荧光特性,包括室温时,在二氯甲烷溶液中浓度为1×10-5mol/l的紫外吸收光谱和光致发光光谱,。经测定,主体材料的室温紫外吸收光谱位于230~300nm,荧光发射峰位于425~450nm范围内。
本发明还测定了主体材料的电化学性能。使用荷兰autolab/pgstat302电化学测试仪测试产物的循环伏安曲线,参比电极为222型甘汞电极,工作电极和对电极分别为铂片,以四丁基高氯酸铵溶于丙酮作为支持电解液,浓度1mol/l。经测定,主体材料的氧化起始电位
本发明也提供了一种有机电致发光器件,所述有机电致发光器件中包含有本发明上述的有机电致可自主发光的蓝色主体材料。
众所周知,有机电致发光器件包括两个电极以及插入在两个电极之间的有机层,有机层结构则至少包括空穴传输层、发光层和电子传输层,包括或不包括空穴注入层和电子注入层,其中的发光层又由非掺杂的客体材料构成。进而,本发明上述有机电致发光化合物被用作有机电致发光器件中的自发光蓝色主体材料。
具体地,本发明是将有机电致发光材料,即客体材料非掺杂作为发光层,采用传统真空蒸镀法制备出了结构为ito/moo3(3nm)/mcp(30nm)/hosts(25nm)/tpbi(60nm)/lif(1nm)/al(200nm)的器件。上述结构中,ito为氧化铟锡,作为阳极材料;moo3为空穴注入材料;mcp是n,n'-二咔唑基-3,5-苯的缩写,为空穴传输材料;tpbi是1,3,5-三(1-苯基-1h-苯并咪唑-2-基)苯的缩写,为电子传输材料;lif为电子注入材料;al为阴极材料。
上述制备的有机电致发光器件,电致发光谱的最大发光峰均位于430~455nm,为自主发光的蓝色材料的发光,器件的启亮电压为3~3.5v,器件的最大亮度为3044~6000cd/m2,器件的最大发光效率为10.2~13.9cd/a,器件的最大功率效率为8.0~10.0lm/w,器件的最大外量子效率为4.2~6.0%。
显然,上述以xnapcz作为蓝光材料和磷光主体材料的有机电致发光器件的结构并不是对本发明保护范围的限定,本发明也并不局限于上述器件结构。本发明保护的宗旨是以xcp作为自发光蓝光材料和磷光主体材料,凡是以xnapcz作为蓝光和主体材料的有机电致发光器件,都应该理解为本发明的保护范围。例如,还可以制备得到以下结构的有机磷光电致发光器件。
ito/m-mtdata(10nm)/npb(30nm)/ir(piq)2acac:hosts/tpbi(30nm)/lif(1nm)/al。
ito/m-mtdata(10nm)/npb(30nm)/ir(piq)2acac:hosts/bphen(30nm)/lif(1nm)/al
ito/m-mtdata(10nm)/npb(30nm)/ir(piq)2acac:hosts/bcp(30nm)/lif(1nm)/al
ito/npb(30nm)/ir(ppy)3:hosts/bphen(30nm)/lif(1nm)/al。
ito/npb(30nm)/ir(ppy)3:hosts/tpbi(30nm)/lif(1nm)/al。
ito/npb(30nm)/ir(ppy)3:hosts/bcp(30nm)/lif(1nm)/al。
综上所述,本发明制备得到的基于咔唑和蒽基团结构的可自主发光的蓝色主体材料具有较高的玻璃化温度,作为有机自发光材料和磷光主体材料,可以有效提高磷光器件的稳定性;同时,该类化合物具有较宽的光学带隙,有良好的电子传输性能。将本发明所述的基于咔唑和蒽基团结构的蓝色主体发光材料作为有机电致发光器件中的自发光材料或磷光主体材料,可以有效避免客体材料到主体材料的能量回传,从而提高器件的发光效率和寿命,满足制备高性能发光器件的要求。
附图说明
图1是本发明基于咔唑和蒽基团结构的蓝色主体发光材料的结构通式。
图2是实施例1制备得到的napcz的1hnmr核磁谱图。
图3是实施例1制备得到的napcz的13cnmr核磁谱图。
图4是实施例1制备得到的napcz的紫外吸收和发射光谱图。
图5是实施例1制备得到的napcz的循环伏安曲线图。
图6是实施例1制备得到的napcz的tg和dsc曲线图。
图7是以napcz为可自主发光的蓝色主体材料的有机电致发光器件在不同电压下的电致发光光谱图。
图8是以napcz作为可自主发光的蓝色主体材料的有机电致发光器件的电流密度-电压与亮度-电压曲线图。
图9是以napcz作为可自主发光的蓝色主体材料的有机电致发光器件的电流效率-电流密度曲线图。
图10是以napcz作为可自主发光的蓝色主体材料的有机电致发光器件的外量子效率-电流密度曲线图。
具体实施方式
下面通过具体实施例进一步说明本发明中所述的基于咔唑和蒽基团结构的蓝色主体发光材料的制备方法、发光性能及其作为有机电致发光器件中的自发光材料和磷光主体材料的性能测试效果。
实施例1
将9-溴-10-(1-萘基)蒽(3.83g,10mmol),(9-苯基-9h-咔唑-2-基)硼酸(2.87g,10mmol)和2m的无水碳酸钠溶解在50ml的无水甲苯中,再加入10ml的无水乙醇,以四(三苯基膦)钯(pd(pph3)4)(0.03g,0.05mmol)为催化剂,混合溶液在氮气气氛下加热至回流状态,反应24h。冷却至室温后,将水(50ml)倒入混合物中,用乙酸乙酯提取。分出有机层,用水洗涤,经过无水硫酸镁干燥,真空旋转蒸发掉溶剂。得到的物质经硅胶柱层析,以石油醚/乙酸乙酯(20:1,v/v)作为洗脱剂,得到白色产物。反应方程式如下:
以1hnmr和13cnmr对得到化合物的结构进行表征,图2中1hnmr(600mhz,dmso-d6,tms)δ:8.317(dd,1h),8.221(d,1h),7.99(d,1h),7.938(dd,1h),7.719(d,2h),7.629(dd,1h),7.5415(m,4h),7.423(m,8h),7.305(m,2h),7.222(m,2h),7.1145(m,4h);图2中13cnmr(150mhz,dmso-d6):δ141.365,141.102,138.233,137.615,137.583,137.010,136.841,136.806,134.961,133.721,133.640,133.628,130.613,130.232,129.958,129.916,129.252,129.193,128.244,128.114,127.482,127.453,127.323,127.147,127.094,127.048,126.723,126.321,126.239,126.165,126.042,126.004,125.635,125.160,125.060,123.524,123.324,122.736,120.425,120.245,120.202,112.567,110.026.证明其分子结构为napcz。
将napcz溶解在二氯甲烷中得到浓度5×10-6mol/l的溶液,以lambdabio40紫外-可见光谱仪测试其紫外-可见吸收光谱;将napcz溶解在二氯甲烷中得到浓度1×10-5mol/l的溶液,使用caryeclipse荧光分光光度计测试其荧光光谱,谱图合并于图4中。由图5可知,napcz的紫外吸收峰波长主要为230、263和297nm;在二氯甲烷溶液中的荧光发射峰分别位于425nm,属于蓝光发射,可以自发光既作为发光材料又作为主体材料。
napcz的循环伏安曲线如图5所示,计算得到napcz的homo能级为-6.1ev。结合图4的紫外吸收光谱数据,可近似计算出napcz的光学带隙为3.1ev,并计算得到napcz的lumo能级为-3.0ev。
图6为napcz的热重(tg)曲线和二次加热差热(dsc)曲线图,从图中可以得到napcz的玻璃化温度和热分解温度分别为106℃和376℃,其玻璃化温度比经典的磷光主体材料cbp提高了44℃。
选用pholed器件结构,以napcz可自主发光的蓝色主体材料,将其非掺杂既作为主体材料又作为发光层,并以mcp和tpbi分别为空穴传输层和电子传输层,制备出了器件。
器件:ito/moo3(3nm)/mcp(30nm)/hosts(25nm)/tpbi(60nm)/lif(1nm)/al(200nm)。
使用pr655光谱辐射仪和keithley2400数字源表测试了器件的各项性能,所有测试均在大气环境下进行。
图7为器件在不同电压下的电致发光光谱,其最大发光峰波长为430nm,对应于可自主发光的蓝色主体材料napcz的发射峰,呈现蓝光发射,实现了完全的能量转移。
图8为器件的电流密度-电压以及亮度-电压曲线图,从图中可以看出,器件的启亮电压为3v。当驱动电压为9.5v时,器件达到最大发光亮度3044cd/m2。
图9为器件的电流效率-电流密度-功率效率曲线,当电流密度为2ma/cm2时,器件达到最大电流效率10.2cd/a,最大功率效率达到8.0lm/w。
图10为外量子效率-电流密度曲线,器件的最大外量子效率为4.2%。基于咔唑和蒽的可自主发光的蓝色主体材料既具有电子传输特性有具有空穴传输特性的双极性传输性质,可以很好的平衡载流子传输性能,进而提高器件性能。
实施例2
将9-溴-10-(2-萘基)蒽(3.83g,10mmol),(9-苯基-9h-咔唑-2-基)硼酸(2.87g,10mmol)和2m的无水碳酸钠溶解在50ml的无水甲苯中,再加入10ml的无水乙醇,以四(三苯基膦)钯(pd(pph3)4)(0.03g,0.05mmol)为催化剂,混合溶液在氮气气氛下加热至回流状态,反应24h。冷却至室温后,将水(50ml)倒入混合物中,用乙酸乙酯提取。分出有机层,用水洗涤,经过无水硫酸镁干燥,真空旋转蒸发掉溶剂。得到的物质经硅胶柱层析,以石油醚/乙酸乙酯(20:1,v/v)作为洗脱剂,得到白色产物。反应方程式如下:
实施例3
将9-溴-10-(4-(萘-1-基)苯基)蒽(4.59g,10mmol),(9-苯基-9h-咔唑-2-基)硼酸(2.87g,10mmol)和2m的无水碳酸钠溶解在50ml的无水甲苯中,再加入10ml的无水乙醇,以四(三苯基膦)钯(pd(pph3)4)(0.03g,0.05mmol)为催化剂,混合溶液在氮气气氛下加热至回流状态,反应24h。冷却至室温后,将水(50ml)倒入混合物中,用乙酸乙酯提取。分出有机层,用水洗涤,经过无水硫酸镁干燥,真空旋转蒸发掉溶剂。得到的物质经硅胶柱层析,以石油醚/乙酸乙酯(20:1,v/v)作为洗脱剂,得到白色产物。反应方程式如下:
实施例4
将9-溴-10-(4-(萘-2-基)苯基)蒽(4.59g,10mmol),(9-苯基-9h-咔唑-2-基)硼酸(2.87g,10mmol)和2m的无水碳酸钠溶解在50ml的无水甲苯中,再加入10ml的无水乙醇,以四(三苯基膦)钯(pd(pph3)4)(0.03g,0.05mmol)为催化剂,混合溶液在氮气气氛下加热至回流状态,反应24h。冷却至室温后,将水(50ml)倒入混合物中,用乙酸乙酯提取。分出有机层,用水洗涤,经过无水硫酸镁干燥,真空旋转蒸发掉溶剂。得到的物质经硅胶柱层析,以石油醚/乙酸乙酯(20:1,v/v)作为洗脱剂,得到白色产物。反应方程式如下:
实施例5
将9-(4-溴苯基)-10-(萘-1-基)蒽(4.59g,10mmol),(9-苯基-9h-咔唑-2-基)硼酸(2.87g,10mmol)和2m的无水碳酸钠溶解在50ml的无水甲苯中,再加入10ml的无水乙醇,以四(三苯基膦)钯(pd(pph3)4)(0.03g,0.05mmol)为催化剂,混合溶液在氮气气氛下加热至回流状态,反应24h。冷却至室温后,将水(50ml)倒入混合物中,用乙酸乙酯提取。分出有机层,用水洗涤,经过无水硫酸镁干燥,真空旋转蒸发掉溶剂。得到的物质经硅胶柱层析,以石油醚/乙酸乙酯(20:1,v/v)作为洗脱剂,得到白色产物。反应方程式如下:
实施例6
将9-(4-溴苯基)-10-(萘-2-基)蒽(4.59g,10mmol),(9-苯基-9h-咔唑-2-基)硼酸(2.87g,10mmol)和2m的无水碳酸钠溶解在50ml的无水甲苯中,再加入10ml的无水乙醇,以四(三苯基膦)钯(pd(pph3)4)(0.03g,0.05mmol)为催化剂,混合溶液在氮气气氛下加热至回流状态,反应24h。冷却至室温后,将水(50ml)倒入混合物中,用乙酸乙酯提取。分出有机层,用水洗涤,经过无水硫酸镁干燥,真空旋转蒸发掉溶剂。得到的物质经硅胶柱层析,以石油醚/乙酸乙酯(20:1,v/v)作为洗脱剂,得到白色产物。反应方程式如下:
实施例7
将9-(4-溴苯基)-10-(4-(萘-1-基)苯基)蒽(5.35g,10mmol),(9-苯基-9h-咔唑-2-基)硼酸(2.87g,10mmol)和2m的无水碳酸钠溶解在50ml的无水甲苯中,再加入10ml的无水乙醇,以四(三苯基膦)钯(pd(pph3)4)(0.03g,0.05mmol)为催化剂,混合溶液在氮气气氛下加热至回流状态,反应24h。冷却至室温后,将水(50ml)倒入混合物中,用乙酸乙酯提取。分出有机层,用水洗涤,经过无水硫酸镁干燥,真空旋转蒸发掉溶剂。得到的物质经硅胶柱层析,以石油醚/乙酸乙酯(20:1,v/v)作为洗脱剂,得到白色产物。反应方程式如下:
实施例8
将9-(4-溴苯基)-10-(4-(萘-2-基)苯基)蒽(5.35g,10mmol),(9-苯基-9h-咔唑-2-基)硼酸(2.87g,10mmol)和2m的无水碳酸钠溶解在50ml的无水甲苯中,再加入10ml的无水乙醇,以四(三苯基膦)钯(pd(pph3)4)(0.03g,0.05mmol)为催化剂,混合溶液在氮气气氛下加热至回流状态,反应24h。冷却至室温后,将水(50ml)倒入混合物中,用乙酸乙酯提取。分出有机层,用水洗涤,经过无水硫酸镁干燥,真空旋转蒸发掉溶剂。得到的物质经硅胶柱层析,以石油醚/乙酸乙酯(20:1,v/v)作为洗脱剂,得到白色产物。反应方程式如下:
实施例9
将9-([1,1':3',1”-三苯基]-5'-基)-10溴蒽(4.85g,10mmol),(9-苯基-9h-咔唑-2-基)硼酸(2.87g,10mmol)和2m的无水碳酸钠溶解在50ml的无水甲苯中,再加入10ml的无水乙醇,以四(三苯基膦)钯(pd(pph3)4)(0.03g,0.05mmol)为催化剂,混合溶液在氮气气氛下加热至回流状态,反应24h。冷却至室温后,将水(50ml)倒入混合物中,用乙酸乙酯提取。分出有机层,用水洗涤,经过无水硫酸镁干燥,真空旋转蒸发掉溶剂。得到的物质经硅胶柱层析,以石油醚/乙酸乙酯(20:1,v/v)作为洗脱剂,得到白色产物。反应方程式如下:
实施例10
将9-([1,1':3',1”-三苯基]-5'-基)-10-(4-溴苯基)蒽(5.61g,10mmol),(9-苯基-9h-咔唑-2-基)硼酸(2.87g,10mmol)和2m的无水碳酸钠溶解在50ml的无水甲苯中,再加入10ml的无水乙醇,以四(三苯基膦)钯(pd(pph3)4)(0.03g,0.05mmol)为催化剂,混合溶液在氮气气氛下加热至回流状态,反应24h。冷却至室温后,将水(50ml)倒入混合物中,用乙酸乙酯提取。分出有机层,用水洗涤,经过无水硫酸镁干燥,真空旋转蒸发掉溶剂。得到的物质经硅胶柱层析,以石油醚/乙酸乙酯(20:1,v/v)作为洗脱剂,得到白色产物。反应方程式如下:
实施例11
将9-溴-10-(5'-苯基-[1,1':3',1”-三苯基]-4-基)蒽(5.61g,10mmol),(9-苯基-9h-咔唑-2-基)硼酸(2.87g,10mmol)和2m的无水碳酸钠溶解在50ml的无水甲苯中,再加入10ml的无水乙醇,以四(三苯基膦)钯(pd(pph3)4)(0.03g,0.05mmol)为催化剂,混合溶液在氮气气氛下加热至回流状态,反应24h。冷却至室温后,将水(50ml)倒入混合物中,用乙酸乙酯提取。分出有机层,用水洗涤,经过无水硫酸镁干燥,真空旋转蒸发掉溶剂。得到的物质经硅胶柱层析,以石油醚/乙酸乙酯(20:1,v/v)作为洗脱剂,得到白色产物。反应方程式如下:
实施例12
将9-(4-溴苯基)-10-(5'-苯基-[1,1':3',1'-三苯基]-4-基)蒽(6.37g,10mmol),(9-苯基-9h-咔唑-2-基)硼酸(2.87g,10mmol)和2m的无水碳酸钠溶解在50ml的无水甲苯中,再加入10ml的无水乙醇,以四(三苯基膦)钯(pd(pph3)4)(0.03g,0.05mmol)为催化剂,混合溶液在氮气气氛下加热至回流状态,反应24h。冷却至室温后,将水(50ml)倒入混合物中,用乙酸乙酯提取。分出有机层,用水洗涤,经过无水硫酸镁干燥,真空旋转蒸发掉溶剂。得到的物质经硅胶柱层析,以石油醚/乙酸乙酯(20:1,v/v)作为洗脱剂,得到白色产物。反应方程式如下:
- 还没有人留言评论。精彩留言会获得点赞!