一类高比活的融合木聚糖酶突变体及其应用的制作方法
[0001]
本发明属于功能基因改造技术领域,具体涉及一类高比活的木聚糖酶突变体及其应用。
背景技术:
[0002]
低聚木糖是由2-7个木糖分子以β-1,4糖苷键结合而形成的功能性低聚糖,其中以木二糖、木三糖和木四糖为主要功能成分。低聚木糖是目前所有功能糖中性能最稳定、功能性最强、摄入量最少的益菌因子,其甜味纯正,增值双歧杆菌的功效是其他功能性寡糖类20倍以上。同时,难以为人体消化吸收,能量值几乎为零。因此,低聚木糖在食品、医药和饲料等领域有着广阔应用前景。
[0003]
木聚糖广泛存在于玉米芯、甘蔗渣、麦麸、秸秆等农业废弃物,其碳骨架中的β-1,4-木糖苷键可通过木聚糖酶水解生产低聚木糖。
[0004]
中国专利文献cn108570107a公开了将来自枯草芽孢杆菌bacillus subtilis lucky9的扩张蛋白(expansin)与木聚糖酶(xylanase)进行融合,得到的融合蛋白excl-ek2-xyn(以下简称erx)。该融合蛋白可显著增加木聚糖酶的吸附能力,且能打开木质纤维素的天然结构。所述融合蛋白通过吸附-催化耦合技术水解玉米芯,提高低聚木糖的制备效率。吸附融合蛋白后的玉米芯可直接用于低聚木糖的生产,在生产完成后,融合蛋白仍然保留在玉米芯上,这样的反应上清仅含有目标产物低聚木糖,通过一步简单离心即可获得高纯度的目标产物。但该融合蛋白的稳定性较差,应用于水解时较易染菌,不能完全满足工业化的需求。
技术实现要素:
[0005]
本发明针以现有技术融合木聚糖酶erx基础,对其进行了探索与研究,获得了一类高比活的且热稳定性高的融合木聚糖酶突变体。
[0006]
本发明具体技术方案如下:一种融合木聚糖酶突变体,所述突变体在seq id no:1所示的融合木聚糖酶的氨基酸序列基础上具有q226h、n251d和s398c位点突变。
[0007]
进一步的,所述突变体还可以具有g232r、s241p或s241e中的一种或几种位点突变。
[0008]
优选的,具有g232r和s241p位点突变或者g232r和s241e位点突变。
[0009]
本发明另一目的在于提供一种dna分子,所述dna分子编码本发明所述的融合木聚糖酶突变体。
[0010]
本发明另一目的在于提供一种融合木聚糖酶突变体的表达载体,表达如本发明所述的木聚糖酶突变体。所述表达载体,含有编码本发明所述的融合木聚糖酶突变体的dna分子。
[0011]
所述表达载体为质粒、噬菌体、病毒或宿主细胞。
and accessibility calculation for protein(ver.1.2)在线服务器对突变前后的氨基酸残基进行计算,按突变位点与活性中心相对距离建库(库1-y224/q226/n251,库2-w225,库3-g232/s241,库4-s398)。所用的单点突变引物如下:primersequence(5'to 3') y224x-faaagctagcacagacnnntggcaaaattggactseq id no:3y224x-ragtccaattttgccannngtctgtgctagctttseq id no:4w225x-fgctagcacagactactggnnnaattggactgatseq id no:5w225x-ratcagtccaattnnnccagtagtctgtgctagcseq id no:6q226x-fgcacagactactggnnnaattggactgatgggseq id no:7q226x-rcccatcagtccaattnnnccagtagtctgtgcseq id no:8g232x-faattggactgatgggnnnggtatagtaaacgctseq id no:9g232x-ragcgtttactataccnnncccatcagtccaattseq id no:10v238x-fggtatagtaaacgctnnnaatgggtctggcgggseq id no:11v238x-rcccgccagacccattnnnagcgtttactataccseq id no:12s241x-faacgctgttaatgggnnnggcgggaattacagtseq id no:13s241x-ractgtaattcccgccnnncccattaacagcgttseq id no:14n251x-fagtgttaattggtctnnnaccggaaattttgttseq id no:15n251x-raacaaaatttccggtnnnagaccaattaacactseq id no:16s398x-fggatatcaaagtagtggannntctaacgtaacagtgtggseq id no:17s398x-rccacactgttacgttagannntccactactttgatatccseq id no:18nnn对应不同氨基酸的密码子如下:gca(ala)、tgt(cys)、gat(asp)、gaa(glu)、ttt(phe)、ggc(gly)、cat(his)、att(ile)、aaa(lys)、ctg(leu)、atg(met)、aat(asn)、ccg(pro)、cag(gln)、cgt(arg)、tca(ser)、aca(thr)、gtt(val)、tgg(trp)、tat(tyr)。
[0025]
以融合木聚糖酶erx的基因序列(seq id no:2)为模版,参照vazyme生物产品及操作手册,使用上述引物对,全质粒扩增出定点突变序列。pcr产物使用dpn i进行酶切处理,模板消化结束后,采用热激法转化至大肠杆菌感受态细胞e.coli bl21(de3),并涂布于含有100μg/ml硫酸卡那霉素的lb琼脂平板上,37℃倒置培养过夜。突变结果由安徽通用生物公司进行序列测定完成验证。
[0026]
对上述4个突变库中共计284株突变体进行筛选后得到如下突变:n251d/q226h,n251d/q226t,s241e/g232r,s241p/g232e,s398c。将得到的突变进行组合,得到12种组合方式:突变体m1(q226h,g232r,s241p,n251d,s398c);突变体m2(q226h,g232r,s241e,n251d,s398c);突变体m3(q226t,g232r,s241p,n251d,s398c);突变体m4(q226t,g232r,s241e,n251d,s398c);突变体m5(q226h,n251d,g232r,s241e);突变体m6(q226h,n251d,g232e,s241p);突变体m7(q226h,n251d,s398c);突变体m8(q226t,n251d,g232r,s241e)
突变体m9(q226t,n251d,g232e,s241p)突变体m10(q226t,n251d,s398c);突变体m11(g232r,s241e,s398c);突变体m12(g232e,s241p,s398c)。
[0027]
实施例2重组木聚糖酶突变体在大肠杆菌中的发酵分别将实施例1构建的12种组合突变体以及原始酶erx接种至含有100μg/ml硫酸卡那霉素的50ml的lb液体培养基中,37℃,180rpm过夜培养;以2%的接种量将种子液,接种至新鲜的50ml的lb液体培养基中,37℃,180rpm培养至od
600
为0.6~1.0时,取出经冰水浴冷却5min,加入诱导剂iptg(异丙基-β-d硫代半乳糖苷)(终浓度0.1mmol/l),20℃,150rpm诱导表达20h。
[0028]
取诱导表达的发酵液,12000rpm离心20min,弃去上清,然后用50mm na2hpo
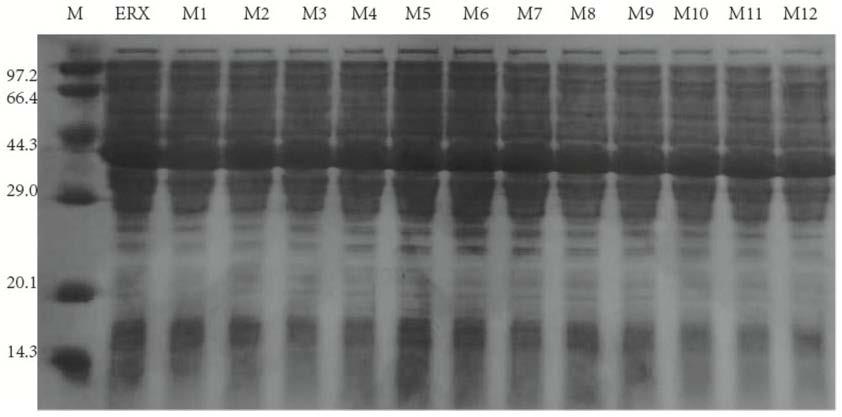
4-kh2po4(ph 7.0)缓冲重悬清洗菌体,12000rpm离心20min,弃去上清,用缓冲再次重悬,然后超声破碎。破碎液离心12000rpm,20min,取上清进行sds-page电泳检测,浓缩胶浓度为4%,分离胶浓度为12.5%,样品与上样缓冲按照3:1的比例混合,沸水浴反应5min进行上样电泳。电泳仪设定初始电压为120v,当样品移动至分离胶时提高电压至230v,直至样品移动到电泳槽底部时结束电泳。
[0029]
上述erx各突变粗酶液sds-page电泳结果如图1所示,原始酶erx的分子量为40kda,诱导后各突变体都在40kda处都有明显的条带,这与原始酶erx的分子量一致,表明原始酶erx和突变体成功诱导表达。
[0030]
实施例3酶突变体的筛选程序将实施例1中构建的带有突变基因的菌株按实施例2方法发酵培养,获得的融合蛋白及其突变体的粗酶液以榉木木聚糖为底物测定酶活变化,测定方法如下:酶活力单位定义:一个酶活力单位即为在60℃,ph 7.0条件下,每分钟由底物产1mmol还原糖所需的酶量定义为一个活力单位。
[0031]
木聚糖酶(endo-glucanase):准确称取1g榉木木聚糖溶于100ml的na2hpo
4-kh2po4缓冲中(50mm,ph 7.0),搅拌混匀,准确吸取1.0ml加入试管作为酶反应底物,60℃预热5min后加入已适当稀释的蛋白酶液0.5ml,放入60℃的水浴摇床反应10min,加入3ml的dns(3,5-二硝基水杨酸)试剂,沸水浴反应5min后迅速冷却至室温,以灭活的酶反应液为对照,测定540nm波长下的吸光度值。
[0032]
比酶活x=(还原糖含量/150/15)/n其中:x
---
比酶活,u/mg150
------------
还原糖从毫克转换为微摩尔15
------------
反应时间n
------------
反应蛋白含量,mg以组合突变为例,原始酶erx和各突变体的相对水解活性结果如图2所示。与原始酶相比,突变体m1、m2和m7对于榉木木聚糖的底物活性均明显提高,其中m2提升幅度最为显著,提高了80.3%,m1和m7分别提高21.7%和55.3%。突变体m4酶活无明显变化,其余组合突变体酶活均有不同程度的下降。
[0033]
实施例4酶突变体的温度稳定性分析
为了测定突变体和原始酶的温度稳定性,将实施例3筛选得到的突变体m2的粗酶液分别放入40℃、45℃、50℃、60℃、70℃水浴锅中孵育2h后,取样按照实施例3中水解榉木木聚糖的方式测定其剩余的酶活力。融合蛋白erx与突变体m2分别以0h最高的酶活为100%,依次计算相对酶活,绘制不同孵育条件下酶活的变化曲线。
[0034]
结果如图3所示,原始酶erx在40~70℃范围内保温2h后,酶活损失随温度升高而加剧。在40℃保温2h时,原始酶酶活损失最少,保留80%的酶活力,而突变体m2在50℃条件下保温2h后,活力仍有94%,各温度条件下孵育的突变体m2剩余酶活均高于原始酶,表明突变后的热稳定性好于原始酶。
[0035]
实施例5酶突变体应用于水解玉米芯制备低聚木糖将实施例3筛选得到的突变体m2的粗酶液应用于水解底物玉米芯制备低聚木糖。采用经过碱预处理的玉米芯,分别吸附原始融合蛋白和突变体,吸附条件参数为:玉米芯浓度5%,ph值7.0,温度20℃,时间30min。融合蛋白-玉米芯混合物经含有0.1%tween-20的纯水清洗后,加入40ml纯水,在50℃,200rpm下反应水解72小时。每间隔6小时取出少量上清样品,通过用dns法测定降解产生还原糖的量。
[0036]
融合蛋白erx和突变体m2降解玉米芯产生还原糖的时间曲线如图4所示。在酶解开始24h内,原始酶m2和突变体产生的还原糖浓度相近,在24h后原始酶还原糖产量上升趋势减缓,突变体m2的酶解速率明显大于原始酶,最终获得了8.13mg/ml还原糖,而原始酶产生了4.52mg/ml还原糖。这一结果表明,突变体m2比原始酶具有更高的水解能力,这可能是由于突变体m2具有更好的温度稳定性。因此,突变后的融合酶m2不仅保留了吸附纤维素类底物的能力,还提高了对木聚糖的热稳定性,使得突变体对木聚糖的水解能力大大提高,这将有利于降低低聚木糖生产的酶用量,从而降低整体的生产成本。
[0037]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1