用cGAMP或cGAsMP治疗癌症的方法与流程
本申请是申请日为2015年12月15日、申请号为201580069410.4、发明名称为“用cgamp或cgasmp治疗癌症的方法”的专利申请的分案申请。
用cgamp或cgasmp治疗癌症的方法。
背景技术:
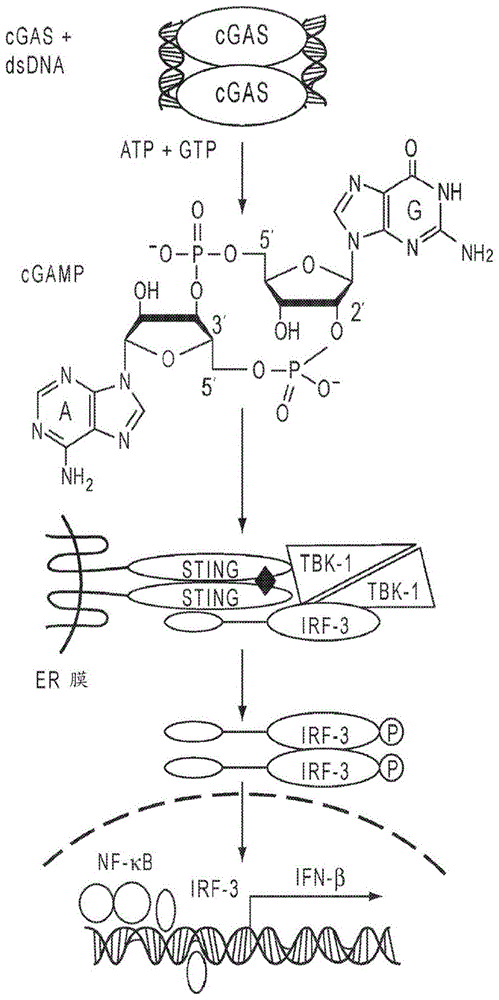
已发现cgas-cgamp-sting途径是对哺乳动物细胞的细胞质中dna的存在的细胞先天免疫应答的一部分。已鉴定了许多细胞质dna或rna的先天传感器(innatesensors)。参见barbergn,sting-dependentcytosolicdnasensingpathways,trendsinimmunology35:88-93(2014)。长期以来,认为细胞溶质中的微生物dna通过刺激i型干扰素的表达来诱导有力的先天免疫应答。参见stetsondb,eta1.,recognitionofcytosolicdnaactivatinganirf3-dependentinnateimmuneresponse,immunity24:93-103(2006)。搜索细胞溶质dna传感器首先导致发现sting(也称为mita、eris、mpys和tmem173),其是位于er膜上的衔接蛋白并介导发送至细胞溶质dna和细菌环状二核苷酸(诸如c-di-gmp和c-di-amp)的信号。图1;另见ishikawah.etal.,stingisanendoplasmicreticulumadaptorthatfacilitatesinnateimmunesignalling,nature455:674-8(2008)。尽管sting用作环状二核苷酸的直接传感器,但它不是细胞溶质dna的直接传感器,并且对dsdna的亲和性非常低。参见wuj.etal.,innateimmunesensingandsignalingofcytosolicnucleicacids,annualreviewofimmunology32:461-88(2014)。在搜索细胞溶质dna传感器时,sun等人鉴定了作为sting上游的细胞溶质dsdna传感器的酶环状gmp-amp合酶(cgas)。sunl,etal.,cyclicgmp-ampsynthaseisacytosolicdnasensorthatactivatesthetypeiinterferonpathway,science339:786-91(2013)。cgas被dsdna活化并催化来自atp和gtp的非经典环状二核苷酸2′,5′cgamp(以下称为cgamp)的合成。参见zhangx,etal.,cyclicgmp-ampcontainingmixedphosphodiesterlinkagesisanendogenoushigh-affinityligandforsting,molecularcell51:226-35(2013);并见图1。
cgamp用作内源性第二信使,其经由sting刺激i型干扰素的诱导。通过sting的cgamp结合导致蛋白激酶tbk1和转录因子irf3到信号复合物的募集。参见图1;并见tanakay,etal.,stingspecifiesirf3phosphorylationbytbk1inthecytosolicdnasignalingpathway,sciencesignaling5:ra20(2012)。
信号传导复合物上通过tbk1的irf3磷酸化促进了irf3的低聚及其向细胞核的移位,在那里其与转录因子nf-κb共同激活ifn-β基因的转录。参见tanaka;并见图1。
cgamp合成的现有技术方法使用化学合成方法,其包括多个步骤并使用各种修饰核苷酸。gaop,etal.,structure-functionanalysisofstingactivationbyc[g(2′,5′)pa(3′,5′)p]andtargetingbyantiviraldmxaa,cell154:748-62(2013).
然而,cgamp治疗癌症的潜力尚未被探索。本公开证实了cgamp针对某些肿瘤细胞系的直接且有效的肿瘤抑制活性。本公开还提供了使用重组人或鼠cgas催化结构域从atp和gtp合成cgamp的高效方案和纯化cgamp的有效技术。
技术实现要素:
根据本说明书,治疗患者癌症的方法包括向患有癌症的患者施用cgamp或cgasmp并允许cgamp或cgasmp治疗癌症。在一些实施方式中,抑制癌细胞生长的方法包括:提供癌细胞群;将癌细胞暴露于cgamp或cgasmp,并允许cgamp或cgasmp抑制癌细胞的生长。
在一些实施方式中,癌症中的sting表达水平比正常细胞中的平均水平高至少约1、1.2、1.25、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.25、2.5、2.75、3.0、3.25、3.5、3.75、4.0、4.25或4.5倍。在一些实施方式中,当评估患者组(poolofpatient)中的cgas水平时,cgas表达水平在较低的50%、45%、40%、35%、30%、25%、20%、15%或10%的患者中。
另外,在一些方面,酶促合成cgamp的方法包括提供重组cgas并将cgas与atp、gtp和dsdna结合以合成cgamp。
在一些情况下,在合成方法中不使用修饰核苷酸,合成可在单罐中进行,和/或合成可在单个步骤中进行。
在一些方面,纯化cgamp的方法包括:提供cgamp与选自dsdna和cgas的至少一种其它化合物的混合物;通过超滤将cgamp与dsdna和cgas分离;使用离子交换色谱法纯化cgamp;并通过冻干法从cgamp中除去盐。
在一些方面,酶促合成和纯化cgamp的方法包括:提供重组cgas;将cgas与atp、gtp和dsdna结合以合成cgamp;通过超滤将cgamp与dsdna和cgas分离;使用离子交换色谱法纯化cgamp;并通过冷干法从cgamp中除去盐。
上述方法也可用于使用重组cgas从atp硫代磷酸酯和gtp合成被称为cgasmp的cgamp的新衍生物。cgasmp不是天然产物。
其它目的和优点将在下面的描述中部分阐述,并且部分将从描述中显而易见,或者可通过实践来学习。这些目的和优点将通过所附权利要求中特别指出的要素和组合来实现和获得。
应当理解,前面的一般描述和以下的详细描述仅仅是示例性和解释性的,而不是权利要求的限制。
并入并构成本说明书的一部分的附图示出了一个(多个)实施方式,并与描述一起用于解释本文所述的原理。
附图说明
图1提供了针对细胞溶质dsdna的先天免疫中的cgamp/sting途径。
图2a-b显示了使用重组cgas的cgamp的合成。图2a显示在纯化之前通过离子交换色谱法分析酶促合成的cgamp。图2b说明通过离子交换色谱法分析纯化的cgamp。
图3a-c显示cgamp在细胞中和在小鼠中诱导ifn-β的表达。图3a是显示cdns差异化调节thp1细胞中的ifn-β诱导的ifn-β报告检测。图3b是用cgamp(黑色)和3′,5′cgamp(灰色)治疗的thp1细胞的ifn-βelisa。图3c是来自注射以cgamp的小鼠的血清的ifn-βelisa。
图4显示多重细胞因子检测,显示cgamp在thp1细胞中诱导广谱细胞因子和趋化因子的表达。
图5提供了通过cgamp刺激的thp1细胞中基因表达的微阵列分析。表达水平通过相对表达水平的log2表示,从-7到7,颜色从绿色到红色。
图6显示cgamp对数种人类肿瘤细胞系具有抗肿瘤活性。图6a是显示cgamp抑制神经元癌细胞系sf539生长的mtt检测。图6b是显示cgamp抑制肾癌细胞系a498生长的mtt检测。对照物(白色)是来自相同类型组织的癌细胞系。
图7a-b显示cgamp在两个cgamp响应性癌细胞系中诱导ifn-β的表达。图7a显示cgamp在肾癌细胞系a498中诱导ifn-β。图7b显示cgamp在cns癌细胞系sf539中诱导ifn-β。
图8显示白血病细胞系sr对cgamp治疗有响应,但对ifn-β治疗无响应。(a).用cgamp治疗的白血病细胞系sr和ccrf-cem的mtt检测。(b).用ifn-β治疗的两种白血病细胞系的mtt检测。
图9a-m提供了正常患者与癌症样品相比的sting表达水平的比较。图中显示,sting在癌症患者中表达水平较高。每个图用不同的数据集绘制。
图10a-b显示五种乳腺癌亚型中的cgas(也称为mb21d)表达量(expressionmagnitude)。图10c-d绘制了具有较低和较高量的cgas表达的患者的无复发生存(以年计)的存活可能性。
图11a-b提供了证明在某些癌症患者中cgamp的产生过低的数据。图11a显示了具有抗cgas抗体的乳腺癌和正常乳腺组织的染色。图11b还与正常乳腺组织相比量化了乳腺癌中cgas表达的降低。
图12a-b提供了结构图,图12a提供2′5′-cgamp的化学结构,且图12b提供2′5′-cgasmp的化学结构,后者是cgamp的非天然存在的衍生物。
图13a-b显示,cgamp和cgasmp都可以诱导ifn-β产生,但cgamp的衍生物cgasmp具有增强的效力。图13a显示用cgamp和cgasmp治疗的thp1细胞的ifn-βelisa结果。图13b显示用cgamp和cgasmp治疗的thp1细胞的ifn-β报告基因(reporter)检测结果。cgasmp是一种非天然存在的新化合物。
图14a显示用cgamp和cgasmp治疗的神经元癌细胞系sf539的治疗的mtt结果。图14b显示了用cgamp和cgasmp治疗的白血病细胞系sr的mtt检测中的结果。
图15a-d显示了数种体内小鼠癌模型实验的结果,其评估了cgamp与仅用载体相比在接种结肠癌、接种乳腺癌和自发性乳腺癌小鼠模型中降低肿瘤生长的能力。
具体实施方式
i.cgamp和cgasmp的酶促合成和纯化
cgamp和cgasmp可使用cgas(由mb21d1基因编码)来酶促合成。cgas可与atp(用于合成cgamp)或atp硫代磷酸酯(用于合成cgasmp)和gtp底物混合,任选地在降低非特异性相互作用的成分(诸如,鲑鱼精子dna)以及缓冲剂、盐和抗氧化剂(诸如,mgcl2、hepes缓冲剂、nacl和β-巯基乙醇)的存在下。
这种合成方法从现有技术提供了改进,因为在某些情况下,其不需要修饰核苷酸(modifiednucleotides)。其也可在单个步骤和单罐中进行(无论是仅合成还是合成与纯化方法的组合的合成部分)。
可通过离心除去样品中的沉淀物。可通过超滤将cgamp与酶和dsdna分离(诸如,用具有10kd截止值的amicon离心过滤器)。cgamp可使用离子交换色谱法使用qsepharose柱进一步纯化,并用乙酸铵溶液从柱上洗脱。或者,cgamp或cgasmp可通过凝胶过滤色谱法使用superdex肽柱纯化,用纯水或乙酸铵溶液从柱上洗脱。如果正在制备cgasmp,则可通过一个额外的纯化步骤,即使用superdex肽柱并以乙酸铵溶液(诸如0.05m)洗脱的凝胶过滤色谱法步骤,实现cgasmp的活性立体异构体的纯化。cgasmp可作为外消旋混合物使用,或者活性立体异构体可单独使用。
在一些情况下,酶促合成方法提供了高产率和高纯度产物,因此产物可容易地通过超滤然后通过离子交换色谱法来纯化。
在一些实施方式中,这种纯化方案可从dsdna、cgas、atp、gtp和/或其他副产物纯化cgamp。另外,在一些实施方式中,可通过该途径合成和纯化高达1克量的cgamp。在一些实施方式中,可制备千克级的数量,例如10千克。因为合成可在单个步骤和单罐中进行,并且通过诸如超滤和柱色谱法的可放大技术纯化,柱等的尺寸可调整到适合生产所需的cgamp量。这些改进可改进产率、方便性,并降低cgamp的生产和/或纯化成本。
ii.癌症治疗方法
a.癌症类型
在一个实施方式中,所述方法包括通过向患有癌症的患者施用cgamp或cgasmp并允许cgamp或cgasmp治疗癌症来治疗癌症的方法。在一个实施方式中,所述癌症具有升高的sting表达水平。在另一个实施方式中,所述癌症具有降低的cgas表达水平。在另一个实施方式中,所述癌症同时具有升高的sting表达水平和降低的cgas表达水平。
升高的sting表达水平可比正常细胞中平均水平至少高约1、1.2、1.25、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.25、2.5、2.75、3.0、3.25、3.5、3.75、4.0、4.25或4.5倍。可使用免疫组织化学染色通过使用对sting具有特异性的抗体将癌症样品中的sting表达水平与正常患者组中的正常水平相比较,所述对sting具有特异性的抗体可轭合到能使其视觉可见的部分(诸如酶,包括碱性磷酸酶或辣根过氧化物酶,或者荧光基团,诸如荧光素或若丹明)上。正常的患者组数据可存储在数据库中,并可以用于在不同时间点比较癌症标本。
cgas/mb21d1催化atp和gfp以产生cgamp,后者用作sting的配体。由于sting在癌症中过表达,并且尽管不受理论约束,cgas在某些癌症中可能无法正常表达,或者可能无法正常发挥功能。在某些癌症中,与正常患者相比或与其他癌症样本相比,cgas水平降低。较低的cgas水平与较差的效果相关,较高的cgas水平与更积极的效果相关。因此,恢复肿瘤中cgas途径的水平可能有助于通过与sting相关的途径抑制肿瘤细胞生长。
当评价患有癌症的患者组或者同时包括癌症患者和正常患者的受试者组中的cgas水平时,降低的cgas表达水平可以在较低的约75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%、15%或10%的患者中。75%患者具有较低表达的cgas水平将被设定为一个标准,因为这种低cgas表达人群具有降低的存活率。
至少在以下癌症类型中证实了升高的sting表达:白血病(包括,但不限于急性骨髓性白血病、慢性骨髓性白血病和前b型急性淋巴细胞性白血病),淋巴瘤(包括,但不限于活化b细胞样弥漫性大b细胞淋巴瘤、弥漫性大b细胞淋巴瘤、滤泡淋巴瘤、间变性大细胞淋巴瘤、血管免疫母细胞性t细胞淋巴瘤、alk阳性、伯基特淋巴瘤、霍奇金淋巴瘤、结节性淋巴细胞为主型霍奇金淋巴瘤、t-细胞/组织细胞丰富的大b细胞淋巴瘤、生发中心b细胞样弥漫性大b细胞淋巴瘤),胃癌(弥漫性胃腺癌、胃肠型腺癌和胃混合腺癌),食管癌(巴雷特食管、食管鳞状细胞癌和食管腺癌),结肠直肠癌,胰腺癌,胚胎癌,混合型生殖细胞瘤,精原细胞瘤,畸胎瘤,卵黄囊瘤,睾丸畸胎瘤,甲状腺癌,肾癌,黑素瘤,成胶质细胞瘤,舌癌,乳腺癌,口腔癌,口咽癌,扁桃体癌。
b.施用剂量和途径
cgamp或cgasmp可通过多种施用途径施用给有此需要的患者。在一个实施方式中,cgamp或cgasmp可通过肠胃外施用途径施用,包括但不限于静脉内、动脉内、肌内、大脑内、脑室内(intracerebroventicular)、鞘内和皮下。在另一个实施方式中,cgamp或cgasmp可通过吸入、局部或口服提供。
cgamp或cgasmp可制备成药物制剂。在一个实施方式中,可使用无菌盐水制备药学上可接受的制剂。cgamp或cgasmp也可以制备成冻干形式,并在施用给患者之前溶解于无菌盐水中用于注射。
约0.1至约1mg/kg体重的剂量可用于治疗患者。在一些实施方式中,剂量可为约0.1mg/kg、0.5mg/kg或1.0mg/kg。
实施例
实施例1.cgamp的酶促合成和纯化
a.重组cgas的表达和纯化
人和鼠cgas(分别称为hcgas和mcgas)的cdna克隆购自openbiosystemsinc.。将hcgas和mcgas的全长和催化结构域亚克隆到带有n端6xhis然后是sumo标签的修饰pet-28(a)(novagen)载体中。将重组his6-sumo-hcgas(157-522)和his6-sumo-mcgas(142-507)在用1mm异丙基β-d-1-硫代半乳糖苷(iptg)诱导的大肠杆菌bl21(de3)中于15℃表达整夜。
离心收获细胞,并将其再悬浮于ph8.0的含有50mmtris、300mmnacl的裂解缓冲剂中。将细胞溶解产物以4000rpm离心10分钟并收集上清液。将样品以16,000rpm再离心30分钟。然后将上清液装载在ni-nta柱上,并用ph7.5的含有500mmnacl、20mmtris、25mm咪唑的缓冲剂洗涤。蛋白质用ph7.6的含有约250mm咪唑、150mmnacl、20mmtris-hcl的缓冲剂洗脱。汇集含有cgas的部分,并向样品中加入5mmdtt。sumo标签用sumo蛋白酶切割过夜。通过sds-page分析样品以证实切割完成。将切割后的cgas样品使用superdex200(16×60)柱(gehealthcare)再次浓缩并纯化,对于人cgas可用ph7.5的含有20mmtris-hc1、500mmnacl的缓冲剂洗脱柱,对于小鼠cgas可用ph7.5的含有20mmtris-hcl、150mmnacl的缓冲剂洗脱。来自凝胶过滤柱的部分通过sds-page分析,汇集含有cgas的部分,并向样品中加入5mmβ-巯基乙醇。将经纯化的cgas浓缩至约15mg/ml,等分,在液氮中冷冻,并储存在-80℃。重组酶的产率为每升细菌培养物约4mg。这些酶用于cgamp的生物合成。
b.cgamp的酶促合成和纯化
用于生物合成cgamp的反应混合物含有10μm重组cgas、0.2mg/ml鲑鱼精子dna、5mmatp、5mmgtp、5mmmgcl2、ph7.5的20mmhepes缓冲剂、150mmnacl和10mmβ-巯基乙醇。将混合物在37℃下培养12小时,直到atp和gtp的底物被耗尽。使用monoq柱(gehealthcare)通过离子交换色谱法分析样品以证实cgamp的形成。然后通过以4000xg离心15分钟将样品澄清,以除去反应期间形成的不溶性沉淀物。使用具有10kd孔径的离心过滤器(millipore)通过超滤从反应产物中分离出酶和dsdna。使用qsepharose柱通过离子交换色谱法进一步纯化cgamp(图2)。在用0.1m乙酸铵溶液洗涤后,用含有0.3m乙酸铵的溶液从柱洗脱cgamp。将洗脱的cgamp冻干并储存在-80℃。在最佳反应条件下,超过80%的atp和gtp转化为cgamp。对于每毫克所用重组cgas,cgamp的产率为约5mg。该方案已经被常规地用于在实验室中以50-100mg规模合成cgamp,并且可以根据不同需要扩展到更大规模。
实施例2.cgamp刺激ifn-β和其它细胞因子的表达
a.cgamp诱导细胞和小鼠中的ifn-β表达
为证实cgamp可诱导ifn-β的表达,我们用加入到培养基中的cgamp和其他三种环状二核苷酸刺激人单核细胞thp1蓝细胞。我们观察到cgamp在诱导ifn-β报告的表达方面非常有效(图3a)。相比之下,3′,5′cgamp具有较低的活性(图3a)。环状di-amp和c-di-gmp表现出甚至更低的活性(图3a)。为了证实这些结果,我们通过elisa分析培养上清液中的ifn-β水平。我们观察到thp1细胞对cgamp的快速响应。ifn-β的诱导在刺激后8-10小时达到峰值(图3b)。相比之下,对3′,5′cgamp的响应要弱得多(图3b)。此外,我们分析了小鼠中cgamp对ifn-β的诱导。我们观察到在以100μg/小鼠的剂量静脉内(i.v.)注射cgamp(图3c)后,小鼠中的快速响应。
b.cgamp上调广谱的细胞因子和趋化因子
作为先天免疫的新型第二信使,只知道cgamp刺激i型干扰素的表达。我们的nf-κb报道检测显示cgamp或cgas的过度表达也刺激nf-κb的活化。可能地,通过cgamp刺激sting也可调节其他细胞因子或趋化因子的诱导。实际上,我们通过多重细胞因子检测观察到thp1细胞中cgamp对il-8、tnf-α、groa、ip-10、mcp-1、mcp-2和rantes的上调(图4)。然而,cgamp不会上调il-iβ的表达,il-iβ是主要的炎性细胞因子。
为了研究cgamp对全基因组基因表达的影响,我们在用20μg/mlcgamp治疗4小时和8小时后进行thp1细胞的微阵列分析。这些微阵列数据显示,cgamp上调超过200个基因,其中许多是干扰素诱导基因和各种细胞因子基因(图5)。
实施例3.cgamp的抗肿瘤活性
a.cgamp的抗肿瘤活性
首先,我们通过等温滴定量热法(itc)证实了cgamp和人sting之间的结合相互作用。配体结合研究表明,cgamp以约60nm的亲和力结合人sting,这是其对细菌环状二核苷酸c-di-gmp的结合亲和力的50倍。接下来,我们使用酶促合成的cgamp进行nci60抗肿瘤筛选。在测试的六十个人类癌细胞系(nci60)中,单剂量的10μmcgamp有效抑制cns癌细胞系sf539、肾癌细胞系a498和白血病细胞系sr的生长;然而,仅测试了一个浓度,并且初始测试选择的浓度可能太低。预期更高的剂量将在更多数量的测试细胞系中提供有益的结果。
所测试的细胞系是:nsclc_ncih23、nsclc_ncih522、nsclc_a549atcc、nsclc_ekvx、nsclc_ncih226、nsclc_ncih332m、nsclc_h460、nsclc_hop62、nsclc_hop92、colon_ht29、colon_hcc-2998、colon_hct116、colon_sw620、colon_colo205、colon_hct15、colon_km12、breast_mcf7、breast_mcf7adrr、breast_mdamb231、breast_hs578t、breast_mdamb435、breast_mdn、breast_bt549、breast_t47d、ovar_ovcar3、ovar_ovcar4、ovar_ovcar5、ovar_ovcar8、ovar_igrovl、ovar_skov3、leuk_ccrfcem、leuk_k562、leuk_molt4、leuk_hl60、leuk_rpmi8266、leuk_sr、renal_uo31、renal_sn12c、renal_a498、renal_caki1、renal_rxf393、renal_7860、renal_achn、renal_tk10、melan_loximvi、melan_malme3m、melan_skmel2、melan_skmel5、melan_skmel28、melan_m14、melan_uacc62、melan_uacc257、prostate_pc3、prostate_du145、cns_snb19、cns_snb75、cns_u251、cns_sf268、cns_sf295和cns_sf539。
我们重现了nci60筛选结果,并证实了cgamp在三种癌细胞系中的抗肿瘤活性。在这些研究中,使用来自相同类型组织的三个不响应的肿瘤细胞系作为对照。在验证了nci60筛选的数据后,我们对这三种肿瘤细胞系和三种对照细胞系进行了mtt检测,并观察到相似的结果(图6和8a)。这些结果清楚地表明,cgamp对某些类型的人类肿瘤细胞具有直接的肿瘤抑制活性。
b.cgamp诱导肿瘤细胞中ifn-β的表达
为了检查sting介导的信号传导在cgamp的抗肿瘤活性中是否发挥作用,我们分析了可用于nci60细胞系的微阵列数据。我们发现响应cgamp的三种细胞系表达较高水平的sting,而对照细胞系表达较低水平的sting。来自nci的60个细胞系的微阵列数据显示与我们使用的无响应对照细胞系相比,cgamp响应性肿瘤细胞系中sting的水平较高。这表明sting介导的信号传导可能在cgamp的抗肿瘤活性中起关键作用。与这些观察结果一致,我们观察到在两种响应性细胞系中cgamp诱导的ifn-β(图7)。相比之下,在测试的两个对照细胞系中ifn-β的诱导相当低(图7)。这些数据表明cgamp/sting途径可能参与cgamp的抗肿瘤活性。
为了检测cgamp诱导的ifn-β是否介导抑制肿瘤生长,我们用单独的cgamp或ifn-β治疗了三种肿瘤细胞系。我们观察到ifn-β抑制了两种肿瘤细胞系的生长,并且在所测试的浓度下几乎与cgamp一样有效。然而,白血病细胞系sr对cgamp治疗有强烈响应(图8a),但对ifn-β治疗没有很好的响应(图8b)。对照白血病细胞系ccrf-cem也没有对cgamp或ifn-β的治疗作出响应(图8b)。这些数据表明,虽然ifn-β在cgamp的肿瘤抑制中起关键作用,但cgamp诱导的其他因子也在某些类型的癌细胞的肿瘤抑制中起重要作用。
实施例4.识别表现出升高的sting表达的癌症类型
不受理论的约束,我们认为cgamp通过sting依赖性途径来执行其抗肿瘤功能。为了支持这个看法,我们分析了某些全基因组基因表达数据库。使用许多公开存档的全基因组基因表达阵列进行分析,以检查sting基因的表达。比较人类癌症标本与正常组织。使用可从lifetechnologies、thermofisherscientific获得的
该分析的结果示于图9a-m中。在以下癌症类型中发现sting表达增加:白血病(包括,但不限于急性骨髓性白血病、慢性骨髓性白血病和前b型急性淋巴细胞性白血病),淋巴瘤(包括,但不限于活化b细胞型弥漫性大b细胞淋巴瘤、弥漫性大b细胞淋巴瘤、滤泡性淋巴瘤、间变性大细胞淋巴瘤、血管免疫母细胞性t细胞淋巴瘤、alk阳性、伯基特淋巴瘤、霍奇金淋巴瘤、结节性淋巴细胞为主型霍奇金淋巴瘤、t-细胞/组织细胞丰富的大b细胞淋巴瘤、生发中心b细胞样弥漫性大细胞淋巴瘤),胃癌(弥漫性胃腺癌、胃肠型腺癌和胃混合腺癌),食管癌(巴雷特食管、食管鳞状细胞癌和食管腺癌),结肠直肠癌,胰腺癌,胚胎癌,混合性生殖细胞瘤,精原细胞瘤,畸胎瘤,卵黄囊瘤,睾丸畸胎瘤,甲状腺癌,肾癌,黑素瘤,成胶质细胞瘤,舌癌,乳腺癌,口腔癌,口咽癌,扁桃体癌和肝硬化肝。
实施例5.癌症中降低的cgas表达的说明
以乳腺癌为例,我们已经表明,肿瘤中cgas基因的平均表达与正常组织(a)相似。与其他亚型(b)相比,her2亚型显示出显著降低的cgas表达。基于肿瘤中的cgas表达,我们将患者分为两组或三组。当评估一组患有癌症的患者或一组包括癌症患者和正常患者的受试者的cgas水平时,降低的cgas表达水平可能在较低的50%、45%、40%、35%、30%、25%、20%、15%或10%的患者中。具有高cgas表达的较高的75%的患者具有改善的无复发生存率,较低的25%具有最差的结果(c)。luminala和b亚型均为雌激素受体阳性(er+)和低级别,luminala肿瘤生长非常缓慢,luminalb肿瘤生长更具侵袭性。侵袭性luminalb亚型是异质和复杂的疾病,并且经常发展对现有疗法的抵抗。亚型b中较高的25%的患者的高cgas表达显示增加的无复发存活(d)的明显益处。该结果表明肿瘤具有异质表达模式。
恢复肿瘤中cgas的水平可能有助于通过sting依赖性途径抑制肿瘤细胞生长。因此,降低的cgas表达和/或升高的sting表达可以帮助患者选择。
实施例6.人类乳房标本染色
来自正常患者的乳腺组织和乳腺癌组织用抗cgas抗体染色以显示cgas的水平。本研究中使用的福尔马林固定的和石蜡包埋的肿瘤标本来自lipogenllc的组织库。手术前所有肿瘤均为原发性和未治疗的,具有完整的临床病理信息。肿瘤大小定义为在手术时在肿瘤标本上测量的最大肿瘤直径。检查标本的h&e染色部分,并由专家妇科病理学家确诊。所有标本都是匿名的,组织按照机构审查委员会规定收集。一些癌组织包括相邻的正常组织。
在石蜡包埋的组织块上进行srebp1的ihc染色。检查苏木精和伊红(h&e)染色以确保癌组织和正常上皮细胞。在5μm厚的切片上进行cgas的ihc染色。简言之,将组织载玻片用二甲苯脱蜡并通过分级醇系列再水化。通过在3%过氧化氢溶液中培养15分钟来阻断内源性过氧化物酶活性。通过将载玻片浸入10mm柠檬酸钠缓冲剂(ph6.0)中来进行抗原修复,并将在亚沸点温度保持5分钟。将载玻片在磷酸盐缓冲剂中冲洗,并与10%正常血清一起培养以阻断非特异性染色。然后,载玻片于4℃在加湿室中与初级抗体(来自sigma的抗cgas,目录号hpa031700)培养整夜。
所有染色均由对样品来源不知情的病理学家使用半定量方法进行评估。每个标本根据核酸和细胞质染色的强度分配得分。基于阳性细胞的总百分比和染色强度(1+、2+或3+)对组织进行评分(h评分),其中h=(%x1)+(%“2+”×2)+(%“3+”×3)。在计算h评分时评估至少100个细胞。
统计分析。通过单因素方差分析(多重比较)比较乳腺癌和相邻正常组织间cgas染色强度的连续变量的方法。用mann-whitneyu测试评估乳腺癌临床病理特征与cgas染色强度的比较。所有统计测试均为双侧的,且p值小于0.05被认为具有统计学意义。统计分析使用spss13.0软件(spssinc.)进行。
由于cgas涉及生产cgamp,较低水平的cgas导致cgamp的水平较低。乳腺癌组织样本显示抗cgas抗体染色减少。参见图11a。
ccas表达量被定量,结果提供在图11b中,表明与正常的乳腺组织相比,乳腺癌中的cgas表达降低。
实施例7.cgasmp的合成和纯化
制备2′5′-cgamp的衍生物2′5′-cgasmp,并且在图12a-b中提供了两种化合物的化学结构。cgasmp可使用与实施例1中针对cgamp所述的类似方案从atp硫代磷酸酯和gtp合成。底物(atp硫代磷酸酯和gtp)的浓度用于cgasmp合成为1mm,从用于合成cgamp的方案改进以提高cgasmp的产率;然而,与现有方案相比,cgas浓度没有变化。cgasmp的活性立体异构体的纯化通过一个额外的纯化步骤实现,即使用乙酸铵溶液(0.05m)洗脱的superdex肽柱的凝胶过滤色谱法步骤。凝胶过滤色谱法显示纯化的cgasmp立体异构体结合sting,而cgasmp的另一种立体异构体不结合sting。因此,cgasmp可作为外消旋混合物使用,或者活性立体异构体可单独使用。
实施例8.cgasmp在诱导ifn-β表达方面比cgamp更有效
图13a-b显示,cgamp和cgasmp均可诱导thp1细胞中的ifn-ββ产生,但是cgasmp(cgamp的硫代磷酸酯衍生物)具有增强的效力。用5和25μg/ml的cgamp和cgasmp治疗的thp1细胞的ifn-βelisa显示cgasmp可诱导5-10倍高的ifn-β水平(图13a)。与这些结果一致,我们还观察到在用0.2至25μg/ml的cgamp和cgasmp处理的thp1细胞中诱导ifn-β报告基因的表达时,cgasmp比cgamp更有效(图13b)。
实施例9.cgamp和cgasmp的抗肿瘤活性
使用mtt检测以显示cgamp和cgasmp都具有抗癌活性。
a.mtt检测中使用的试剂
mtt溶液:pbs中的5mg/ml噻唑蓝溴化四唑(mtt)。加入mtt后将溶液过滤灭菌,储存于-20℃;mtt溶剂:4mmhcl、0.1%nondetp-40(np40)的异丙醇。cgamp或cgasmp溶液:pbs中含10-30mg/ml,使用0.2μm过滤器过滤灭菌。
b.对于附着癌细胞系sf539、u251、a498和achn的mtt检测
在第一天,将一个t-25烧瓶进行胰蛋白酶化,并向细胞中加入5ml完全培养基。将细胞和培养基在无菌15ml离心管中以300xgrcf在浮桶式转头中离心5分钟。去除培养基,将细胞再悬浮于1.0ml完全rpmi1640培养基中。计数每毫升的细胞并记录。用完全的rpmi培养基将细胞稀释(cv=cv)至每毫升75,000个细胞。将100μl细胞(7500个总细胞)加入到96孔板的每个孔中并培养整夜。24小时后,向每个孔中加入100μl培养基或cgamp或cgasmp溶液。在第五天,向每个孔中加入5mg/ml的mtt20μl。一组含有mtt但没有细胞的孔作为对照。所有步骤都是无菌完成。将孔在co2培养箱中于37℃下培养3.5小时。移出培养基,注意不要打扰细胞。不进行pbs冲洗。加入150μlmtt溶剂。用箔覆盖板,并在轨道振荡器上搅拌细胞15分钟。使用平板读数器在590nm处测量吸光度。每次检测重复5次。
c.非附着癌细胞系sr或ccrf-cem的mtt检测
将细胞在无菌15ml离心管中以300xgrcf在浮桶式转头中离心5分钟。取出培养基,将细胞再悬浮于1.0ml完全rpmi1640培养基中。计数每毫升的细胞并记录。用完全培养基将细胞稀释(cv=cv)至每毫升100,000个细胞。将100μl细胞(10000个总细胞)加入到96孔板的每个孔中并培养整夜。24小时后,向每个孔中加入100μl培养基或cgamp或cgasmp溶液。在第五天,向每个孔中加入20μl5mg/ml的mtt。一组含有mtt但没有细胞的孔作为对照。将孔在co2培养箱中于37℃下培养3.5小时。从每个孔中取出150μl培养基,注意不要打扰细胞。不进行pbs冲洗。加入150μlmtt溶剂。仅在需要时,才需要上下移液以完全溶解mtt甲瓒晶体。用箔覆盖板,并在轨道振荡器上搅拌细胞15分钟。使用平板读数器在590nm处测量吸光度。每次检测重复5次。
图14a显示用cgamp和cgasmp治疗的神经元癌细胞系sf539的mtt治疗结果。图14b显示了用cgamp和cgasmp治疗的白血病细胞系sr的mtt检测中的结果。这些图表明,cgamp和cgasmp都在评估的神经元和白血病细胞系中具有抗肿瘤活性,并且cgasmp在较低浓度下对细胞活性的影响一般较大。
实施例10.cgamp抑制体内肿瘤生长
a.结肠癌模型的体内评估
通过皮下注射分别在5-6周龄的balb/c和c57b/j小鼠的两侧植入结肠癌ct26和mc38细胞。植入结肠癌细胞后14天开始治疗,并对具有100-200mm3大小的肿瘤的小鼠进行治疗。通过每天一次肿瘤内注射4mg/kg的浓度施用cgamp,持续连续三天。治疗期后,测量肿瘤生长7天,且每隔一天测量肿瘤大小的倍数变化。图15a(结肠癌ct26细胞植入balb/c小鼠)和图15b(结肠癌mc38细胞植入c57b/j小鼠)中显示了后处理第7天的结果。体内实验结果表明,cgamp施用有效减少肿瘤生长。
b.乳腺癌模型的体内评估
通过皮下注射在5-6周龄的balb/cnu/nu小鼠的两侧植入乳腺癌mda-mb-231细胞。监测肿瘤生长14天,并使用连续卡尺测量检查生长速率。使用方程(axb2)/2计算肿瘤体积,其中“a”和“b”分别是肿瘤的长度和宽度。植入乳腺癌细胞后第14天开始治疗。当肿瘤生长至100-200mm3时,连续七天以10mg/kg的浓度施用cgamp。治疗期后,测量肿瘤生长7天,并且每隔一天测定肿瘤大小的倍数变化。图15c显示了后处理第7天的结果。体内实验结果表明,cgamp施用有效减少肿瘤生长,p值为0.0058。
c.乳腺癌模型的体内评估
mmtv-balb-neut小鼠构成了大鼠her-2/neu乳腺癌的侵袭性模型,为自发性乳腺癌提供了有效的模型。这些小鼠在小鼠乳腺肿瘤病毒启动子/增强子的转录控制下表达未活化的neu。在约8个月肿瘤达到200mm3时,根据肿瘤大小对小鼠进行分组。通过每天一次肿瘤内注射连续三天,以每只小鼠0.1mg的浓度施用cgamp。在载体(veh.)和cgamp治疗之间进行比较。监测肿瘤生长4天,并使用连续卡尺测量检查生长速率。使用方程(axb2)/2计算肿瘤体积,其中″a”和“b”分别是肿瘤的长度和宽度。实验完成后,切除肿瘤,分析肿瘤体积差异的统计学意义。图15d显示后处理第4天的结果。这些体内结果表明,cgamp施用对于减少肿瘤生长和减少肿瘤尺寸都有效,p值为0.0009。
实施例11.其它实施方式
其它实施方式可在以下编号的项目中找到。
项目1.治疗患者癌症的方法,包括向患有癌症的患者施用cgamp或cgasmp并允许cgamp或cgasmp治疗癌症。
项目2.抑制癌症细胞生长的方法,包括:
a.提供癌细胞群;
b.将癌细胞暴露于cgamp或cgasmp;和
c.允许cgamp或cgasmp抑制癌细胞的生长。
项目3.根据项目1-2中任一项所述的方法,其中癌症中的sting表达水平比正常细胞中的平均水平高约1、1.2、1.25、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.25、2.5、2.75、3.0、3.25、3.5、3.75、4.0、4.25或4.5倍。
项目4.根据项目1-3中任一项所述的方法,其中当评估患者组的cgas水平时,cgas表达水平在较低的50%、45%、40%、35%、30%、25%、20%、15%或10%的患者中。
项目5.根据项目1-4中任一项所述的方法,其中患者组仅是癌症患者。
项目6.根据项目1-5中任一项所述的方法,其中患者组是癌症患者和正常患者两者。
项目7.根据项目1-6中任一项所述的方法,其中癌症为cns癌、肾癌或淋巴瘤。
项目8.根据项目7所述的方法,其中cns癌为成胶质细胞瘤。
项目9.根据项目7所述的方法,其中肾癌为肾脏肿瘤。
项目10.根据项目1-6中任一项所述的方法,其中癌症为白血病(包括,但不限于急性骨髓性白血病、慢性骨髓性白血病和前b型急性淋巴细胞性白血病),淋巴瘤(包括,但不限于活化b细胞样弥漫性大b细胞淋巴瘤、弥漫性大b细胞淋巴瘤、滤泡性淋巴瘤、间变性大细胞淋巴瘤、血管免疫母细胞性t细胞淋巴瘤、alk阳性、伯基特淋巴瘤、霍奇金淋巴瘤、结节性淋巴细胞为主型霍奇金淋巴瘤、t-细胞/组织细胞丰富的大b细胞淋巴瘤、生发中心b细胞样弥漫性大b细胞淋巴瘤),胃癌(弥漫性胃腺癌、胃肠型腺癌和胃混合腺癌),食管癌(巴雷特食管、食管鳞状细胞癌和食管腺癌),结肠直肠癌,胰腺癌,胚胎癌,混合性生殖细胞瘤,精原细胞瘤,畸胎瘤,卵黄囊瘤,睾丸畸胎瘤,甲状腺癌,肾癌,黑素瘤,成胶质细胞瘤,舌癌,乳腺癌,口腔癌,口咽癌和扁桃体癌。
项目11.根据项目1-10中任一项所述的方法,其中癌症细胞离体筛选以确定cgamp或cgasmp是否会抑制癌症细胞的生长。
项目12.根据项目1-11中任一项所述的方法,其中在cgamp或cgasmp施用于患者之前,离体筛选癌症细胞以确定cgamp或cgasmp是否将诱导ifn-β的表达。
项目13.根据项目1-12中任一项所述的方法,其中所述方法包括向患者施用0.1至1mg/kg的cgamp或cgasmp。
项目14.酶促合成cgamp或cgasmp的方法,包括:
a.提供重组cgas;和
b.将cgas与atp或atp硫代磷酸酯、gtp和dsdna结合以合成cgamp或cgasmp。
项目15.根据项目14所述的方法,其中在合成方法中使用修饰性核苷酸。
项目16.根据项目14-15中任一项所述的方法,其中合成可以在单罐中进行。
项目17.根据项目14-16中任一项所述的方法,其中合成可以在单一步骤中进行。
项目18.纯化cgamp或cgasmp的方法,包括:
a.提供cgamp或cgasmp与选自dsdna和cgas的至少一种其它化合物的混合物;
b.通过超滤将cgamp或cgasmp与dsdna和cgas分离;
c.使用离子交换色谱法纯化cgamp或cgasmp;和
d.通过冻干法从cgamp或cgasmp中除去盐。
项目19.酶促合成和纯化cgamp或cgasmp的方法,包括:
a.提供重组cgas;
b.将cgas与atp或atp硫代磷酸酯、gtp和dsdna结合以合成cgamp;
c.通过超滤将cgamp或cgasmp与dsdna和cgas分离;
d.使用离子交换色谱法和任选的凝胶过滤色谱法纯化cgamp或cgasmp;和
e.通过冻干法从cgamp或cgasmp中除去盐。
项目20.根据项目14-17或19中任一项所述的方法,其中cgas与atp或atp硫代磷酸酯和gtp在减少非特异性相互作用的成分的存在下结合。
项目21.根据项目20所述的方法,其中减少非特异性相互作用的成分是鲑鱼精子dna。
项目22.根据项目14-17或19-21中任一项所述的方法,其中cgas与atp和gtp在至少一种缓冲剂、盐和/或抗氧化剂的存在下结合。
项目23.根据项目22所述的方法,其中至少一种缓冲剂是hepes缓冲剂。
项目24.根据项目22-23中任一项所述的方法,其中至少一种盐是mgcl2和/或nacl。
项目25.根据项目22-24中任一项所述的方法,其中至少一种抗氧化剂是β-巯基乙醇。
项目26.根据项目18-25中任一项所述的方法,其中沉淀物通过以4000xg离心15分钟除去。
项目27.根据项目18-26中任一项所述的方法,其中超滤通过具有10kd孔径的超滤过滤器发生。
项目28.根据项目18-27中任一项所述的方法,其中离子交换色谱法采用qsepharose柱。
项目29.根据项目18-28中任一项所述的方法,其中qsepharose柱用含有乙酸铵的挥发性盐缓冲剂洗脱。
等同物
认为上述书面说明书足以使本领域技术人员能够实施实施方式。上述描述和实施例详细说明了某些实施方式并描述了本发明人预期的最佳模式。然而,应当理解,无论前述内容在文中如何详细地描述,实施方式可以以许多方式实施,并且应当根据所附权利要求及其任何等同物来解释。
如本文所使用的,术语“约”是指数值,包括例如整数、分数和百分比,无论是否明确指出。术语“一般地”是指本领域普通技术人员将认为等同于所列举的值的数值范围(例如,所述范围的+/-5-10%)(例如,具有相同的功能或结果)。在某些情况下,术语“约”可以包括四舍五入到最接近的有效数字的数值。
- 还没有人留言评论。精彩留言会获得点赞!