一种高效紫萍遗传转化技术的制作方法
[0001]
本发明涉及植物愈伤组织再生的技术,特别是一种高效紫萍遗传转化技术。
背景技术:
[0002]
紫萍(spirodela polyrhiza)是浮萍科(1emnaceae)多根紫萍属(spirodela)水生漂浮植物,是最小的开花植物之一。紫萍个体小、结构简单,仅由叶状体和根系组成;无性繁殖速度快,2~3 天可增殖一代。浮萍家族中只有紫萍完成了全基因组测序,紫萍作为植物表达系统具有潜在的研究和应用价值。
[0003]
从进化关系上来说,紫萍是浮萍科中最原始的类型,其基因组也比其他浮萍科植物小,并且具有最紧凑的单子叶植物线粒体基因组,也是浮萍家族中唯一完成全基因组测序工作的品系(accession:prjn a46611),紫萍的线粒体基因组也完成了测序工作,遗传背景清晰,有利于后续分子水平的研究工作。相较于青萍属,紫萍属不存在种内变异的情况,遗传相对稳定。紫萍进行大量培养时,其个体小、整个植株漂浮于水面,易于捕捞进行数量控制。紫萍在植物生理学、遗传学、生态学等领域已在国内外展开了广泛研究,多应用于水体污染修复生物质能源利用等方面。
[0004] 近年来,浮萍科38个亚种中,受基因型的影响,只有6个种(spirodela oligorrhiza、lemna gibba、lemna minor、landoltia punctata、wolffia arrhiza、wolffia globos)建立了稳定的再生体系和遗传转化体系,且它们间的再生体系和遗传转化体系条件千差万别,已发展成为一个较好的植物表达系统,在生物制药方面表现出巨大的潜力。目前已成功商业化的两种浮萍表达体系是lemna minor和landoltia punctata,且与浮萍蛋白表达体系相关的所有专利技术都为美国synthon公司拥有,我国若想在这一领域有所突破,将只能从紫萍、无根萍和扁无根萍着手。并且中国目前缺乏自主知识产权的植物表达系统,国家科技部科技规划中建立和发展植物高效表达系统是重点研究领域,紫萍作为植物表达系统具有产量高、成本低、安全性、用途广、受益大这五大潜在优势。
[0005]
发明以紫萍叶状体愈伤组织作为外植体,建立农杆菌介导的紫萍高效遗传转化体系,为浮萍植物转基因表达系统的建立提供强有力技术支撑。
技术实现要素:
[0006]
本发明的目的是克服现有技术中尚无紫萍蛋白表达体系的技术缺陷,提供一种高效紫萍遗传转化技术。
[0007]
为实现上述技术目的,本发明提供的一种高效紫萍遗传转化技术,其特征在于包括如下步骤:1).紫萍愈伤组织诱导;2).愈伤组织生长:获得的紫萍愈伤组织置于愈伤组织生长培养基中,所述愈伤组织生长培养基为基本培养基i+2 mg/l 2,4-d+质量百分比1 % 山梨醇+ 质量百分比0.8 % 琼脂+质量百分比3 %蔗糖,生长1周后,作为农杆菌的侵染外植体;
3).农杆菌侵染后共培养:将od
600
(0.3~0.5)农杆菌菌株与紫萍愈伤组织混合,抽真空时长为13 min,压力1kg/cm2,侵染后的紫萍愈伤组织在愈伤组织生长培养基中暗培养共培养 3 天,每天在26 ℃保持16h、24 ℃保持8h;4).愈伤组织分化培养:
①
看护培养条件下选择培养:侵染后的愈伤组织在选择培养基中看护培养,所述选择培养基为超纯水+质量百分比0.8 % 琼脂+200 mg/l头孢霉素+30 mg/l潮霉素b ,在此看护培养中,光照下进行选择培养1周;
②
zt分化培养:选择培养后的紫萍愈伤组织在zt分化培养基中,所述zt分化培养基中为基本培养基ii+2 mg/l zt+ 质量百分比0.15 % 植物凝胶phytagel +质量百分比0.4 % 琼脂+200 mg/l头孢霉素+30 mg/l潮霉素b ,光照条件下,每2周继代一次,3周后形成转基因紫萍叶状体;5.紫萍叶状体扩培培养:
①
固体扩培:转基因紫萍叶状体在固体扩培培养基中扩培,所述固体扩培培养基为基本培养基ii+30 mg/l潮霉素b + 质量百分比0.15 % 植物凝胶 phytagel +质量百分比 0.4 % 琼脂+质量百分比3 % 蔗糖,光照条件下扩培筛选,第4天紫萍叶状体自愈生长出幼根,继续培养3天后将再生紫萍单叶片“克隆”的再生转基因紫萍叶状体分别继代至液体扩培培养基中;
②
液体扩培:上述再生转基因紫萍叶状体在液体扩培培养基中扩培,所述液体扩培培养基为基本培养基iii+30 mg/l潮霉素b +质量百分比1.2 % 蔗糖,连续培养 5-7天,生长旺盛的叶状体即为表达量高的再生转基因紫萍叶状体,每隔5-7天,将再生转基因紫萍叶状体在液体扩培培养基中,光照条件下继代扩大培养一次,1周后即可获得转基因植株;以上各步骤中,所述光照条件均为:光照16h/黑暗8h,光照温度26℃/黑暗温度24℃、光照强度70-80 μmol photons/m
2 /s;在所述基本培养基i中,成分组成及各成分含量为在专利zl201410534187.3中所述的紫萍诱导培养基的基础上,不含激素成分、固化剂和碳源;在所述基本培养基ii中,成分组成及各成分含量为: a).大量元素,其中含有2200 mg/l kno3、270 mg/l nh4hpo4、350 mg/l mgso4·
7h2o、160 mg/l cacl2·
2h2o;b).微量元素,其中含有15 mg/l mnso4·
4h2o、7.5 mg/l znso4·
7h2o、6.0 mg/l h3bo3、0.8 mg/l kcl、0.25 mg/l na2moo4·
7h2o、0.025 mg/l cuso4·
5h2o4、0.025 mg/l cocl2·
6h2o;c).铁盐,其中含有3.7 mg/l na
2-edta
·
2h2o和2.3 mg/l feso4.7h2o;d).有机物,其中含有1.2 mg/l甘氨酸、0.2 mg/l盐酸吡哆醇、0.05 mg/l盐酸硫铵素、0.2 mg/l烟酸、30 mg/l肌醇;所述基本培养基iii与专利zl201410534187.3中所述的紫萍生根培养基相同。
[0008]
本发明的有益效果是:
①
.转化效率高,方法简单易操作:以紫萍叶状体脱分化形成的愈伤组织作为工程农杆菌的侵染对象,采取抽真空法,侵染效率高,愈伤组织侵染成功阳性率达100 %,愈伤组织分化率达51.3 %,转基因植株生根率100 %;
②
.转基因植株再生时间短:从愈伤组织的获得、农杆菌侵染愈伤组织、农杆菌和愈伤组织共培养、愈伤组织分化为叶状体、叶状体再生根等阶段,转基因紫萍再生的时间为11-12周;
③
转基因植株遗传稳定;
④
产量高、成本低、安全性高、用途广、受益大。
附图说明
[0009]
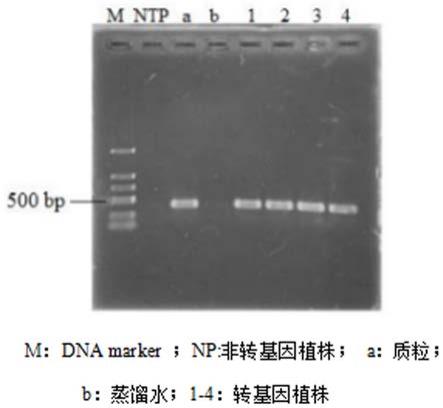
图1为愈伤组织侵染共培养3天后的gus检测结果图;图2为愈伤组织在看护培养条件下选择培养1周后的gus检测结果图;图3为野生型紫萍叶状体gus检测结果gus检测结果图;图4为转基因紫萍叶状体gus检测结果gus检测结果图;图5为抗性植株的pcr检测结果图。
具体实施方式
[0010]
为了更好地理解本发明,下面结合附图,详细描述实施例。应理解,本实施例仅用于说明本发明,而不能限制本发明的范围。
[0011]
除特别说明外,本实施例所采用的技术手段为本领域的常规技术手段。
[0012]
实施例1 本发明高效紫萍遗传转化方法1.紫萍愈伤组织诱导与生长
①
紫萍愈伤组织诱导。
[0013]
按照本申请人的专利技术(专利号,zl201410534187.3)建立的方法诱导紫萍愈伤组织:取生长旺盛的无菌紫萍植株,并对其叶片基部靠近着根处1/4处横切,将处理好的靠近根部的叶片1/4部分作为外植体,置于所述专利中紫萍诱导培养基中[即基本培养基i+1.2 mg/l naa + 1.0 mg/l ga
3 +2.5 mg/l 6-ba +3.5 mg/l 2,4-d+质量百分比0.15 % 植物凝胶(phytagel)+质量百分比0.4 % 琼脂+质量百分比3 % 蔗糖,ph=5.5],愈伤组织诱导的光照条件为:光照16h/黑暗8h,光照温度26℃/黑暗温度24℃、光照强度70-80 μmol photons/m
2 /s。(以下步骤中除暗培养外,光照培养条件均同于此条件)。
[0014]
②
.愈伤组织生长:获得的紫萍愈伤组织置于愈伤组织生长培养基中,所述愈伤组织生长培养基为基本培养基i+2 mg/l 2,4-d+质量百分比1 % 山梨醇+ 质量百分比0.8 % 琼脂+质量百分比3 %蔗糖,生长1周后,作为农杆菌的侵染外植体;2.农杆菌工程菌株的构建与培养
①
农杆菌eha105工程菌株的构建冰上融化农杆菌eha105感受态细胞(购自生工生物工程(上海)股份有限公司);加入2 μl (15 ng/μl)pcambia1305.1(购自上海联迈生物工程有限公司)的质粒dna与eha105感受态细胞混匀,冰冻30 min,液氮中冷冻1 min,然后在37 ℃水浴5 min;加入1ml无抗生素的yeb培养基,28℃,200 rpm振荡培养4h;10,000 rpm离心1 min以浓缩菌液,用100 μl yeb回溶菌体;将回溶后的菌体涂于附加50 mg /l卡那霉素(kanamycin sulfate,kana)和50 mg /l 利福平(rifampicin,rif)的固体yeb培养基上,28 ℃培养36-48 h;pcr检测阳性转化子。
[0015]
②
.农杆菌工程菌株的培养挑选上述步骤中的pcr验证过的阳性单菌落(转化了pcambia1305.1 的eha105菌株,以下简称农杆菌工程菌株),于 4 ml lb(终浓度50 mg/l 卡那霉素50 mg/l 和 50 mg/l 利福平)液体培养基,28 ℃,180 rpm 振荡培养12 h后,用接种环蘸取菌液于 lb固体培养基(含50 mg/l 卡那霉素(kana)和 50 mg/l利福平( rif)上之字型划线,培养皿倒置28 ℃培养36-48 h。挑取单菌落于4 ml lb(终浓度 50 mg/l kana 和 50 mg/l rif)液体培养基在28 ℃,180 rpm的条件下,振荡培养12-16 h。待菌液浓度合适,按照1:10的体积比例,活化扩培农杆菌工程菌株,在含lb(含50 mg/l kana和 50 mg/l rif)液体培养基的三角瓶中,28 ℃,180 rpm 振荡培养 4
ꢀ-
6h,至 0d
600
值为 0.4-0.6。即取上述菌液于4 ℃、5000 r / min 条件下离心10 min,弃上清液, 1/10 ms 重新悬浮并菌体后4 ℃、5000 r / min 条件下离心10 min,再用 1/10 ms 溶液重新悬浮菌体,保持0d600 值为 0.3-0.5,并添加终浓度为 100
ꢀµ
m 的as于菌体中,常温静置20 min。
[0016] 1/10 ms溶液配制:大量元素为ms的1/10,微量元素、有机物、铁盐与ms培养基中的量相同。
[0017]
3.农杆菌侵染愈伤组织挑选在愈伤组织生长培养基条件下继代生长了1周、健康、浅绿色、松散的愈伤组织(3周年龄的愈伤组织),剔除愈伤组织周围非愈伤组织。农杆菌工程菌株用1/10 ms液体培养基悬浮,od
600
值调至 0.3-.05,将愈伤组织和农杆菌工程菌株混合,抽真空时长为13 min,压力1kg/cm2。后用无菌滤纸吸干愈伤组织表面的农杆菌液体,将愈伤组织置于两张滤纸中间静置1-3 m备用。
[0018]
4.黑暗条件下共培养将上述步骤中工程农杆菌浸染过的紫萍愈伤组织置于已涂布了乙酰丁香酮(acetosyringone,as,100 μm)且放置了两层无菌滤纸的共培养基中(基本培养基i+2 mg/l 2, 4-d+质量百分比1 %山梨醇+质量百分比 0.8 % 琼脂),后在愈伤组织表面上再盖上一层无菌滤纸,在26 ℃保持16h、24 ℃保持8h的条件下,暗培养3 天。每个处理 3 组重复,每个培养基接种 20 个侵染过的愈伤组织。农杆菌侵染率= (gus染色愈伤组织阳性个数/侵染愈伤组织总个数)
×
100 %。
[0019]
暗培养 3 天后,取部分侵染的紫萍愈伤组织,用 gus 染色液(x-gluc1 mm+triton x-100 0.1%+edta 10 mm+ph 7.0 磷酸缓冲液 100 mm)在 37 ℃下染色6
-ꢀ
12 h后,用90 %乙醇进行脱色处理2-3次2-3次,gus检测结果表明,共培养 3 天后的愈伤组织 gus 阳性率100 %,即农杆菌侵染愈伤组织的侵染率为100%(图1)。
[0020]
x-gluc母液的配制:称取25.125g x-gluc,溶于2.5 ml的n,n`-二甲基甲酰胺(dmf),得到20 mm的x-gluc母液,分装于1.5mlep管中,-20℃保存。
[0021]
gus 染色液配制:x-gluc母液用0.1% triton x-100 +10 mm edta + 100 mm磷酸缓冲液稀(ph 7.0 )+适量超纯水释至浓度为1mm ,备用。
[0022]
5.转基因紫萍植株的诱导及抗性筛选
①
看护培养条件下选择培养:暗培养3天的紫萍愈伤组织转至选择培养基(超纯水+质量百分比0.8 % 琼脂+200 mg/l头孢霉素+30 mg/l潮霉素b)中首先在光照条件下“看护培养”1周后,随机挑取一部分愈伤组织gus染色检测,剩下愈伤组织移至zt分化培养基。愈伤
组织阳性率= (gus染色愈伤组织个数/侵染愈伤组织总个数)
×
100 %。
[0023]
随机挑取的紫萍愈伤组织,用 gus 染色液在 37 ℃下染色6
-ꢀ
12 h,再用90 %乙醇进行脱色处理2-3次2-3次,gus 检测结果表明7 天抗性筛选后的愈伤组织中均有 gus 表达,gus检测染色阳性率为100 %(图2)。
[0024]
②
zt分化培养:将上述步骤中的愈伤组织继代至zt分化培养基(基本培养基ii+2 mg/l zt+ 质量百分比0.15 % 植物凝胶phytagel +质量百分比0.4 % 琼脂+200 mg/l头孢霉素+30 mg/l潮霉素b)中,光照条件下,每2周继代一次,第2周愈伤组织开始分化,形成嫩芽,第3 周开始形成比正常紫萍叶状体稍小的单片叶状体。第4周末期将单片叶状体再生的紫萍叶状体继代至固体扩培培养基中并开展gus检测。转基因植株再生率=(再分化出抗性植株的愈伤组织个数)/侵染愈伤组织总个数)
×
100 %。转基因植株的再生率为51.3 %。
[0025]
6.紫萍叶状体扩培培养6.1固体扩培:转基因紫萍叶状体在固体扩培培养基中,所述固体扩培培养基为基本培养基ii+30 mg/l潮霉素b + 质量百分比0.15 % 植物凝胶 phytagel +质量百分比 0.4 % 琼脂+质量百分比3 % 蔗糖,光照条件下扩培筛选,第4天紫萍叶状体自愈生长出幼根,继续培养3天后将再生紫萍单叶片“克隆”的再生转基因紫萍叶状体分别继代至液体扩培培养基中;6.2液体扩培:上述再生转基因紫萍叶状体在液体扩培培养基中扩培,所述液体扩培培养基为基本培养基iii+30 mg/l潮霉素b +质量百分比1.2 % 蔗糖,连续培养 5-7天,生长旺盛的叶状体即为表达量高的再生转基因紫萍叶状体,每隔5-7天,将再生转基因紫萍叶状体在液体扩培培养基中光照继代扩大培养一次,1周后即可获得转基因植株。
[0026]
7. 转基因紫萍叶状体的检测7.1转基因紫萍叶状体的gus 检测。取上述步骤(6.2)中的30 mg/l潮霉素选择压下生长的转基因紫萍叶状体,随机挑选培养10天后筛选的再生紫萍叶状体,置于 gus 染色液(1 mm x-gluc +0.1% triton x-100 +10 mm edta +100 mm磷酸缓冲液(ph 7.0))中, 37 ℃下染色6
-ꢀ
12 h后,用90 %乙醇进行脱色处理2-3次,gus 检测结果证明,野生型非转基因紫萍叶状体呈现无色(图 3),转基因紫萍gus 染色后都呈蓝色(图 4),表明抗性转基因再生紫萍叶状体中的gus染色率100 %。
[0027]
7.2转基因紫萍叶状体的 pcr 检测随机选取上述步骤(6.2)单片叶状体再生的紫萍植株,以ctab 法提取紫萍基因组dna,使用 thermo 超微量紫外分光光度计对上述提取的 dna进行浓度测定,根据测定结果将其浓度稀释至 10 ng/μl,针对载体pcambia1305.1中的kana基因设计引物,然后进行 pcr 检测,以提取的植株 dna 为模板作为检测样本,质粒作为阳性对照,非转基因紫萍和蒸馏水为阴性对照,扩增产物用1 % 琼脂糖凝胶中,电压为60v的条件下电泳40 min,凝胶成像分析仪照相保存。电泳结果表明,所有抗性转基因植株均扩增出目的大小dna条带,与质粒载体扩增出的目的条带大小一致,扩增目的片段大小与引物设计时选定的片段大小一致,证明外源目的基因已经整合到转基因植株的基因组中,转基因植株检测阳性率100 %(图5)。连续培养一年后,转基因植株检测结果与上述结果相同,表明转基因紫萍遗传表达稳定。
[0028]
本实施例建立的农杆菌介导愈伤组织的紫萍遗传转化体系紫萍再生率51.3 %,方法简单易操作,以紫萍叶状体脱分化形成的愈伤组织作为工程农杆菌的侵染对象,采取抽
真空法,侵染效率高,愈伤组织侵染成功阳性率达100 %,愈伤组织分化率达51.3 %,转基因植株生根率100 %;用时短,11-12周即可从紫萍愈伤组织诱导到获得获得转基因植株;转基因植株遗传稳定、连续继代一年以上未出现外源基因丢失现象。
[0029]
实施例2 对比实验之一紫萍愈伤组织诱导与生长方法同实施例1。
[0030]
农杆菌工程菌株的构建与培养方法同实施例1。
[0031]
农杆菌侵染愈伤组织方法同实施例1。
[0032]
黑暗条件下共培养方法同实施例1。
[0033]
5.转基因紫萍植株的诱导及抗性筛选 按照实施例1中的“看护培养”条件下进行转基因紫萍植株的诱导及抗性筛选。暗培养3天的紫萍愈伤组织转至选择培养基中,首先在光照条件下“看护培养”7天后,每2周继代一次。
[0034]
但从第3周开始愈伤组织逐渐白化枯萎死亡,第4周末,死亡率达到80 %,第四周末,未死死亡愈伤组织仅有5 %分化出紫萍叶状体。可能是在抗性选择压下,非侵染愈伤组织大量死亡,未能及时向已侵染的愈伤组织提供足够营养物质,导致愈伤组织营养缺乏,未死亡愈伤组织分化为紫萍叶状体数量有限所致。
[0035]
6. 紫萍叶状体扩培培养:方法同实施例1。
[0036]
7. 转基因紫萍叶状体的检测7.1 gus检测(方法同实施例1)。gus 检测结果表明,再生植株gus阳性率为100 %。
[0037]
7.2转基因紫萍叶状体的 pcr 检测(方法同实施例1)。再生紫萍叶状体pcr阳性率为100%。
[0038]
这表明愈伤组织在抗性条件筛选下,转基因植物再生率为1 %。
[0039]
实施例3 对比实验之一1.紫萍愈伤组织诱导与生长:方法同实施例1。
[0040]
2.农杆菌工程菌株的构建与培养:方法同实施例1。
[0041]
3.农杆菌侵染愈伤组织:方法同实施例1。
[0042]
4.黑暗条件下共培养:方法同实施例1。
[0043]
5转基因紫萍植株的诱导及抗性筛选按照实施例1中的 zt分化培养基条件下转基因紫萍植株的诱导及抗性筛选。暗培养了3天的紫萍愈伤组织继代至zt分化培养基中,光照条件下培养,每2周继代一次。第3周愈伤组织开始分化,形成嫩芽,第4周开始形成比正常紫萍叶状体稍小的单片叶状体,第4周末愈伤组织仅有5.1%再生分化出紫萍叶状体。
[0044]
6.紫萍叶状体扩培培养:方法同实施例1。
[0045]
7. 转基因紫萍叶状体的检测7.1 gus检测方法(方法同实施例1)。gus 检测结果表明,再生植株gus阳性率为100 %。
[0046]
7.2转基因紫萍叶状体的 pcr 检测(方法同实施例1)再生紫萍叶状体pcr阳性率为100%。
[0047]
这表明愈伤组织在抗性条件筛选下,转基因植物再生率为5.1%。
[0048]
由实施例2和实施例3的结果表明,在转基因紫萍植株的诱导及抗性筛选步骤,如果只是单独采取看护培养或zt分化培养,转基因植物再生率低下;而本申请中,在转基因紫萍植株的诱导及抗性筛选步骤,将看护培养和zt分化培养结合起来,愈伤组织分化培养后,获得的转基因植株效率高,转基因植物再生率高。
[0049]
实施例4 对比实验之三1.紫萍愈伤组织诱导与生长:方法同实施例1。
[0050]
2.农杆菌工程菌株的构建与培养:方法同实施例1。
[0051]
3. 农杆菌侵染愈伤组织(震荡法浸染)。
[0052]
挑选继代后在愈伤组织生长培养基中生长了1周、健康、浅绿色、松散的愈伤组织(3周年龄的愈伤组织),剔除愈伤组织周围非愈伤组织。农杆菌工程菌株用1/10 ms液体培养基悬浮,od
600
值调至 0.3-.05,将愈伤组织和农杆菌工程菌株混合,在80-10 0 rpm,28 ℃条件下,震荡时间设置为25、30、35m。
[0053]
4.黑暗条件下共培养:方法同实施例1。
[0054]
暗培养3天后,震荡侵染25m的愈伤组织gus瞬时检测结果表明,农杆菌侵染愈伤组织侵染率26 %,震荡侵染30 m和35m的愈伤组织,农杆菌侵染愈伤组织侵染率与震荡时间25m愈伤组织的结果基本一致。
[0055]
5转基因紫萍植株的诱导及抗性筛选:方法同实施例1。
[0056]
抗性筛选后的第4周末,愈伤组织仅有4.2 % 再生分化出紫萍叶状体。
[0057]
6. 紫萍叶状体扩培培养:方法同实施例1。
[0058]
7. 转基因紫萍叶状体的检测7.1 gus检测方法(方法同实施例1)。gus 检测结果表明,再生植株gus阳性率为100 %。
[0059]
7.2转基因紫萍叶状体的 pcr 检测(方法同实施例1)。再生紫萍叶状体pcr阳性率为100 %。
[0060]
这表明震荡侵染25 m的愈伤组织在抗性条件筛选下,转基因植物再生率为4.2 %。震荡侵染30和35 m的愈伤组织在抗性条件筛选下,其分化为转基因植物的再生率均保持在4.2 %左右。
[0061]
实施例5 对比实验之四1.紫萍愈伤组织诱导与生长:方法同实施例1。
[0062]
2.农杆菌工程菌株的构建与培养:方法同实施例1。
[0063]
3.农杆菌侵染愈伤组织(震荡法浸染+抽真空)。
[0064]
挑选继代后在愈伤组织生长培养基中生长了1周、健康、浅绿色、松散的愈伤组织(3周年龄的愈伤组织),剔除愈伤组织周围非愈伤组织。农杆菌工程菌株用1/10 ms液体培养基悬浮,od
600
值调至 0.3-0.5,将愈伤组织和的农杆菌工程菌株混合,在2 ml ep管中,80-10 0 rpm, 28 ℃震荡25 m后,抽真空,时长为10 min,压力 0.8 kg/cm24.黑暗条件下共培养:方法同实施例1。
[0065]
5.转基因紫萍植株的诱导及抗性筛选:方法同实施例1。
[0066]
抗性筛选后的第4周末,愈伤组织仅有2.2% 再生分化出紫萍叶状体。抗性筛选后的第2周,愈伤组织逐渐白化枯萎死亡,第4周末,死亡率达到30-40 %,第四周末,未死亡愈伤组织仅有3.9 %分化出紫萍叶状体。可能是震荡法浸染+抽真空侵染两者加起来的时间35m,时间过长,导致农杆菌过度侵染愈伤组织,使得愈伤组织受到农杆菌和抽真空的过度伤害,造成30-40 %愈伤组织死亡。
[0067]
6. 紫萍叶状体扩培培养:方法同实施例1。
[0068]
7. 转基因紫萍叶状体的检测7.1 gus检测方法(方法同实施例1)。gus 检测结果表明,再生植株gus阳性率为100 %。
[0069]
7.2转基因紫萍叶状体的 pcr 检测(方法同实施例1)。再生紫萍叶状体pcr阳性率为100 %。
[0070]
这表明愈伤组织在抗性条件筛选下,转基因植物再生率为2.2 %。
[0071]
实施例6 对比实验之五1.紫萍愈伤组织诱导与生长:方法同实施例1。
[0072]
2.农杆菌工程菌株的构建与培养:方法同实施例1。
[0073]
3.农杆菌侵染愈伤组织挑选继代后在愈伤组织生长培养基中生长了1周、健康、浅绿色、松散的愈伤组织(3周年龄的愈伤组织),剔除愈伤组织周围非愈伤组织。农杆菌工程菌株用1/10 ms液体培养基悬浮,od600值调至 0.3-.05,将愈伤组织和的农杆菌工程菌株混合,在2 ml ep管中,抽真空时长为10 min,压力 0.8 kg/cm2。
[0074]
4.黑暗条件下共培养:方法同实施例1。
[0075]
5.转基因紫萍植株的诱导及抗性筛选:方法同实施例1。
[0076]
抗性筛选后的第4周末,愈伤组织仅有8.2% 再生分化出紫萍叶状体。
[0077]
6. 紫萍叶状体扩培培养:方法同实施例1。
[0078]
7. 转基因紫萍叶状体的检测7.1 gus检测方法(方法同实施例1)。gus 检测结果表明,再生植株gus阳性率为100 %。
[0079]
7.2转基因紫萍叶状体的 pcr 检测(方法同实施例1)。再生紫萍叶状体pcr阳性率为100%。
[0080]
这表明愈伤组织在抗性条件筛选下,转基因植物再生率为8.2 %。
[0081]
实施例4-6的结果表明,抽真空的时间和压力对农杆菌侵染愈伤组织成功率影响十分巨大,本申请方法中的抽真空(抽真空时长为13 min,压力1kg/cm2)条件是更高效的。
[0082]
上述实施例中,所述基本培养基i的成分组成及各成分含量为在专利zl201410534187.3中所述的紫萍诱导培养基的基础上,不含激素成分、固化剂和碳源;所述基本培养基ii的成分组成及各成分含量为: a).大量元素,其中含有2200 mg/l kno3、270 mg/l nh4hpo4、350 mg/l mgso4·
7h2o、160 mg/l cacl2·
2h2o;b).微量元素,其中含有15 mg/l mnso4·
4h2o、7.5 mg/l znso4·
7h2o、6.0 mg/l h3bo3、0.8 mg/l kcl、0.25 mg/l na2moo4·
7h2o、0.025 mg/l cuso4·
5h2o、0.025 mg/l cocl2·
6h2o;c).铁盐,其中含有3.7 mg/l na
2-edta
·
2h2o和2.3 mg/l feso4.7h2o;
d).有机物,其中含有1.2 mg/l甘氨酸、0.2 mg/l盐酸吡哆醇、0.05 mg/l盐酸硫铵素、0.2 mg/l烟酸、30 mg/l肌醇;所述基本培养基iii与专利zl201410534187.3中所述的紫萍生根培养基相同;上述各培养基中铁盐配制方法与专利zl201410534187.3相同。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1