一种光感受器神经元细胞的化学诱导方法与流程
本发明属于生物领域。具体涉及光感受器神经元细胞的化学诱导及培养方法、培养基及其在多种疾病中的应用。
背景技术:
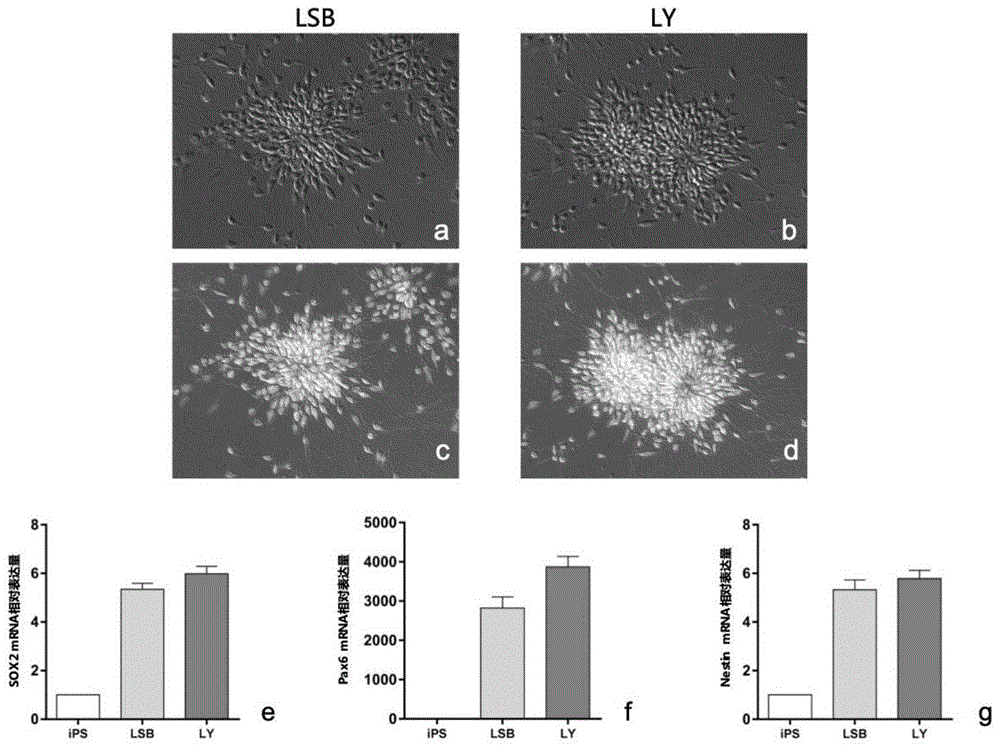
:外胚层是胚胎发育过程中形成的最外层,随着器官发生的开始,外胚层细胞逐渐分化为大脑、脊髓、感觉器官等重要的系统。其中神经系统是负责思维、情感、感知、运动等功能的重要系统。相比于肿瘤等疾病,目前神经系统疾病的药物数量较少,且研发周期漫长,其中最为重要的一个原因是外胚层谱系中多种原代细胞的特殊性,例如原代神经元的不可再生性导致了神经系统药物体外药物筛选平台的稀缺。外胚层细胞的体外再生能解决多种退行性疾病,例如神经退行性疾病是目前常见的老龄化疾病,治疗及护理费用极其昂贵,而且市面上无特效药物可以进行有效的治疗。神经退行性疾病包括肌萎缩侧索硬化症(als)、帕金森病(pd)、阿尔茨海默症(ad)等疾病。世界卫生组织统计,2050年我国神经退行性疾病患者将超过3000万,预期医疗费用将超过1万亿。此类疾病的治疗难点在于中枢神经系统的神经细胞具有不可再生性,而这类疾病是由于中枢神经的不可逆损伤造成。目前,神经细胞的移植是最为有效的一种治疗方式。视觉神经的退行性疾病也是其中的一大类疾病。以与年龄相关的黄斑变性(amd)为例,它是50岁以上人群视力受损的主要原因,其特征是视网膜退化,可导致中央视力丧失。此外,色素变性这种罕见遗传性疾病,其特征是视网膜中的光感受器逐渐退化,无法将光信号转换成向大脑的电信号。视网膜是高等动物体中能够感受“影像”的重要组织,由光敏细胞和光感受器组成。光感受器能将影像的光信号转变为神经信号,是能让大脑“看见”影像的重要细胞。这其中,锥形受体细胞即视锥细胞负责我们的日间视觉及颜色的感知,视杆细胞,则更为敏感,即使在低光照条件也可以感知到微弱的光。感光细胞的受损,是视网膜退行性疾病的重要成因,导致眼球无法将“影像”转化的神经信号传递到大脑,从而严重影响人的视力,甚至导致失明。更为严峻的是,光感受器神经细胞的受损是一种不可逆的过程,无法自我修复,因此此类疾病没有良好的治疗方法。部分患者采取视网膜移植方法,但视网膜资源有限,多来自于遗体捐赠,远不能满足临床需要;人工视网膜的原理是替换这些光感受器。该装置由固定在视网膜和电极化合物下的植入物组成,这些植入物可刺激视网膜神经元向大脑传递信息,但目前人工视网膜价格昂贵,且不能精细恢复视觉功能;除此之外,还有基于病毒载体的基因疗法,通过修正遗传突变让遗传性光感受器恢复功能,同样,基因疗法除了价格昂贵之外,并不能解决由年龄造成的视觉神经的退行性疾病。2006年,山中伸弥的团队发明了一种由oct4、sox2、klf4和c-myc四种转录因子构成的“鸡尾酒”法,能够成功将终端分化的皮肤成纤维细胞重编程成为具有分化多能性的干细胞,这种干细胞被称为诱导多能干细胞(inducedpluripotentcells)(cell,2006,124(4)pp.663-676;cell,2007,131(5)pp.861-872)。这些干细胞具有和胚胎干细胞(embryonicstemcells)类似的分化潜能,能够形成人体发育最基本的三个胚层:外胚层、中胚层及内胚层,并最终形成多种成体细胞。这一发明突破了在医学上使用人胚胎干细胞的伦理限制,可以解决细胞移植治疗中的免疫排斥问题,大大拓展了干细胞技术在临床医学上的应用潜力。使用包括胚胎干细胞及ipsc在内的全能干细胞或者多能干细胞作为原材料进行外胚层细胞诱导分化可以作为临床治疗的新思路,大大拓展了外胚层细胞在临床医学上的应用潜力。以神经系统为例,目前在再生医学领域,神经干细胞及神经元的诱导多采取smad途径双重抑制法(dualsmadinhibition)(natbiotechnol,2009,05;27(5):485),该方法得到的神经干细胞能够分化为其它类型的神经元细胞,其原理是通过抑制bmp和tgfbeta途径来模拟胚胎发育早期的信号途径,从而诱导神经干细胞的产生。其中ldn-193189和sb431542是广为使用的两种化学小分子抑制剂,分别通过作用于bmp4途径中的alk2和alk3,以及tgfbeta途径中的alk5来实现移植内胚层及中胚层形成,从而起到神经发生的作用。通过这种方法,可以在血清类成分(knockoutserumreplacement)胎牛血清(fbs)和视黄酸的存在下得到光感受器神经元,且生产周期至少需要70天以上(stemcellstranslationalmedicine,2018;7:210-219;scitranslmed,2019.116;11(475))。但是血清提取物,动物源性提取物的存在,对细胞治疗领域,特别是细胞制药来说,是一种不利于药物安全性的潜在危险,例如动物源性病毒的混入,以及致敏性蛋白的存在,都可能会导致治疗效果的失败。此外,视黄酸是视觉循环的重要参与组成成分,涉及通过视网膜色素上皮(rpe)将维生素a(称为全反式视黄醇或全反式rol)转化为11-顺式视黄醛(11-顺式-ral),转运11-顺式-ral转化为感光体,产生光色素,将11-顺式-ral异构化并还原成全反式rol,并将全反式rol转运回rpe参与另一个循环(nature.1960;168:114-118;nat.genet.1997;15:236-246;j.biol.chem.1997;272:10303-10310)。细胞培养体系中的类维生素a,例如视黄酸(ra),非常容易受到氧化而失去活性。因此,为了稳定视黄酸不被快速氧化损伤,血清被大量用来稳定细胞培养体系中的视黄酸(intjdevbiol.2012;56(4):273-8)。因此,一种既不依赖于血清,又能在细胞培养条件下稳定存在的类维生素a化学分子,对光感受器神经元的体外稳定安全诱导极为重要。本发明使用的galunisertib(ly2157299),标准化学命名:4-(2-(6-methylpyridin-2-yl)-5,6-dihydro-4h-pyrrolo[1,2-b]pyrazol-3-yl)quinoline-6-carboxamide或4-(2-(6-甲基吡啶-2-基)-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)喹啉-6-甲酰胺;为tgf-β受体ⅰ(tgf-βri,alk5)小分子抑制剂。ly2157299目前正处于ii期临床评估,针对肝癌和胶质母细胞瘤的抗癌活性(giannellig1,villae,lahnm.transforminggrowthfactor-βasatherapeutictargetinhepatocellularcarcinoma.cancerres.2014.4.1;74(7):1890-4),通过阻断tgf-β信号通路抑制肿瘤的生长、侵袭和转移过程;此外,多项研究表明ly2157299阻断了ctgf的产生并抑制了新血管生成,从而抑制了癌细胞的生长。目前,该分子的发展方向主要是基于肺癌、肝癌和胶质母细胞瘤的药物开发以及治疗(pharmaceutics.2020.5.18;12(5):459),并没有公开任何在神经再生领域的应用。本发明使用了一种无血清小分子化学诱导体系,将多能干细胞快速转化为光感受器神经细胞,与目前国际通行的血清加视黄醇的诱导方法相比,本发明不使用血清,使用化学小分子替代视黄醇,保证了光感受器神经元发育所需要的视觉循环的运行的同时也排除了血清的不利因素。因此,本发明不仅完全免除了在细胞培养过程中动物源性成分带来的潜在危险,而且全新的化学小分子的组合展现出极大的纯度及产率优势。所以,本发明大大拓展了光感受器神经细胞移植的临床前景。同时解决了同类细胞产品生产过程中纯度低,周期长的问题,因此具有巨大的经济效应和社会效应。技术实现要素:本发明涉及光感受器神经元细胞的化学诱导及培养方法、培养基及其在多种疾病中的应用。具体地,本发明涉及如下几个方面:一方面,本发明提供ly2157299在(例如人源)多能干细胞分化为外胚层中的应用。另一方面,本发明提供了一种从(例如人源)多能干细胞分化为(例如人源)外胚层的培养基。进一步地,所述从(例如人源)多能干细胞分化为(例如人源)外胚层的培养基,其特征在于,在nouvneu-basal基础培养基中加入ly2157299,所述nouvneu-basal基础培养基的配方为杜氏改良伊格尔/f12培养基(dmem/f12培养基)、0.1%-2%最低必须培养基非必需氨基酸(minimumessentialmediumnon-essentialaminoacids,最佳浓度为1%)、0.1-0.8g/l氯化钠(sodiumchloride,最佳浓度为0.5g/l)、0.1-80mg/l维生素c(l-ascorbicacid,最佳浓度为64mg/l)、0.1-1.8um维生素b12(最佳浓度为1.2um)、0.1-9.8ng/ml黄体酮(progesterone,最佳浓度6.3ng/ml)、10-35ug/ml腐胺(putrescine,最佳浓度为23ug/ml)、1ug/l-25ug/l亚硒酸钠(最佳浓度为13.6ug/l)、0.1-44ug/ml胰岛素(最佳浓度为22ug/ml)、0.5-20umol/loptiferrin(最佳浓度为10μmol/l)、2.5-100ng/ml植物源重组人碱性生长因子(osrbfgf,最佳浓度为50ng/ml)。进一步地,ly2157299的用量为55nm-25um,优选为100nm、300nm、500nm、700nm、900nm、1um、2.5um、5um、7.5um、10um、12.5um、15um、17.5um、20um或22um。进一步地,所述ly2157299的用量为7.5um。另一方面,本发明提供一种(例如人源)多能干细胞分化为(例如人源)外胚层的方法,其特征在于,将多能干细胞在添加55nm-25umly2157299(优选为100nm、300nm、500nm、700nm、900nm、1um、2.5um、5um、7.5um、10um、12.5um、15um、17.5um、20um或22um)的nouvneu-basal基础培养基中培养,获得外胚层细胞,所述nouvneu-basal基础培养基的配方为杜氏改良伊格尔/f12培养基(dmem/f12培养基)、0.1%-2%最低必须培养基非必需氨基酸(minimumessentialmediumnon-essentialaminoacids,最佳浓度为1%)、0.1-0.8g/l氯化钠(sodiumchloride,最佳浓度为0.5g/l)、0.1-80mg/l维生素c(l-ascorbicacid,最佳浓度为64mg/l)、0.1-1.8um维生素b12(最佳浓度为1.2um)、0.1-9.8ng/ml黄体酮(progesterone,最佳浓度6.3ng/ml)、10-35ug/ml腐胺(putrescine,最佳浓度为23ug/ml)、1ug/l-25ug/l亚硒酸钠(最佳浓度为13.6ug/l)、0.1-44ug/ml胰岛素(最佳浓度为22ug/ml)、0.5-20umol/loptiferrin(最佳浓度为10μmol/l)、2.5-100ng/ml植物源重组人碱性生长因子(osrbfgf,最佳浓度为50ng/ml)。另一方面,本发明提供ly2157299和jw55在(例如人源)多能干细胞分化为神经干细胞中的应用。另一方面,本发明提供将(例如人源)多能干细胞分化为神经干细胞的培养基,其特征在于,在nouvneu-basal基础培养基中加入ly2157299和jw55,所述nouvneu-basal基础培养基的配方为杜氏改良伊格尔/f12培养基(dmem/f12培养基)、0.1%-2%最低必须培养基非必需氨基酸(minimumessentialmediumnon-essentialaminoacids,最佳浓度为1%)、0.1-0.8g/l氯化钠(sodiumchloride,最佳浓度为0.5g/l)、0.1-80mg/l维生素c(l-ascorbicacid,最佳浓度为64mg/l)、0.1-1.8um维生素b12(最佳浓度为1.2um)、0.1-9.8ng/ml黄体酮(progesterone,最佳浓度6.3ng/ml)、10-35ug/ml腐胺(putrescine,最佳浓度为23ug/ml)、1ug/l-25ug/l亚硒酸钠(最佳浓度为13.6ug/l)、0.1-44ug/ml胰岛素(最佳浓度为22ug/ml)、0.5-20umol/loptiferrin(最佳浓度为10μmol/l)、2.5-100ng/ml植物源重组人碱性生长因子(osrbfgf,最佳浓度为50ng/ml);任选地,所述jw55的浓度为0.5-20um,最佳浓度为5um;任选地,所述ly2157299的用量为55nm-25um,优选为100nm、300nm、500nm、700nm、900nm、1um、2.5um、5um、7.5um、10um、12.5um、15um、17.5um、20um或22um。另一方面,本发明提供将(例如人源)外胚层分化为神经干细胞的培养基,其特征在于,在nouvneu-basal基础培养基中加入ly2157299和jw55,所述nouvneu-basal基础培养基的配方为杜氏改良伊格尔/f12培养基(dmem/f12培养基)、0.1%-2%最低必须培养基非必需氨基酸(minimumessentialmediumnon-essentialaminoacids,最佳浓度为1%)、0.1-0.8g/l氯化钠(sodiumchloride,最佳浓度为0.5g/l)、0.1-80mg/l维生素c(l-ascorbicacid,最佳浓度为64mg/l)、0.1-1.8um维生素b12(最佳浓度为1.2um)、0.1-9.8ng/ml黄体酮(progesterone,最佳浓度6.3ng/ml)、10-35ug/ml腐胺(putrescine,最佳浓度为23ug/ml)、1ug/l-25ug/l亚硒酸钠(最佳浓度为13.6ug/l)、0.1-44ug/ml胰岛素(最佳浓度为22ug/ml)、0.5-20umol/loptiferrin(最佳浓度为10μmol/l)、2.5-100ng/ml植物源重组人碱性生长因子(osrbfgf,最佳浓度为50ng/ml);任选地,所述jw55的浓度为0.5-20umjw55,最佳浓度为5um;任选地,所述ly2157299的用量为55nm-25um,优选为100nm、300nm、500nm、700nm、900nm、1um、2.5um、5um、7.5um、10um、12.5um、15um、17.5um、20um或22um。另一方面,本发明提供(例如人源)多能干细胞分化为神经干细胞的方法,其特征在于,利用前述将(例如人源)多能干细胞分化为神经干细胞的培养基培养。另一方面,本发明提供(例如人源)外胚层细胞分化为神经干细胞的方法,其特征在于,利用前述将(例如人源)外胚层分化为神经干细胞的培养基培养。另一方面,本发明提供ly2157299和am580在(例如人源)多能干细胞分化为光感受器神经元细胞中的应用。进一步地,ly2157299的用量为55nm-25um,优选为100nm、300nm、500nm、700nm、900nm、1um、2.5um、5um、7.5um、10um、12.5um、15um、17.5um、20um或22um。进一步地,am580的用量为0.05-0.95um,优选为0.08um,0.09um,0.1um,0.2um,0.3um,0.5um,0.6um,0.7um,0.8um,0.9um。另一方面,本发明提供一种从(例如人源)外胚层分化到光感受器神经元细胞的诱导培养基,其特征在于:在nouvneu-basal基础培养基中加入ly2157299以及am580,所述nouvneu-basal基础培养基的配方为杜氏改良伊格尔/f12培养基(dmem/f12培养基)、0.1%-2%最低必须培养基非必需氨基酸(minimumessentialmediumnon-essentialaminoacids,最佳浓度为1%)、0.1-0.8g/l氯化钠(sodiumchloride,最佳浓度为0.5g/l)、0.1-80mg/l维生素c(l-ascorbicacid,最佳浓度为64mg/l)、0.1-1.8um维生素b12(最佳浓度为1.2um)、0.1-9.8ng/ml黄体酮(progesterone,最佳浓度6.3ng/ml)、10-35ug/ml腐胺(putrescine,最佳浓度为23ug/ml)、1ug/l-25ug/l亚硒酸钠(最佳浓度为13.6ug/l)、0.1-44ug/ml胰岛素(最佳浓度为22ug/ml)、0.5-20umol/loptiferrin(最佳浓度为10μmol/l)、2.5-100ng/ml植物源重组人碱性生长因子(osrbfgf,最佳浓度为50ng/ml)。进一步地,所述ly2157299的用量为55nm-25um,优选为100nm、300nm、500nm、700nm、900nm、1um、2.5um、5um、7.5um、10um、12.5um、15um、17.5um、20um或22um。进一步地,所述am580的用量为0.05-0.95um,优选为0.08um,0.09um,0.1um,0.2um,0.3um,0.5um,0.6um,0.7um,0.8um,0.9um。进一步地,所述ly2157299的用量为7.5um,所述am580的用量为0.5um。另一方面,本发明提供一种多能干细胞分化为光感受器神经元细胞的方法,其特征在于,将多能干细胞在添加55nm-25umly2157299(优选为100nm、300nm、500nm、700nm、900nm、1um、2.5um、5um、7.5um、10um、12.5um、15um、17.5um、20um或22um)的nouvneu-basal基础培养基中培养,获得外胚层细胞,然后将外胚层细胞在上述的光感受器神经元细胞诱导培养基中培养,获得光感受器神经元细胞,优选地,所述培养是在有基底膜的情况下进行的,更优选地,所述基底膜为基底胶(matrigel)(stemcelltechnologies),层粘蛋白(laminin)和玻连蛋白的一种或多种的组合,所述nouvneu-basal基础培养基的配方为杜氏改良伊格尔/f12培养基(dmem/f12培养基)、0.1%-2%最低必须培养基非必需氨基酸(minimumessentialmediumnon-essentialaminoacids,最佳浓度为1%)、0.1-0.8g/l氯化钠(sodiumchloride,最佳浓度为0.5g/l)、0.1-80mg/l维生素c(l-ascorbicacid,最佳浓度为64mg/l)、0.1-1.8um维生素b12(最佳浓度为1.2um)、0.1-9.8ng/ml黄体酮(progesterone,最佳浓度6.3ng/ml)、10-35ug/ml腐胺(putrescine,最佳浓度为23ug/ml)、1ug/l-25ug/l亚硒酸钠(最佳浓度为13.6ug/l)、0.1-44ug/ml胰岛素(最佳浓度为22ug/ml)、0.5-20umol/loptiferrin(最佳浓度为10μmol/l)、2.5-100ng/ml植物源重组人碱性生长因子(osrbfgf,最佳浓度为50ng/ml)。另一方面,本发明提供一种光感受器神经元细胞,其特征在于利用前面所述的从(例如人源)外胚层分化到光感受器神经元细胞的诱导培养基培养。另一方面,本发明提供一种光感受器神经元细胞,其特征在于利用前面所述的(例如人源)多能干细胞分化为光感受器神经元细胞的方法制备。另一方面,本发明提供一种神经干细胞,其特征在于利用前面所述的从(例如人源)外胚层分化到神经干细胞的诱导培养基培养。另一方面,本发明提供一种神经干细胞,其特征在于利用前面所述的(例如人源)外胚层分化为神经干细胞的方法制备。另一方面,本发明提供一种外胚层细胞,其特征在于利用前面所述的(例如人源)多能干细胞分化为(例如人源)外胚层的培养基培养。另一方面,本发明提供一种外胚层细胞,其特征在于利用前面所述的(例如人源)多能干细胞分化为(例如人源)外胚层的方法制备。另一方面,本发明涉及前面所述的光感受器神经元细胞在视觉神经的退行性疾病的治疗中的用途,所述视觉神经的退行性疾病是例如与年龄相关的黄斑变性、色素变性。另一方面,本发明涉及前面所述的光感受器神经元细胞在光感受器神经细胞移植中的用途。另一方面,本发明涉及外胚层细胞在制备光感受器神经元细胞中的用途。本发明涉及化合物ly2157299和/或jw55在神经系统体外发育中的应用,涉及到该化合物与基础培养基的组合,以及这一组合在外胚层细胞或神经干细胞中的培养及其临床应用。本发明涉及化合物(例如ly2157299,和/或am580)在神经系统体外发育中的应用,涉及到该化合物与基础培养基的组合,以及这一组合在光感受器神经细胞中的培养及其临床应用。本发明涉及一种试剂盒,其包含nouvneu-basal基础培养基,ly2157299,和/或am580,优选地,所述ly2157299的用量为55nm-25um优选为100nm、300nm、500nm、700nm、900nm、1um、2.5um、5um、7.5um、10um、12.5um、15um、17.5um、20um或22um,所述am580的用量为0.05-0.95um,优选为0.08um,0.09um,0.1um,0.2um,0.3um,0.5um,0.6um,0.7um,0.8um,0.9um。本发明人诱导光感受器神经元细胞制备步骤:在无血清外胚层诱导培养基中对多能干细胞进行单层贴壁培养,所述无血清培养基中含有本发明使用的化学小分子、氨基酸、无机盐等成分,而不含有血清、bmp或者tgf信号转导途径的物质等成分,使用这一无血清神经诱导培养基贴壁培养15天,得到贴壁神经干细胞。进一步使用维生素途径激活剂处理细胞,从而获得光感受器细胞。在具体的实施方案中,所述作用于bmp信号转导途径的物质包括一个或者多个由下列各项自由排列组合的蛋白质:bmp2,bmp4,bmp4,smad1,smad5,smad8;其中所述作用于tgf信号转导途径的物质包括一个或者多个由下列各项自由排列组合的蛋白质:activin,tgf-beta,nodal,smad2,smad3。维生素包括一个或者多个由下列各项排列组合的维生素:维生素c,维生素e,维生素b12,维生素a。在具体的实施方案中,所述贴壁培养是在有基底膜制剂的情况下进行的。本发明所述基底膜制剂,可以在培养器皿的表面形成一层由胞外基质分子构成的薄膜,可以为细胞的形态、生长分化以及运动等参数提供与体内环境类似的支持。在具体的实施方案中,所述基底膜为基底胶(matrigel)(stemcelltechnologies),层粘蛋白(laminin)和玻连蛋白的一种或多种的组合。本发明中的无血清培养基表示不含有直接从血液中分离的血清。血清为血浆的透明液体部分,其不含纤维蛋白原或血细胞,并且在血液凝固后保持为液体。无血清培养基可以含有血清替代物,血清替代物的实例包括血清白蛋白,转铁蛋白,脂肪酸等纯化物质。在本发明中,表述“光感受器神经元细胞”、“光感受器神经细胞”和“光感受器细胞”可以互换。附图说明1.图1示出:使用ly2157299获得的外胚层细胞,所获细胞向神经干细胞分化及其分子鉴定结果。图1a表示使用对照方法获得的神经干细胞,经过体外传代后重建神经花环的结构;图1b表示使用ly2157299获得的神经干细胞,经过体外传代后重建神经花环的结构;图1c表示使用对照方法获得的神经干细胞,经过体外重建神经花环,能够表达神经干细胞的标志物pax6和nestin;图1d表示使用ly2157299获得的神经干细胞,经过体外重建神经花环,能够表达神经干细胞的标志物pax6和nestin;图1e-1g表示使用q-pcr比较本发明的小分子抑制剂,与对比诱导方法(ck)相比在神经干细胞形成过程中神经干细胞标志物的表达差异。以上结果显示,ly2157299不仅能够形成神经干细胞,且与对照方法相比,在神经干细胞标志物的表达上比对照方法略有增加。2.图2示出:使用不同浓度ly2157299进行外胚层细胞诱导,对最佳浓度进行筛选。图2a显示,使用lsb对照形成外胚层细胞形态;图2b显示,没有ly2157299时,细胞不形成外胚层形态;图2c显示,低浓度ly2157299产生包括外胚层细胞在内的混合细胞分化;图2d显示,适当浓度ly2157299产生均匀分化的外胚层细胞;图2e显示,过高浓度ly2157299促进外胚层细胞向神经细胞分化;图2f显示外胚层标志物与ly2157299浓度呈正相关;图2g显示凋亡标志物与ly2157299浓度呈正相关。因此,本发明使用的ly2157299最佳浓度为7.5um。3.图3示出:使用不同浓度am580进行光感受器细胞诱导,对最佳浓度进行筛选。图3a显示,使用lsb对照形成外胚层细胞形态;图3b显示,没有am580时,细胞形成具有长轴突的皮质神经元形态;图3c显示,低浓度am580产生包括皮质神经元在内的混合细胞分化;图3d显示,适当浓度am580产生均匀分化的具有短轴突的光感受器细胞类型;图3e显示,过高浓度am580使分化细胞产生协迫;图3f显示外胚层及光感受器标志物pax6与am580浓度呈正相关;图3g显示凋亡标志物与am580浓度呈正相关。因此,本发明中am580最佳浓度为0.5um。4.图4示出:使用不同浓度am580进行光感受器细胞诱导,所获细胞的形态及光感受器标志物的q-pcr鉴定。图4a-4d显示,使用ra对照和不同浓度am580形成的光感受器细胞;图4e显示,4a-4d中所使用的细胞的神经细胞标志物nestin的表达比较;图4f显示,4a-4d中所使用的细胞的光感受器细胞标志物rcoverin的表达比较;图4g显示,4a-4d中所使用的细胞的光感受器细胞标志物rhodopsin的表达比较;图4h显示,4a-4d中所使用的细胞的光感受器细胞标志物crx的表达比较;图4i显示4a-4d中所使用的细胞的光感受器细胞标志物opsin1(opn1lw)的表达比较。图5:使用不同浓度am580进行光感受器细胞诱导,所获细胞的形态及光受体标志物的荧光免疫鉴定。结果表明,ra对照组获得的光感受器细胞表达nestin蛋白和recoverin蛋白(5a)、成熟光感受器的标志蛋白crx和opsin蛋白(5b)、rhodopsin和pax6蛋白(5c);am580不同浓度组也表达和ra对照组一致的蛋白表达模式(5d-5l)。图6:基础培养体系中关键成分的浓度鉴定示意图。6a:不同浓度氯化钠对培养体系渗透压的影响示意图;6b:使用不同浓度维生素b12得到的光感受器神经元细胞的表达差异示意图;6c:胰岛素在细胞长期培养过程中对细胞生理状态的影响示意图;6d:维生素c在细胞长期培养过程中对细胞生理状态的影响示意图;6e:不同浓度黄体酮在光感受器细胞诱导过程中对细胞生理状态的影响示意图;6f:不同浓度腐胺在光感受器细胞诱导过程中对细胞生理状态的影响示意图;6g:不同浓度optiferrin在光感受器细胞诱导过程中对细胞生理状态的影响示意图。有益效果本发明建立了无血清无动物源性物质的光感受器神经元的诱导培养体系。因此,使用多种来源的成体细胞(例如人源)经过重编程及定向分化的方法得到了光感受器神经元,且具有各项完备的生物学功能,多个批次之间状态稳定,纯度高,解决了细胞类药物生产过程中纯度低,周期长的问题;而且本发明同时解决了长久以来动物源性培养方法和滋养细胞污染的问题,能够用于多种视觉障碍疾病的移植治疗,因此具有巨大的经济效应和社会效应。具体实施方式以下通过具体实施例详细说明本发明的实施过程和产生的有益效果,旨在帮助阅读者更好地理解本发明的实质和特点,不作为对本案可实施范围的限定。实施例1.外胚层细胞诱导培养基的制备诱导培养基的配方,以下简称nouvneu-basal:杜氏改良伊格尔/f12培养基(dmem/f12培养基,sigma),0.1%-2%最低必须培养基非必需氨基酸(minimumessentialmediumnon-essentialaminoacids,货号:11140076,thermofisher),0.1-0.8g/l氯化钠(sodiumchloride,0.5g/l,sigma),0.1-80mg/l维生素c(l-ascorbicacid,64mg/l,sigma),0.1-1.8um维生素b12(1.2um,sigma),0.1-9.8ng/ml黄体酮(progesterone,6.3ng/ml,sigma),10-35ug/ml腐胺(putrescine,23ug/ml,sigma),1ug/l-25ug/l亚硒酸钠(最佳浓度为13.6ug/l,sigma),0.1-44ug/ml胰岛素(22ug/ml,solarbio),0.5-20umol/loptiferrin(10μmol/l,sigma),2.5-100ng/ml植物源重组人碱性生长因子(osrbfgf,最佳浓度为50ng/ml,禾元生物)。本发明外胚层细胞诱导培养基的制备为在nouvneu-basal基础培养基中加入55nm-25umly2157299(selleck)(最佳浓度为7.5um)(优选为100nm、300nm、500nm、700nm、900nm、1um、2.5um、5um、7.5um、10um、12.5um、15um、17.5um、20um或22um)。以下简称ly诱导方法。对照实验为,nouvneubasal基础培养基中添加100nmldn-193189(selleck)和10umsb431542(selleck),以下简称lsb诱导方法。实施例2.外胚层的诱导与鉴定2.1外胚层的化学诱导外胚层细胞来源于人多能干细胞,包括胚性多能干细胞,如h9细胞系和人诱导多能干细胞。其中人诱导多能干细胞按照“重编程培养基及重编程诱导多能干细胞的培养方法”(zl201910050800.7)进行从cd34+细胞重编程获得。在本发明中,“诱导多能干细胞”和“多能干细胞”可以互换使用。人多能干细胞使用matrigel(stemcelltechnologies)包被t25细胞培养瓶,铺板后置于37℃恒温箱中孵育一个小时以上。按照1x106细胞接种于t25培养瓶中进行扩增和传代。进行外胚层细胞诱导时,使用50ug/ml多聚赖氨酸(sigma,p6407)包被6孔培养板,铺板后置于37℃恒温箱中孵育3小时以上;然后使用5ug/ml层粘连蛋白(laminin,i2020,sigmaaldrich)进一步包被,铺板后置于37℃恒温箱中孵育3小时以上。当多能干细胞达到70%的覆盖率时,用edta在37℃消化5分钟,使用dmem终止细胞消化。细胞洗涤离心后按照2×105每瓶的比例重新接种于t25培养板中。使用本发明神经干细胞诱导培养基进行诱导,每天更换培养基直至形成片层状外胚层细胞。外胚层用edta在37℃消化5分钟,使用dmem终止细胞消化。细胞洗涤离心后按照2×105每瓶的比例重新接种于50ug/ml多聚赖氨酸及5ug/ml层粘连蛋白包被的t25培养板中,进行扩增培养。培养条件为37℃,5%的co2(panasonic,mco-18ac)。2.2外胚层细胞的鉴定外胚层细胞可以进一步形成神经干细胞,为了鉴定外胚层细胞的这一能力,在体外使用nouvneu-basal基础培养基,添加7.5umly2157299和0.5-20umjw55(最佳浓度为5um),进一步培养实施例2.1中得到的外胚层细胞,直至形成神经花环状结构。使用lsb诱导方法作为对照。分别取ly诱导方法和lsb诱导方法得到的外胚层分化得到的神经干细胞进行免疫荧光染色鉴定:采用4%多聚甲醛室温固定细胞40分钟,用dpbs缓冲液清洗两遍;然后用0.1%tritonx-100透化处理5分钟,用dpbs缓冲液清洗两遍;然后用含10%马血清和0.1%tritonx-100的dpbs缓冲液将细胞4℃孵育过夜;然后加入用dpbs缓冲液稀释的抗体,37℃孵育2小时,用dpbs缓冲液清洗三遍后拍照,拍照使用leicadmi8进行。抗体使用细节如表1所示。结果如图1a-1d所示,显示ly诱导方法和对照lsb诱导方法均能诱导具有神经花环结构的神经干细胞产生,且得到的神经干细胞表达pax6和nestin。表1.细胞免疫荧光染色所用抗体使用q-pcr检测从外胚层细胞向神经干细胞诱导过程中的不同标志物基因的转录变化。实施例2中使用的外胚层细胞,使用ly诱导方法和lsb诱导对照方法得到的神经干细胞,分别使用rneasyminiormicrokit(qiagen)进行总rna抽提,1mgrna用superscriptiiifirst-strandsynthesissystem(invitrogen)合成cdna。用sybrpremixextaq(takara)和thermalcyclerdicerealtimesystem(takara)来进行quantitativepcr的标记和反应,beta-actin用来作为内参。所有数据用delta-ctmethod进行分析。每组试验使用三组重复进行试验,并进行方差统计。用于鉴定不同细胞标志物的编码基因的引物序列如表2所示。结果如图1e-1g所示。结果显示ly诱导方法和对照lsb诱导方法诱导得到的神经干细胞在转录水平表达多种神经干细胞标志物sox2、pax6和nestin。因此,本发明获得的外胚层具有进一步分化为神经干细胞的能力。2.3不同浓度ly2157299对外胚层细胞的转录水平的影响使用q-pcr检测不同浓度ly2157299对外胚层细胞形成过程中的影响。实施例2中使用的诱导多能干细胞,使用ly诱导方法中不同浓度ly2157299和lsb诱导方法得到的外胚层细胞,分别使用rneasyminiormicrokit(qiagen)进行总rna抽提,1mgrna用superscriptiiifirst-strandsynthesissystem(invitrogen)合成cdna。用sybrpremixextaq(takara)和thermalcyclerdicerealtimesystem(takara)来进行quantitativepcr的标记和反应,beta-actin用来作为内参。所有数据用delta-ctmethod进行分析。每组试验使用三组重复进行试验,并进行方差统计。用于鉴定不同细胞标志物的编码基因的引物序列如表2所示。如图2所示,结果显示无ly2157299或者低浓度情况下,外胚层不能充分形成,高浓度则引发细胞凋亡,因此本发明使用的浓度为ly2157299最佳浓度范围。表2.外胚层及神经干细胞检测引物sox2-fcatgcaggttgacaccgttgg(seqidno:1)sox2-ratggattctcggcagactgattca(seqidno:2)pax6-ftctttgcttgggaaatccg(seqidno:3)pax6-rctgcccgttcaacatccttag(seqidno:4)nestin-ftcaagatgtccctcagcctgga(seqidno:9)nestin-rtggcacaggtgtctcaagggtag(seqidno:10)casp3-fggaagcgaatcaatggactctgg(seqidno:5)casp3-rgcatcgacatctgtaccagacc(seqidno:6)actin-ftccctggagaagagctacga(seqidno:7)actin-ragcactgtgttggcgtacag(seqidno:8)实施例3.外胚层细胞分化为光感受器神经元细胞将实施例2中nouvneu系统获得的外胚层细胞在nouvneu培养基中进行定向分化。进行分化时,使用50ug/ml多聚赖氨酸(sigma,p6407)包被6孔培养板,铺板后置于37℃恒温箱中孵育3小时以上,直至细胞接种。本发明光感受器神经元细胞诱导培养基的制备为在nouvneu-basal基础培养基中加入55nm-25umly2157299(最佳浓度为7.5um)(优选为100nm、300nm、500nm、700nm、900nm、1um、2.5um、5um、7.5um、10um、12.5um、15um、17.5um、20um或22um)以及0.05-0.95umam580(selleck)(最佳浓度为0.5um)(优选为0.08um,0.09um,0.1um,0.2um,0.3um,0.5um,0.6um,0.7um,0.8um,0.9um)。直至细胞形成光感受器神经元细胞。在nouvneu培养基中添加0.5um视黄酸(retinoicacid)形成对照实验,以下简称ra。am580浓度筛选试验参照实施例2.3进行,比较使用am580诱导方法中不同浓度am580和lsb诱导方法得到的光感受器神经元细胞的表达差异。引物使用列表见表2及表4。如图3所示,结果表明am580浓度与光感受器非特异性标志物pax6呈正相关,但当am580浓度过高时,会引起细胞凋亡。结合图4中am580对光感受器神经元特异性基因的表达,因此,本发明使用的am580浓度为最佳使用浓度。每隔3天更换新鲜培养基,直至第21天。培养条件为37℃,5%的co2(panasonic,mco-18ac)。诱导完成后,分别取每组对照两种材料进行免疫荧光染色鉴定:采用4%多聚甲醛室温固定细胞40分钟,用dpbs缓冲液清洗两遍;然后用0.1%tritonx-100透化处理5分钟,用dpbs缓冲液清洗两遍;然后用含10%马血清和0.1%tritonx-100的dpbs缓冲液将细胞4℃孵育过夜;然后加入2%马血清和0.1%tritonx-100的dpbs缓冲液稀释的一抗,37℃孵育2小时,用dpbs缓冲液清洗三遍后,加入2%马血清和0.1%tritonx-100的dpbs缓冲液稀释的二抗拍照。抗体使用细节如表3所示。实验结果表明实施例3中得到的光感受器神经元和ra对照一样,具有轴突结构且表达光感受器神经元标志物opsin、crx、recoverin、rhodopsin和pax6,以及神经谱系标志物nestin(图5)。表3.定向分化免疫荧光染色所用抗体使用q-pcr检测从外胚层细胞向光感受器神经细胞诱导过程中的不同标志物基因的转录变化。使用本发明及不同浓度am580获得的光感受器细胞,以及ra对照诱导方法得到的光感受器细胞,分别使用rneasyminiormicrokit(qiagen)进行总rna抽提,1mgrna用superscriptiiifirst-strandsynthesissystem(invitrogen)合成cdna。用sybrpremixextaq(takara)和thermalcyclerdicerealtimesystem(takara)来进行quantitativepcr的标记和反应,beta-actin用来作为内参。所有数据用delta-ctmethod进行分析。每组试验使用三组重复进行试验,并进行方差统计。用于鉴定不同细胞标志物的编码基因的引物序列如表4所示。结果显示,使用am580可以诱导细胞表达多种光感受器细胞特异标志基因,且不显著低于ra对照(图4)。表4.光感受器细胞诱导过程中的不同标志物基因引物实施例4.基础培养体系中关键成分的浓度鉴定:本发明实施例中示出的nouvneu-basal基础培养基的配方为杜氏改良伊格尔/f12培养基(dmem/f12培养基)、0.1%-2%最低必须培养基非必需氨基酸(minimumessentialmediumnon-essentialaminoacids,最佳浓度为1%)、0.1-0.8g/l氯化钠(sodiumchloride,最佳浓度为0.5g/l)、0.1-80mg/l维生素c(l-ascorbicacid,最佳浓度为64mg/l)、0.1-1.8um维生素b12(最佳浓度为1.2um)、0.1-9.8ng/ml黄体酮(progesterone,最佳浓度6.3ng/ml)、10-35ug/ml腐胺(putrescine,最佳浓度为23ug/ml)、1ug/l-25ug/l亚硒酸钠(最佳浓度为13.6ug/l)、0.1-44ug/ml胰岛素(最佳浓度为22ug/ml)、0.5-20umol/loptiferrin(最佳浓度为10μmol/l)、2.5-100ng/ml植物源重组人碱性生长因子(osrbfgf,最佳浓度为50ng/ml)。在保持其他成分最佳浓度的情况话,取氯化钠的不同浓度梯度配制筛选培养体系。使用全自动冰点渗透压计(fm-8p,上海医大仪器有限公司)来检测不同浓度氯化钠对培养体系渗透压的影响,具体操作参加产品说明书(fm-8p,上海医大仪器有限公司)。试验结果详见图6a,结果说明氯化钠浓度与培养体系渗透压呈线性增加。但当浓度达到1g/ml时,培养体系的渗透压已经超过细胞培养极限渗透压320mosm/kg。说明本发明使用的氯化钠浓度为最适于细胞培养的浓度。维生素b12浓度筛选试验参照实施例2.3进行,比较使用不同浓度维生素b12得到的光感受器神经元细胞的表达差异。引物使用列表见表2及表4。如图6b所示,结果表明维生素b12浓度与光感受器非特异性标志物pax6呈正相关,但当维生素b12浓度过高时,引起细胞非特异性分化,从而导致pax6相对表达量降低。因此,本发明使用的维生素b12浓度为最佳使用浓度。在保持其他成分最佳浓度的情况话,分别取胰岛素或者维生素c的不同浓度梯度配制筛选培养体系。按照实施例2.1的方法进行外胚层诱导。使用cyquant试验来进行细胞活力定量检测,从而研究胰岛素或者维生素c在细胞长期培养过程中对细胞生理状态的影响。包被96孔不透光细胞培养板,包被完成后将细胞按照5x104每孔的细胞数量分别接种,并设置三组平行重复(三组的平均值作为数据进行计算),重复实施例2.1的过程,培养条件为37℃,5%二氧化碳。分别在1天、5天、10天以及20天取样,细胞活力检测使用cyquantkit(invitrogen,货号:x12223)进行,按照使用说明书操作,使用spectramaxi3multi-modemicroplatereader(vwr,型号id3-std)进行数据读取。结果如图6c-6d所示,cyquant实验显示,诱导得到的细胞数量与胰岛素或者维生素c均称正相关,但是在高浓度下,细胞数量与本发明中的最佳浓度相比,差异不显著;此外,高浓度维生素c在诱导后期导致了细胞成片脱落,不能继续进行诱导。因此,结合成本因素,本发明基础培养基中的胰岛素或者维生素c为最佳浓度。同样使用cyquant试验来进行黄体酮,腐胺和optiferrin对细胞活力的检测,从而研究不同浓度黄体酮,腐胺和optiferrin在光感受器细胞诱导过程中对细胞生理状态的影响,结果如图6e,6f,和图6g所示,黄体酮,腐胺和optiferrin浓度均与细胞增殖速度呈正相关,结合成本因素,本发明使用的黄体酮,腐胺和optiferrin范围属于最佳使用范围。需要说明的是,上述实施例仅为本发明较佳的具体实施方式,并不以任何形式限制本发明,凡根据本发明的技术方案等同替换或改变获得的技术方案,均涵盖在本发明的保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1