一种体外纯化培养大鼠胚胎海马放射状胶质细胞的方法
本发明属于细胞培养技术领域,具体涉及一种体外纯化培养大鼠胚胎海马放射状胶质细胞的方法
背景技术:
目前已证实,放射状胶质细胞(radialgliacells,rgcs)是一类形态、生物学特性和功能上独特的细胞,为神经胶质细胞的一种,具有典型的细而长的突起,为双极性形态。在胚胎时期是一类干细胞,其放射状的突起可以担当新生未成熟神经元的“脚手架(scaffolding)”,引导神经元长距离迁移,到达某些特定区域并分化为成熟神经细胞,与局部区域建立突触联接;还具有nscs功能,作为神经前体细胞,通过不对称分裂与对称分裂产生神经元或神经胶质细胞。rgcs呈现出神经上皮细胞和胶质细胞的特征,能表达干/祖细胞的标记物,比如nestin、sox2,同时也能表达一些星形胶质细胞标记物,如脑脂结合蛋白(brainlipidbindingprotein,blbp)、vimentin、rc1、rc2、c腱糖蛋白(tenascin-c,tn-c)、谷氨酸盐转运蛋白(glutamatetransporter,glast)、谷氨酰胺合成酶(glutaminesynthetase,gs)、s100等。目前关于rgcs的分离培养,有学者应用具有2μm槽的聚甲基丙烯酸甲酯(ln2pmma)支架,模拟胚胎神经干细胞池的生物微环境,体外诱导rgcs培养,然而获得的rgcs仅达到80%。用此纯度不高的细胞作为研究对象,对后续的实验研究带来诸多干扰因素,导致实验结果不稳定。因此如何提高体外培养的大鼠海马胚胎rgcs的纯度成为关键问题。
技术实现要素:
本部分的目的在于概述本发明的实施例的一些方面以及简要介绍一些较佳实施例。在本部分以及本申请的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
鉴于上述的技术缺陷,提出了本发明。本发明的主要目的在于提供一种体外纯化培养大鼠海马rgcs的方法。
因此,作为本发明其中一个方面,本发明克服现有技术中存在的不足,提供一种体外纯化培养大鼠胚胎海马放射状胶质细胞的方法。
为解决上述技术问题,本发明提供了如下技术方案:一种体外纯化培养大鼠胚胎海马放射状胶质细胞的方法,其包括,获取孕鼠大脑皮质和海马组织;用dmem/f12基础培养液制备所述海马组织的单细胞悬液;用神经干细胞培养液重悬,接种、培养形成细胞球;消化所述细胞球,终止后过滤得单细胞悬液,接种后传代培养,收集细胞球;消化收集到的所述细胞球,终止后用神经干细胞培养液重悬,接种,让悬浮的单细胞贴壁,继续用神经干细胞培养液培养。
作为本发明所述的体外纯化培养大鼠胚胎海马放射状胶质细胞的方法的优选方案,其中:所述神经干细胞培养液由dmem/f12、2%b27、20ng/mlegf、20ng/mlbfgf组成。
作为本发明所述的体外纯化培养大鼠胚胎海马放射状胶质细胞的方法的优选方案,其中:所述接种,其接种的细胞密度为1×104个/ml~1×105个/ml。
作为本发明所述的体外纯化培养大鼠胚胎海马放射状胶质细胞的方法的优选方案,其中:所述接种、培养形成细胞球,其接种的细胞密度为1×105个/ml;所述接种后传代培养,其其接种的细胞密度为1×104个/ml。
作为本发明所述的体外纯化培养大鼠胚胎海马放射状胶质细胞的方法的优选方案,其中:所述消化用的酶包括accutase酶、胰酶中的一种或几种。
作为本发明所述的体外纯化培养大鼠胚胎海马放射状胶质细胞的方法的优选方案,其中:所述消化所述细胞球,其为使用accutase酶进行;所述消化收集到的所述细胞球,其为使用胰酶进行。
作为本发明所述的体外纯化培养大鼠胚胎海马放射状胶质细胞的方法的优选方案,其中:所述终止,其为用含10%fbs的dmem/f12培养基终止消化。
作为本发明所述的体外纯化培养大鼠胚胎海马放射状胶质细胞的方法的优选方案,其中:所述传代,其为传代3次以上。
作为本发明所述的体外纯化培养大鼠胚胎海马放射状胶质细胞的方法的优选方案,其中:所述培养,其为培养2~7天。
作为本发明所述的体外纯化培养大鼠胚胎海马放射状胶质细胞的方法的优选方案,其中:所述培养形成细胞球,其为培养5~7d;所述接种后传代培养,其为培养5~7d;所述继续用神经干细胞培养液培养,其为培养3天以上。
本发明的有益效果:
本方法可明显提高体外培养的大鼠海马rgcs的纯度,可达97%左右。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
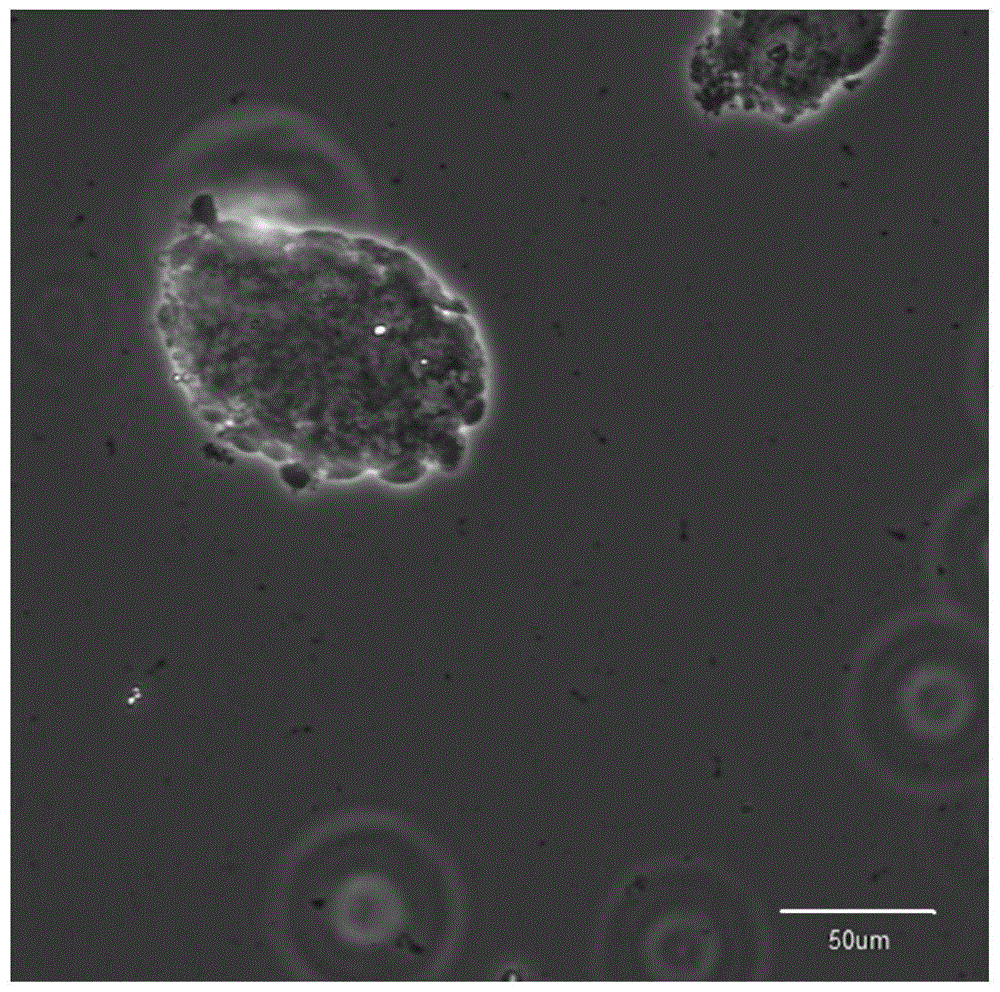
图1为原代悬浮培养约5d后,可见培养瓶内新形成的细胞球;
图2为传代3次后,将球消化制成单细胞悬液,接种于含有预涂多聚赖氨酸24孔培养板内,让悬浮的单细胞进行贴壁培养,3d后明视野下可见细胞长出突起,呈现双极特征,形成rgcs;
图3为体外通过贴壁法纯化培养大鼠海马rgcs的免疫荧光检测,海马rgcs共表达神经干细胞标记物nestin、sox2和胶质细胞标记物gfap、blbp和vimentin(c-f),scalebars=50μm;
图4为各双标记细胞与总细胞百分比的统计图(g),原代悬浮培养约5d后,可见培养瓶内新形成的细胞球。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合具体实施例对本发明的具体实施方式做详细的说明。
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
其次,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
本发明的技术方案如下:
1.取孕14dsd大鼠1只,用复合麻醉剂chlorpent0.4ml/100g经腹腔麻醉后,无菌条件下打开腹腔,取出胎鼠(7-8只),置于含有预冷dmem/f12基础培养液的培养皿中;
2.在超净台上用眼科剪剪开胎鼠头部皮肤和头骨后,取出全脑组织,掀开大脑皮质,使用眼科镊分离分离并取出海马组织,剔除血管、脑膜和脉络膜等结缔组织,经dmem/f12基础培养液轻轻洗涤后,将皮质组织剪碎成1mm3大小的组织块;
3.将海马组织块移至盛有dmem/f12基础培养液的离心管内,机械反复轻轻吹打成单细胞悬液,用无菌200目尼龙网过滤,收集过滤后的细胞悬液;用dmem/f12基础培养液清洗,1000r/min离心10min,吸去上清,重复一次。
4.用神经干细胞培养液(由dmem/f12、2%b27、20ng/mlegf、20ng/mlbfgf组成)重悬细胞,取10μl细胞悬液进行台盼蓝染色,并用细胞计数板进行细胞计数,按1×105个/ml细胞的密度接种于含有10ml神经干细胞培养液的细胞培养瓶中,置于饱和湿度、37℃、5%co2培养箱中培养;
5.约5d后,可见培养瓶内新形成的细胞球,低速离心收集细胞球,加入accutase酶将细胞球消化成单个细胞,于37℃消化20min后,用含10%fbs的dmem/f12培养基终止消化。经细胞过滤器过滤后,收集过滤后的细胞悬液,继续接种于培养瓶中进行传代培养;
6.经传代3次后,再次低速离心收集细胞球,用0.125%胰酶细胞消化液进行消化,约5min后,用含10%fbs的dmem/f12终止消化,dmem/f12培养基清洗3遍后,经细胞过滤器过滤后,收集过滤后的细胞悬液;
7.继续用神经干细胞培养液重悬细胞,经细胞计数和活力观察后,进一步以1.5×104个/ml细胞接种于含有预涂多聚赖氨酸24孔培养板内,让悬浮的单细胞进行贴壁,继续用神经干细胞培养液培养。
8.倒置显微镜下观察,培养的细胞逐渐伸出突起,3d后贴壁培养的海马rgcs具有细而长的突起,呈现rgcs的典型双极性形态。
实施例1:
1.体外纯化培养大鼠胚胎海马rgcs:
(1)取孕14dsd大鼠1只,用复合麻醉剂chlorpent0.4ml/100g经腹腔麻醉后,无菌条件下打开腹腔,取出胎鼠(7-8只),置于含有预冷dmem/f12基础培养液的培养皿中;
(2)在超净台上用眼科剪剪开胎鼠头部皮肤和头骨后,取出全脑组织,掀开大脑皮质,使用眼科镊分离分离并取出海马组织,剔除血管、脑膜和脉络膜等结缔组织,经dmem/f12基础培养液轻轻洗涤后,将皮质组织剪碎成1mm3大小的组织块;
(3)将海马组织块移至盛有dmem/f12基础培养液的离心管内,机械反复轻轻吹打成单细胞悬液,用无菌200目尼龙网过滤,收集过滤后的细胞悬液;用dmem/f12基础培养液清洗,1000r/min离心10min,吸去上清,重复一次。
(4)用神经干细胞培养液(由dmem/f12、2%b27、20ng/mlegf、20ng/mlbfgf组成)重悬细胞,取10μl细胞悬液进行台盼蓝染色,并用细胞计数板进行细胞计数,按1×105个/ml细胞的密度接种于含有10ml神经干细胞培养液的细胞培养瓶中,置于饱和湿度、37℃、5%co2培养箱中培养;
(5)约5d后,可见培养瓶内新形成的细胞球(图a),低速离心收集细胞球,加入accutase酶将细胞球消化成单个细胞,于37℃消化20min后,用含10%fbs的dmem/f12培养基终止消化。经细胞过滤器过滤后,收集过滤后的细胞悬液,继续接种于培养瓶中进行传代培养;
(6)经传代3次后,再次低速离心收集细胞球,用0.125%胰酶细胞消化液进行消化,约5min后,用含10%fbs的dmem/f12终止消化,dmem/f12培养基清洗3遍后,经细胞过滤器过滤后,收集过滤后的细胞悬液;
(7)继续用神经干细胞培养液重悬细胞,经细胞计数和活力观察后,进一步以1.5×104个/ml细胞接种于含有预涂多聚赖氨酸24孔培养板内,让悬浮的单细胞进行贴壁,继续用神经干细胞培养液培养。
(8)倒置显微镜下观察,培养的细胞逐渐伸出突起,3d后贴壁培养的海马rgcs具有细而长的突起,呈现rgcs的典型双极性形态(图b)。
2.免疫荧光检测大鼠胚胎海马rgcs同时表达干/祖细胞和星形胶质细胞标记物:
对上述培养的海马rgcs行免疫荧光检测,结果显示,rgcs共标记nestin/gfap(图c)、sox2/gfap(图d)、blbp/gfap(图e)、vimentin/gfap(图f)。用hoechst标记所有细胞核,对各组双标记的rgcs细胞数进行统计学分析,nestin/gfap双标阳性细胞数占总细胞数的96.93%±3.03%,sox2/gfap双标阳性细胞数占总细胞数的96.24%±3.71%,blbp/gfap双标阳性细胞数为95.04%±2.95%,vimentin/gfap阳性细胞为96.28%±3.33%(图g)。nestin和sox2为神经前体细胞标记物,vimentin、gfap和blbp为星形胶质细胞标记物。由此可见,该实验方法成功体外纯化培养海马rgc,且纯度较高,约97%。
3.细胞培养试剂:
(1)dmem/f12基础培养液(thermo公司);
(2)b27无血清培养基添加剂(b27serum-freesupplements50×,b27,gibco公司);
(3)胎牛血清(fetalbovineserum,fbs,gibco公司);
(4)表皮生长因子(epidermalgrowthfactor,egf,sigma公司);
(5)碱性成纤维细胞生长因子(basicfibroblastgrowthfactor,bfgf,sigma公司);
(6)nscs培养液(基础培养基98ml,含egf20ng/ml,bfgf20ng/ml,b272ml);
(7)accutase细胞消化酶(sigma公司);
(8)胰酶细胞消化液(beyotime公司);
4.细胞免疫荧光实验试剂:
(1)甲醇(上海振兴化工一厂);
(2)4%多聚甲醛(sangon公司);
(3)20×磷酸盐缓冲液(phosphatebufferedsalinepbs,pbs)(sangon公司):使用时加ddh2o稀释为1×pbs即可;
(4)山羊血清(sigma公司);
(5)tritonx-100(sangon公司);
封闭液:山羊血清2ml,tritonx-1000.06ml,nan36mg,加1×pbs至20ml;
5.主要抗体:
(1)hoechst33342(sigma公司,merck公司);
(3)mouseanti-gfap(1:1000,millipore公司);
(4)rabbitanti-gfap(1:1000,millipore公司);
(5)rabbitanti-blbp(1:1000,abcam公司)
(6)mouseanti-vimentin(1:100,abcam公司);
(7)mouseanti-nestin(1:100,abcam公司);
(8)rabbitanti-sox2(1:100,abcam公司);
(10)alexafluor594donkeyanti-mouseigg(1:1000,invitrogen公司);
(11)alexafluor647donkeyanti-rabbitigg(1:1000,invitrogen公司);
(12)alexafluor488donkeyanti-mouseigg(1:1000,invitrogen公司);
(13)alexafluor488donkeyanti-rabbitigg(1:1000,invitrogen公司);
(14)alexafluor594donkeyanti-rabbitigg(1:1000,invitrogen公司);
6.其他溶液配制:
(1)多聚-l-赖氨酸(poly-l-lysine,pll,sigma公司):超纯水配成终浓度为0.01%的稀释液,过滤后分装保存;
(2)台盼蓝染色液:3.6%nacl5ml(nacl0.8g加双蒸水至5ml)、0.4%曲利本兰16.5ml(曲利本兰0.066g加双蒸水至16.5ml);
(3)4%多聚甲醛液:40%多聚甲醛液500ml加0.2mol/lpbs(ph7.4)500ml;
(4)chlorpent复合麻醉剂:水合氯醛4.25g,mgso42.12g,戊巴比妥钠0.886g,无水乙醇14.25ml,丙二醇33.8ml,加ddh2o至100ml;
(5)2%外用碘酊,75%外用酒精。
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!