间充质干细胞传代培养方法与流程
本发明涉及干细胞培养
技术领域:
,具体涉及一种间充质干细胞传代培养方法及用于间充质干细胞传代培养的无血清传代培养基。
背景技术:
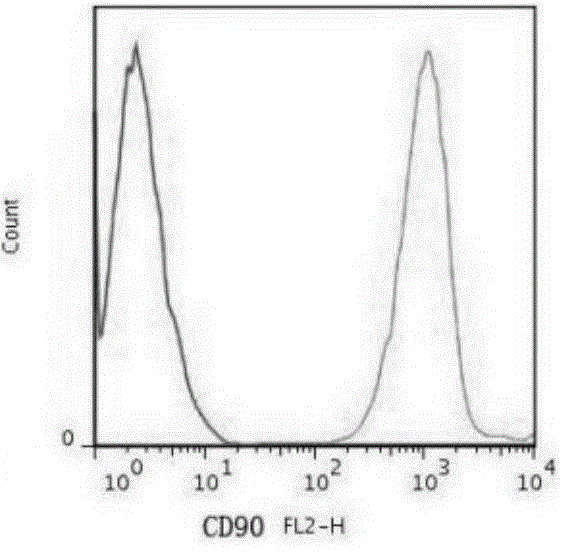
:间充质干细胞(mesenchymalstemcells,msc)是一类具有自我更新、增殖和多向分化潜能的干细胞,广泛存在于脐带、骨髓、牙髓、脂肪或胎盘组织中,具有易于采集、保存和运输、无异体排斥、避免伦理争议、刺激组织再生、调节免疫功能等诸多优点。目前,脐带间充质干细胞(uc-msc,umbiliaclcordmesenchymalstemcells)在软骨再生、脑缺血性疾病、糖尿病、类风湿性关节炎等动物模型和临床研究中有良好的治疗效果,显示出广阔的应用前景。国内外对脐带间充质干细胞的分离培养、扩增方法还没有统一的标准,考虑到临床应用时需要大量的纯度高、分化能力强、增殖能力强、干性稳定的间充质干细胞,现有的培养技术在人脐带间充质干细胞传代至5代后就逐渐老化,尚没有一种明确的方法可以在短时间内获得大量性能稳定的人脐带间充质干细胞。现有培养技术存在以下问题:使用现有的有血清培养基培养人脐带间充质干细胞存在免疫排斥等问题,不能满足未来临床的需求;使用现有无血清传代培养基培养人脐带间充质干细胞,存在细胞生长周期长、稳定性差、增殖能力弱、分化能力不稳定等问题。专利cn108300690a公开了一种脂肪间充质干细胞的分离培养方法,所述分离培养方法包括以下步骤:①分离收集脂肪组织并清洗,向脂肪组织中加入混合消化酶溶液,37℃消化30-90min,加入培养基终止消化,吹打均匀后,1500-3000rpm离心10-30min,收集底部沉淀,得原代脂肪间充质干细胞,所述混合消化酶溶液为溶有胰蛋白酶和i型胶原酶的pbs缓冲溶液;②配制无血清培养基:向基础培养基中加入抗坏血酸、碱性成纤维细胞生长因子、血小板衍生因子和人血白蛋白,配制成无血清培养基;③将原代脂肪间充质干细胞以步骤②的无血清培养基重悬,37℃、5%co2培养箱中培养。专利cn108300690a公开的脂肪间充质干细胞的分离培养方法在培养脂肪间充质干细胞方面,虽然取得一定技术进步,但是细胞增殖能力仍然有限,脂肪间充质干细胞6天后获得的细胞数量仅为63×103,参考图1,这样导致样本用量较大,成本较高,另外,专利cn108300690a使用了人血白蛋白,人血白蛋白来源于人体血液,不能人工合成,来源困难,价格高昂,导致脂肪间充质干细胞的分离培养难以产业化,不能满足大规模培养需求。技术实现要素:针对现有技术存在的问题,本发明提供一种间充质干细胞传代培养方法及用于间充质干细胞传代培养的无血清传代培养基。本发明的目的是通过以下技术方案来实现的:一方面,提供一种间充质干细胞传代培养方法,包括以下步骤:1)配制无血清传代培养基,所述无血清传代培养基的组分为:α-mem培养基、血小板衍生因子、成纤维细胞生长因子和抗坏血酸;所述血小板衍生因子的浓度为10-15ng/ml,例如:10ng/ml、11ng/ml、12ng/ml、13ng/ml、14ng/ml、15ng/ml;所述成纤维细胞生长因子的浓度为10-15ng/ml,例如:10ng/ml、11ng/ml、12ng/ml、13ng/ml、14ng/ml、15ng/ml;2)取原代间充质干细胞,加入到t-75有孔培养瓶中,加入所述无血清传代培养基,在37℃、5%co2培养箱中进行培养,待细胞融合度达到80%-90%时,用胰蛋白酶-edta溶液进行消化,消化完成后按1:4-5进行传代培养。优选地,所述抗坏血酸的浓度为25-50μg/ml,例如:25μg/ml、28μg/ml、30μg/ml、32μg/ml、35μg/ml、38μg/ml、40μg/ml、42μg/ml、45μg/ml、48μg/ml、49μg/ml、50μg/ml。优选地,所述胰蛋白酶-edta中胰蛋白酶的浓度为0.25mg/ml,edta浓度为0.04mg/ml。优选地,步骤2)中所述无血清传代培养基的加入量为10-15ml,例如:10ml、11ml、12ml、13ml、14ml、15ml。优选地,所述间充质干细胞选自脐带间充质干细胞、骨髓间充质干细胞、脂肪间充质干细胞、胎盘间充质干细胞、牙髓间充质干细胞或外周血间充质干细胞。优选地,所述无血清传代培养基还包含褪黑素,所述褪黑素的含量为2nm-200nm,例如:2nm、5nm、10nm、15nm、20nm、25nm、30nm、35nm、40nm、45nm、50nm、55nm、60nm、65nm、70nm、78nm、80nm、85nm、90nm、95nm、100nm、110nm、115nm、120nm、130nm、140nm、145nm、150nm、155nm、160nm、165nm、170nm、175nm、180nm、185nm、190nm、195nm、200nm。另一方面,提供一种无血清传代培养基,所述无血清传代培养基的组分包含:α-mem培养基、血小板衍生因子、成纤维细胞生长因子、抗坏血酸;所述血小板衍生因子的浓度为10-15ng/ml,例如:10ng/ml、11ng/ml、12ng/ml、13ng/ml、14ng/ml、15ng/ml;所述成纤维细胞生长因子的浓度为10-15ng/ml,例如:10ng/ml、11ng/ml、12ng/ml、13ng/ml、14ng/ml、15ng/ml。所述无血清传代培养基中不含人血白蛋白,成本较低,并且使用所述无血清传代培养基培养得到的间充质干细胞产量高,性能稳定。优选地,所述抗坏血酸的浓度为25-50μg/ml,例如:25μg/ml、28μg/ml、30μg/ml、32μg/ml、35μg/ml、38μg/ml、40μg/ml、42μg/ml、45μg/ml、48μg/ml、49μg/ml、50μg/ml。所述褪黑素的含量为2nm-200nm,例如:2nm、5nm、10nm、15nm、20nm、25nm、30nm、35nm、40nm、45nm、50nm、55nm、60nm、65nm、70nm、78nm、80nm、85nm、90nm、95nm、100nm、110nm、115nm、120nm、130nm、140nm、145nm、150nm、155nm、160nm、165nm、170nm、175nm、180nm、185nm、190nm、195nm、200nm。相对于现有技术,本发明的有益效果在于:上述间充质干细胞传代培养方法在无血清基础培养基α-mem的基础上添加低浓度的血小板衍生因子和成纤维细胞生长因子以及抗坏血酸作为无血清传代培养基,低浓度血小板衍生因子和成纤维细胞生长因子的联合使用,促进了间充质干细胞的分裂增殖,使细胞增殖传代时间缩短到1.5天,抗坏血酸可以维持间充质干细胞的干性稳定,防止间充质干细胞在增殖过程中分化或突变,这几种因子的联合使用使间充质干细胞在具备干性的基础上,快速分裂增殖,间充质干细胞传到20代时,仍保持较好的增殖和分化能力,克服了以往技术间充质干细胞快速老化的问题,同时缩短了培养时间。本发明配制的无血清传代细胞培养基,未使用胎牛血清,降低间充质干细胞临床使用风险;未使用人血白蛋白,节省了生产成本;使用本发明配制的无血清传代细胞培养基培养间充质干细胞,可以在短时间内获得纯度高、分化能力强、干性稳定、增殖能力强的间充质干细胞。附图说明图1是现有技术cn108300690a中不同培养方法时间充质干细胞扩增结果数据图;图2a-图2f分别是第5代人脐带间充质干细胞的使用无血清传代培养基培养、α-mem培养基+10%fbs培养96h后的表面标志物检测结果图;图3a-图3f是第20代人脐带间充质干细胞的使用无血清传代培养基培养、α-mem培养基+10%fbs培养96h的表面标志物检测结果图;图4是使用实验组1和对照组1培养至p5代人脐带间充质干细胞的生长曲线;图5是使用实验组1和对照组1培养至p20代人脐带间充质干细胞的生长曲线;图6为血小板衍生因子、成纤维细胞生长因子的协同增殖性鉴定即接种24孔板后绘制的生长曲线;图7a-图7f为p5代、p20代人脐带间充质干细胞进行成脂、成骨、成软骨诱导检测结果图;其中,图7a为p5代成骨染色结果;图7b为p20代成骨染色结果;图7c为p5代成软骨染色结果;图7d为p20代成软骨染色结果;图7e为p5代成脂染色结果;图7f为p20代成脂染色结果。具体实施方式为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具体图示,进一步阐述本发明。实施例1本实施例提供一种人脐带间充质干细胞传代培养方法,包括以下步骤:1)配制无血清传代培养基,所述无血清传代培养基的组分为:α-mem培养基、血小板衍生因子、成纤维细胞生长因子和抗坏血酸;所述血小板衍生因子的浓度为10ng/ml,在其他优选实施例中,所述血小板衍生因子的浓度为11ng/ml、12ng/ml、13ng/ml、14ng/ml、或15ng/ml;所述成纤维细胞生长因子的浓度为10ng/ml;在其他优选实施例中,所述成纤维细胞生长因子的浓度为11ng/ml、12ng/ml、13ng/ml、14ng/ml或15ng/ml;所述抗坏血酸浓度为50μg/ml,在其他优选实施例中,所述抗坏血酸浓度为25μg/ml、28μg/ml、30μg/ml、32μg/ml、35μg/ml、38μg/ml、40μg/ml、42μg/ml、45μg/ml、48μg/ml或49μg/ml。2)取原代人脐带间充质干细胞,加入到t-75有孔培养瓶中,加入所述无血清传代培养基,在37℃、5%co2培养箱中进行培养,待细胞融合度达到80%-90%时,用胰蛋白酶含量为0.25mg/ml的胰蛋白酶-edta溶液进行消化,消化完成后按1:5进行传代培养,传代接种密度为1×104/cm2,接种在直径10cm的平皿上,记为p2代,每隔一天换一次新鲜无血清传代培养基,传代至第二代的人脐带间充质干细胞记为p2,传代至第三代的人脐带间充质干细胞记为p3,以此类推,p2代以后按照1:5进行传代。上述间充质干细胞传代培养方法在无血清基础培养基α-mem的基础上添加低浓度的血小板衍生因子和成纤维细胞生长因子以及抗坏血酸作为无血清传代培养基,低浓度血小板衍生因子和成纤维细胞生长因子的联合使用,促进了间充质干细胞的分裂增殖,使细胞增殖传代时间缩短到1.5天,抗坏血酸可以维持间充质干细胞的干性稳定,防止间充质干细胞在增殖过程中分化或突变,这几种因子的联合使用使间充质干细胞在具备干性的基础上,快速分裂增殖,间充质干细胞传到20代时,仍保持较好的增殖和分化能力,克服了以往技术间充质干细胞快速老化的问题,同时缩短了培养时间。实施例2本实施例提供一种无血清传代培养基,所述无血清传代培养基的组分为:α-mem培养基、血小板衍生因子、成纤维细胞生长因子、抗坏血酸;所述血小板衍生因子的浓度为10ng/ml,在其他优选实施例中,所述血小板衍生因子的浓度为11ng/ml、12ng/ml、13ng/ml、14ng/ml或15ng/ml;所述成纤维细胞生长因子的浓度为10ng/ml,在其他优选实施例中,所述血小板衍生因子的浓度为11ng/ml、12ng/ml、13ng/ml、14ng/ml或15ng/ml。所述抗坏血酸的浓度为50μg/ml,在其他优选实施例中,所述抗坏血酸的浓度为25μg/ml、28μg/ml、30μg/ml、32μg/ml、35μg/ml、38μg/ml、40μg/ml、42μg/ml、45μg/ml、48μg/ml或49μg/ml。上述无血清传代培养基在无血清基础培养基α-mem的基础上添加了低浓度的血小板衍生因子和成纤维细胞生长因子以及抗坏血酸作为无血清传代培养基,低浓度血小板衍生因子和成纤维细胞生长因子的联合使用,促进了间充质干细胞的分裂增殖,使细胞增殖传代时间缩短到1.5天,抗坏血酸可以维持间充质干细胞的干性稳定,防止间充质干细胞在增殖过程中分化或突变,这几种因子的联合使用使间充质干细胞在具备干性的基础上,快速分裂增殖,间充质干细胞传到20代时,仍保持较好的增殖和分化能力,克服了以往技术间充质干细胞快速老化的问题,同时缩短了培养时间。上述配制的无血清传代细胞培养基,未使用胎牛血清,降低间充质干细胞临床使用风险;未使用人血白蛋白,节省了生产成本;使用本发明配制的无血清传代细胞培养基培养间充质干细胞,可以在短时间内获得纯度高、分化能力强、干性稳定、增殖能力强的间充质干细胞。实施例3本实施例提供一种无血清传代培养基,所述无血清传代培养基的组分为:α-mem培养基、血小板衍生因子、成纤维细胞生长因子、抗坏血酸和褪黑素;所述血小板衍生因子的浓度为15ng/ml,在其他优选实施例中,所述血小板衍生因子的浓度为10ng/ml、11ng/ml、12ng/ml、13ng/ml或14ng/ml;所述成纤维细胞生长因子的浓度为15ng/ml,在其他优选实施例中,所述血小板衍生因子的浓度为10ng/ml、11ng/ml、12ng/ml、13ng/ml、14ng/ml或15ng/ml;所述抗坏血酸的浓度为25μg/ml,在其他优选实施例中,所述抗坏血酸的浓度为28μg/ml、30μg/ml、32μg/ml、35μg/ml、38μg/ml、40μg/ml、42μg/ml、45μg/ml、48μg/ml、49μg/ml或50μg/ml;所述褪黑素的含量为10nm,在其他优选实施例中,所述褪黑素的含量为2nm、5nm、15nm、20nm、25nm、30nm、35nm、40nm、45nm、50nm、55nm、60nm、65nm、70nm、78nm、80nm、85nm、90nm、95nm、100nm、110nm、115nm、120nm、130nm、140nm、145nm、150nm、155nm、160nm、165nm、170nm、175nm、180nm、185nm、190nm、195nm、200nm。本实施例添加的褪黑素具有抗氧化作用,可以减少自由基对对细胞的伤害,能够在间充质干细胞分化20代以后,仍然能够有效维持间充质干细胞的分化潜能。实施例4人脐带间充质干细胞高产量培养的稳定性鉴定流式检测实施例1所述方法培养得到的p5、p20代人脐带间充质干细胞表面标志物cd73、cd90、cd105阳性的比例和cd34、cd45、hla-dr阴性的比例,分别取p5、p20代人脐带间充质干细胞用0.25mg/ml胰蛋白酶消化后计数,稀释为1×105-1×106个/l,分为六组,每组分别加入一种稀释后的单克隆抗体,所述单克隆抗体为cd73单克隆抗体、cd90单克隆抗体、cd105单克隆抗体、cd34单克隆抗体、cd45单克隆抗体、hla-dr单克隆抗体六种,稀释液为1%胎牛血清的磷酸缓冲液,以上单克隆抗体与稀释液的比例为:1:1000,室温孵育15-20min;将以上单克隆抗体的同型抗体与稀释液1:1000混合作对照,pbs洗涤2次后,分别加入fitc标记的不同二抗,二抗与稀释液的比例为1:5000,室温孵育15-20min,pbs洗涤两次,各加入流式上样buffer300μl,分别上机进行检测。人脐带间充质干细胞表面标志物cd73、cd90、cd105阳性检测标准一般不低于95%,cd34、cd45、hla-dr阴性检测标准一般不高于2%。表1结果显示,cd73、cd90、cd105阳性表达率均高于95%,cd34、cd45、hla-dr阴性表达率均低于2%,此结果符合人脐带间充质干细胞的标准,说明无血清传代培养基培养的p5、p20代人脐带间充质干细胞是稳定的。表1细胞代数cd90cd105cd34cd45hla-drcd73p599.68%97.17%1.41%0.12%0.37%96.21%p2098.34%96.38%0.57%0.53%1.65%95.34%表1是流式检测p5代、p20代人脐带间充质干细胞表面标志物cd73、cd90、cd105阳性的比例和cd34cd45hla-dr阴性的比例。实施例5脐带间充质干细胞增殖能力鉴定分别取p5代、p20代脐带间充质干细胞使用实施例2所述无血清传代培养基培养,记为实验组1;采用α-mem培养基+10%胎牛血清进行培养,记为对照组1;检测脐带间充质干细胞的增殖情况,绘制生长曲线。具体分组如下:细胞代数使用培养基p5实验组1p5对照组2p20实验组1p20对照组2从图2a-图5结果可知,p5代、p20间充质干细胞使用无血清传代培养基培养生长状态良好,生长曲线均成s形,与对照组1和对照组2相比,使用无血清传代培养基缩短了潜伏期时间,而且对数期增殖能力更强,细胞得率更高。实施例6血小板衍生因子、成纤维细胞生长因子的协同增殖性鉴定取10代间充质干细胞分别使用培养基a、培养基b、培养基c进行培养,检测细胞增殖能力,绘制生长曲线。接种密度为5×103,分别接种至24孔板上。培养基a:无血清基础培养基α-mem+血小板衍生因子,其中血小板衍生因子浓度为10ng/ml。培养基b:无血清基础培养基α-mem+成纤维细胞生长因子,其中成纤维细胞生长因子浓度为10ng/ml。培养基c:无血清基础培养基α-mem+血小板衍生因子+成纤维细胞生长因子,其中血小板衍生因子浓度为10ng/ml,成纤维细胞生长因子浓度为10ng/ml。比较血小板衍生因子、成纤维细胞生长因子、血小板衍生因子和成纤维细胞生长因子组细胞的增殖能力。结果如图6所示,血小板衍生因子、成纤维细胞生长因子、血小板衍生因子和成纤维细胞生长因子组细胞生长良好,生长曲线呈s形,血小板衍生因子和成纤维细胞生长因子组细胞与血小板衍生因子组、成纤维细胞生长因子组细胞相比,对数生长期细胞增殖能力更强,血小板衍生因子组、成纤维细胞生长因子组细胞对数期增殖能力无差异,表明血小板衍生因子、成纤维细胞生长因子在hc-msc的增殖能力方面表现为协同性。实施例7脐带间充质干细胞的分化能力鉴定分别取5代、20代间充质干细胞分别进行成骨、成软骨、成脂分化试验。(1)成骨分化试验分别取5代、20代间充质干细胞用无血清传代培养基重悬后以2×104/cm2接种在6孔板中,24h后,加入自制的成骨诱导培养基3ml,其成分:α-mem,10%fbs,地塞米松1mmol/l,β-甘油磷酸钠1mol/l,抗坏血酸50mmol/l,每两天更换自制的新鲜成骨诱导培养基,培养3周后,4%多聚甲醛固定,茜素红染色3-5min,显微镜下观察。结果见图7a-图7b,表明无血清传代培养基培养的5代、20代间充质干细胞在成骨诱导两周后,出现明显钙结节。(2)成软骨分化试验:分别取5代、20代间充质干细胞用无血清传代培养基重悬后以2×104/cm2接种在6孔板中,24h后,加入自制的成软骨诱导培养基3ml,成软骨诱导培养基的成分:α-mem,10%fbs,地塞米松100nmol/l、维生素c10mmol/l、tgf-β11ong/ml、转铁蛋白6.25μg/ml,每两天更换自制的新鲜成软骨诱导培养基,培养3周后,4%多聚甲醛固定,番红o染色3-5min,显微镜下观察。结果见图7c-图7d,表明无血清传代培养基培养的5代、20代间充质干细胞在成软骨诱导两周后,出现明显软骨细胞生成。(3)成脂分化试验分别取5代、20代间充质干细胞用无血清传代培养基重悬后以2×104/cm2接种在6孔板中,24h后,加入自制的成脂诱导培养基3ml,其成分:α-mem,10%fbs,地塞米松1mmol/l,胰岛素10mg/l,吲哚辛0.2mmol/l,每两天更换自制的新鲜成脂诱导培养基,培养2周后,4%多聚甲醛固定,油红o染色3-5min,显微镜下观察。结果见图7e-图7f,表明无血清传代培养基培养的5代、20代间充质干细胞在成脂诱导两周后,细胞内出现多量的脂滴。实施例8人脐带间充质干细胞对外周血单核细胞(pbmc)免疫调节能力鉴定分别取5代、10代、15代、20代间充质干细胞以2×104/cm2接种在6孔板中,37℃孵育72h,弃上清。t淋巴细胞,用1640培养基重悬,以5×105/ml接种于上述各孔,加入聚羟基脂肪酸酯(pha,polyhydroxyalkanoates)5μg/ml刺激淋巴细胞增殖。每组5个平行孔,37℃孵育72h,加入cck820μl/孔,继续孵育4h,于酶标仪450nm处测定od值。分组:uc-msc组;uc-msc+pha组;uc-msc+pbmc组;pbmc组;uc-msc+pbmc+pha组;pbmc+pha组计算淋巴细胞增殖抑制率,公式如下:抑制率(%)=1-[(uc+淋巴细胞+pha)-(uc+淋巴细胞)]/[(淋巴细胞+pha)-淋巴细胞]×100%结果见表2,结果表明5代、10代、15代、20代间充质干细胞对外周血单核细胞(pbmc)免疫调节能力无显著性差异。表2是第5代、20代人脐带间充质干细胞进行免疫调节检测。以上显示和描述了本发明的基本原理和主要特征及本发明的优点,本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内,本发明要求保护范围由所附的权利要求书及其等效物界定。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1