OsWRKY12及其在水稻磷高效育种中的应用
oswrky12及其在水稻磷高效育种中的应用
技术领域
1.本发明属于植物基因工程领域。具体的说,本发明涉及一种反向遗传学途径鉴定的水稻oswrky12基因,该基因在地上部受缺磷诱导,根部受缺磷先诱导后恢复,超表达该基因可以显著提高水稻对磷的吸收效率;本发明还涉及利用该基因产物提高水稻的磷吸收效率。
背景技术:
2.磷(p)是植物正常生长发育所必需的大量营养元素之一,是atp、磷脂、核酸等代谢物及生物大分子的重要组成部分,参与植物体内磷酸化、碳代谢等多种生化过程[1,2]。土壤中的无机磷大约占总磷的35%
‑
70%,但是很容易与钙以及铝、铁的氧化物、氢氧化物等形成难溶的复合物,因此能够被植物直接吸收利用的正磷酸盐(pi,h2po
4_
)是非常有限的[3]。2013年,农业部《中国三大粮食作物肥料利用率研究报告》指出,我国水稻、玉米、小麦三大粮食作物的磷肥当季平均利用率仅为24%。植物在长期的演化中进化出了多种策略利用土壤养分,以便其生存、生长和繁殖。水稻生产中磷肥利用率低,增加了成本和污染。因此,阐明水稻吸收磷的分子机理,通过遗传改良的方法提高作物的肥料利用效率,为科学、合理地使用化学肥料、节能减排提供理论基础,也是绿色农业的重大使命和必然要求。
[0003]
为了应对低磷的生长环境,植物进化出多种策略,以高效吸收、利用土壤中的有效磷。土壤中有效磷的水平较低时,植物体内psi(pi
‑
starvation
‑
inducible)基因会诱导并分泌一系列磷酸水解酶,来释放根际环境中的有机磷[4]。磷酸水解酶分解有机磷基质释放的磷占土壤中全部无机磷的80%[5]。
[0004]
此外,植物体通过整合外部及自身的磷的状况,形成复杂的磷调控网络。植物体内的生化响应途径主要包括两部分功能,通过增强磷酸酶的分泌、有机酸的释放来活化土壤中的有机磷,通过诱导高亲和性的磷酸盐转运体从而增强植物对磷的摄取能力[6],以及通过新陈代谢层面的调控来适应缺磷[7]。
[0005]
迄今为止,wrky转录因子中与养分胁迫相关的报道还比较少。拟南芥中atwrky75是首个报道的与营养胁迫相关的wrky转录因子。atwrky75的表达受到缺磷诱导,通过rnai抑制atwrky75表达的拟南芥植株,相比于野生型,在生长发育早期出现花青素积累,表现为对缺磷更加敏感,同时抑制了植株体内许多缺磷响应基因的表达,包括ips1以及高亲和性的磷转运体atpht1;1、atpht1;4,因此在缺磷时对磷的吸收减少。此外,rnai株系的侧根长度、数量,以及根毛的数量都增加,表明,atwrky75可能同时参与调控根的发育[8]。缺磷情况下,根部atwrky45的表达被明显诱导,与atwrky75相同,atwrky45的rnai株系同样表现为低磷敏感的表型。超表达atwrky45基因,能够同时诱导atpht1;1的表达,染色质免疫沉淀实验结果表明,atwrky45能够与atpht1;1中的w
‑
box结合,从而直接调控atpht1;1的表达,参与拟南芥的缺磷应答[9]。在磷充足的情况下,atwrky42能与pho1结合,缺磷时atwrky42被降解,失去了结合能力,表明atwrky42通过控制pho1调控磷的转运。atwrky42与atpht1;1的结合也是如此[10]。atwrky6也能通过与pho1结合下调pho1的表达,最近的研究表明,缺磷
no:1所示的dna序列。本发明中的seq id no:2所示的氨基酸序列属于oswrky12,其中进行一个或几个替换,插入或缺失所获得的功能类似物。另外,也包括在seq id no:1中添加、取代、插入或缺失一个或多个核苷酸而生成的突变体、等位基因或衍生物,具有相同功能的序列也能达到本发明的目的。
[0030]
本发明的另一个目的是提供一种用oswrky12基因进行高效的植物转化的方法,具体地说,本发明提供了具有seq id no:1所示的序列的基因片段的载体。
[0031]
本发明还提供了一种利用植物表达载体转化植物提高磷吸收效率的方法。
[0032]
本发明鉴定到一个参与调控水稻(oryza sativa)磷平衡的wrky转录因子oswrky12。该基因在地上部受缺磷诱导,并且随着缺磷时间增加,诱导倍数逐渐提高,在根部随着缺磷时间的增加,先诱导后降低到野生型水平;超表达oswrky12能够显著提高转基因水稻对磷的吸收效率。因此可以利用该基因通过基因工程技术提高水稻对磷的吸收利用效率。
[0033]
实现本发明的具体技术步骤如下:
[0034]
一、wrky12在不同缺磷条件下表达模式
[0035]
野生型水稻在正常营养液培养7天后,在缺磷营养液中培养0天、1天、3天、5天及7天,提取地上部和根部的总rna,逆转录,进行荧光定量pcr。
[0036]
二、发展超表达材料
[0037]
通过构建oswrky12基因超表达载体,并进行水稻转基因,获得超表达材料。鉴定t1代超表达株系,进行无机磷含量的测定,确定磷表型。发现超表达oswrky12基因促进磷的吸收。
[0038]
本发明实验结果证明:超表达oswrky12的株系,正常条件下苗期叶片有效磷比野生型高300%。
附图说明
[0039]
下面结合附图对本发明的具体实施方式作进一步详细说明。
[0040]
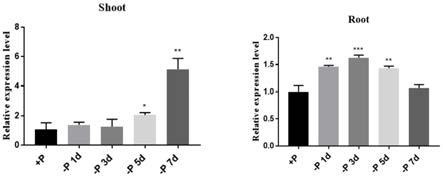
图1为wrky12在不同缺磷条件下的表达模式;
[0041]
野生型水稻在正常营养液培养7天后,在缺磷营养液中培养0天、1天、3天、5天及7天,提取叶片和根部的总rna,逆转录,进行荧光定量pcr。数据为3次重复的平均数
±
sd,*表示相对于野生型存在显著差异(p<0.05,t
‑
test),**表示相对于野生型存在显著差异(p<0.01,t
‑
test),***表示相对于野生型存在显著差异(p<0.005,t
‑
test)。
[0042]
根据图1,可得知:在地上部wrky12基因表达受缺磷诱导,随着缺磷时间的增加,诱导越强;在根部,wrky12基因表达受缺磷先诱导后恢复。
[0043]
图2为超表达oswrky12促进磷的吸收。
[0044]
a.oswrky12超表达转基因材料t1代的鉴定。
[0045]
b.野生型hj2水稻以及35s
‑
1300
‑
oswrky12转基因材料t1代的8号、18号及19号株系在正常营养液(200μm pi)条件下培养21天,地上部分剪取倒二叶,地下部分剪取新生的不定根,测定无机磷含量。*表示相对于野生型存在显著差异(p<0.05,t
‑
test),**表示相对于野生型存在显著差异(p<0.01,t
‑
test),***表示相对于野生型存在显著差异(p<0.001,t
‑
test),****表示相对于野生型存在显著差异(p<0.0001,t
‑
test)。
[0046]
根据图2,可得知:超表达oswrky12株系叶片中无机磷含量约为野生型的4倍,说明oswrky12基因正调控水稻磷平衡,能够提高叶片无机磷浓度。
[0047]
图3为超表达oswrky12载体。
具体实施方式
[0048]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明范围。
[0049]
实施例1、水稻rna提取
[0050]
(1)水稻培养
[0051]
水稻野生型日本晴种子用1%稀硝酸浸泡16h,破除休眠状态。播种于网纱板上,正常营养液(配方见表1),7天后移栽到有海绵球支撑的孔板上。每7天换一次营养液。根据实验需求择机取样,提取rna。对于研究oswrky12基因表达模式所需的rna,从移栽到孔板起,分成2组。其中一组作为对照组,采用正常营养液进行培养;另一组采用缺磷营养液(表1中stock
‑
2减少90%,并补充kcl)进行培养。处理7天后,分别对正常营养液和缺磷营养液中培养的水稻幼苗进行取样,提取根、叶的总rna,进行逆转录。
[0052]
表1、水稻营养液配方
[0053][0054]
(2)水稻rna提取
[0055]
rna的提取使用德国macherey
‑
nagel公司的nucleospin rna plant试剂盒进行抽提。步骤如下:
[0056]
1)准备2ml进口离心管若干,每管中放入经酒精浸泡、纯水冲洗、晾干的氧化锆打
样珠2粒;
[0057]
2)取样:剪取适当苗龄的水稻叶片、根的幼嫩部位(其中根需要在纯水中漂洗后用纸巾擦干),约100mg,剪碎后置于进口离心管中,迅速置于液氮中;
[0058]
3)打样:在打样机中以23次/s的频率打样,持续45s,将打样后的离心管再次置于液氮中;
[0059]
4)裂解:准备裂解液ra1(lysis buffer),每个样品需用350μl ra1与3.5μlβ
‑
巯基乙醇,根据样品数量,准备相应的ra1、β
‑
巯基乙醇,混合均匀;
[0060]
5)涡旋:从液氮中取出离心管,于每管中加入350μl裂解液,在涡旋振荡器上,充分涡旋振荡3min;
[0061]
6)离心:涡旋至匀浆状的样品,室温条件下,置于离心机中,13000rpm,离心10min;
[0062]
7)过滤:吸取离心后的上清液于紫色过滤柱(nucleospin)中,12000
×
g,离心2min;
[0063]
8)将滤液转移到新的2ml进口离心管中,丢弃紫色过滤柱。按照1:1的比例,向滤液中加入70%的乙醇350μl,上下颠倒混匀;
[0064]
9)过滤:将上述混合液转移到蓝色过滤柱(nucleospin rna plant column)中,11000
×
g,离心1min,弃下层滤出液;
[0065]
10)向蓝色过滤柱中加入350μl mdb,11000
×
g,离心1min,弃下层滤出液;
[0066]
11)去除基因组dna每样品需用dnase buffer 90μl与dnase 10μl,按照所需用量混匀后,吸取95μl加入蓝色过滤柱中央滤膜上,室温静置15
‑
20min;
[0067]
12)于每个蓝色过滤柱中加入200μl buffer raw2,11000
×
g,离心1min,弃下层滤出液;
[0068]
13)于每个蓝色过滤柱中加入600μl buffer raw3,11000
×
g,离心1min,弃下层滤出液;
[0069]
14)于每个蓝色过滤柱中加入250μl buffer raw3,11000
×
g,离心1min,弃下层滤出液;
[0070]
15)11000
×
g,离心1min,尽可能除去滤膜上的水分,并打开离心管盖,静置1min,以便酒精挥发;
[0071]
16)将蓝色过滤柱转移到新的1.5ml进口离心管中,在滤膜中央加入30μl rnase
‑
free的h2o,静置1min,11000
×
g,离心1min。滤除液即为水稻总rna。
[0072]
(3)逆转录
[0073]
将得到的rna样品,使用nanodrop nd
‑
1000测量浓度。使用takara公司的primescript rt reagent kit with gdna eraser(perfect real time)试剂盒,对rna样品进行逆转录。步骤如下:
[0074]
于200μl进口离心管中加入以下组分:
[0075][0076]
将样品用移液枪吹打混匀,短暂离心,放入pcr仪中,42℃,5min,取出置于冰上冷却;
[0077]
继续向其中加入以下组分:
[0078][0079]
将样品用移液枪吹打混匀,短暂离心,放入pcr仪中,37℃,60min,然后85℃,3min。所得产物即为cdna第一链。
[0080]
(4)实时荧光定量pcr
[0081]
qrt
‑
pcr所使用的引物如下:
[0082][0083]
说明:每对引物对应一个基因,其中actin为内参,ips1为阳性对照。
[0084]
qrt
‑
pcr使用lightcycler 480sybr greenⅰmaster(roche公司)。
[0085]
反应体系如下:
super
‑
fidelity dna polymerase(南京诺唯赞生物科技有限公司)试剂盒,扩增所需片段。扩增体系:
[0095][0096]
得到的片段和pcambia1300载体以bamhi、sali酶切、连接;转化大肠杆菌dh5α,挑菌,扩摇抽取质粒,经过测序与seq id no:1序列完全一致后,得35s
‑
1300
‑
oswrky12超表达载体(图3)。载体转入农杆菌感受态eha105中进行水稻转基因。
[0097]
实施例3、水稻转基因及t0代阳性转基因苗的筛选
[0098]
一、水稻转基因
[0099]
1外植体的消毒
[0100]
(1)选择饱满的野生型日本晴种子,脱去颖壳,注意不要损伤种子;
[0101]
(2)将种子置于50ml灭菌离心管中,使用75%的乙醇对种子进行消毒,摇床1min,清洗两遍;
[0102]
(3)使用30%次氯酸钠溶液对种子进行消毒,摇床30min;
[0103]
(4)将种子用灭菌水清洗3遍,每次摇床5min。
[0104]
2诱导愈伤组织
[0105]
(1)在超净工作台上,使用灭菌纸巾擦干种子,每个愈伤组织诱导培养基中放入15粒;使用0.22μm胶带(3m公司)封住培养基,放置于28℃培养箱中诱导4周;
[0106]
(2)4周后,挑取淡黄色愈伤放入继代培养基中,每培养基约25颗,28℃培养箱中继续培养1周。
[0107]
3共培养、选择抗性愈伤组织
[0108]
(1)准备农杆菌吸取实施例2中得到的农杆菌菌液50μl,加入到50ml相应抗性的yep液体培养基中,28℃、200rpm摇床培养至细菌对数生长期;
[0109]
(2)侵染、共培养4000rpm、10min离心农杆菌菌液,弃上清,用含200μm as(乙酰丁香酮)的40ml aam感菌液制成悬浮液,调整od
600
至0.01;将农杆菌菌液倒入灭菌平皿中,挑取80
‑
120个愈伤置于其中,水平摇床缓慢震荡10min;用移液枪吸出菌液,将愈伤放在灭菌纸巾上晾干,然后置于共培养基上,25℃暗培养3天;
[0110]
(3)选择培养将愈伤取出置于50ml灭菌离心管中,加入适量灭菌水清洗5次,然后加入含有300mg/l羧苄青霉素钠(carb300)的无菌水,缓慢摇晃30min,取出后置于灭菌纸巾上沥干水分;然后将愈伤置于含有300mg/l carb300和50mg/l潮霉素(hyg+)的选择培养基
上进行第一轮选择培养,28℃光照培养14天;再将选择培养的愈伤组织转到含300mg/l carb300和50mg/l hyg+的培养基上进行第二轮选择培养,28℃光照培养15d,直到新的抗性愈伤组织长出;
[0111]
(4)分化、生根挑选同一愈伤的3粒鲜黄色抗性愈伤放入分化培养基,25℃恒温培养室(16/24h光周期)中待其分化成苗;待苗长至约2cm时,取出置于生根培养基中,培养一周;
[0112]
(5)炼苗、移栽待苗生长至分化罐顶部时,可打开分化罐,加入适当水,置于温室,炼苗2
‑
3天;洗净水稻苗根部培养基,即可进行移栽。
[0113]
二、t0代阳性转基因苗的筛选
[0114]
t0代转基因苗在正常条件下(温度:白天30℃,晚上22℃;湿度>60%;光照度30000lx,16h/8h光周期)溶液培养1周之后,取1cm长的叶片提取基因组dna,利用抗性筛选标记基因对转基因苗进行鉴定,筛选成功的转化株系。pcr体系同实施例2。
[0115]
说明:鉴定结果为阳性时,判定为成功的转化株系。
[0116]
三、阳性转基因苗的rt
‑
pcr鉴定
[0117]
对阳性转基因水稻提取总rna,进行逆转录,采用qrt
‑
pcr实验检测oswrky12基因的相对表达量。
[0118]
具体如下:
[0119]
1、rna的提取
[0120]
使用德国macherey
‑
nagel公司的nucleospin rna plant试剂盒进行抽提。步骤如下:
[0121]
(1)取样至于液氮环境中,在冷冻状态下将样品在打样机中充分打碎。
[0122]
(2)加入裂解液、涡旋,离心。
[0123]
(3)取上清液于过滤柱中,除去蛋白、dna以及盐分。
[0124]
(4)用rnase
‑
free h2o洗脱获取rna。
[0125]
2、逆转录
[0126]
将得到的rna样品,使用nanodrop nd
‑
1000测量浓度。使用takara公司的primescript rt reagent kit with gdna eraser(perfect real time)试剂盒,对rna样品进行逆转录。
[0127]
3、qrt
‑
pcr
[0128]
qrt
‑
pcr使用lightcycler 480sybr greenⅰmaster(roche公司)。
[0129]
反应体系如下:
[0130][0131]
qrt
‑
pcr使用lightcycler 480ⅱ(roche公司),反应程序如下:
[0132][0133]
相对表达量的结果如图2a所示,在3个阳性株系中,wrky12的表达都比野生型要高。
[0134]
实施例4、水稻无机磷含量的测定
[0135]
(1)水稻的培养水稻种子经1%稀硝酸破除休眠状态后,置于网纱板上培养7天,随后移栽于水槽中的孔板上,正常营养液培养,每7天更换一次营养液,取样前3天可更换一次营养液;
[0136]
(2)取样水稻在孔板上培养3周后即可取样。叶片剪取倒二叶,根在去离子水中漂洗、擦干水分后,剪取新生长出的不定根。取样的质量范围为0.05
‑
0.08g。使用2ml离心管取样,取样前后均需使用万分之一天平对离心管进行称重;
[0137]
(3)打样于每个2ml离心管中加入2粒氧化锆打样珠,用移液枪向每管中加入500μl 5m硫酸,紧闭离心管盖,在打样机中打成匀浆状;
[0138]
(4)稀释向每管样品中分次加入共计5ml的去离子水,同时转移到15ml离心管中,颠倒摇匀;
[0139]
(5)过滤将稀释后的样品,经3层折叠的定量分析滤纸过滤后,转移到新离心管;
[0140]
(6)将样品放置于流动分析仪(skalar,skalar san plus system)上进行测定。
[0141]
结果如图2所述,wrky12超表达株系叶片和根部的有效磷相比野生型提高到了4倍以上,说明wrky12超表达能够提高水稻的磷吸收。
[0142]
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1