取代的吡唑类化合物的制备及其作为邻氨基苯甲酰胺前体的用途的制作方法
取代的吡唑类化合物的制备及其作为邻氨基苯甲酰胺前体的用途
1.相关申请
2.本技术要求于2019年4月19日提交的中国专利申请号201910317694.4的优先权,其内容通过引用整体并入本文。
发明领域
3.本发明涉及制备取代的吡唑衍生物及其进一步转化为农药活性的邻氨基苯甲酰胺化合物,特别是氯虫苯甲酰胺(chloranthraniliprole)。
4.发明背景
5.吡唑类化合物是含氮的五元杂环,其构成一类广泛用于有机合成的化合物。因为它们以具有各种应用(特别是在农业中)的不同结构存在,它们是含氮杂环类中研究最多的化合物群组之一。实际上,多年来已经报道了大量生成活性农药的吡唑前体的合成方法。
6.特别感兴趣的活性农药是先前例如在pct专利公开wo 2001/070671、wo 2003/015519和wo 2003/015518中公开的邻氨基苯甲酰胺杀虫剂,特别是氯虫苯甲酰胺。导致制备所述邻氨基苯甲酰胺类化合物的多种吡唑前体及其制备的一般方法公开于例如pct专利公开wo 2001/070671、wo 2006/062978、wo 2003/016283、wo 2004/011447和wo 2003/015519中。此外,例如在wo 1998/040358、ep0333131、ep 0151866和us3254093中公开了可用于进一步制备邻氨基苯甲酰胺类化合物的一些吡唑前体的制备。然而,所有记载的方法在工业规模的批量合成中仅具有有限的用途。
7.此外,pct专利公开wo 2001/070671和wo 2003/016300都以一般方式公开了取代的甲基吡唑的烷基化和通过高锰酸钾使甲基基团进一步氧化以产生作为制备邻氨基苯甲酰胺类化合物的前体的吡唑羧酸类化合物。然而,上述类型的转化仅记载了吡唑环上的烷基和/或卤代烷基取代基,并且没有提供制备起始甲基吡唑类化合物的工业规模方式。因此,仍然需要用于生产起始甲基吡唑类化合物及通过卤素取代的甲基吡唑类化合物的烷基化和随后甲基基团的有效氧化将其进一步转化为氯虫苯甲酰胺的吡唑羧酸前体的有效工业规模方法。通常,需要用于制备氯虫苯甲酰胺的吡唑羧酸前体的另外的成本有效的大规模工业方法。
技术实现要素:
8.本发明涉及通过任选地在碱和有机溶剂的存在下,使式ii化合物与卤素取代的吡啶反应来制备吡唑衍生物3
‑
溴
‑5‑
甲基
‑1‑
h
‑
吡唑
‑
n
‑2‑
氯吡啶(式i化合物)
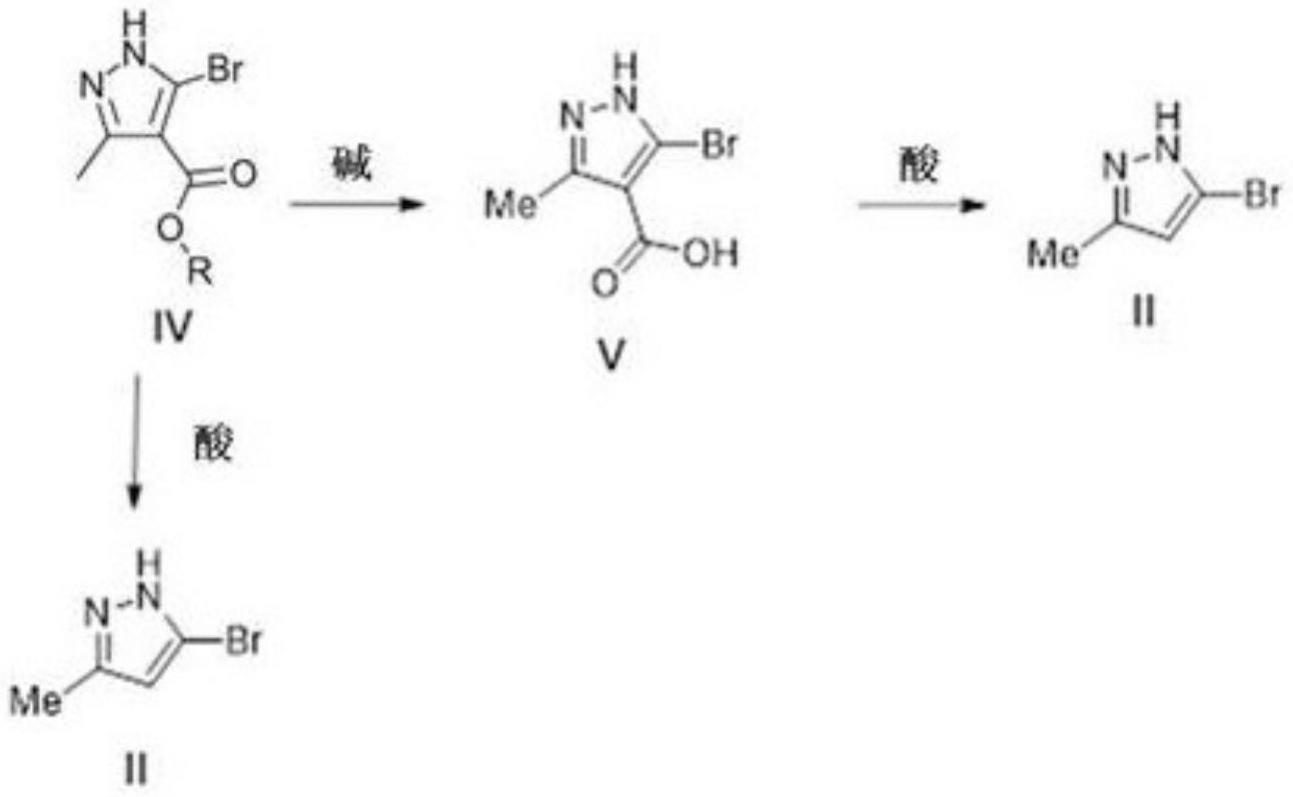
9.10.根据本发明,还提供了制备式ii化合物的方法,其包括使式iv化合物与碱接触以得到式v化合物,并进一步在酸存在下使式v化合物脱羧,或通过使式iv化合物与酸接触以得到式ii化合物,
[0011][0012]
此外,本发明涉及制备式iv化合物的方法,其包括任选在碱和有机溶剂存在下,使式vi化合物与溴化剂接触,
[0013][0014]
此外,本发明涉及制备式i化合物的方法,其包括在酸的存在下使式xi化合物脱羧,
[0015][0016]
此外,本发明涉及制备式xi化合物的方法,其包括:a)任选地在碱和有机溶剂的存在下,使式xii化合物与溴化剂接触,以得到式xiii化合物;和b)使式xiii化合物与酸接触
[0017][0018]
此外,本发明涉及制备式xi化合物的方法,其包括:a)使式iv化合物与碱接触以得到式v化合物,
[0019]
[0020]
其中r是c1
‑
c6烷基、c1
‑
c6烷氧基、c3
‑
c6环烷基、任选取代的苯基或任选取代的苄基;
[0021][0022]
和b)在碱和有机溶剂的存在下,任选地在催化剂的存在下,使式v化合物与式iii的吡啶接触,
[0023]
其中l是离去基团。
[0024]
此外,本发明涉及由如上所述制备的式xi化合物制备式i化合物的方法。
[0025]
此外,本发明提供式i化合物:
[0026][0027]
此外,本发明提供制备式vii化合物的方法,
[0028][0029]
其包括任选地在催化剂的存在下使式i化合物与氧化剂反应。
[0030]
本发明还涉及使用式i化合物制备式viii化合物的方法,
[0031][0032]
本发明还涉及制备式viii化合物的方法,
[0033][0034]
其包括以下步骤:任选地在催化剂的存在下使式i化合物与氧化剂反应,以得到式vii化合物;然后使式vii化合物与邻氨基芳族羧酸ix
[0035][0036]
反应以得到相应的苯并噁嗪酮x
[0037][0038]
然后使所得苯并噁嗪酮x与甲胺反应,以得到式viii化合物。
[0039]
此外,本发明提供制备式viii化合物的方法,
[0040][0041]
该方法通过以下方式进行:任选地在催化剂的存在下使式i化合物与氧化剂反应,以得到式vii化合物,然后使式vii化合物与邻氨基苯甲酰胺xiv反应以得到式viii化合物,
[0042]
[0043]
本发明的另一方面涉及使用如上所述制备的式i化合物制备式viii化合物的方法。
[0044]
本发明的另一方面涉及使用如上所述制备的式vii化合物制备式viii化合物的方法。
[0045]
本发明的又一方面涉及使用如上所述制备的式ii化合物制备式viii化合物的方法。
[0046]
本发明的又一方面涉及使用如上所述制备的式xi化合物制备式viii化合物的方法。
具体实施方式
[0047]
如本文所用,术语“包含(comprises)”、“包含(comprising)”、“包括(includes)”、“包括(including)”、“具有(has)”、“具有(having)”、“含有(contains)”、“含有(containing)”、“特征在于”或其任何其他变型旨在明确指出的任何限制的情况下,涵盖非排他性的包括。例如,包含元素列表的组合物、混合物、工艺或方法不一定仅限于那些元素,而是可包括未明确列出的或这种组合物、混合物、工艺或方法固有的其他元素。
[0048]
连接短语“由
……
组成”排除了未指定的任何元素、步骤或成分。如果在权利要求中,这样的短语会使权利要求不包含除了所述材料之外的材料,除通常与之相关的杂质外。当短语“由
……
组成”出现在一项权利要求正文的一个条款中,而不是紧接在前序之后时,它仅限制该条款中规定的元素;其他元素不排除在整个权利要求之外。
[0049]
连接短语“基本上由
……
组成”用于定义还包括除了字面上公开的那些之外的材料、步骤、特征、组件或元素的组合物或方法,条件是这些附加材料、步骤、特征、组件或元素不会对要求保护的发明的基本和新颖特征产生实质性影响。术语“基本上由
……
组成”占据“包含”和“由
……
组成”之间的中间地带。
[0050]
如果申请人已经用开放式术语例如“包含”定义发明或其一部分,则应容易理解(除非另有说明)该描述应被解释为也使用术语“基本上由
……
组成”或“由
……
组成”来描述这样的发明。
[0051]
此外,除非明确说明相反的情况,否则“或”是指包含性的或,而不是排他性的或。例如,条件a或b满足以下的任何一项:a为真(或存在)且b为假(或不存在),a为假(或不存在)且b为真(或存在),和a和b均为真(或存在)。
[0052]
而且,在本发明的元素或组件之前的不定冠词“一”和“一个”旨在对于元素或组件的实例(即,出现)的数量是非限制性的。因此,“一”或“一个”应被理解为包括一个或至少一个,并且元素或组件的单数单词形式也包括复数,除非该数字显然表示单数。
[0053]
本发明的某些化合物可以作为一种或多种立体异构体存在。各种立体异构体包括对映异构体、非对映异构体和几何异构体。本领域技术人员将理解,当相对于其他一种或多种立体异构体富集时或当与其他一种或多种立体异构体分离时,一种立体异构体可能更具活性和/或可能表现出有益效果。另外,技术人员知道如何分离、富集和/或选择性地制备所述立体异构体。
[0054]
因此,本发明化合物可以作为立体异构体的混合物、单独的立体异构体或作为光学活性形式存在。
[0055]
术语“卤素”,单独地或在复合词如“卤代烷基”中,包括氟、氯、溴或碘。此外,当用于诸如“卤代烷基”的复合词时,所述烷基可部分或完全被卤素原子取代,所述卤素原子可以相同或不同。“卤代烷基”的实例包括f3c、clch2、cf3ch2和cf3ccl2。术语“卤代烷氧基”包括cf3o、ccl3ch2o、hcf2ch2ch2o和cf3ch2o。
[0056]
根据一个实施方案,式i化合物通过在碱和有机溶剂存在下,任选地在催化剂的存在下,使式ii化合物与式iii的吡啶(其中l为离去基团)反应来制备,如方案1所示:
[0057][0058]
方案1。
[0059]
l可以是与反应条件相容的任何离去基团。例如,l可以是卤素或任选卤代的磺酰基基团。
[0060]
根据一个实施方案,在上述反应中使用的合适的碱选自碱金属和碱土金属的氢氧化物、氢化物、醇盐、以及硫酸盐、磺酸盐、亚磺酸盐、磷酸盐、膦酸盐、甲酸盐、草酸盐、碳酸盐、乙酸盐、丙酸盐、苯甲酸盐和柠檬酸盐。更优选地,合适的碱可以是碱金属碳酸盐和/或碱金属氢氧化物。
[0061]
在上述方法步骤中使用的合适的碱通常以0.01至100.0mol、更优选0.1至10.0mol、特别是1.0至5.0mol且尤其是1.2至2.0mol的量使用,各自基于1mol的式ii化合物计。
[0062]
根据另一个实施方案,有机溶剂可选自极性或非极性有机溶剂,例如c1
‑
c6醇、酮、酯、芳族溶剂、杂芳族溶剂、脂族溶剂、酰胺、砜、亚砜、卤代溶剂、腈、碳酸酯、脲及其混合物。合适的极性溶剂可以是,例如但不限于,醇(优选c1
‑
c4醇)、丙酮、乙腈、四氢呋喃、二甲基亚砜、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、n,n
‑
二甲基乙醇胺或它们的混合物。在一个实施方案中,合适的溶剂由n,n
‑
二甲基乙酰胺、n,n
‑
二甲基甲酰胺、二甲基亚砜、正丁醇、乙醇或其混合物组成。在一个优选的实施方案中,合适的极性溶剂由n,n
‑
二甲基乙酰胺、二甲基亚砜或其混合物组成。合适的非极性溶剂可以是,例如但不限于,c1
‑
c6烷烃,c1
‑
c6卤代烷烃,芳族溶剂如苯、二甲苯、硝基苯,和/或醚如1,4
‑
二噁烷,或其混合物。
[0063]
合适的催化剂选自碱金属氟化物如csf、kf、naf,季铵盐如四乙基硫酸氢铵、三乙基苄基氯化铵,鏻盐如四苯基溴化鏻,peg,冠醚及其混合物。
[0064]
催化剂与式ii的吡唑化合物的合适摩尔比为0.001至100mol/mol,特别是0.01至10.0mol/mol。
[0065]
原则上,反应物可以以任何所需的顺序彼此接触。例如,可以首先装入任选地溶解在溶剂中或为分散形式的式ii化合物和式iii的吡啶的每一种,然后加入任选为溶解或分散形式的碱,或相反地首先装入任选地溶解或分散在溶剂中的碱并与化合物ii混合。可替代地,也可以将两种反应物同时加入反应容器中。
[0066]
根据一个实施方案,如方案2中所示制备式ii化合物。该方法包括使式iv化合物(其中r为c1
‑
c6烷基、c1
‑
c6烷氧基、c3
‑
c6环烷基、任选取代的苯基或任选取代的苄基)与碱
接触,以得到式v化合物,并进一步在酸的存在下使式v化合物脱羧,或通过使式iv化合物与酸接触,以得到式ii化合物。
[0067][0068]
方案2.式ii化合物的制备。
[0069]
根据一个实施方案,将式iv化合物与碱一起加热,优选加热至90℃至120℃的温度,更优选加热至100℃的温度。将反应混合物冷却至5至10℃的温度并进一步用酸淬灭后,分离得到的式v化合物。合适的碱选自碱金属和碱土金属的氢氧化物、氢化物、醇盐、以及硫酸盐、磺酸盐、亚磺酸盐、磷酸盐、膦酸盐、甲酸盐、草酸盐、碳酸盐、乙酸盐、丙酸盐、苯甲酸盐和柠檬酸盐,优选选自碱金属氢氧化物或醇盐,如氢氧化钠、氢氧化钾、叔丁醇钾等。
[0070]
根据一个实施方案,所述酸选自盐酸、氢溴酸、四氟硼酸、六氟磷酸、三氟乙酸、硫酸、磺酸、亚磺酸、磷酸、膦酸及其混合物。
[0071]
根据另一个实施方案,通过将式v化合物与30
‑
60体积%的酸优选加热至90℃至120℃的温度,更优选加热至100
‑
105℃的温度,将得到的式v化合物转化为式ii化合物,所述酸例如为盐酸、氢溴酸、四氟硼酸、六氟磷酸、三氟乙酸、硫酸、磺酸、亚磺酸、磷酸、膦酸及其混合物。
[0072]
根据另一个实施方案,上述式iv化合物向式ii化合物的转化可以以一锅法(one
‑
pot
‑
process)进行,而不分离式v化合物。
[0073]
根据另一个实施方案,通过包括将式iv化合物与30
‑
60体积%的酸优选加热至90℃至120℃的温度,更优选加热至100
‑
110℃的一步法获得式ii化合物,所述酸例如为盐酸、氢溴酸、四氟硼酸、六氟磷酸、三氟乙酸、硫酸、磺酸、亚磺酸、磷酸、膦酸及其混合物。
[0074]
根据一个实施方案,式iv化合物通过溴化式vi化合物制备,其中r如前所定义,所述溴化包括任选地在碱和有机溶剂的存在下,使式vi化合物与溴化剂接触,如方案3所示。
[0075]
根据一个实施方案,合适的碱选自碱金属和碱土金属的氢氧化物、氢化物、醇盐、以及硫酸盐、磺酸盐、亚磺酸盐、磷酸盐、膦酸盐、甲酸盐、草酸盐、碳酸盐、乙酸盐、丙酸盐、苯甲酸盐和柠檬酸盐。
[0076]
根据另一个实施方案,合适的有机溶剂选自c1
‑
c6醇、酮、酯、芳族溶剂、杂芳族溶剂、脂族溶剂、酰胺、砜、亚砜、卤代溶剂、腈、碳酸酯、脲及其混合物。
[0077]
能够产生亲电子溴离子(br+)的任何溴化剂可用于所述溴化方法。这种试剂的非限制性实例包括溴(br2)、n
‑
溴代琥珀酰亚胺(nbs)、二溴二甲基乙内酰脲、n
‑
溴代邻苯二甲
酰亚胺、n
‑
溴代糖精、溴代异氰脲酸单钠水合物、二溴异氰脲酸(=dbi)、溴化二甲基溴化鋶、5,5
‑
二溴麦氏酸(5,5
‑
dibromomeldrum's acid)cas号:66131
‑
14
‑
4、双(2,4,6
‑
三甲基吡啶)
‑
溴鎓六氟磷酸盐和brcl及其混合物。
[0078]
根据一个实施方案,合适的溴化剂选自溴(br2)、n
‑
溴代琥珀酰亚胺(nbs)和/或n
‑
溴代邻苯二甲酰亚胺。
[0079]
根据一个实施方案,所采用的方法,其中溴化剂的量选自0.01至10.0摩尔当量的值,相对于起始的式vi化合物计。
[0080]
根据一个实施方案,该方法在碱的存在下使用。
[0081]
在该实施方案的一类中是这样的方法,其中所用碱的量选自0.01至10.0摩尔当量的值,相对于起始的式vi化合物计。
[0082][0083]
方案3.式iv化合物的制备
[0084]
根据一个实施方案,溴化方法可以在有机溶剂的存在下进行。合适的有机溶剂包括乙腈、丙腈和卤代的饱和脂族烃,例如低级烷基卤化物——如二氯甲烷、四氯化碳、氯仿、溴氯甲烷、1,1,2
‑
三氯乙烷、1,2
‑
二溴乙烷、二溴甲烷、二氯乙烷等。液体饱和烃稀释剂也是合适的,并且典型地是这样的物质,例如环己烷、甲基环己烷、1,3
‑
二甲基环己烷、1,4
‑
二甲基环己烷、异丙基环己烷。
[0085]
根据另一个实施方案,该方法在碱和有机溶剂的存在下使用。
[0086]
在本发明的实施中,反应温度保持在0至50℃的范围内,优选在15至30℃的范围内,基本上持续整个反应期间,即至少直至所有的溴化剂和式vi化合物已混合在一起。由于溴化反应是放热的,因此优选通过向式vi化合物底物中逐步加入溴化剂来保持温度控制。
[0087]
式vi化合物可通过已知方法制备,例如如journal of heterocyclic chemistry,第46卷,第5期,第801
‑
827页中一般性公开的方法。具体地,方案4表示通过二甲基甲酰胺缩二甲醇和乙酰乙酸乙酯经由活性亚甲基基团的甲酰化的反应和进一步与水合肼的反应来制备化合物via。
[0088][0089]
方案4:式via化合物的制备。
[0090]
根据本发明,通过任选地在催化剂的存在下,使式i化合物与氧化剂反应制备式vii化合物,如方案5所示。
[0091][0092]
方案5.式vii化合物的制备。
[0093]
式vii化合物包括先前例如在wo 2003/015519和wo 2003/015518中公开的不同制备方法。
[0094]
根据一个实施方案,前述氧化反应包括选自水、惰性醇、羧酸及其酯、氯化烃、亚砜、砜、酰胺、醚、酮、吡啶及其混合物的溶剂。当选择溶剂时,需要部分或完全溶解起始的式i化合物。
[0095]
根据一个实施方案,氧化剂选自高锰酸盐,例如高锰酸钾、高锰酸钠,或选自有机和无机过氧化物,例如过氧化苯甲酰、叔丁基过氧化物、过氧化钠、过氧化氢、氧(稀释或未稀释的o2、o3),或其混合物。
[0096]
根据另一个实施方案,氧化反应在催化剂的存在下使用。合适的催化剂选自n
‑
羟基琥珀酰亚胺,n
‑
羟基邻苯二甲酰亚胺,n
‑
羟基苯并三唑,季铵盐如四乙基硫酸氢铵,三乙基苄基氯化铵,鏻盐如四苯基溴化鏻,peg,冠醚,亚硝酸钠,亚硝酸叔丁酯,乙酸钴(ii),乙酸锰(ii)及其混合物。
[0097]
根据另一个实施方案,氧化反应可在催化剂的存在下使用,所述催化剂选自n
‑
羟基琥珀酰亚胺、n
‑
羟基邻苯二甲酰亚胺和亚硝酸钠、亚硝酸叔丁酯、乙酸钴(ii)、乙酸锰(ii)及其混合物。
[0098]
根据另一个实施方案,氧化反应可在溶剂的存在下使用,所述溶剂选自c1
‑
c6醇如叔丁醇、有机腈如乙腈、羧酸如乙酸或其卤代衍生物。
[0099]
催化剂与式i的吡唑化合物的合适摩尔比为0.001至100mol/mol,特别是0.01至10.0mol/mol。
[0100]
如果氧化剂与式i的吡唑化合物的摩尔比为0.1至100mol/mol,特别是1.0至10.0mol/mol,则氧化进行得尤其顺利。
[0101]
最后,后处理含有氧化产物的反应混合物。该阶段可包括过滤、纯化、酸化(ph<4)、萃取、浓缩和重结晶。优化这些步骤可使纯度超过90%。
[0102]
根据本发明,式i化合物优选在升高的温度下,即在室温(20℃)之上与氧化剂接触。优选的温度区间是50至120℃,最优选的是70至120℃。在不限制保护范围的情况下,升高的温度最有可能促进式i化合物的溶解以进行更有效的氧化。
[0103]
根据本发明的另一方面,通过在酸的存在下,使式xi化合物脱羧来制备式i化合物,如方案6中所示:
[0104]
[0105]
方案6:由式xi化合物制备式i化合物。
[0106]
合适的酸选自盐酸、氢溴酸、四氟硼酸、六氟磷酸、三氟乙酸、硫酸、磺酸、亚磺酸、磷酸、膦酸及其混合物。
[0107]
在本发明的实践中,脱羧反应温度保持在10至130℃的范围内,优选在100至120℃的范围内。
[0108]
对于该反应,催化量的酸通常是足够的。通常,酸以每摩尔式xi化合物0.1
‑
1000摩尔的量、尤其是1.0
‑
10.0摩尔的量使用。
[0109]
通常,脱羧反应在有机溶剂或溶剂混合物的存在下使用。合适的有机溶剂是质子极性溶剂,例如具有优选1至4个碳原子的脂族醇,如甲醇、乙醇、正丙醇、异丙醇、正丁醇、异丁醇或叔丁醇,或羧酸,如乙酸,或芳族极性溶剂,如芳族烃,如苯、甲苯、二甲苯、异丙苯、氯苯、硝基苯或叔丁基苯,非质子极性溶剂,例如环醚或无环醚,如乙醚、二异丙醚、叔丁基甲基醚(mtbe)、叔丁基乙基醚、四氢呋喃(thf)或二噁烷,环状或无环酰胺,如二甲基甲酰胺、二甲基乙酰胺、n
‑
甲基吡咯烷酮或四甲基脲,或脂族腈,如乙腈或丙腈,及其混合物。
[0110]
根据本发明的另一方面,式xi化合物可以通过以下方式制备:a)任选地在碱和有机溶剂的存在下,使式xii化合物与溴化剂接触,以得到式xiii化合物;和b)使式xiii化合物与酸接触,如方案7中所示。
[0111][0112]
方案7.式xi化合物的制备。
[0113]
根据一个实施方案,合适的溴化剂选自溴(br2)、n
‑
溴代琥珀酰亚胺(nbs)、二溴二甲基乙内酰脲、n
‑
溴代邻苯二甲酰亚胺、n
‑
溴代糖精、溴代异氰脲酸单钠水合物、二溴异氰脲酸(=dbi)、溴化二甲基溴化鋶、5,5
‑
二溴麦氏酸cas号:66131
‑
14
‑
4、双(2,4,6
‑
三甲基吡啶)
‑
溴鎓六氟磷酸盐和brcl及其混合物,优选选自溴(br2)、n
‑
溴代琥珀酰亚胺(nbs)和/或n
‑
溴代邻苯二甲酰亚胺。
[0114]
合适的酸选自盐酸、氢溴酸、四氟硼酸、六氟磷酸、三氟乙酸、硫酸、磺酸、亚磺酸、磷酸、膦酸及其混合物。
[0115]
根据一个实施方案,式xi化合物在有机溶剂的存在下制备。合适的有机溶剂选自c1
‑
c6醇、酮、酯、芳族溶剂、杂芳族溶剂、脂族溶剂、酰胺、砜、亚砜、卤代溶剂、腈、碳酸酯、脲及其混合物。
[0116]
根据另一个实施方案,在碱的存在下进行式xii化合物的溴化。合适的碱选自碱金属和碱土金属的氢氧化物、氢化物、醇盐、以及硫酸盐、磺酸盐、亚磺酸盐、磷酸盐、膦酸盐、甲酸盐、草酸盐、碳酸盐、乙酸盐、丙酸盐、苯甲酸盐和柠檬酸盐。
[0117]
根据一个优选的实施方案,式xi化合物在碱和有机溶剂的存在下制备。
[0118]
根据本发明的另一方面,式i化合物可以由式xi化合物制备,式xi化合物通过以下方式制备:a)任选地在碱和有机溶剂存在下,使式xii化合物与溴化剂接触,以得到式xiii
化合物;和b)使式xiii化合物与酸接触,如方案7中所示。
[0119]
根据本发明的另一方面,式xi化合物通过以下方式制备:a)使式iv化合物(其中r为c1
‑
c6烷基、c1
‑
c6烷氧基、c3
‑
c6环烷基、任选取代的苯基或任选取代的苄基)与碱接触以得到式v化合物,和b)在碱和有机溶剂的存在下,任选地在催化剂的存在下,使式v化合物与式iii的吡啶(其中l是如上文定义的离去基团)接触,如方案8中所示。
[0120][0121]
方案8.由式iv化合物制备式xi化合物。
[0122]
合适的碱选自碱金属和碱土金属的氢氧化物、氢化物、醇盐、以及硫酸盐、磺酸盐、亚磺酸盐、磷酸盐、膦酸盐、甲酸盐、草酸盐、碳酸盐、乙酸盐、丙酸盐、苯甲酸盐和柠檬酸盐。
[0123]
合适的有机溶剂选自c1
‑
c6醇、酮、酯、芳族溶剂、杂芳族溶剂、脂族溶剂、酰胺、砜、亚砜、卤代溶剂、腈、碳酸酯、脲及其混合物。
[0124]
根据一个实施方案,上述方法在催化剂的存在下使用,所述催化剂选自碱金属氟化物如csf、kf、naf,季铵盐如四乙基硫酸氢铵、三乙基苄基氯化铵,鏻盐如四苯基溴化鏻,peg,冠醚及其混合物。
[0125]
催化剂与式v的吡唑化合物的合适摩尔比为0.001至100mol/mol,特别是0.01至10.0mol/mol。
[0126]
本发明的另一方面涉及由如上述实施方案中所示制备的式xi化合物制备式i化合物。
[0127]
根据一个实施方案,本发明涉及式i化合物,特别是3
‑
溴
‑5‑
甲基
‑1‑
h
‑
吡唑
‑
n
‑2‑
氯吡啶,其立体异构体、溶剂化物和/或n
‑
氧化物。
[0128]
在本发明的另一方面,通过本发明方法制备的式i化合物可以用作中间体来通过wo 2001/070671、wo 2006062978、wo 2003/015519和wo 2003/015518中已知的方法制备式viii化合物(氯虫苯甲酰胺)。
[0129]
根据本发明的另一个实施方案,式viii化合物使用式ii化合物制备,式ii化合物通过以下方式形成:使式iv化合物与碱接触以得到式v化合物,并进一步在酸的存在下,使式v化合物脱羧;或b)使式iv化合物与酸接触,如上文所公开的。
[0130]
本发明的另一方面是使用式xi化合物制备式viii化合物,式xi化合物通过任选地在碱和有机溶剂的存在下,使式vi化合物与溴化剂接触来形成,如上文所公开的。
[0131]
本发明的另一方面是使用式xi化合物制备式viii化合物,式xi化合物通过以下方式形成:a)使式iv化合物(其中r为c1
‑
c6烷基、c1
‑
c6烷氧基、c3
‑
c6环烷基、任选取代的苯基或任选取代的苄基)与碱接触以得到式v化合物,和b)在碱和有机溶剂的存在下,任选地在催化剂的存在下,使式v化合物与式iii的吡啶(其中l是如上文定义的离去基团)接触,如前文的实施方案中所公开的。
[0132]
本发明的另一方面是使用通过上文公开的方法制备的式i化合物制备式vii化合
物。
[0133]
无需进一步详细说明,相信使用前文描述的本领域技术人员能够最大程度地利用本发明。因此,以下实施例仅被解释为说明性的,并且绝不以任何方式限制本公开内容。
[0134]
实施例
[0135]
实施例1.(z)
‑2‑
((二甲基氨基)亚甲基)
‑3‑
氧代丁酸乙酯(a)的制备
[0136]
向装有机械搅拌器和温度计的500ml四颈烧瓶中装入152.7g(1.20mol)99%硫酸二甲酯并加热至80℃。在80至90℃下,在1小时内将92.9g(1.26mol)dmf逐滴加入反应中。将混合物在80
‑
85℃保持3h,然后冷却至20
‑
30℃,以得到dmf
‑
dms溶液。
[0137]
向装有机械搅拌器、温度计和滴液漏斗的1l四颈烧瓶中装入131.3g(1.0mol)99%乙酰乙酸乙酯和122.4g(1.20mol)三乙胺。在30分钟内将上述制备的dmf
‑
dms溶液逐滴加入到混合物中,并将温度保持在低于20℃。添加完成后,将反应混合物升温至25
‑
30℃并再搅拌1h。然后将1l dcm和0.5l水加入混合物中并再搅拌10min。分离水层并再次用2
×
200ml dcm萃取。合并的(z)
‑2‑
((二甲基氨基)亚甲基)
‑3‑
氧代丁酸乙酯/dcm溶液无需进一步纯化即可使用(产率:99%)。
[0138]
实施例2.3
‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸乙酯(vi)的制备
[0139]
向装有机械搅拌器、温度计和滴液漏斗的1l四颈烧瓶中装入(z)
‑2‑
((二甲基氨基)亚甲基)
‑3‑
氧代丁酸乙酯/dcm溶液(1.0mol)。在2h内将65.6g(1.05mol)80%水合肼逐滴加入到dcm溶液中,并将温度保持在低于20℃。然后将混合物升温至25
‑
30℃并再搅拌1h。分离所得的dcm层并用0.5%hcl水溶液洗涤直至水相的ph达到7或以下。浓缩dcm相,以得到3
‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸乙酯143g,为黄色液体(产率:93%)。
[0140]
实施例3.5
‑
溴
‑3‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸乙酯(iv)的制备
[0141]
向装有机械搅拌器、温度计、ph计和滴液漏斗的2l四颈烧瓶中装入143g(0.93mol)3
‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸乙酯、250ml etoh、270g水和77.0g(0.93mol)naoac,将反应混合物在室温下搅拌0.5h。在2h内向反应混合物中逐滴加入203g(1.26mol)br2,同时加入20%naoh水溶液以保持ph在6至8之间。然后将混合物在20至30℃下再搅拌1h。然后过滤所得混合物,将滤液在40℃下真空(
‑
0.1mp)浓缩,然后再次过滤。将合并的滤饼在500ml水中搅拌0.5h。将混合物过滤并用500ml水洗涤,将滤饼干燥,以得到5
‑
溴
‑3‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸乙酯216.0g,为白色固体(98%产率)。
[0142]
实施例4.5
‑
溴
‑3‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸(v)的制备
[0143]
向装有机械搅拌器、温度计和冷凝器的100ml四颈烧瓶中装入3.2g(80mmol)naoh和46ml h2o。在naoh溶解后,加入9.3g(40mmol)5
‑
溴
‑3‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸乙酯并悬浮在溶液中。将混合物加热至100℃并在该温度下保持4h。然后将混合物冷却至5至10℃并用10ml浓hcl淬灭。过滤分离所得混合物,滤饼用10ml水洗涤并干燥,以得到5
‑
溴
‑3‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸8.2g,为淡白色固体(100%产率)。
[0144]
实施例5.5
‑
溴
‑3‑
甲基
‑
1h
‑
吡唑(ii)的制备
[0145]
向装有机械搅拌器、温度计和冷凝器的100ml四颈烧瓶中装入5
‑
溴
‑3‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸8.2g(40mmol)和浓盐酸67ml(0.8mol)。将混合物加热至105℃并在该温度下保持6h。反应完成后,将其冷却至室温并浓缩至干燥。将残余物溶解于40ml水中并用6mol/l naoh水溶液中和直至ph达到7至8。过滤分离所得混合物,滤饼用5ml水洗涤并干燥,以得到
naoh水溶液,用乙酸乙酯30ml洗涤。用浓hcl溶液将水溶液的ph值调至1
‑
2。过滤分离所得混合物,滤饼用20ml水洗涤并干燥,以得到3
‑
溴
‑1‑
(3
‑
氯吡啶
‑2‑
基)
‑
1h
‑
吡唑
‑5‑
甲酸4.7g,为灰白色固体(70%产率)。
[0156]
实施例11.5
‑
溴
‑2‑
(3
‑
氯
‑2‑
吡啶基)
‑
2h
‑
吡唑
‑3‑
甲酸(vii)的制备
[0157]
向装有磁力搅拌器、温度计、冷凝器和氧气入口的250ml 4颈rbf中装入10g m
‑
272(0.037mol)、8.45g n
‑
羟基琥珀酰亚胺(0.073mol)和100ml乙酸(10体积当量)。将反应混合物在室温搅拌15
‑
20min,然后加热至110℃。氧气吹扫以5ml/min开始。此时,将7.6g nano2分小份(5至10份)加入反应物料中(立即放出微红色气体)。继续进行氧气吹扫,并将反应物料在110℃下搅拌2h。反应完成后,停止通氧,将反应物料冷却至室温并减压蒸发乙酸。将残余物质溶解在110ml 2nnaoh溶液中并在室温下搅拌0.5h。水层用50ml乙酸乙酯萃取两次并分离有机层。有机相浓缩至干燥,回收5.0g原料3
‑
溴
‑1‑
(3
‑
氯
‑2‑
吡啶基)
‑5‑
甲基
‑
1h
‑
吡唑。用浓盐酸将水层的ph调节至1,过滤收集粗产物,然后空气干燥2小时,以得到5
‑
溴
‑2‑
(3
‑
氯
‑2‑
吡啶基)
‑
2h
‑
吡唑
‑3‑
甲酸4.33g,为白色产物(39%产率)。
[0158]
实施例12.3
‑
溴
‑1‑
(3
‑
氯
‑2‑
吡啶基)
‑5‑
甲基
‑
1h
‑
吡唑(i)的制备
[0159]
向装有机械搅拌器、温度计和冷凝器的100ml三颈烧瓶中装入10g(60.2mmol)97%的3
‑
溴
‑5‑
甲基
‑
1h
‑
吡唑、9.09g(60.2mmol)98%的2,3
‑
二氯吡啶、16.6g(120.4mmol)碳酸钾粉末和30ml n,n
‑
二甲基乙酰胺。将反应加热至150℃并剧烈搅拌13小时。将反应冷却至环境温度,通过硅藻土垫过滤以除去未溶解的固体并用10ml n,n
‑
二甲基乙酰胺洗涤。所得棕色溶液减压蒸馏,在45℃下收集馏分,向残余物中加入40ml水和20ml己烷,将混合物在50℃下剧烈搅拌1小时,然后冷却至室温。通过过滤分离产物,然后空气干燥12小时,以得到3
‑
溴
‑1‑
(3
‑
氯
‑2‑
吡啶基)
‑5‑
甲基
‑
1h
‑
吡唑12.3g,为棕色固体(产率75%)。
[0160]
实施例13.5
‑
溴
‑3‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸乙酯(iv)的制备
[0161]
向装有机械搅拌器、温度计和滴液漏斗的1l四颈烧瓶中加入100g(0.65mol)3
‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸乙酯、200ml etoh和250g水,反应混合物在室温下搅拌0.5h,并在2h内将160g(1.0mol)br2逐滴加入反应混合物中。然后,将混合物在20至30℃下再搅拌1h。将所得混合物在减压下在40℃下浓缩。滤饼在500ml水中搅拌0.5h。将混合物过滤并用500ml水洗涤并干燥滤饼,以得到5
‑
溴
‑3‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸乙酯75.7g,为白色固体(50%产率)。
[0162]
实施例14.3
‑
溴
‑1‑
(3
‑
氯
‑2‑
吡啶基)
‑5‑
甲基
‑
1h
‑
吡唑(i)的制备
[0163]
向装有机械搅拌器、温度计和滴液漏斗的1l四颈烧瓶中加入113.9g(0.36mol)3
‑
溴
‑1‑
(3
‑
氯吡啶
‑2‑
基)
‑5‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸和353g(1.44mol)40%h2so4。将混合物在100至110℃下搅拌22h,然后冷却至20至30℃。加入380g 30%naoh水溶液中和混合物直至ph达到7至8。所得混合物在40至50℃之间过滤,滤饼用250ml水洗涤,然后干燥,以得到63.6g淡黄色固体。
[0164]
实施例15.3
‑
溴
‑1‑
(3
‑
氯吡啶
‑2‑
基)
‑5‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸乙酯(xiii)的制备
[0165]
向装有机械搅拌器、温度计、ph计和滴液漏斗的500ml四颈烧瓶中加入66.4g(0.25mol)1
‑
(3
‑
氯吡啶
‑2‑
基)
‑5‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸乙酯、50ml etoh、70g水和20.7g(0.25mol)乙酸钠,将反应混合物在室温下搅拌0.5h。在2h内将50.4g(0.32mol)br2逐滴加入反应混合物中,然后加入20%naoh水溶液以保持ph在6至8之间。然后将混合物在20至30
℃下再搅拌1h。然后过滤所得混合物,并将滤液在40℃下减压浓缩,然后再次过滤。将合并的滤饼在100ml水中搅拌0.5h。过滤混合物,并用100ml水洗涤,并干燥滤饼,以得到3
‑
溴
‑1‑
(3
‑
氯吡啶
‑2‑
基)
‑5‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸乙酯84.4g,为白色固体。
[0166]
实施例16.3
‑
溴
‑1‑
(3
‑
氯吡啶
‑2‑
基)
‑5‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸乙酯(xiii)的制备
[0167]
向装有机械搅拌器、温度计和滴液漏斗的500ml四颈烧瓶中加入66.4g(0.25mol)1
‑
(3
‑
氯吡啶
‑2‑
基)
‑5‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸乙酯、50ml etoh、70g水,并将反应混合物在室温下搅拌0.5h。在2小时内将40g(0.25mol)br2逐滴加入反应混合物中,然后将混合物在20至30℃下再搅拌1h。将所得混合物在减压下在40℃下浓缩。滤饼在100ml水中搅拌0.5h。将混合物过滤并用100ml水洗涤,并干燥滤饼,以得到3
‑
溴
‑1‑
(3
‑
氯吡啶
‑2‑
基)
‑5‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸乙酯63.8g,为白色固体。
[0168]
实施例17.3
‑
溴
‑1‑
(3
‑
氯吡啶
‑2‑
基)
‑5‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸(xi)的制备
[0169]
向装有机械搅拌器、温度计和滴液漏斗的1l四颈烧瓶中加入50g(0.15mol)3
‑
溴
‑1‑
(3
‑
氯吡啶
‑2‑
基)
‑5‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸乙酯和0.75l1m hcl溶液,将混合物加热至110℃并保持5h。反应结束后,过滤收集产物。干燥,以得到3
‑
溴
‑1‑
(3
‑
氯吡啶
‑2‑
基)
‑5‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸42.7g,为白色固体。
[0170]
实施例18.3
‑
溴
‑1‑
(3
‑
氯吡啶
‑2‑
基)
‑5‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸(xi)的制备
[0171]
向装有机械搅拌器、温度计和冷凝器的100ml三颈烧瓶中装入5g(24.4mmol)3
‑
溴
‑5‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸、3.61g(24.4mmol)98%2,3
‑
二氯吡啶、6.77g(49mmol)碳酸钾粉末、0.14g(2.44mmol)99%无水氟化钾、0.65g(2.44mmol)99%的1,4,7,10,13,16
‑
六氧杂环十八烷和20ml n,n
‑
二甲基乙酰胺。将反应加热至150℃并剧烈搅拌13小时。将反应冷却至环境温度,通过硅藻土垫过滤以除去未溶解的固体。固体用10ml n,n
‑
二甲基乙酰胺洗涤。减压蒸馏所得棕色溶液,在45℃下收集馏分并与20ml水和10ml己烷在50℃下搅拌1小时,然后冷却至室温。通过过滤分离产物,然后空气干燥12小时,以得到3
‑
溴
‑1‑
(3
‑
氯吡啶
‑2‑
基)
‑5‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸6.18g,为棕色固体。
[0172]
实施例19.3
‑
溴
‑1‑
(3
‑
氯吡啶
‑2‑
基)
‑5‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸(xi)的制备
[0173]
向装有机械搅拌器、温度计和冷凝器的100ml三颈烧瓶中装入5g(24.4mmol)3
‑
溴
‑5‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸、3.61g(24.4mmol)98%的2,3
‑
二氯吡啶、6.77g(49mmol)碳酸钾粉末和20ml n,n
‑
二甲基乙酰胺。将反应加热至150℃并剧烈搅拌13小时。将反应冷却至环境温度,通过硅藻土垫过滤以除去未溶解的固体。固体用10ml n,n
‑
二甲基乙酰胺洗涤。减压蒸馏所得棕色溶液,在45℃下收集馏分,向残余物中加入20ml水和10ml己烷,将混合物在50℃下剧烈搅拌1小时,然后冷却至室温。通过过滤分离产物,然后空气干燥12小时,以得到3
‑
溴
‑1‑
(3
‑
氯吡啶
‑2‑
基)
‑5‑
甲基
‑
1h
‑
吡唑
‑4‑
甲酸4.94g,为棕色固体。
[0174]
此外,本技术的任何优先权文件的全部内容通过引用并入本文。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1