检测卵巢癌的制作方法
检测卵巢癌
1.相关申请的交叉引用
2.本技术要求于2019年10月31日提交的美国临时申请no.62/928,888和于2020年8月13日提交的美国临时申请no.63/065,081的优先权益,所述临时申请以引用的方式整体并入本文中。
技术领域
3.本文提供了用于筛查卵巢癌的技术,特别是但不限于用于检测卵巢癌和卵巢癌亚型(例如,透明细胞卵巢癌、子宫内膜样卵巢癌、粘液性卵巢癌、浆液性卵巢癌)的存在的方法、组合物和相关用途。
背景技术:
4.卵巢癌是发达国家最致命的妇科恶性肿瘤之一。在美国,每年大约有23,000名女性被诊断出患有这种疾病,并且有近14,000名女性死于这种疾病。卵巢癌主要分为三种类型:上皮性卵巢癌、生殖细胞卵巢癌和性索间质卵巢癌。约90%的卵巢癌始于上皮组织,即卵巢外侧的内层。这类卵巢癌分为浆液性卵巢癌、粘液性卵巢癌、子宫内膜样卵巢癌、透明细胞卵巢癌、移行性卵巢癌和未分化型卵巢癌。上皮性卵巢癌的风险随着年龄的增长而增加,尤其是在50岁之后。生殖细胞肿瘤约占卵巢癌的5%。它们从产卵细胞开始。这类卵巢癌可以发生在任何年龄的女性身上,但约80%发生在30岁以下的女性身上。主要亚型有畸胎瘤、无性细胞瘤、内胚窦瘤和绒毛膜癌。性索间质肿瘤约占卵巢癌的5%,生长在结缔组织中,该结缔组织将卵巢固定在一起并产生雌激素和黄体酮。大多数见于老年女性。
5.尽管癌症疗法取得了进展,但卵巢癌死亡率在过去二十年中实际上没有变化。鉴于相对于疾病诊断阶段的陡峭生存梯度,早期检测仍然是提高卵巢癌患者长期生存率的最重要因素。
6.需要改进的检测卵巢癌和各种卵巢癌亚型(例如,透明细胞卵巢癌、子宫内膜样卵巢癌、粘液性卵巢癌和浆液性卵巢癌)的方法。
7.本发明满足了这些需要。
技术实现要素:
8.如前所述,卵巢癌(oc)是妇科癌症死亡的首要原因,并且总体上是女性致命恶性肿瘤的最常见原因之一(参见ozor r.f.等人,epithelial ovarian cancer.hoskin w.j.,perez c.a.,young r.c.编辑,principles and practice of gynecologic oncology.lippincott williams&wilkins;philadelphia,pa,usa:2000.第981-1057页)。症状通常是非特异性的,这妨碍早期检测,因此大多数患者呈现晚期疾病。
9.最近,组织病理学、分子和遗传学研究的结果阐明了几种oc亚型的特征。主要的组织型起源于上皮,包括浆液性卵巢癌(浆液性oc)、透明细胞癌(透明细胞oc)、子宫内膜样癌(子宫内膜样oc)和粘液性癌(粘液性oc)。浆液性oc是最恶性的卵巢癌形式,占所有卵巢癌
病例的70%。透明细胞oc是第二常见的组织型,约占被诊断患有卵巢癌的女性的10-13%。子宫内膜样oc是卵巢癌的第三大常见组织型,并且与透明细胞癌一样,被认为是由子宫内膜异位引起的。粘液性oc占卵巢癌的4%,通常在低期诊断。
10.为了减轻oc和其各种亚型(例如,透明细胞oc、浆液性oc、子宫内膜样oc、粘液性oc)的沉重负担,迫切需要有效的筛查方法。创新势在必行,为早期癌症和晚期癌前病变的症状前检测提供准确、负担得起和安全的筛查工具。
11.本发明满足了这些需要。实际上,本发明提供了新的甲基化dna标志物,其区分oc和其各种亚型(例如透明细胞oc、浆液oc、子宫内膜样oc、粘液oc)的病例。
12.已经将甲基化dna作为大多数肿瘤类型组织中潜在的一类生物标志物进行研究。在许多情况下,dna甲基转移酶在胞嘧啶-磷酸-鸟嘌呤(cpg)岛位点处将甲基添加到dna上,作为基因表达的表观遗传控制。在生物学上有吸引力的机制中,认为肿瘤抑制基因启动子区域中的获得性甲基化事件会使表达沉默,从而促进肿瘤发生。dna甲基化可能是比rna或蛋白质表达更具有化学和生物学稳定性的诊断工具(laird(2010)nat rev genet 11:191-203)。此外,在如散发性结肠癌等其它癌症中,甲基化标志物提供了极好的特异性,并且比单独dna突变具有更广泛的信息和更灵敏(zou等人(2007)cancer epidemiol biomarkers prev 16:2686-96)。
13.当应用于动物模型和人类细胞系时,对cpg岛的分析产生了重要的发现。例如,zhang和同事发现来自同一cpg岛不同部分的扩增子可能具有不同的甲基化水平(zhang等人(2009)plos genet 5:e1000438)。此外,甲基化水平在高度甲基化与未甲基化序列之间呈双峰分布,这进一步证明了dna甲基转移酶活性的二元开关样模式(zhang等人(2009)plos genet 5:e1000438)。对鼠体内组织和体外细胞系的分析表明,只有约0.3%的高cpg密度启动子(hcp,定义为在300个碱基对区域内具有》7%cpg序列)被甲基化,而低cpg密度区域(lcp,定义为在300个碱基对区域内具有《5%cpg序列)往往以动态组织特异性模式频繁甲基化(meissner等人(2008)nature 454:766-70)。hcp包括普遍存在的看家基因和高度调控的发育基因的启动子。在》50%甲基化的hcp位点中,有几个已建立的标志物,例如wnt 2、ndrg2、sfrp2和bmp3(meissner等人(2008)nature 454:766-70)。
14.已经将dna甲基转移酶在胞嘧啶-磷酸-鸟嘌呤(cpg)岛位点处对dna的表观遗传甲基化作为大多数肿瘤类型组织中潜在的一类生物标志物进行研究。在生物学上有吸引力的机制中,认为肿瘤抑制基因启动子区域中的获得性甲基化事件会使表达沉默,从而促进肿瘤发生。dna甲基化可能是比rna或蛋白质表达更具有化学和生物学稳定性的诊断工具。此外,在如散发性结肠癌等其它癌症中,异常的甲基化标志物比单独dna突变具有更广泛的信息和更灵敏,并且提供了出色的特异性。
15.有几种方法可用于搜索新的甲基化标志物。虽然基于微阵列的cpg甲基化询问是一种合理的高通量方法,但这种策略偏向于已知的感兴趣区域,主要是已确立的肿瘤抑制启动子。在过去十年中,已经开发了用于全基因组dna甲基化分析的替代方法。有三种基本方法。第一种采用通过识别特定甲基化位点的限制酶消化dna,然后是几种可能的分析技术,这些技术提供的甲基化数据仅限于酶识别位点或用于在定量步骤中扩增dna的引物(例如甲基化特异性pcr;msp)。第二种方法使用针对甲基胞嘧啶或其它甲基化特异性结合结构域的抗体富集基因组dna的甲基化部分,然后进行微阵列分析或测序以将片段映射至参考
基因组。这种方法不提供片段内所有甲基化位点的单核苷酸分辨率。第三种方法首先是对dna进行亚硫酸氢盐处理,将所有未甲基化的胞嘧啶转化为尿嘧啶,然后是限制酶消化,并在与接头配体偶联后对所有片段进行完整测序。限制酶的选择可以富集cpg密集区域的片段,减少在分析过程中可能映射至多个基因位置的冗余序列的数目。
16.在中高读取覆盖率下rrbs在单核苷酸分辨率下产生所有cpg岛的80-90%和大多数肿瘤抑制启动子的cpg甲基化状态数据。在癌症病例对照研究中,对这些读数的分析可鉴定差异甲基化区域(dmr)。在之前对胰腺癌样本的rrbs分析中,发现了数百个dmr,其中许多从未与致癌作用相关联,并且许多未注释。对独立组织样品集的进一步验证研究证实了在性能方面具有100%灵敏度和特异性的标志物cpg。
17.本文提供了用于筛查oc和各种oc亚型(例如透明细胞oc、子宫内膜样oc、粘液性oc、浆液性oc)的技术,特别是但不限于用于检测oc和各种oc亚型(例如,透明细胞oc、子宫内膜样oc、粘液性oc、浆液性oc)的存在的方法、组合物和相关用途。
18.实际上,如实施例i和ii中所述,在鉴定本发明实施方案的过程中进行的实验鉴定了一组新的差异甲基化区域(dmr),用于区分:1)卵巢癌来源的dna与非赘生物对照dna;2)源自透明细胞oc组织的dna与非赘生物对照dna;3)源自子宫内膜样oc组织的dna与非赘生物对照dna;4)源自粘液性oc组织的dna与非赘生物对照dna;以及5)源自浆液性oc组织的dna与非赘生物对照dna。
19.这类实验列出并描述了560种新的dna甲基化标志物,可将oc组织与良性组织(参见表1a、1b、3、4a、6a和8a;实施例i和ii)、透明细胞oc组织与良性组织(参见表1a、1b、2a、4b、5b、6a、8b;实施例i和ii)、子宫内膜样oc组织与良性组织(参见表1a、1b、2b、4c、5c、6a和8c;实施例i和ii)、粘液性oc组织与良性组织(参见表1a、1b、2c、4d、5d、6a和8d;实施例i和ii)、浆液性oc组织与良性组织(参见表1a、1b、2d、4e、5a、6a和8e;实施例i和ii)区分开来,并检测血液样品中的oc(例如oc、透明细胞oc、子宫内膜样oc、粘液性oc、浆液性oc)(参见表9;实施例iii)。
20.从这560种新的dna甲基化标志物中,进一步的实验鉴定了以下能够区分卵巢癌组织与良性组织的标志物和/或标志物组:
21.·
agrn_a、atp10a_a、atp10a_b、atp10a_c、atp10a_d、bcat1、ccnd2_d、cmtm3_a、elmo1_a、elmo1_b、elmo1_c、emx1、eps8l2_a、eps8l2_b、eps8l2_c、eps8l2_d、faim2_a、flj34208_a、gprin1、gypc_a、ina_a、itga4_b、kcna3_a、kcna3_c、lbh、lime1_a、lime1_b、loc646278、lrrc4、lrrc41_a、max.chr1.110626771-110626832、max.chr1.147790358-147790381、max.chr1.161591532-161591608、max.chr15.28351937-28352173、max.chr15.28352203-28352671、max.chr15.29131258-29131734、max.chr4.8859995-8860062、max.chr5.42952182-42952292、mdfi、ncor2、nkx2-6、oplah_a、parp15、pde10a、ppp1r16b、rassf1_b、septin9、ski、slc12a8、src_a、ssbp4_b、st8sia1、tacc2_a、tshz3、ubtf、vim、vipr2_a、zbed4、zmiz1_a、zmiz1_b、zmiz1_c、znf382_a、znf469_b、atp6v1b1_a、bzrap1、gdf6、iffo1_a、iffo1_b、kcnab2、limd2、maml3_b、max.chr14.102172350-102172770、max.chr16.85482307-85482494、max.chr17.76254728-76254841、max.chr5.42993898-42994179和rasal3(参见表1a、1b、6a;实施例i);
22.·
max.chr16.85482307-85482494、gdf6、iffo_a、max.chr5.42993898-42994179、
max.chr17.76254728-76254841、max.chr14.102172350-102172770、rasal3、bzrap1和limd2(参见表3;实施例i);
23.·
palld、prdm14、max.chr1.147790358-147790381、bcat1、maml3_a、ski、dnmt3a_a和c2cd4d(参见表4a;实施例i);以及
24.·
bcat1_6015、ski、sim2_b、dnmt3a_a、cdo1_a和dscr6(参见表8a;实施例ii)。
25.从这560种新的dna甲基化标志物中,进一步的实验鉴定了以下标志物和/或标志物组,用于检测血液样品(例如,血浆样品、全血样品、白细胞样品、血清样品)中的卵巢癌(例如,oc、透明细胞oc、子宫内膜样oc、粘液性oc、浆液性oc):
26.·
gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、src(例如,src_a、src_b)、sim2(例如,sim2_a、sim2_b)、agrn(例如,agrn_a、agrn_b、agrn_c、agrn_8794)、faim2(例如,faim2_a、faim2_b)、celf2(例如,celf2_a、celf2_b)、dscr6、gypc(例如,gypc_a、gypc_b、gypc_c)、capn2(例如,capn2_a、capn2_b)和bcat1(参见表9;实施例iii);以及
27.·
atp10a(例如,atp10a_a、atp10a_b、atp10a_c、atp10a_d、atp10a_e)、eps8l2(例如,eps8l2_a、eps8l2_b、eps8l2_c、eps8l2_d)、c1ql3(例如,c1ql3_a、c1ql3_b)、faim2(例如,faim2_a、faim2_b)、capn2_b、lbh、cmtm3(例如,cmtm3_a、cmtm3_b)、zmiz1(例如,zmiz1_a、zmiz1_b、zmiz1_c、zmiz1_d)、gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、gp5、dscr6、ski、sim2_a、agrn_8794、bcat1_6015、kcna3_7518、kcna3_7320、loc10013136、gypc_c、src(例如,src_a、src_b)、nr2f6、tshz3、celf2(例如,celf2_a、celf2_b)、tacc2(例如,tacc2_a、tacc2_b)、vipr2(例如,vipr2_a、vipr2_b)和spock2_74333(参见表10,实施例iii)。
28.从这560种新的dna甲基化标志物中,进一步的实验鉴定了以下标志物和/或标志物组,与血液样品中增加水平的癌抗原125(ca-125)组合用于检测血液样品(例如,血浆样品、全血样品、白细胞样品、血清样品)中的卵巢癌(例如,oc、透明细胞oc、子宫内膜样oc、粘液性oc、浆液性oc):
29.·
ca-125和atp10a(例如,atp10a_a、atp10a_b、atp10a_c、atp10a_d、atp10a_e)、eps8l2(例如,eps8l2_a、eps8l2_b、eps8l2_c、eps8l2_d)、c1ql3(例如,c1ql3_a、c1ql3_b)、faim2(例如,faim2_a、faim2_b)、capn2_b、lbh、cmtm3(例如,cmtm3_a、cmtm3_b)、zmiz1(例如,zmiz1_a、zmiz1_b、zmiz1_c、zmiz1_d)、gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、gp5、dscr6、ski和sim2_a(参见表11、12和13,实施例iii)。
30.从这560种新的dna甲基化标志物中,进一步的实验鉴定了以下能够区分透明细胞oc组织与卵巢组织的标志物和/或标志物组:
31.·
tacc2_a、lrrc41_a、eps8l2、lbh、lime1_b、mdfi、faim2_a、gypc_a、agrn_b和zbed4(参见表2a;实施例i);
32.·
mt1a_a、celf2_a、kcna3_a、mdfi、palld、prdm14、parp15、tacc2_a、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、agrn_b、max.chr6.10382190-10382225、dscr6、maml3_a、max.chr14.105512178-105512224、eps8l2_e、ski、gprin1_a、max.chr8.142215938-142216298、cdo1_a、dnmt3a_a、sim2_a、ski、mt1a_b、gypc_a、bcl2l11、pisd和c2cd4d(参见表4b;实施例i);
33.·
ncor2、mt1a_b、celf2_a、palld、prdm14、parp15、tacc2_a、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、agrn_b、max.chr6.10382190-10382225、dscr6、maml3_a、ski、gprin1_a、cdo1_a、sim2_a、iffo1_a、mt1a_b、gypc_a、bcl2l11、gdf6和c2cd4d(参见表5b;实施例i);以及
34.·
agrn_8794、bhlhe23_8339、eps8l2_f、rassf1_8293、mdfi_6321、ski、gypc_c、nkx2-6_4159、loc100131366、faim2_b、gprin1_b、lrrc41_b、tacc2_b、lbh、sim2_b、cdo1_a和dscr6(参见表8b;实施例ii)。
35.从这560种新的dna甲基化标志物中,进一步的实验鉴定了以下能够区分子宫内膜样oc组织与良性组织的标志物和/或标志物组:
36.·
parp15、gprin1_a、gypc1_a、flj34208、max.chr1.147790358-147790381、faim2_a、sh2b3、kcnq5、irf4和bcat1(参见表2b;实施例i);
37.·
ncor2、celf2_a、palld、prdm14、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、maml3_a、ski、gprin1_a、ski、bcl2l11和c2cd4d(参见表4c;实施例i);
38.·
ncor2、palld、prdm14、max.chr1.147790358-147790381、max.chr11.14926602-14926671、dscr6、gprin1_a、cdo1_a、sim2_a、iffo1_a和c2cd4d(参见表5c;实施例i);以及
39.·
bcat1_6015、eps8l2_f、ski、nkx2-6_4159、c1ql3_b、gprin1_b、parp15、oxt_c、sim2_b、dnmt3a_a和celf2_a(参见表8c;实施例ii)。
40.从这560种新的dna甲基化标志物中,进一步的实验鉴定了以下能够区分粘液性oc组织与良性组织的标志物和/或标志物组:
41.·
cmtm3_a、atp10a_c、tshz3、zmiz1_b、atp10a_b、elmo1_b、tacc2_a、lrrc4、vim和znf382_a(参见表2c;实施例i);
42.·
ncor2、mt1a_a、kcna3_a、zmiz1_c、tacc2_a、max.chr1.147790358-147790381、bcat1、agrn_b、ski、slc12a8、zmiz1_b、bcl2l11和gata2(参见表4d;实施例i);
43.·
ncor2、palld、tacc2_a、bcat1、agrn_b、ski、slc12a8、zmiz1_b和bcl2l11(参见表5d;实施例i);以及
44.·
bcat1_6015、elmo1_9100、kcna3_7518、kcna3_7320、mdfi_6321、ski、vipr_b、znf382_b、atp10a_e、cmtm3_b、zmiz1_d、src_b、hdgfrp3、tacc2_b、tshz3、lbh、dnmt3a_a(参见表8d;实施例ii)。
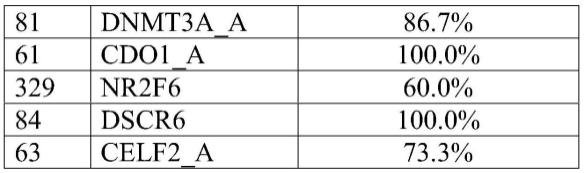
45.从这560种新的dna甲基化标志物中,进一步的实验鉴定了以下能够区分浆液性oc组织与良性组织的标志物和/或标志物组:
46.·
max.chr1.147790358-147790381、maml3、nr2f6、dnmt3a_a、ski、sobp、ubtf、agrn_c、max.chr12.30975740-30975780和capn2_a(参见表2d;实施例i);
47.·
palld、prdm14、max.chr1.147790358-147790381、capn2_a、max.chr6.10382190-10382225、ski、nr2f6、iffo1_a、mt1a_b、iffo1_b、gdf6和c2cd4d(参见表4e;实施例i);
48.·
ncor2、max.chr1.147790358-147790381、max.chr6.10382190-10382225、iffo1_a、gdf6和c2cd4d(参见表5a;实施例i);以及
49.·
ski、pear1_b、capn2_b、sim2_b、dnmt3a_a、cdo1_a和nr2f6(参见表8e;实施例
ii)。
50.如本文所述,这项技术提供了对卵巢癌总体和各种类型卵巢癌(例如透明细胞oc、子宫内膜样oc、粘液性oc、浆液性oc)具有高辨别力的许多甲基化dna标志物和其子集(例如,2种、3种、4种、5种、6种、7种或8种标志物的集合)。实验将选择过滤器应用于候选标志物以鉴定提供高信噪比和低背景水平,从而为卵巢癌筛查或诊断提供高特异性的标志物。
51.在一些实施方案中,这项技术涉及评估生物样品(例如卵巢组织、血浆样品)中本文鉴定的一种或多种标志物的存在和甲基化状态。这些标志物包含如本文所讨论,例如,如表1a和6a中提供的一个或多个差异甲基化区域(dmr)。在这项技术的实施方案中评估甲基化状态。因此,在测量基因甲基化状态的方法中不限制本文提供的技术。例如,在一些实施方案中,通过基因组扫描方法测量甲基化状态。例如,一种方法涉及限制性界标基因组扫描(kawai等人(1994)mol.cell.biol.14:7421-7427)并且另一实例涉及甲基化敏感性随机引物pcr(gonzalgo等人(1997)cancer res.57:594-599)。在一些实施方案中,特定cpg位点处甲基化模式的变化通过用甲基化敏感性限制酶消化基因组dna,随后对感兴趣区域进行南方分析(southern analysis)(消化-南方法(digestion-southern method))来监测。在一些实施方案中,分析甲基化模式的变化涉及基于pcr的方法,所述方法涉及在pcr扩增之前用甲基化敏感性限制酶或甲基化依赖性限制酶消化基因组dna(singer-sam等人(1990)nucl.acids res.18:687)。此外,已报告利用亚硫酸氢盐处理dna作为甲基化分析的起点的其它技术。这些包括甲基化特异性pcr(msp)(herman等人(1992)proc.natl.acad.sci.usa 93:9821-9826)和从亚硫酸氢盐转化的dna扩增的pcr产物的限制酶消化(sadri和hornsby(1996)nucl.acids res.24:5058-5059;以及xiong和laird(1997)nucl.acids res.25:2532-2534)。已开发pcr技术用于检测基因突变(kuppuswamy等人(1991)proc.natl.acad.sci.usa 88:1143-1147)和定量等位基因特异性表达(szabo和mann(1995)genes dev.9:3097-3108;以及singer-sam等人(1992)pcr methods appl.1:160-163)。这类技术使用内部引物,其与pcr生成的模板退火并紧邻待测定的单个核苷酸的5'端终止。如美国专利no.7,037,650中所述的使用“定量ms-snupe测定”的方法用于一些实施方案中。
52.在评估甲基化状态时,甲基化状态通常表示为在特定位点(例如,在单个核苷酸、特定区域或基因座、更长的感兴趣序列,例如,高达约100-bp、200-bp、500-bp、1000-bp的dna子序列或更长序列)处甲基化的单个dna链相对于包含该特定位点的样品中的dna总群体的分数或百分比。传统上,未甲基化核酸的量是通过pcr使用校准器来确定。然后,用亚硫酸氢盐处理已知量的dna,并使用实时pcr或其它指数扩增,例如quarts测定(例如,由美国专利no.8,361,720以及美国专利申请公布no.2012/0122088和2012/0122106提供,以引用的方式并入本文中)来确定所得到的甲基化特异性序列。
53.例如,在一些实施方案中,方法包括通过使用外部标准来生成未甲基化靶标的标准曲线。标准曲线由至少两个点构建,并将未甲基化dna的实时ct值与已知的定量标准相关联。然后,由至少两个点和外部标准构建甲基化靶标的第二条标准曲线。这个第二条标准曲线将甲基化dna的ct与已知的定量标准相关联。接着,确定甲基化和未甲基化群体的测试样品ct值,并根据前两个步骤产生的标准曲线计算dna的基因组当量。感兴趣位点处的甲基化百分比由甲基化dna的量相对于群体中dna的总量计算,例如(甲基化dna的数目)/(甲基化
dna的数目+未甲基化dna的数目)
×
100。
54.本文还提供了用于实施所述方法的组合物和试剂盒。例如,在一些实施方案中,对一种或多种标志物具有特异性的试剂(例如,引物、探针)单独或成组提供(例如,用于扩增多种标志物的引物对组)。还可提供用于进行检测测定的额外试剂(例如,用于进行quarts、pcr、测序、亚硫酸氢盐或其它测定的酶、缓冲液、阳性和阴性对照)。在一些实施方案中,试剂盒含有能够以甲基化特异性方式修饰dna的试剂(例如,甲基化敏感性限制酶、甲基化依赖性限制酶和亚硫酸氢盐试剂)。在一些实施方案中,提供了含有一种或多种对于实施方法而言必需的、足够的或有用的试剂的试剂盒。还提供了含有试剂的反应混合物。还提供了含有多种试剂的预混试剂组,这些试剂可以相互添加和/或添加至测试样品中以完善反应混合物。
55.在一些实施方案中,本文所述的技术与可编程机器相关联,该可编程机器被设计用于执行由本文所述的方法提供的一系列算术或逻辑运算。例如,这项技术的一些实施方案与计算机软件和/或计算机硬件相关联(例如,在其中执行)。在一个方面,这项技术涉及一种计算机,该计算机包括一种形式的存储器、用于执行算术和逻辑运算的元件以及用于执行一系列指令(例如,本文提供的方法)以读取、操作和存储数据的处理元件(例如,微处理器)。在一些实施方案中,微处理器是系统的一部分,用于:确定甲基化状态(例如,一种或多种dmr,例如表1a和6a中提供的dmr 1-560);比较甲基化状态(例如,一种或多种dmr,例如表1a和6a中提供的dmr 1-560);生成标准曲线;确定ct值;计算甲基化的分数、频率或百分比(例如,一种或多种dmr,例如表1a和6a中提供的dmr 1-560);鉴定cpg岛;确定测定或标志物的特异性和/或灵敏度;计算roc曲线和相关的auc;序列分析;皆如本文所述或本领域已知。
56.在一些实施方案中,微处理器或计算机在算法中使用甲基化状态数据来预测癌症部位。
57.在一些实施方案中,软件或硬件组件接收多个测定的结果并基于多个测定的结果确定单个值结果以向用户报告,指示癌症风险(例如,确定如表1a和6a中提供的多个dmr的甲基化状态)。相关实施方案基于来自多个测定的结果的数学组合(例如加权组合、线性组合)计算风险因子,例如确定多种标志物(例如,如表1a和6a中提供的多个dmr)的甲基化状态。在一些实施方案中,dmr的甲基化状态定义了一个维度并且可以在多维空间中具有值并且由多个dmr的甲基化状态定义的坐标是例如向用户报告的结果,例如与癌症相关风险。
58.一些实施方案包含存储媒体和存储器组件。存储器组件(例如,易失性和/或非易失性存储器)可用于存储指令(例如,如本文提供的方法的实施方案)和/或数据(例如工件,例如甲基化测量、序列和与之相关的统计描述)。一些实施方案涉及还包括cpu、图形卡和用户界面(例如,包括例如显示器的输出装置和例如键盘的输入装置)中的一个或多个的系统。
59.与这项技术相关的可编程机器包括常规的现存技术和正在开发或有待开发的技术(例如,量子计算机、化学计算机、dna计算机、光学计算机、基于自旋电子学的计算机等)。
60.在一些实施方案中,这项技术包含用于传输数据的有线(例如,金属电缆、光纤)或无线传输媒体。例如,一些实施方案涉及通过网络(例如,局域网(lan)、广域网(wan)、自组织网络、互联网等)进行数据传输。在一些实施方案中,可编程机器作为对等体存在于这样
的网络上,并且在一些实施方案中可编程机器具有客户端/服务器关系。
61.在一些实施方案中,数据存储在例如硬盘、闪存、光学媒体、软盘等计算机可读存储媒体上。
62.在一些实施方案中,本文提供的技术与协同操作以执行如本文所述的方法的多个可编程装置相关联。例如,在一些实施方案中,多台计算机(例如,通过网络连接)可以并行工作以收集和处理数据,例如,在集群计算或网格计算或一些其它依赖于完整计算机(具有板载cpu、存储器、电源、网络接口等)通过常规网络接口(例如以太网、光纤)或无线网络技术连接到网络(私有、公共或互联网)的分布式计算机架构的执行中。
63.例如,一些实施方案提供了一种包括计算机可读媒体的计算机。该实施方案包括耦合到处理器的随机存取存储器(ram)。处理器执行被存储在存储器中的计算机可执行程序指令。这样的处理器可以包括微处理器、asic、状态机或其它处理器,并且可以是多种计算机处理器中的任一种,例如来自santa clara(california)的intel公司和schaumburg(illinois)的motorola公司的处理器。这样的处理器包括或可以与媒体,例如计算机可读媒体通信,所述媒体存储指令,在由处理器执行时,这些指令使处理器执行本文所述的步骤。
64.计算机可读媒体的实施方案包括但不限于能够为处理器提供计算机可读指令的电子、光学、磁性或其它存储或传输装置。合适媒体的其它实例包括但不限于软盘、cd-rom、dvd、磁盘、存储芯片、rom、ram、asic、配置的处理器、所有光学媒体、所有磁带或其它磁性媒体,或计算机处理器可以从中读取指令的任何其它媒体。此外,各种其它形式的计算机可读媒体可以向计算机传输或携带指令,包括路由器、私有或公共网络、或其它有线和无线传输装置或信道。指令可以包含来自任何合适的计算机编程语言的代码,包括例如c、c++、c#、visual basic、java、python、perl和javascript。
65.在一些实施方案中,计算机连接到网络。计算机还可能包括许多外部或内部装置,例如鼠标、cd-rom、dvd、键盘、显示器或其它输入或输出装置。计算机的实例是个人计算机、数字助理、个人数字助理、蜂窝电话、移动电话、智能电话、寻呼机、数字平板电脑、膝上型计算机、互联网设备和其它基于处理器的装置。一般来说,与本文提供的技术的各方面相关的计算机可以是在任何操作系统上操作的任何类型的基于处理器的平台,例如microsoft windows、linux、unix、mac os x等,能够支持一个或多个包含本文提供的技术的程序。一些实施方案包括执行其它应用程序(例如,应用程序)的个人计算机。应用程序可以含在存储器中并且可以包括例如文字处理应用程序、电子表格应用程序、电子邮件应用程序、即时消息应用程序、演示应用程序、因特网浏览器应用程序、日历/组织器应用程序和任何其它能够由客户端装置执行的应用程序。
66.本文所述的与这项技术相关联的所有这类组件、计算机和系统可以是逻辑的或虚拟的。
67.因此,本文提供了与从受试者获得的样品中筛查卵巢癌和/或卵巢癌的各种形式(例如,透明细胞oc、子宫内膜样oc、粘液性oc、浆液性oc)的方法相关的技术,所述方法包括测定从受试者获得的样品(例如卵巢组织)(例如血浆样品)中标志物的甲基化状态,并且当标志物的甲基化状态不同于在未患这类癌症的受试者中测定的标志物的甲基化状态时,将所述受试者鉴定为患有oc和/或特定形式的oc(例如,透明细胞oc、子宫内膜样oc、粘液性
oc、浆液性oc),其中标志物包含差异甲基化区域(dmr)中的碱基,所述dmr选自由表1a和6a中提供的dmr 1-560组成的组。
68.在一些实施方案中,其中从受试者获得的样品是卵巢组织并且以下标志物中的一种或多种的甲基化状态不同于在未患卵巢癌的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有卵巢癌:agrn_a、atp10a_a、atp10a_b、atp10a_c、atp10a_d、bcat1、ccnd2_d、cmtm3_a、elmo1_a、elmo1_b、elmo1_c、emx1、eps8l2_a、eps8l2_b、eps8l2_c、eps8l2_d、faim2_a、flj34208_a、gprin1、gypc_a、ina_a、itga4_b、kcna3_a、kcna3_c、lbh、lime1_a、lime1_b、loc646278、lrrc4、lrrc41_a、max.chr1.110626771-110626832、max.chr1.147790358-147790381、max.chr1.161591532-161591608、max.chr15.28351937-28352173、max.chr15.28352203-28352671、max.chr15.29131258-29131734、max.chr4.8859995-8860062、max.chr5.42952182-42952292、mdfi、ncor2、nkx2-6、oplah_a、parp15、pde10a、ppp1r16b、rassf1_b、septin9、ski、slc12a8、src_a、ssbp4_b、st8sia1、tacc2_a、tshz3、ubtf、vim、vipr2_a、zbed4、zmiz1_a、zmiz1_b、zmiz1_c、znf382_a、znf469_b、atp6v1b1_a、bzrap1、gdf6、iffo1_a、iffo1_b、kcnab2、limd2、maml3_b、max.chr14.102172350-102172770、max.chr16.85482307-85482494、max.chr17.76254728-76254841、max.chr5.42993898-42994179和rasal3(参见表1a、1b、6a;实施例i)。
69.在一些实施方案中,其中从受试者获得的样品是卵巢组织并且以下标志物中的一种或多种的甲基化状态不同于在未患卵巢癌的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有卵巢癌:max.chr16.85482307-85482494、gdf6、iffo_a、max.chr5.42993898-42994179、max.chr17.76254728-76254841、max.chr14.102172350-102172770、rasal3、bzrap1和limd2(参见表3;实施例i)。
70.在一些实施方案中,其中从受试者获得的样品是卵巢组织并且以下标志物中的一种或多种的甲基化状态不同于在未患卵巢癌的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有卵巢癌:palld、prdm14、max.chr1.147790358-147790381、bcat1、maml3_a、ski、dnmt3a_a和c2cd4d(参见表4a;实施例i)。
71.在一些实施方案中,其中从受试者获得的样品是卵巢组织并且以下标志物中的一种或多种的甲基化状态不同于在未患卵巢癌的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有卵巢癌:bcat1_6015、ski、sim2_b、dnmt3a_a、cdo1_a和dscr6(参见表8a;实施例ii)。
72.在一些实施方案中,其中从受试者获得的样品是卵巢组织并且以下标志物中的一种或多种的甲基化状态不同于在未患卵巢癌的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有透明细胞卵巢癌:tacc2_a、lrrc41_a、eps8l2、lbh、lime1_b、mdfi、faim2_a、gypc_a、agrn_b和zbed4(参见表2a;实施例i)。
73.在一些实施方案中,其中从受试者获得的样品是卵巢组织并且以下标志物中的一种或多种的甲基化状态不同于在未患卵巢癌的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有透明细胞卵巢癌:mt1a_a、celf2_a、kcna3_a、mdfi、palld、prdm14、parp15、tacc2_a、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、agrn_b、max.chr6.10382190-10382225、dscr6、maml3_a、max.chr14.105512178-105512224、eps8l2_e、ski、gprin1_a、max.chr8.142215938-142216298、cdo1_a、dnmt3a_a、
sim2_a、ski、mt1a_b、gypc_a、bcl2l11、pisd和c2cd4d(参见表4b;实施例i)。
74.在一些实施方案中,其中从受试者获得的样品是卵巢组织并且以下标志物中的一种或多种的甲基化状态不同于在未患卵巢癌的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有透明细胞卵巢癌:ncor2、mt1a_b、celf2_a、palld、prdm14、parp15、tacc2_a、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、agrn_b、max.chr6.10382190-10382225、dscr6、maml3_a、ski、gprin1_a、cdo1_a、sim2_a、iffo1_a、mt1a_b、gypc_a、bcl2l11、gdf6和c2cd4d(参见表5b;实施例i)。
75.在一些实施方案中,其中从受试者获得的样品是卵巢组织并且以下标志物中的一种或多种的甲基化状态不同于在未患卵巢癌的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有透明细胞卵巢癌:agrn_8794、bhlhe23_8339、eps8l2_f、rassf1_8293、mdfi_6321、ski、gypc_c、nkx2-6_4159、loc100131366、faim2_b、gprin1_b、lrrc41_b、tacc2_b、lbh、sim2_b、cdo1_a和dscr6(参见表8b;实施例ii)。
76.在一些实施方案中,其中从受试者获得的样品是卵巢组织并且以下标志物中的一种或多种的甲基化状态不同于在未患卵巢癌的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有子宫内膜样卵巢癌:parp15、gprin1_a、gypc1_a、flj34208、max.chr1.147790358-147790381、faim2_a、sh2b3、kcnq5、irf4和bcat1(参见表2b;实施例i)。
77.在一些实施方案中,其中从受试者获得的样品是卵巢组织并且以下标志物中的一种或多种的甲基化状态不同于在未患卵巢癌的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有子宫内膜样卵巢癌:ncor2、celf2_a、palld、prdm14、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、maml3_a、ski、gprin1_a、ski、bcl2l11和c2cd4d(参见表4c;实施例i)。
78.在一些实施方案中,其中从受试者获得的样品是卵巢组织并且以下标志物中的一种或多种的甲基化状态不同于在未患卵巢癌的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有子宫内膜样卵巢癌:ncor2、palld、prdm14、max.chr1.147790358-147790381、max.chr11.14926602-14926671、dscr6、gprin1_a、cdo1_a、sim2_a、iffo1_a和c2cd4d(参见表5c;实施例i)。
79.在一些实施方案中,其中从受试者获得的样品是卵巢组织并且以下标志物中的一种或多种的甲基化状态不同于在未患卵巢癌的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有子宫内膜样卵巢癌:bcat1_6015、eps8l2_f、ski、nkx2-6_4159、c1ql3_b、gprin1_b、parp15、oxt_c、sim2_b、dnmt3a_a和celf2_a(参见表8c;实施例ii)。
80.在一些实施方案中,其中从受试者获得的样品是卵巢组织并且以下标志物中的一种或多种的甲基化状态不同于在未患卵巢癌的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有粘液性卵巢癌:cmtm3_a、atp10a_c、tshz3、zmiz1_b、atp10a_b、elmo1_b、tacc2_a、lrrc4、vim和znf382_a(参见表2c;实施例i)。
81.在一些实施方案中,其中从受试者获得的样品是卵巢组织并且以下标志物中的一种或多种的甲基化状态不同于在未患卵巢癌的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有粘液性卵巢癌:ncor2、mt1a_a、kcna3_a、zmiz1_c、tacc2_a、max.chr1.147790358-147790381、bcat1、agrn_b、ski、slc12a8、zmiz1_b、bcl2l11和gata2
(参见表4d;实施例i)。
82.在一些实施方案中,其中从受试者获得的样品是卵巢组织并且以下标志物中的一种或多种的甲基化状态不同于在未患卵巢癌的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有粘液性卵巢癌:ncor2、palld、tacc2_a、bcat1、agrn_b、ski、slc12a8、zmiz1_b和bcl2l11(参见表5d;实施例i)。
83.在一些实施方案中,其中从受试者获得的样品是卵巢组织并且以下标志物中的一种或多种的甲基化状态不同于在未患卵巢癌的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有粘液性卵巢癌:bcat1_6015、elmo1_9100、kcna3_7518、kcna3_7320、mdfi_6321、ski、vipr_b、znf382_b、atp10a_e、cmtm3_b、zmiz1_d、src_b、hdgfrp3、tacc2_b、tshz3、lbh、dnmt3a_a(参见表8d;实施例ii)。
84.在一些实施方案中,其中从受试者获得的样品是卵巢组织并且以下标志物中的一种或多种的甲基化状态不同于在未患卵巢癌的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有浆液性卵巢癌:max.chr1.147790358-147790381、maml3、nr2f6、dnmt3a_a、ski、sobp、ubtf、agrn_c、max.chr12.30975740-30975780和capn2_a(参见表2d;实施例i)。
85.在一些实施方案中,其中从受试者获得的样品是卵巢组织并且以下标志物中的一种或多种的甲基化状态不同于在未患卵巢癌的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有浆液性卵巢癌:palld、prdm14、max.chr1.147790358-147790381、capn2_a、max.chr6.10382190-10382225、ski、nr2f6、iffo1_a、mt1a_b、iffo1_b、gdf6和c2cd4d(参见表4e;实施例i)。
86.在一些实施方案中,其中从受试者获得的样品是卵巢组织并且以下标志物中的一种或多种的甲基化状态不同于在未患卵巢癌的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有浆液性卵巢癌:ncor2、max.chr1.147790358-147790381、max.chr6.10382190-10382225、iffo1_a、gdf6和c2cd4d(参见表5a;实施例i)。
87.在一些实施方案中,其中从受试者获得的样品是卵巢组织并且以下标志物中的一种或多种的甲基化状态不同于在未患卵巢癌的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有浆液性卵巢癌:ski、pear1_b、capn2_b、sim2_b、dnmt3a_a、cdo1_a和nr2f6(参见表8e;实施例ii)。
88.在一些实施方案中,其中从受试者获得的样品是血液样品(例如,血浆样品、全血样品、白细胞样品、血清样品)并且以下标志物中的一种或多种的甲基化状态不同于在未患oc的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有oc:gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、src(例如,src_a、src_b)、sim2(例如,sim2_a、sim2_b)、agrn(例如,agrn_a、agrn_b、agrn_c、agrn_8794)、faim2(例如,faim2_a、faim2_b)、celf2(例如,celf2_a、celf2_b)、dscr6、gypc(例如,gypc_a、gypc_b、gypc_c)、capn2(例如,capn2_a、capn2_b)和bcat1(参见表9;实施例iii)。
89.在一些实施方案中,其中从受试者获得的样品是血液样品(例如,血浆样品、全血样品、白细胞样品、血清样品)并且以下标志物中的一种或多种的甲基化状态不同于在未患oc的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有oc:atp10a(例如,atp10a_a、atp10a_b、atp10a_c、atp10a_d、atp10a_e)、eps8l2(例如,eps8l2_a、eps8l2_
b、eps8l2_c、eps8l2_d)、c1ql3(例如,c1ql3_a、c1ql3_b)、faim2(例如,faim2_a、faim2_b)、capn2_b、lbh、cmtm3(例如,cmtm3_a、cmtm3_b)、zmiz1(例如,zmiz1_a、zmiz1_b、zmiz1_c、zmiz1_d)、gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、gp5、dscr6、ski、sim2_a、agrn_8794、bcat1_6015、kcna3_7518、kcna3_7320、loc10013136、gypc_c、src(例如,src_a、src_b)、nr2f6、tshz3、celf2(例如,celf2_a、celf2_b)、tacc2(例如,tacc2_a、tacc2_b)、vipr2(例如,vipr2_a、vipr2_b)和spock2_74333(参见表10,实施例iii)。
90.在一些实施方案中,其中从受试者获得的样品是血液样品(例如,血浆样品、全血样品、白细胞样品、血清样品)并且1)检测到增加水平的ca-125以及2)以下标志物中的一种或多种的甲基化状态不同于在未患oc的受试者中测定的一种或多种标志物的甲基化状态指示所述受试者患有oc:atp10a(例如,atp10a_a、atp10a_b、atp10a_c、atp10a_d、atp10a_e)、eps8l2(例如,eps8l2_a、eps8l2_b、eps8l2_c、eps8l2_d)、c1ql3(例如,c1ql3_a、c1ql3_b)、faim2(例如,faim2_a、faim2_b)、capn2_b、lbh、cmtm3(例如,cmtm3_a、cmtm3_b)、zmiz1(例如,zmiz1_a、zmiz1_b、zmiz1_c、zmiz1_d)、gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、gp5、dscr6、ski和sim2_a(参见表11-13,实施例iii)。
91.这项技术涉及鉴定和区分卵巢癌和/或卵巢癌的各种形式(例如,透明细胞oc、子宫内膜样oc、粘液性oc、浆液性oc)。一些实施方案提供了包括测定多种标志物,例如包括测定1种、2种、3种、2种至11种至100种或120种或375种或560种标志物(例如,1-4种、1-6种、1-7种、1-8种、1-9种、1-10种、1-11种、1-12种、1-13种、1-14种、1-15种、1-16种、1-17种、1-18种、1-19种、1-20种、1-25种、1-50种、1-75种、1-100种、1-200种、1-300种、1-400种、1-500种、1-560种)(例如,2-4种、2-6种、2-7种、2-8种、2-9种、2-10种、2-11种、2-12种、2-13种、2-14种、2-15种、2-16种、2-17种、2-18种、2-19种、2-20种、2-25种、2-50种、2-75种、2-100种、2-200种、2-300种、2-400种、2-500种、2-560种)(例如,3-4种、3-6种、3-7种、3-8种、3-9种、3-10种、3-11种、3-12种、3-13种、3-14种、3-15种、3-16种、3-17种、3-18种、3-19种、3-20种、3-25种、3-50种、3-75种、3-100种、3-200种、3-300种、3-400种、3-500种、3-560种)(例如,4-5种、4-6种、4-7种、4-8种、4-9种、4-10种、4-11种、4-12种、4-13种、4-14种、4-15种、4-16种、4-17种、4-18种、4-19种、4-20种、4-25种、4-50种、4-75种、4-100种、4-200种、4-300种、4-400种、4-500种、4-560种)(例如,5-6种、5-7种、5-8种、5-9种、5-10种、5-11种、5-12种、5-13种、5-14种、5-15种、5-16种、5-17种、5-18种、5-19种、5-20种、5-25种、5-50种、5-75种、5-100种、5-200种、5-300种、5-400种、5-500种、5-560种)的方法。
92.这项技术不限于所评估的甲基化状态。在一些实施方案中,评估样品中标志物的甲基化状态包括确定一种碱基的甲基化状态。在一些实施方案中,测定样品中标志物的甲基化状态包括确定多种碱基的甲基化程度。此外,在一些实施方案中,标志物的甲基化状态包含相对于标志物的正常甲基化状态增加的标志物甲基化。在一些实施方案中,标志物的甲基化状态包含相对于标志物的正常甲基化状态减少的标志物甲基化。在一些实施方案中,标志物的甲基化状态包含相对于标志物的正常甲基化状态不同的标志物甲基化模式。
93.此外,在一些实施方案中,标志物是100个或更少碱基的区域,标志物是500个或更少碱基的区域,标志物是1000个或更少碱基的区域,标志物是5000个或更少碱基的区域,或在一些实施方案中,标志物是一个碱基。在一些实施方案中,标志物在高cpg密度启动子中。
94.这项技术不受样品类型的限制。例如,在一些实施方案中,样品是粪便样品、组织
样品(例如卵巢组织样品)、血液样品(例如血浆、血清、全血)、排泄物或尿液样品。
95.此外,在用于确定甲基化状态的方法中不限制这项技术。在一些实施方案中,分析包括使用甲基化特异性聚合酶链式反应、核酸测序、质谱法、甲基化特异性核酸酶、基于质量的分离或靶标捕获。在一些实施方案中,测定包括使用甲基化特异性寡核苷酸。在一些实施方案中,这项技术使用大规模平行测序(例如,下一代测序)来确定甲基化状态,例如,边合成边测序、实时(例如,单分子)测序、珠乳液测序(bead emulsion sequencing)、纳米孔测序等。
96.这项技术提供了用于检测dmr的试剂,例如,在一些实施方案中提供了一组寡核苷酸,其包含由seq id no:1-283提供的序列(参见表1c和6b)。在一些实施方案中,提供了包含与在dmr中具有碱基的染色体区域互补的序列的寡核苷酸,例如对dmr的甲基化状态敏感的寡核苷酸。
97.这项技术提供了用于鉴定卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:agrn_a、atp10a_a、atp10a_b、atp10a_c、atp10a_d、bcat1、ccnd2_d、cmtm3_a、elmo1_a、elmo1_b、elmo1_c、emx1、ep s8l2_a、eps8l2_b、eps8l2_c、eps8l2_d、faim2_a、flj34208_a、gprin1、gypc_a、ina_a、itga4_b、kcna3_a、kcna3_c、lbh、lime1_a、lime1_b、loc646278、lrrc4、lrrc41_a、max.chr1.110626771-110626832、max.chr1.147790358-147790381、max.chr1.161591532-161591608、max.chr15.28351937-28352173、max.chr15.28352203-28352671、max.chr15.29131258-29131734、max.chr4.8859995-8860062、max.chr5.42952182-42952292、mdfi、ncor2、nkx2-6、oplah_a、parp15、pde10a、ppp1r16b、rassf1_b、septin9、ski、slc12a8、src_a、ssbp4_b、st8si a1、tacc2_a、tshz3、ubtf、vim、vipr2_a、zbed4、zmiz1_a、zmiz1_b、zmiz1_c、znf382_a、znf469_b、atp6v1b1_a、bzrap1、gdf6、iffo1_a、iffo1_b、kcnab2、limd2、maml3_b、max.chr14.102172350-102172770、max.chr16.85482307-85482494、max.chr17.76254728-76254841、max.chr5.42993898-42994179和rasal3(参见表1a、1b、6a、6b;实施例i)。
98.这项技术提供了用于鉴定卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:max.chr16.85482307-85482494、gdf6、iffo_a、max.chr5.42993898-42994179、max.chr17.76254728-76254841、max.chr14.102172350-102172770、rasal3、bzrap1和limd2(参见表3;实施例i)。
99.这项技术提供了用于鉴定卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:palld、prdm14、max.chr1.147790358-147790381、bcat1、maml3_a、ski、dnmt3a_a和c2cd4d(参见表4a;实施例i)。
100.这项技术提供了用于鉴定卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:bcat1_6015、ski、sim2_b、dnmt3a_a、cdo1_a和dscr6(参见表8a;实施例ii)。
101.这项技术提供了用于鉴定透明细胞卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:tacc2_a、lrrc41_a、eps8l2、lbh、lime1_b、mdfi、faim2_a、gypc_a、agrn_b和zbed4(参见表2a;实施例i)。
102.这项技术提供了用于鉴定透明细胞卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:mt1a_a、celf2_a、kcna3_a、mdfi、palld、
prdm14、parp15、tacc2_a、max.chr1.147790358-147790381、bcat1、max.ch r11.14926602-14926671、agrn_b、max.chr6.10382190-10382225、dscr6、maml3_a、max.chr14.105512178-105512224、eps8l2_e、ski、gprin1_a、max.chr8.142215938-142216298、cdo1_a、dn mt3a_a、sim2_a、ski、mt1a_b、gypc_a、bcl2l11、pisd和c2cd4d(参见表4b;实施例i)。
103.这项技术提供了用于鉴定透明细胞卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:ncor2、mt1a_b、celf2_a、palld、prdm14、parp15、tacc2_a、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、agrn_b、max.chr6.10382190-10382225、dscr6、maml3_a、ski、gprin1_a、cdo1_a、sim2_a、iffo1_a、mt1a_b、gypc_a、bcl2l11、gdf6和c2cd4d(参见表5b;实施例i)。
104.这项技术提供了用于鉴定透明细胞卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:agrn_8794、bhlhe23_8339、eps8l2_f、rassf1_8293、mdfi_6321、ski、gypc_c、nkx2-6_4159、loc100131366、faim2_b、gprin1_b、lrrc41_b、tacc2_b、lbh、sim2_b、cdo1_a和dscr6(参见表8b;实施例ii)。
105.这项技术提供了用于鉴定子宫内膜样卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:parp15、gprin1_a、gypc1_a、flj34208、max.chr1.147790358-147790381、faim2_a、sh2b3、kcnq5、irf4和bcat1(参见表2b;实施例i)。
106.这项技术提供了用于鉴定子宫内膜样卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:ncor2、celf2_a、palld、prdm14、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、maml3_a、ski、gprin1_a、ski、bcl2l11和c2cd4d(参见表4c;实施例i)。
107.这项技术提供了用于鉴定子宫内膜样卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:ncor2、palld、prdm14、max.chr1.147790358-147790381、max.chr11.14926602-14926671、dscr6、gprin1_a、cdo1_a、sim2_a、iffo1_a和c2cd4d(参见表5c;实施例i)。
108.这项技术提供了用于鉴定子宫内膜样卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:bcat1_6015、eps8l2_f、ski、nkx2-6_4159、c1ql3_b、gprin1_b、parp15、oxt_c、sim2_b、dnmt3a_a和celf2_a(参见表8c;实施例ii)。
109.这项技术提供了用于鉴定粘液性卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:cmtm3_a、atp10a_c、tshz3、zmiz1_b、atp10a_b、elmo1_b、tacc2_a、lrrc4、vim和znf382_a(参见表2c;实施例i)。
110.这项技术提供了用于鉴定粘液性卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:ncor2、mt1a_a、kcna3_a、zmiz1_c、tacc2_a、max.chr1.147790358-147790381、bcat1、agrn_b、ski、slc12a8、zmiz1_b、bcl2l11和gata2(参见表4d;实施例i)。
111.这项技术提供了用于鉴定粘液性卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:ncor2、palld、tacc2_a、bcat1、agrn_b、ski、slc12a8、zmiz1_b和bcl2l11(参见表5d;实施例i)。
112.这项技术提供了用于鉴定粘液性卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:bcat1_6015、elmo1_9100、kcna3_7518、kcna3_7320、mdfi_6321、ski、vipr_b、znf382_b、atp10a_e、cmtm3_b、zmiz1_d、src_b、hdgfrp3、tacc2_b、tshz3、lbh、dnmt3a_a(参见表8d;实施例ii)。
113.这项技术提供了用于鉴定浆液性卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:max.chr1.147790358-147790381、maml3、nr2f6、dnmt3a_a、ski、sobp、ubtf、agrn_c、max.chr12.30975740-30975780和capn2_a(参见表2d;实施例i)。
114.这项技术提供了用于鉴定浆液性卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:pall d、prdm14、max.chr1.147790358-147790381、capn2_a、max.chr6.10382190-10382225、ski、nr2f6、iffo1_a、mt1a_b、iffo1_b、gdf6和c2cd4d(参见表4e;实施例i)。
115.这项技术提供了用于鉴定浆液性卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:ncor2、max.chr1.147790358-147790381、max.chr6.10382190-10382225、iffo1_a、gdf6和c2cd4d(参见表5a;实施例i)。
116.这项技术提供了用于鉴定浆液性卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:ski、pear1_b、capn2_b、sim2_b、dnmt3a_a、cdo1_a和nr2f6(参见表8e;实施例ii)。
117.这项技术提供了用于鉴定卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、src(例如,src_a、src_b)、sim2(例如,sim2_a、sim2_b)、agrn(例如,agrn_a、agrn_b、agrn_c、agrn_8794)、faim2(例如,faim2_a、faim2_b)、celf2(例如,celf2_a、celf2_b)、dscr6、gypc(例如,gypc_a、gypc_b、gypc_c)、capn2(例如,capn2_a、capn2_b)和bcat1(参见表9;实施例iii)。
118.这项技术提供了用于鉴定卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:atp10a(例如,atp10a_a、atp10a_b、atp10a_c、atp10a_d、atp10a_e)、eps8l2(例如,eps8l2_a、eps8l2_b、eps8l2_c、eps8l2_d)、c1ql3(例如,c1ql3_a、c1ql3_b)、faim2(例如,faim2_a、faim2_b)、capn2_b、lbh、cmtm3(例如,cmtm3_a、cmtm3_b)、zmiz1(例如,zmiz1_a、zmiz1_b、zmiz1_c、zmiz1_d)、gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、gp5、dscr6、ski、sim2_a、agrn_8794、bcat1_6015、kcna3_7518、kcna3_7320、loc10013136、gypc_c、src(例如,src_a、src_b)、nr2f6、tshz3、celf2(例如,celf2_a、celf2_b)、tacc2(例如,tacc2_a、tacc2_b)、vipr2(例如,vipr2_a、vipr2_b)和spock2_74333(参见表10,实施例iii)。
119.这项技术提供了用于鉴定卵巢癌的各种标志物组,例如,在一些实施方案中,标志物包含具有如下注释的染色体区域:atp10a(例如,atp10a_a、atp10a_b、atp10a_c、atp10a_d、atp10a_e)、eps8l2(例如,eps8l2_a、eps8l2_b、eps8l2_c、eps8l2_d)、c1ql3(例如,c1ql3_a、c1ql3_b)、faim2(例如,faim2_a、faim2_b)、capn2_b、lbh、cmtm3(例如,cmtm3_a、cmtm3_b)、zmiz1(例如,zmiz1_a、zmiz1_b、zmiz1_c、zmiz1_d)、gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、gp5、dscr6、ski、sim2_a、agrn_8794、bcat1_6015、
kcna3_7518、kcna3_7320、loc10013136、gypc_c、src(例如,src_a、src_b)、nr2f6、tshz3、celf2(例如,celf2_a、celf2_b)、tacc2(例如,tacc2_a、tacc2_b)、vipr2(例如,vipr2_a、vipr2_b)和spock2_74333(参见表10,实施例iii)。
120.提供了试剂盒实施方案,例如一种试剂盒,所述试剂盒包括能够以甲基化特异性方式修饰dna的试剂(例如,甲基化敏感性限制酶、甲基化依赖性限制酶和亚硫酸氢盐试剂);以及对照核酸,所述对照核酸包含来自选自由dmr 1-560(来自表1a和6a)组成的组的dmr的序列并且具有与未患卵巢癌或oc亚型(例如,透明细胞oc、子宫内膜样oc、粘液性oc、浆液性oc)的受试者相关的甲基化状态。在一些实施方案中,试剂盒包括亚硫酸氢盐试剂和如本文所述的寡核苷酸。在一些实施方案中,试剂盒包括能够以甲基化特异性方式修饰dna的试剂(例如,甲基化敏感性限制酶、甲基化依赖性限制酶和亚硫酸氢盐试剂);以及对照核酸,所述对照核酸包含来自选自由dmr1-560(来自表1a和6a)组成的组的dmr的序列并且具有与患有卵巢癌或卵巢癌亚型(例如,透明细胞oc、子宫内膜样oc、粘液性oc、浆液性oc)的受试者相关的甲基化状态。一些试剂盒实施例包括用于从受试者获得样品(例如,粪便样品;卵巢组织样品;血浆样品、血清样品、全血样品)的样品收集器;能够以甲基化特异性方式修饰dna的试剂(例如,甲基化敏感性限制酶、甲基化依赖性限制酶和亚硫酸氢盐试剂);以及如本文所述的寡核苷酸。
121.这项技术涉及组合物(例如,反应混合物)的实施方案。在一些实施方案中,提供了一种组合物,所述组合物包含:包含dmr的核酸,以及能够以甲基化特异性方式修饰dna的试剂(例如,甲基化敏感性限制酶、甲基化依赖性限制酶和亚硫酸氢盐试剂)。一些实施方案提供包含核酸的组合物,所述核酸包含dmr和如本文所述的寡核苷酸。一些实施方案提供包含核酸的组合物,所述核酸包含dmr和甲基化敏感性限制酶。一些实施方案提供包含核酸的组合物,所述核酸包含dmr和聚合酶。
122.提供了额外的相关方法实施方案,用于筛查从受试者获得的样品(例如,卵巢组织样品;血浆样品;粪便样品)中的卵巢癌和/或卵巢癌的各种形式(例如,透明细胞oc、子宫内膜样oc、粘液性oc、浆液性oc),例如一种方法,所述方法包括确定样品中的标志物的甲基化状态,所述标志物包含如dmr 1-506(来自表1a和6a)中的一个或多个的dmr中的碱基;将来自受试者样品的标志物的甲基化状态与来自未患卵巢癌(例如,卵巢癌和/或一种形式的卵巢癌:透明细胞oc、子宫内膜样oc、粘液性oc、浆液性oc)的受试者的正常对照样品的标志物的甲基化状态进行比较;以及确定受试样品和正常对照样品的甲基化状态差异的置信区间和/或p值。在一些实施方案中,置信区间为90%、95%、97.5%、98%、99%、99.5%、99.9%或99.99%,并且p值为0.1、0.05、0.025、0.02、0.01、0.005、0.001或0.0001。方法的一些实施方案提供了使包含dmr的核酸与能够以甲基化特异性方式修饰核酸的试剂(例如,甲基化敏感性限制酶、甲基化依赖性限制酶和亚硫酸氢盐试剂)反应的步骤,以产生例如以甲基化特异性方式修饰的核酸;对以甲基化特异性方式修饰的核酸进行测序,以提供以甲基化特异性方式修饰的核酸的核苷酸序列;将以甲基化特异性方式修饰的核酸的核苷酸序列与来自未患卵巢癌和/或一种形式的卵巢癌的受试者的包含dmr的核酸的核苷酸序列进行比较,以鉴定这两个序列的差异;以及当存在差异时,将受试者鉴定为患有卵巢癌和/或一种形式的卵巢癌(例如,透明细胞oc、子宫内膜样oc、粘液性oc、浆液性oc)。
123.这项技术提供了用于筛查从受试者获得的样品中的卵巢癌的系统。系统的示例性
实施方案包括例如用于筛查从受试者获得的样品(例如卵巢组织样品;血浆样品;粪便样品)中的卵巢癌和/或卵巢癌类型(例如,透明细胞oc、子宫内膜样oc、粘液性oc、浆液性oc)的系统,该系统包括:分析组件,所述分析组件被配置用于确定样品的甲基化状态;软件组件,所述软件组件被配置用于将样品的甲基化状态与数据库中记录的对照样品或参考样品甲基化状态进行比较;以及警报组件,所述警报组件被配置用于向用户发出关于卵巢癌相关的甲基化状态的警报。在一些实施方案中,警报由软件组件确定,所述软件组件接收多个测定的结果(例如,确定多种标志物,如例如表1a和6a中提供的dmr的甲基化状态)并基于多个结果计算值或结果以进行报告。一些实施例提供与本文提供的每个dmr相关联的加权参数的数据库,用于计算值或结果和/或警报以向用户(例如,如医师、护士、临床医生等)报告。在一些实施方案中,报告了来自多个测定的所有结果,并且在一些实施方案中,一个或多个结果用于提供评分、值或结果,所述评分、值或结果基于来自多个测定的一个或多个结果的复合物,其指示受试者中的癌症风险。
124.在系统的一些实施方案中,样品包含含有dmr的核酸。在一些实施方案中,该系统还包括用于分离核酸的组件、用于收集样品的组件,例如用于收集粪便样品的组件。在一些实施方案中,系统包含含有dmr的核酸序列。在一些实施方案中,数据库包含来自未患卵巢癌和/或特定类型的卵巢癌(例如,透明细胞oc、子宫内膜样oc、粘液性oc、浆液性oc)的受试者的核酸序列。还提供了核酸,例如一组核酸,每个核酸具有包含dmr的序列。在一些实施方案中,该组核酸中每个核酸具有来自未患卵巢癌和/或特定类型的卵巢癌的受试者的序列。相关系统实施方案包括如所述的一组核酸和与该组核酸相关的核酸序列数据库。一些实施方案还包括能够以甲基化特异性方式修饰dna的试剂(例如,甲基化敏感性限制酶、甲基化依赖性限制酶和亚硫酸氢盐试剂)。并且,一些实施方案还包括核酸测序仪。
125.在某些实施方案中,提供了用于表征来自人类患者的样品(例如,卵巢组织样品;血浆样品;全血样品;血清样品;粪便样品)的方法。例如,在一些实施方案中,这类实施方案包括从人类患者的样品获得dna;测定dna甲基化标志物的甲基化状态,所述dna甲基化标志物包含选自由表1a和6a的dmr 1-560组成的组的差异甲基化区域(dmr)中的碱基;以及将一种或多种dna甲基化标志物的所测定的甲基化状态与未患卵巢癌和/或特定类型的卵巢癌(例如,透明细胞oc、子宫内膜样oc、粘液性oc、浆液性oc)的人类患者的一种或多种dna甲基化标志物的甲基化水平参考进行比较。
126.这类方法不限于来自人类患者的特定类型的样品。在一些实施方案中,样品是卵巢组织样品。在一些实施方案中,样品是血浆样品。在一些实施方案中,样品是粪便样品、组织样品、卵巢组织样品、血液样品(例如血浆样品、全血样品、血清样品)或尿液样品。
127.在一些实施方案中,这类方法包括测定多种dna甲基化标志物(例如,1-4种、1-6种、1-7种、1-8种、1-9种、1-10种、1-11种、1-12种、1-13种、1-14种、1-15种、1-16种、1-17种、1-18种、1-19种、1-20种、1-25种、1-50种、1-75种、1-100种、1-200种、1-300种、1-400种、1-500种、1-560种)(例如,2-4种、2-6种、2-7种、2-8种、2-9种、2-10种、2-11种、2-12种、2-13种、2-14种、2-15种、2-16种、2-17种、2-18种、2-19种、2-20种、2-25种、2-50种、2-75种、2-100种、2-200种、2-300种、2-400种、2-500种、2-560种)(例如,3-4种、3-6种、3-7种、3-8种、3-9种、3-10种、3-11种、3-12种、3-13种、3-14种、3-15种、3-16种、3-17种、3-18种、3-19种、3-20种、3-25种、3-50种、3-75种、3-100种、3-200种、3-300种、3-400种、3-500种、3-560种)
(例如,4-5种、4-6种、4-7种、4-8种、4-9种、4-10种、4-11种、4-12种、4-13种、4-14种、4-15种、4-16种、4-17种、4-18种、4-19种、4-20种、4-25种、4-50种、4-75种、4-100种、4-200种、4-300种、4-400种、4-500种、4-560种)(例如,5-6种、5-7种、5-8种、5-9种、5-10种、5-11种、5-12种、5-13种、5-14种、5-15种、5-16种、5-17种、5-18种、5-19种、5-20种、5-25种、5-50种、5-75种、5-100种、5-200种、5-300种、5-400种、5-500种、5-560种)。在一些实施方案中,这类方法包括测定2至11种dna甲基化标志物。在一些实施方案中,这类方法包括测定12至120种dna甲基化标志物。在一些实施方案中,这类方法包括测定2至375种dna甲基化标志物。在一些实施方案中,这类方法包括测定样品中的一种或多种dna甲基化标志物的甲基化状态,包括确定一种碱基的甲基化状态。在一些实施方案中,这类方法包括测定样品中的一种或多种dna甲基化标志物的甲基化状态,包括确定多种碱基处的甲基化程度。在一些实施方案中,这类方法包括测定正向链的甲基化状态或测定反向链的甲基化状态。
128.在一些实施方案中,dna甲基化标志物是100个或更少碱基的区域。在一些实施方案中,dna甲基化标志物是500个或更少碱基的区域。在一些实施方案中,dna甲基化标志物是1000个或更少碱基的区域。在一些实施方案中,dna甲基化标志物是5000个或更少碱基的区域。在一些实施方案中,dna甲基化标志物是一个碱基。在一些实施方案中,dna甲基化标志物在高cpg密度启动子中。
129.在一些实施方案中,分析包括使用甲基化特异性聚合酶链式反应、核酸测序、质谱法、甲基化特异性核酸酶、基于质量的分离或靶标捕获。
130.在一些实施方案中,测定包括使用甲基化特异性寡核苷酸。在一些实施方案中,甲基化特异性寡核苷酸选自由seq id no:1-283(表1c、6b)组成的组。
131.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:agrn_a、atp10a_a、atp10a_b、atp10a_c、atp10a_d、bcat1、ccnd2_d、cmtm3_a、elmo1_a、elmo1_b、elmo1_c、emx1、eps8l2_a、eps8l2_b、eps8l2_c、eps8l2_d、faim2_a、flj34208_a、gprin1、gypc_a、ina_a、itga4_b、kcna3_a、kcna3_c、lbh、lime1_a、lime1_b、loc646278、lrrc4、lrrc41_a、max.chr1.110626771-110626832、max.chr1.147790358-147790381、max.chr1.161591532-161591608、max.chr15.28351937-28352173、max.chr15.28352203-28352671、max.chr15.29131258-29131734、max.chr4.8859995-8860062、max.chr5.42952182-42952292、mdfi、ncor2、nkx2-6、oplah_a、parp15、pde10a、ppp1r16b、rassf1_b、septin9、ski、slc12a8、src_a、ssbp4_b、st8sia1、tacc2_a、tshz3、ubtf、vim、vipr2_a、zbed4、zmiz1_a、zmiz1_b、zmiz1_c、znf382_a、znf469_b、atp6v1b1_a、bzrap1、gdf6、iffo1_a、iffo1_b、kcnab2、limd2、maml3_b、max.chr14.102172350-102172770、max.chr16.85482307-85482494、max.chr17.76254728-76254841、max.chr5.42993898-42994179和rasal3(参见表1a、1b、6a、6b;实施例i)。
132.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:max.chr16.85482307-85482494、gdf6、iffo_a、max.chr5.42993898-42994179、max.chr17.76254728-76254841、max.chr14.102172350-102172770、rasal3、bzrap1和li md2(参见表3;实施例i)。
133.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:palld、prdm14、max.chr1.147790358-147790381、bcat1、maml3_a、ski、dnmt3a_a
和c2cd4d(参见表4a;实施例i)。
134.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:bcat1_6015、ski、sim2_b、dnmt3a_a、cdo1_a和dscr6(参见表8a;实施例ii)。
135.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:tacc2_a、lrrc41_a、eps8l2、lbh、lime1_b、mdfi、faim2_a、gypc_a、agrn_b和zbed4(参见表2a;实施例i)。
136.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:mt1a_a、celf2_a、kcna3_a、md fi、palld、prdm14、parp15、tacc2_a、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、agrn_b、max.chr6.10382190-10382225、dscr6、maml3_a、max.chr14.105512178-105512224、eps8l2_e、ski、gprin1_a、max.chr8.142215938-142216298、cdo1_a、dnmt3a_a、sim2_a、ski、mt1a_b、gypc_a、bcl2l11、pisd和c2cd4d(参见表4b;实施例i)。
137.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:ncor2、mt1a_b、celf2_a、pall d、prdm14、parp15、tacc2_a、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、agrn_b、max.chr6.10382190-10382225、dscr6、maml3_a、ski、gprin1_a、cdo1_a、sim2_a、iffo1_a、mt1a_b、gypc_a、bcl2l11、gdf6和c2cd4d(参见表5b;实施例i)。
138.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:agrn_8794、bhlhe23_8339、eps8l2_f、rassf1_8293、mdfi_6321、ski、gypc_c、nkx2-6_4159、loc100131366、faim2_b、gprin1_b、lrrc41_b、tacc2_b、lbh、sim2_b、cdo1_a和dscr6(参见表8b;实施例ii)。
139.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:parp15、gprin1_a、gypc1_a、flj34208、max.chr1.147790358-147790381、faim2_a、sh2b3、kcnq5、irf4和bcat1(参见表2b;实施例i)。
140.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:ncor2、celf2_a、palld、prdm14、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、maml3_a、ski、gprin1_a、ski、bcl2l11和c2cd4d(参见表4c;实施例i)。
141.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:ncor2、palld、prdm14、max.chr1.147790358-147790381、max.chr11.14926602-14926671、dscr6、gprin1_a、cdo1_a、sim2_a、iffo1_a和c2cd4d(参见表5c;实施例i)。
142.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:bcat1_6015、eps8l2_f、ski、nkx2-6_4159、c1ql3_b、gprin1_b、parp15、oxt_c、sim2_b、dnmt3a_a和celf2_a(参见表8c;实施例ii)。
143.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:cmtm3_a、atp10a_c、tshz3、zmiz1_b、atp10a_b、elmo1_b、tacc2_a、lrrc4、vim和znf382_a(参见表2c;实施例i)。
144.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:ncor2、mt1a_a、kcna3_a、zmiz1_c、tacc2_a、max.chr1.147790358-147790381、
bcat1、agrn_b、ski、slc12a8、zmiz1_b、bcl2l11和gata2(参见表4d;实施例i)。
145.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:ncor2、palld、tacc2_a、bcat1、agrn_b、ski、slc12a8、zmiz1_b和bcl2l11(参见表5d;实施例i)。
146.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:bcat1_6015、elmo1_9100、kcna3_7518、kcna3_7320、mdfi_6321、ski、vipr_b、znf382_b、atp10a_e、cmtm3_b、zmiz1_d、src_b、hdgfrp3、tacc2_b、tshz3、lbh、dnmt3a_a(参见表8d;实施例ii)。
147.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:max.chr1.147790358-147790381、maml3、nr2f6、dnmt3a_a、ski、sobp、ubtf、agrn_c、max.chr12.30975740-30975780和capn2_a(参见表2d;实施例i)。
148.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:palld、prdm14、max.chr1.147790358-147790381、capn2_a、max.chr6.10382190-10382225、ski、nr2f6、iffo1_a、mt1a_b、iffo1_b、gdf6和c2cd4d(参见表4e;实施例i)。
149.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:ncor2、max.chr1.147790358-147790381、max.chr6.10382190-10382225、iffo1_a、gdf6和c2cd4d(参见表5a;实施例i)。
150.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:ski、pear1_b、capn2_b、sim2_b、dnmt3a_a、cdo1_a和nr2f6(参见表8e;实施例ii)。
151.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、src(例如,src_a、src_b)、sim2(例如,sim2_a、sim2_b)、agrn(例如,agrn_a、agrn_b、agrn_c、agrn_8794)、faim2(例如,faim2_a、faim2_b)、celf2(例如,celf2_a、celf2_b)、dscr6、gypc(例如,gypc_a、gypc_b、gypc_c)、capn2(例如,capn2_a、capn2_b)和bcat1(参见表9;实施例iii)。
152.在一些实施方案中,具有选自由以下组成的组的注释的染色体区域构成dna甲基化标志物:atp10a(例如,atp10a_a、atp10a_b、atp10a_c、atp10a_d、atp10a_e)、eps8l2(例如,eps8l2_a、eps8l2_b、eps8l2_c、eps8l2_d)、c1ql3(例如,c1ql3_a、c1ql3_b)、faim2(例如,faim2_a、faim2_b)、capn2_b、lbh、cmtm3(例如,cmtm3_a、cmtm3_b)、zmiz1(例如,zmiz1_a、zmiz1_b、zmiz1_c、zmiz1_d)、gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、gp5、dscr6、ski、sim2_a、agrn_8794、bcat1_6015、kcna3_7518、kcna3_7320、loc10013136、gypc_c、src(例如,src_a、src_b)、nr2f6、tshz3、celf2(例如,celf2_a、celf2_b)、tacc2(例如,tacc2_a、tacc2_b)、vipr2(例如,vipr2_a、vipr2_b)和spock2_74333(参见表10,实施例iii)。
153.在一些实施方案中,这类方法包括确定两种dna甲基化标志物的甲基化状态。在一些实施方案中,这类方法包括确定在表1a和/或6a中提供的一对dna甲基化标志物的甲基化状态。
154.在某些实施方案中,这项技术提供了用于表征从人类患者获得的样品(例如,卵巢
组织样品;血浆样品;全血样品;血清样品;粪便样品)的方法。这类方法包括确定样品中的dna甲基化标志物的甲基化状态,所述dna甲基化标志物包含选自由表1a和6a的dmr1-560组成的组的dmr中的碱基;将来自患者样品的dna甲基化标志物的甲基化状态与来自未患卵巢癌和/或特定形式的卵巢癌(例如,透明细胞oc、子宫内膜样ec、粘液性oc、浆液性ec)的人类受试者的正常对照样品的dna甲基化标志物的甲基化状态进行比较;以及确定人类患者和正常对照样品的甲基化状态差异的置信区间和/或p值。在一些实施方案中,置信区间为90%、95%、97.5%、98%、99%、99.5%、99.9%或99.99%,并且p值为0.1、0.05、0.025、0.02、0.01、0.005、0.001或0.0001。
155.在某些实施方案中,这项技术提供了用于表征从人类受试者获得的样品(例如,卵巢组织样品;血浆样品;全血样品;血清样品;粪便样品)的方法,所述方法包括使包含dmr的核酸与能够以甲基化特异性方式修饰dna的试剂(例如,甲基化敏感性限制酶、甲基化依赖性限制酶和亚硫酸氢盐试剂)反应,以产生以甲基化特异性方式修饰的核酸;对以甲基化特异性方式修饰的核酸进行测序,以提供以甲基化特异性方式修饰的核酸的核苷酸序列;将以甲基化特异性方式修饰的核酸的核苷酸序列与来自未患卵巢癌的受试者的包含dmr的核酸的核苷酸序列进行比较,以鉴定这两个序列的差异。
156.在某些实施方案中,这项技术提供了用于表征从人类受试者获得的样品(例如,卵巢组织样品;血浆样品;粪便样品)的系统,所述系统包括:分析组件,所述分析组件被配置用于确定样品的甲基化状态;软件组件,所述软件组件被配置用于将样品的甲基化状态与数据库中记录的对照样品或参考样品甲基化状态进行比较;以及警报组件,所述警报组件被配置用于基于甲基化状态的组合确定单个值并向用户发出关于卵巢癌相关的甲基化状态的警报。在一些实施方案中,样品包含含有dmr的核酸。
157.在一些实施方案中,这类系统还包括用于分离核酸的组件。在一些实施方案中,这类系统还包括用于收集样品的组件。
158.在一些实施方案中,样品是粪便样品、组织样品、卵巢组织样品、血液样品(例如血浆样品、全血样品、血清样品)或尿液样品。
159.在一些实施方案中,数据库包含含有dmr的核酸序列。在一些实施方案中,数据库包含来自未患卵巢癌的受试者的核酸序列。
160.基于本文所含的教导内容,额外实施方法对于相关领域的技术人员来说将是显而易见的。
附图说明
161.图1:用于表1a和6a中列举的各种甲基化dna标志物的标志物染色体区域以及相关的引物和探针信息。显示的是来自pcr靶区域的天然存在的序列(wt)和亚硫酸氢盐修饰的序列(bst)。
162.定义
163.为了便于理解本发明的技术,以下定义了多个术语和短语。在整个详细描述中阐述了另外的定义。
164.在整个说明书和权利要求书中,除非上下文另外清楚规定,否则以下术语采用与本文明确相关的含义。如本文所用,短语“在一个实施方案中”不一定指相同的实施方案,尽
管其可能是这样。此外,如本文所用,短语“在另一个实施方案中”不一定指不同的实施方案,尽管其可能是这样。因此,如下所述,在不脱离本发明的范围或精神下,可以容易地组合本发明的各种实施方案。
165.另外,除非上下文另外清楚规定,否则如本文所用,术语“或”是包括性的“或”运算符并且等同于术语“和/或”。除非上下文另外清楚规定,术语“基于”不是排他性的,并且允许基于未描述的另外的因素。另外,在整个说明书中,“一(a/an)”和“所述”的含义包括复数个提及物。“在
……
中”的含义包括“在
……
中”和“在
……
上”。
166.如在本技术中的权利要求书中使用的过渡短语“基本上由
……
组成”将权利要求的范围限于所说明的材料或步骤,“以及实质上不影响所要求的发明的基本和新颖特征的那些材料或步骤”,如in re herz,537 f.2d 549,551-52,190 uspq 461,463(ccpa 1976)中所论述。举例来说,“基本上由所列举元素组成的”组合物可以含有一定水平的未列举的污染物,使得污染物尽管存在,但与纯组合物,即“由所列举组分组成”的组合物相比,不会改变所列举组合物的功能。
167.如本文所用,“核酸”或“核酸分子”一般是指任何核糖核酸或脱氧核糖核酸,其可以是未修饰的或修饰的dna或rna。“核酸”包括不限于单链和双链核酸。如本文所用,术语“核酸”还包括含有一个或多个修饰碱基的如上所述的dna。因此,具有出于稳定性或其它原因而进行修饰的主链的dna是“核酸”。如本文所用,术语“核酸”涵盖这样的化学、酶促或代谢修饰形式的核酸,以及病毒和细胞(包括例如简单和复杂细胞)特征性的dna化学形式。
168.术语“寡核苷酸”或“多核苷酸”或“核苷酸”或“核酸”是指具有两个或更多个,优选地超过三个和通常超过十个脱氧核糖核苷酸或核糖核苷酸的分子。确切的大小将取决于许多因素,而这些因素又取决于寡核苷酸的最终功能或用途。寡核苷酸可以通过任何方式产生,包括化学合成、dna复制、逆转录或它们的组合。dna的典型脱氧核糖核苷酸是胸腺嘧啶、腺嘌呤、胞嘧啶和鸟嘌呤。rna的典型核糖核苷酸是尿嘧啶、腺嘌呤、胞嘧啶和鸟嘌呤。
169.如本文所用,术语核酸的“基因座”或“区域”是指核酸的亚区域,例如染色体上的基因、单个核苷酸、cpg岛等。
170.术语“互补”和“互补性”是指通过碱基配对规则相关的核苷酸(例如1个核苷酸)或多核苷酸(例如核苷酸序列)。例如,序列5'-a-g-t-3'与序列3'-t-c-a-5'互补。互补性可以是“部分的”,其中仅一些核酸碱基根据碱基配对规则匹配。或者,核酸之间可能存在“完全”或“全部”互补。核酸链之间的互补程度影响核酸链之间杂交的效率和强度。这在依赖于核酸之间的结合的扩增反应和检测方法中特别重要。
171.术语“基因”是指包含产生rna或多肽或其前体所必需的编码序列的核酸(例如dna或rna)序列。功能性多肽可由全长编码序列或由编码序列的任何部分编码,只要保留多肽的所需活性或功能特性(例如酶活性、配体结合、信号转导等)即可。当在提及基因时使用时术语“部分”是指该基因的片段。片段的大小可以在几个核苷酸至整个基因序列减去一个核苷酸的范围内变化。因此,“包含基因至少一部分的核苷酸”可以包含基因片段或整个基因。
172.术语“基因”还涵盖结构基因的编码区,并包括在5'和3'末端与编码区相邻,例如在任一个末端相距约1kb的序列,使得基因对应于全长mrna(例如包含编码、调控、结构和其它序列)的长度。位于编码区5'并且存在于mrna上的序列称为5'非翻译或未翻译序列。位于编码区3'或下游并且存在于mrna上的序列称为3'非翻译或3'未翻译序列。术语“基因”涵盖
基因的cdna与基因组形式。在一些生物体(例如真核生物)中,基因的基因组形式或克隆含有被称为“内含子”或“插入区”或“插入序列”的非编码序列中断的编码区。内含子是转录成核rna(hnrna)的基因区段;内含子可以含有调控元件,例如增强子。内含子从核转录本或初级转录本中移出或“剪除”;因此,在信使rna(mrna)转录本中不存在内含子。mrna在翻译期间发挥作用,以指定新生多肽中氨基酸的序列或次序。
173.除含有内含子外,基因的基因组形式还可以包括位于rna转录本上存在的序列的5'和3'末端的序列。这些序列被称为“侧接”序列或区域(这些侧接序列位于mrna转录本上存在的非翻译序列的5'或3')。5'侧接区域可以含有调控序列,例如启动子和强化子,其控制或影响基因的转录。3'侧接区域可以含有指导转录终止、转录后裂解和多腺苷酸化的序列。
174.在提及基因时术语“野生型”是指具有从天然存在的来源分离的基因特征的基因。在提及基因产物时术语“野生型”是指具有从天然存在的来源分离的基因产物特征的基因产物。如应用于物体的术语“天然存在”是指可以在自然界中发现物体的事实。例如,存在于生物体(包括病毒)中的可以从自然界来源分离并且未经实验室人员有意修饰的多肽或多核苷酸序列是天然存在的。野生型基因通常是在群体中最常观察到的基因或等位基因,因此被任意指定为基因的“正常”或“野生型”形式。相比之下,在提及基因或基因产物时术语“修饰的”或“突变的”分别是指与野生型基因或基因产物相比显示序列和/或功能特性修饰(例如特征改变)的基因或基因产物。注意,可以分离天然存在的突变体;这些通过它们与野生型基因或基因产物相比特征改变的事实来鉴定。
175.术语“等位基因”是指基因的变异;所述变异包括但不限于变体和突变体、多态基因座和单核苷酸多态基因座、移码和剪接突变。等位基因可能在群体中天然存在,或者其可能在群体中任何特定个体的一生中出现。
176.因此,在提及核苷酸序列时使用时术语“变体”和“突变体”是指与另一个通常相关的核苷酸序列相差一个或多个核苷酸的核酸序列。“变异”是两个不同核苷酸序列之间的差异;典型地,一个序列是参考序列。
[0177]“扩增”是涉及模板特异性的核酸复制的特定情况。其与非特异性模板复制(例如依赖用模板但不依赖于特定模板的复制)形成对比。在这里模板特异性不同于复制保真度(例如合成适当多核苷酸序列)和核苷酸(核糖或脱氧核糖)特异性。模板特异性常根据“靶标”特异性来描述。在设法从其它核酸中分选出来的意义上,靶序列是“靶标”。扩增技术主要是为这种分选而设计的。
[0178]
在核酸背景下术语“扩增(amplifying或amplification)”是指典型地从少量多核苷酸(例如单个多核苷酸分子)开始,产生多拷贝的多核苷酸或多核苷酸的一部分,其中扩增产物或扩增子一般是可检测的。多核苷酸的扩增涵盖多种化学和酶促过程。在聚合酶链式反应(pcr)或连接酶链式反应(lcr;参见例如美国专利no.5,494,810;以引用的方式整体并入本文中)期间从靶标或模板dna分子的一个或几个拷贝产生多个dna拷贝是扩增的形式。另外类型的扩增包括(但不限于)等位基因特异性pcr(参见例如美国专利no.5,639,611;以引用的方式整体并入本文中)、装配pcr(参见例如美国专利no.5,965,408;以引用的方式整体并入本文中)、解旋酶依赖性扩增(参见例如美国专利no.7,662,594;以引用的方式整体并入本文中)、热启动pcr(参见例如美国专利no.5,773,258和5,338,671;各以引用
的方式整体并入本文中)、序列间特异性pcr、反向pcr(参见例如triglia等人(1988)nucleic acids res.,16:8186;以引用的方式整体并入本文中)、连接介导的pcr(参见例如guilfoyle,r.等人,nucleic acids research,25:1854-1858(1997);美国专利no.5,508,169;各以引用的方式整体并入本文中)、甲基化特异性pcr(参见例如herman等人,(1996)pnas 93(13)9821-9826;以引用的方式整体并入本文中)、微型引物pcr、多重连接依赖性探针扩增(参见例如schouten等人,(2002)nucleic acids research 30(12):e57;以引用的方式整体并入本文中)、多重pcr(参见例如chamberlain等人,(1988)nucleic acids research 16(23)11141-11156;ballabio等人,(1990)human genetics 84(6)571-573;hayden等人,(2008)bmc genetics 9:80;各以引用的方式整体并入本文中)、巢式pcr、重叠延伸pcr(参见例如higuchi等人,(1988)nucleic acids research 16(15)7351-7367;以引用的方式整体并入本文中)、实时pcr(参见例如higuchi等人,(1992)biotechnology 10:413-417;higuchi等人,(1993)biotechnology 11:1026-1030;各以引用的方式整体并入本文中)、逆转录pcr(参见例如bustin,s.a.(2000)j.molecular endocrinology 25:169-193;以引用的方式整体并入本文中)、固相pcr、热不对称交错pcr和降落pcr(参见例如don等人,nucleic acids research(1991)19(14)4008;roux,k.(1994)biotechniques 16(5)812-814;hecker等人,(1996)biotechniques 20(3)478-485;各以引用的方式整体并入本文中)。多核苷酸扩增也可以使用数字pcr来完成(参见例如kalinina等人,nucleic acids research.25;1999-2004,(1997);vogelstein和kinzler,proc natl acad sci usa.96;9236-41,(1999);国际专利公布no.wo05023091a2;美国专利申请公布no.20070202525;各以引用的方式整体并入本文中)。
[0179]
术语“聚合酶链式反应”(“pcr”)是指k.b.mullis的美国专利no.4,683,195、4,683,202和4,965,188的方法,其描述了一种增加基因组或其它dna或rna的混合物中的靶序列区段的浓度的方法,不进行克隆或纯化。这种扩增靶序列的过程由以下组成:将大量过量的两种寡核苷酸引物引入含有所需靶序列的dna混合物中,接着在dna聚合酶存在下进行精确的热循环序列。两种引物与它们各自的双链靶序列的链互补。为了实现扩增,使混合物变性,然后使引物与它们在靶分子内的互补序列退火。在退火之后,将引物用聚合酶延伸以便形成一对新的互补链。变性、引物退火和聚合酶延伸的步骤可以重复多次(即,变性、退火和延伸构成一个“循环”;可以存在多个“循环”)以获得高浓度的所需靶序列的扩增区段。所需靶序列的扩增区段的长度由引物彼此之间的相对位置决定,因此,该长度是一个可控参数。由于所述过程的重复方面,所述方法称为“聚合酶链式反应”(“pcr”)。因为靶序列的所需扩增区段变成混合物中的主要序列(根据浓度),所以它们被称为“pcr扩增”并且是“pcr产物”或“扩增子”。本领域的技术人员将理解,术语“pcr”涵盖使用例如实时pcr、巢式pcr、逆转录pcr(rt-pcr)、单引物和随机引物pcr等最初描述的方法的许多变体。
[0180]
大部分扩增技术是通过选择酶来实现模板特异性的。扩增酶是在使用它们的条件下将仅加工核酸的异质混合物中的特定核酸序列的酶。例如,在q-β复制酶的情况下,mdv-1rna是复制酶的特定模板(kacian等人,proc.natl.acad.sci.usa,69:3038[1972])。其它核酸不会被这种扩增酶复制。类似地,在t7 rna聚合酶的情况下,这种扩增酶对其自身的启动子具有严格的特异性(chamberlin等人,nature,228:227[1970])。在t4 dna连接酶的情况下,酶不会连接两种寡核苷酸或多核苷酸,其中寡核苷酸或多核苷酸底物与模板之间在
连接点处存在错配(wu和wallace(1989)genomics 4:560)。最终,发现依赖于热稳定模板的dna聚合酶(例如taq和pfu dna聚合酶)由于它们能够在高温下发挥作用,而对由引物限制并因此由引物界定的序列显示高特异性;高温产生有利于引物与靶序列杂交而不利于与非靶序列杂交的热力学条件(h.a.erlich(编辑),pcr technology,stockton press[1989])。
[0181]
如本文所用,术语“核酸检测测定”是指测定感兴趣核酸的核苷酸组成的任何方法。核酸检测测定包括但不限于dna测序法、探针杂交法、结构特异性裂解测定(例如invader测定(hologic公司),并描述于例如美国专利no.5,846,717、5,985,557、5,994,069、6,001,567、6,090,543和6,872,816;lyamichev等人,nat.biotech.,17:292(1999);hall等人,pnas,usa,97:8272(2000)和美国专利no.9,096,893,各以引用的方式整体并入本文中以达成所有目的);酶错配裂解法(例如variagenics,美国专利no.6,110,684、5,958,692、5,851,770,以引用的方式整体并入本文中);上述聚合酶链式反应(pcr);分支杂交法(例如chiron,美国专利no.5,849,481、5,710,264、5,124,246和5,624,802,以引用的方式整体并入本文中);滚环复制(例如美国专利no.6,210,884、6,183,960和6,235,502,以引用的方式整体并入本文中);nasba(例如美国专利no.5,409,818,以引用的方式整体并入本文中);分子信标技术(例如美国专利no.6,150,097,以引用的方式整体并入本文中);电子传感器技术(motorola,美国专利no.6,248,229、6,221,583、6,013,170和6,063,573,以引用的方式整体并入本文中);循环探针技术(例如美国专利no.5,403,711、5,011,769和5,660,988,以引用的方式整体并入本文中);dade behring信号放大法(例如美国专利no.6,121,001、6,110,677、5,914,230、5,882,867和5,792,614,以引用的方式整体并入本文中);连接酶链式反应(例如baranay proc.natl.acad.sci usa 88,189-93(1991));和夹心杂交法(例如美国专利no.5,288,609,以引用的方式整体并入本文中)。
[0182]
术语“可扩增核酸”是指可以通过任何扩增方法扩增的核酸。预期“可扩增核酸”通常包含“样品模板”。
[0183]
术语“样品模板”是指源自针对“靶标”(定义如下)的存在进行分析的样品的核酸。相反,“背景模板”用于指代样品中可能存在或不存在的除样品模板以外的核酸。背景模板通常是无意的。它可能是交叉污染的结果,或者可能是由于存在试图从样品中净化掉的核酸污染物。例如,来自生物体的除待检测核酸之外的核酸可能作为测试样品中的背景存在。
[0184]
术语“引物”是指当置于诱导与核酸模板链互补的引物延伸产物合成的条件下(例如在核苷酸和诱导剂如dna聚合酶存在下以及在合适温度和ph值下)时能够充当合成起始点的寡核苷酸,无论天然存在,如例如来自限制消化液的核酸片段,还是合成产生。引物优选是单链的,以获得最大的扩增效率,但也可以是双链的。如果是双链,那么引物在用于制备延伸产物之前首先进行处理以分离其链。优选地,引物是寡脱氧核糖核苷酸。引物必须足够长以在诱导剂存在下引发延伸产物的合成。引物的确切长度取决于许多因素,包括温度、引物来源和方法的使用。
[0185]
术语“探针”是指能够与另一感兴趣寡核苷酸杂交的寡核苷酸(例如核苷酸序列),无论天然存在,如纯化的限制消化液中,还是合成、重组或通过pcr扩增产生。探针可以是单链或双链的。探针可用于检测、鉴定和分离特定基因序列(例如,“捕获探针”)。预期本发明中使用的任何探针在一些实施方案中都可以用任何“报告分子”标记,以便在任何检测系统中可检测,包括但不限于酶(例如,elisa,以及基于酶的组织化学分析)、荧光、放射性和发
光系统。并不意图将本发明限于任何特定的检测系统或标记。
[0186]
如本文所用,术语“靶标”是指设法例如通过探针结合、扩增、分离、捕获等从其它核酸中分选出的核酸。例如,当用于聚合酶链式反应时,“靶标”是指由用于聚合酶链式反应的引物结合的核酸区域,而当用于不扩增靶dna的测定时,例如在侵入性裂解测定的一些实施方案中,靶标包括探针和侵入性寡核苷酸(例如,invader寡核苷酸)结合形成侵入性裂解结构的位点,以便可以检测到靶核酸的存在。“区段”定义为靶序列内的核酸区域。
[0187]
如本文所用,“甲基化”是指胞嘧啶的c5或n4位置的胞嘧啶甲基化、腺嘌呤的n6位置或其它类型的核酸甲基化。体外扩增的dna通常未甲基化,因为典型的体外dna扩增方法不会保留扩增模板的甲基化模式。然而,“未甲基化的dna”或“甲基化的dna”也可以分别指原始模板未甲基化或甲基化的扩增dna。
[0188]
因此,如本文所用,“甲基化核苷酸”或“甲基化核苷酸碱基”是指核苷酸碱基上存在甲基部分,其中甲基部分不存在于公认的典型核苷酸碱基中。例如,胞嘧啶在其嘧啶环上不含甲基部分,但5-甲基胞嘧啶在其嘧啶环的5位含有甲基部分。因此,胞嘧啶不是甲基化核苷酸,5-甲基胞嘧啶是甲基化核苷酸。在另一个实例中,胸腺嘧啶在其嘧啶环的5位含有甲基部分;然而,就本文而言,当存在于dna中时,胸腺嘧啶不被视为甲基化核苷酸,因为胸腺嘧啶是dna的典型核苷酸碱基。
[0189]
如本文所用,“甲基化核酸分子”是指含有一个或多个甲基化核苷酸的核酸分子。
[0190]
如本文所用,核酸分子的“甲基化状态”、“甲基化概况”和“甲基化状况”是指核酸分子中一个或多个甲基化核苷酸碱基的存在或不存在。例如,含有甲基化胞嘧啶的核酸分子被认为是甲基化的(例如,核酸分子的甲基化状态是甲基化的)。不含任何甲基化核苷酸的核酸分子被认为是未甲基化的。
[0191]
特定核酸序列(例如,如本文所述的基因标志物或dna区域)的甲基化状态可以指示序列中每个碱基的甲基化状态,或者可以指示序列内碱基子集(例如,一个或多个胞嘧啶)的甲基化状态,或者可以指示关于序列内区域甲基化密度的信息,提供或不提供序列内发生甲基化的位置的精确信息。
[0192]
核酸分子中核苷酸基因座的甲基化状态是指核酸分子中特定基因座处甲基化核苷酸的存在或不存在。例如,当核酸分子中第7个核苷酸处存在的核苷酸为5-甲基胞嘧啶时,核酸分子中第7个核苷酸处胞嘧啶的甲基化状态是甲基化的。类似地,当核酸分子中第7个核苷酸处存在的核苷酸为胞嘧啶(而非5-甲基胞嘧啶)时,核酸分子中第7个核苷酸处胞嘧啶的甲基化状态是未甲基化的。
[0193]
甲基化状况可以任选地由“甲基化值”(例如,代表甲基化频率、分数、比率、百分比等)表示或指示。例如,可以通过量化在用甲基化依赖性限制酶进行限制性消化后完整核酸的量,或通过比较亚硫酸氢盐反应后的扩增概况,或通过比较经过亚硫酸氢盐处理和未处理的核酸的序列来产生甲基化值。因此,值,例如甲基化值,代表甲基化状况并且因此可以用作跨基因座的多个拷贝的甲基化状况的定量指标。当需要将样品中序列的甲基化状况与阈值或参考值进行比较时,这特别有用。
[0194]
如本文所用,“甲基化频率”或“甲基化百分比(%)”是指分子或基因座被甲基化的实例数相对于分子或基因座未甲基化的实例数。
[0195]
因此,甲基化状态描述了核酸(例如,基因组序列)的甲基化状态。此外,甲基化状
态是指与甲基化相关的特定基因组基因座处的核酸区段的特征。这类特征包括但不限于,该dna序列中的任何胞嘧啶(c)残基是否被甲基化、甲基化c残基的位置、甲基化c在核酸任何特定区域中的频率或百分比,以及由于例如等位基因来源的差异而导致的甲基化的等位基因差异。术语“甲基化状态”、“甲基化概况”和“甲基化状况”还指生物样品中核酸的任何特定区域中甲基化c或未甲基化c的相对浓度、绝对浓度或模式。例如,如果核酸序列内的胞嘧啶(c)残基被甲基化,那么可以将其称为“高甲基化”或“甲基化增加”,而如果dna序列内的胞嘧啶(c)残基未甲基化,那么可以将其称为“低甲基化”或“甲基化降低”。同样,如果与另一核酸序列(例如,来自不同区域或来自不同个体等)相比,核酸序列内的胞嘧啶(c)残基被甲基化,那么认为该序列与其它核酸序列相比是高甲基化的或甲基化增加。可替代地,如果与另一核酸序列(例如,来自不同区域或来自不同个体等)相比,dna序列内的胞嘧啶(c)残基未被甲基化,那么认为该序列与其它核酸序列相比是低甲基化的或甲基化降低。此外,如本文所用的术语“甲基化模式”是指核酸区域上甲基化和未甲基化核苷酸的集合位点。当整个区域中甲基化和未甲基化核苷酸的数量相同或相似但甲基化和未甲基化核苷酸的位置不同时,两个核酸可能具有相同或相似的甲基化频率或甲基化百分比但具有不同的甲基化模式。当序列的甲基化程度(例如一个的甲基化相对于另一个增加或减少)、频率或模式时有差异时,称其为“差异甲基化”或具有“甲基化差异”或具有“不同甲基化状态”。术语“差异甲基化”是指与癌症阴性样品中的核酸甲基化水平或模式相比,癌症阳性样品中的核酸甲基化水平或模式的差异。它还可能指手术后癌症复发的患者与未复发的患者之间水平或模式的差异。差异甲基化和dna甲基化的特定水平或模式是预后和预测性生物标志物,例如,一旦确定了正确的截止或预测特征。
[0196]
甲基化状态频率可以用于描述个体群体或来自单一个体的样品。例如,甲基化状态频率为50%的核苷酸基因座在50%的情况下被甲基化,在50%的情况下未甲基化。例如,这种频率可以用于描述个体群体或一批核酸中核苷酸基因座或核酸区域被甲基化的程度。因此,当核酸分子的第一个群体或库中的甲基化不同于核酸分子的第二个群体或库中的甲基化时,第一个群体或库的甲基化状态频率将不同于第二个群体或库的甲基化状态频率。例如,这种频率还可以用于描述单一个体中核苷酸基因座或核酸区域被甲基化的程度。例如,这种频率可以用于描述来自组织样品的一组细胞在核苷酸基因座或核酸区域被甲基化或未甲基化的程度。
[0197]
如本文所用,“核苷酸基因座”是指核苷酸在核酸分子中的位置。甲基化核苷酸的核苷酸基因座是指甲基化核苷酸在核酸分子中的位置。
[0198]
典型地,人类dna的甲基化发生在包括相邻鸟嘌呤和胞嘧啶的二核苷酸序列上,其中胞嘧啶位于鸟嘌呤的5'(也称为cpg二核苷酸序列)。cpg二核苷酸内的大多数胞嘧啶在人类基因组中被甲基化,但是一些在特定的富含cpg二核苷酸的基因组区域(称为cpg岛)中保持未甲基化(参见例如antequera等人(1990)cell 62:503-514)。
[0199]
如本文所用,“cpg岛”是指基因组dna的富含g:c的区域,其含有相对于总基因组dna数量增加的cpg二核苷酸。cpg岛的长度可以是至少100、200或更多个碱基对,其中该区域的g:c含量至少为50%,并且观察cpg频率与预期频率的比率为0.6;在某些情况下,cpg岛的长度可以为至少500个碱基对,其中该区域的g:c含量至少为55%并且观察cpg频率与预期频率的比率为0.65。可以根据gardiner-garden等人(1987)j.mol.biol.196:261-281中
提供的方法计算相比于预期频率的观察cpg频率。例如,相比于预期频率的观察cpg频率可以根据公式r=(a
×
b)/(c
×
d)计算,其中r是观察cpg频率与预期频率的比值,a是分析序列中的cpg二核苷酸的数量,b是分析序列中的核苷酸总数,c是分析序列中的c核苷酸总数,d是分析序列中的g核苷酸总数。典型地在cpg岛中,例如在启动子区域确定甲基化状态。应了解尽管人类基因组中的其它序列易于发生dna甲基化,例如cpa和cpt(参见ramsahoye(2000)proc.natl.acad.sci.usa 97:5237-5242;salmon和kaye(1970)biochim.biophys.acta.204:340-351;grafstrom(1985)nucleic acids res.13:2827-2842;nyce(1986)nucleic acids res.14:4353-4367;woodcock(1987)biochem.biophys.res.commun.145:888-894)。
[0200]
如本文所用,“甲基化特异性试剂”是指根据核酸分子的甲基化状态修饰核酸分子的核苷酸的试剂,或甲基化特异性试剂是指能够以反映核酸分子的甲基化状态的方式改变核酸分子的核苷酸序列的化合物或组合物或其它剂。用这种试剂处理核酸分子的方法可以包括使核酸分子与试剂接触,如果需要,再加上额外的步骤,以实现核苷酸序列的所需改变。这类方法可以以将未甲基化的核苷酸(例如,每个未甲基化的胞嘧啶)修饰成不同核苷酸的方式应用。例如,在一些实施方案中,这种试剂可以使未甲基化的胞嘧啶核苷酸脱氨基,产生脱氧尿嘧啶残基。这种试剂的实例包括但不限于甲基化敏感性限制酶、甲基化依赖性限制酶和亚硫酸氢盐试剂。
[0201]
甲基化特异性试剂对核酸核苷酸序列的改变也可能产生每个甲基化核苷酸被修饰为不同的核苷酸的核酸分子。
[0202]
术语“甲基化测定”是指用于确定核酸序列内的一个或多个cpg二核苷酸序列的甲基化状态的任何测定。
[0203]
术语“ms ap-pcr”(甲基化敏感性随机引物聚合酶链式反应)是指本领域公认的技术,这项技术允许使用富含cg的引物对基因组进行全局扫描,重点关注最有可能含有cpg二核苷酸的区域,并由gonzalgo等人(1997)cancer research 57:594-599描述。
[0204]
术语“methylight
tm”是指eads等人(1999)cancer res.59:2302-2306描述的本领域公认的基于荧光的实时pcr技术。
[0205]
术语“heavymethyl
tm”是指一种测定,其中覆盖扩增引物之间的cpg位置或被扩增引物覆盖的甲基化特异性阻断探针(本文也称为阻断剂)能够实现核酸样品的甲基化特异性选择性扩增。
[0206]
术语“heavymethyl
tm methylight
tm”测定是指heavymethyl
tm methylight
tm
测定,它是methylight
tm
测定的变体,其中methylight
tm
测定与覆盖扩增引物之间的cpg位置的甲基化特异性阻断探针组合。
[0207]
术语“ms-snupe”(甲基化敏感性单核苷酸引物延伸)是指由gonzalgo和jones(1997)nucleic acids res.25:2529-2531描述的本领域公认的测定。
[0208]
术语“msp”(甲基化特异性pcr)是指由herman等人(1996)proc.natl.acad.sci.usa 93:9821-9826和由美国专利no.5,786,146描述的本领域公认的甲基化测定。
[0209]
术语“cobra”(联合亚硫酸氢盐限制分析)是指由xiong和laird(1997)nucleic acids res.25:2532-2534描述的本领域公认的甲基化测定。
[0210]
术语“mca”(甲基化cpg岛扩增)是指由toyota等人(1999)cancer res.59:2307-12和wo 00/26401a1中描述的甲基化测定。
[0211]
如本文所用,“选定核苷酸”是指核酸分子中四种典型存在的核苷酸中的一种核苷酸(dna为c、g、t和a,rna为c、g、u和a),并且可以包括典型存在的核苷酸的甲基化衍生物(例如,当c是选定核苷酸时,甲基化和未甲基化的c都包括在选定核苷酸的含义内),而甲基化的选定核苷酸特指甲基化的典型存在的核苷酸并且未甲基化的选定核苷酸特指未甲基化的典型存在的核苷酸。
[0212]
术语“甲基化特异性限制酶”是指根据核酸识别位点的甲基化状态选择性消化核酸的限制酶。在识别位点未甲基化或半甲基化下特异性切割的限制酶的情况下(甲基化敏感性酶),如果在一条或两条链上识别位点甲基化,那么切割不会发生。在只有识别位点甲基化时才特异性切割的限制酶的情况下(甲基化依赖性酶),如果识别位点未甲基化,那么切割不会发生(或会发生,但效率显著降低)。优选的是甲基化特异性限制酶,其识别序列含有cg二核苷酸(例如识别序列如cgcg或cccggg)。对于一些实施方案进一步优选的是如果该二核苷酸中的胞嘧啶在碳原子c5处被甲基化则不会切割的限制酶。
[0213]
如本文所用,“不同核苷酸”是指化学上与选定核苷酸不同的核苷酸,通常使得不同核苷酸具有不同于选定核苷酸的沃森-克里克碱基配对(watson-crick base-pairing)特性,其中与选定核苷酸互补的典型存在的核苷酸不同于与不同核苷酸互补的典型存在的核苷酸。例如,当c是选定核苷酸时,u或t可以是不同核苷酸,例如c与g的互补性和u或t与a的互补性。如本文所用,与选定核苷酸互补或与不同核苷酸互补的核苷酸是指在高严格条件下以比互补核苷酸与四种典型存在的核苷酸中的三种进行碱基配对高的亲和力与选定核苷酸或不同核苷酸进行碱基配对的核苷酸。互补性的一个实例是dna(例如a-t和c-g)和rna(例如a-u和c-g)中的沃森-克里克碱基配对。因此,例如,在高严格条件下,g与c碱基配对的亲和力高于g与g、a或t碱基配对,因此,当c是选定核苷酸时,g是与选定核苷酸互补的核苷酸。
[0214]
如本文所用,给定标志物(或一起使用的标志物组)的“灵敏度”是指报告dna甲基化值高于区分赘生物与非赘生物样品的阈值的样品的百分比。在一些实施方案中,阳性定义为报告dna甲基化值高于阈值(例如,与疾病相关的范围)的组织学确认的瘤形成,并且假阴性定义为报告dna甲基化值低于阈值(例如,与无疾病相关的范围)的组织学确认的瘤形成。因此,灵敏度值反映了从已知患病样品获得的给定标志物的dna甲基化测量值在疾病相关测量值范围内的概率。如这里所定义,计算出的灵敏度值的临床相关性表示对当将给定标志物应用于患有临床疾患的受试者时将检测到该疾患存在的概率的估计。
[0215]
如本文所用,给定标志物(或一起使用的标志物组)的“特异性”是指报告dna甲基化值高于区分赘生物与非赘生物样品的阈值的非赘生物样品的百分比。在一些实施方案中,阴性定义为报告dna甲基化值低于阈值(例如,与无疾病相关的范围)的组织学确认的非赘生物样品,并且假阳性定义为报告dna甲基化值高于阈值(例如,与疾病相关的范围)的组织学确认的非赘生物样品。因此,特异性值反映了从已知非赘生物样品获得的给定标志物的dna甲基化测量值在非疾病相关测量值范围内的概率。如这里所定义,计算出的特异性值的临床相关性表示对当将给定标志物应用于未患临床疾患的受试者时将检测到该疾患不存在的概率的估计。
[0216]
如本文所用,术语“auc”是“曲线下面积”的缩写。其尤其是指接受者操作特征(roc)曲线下面积。roc曲线是针对诊断测试的不同可能切点的真阳性率与假阳性率的关系图。它显示了取决于所选切点的灵敏度与特异性之间的平衡(灵敏度的任何增加都将伴随着特异性的降低)。roc曲线下面积(auc)是衡量诊断测试准确性的量度(面积越大越好;最佳值为1;随机测试的roc曲线位于对角线上,面积为0.5;参考:j.p.egan.(1975)signal detection theory and roc analysis,academic press,new york)。
[0217]
如本文所用,术语“赘生物”是指组织的任何新的异常生长。因此,赘生物可以是癌前赘生物或恶性赘生物。
[0218]
如本文所用,术语“赘生物特异性标志物”是指可用于指示赘生物存在的任何生物物质或要素。生物物质的实例包括但不限于核酸、多肽、碳水化合物、脂肪酸、细胞成分(例如细胞膜和线粒体)和全细胞。在一些情况下,标志物是特定核酸区域(例如,基因、基因内区域、特定基因座等)。作为标志物的核酸区域可称为例如“标志基因”、“标志物区域”、“标志序列”、“标志基因座”等。
[0219]
如本文所用,术语“腺瘤”是指腺来源的良性肿瘤。虽然这些生长是良性的,但随着时间的推移,它们可能会发展为恶性。
[0220]
术语“癌前”或“赘生物前”和其等同术语是指任何正在发生恶性转化的细胞增殖性疾病。
[0221]
赘生物、腺瘤、癌症等的“部位”是受试者体内赘生物、腺瘤、癌症等所在的组织、器官、细胞类型、解剖区域、身体部位等。
[0222]
如本文所用,“诊断”测试应用包括检测或鉴定受试者的疾病状态或疾患,确定受试者感染给定疾病或疾患的可能性,确定患有疾病或疾患的受试者将对疗法作出反应的可能性,确定患有疾病或疾患的受试者的预后(或其可能的进展或消退),以及确定治疗对患有疾病或疾患的受试者的影响。例如,诊断可用于检测受试者感染赘生物的存在或可能性,或这类受试者将对化合物(例如药品,例如药物)或其它治疗产生有利反应的可能性。
[0223]
术语“分离的”如在“分离的寡核苷酸”中当与核酸相关使用时是指从至少一种在天然来源中通常相关联的污染核酸中鉴定并分离的核酸序列。分离的核酸以不同于在自然界中发现的形式或设置存在。相比之下,未分离的核酸,如dna和rna,在它们存在于自然界中的状态下被发现。未分离的核酸的实例包括:在宿主细胞染色体上与邻近基因相邻的给定dna序列(例如,基因);rna序列,例如编码特定蛋白质的特定mrna序列,在细胞中发现其呈与许多其它编码多种蛋白质的mrna的混合物。然而,编码特定蛋白质的分离的核酸包括例如在通常表达蛋白质的细胞中的这种核酸,其中该核酸在与天然细胞不同的染色体位置中,或者另外由不同于自然界中发现的核酸侧接。分离的核酸或寡核苷酸可以单链或双链形式存在。当分离的核酸或寡核苷酸用于表达蛋白质时,该寡核苷酸将至少包含有义链或编码链(即寡核苷酸可以是单链的),但可以同时含有有义链和反义链(即,寡核苷酸可以是双链的)。分离的核酸在从其天然或典型环境分离后,可以与其它核酸或分子组合。例如,分离的核酸可以存在于宿主细胞中,在该宿主细胞中放置该核酸,例如用于异源表达。
[0224]
术语“纯化的”是指从其天然环境中移出、分离或分离出的分子,核酸或氨基酸序列。因此,“分离的核酸序列”可以是纯化的核酸序列。“基本上纯化的”分子至少60%不含,优选至少75%不含,更优选至少90%不含与它们天然相关的其它组分。如本文所用,术语“纯化的”或“进行纯化”还指从样品中去除污染物。污染蛋白质的去除引起样品中感兴趣的多肽或核酸的百分比增加。在另一个实例中,重组多肽在植物、细菌、酵母或哺乳动物宿主细胞中表达,并且通过去除宿主细胞蛋白质来纯化多肽;从而增加了样品中重组多肽的百分比。
[0225]
术语“包含”给定多核苷酸序列或多肽的“组合物”泛指含有给定多核苷酸序列或多肽的任何组合物。该组合物可包含含有盐(例如nacl)、去污剂(例如sds)和其它组分(例如登哈特溶液(denhardt’ssolution)、奶粉、鲑鱼精dna等)的水溶液。
[0226]
术语“样品”以其最广泛的含义使用。在某种意义上,它可以指动物细胞或组织。在另一种意义上,它是指从任何来源获得的样本或培养物,以及生物和环境样品。生物样品可以从植物或动物(包括人类)获得,并且涵盖流体、固体、组织和气体。环境样品包括环境材料,例如表面物质、土壤、水和工业样品。这些实例不应被解释为限制适用于本发明的样品类型。
[0227]
如本文所用,在一些情况下使用的“远程样品”涉及从不是样品的细胞、组织或器官来源的部位间接收集的样品。例如,当在粪便样品中评估源自胰腺的样品材料时(例如,不是来自直接取自卵巢的样品),该样品是远程样品。
[0228]
如本文所用,术语“患者”或“受试者”是指要经受这项技术提供的各种测试的生物体。术语“受试者”包括动物,优选哺乳动物,包括人。在一个优选的实施方案中,受试者是灵长类动物。在一个更优选的实施方案中,受试者是人。进一步关于诊断方法,优选的受试者是脊椎动物受试者。优选的脊椎动物是温血动物;优选的温血脊椎动物是哺乳动物。优选的哺乳动物最优选是人。如本文所用,术语“受试者”包括人和动物受试者。因此,本文提供了兽医治疗用途。因此,本发明的技术提供了对哺乳动物(例如人类)以及以下动物的诊断:那些因濒危而重要的哺乳动物(例如东北虎);具有经济重要性的动物,例如在农场饲养供人类食用的动物;和/或对人类具有社会重要性的动物,例如作为宠物或在动物园饲养的动物。这种动物的实例包括但不限于:食肉动物,例如猫和狗;猪科动物,包括猪、肉猪和野猪;反刍动物和/或有蹄类动物,如牛、公牛、绵羊、长颈鹿、鹿、山羊、野牛和骆驼;鳍足类动物;和马。因此,还提供了家畜的诊断和治疗,包括但不限于家养猪、反刍动物、有蹄类动物、马(包括赛马)等。当前公开的主题还包括用于诊断受试者的肺癌的系统。例如,该系统可作为市售试剂盒提供,该试剂盒可用于筛查已收集生物样品的受试者患肺癌的风险或诊断其患肺癌。根据本发明的技术提供的示例性系统包括评估本文所述的标志物的甲基化状态。
[0229]
如本文所用,术语“试剂盒”是指递送材料的任何递送系统。在反应测定的情况下,这类递送系统包括允许存储反应试剂(例如适当容器中的寡核苷酸、酶等)和/或支持材料(例如,缓冲液、关于进行测定的书面说明书等)、将其从一个位置运输或递送至另一个位置的系统。例如,试剂盒包括含有相关反应试剂和/或支持材料的一个或多个外壳(例如,盒)。如本文使用,术语“零散试剂盒”是指包括两个或更多个单独容器的递送系统,每个容器含有全部试剂盒组分的子部分。这些容器可共同或单独递送至预定接受者。例如,第一个容器可含有用于测定中的酶,而第二个容器含有寡核苷酸。术语“零散试剂盒”意图涵盖含有受联邦食品、药品和化妆品法案第520(e)节监管的分析物特定试剂(asr)的试剂盒,但不限于此。事实上,包含各自含有全部试剂盒组分的子部分的两个或更多个单独容器的任何递送系统均包括在术语“零散试剂盒”中。相比之下,“组合试剂盒”是指在单一容器中(例如,容
560,参见表1a和6a)的标志物,所述标志物用于诊断(例如筛查)卵巢癌和各种卵巢癌类型(例如,透明细胞oc、子宫内膜样oc、粘液性oc、浆液性oc)。
[0237]
除了分析包含本文所提供和表1a和6a中所列出的dmr(例如dmr,例如dmr 1-560)的至少一种标志物、标志物区域或标志物的碱基的甲基化分析的实施方案以外,这项技术还提供了包含含有dmr的至少一种标志物、标志物区域或标志物的碱基的标志物组,用于检测癌症、尤其是卵巢癌。
[0238]
这项技术的的一些实施方案是基于对包含dmr的至少一种标志物、标志物区域或标志物的碱基的cpg甲基化状况的分析。
[0239]
在一些实施方案中,本发明的技术提供了以甲基化特异性方式修饰dna的试剂(例如甲基化敏感性限制酶、甲基化依赖性限制酶和亚硫酸氢盐试剂)的用途,所述试剂与一种或多种甲基化测定组合,用于确定包含dmr(例如dmr 1-560,参见表1a和6a)的至少一种标志物内的cpg二核苷酸序列的甲基化状况。基因组cpg二核苷酸可以是甲基化或未甲基化的(可替代地分别称为高甲基化和低甲基化)。然而,本发明的方法适合于分析非均质性的生物样品,例如在偏远样品(例如血液、器官流出物或粪便)的背景内的低浓度的肿瘤细胞或从中获得的生物材料。因此,当分析这类样品内cpg位置的甲基化状况时,可使用定量测定来确定具体cpg位置的甲基化水平(例如百分比、分数、比率、比例或程度)。
[0240]
根据本发明的技术,对包含dmr的标志物中cpg二核苷酸序列的甲基化状况的确定可用于诊断和表征例如卵巢癌的癌症。
[0241]
标志物的组合
[0242]
在一些实施方案中,这项技术涉及评估包含来自表1a和6a的dmr(例如dmr编号1-560)的标志物的组合的甲基化状态。在一些实施方案中,评估超过一种标志物的甲基化状态增加用于鉴定受试者中的赘生物(例如卵巢癌)的筛查或诊断法的特异性和/或灵敏度。
[0243]
利用例如如通过与预测特异性和灵敏度有关的统计技术鉴定的标志物的多种组合预测多种癌症。这项技术提供了鉴定一些癌症的预测组合和验证预测组合的方法。
[0244]
测定甲基化状态的方法
[0245]
在某些实施方案中,用于分析核酸中5-甲基胞嘧啶的存在的方法涉及用以甲基化特异性方式修饰dna的试剂处理dna。这种试剂的实例包括(但不限于)甲基化敏感性限制酶、甲基化依赖性限制酶和亚硫酸氢盐试剂。
[0246]
常用于分析核酸中5-甲基胞嘧啶的存在的方法是基于frommer等人描述的用于检测dna中的5-甲基胞嘧啶的亚硫酸氢盐方法(frommer等人(1992)proc.natl.acad.sci.usa 89:1827-31,明确地以引用的方式整体并入本文中以达成所有目的)或其变体。定位5-甲基胞嘧啶的亚硫酸氢盐方法是基于如下观测结果:胞嘧啶与亚硫酸氢盐离子(又名亚硫酸氢盐)反应,而5-甲基胞嘧啶不反应。反应通常根据以下步骤进行:首先,胞嘧啶与亚硫酸氢盐反应,形成磺化胞嘧啶。然后,磺化的反应中间体自发脱氨基,产生磺化尿嘧啶。最终,磺化尿嘧啶在碱性条件下脱磺酸,形成尿嘧啶。检测是可能的原因在于尿嘧啶碱基与腺嘌呤配对(因此,行为如胸腺嘧啶一样),而5-甲基胞嘧啶碱基与鸟嘌呤配对(因此,行为如胞嘧啶一样)。这使得通过例如以下区分甲基化胞嘧啶与非甲基化胞嘧啶成为可能:亚硫酸氢盐基因组测序(grigg g和clark s,bioessays(1994)16:431-36;grigg g,dna seq.(1996)6:189-98)、如例如美国专利no.5,786,146中公开的甲基化特异性pcr(msp)或使用包含序列
特异性探针裂解的测定,例如quarts瓣状核酸内切酶测定(参见例如zou等人(2010)“sensitive quantification of methylated markers with a novel methylation specific technology”clin chem 56:a199;以及美国专利no.8,361,720;8,715,937;8,916,344;和9,212,392。
[0247]
一些常规技术涉及如下方法,所述方法包括将待分析的dna封装在琼脂糖基质中,从而防止dna的扩散和复性(亚硫酸氢盐仅与单链dna反应),并用快速透析代替沉淀和纯化步骤(olek a等人,(1996)“amodified and improved method for bisulfite based cytosine methylation analysis”nucleic acids res.24:5064-6)。因此可以分析单个细胞的甲基化状况,这说明了该方法的实用性和灵敏度。rein,t.等人,(1998)nucleic acids res.26:2255概述了检测5-甲基胞嘧啶的常规方法。
[0248]
亚硫酸氢盐技术典型地包括在亚硫酸氢盐处理后扩增已知核酸的短的特定片段,然后通过测序(olek和walter(1997)nat.genet.17:275-6)或引物延伸反应(gonzalgo和jones(1997)nucleic acids res.25:2529-31;wo 95/00669;美国专利no.6,251,594)分析产物以分析单个胞嘧啶位置。一些方法使用酶消化(xiong和laird(1997)nucleic acids res.25:2532-4)。本领域也描述了通过杂交进行的检测(olek等人,wo 99/28498)。此外,已经描述了使用亚硫酸氢盐技术检测单个基因的甲基化(grigg和clark(1994)bioessays 16:431-6;zeschnigk等人(1997)hum mol genet.6:387-95;feil等人(1994)nucleic acids res.22:695;martin等人(1995)gene 157:261-4;wo 9746705;wo 9515373)。
[0249]
根据本发明的技术,各种甲基化测定程序可以与亚硫酸氢盐处理结合使用。这些测定允许确定核酸序列内的一个或多个cpg二核苷酸(例如cpg岛)的甲基化状态。这类测定除其它技术外还涉及经过亚硫酸氢盐处理的核酸的测序、pcr(用于序列特异性扩增)、南方印迹分析(southern blot analysis)和甲基化特异性限制酶如甲基化敏感性或甲基化依赖性酶的使用。
[0250]
例如,通过使用亚硫酸氢盐处理,已简化基因组测序供分析甲基化模式和5-甲基胞嘧啶分布(frommer等人(1992)proc.natl.acad.sci.usa 89:1827-1831)。此外,对从经过亚硫酸氢盐转化的dna扩增的pcr产物的限制酶消化可用于评估甲基化状态,例如,如sadri和hornsby(1997)nucl.acids res.24:5058-5059所述或如在称为cobra(联合亚硫酸氢盐限制分析)的方法中所体现(xiong和laird(1997)nucleic acids res.25:2532-2534)。
[0251]
cobra
tm
分析是一种定量甲基化测定,可用于确定少量基因组dna中特定基因座的dna甲基化水平(xiong和laird,nucleic acids res.25:2532-2534,1997)。简单地说,限制酶消化用于揭示经过亚硫酸氢钠处理的dna的pcr产物的甲基化依赖性序列差异。根据frommer等人(proc.natl.acad.sci.usa89:1827-1831,1992)描述的程序,首先通过标准亚硫酸氢盐处理将甲基化依赖性序列差异引入基因组dna。然后使用对感兴趣的cpg岛具有特异性的引物对经过亚硫酸氢盐转化的dna进行pcr扩增,接着进行限制性内切酶消化、凝胶电泳,并使用特定的标记的杂交探针进行检测。原始dna样品中的甲基化水平由在广泛的dna甲基化水平范围内呈线性定量方式的消化和未消化的pcr产物的相对量表示。此外,这项技术可以可靠地应用于从显微解剖的石蜡包埋组织样品中获得的dna。
[0252]
用于cobra
tm
分析的典型试剂(例如,可在典型的基于cobra
tm
的试剂盒中找到)可
能包括但不限于:针对特定基因座(例如,特定基因、标志物、dmr、基因区域、标志物区域、经过亚硫酸氢盐处理的dna序列、cpg岛等)的pcr引物;限制酶和适当的缓冲液;基因杂交寡核苷酸;对照杂交寡核苷酸;寡核苷酸探针的激酶标记试剂盒;和标记的核苷酸。此外,亚硫酸氢盐转化试剂可能包括:dna变性缓冲液;磺化缓冲液;dna回收试剂或试剂盒(如沉淀、超滤、亲和柱);脱磺酸缓冲液;和dna回收组分。如“methylight
tm”(一种基于荧光的实时pcr技术)(eads等人,cancer res.59:2302-2306,1999)、ms-snupe
tm
(甲基化敏感性单核苷酸引物延伸)反应(gonzalgo和jones,nucleic acids res.25:2529-2531,1997)、甲基化特异性pcr(“msp”;herman等人,proc.natl.acad.sci.usa 93:9821-9826,1996;美国专利no.5,786,146)和甲基化cpg岛扩增(“mca”;toyota等人,cancer res.59:2307-12,1999)等测定单独使用或与这些方法中的一种或多种组合使用。
[0253]“heavymethyl
tm”测定技术是一种基于经过亚硫酸氢盐处理的dna的甲基化特异性扩增来评估甲基化差异的定量方法。覆盖扩增引物之间的cpg位置或被扩增引物覆盖的甲基化特异性阻断探针(本文也称为阻断剂)能够实现核酸样品的甲基化特异性选择性扩增。
[0254]
术语“heavymethyl
tm methylight
tm”测定是指heavymethyl
tm methylight
tm
测定,它是methylight
tm
测定的变体,其中methylight
tm
测定与覆盖扩增引物之间的cpg位置的甲基化特异性阻断探针组合。heavymethyl
tm
测定也可以与甲基化特异性扩增引物结合使用。
[0255]
用于heavymethyl
tm
分析的典型试剂(例如,可在典型的基于methylight
tm
的试剂盒中找到)可以包括但不限于:针对特定基因座(例如,特定基因、标志物、基因区域、标志物区域、经过亚硫酸氢盐处理的dna序列、cpg岛或经过亚硫酸氢盐处理的dna序列或cpg岛等)的pcr引物;阻断寡核苷酸;优化的pcr缓冲液和脱氧核苷酸;以及taq聚合酶。msp(甲基化特异性pcr)允许评估cpg岛内几乎任一组cpg位点的甲基化状况,而无需使用甲基化敏感性限制酶(herman等人proc.natl.acad.sci.usa 93:9821-9826,1996;美国专利no.5,786,146)。简单地说,亚硫酸氢钠对dna进行修饰,将未甲基化而非甲基化的胞嘧啶转化为尿嘧啶,随后使用对甲基化与未甲基化dna具有特异性的引物扩增产物。msp只需要少量的dna,对给定cpg岛基因座的0.1%甲基化等位基因敏感,并且可以对从石蜡包埋样品中提取的dna进行分析。用于msp分析的典型试剂(例如,可在典型的基于msp的试剂盒中找到)可以包括但不限于:针对特定基因座(例如,特定基因、标志物、基因区域、标志物区域、经过亚硫酸氢盐处理的dna序列、cpg岛等)的甲基化和未甲基化pcr引物;优化的pcr缓冲液和脱氧核苷酸;以及特定的探针。
[0256]
methylight
tm
测定是一种高通量的定量甲基化测定,它利用基于荧光的实时pcr(例如),在pcr步骤后无需进一步操作(eads等人,cancer res.59:2302-2306,1999)。简单地说,methylight
tm
过程从基因组dna的混合样品开始,该样品在亚硫酸氢钠反应中根据标准程序转化为甲基化依赖性序列差异的混合库(亚硫酸氢盐过程将未甲基化的胞嘧啶残基转化为尿嘧啶)。然后在“偏向”反应中例如使用与已知的cpg二核苷酸重叠的pcr引物进行基于荧光的pcr。序列区分发生在扩增过程的水平和荧光检测过程的水平下。
[0257]
methylight
tm
测定用作核酸,例如基因组dna样品中甲基化模式的定量测试,其中序列区分发生在探针杂交水平下。在定量型式中,pcr反应在存在与特定假定甲基化位点重叠的荧光探针的情况下提供甲基化特异性扩增。引物和探针都不覆盖任何cpg二核苷酸的反应提供了对所述量的输入dna的无偏向控制。可替代地,通过使用不覆盖已知的甲基化位
res.25:2529-2531,1997)。简单地说,基因组dna与亚硫酸氢钠反应,将未甲基化的胞嘧啶转化为尿嘧啶,同时保持5-甲基胞嘧啶不变。然后使用对经过亚硫酸氢盐转化的dna具有特异性的pcr引物进行所需靶序列的扩增,并且分离所得产物并用作感兴趣cpg位点的甲基化分析的模板。可以分析少量的dna(例如,显微解剖病理切片),并且避免使用限制酶来确定cpg位点的甲基化状况。
[0263]
用于ms-snupe
tm
分析的典型试剂(例如,可在典型的基于ms-snupe
tm
的试剂盒中找到)可能包括但不限于:针对特定基因座(例如,特定基因、标志物、基因区域、标志物区域、经过亚硫酸氢盐处理的dna序列、cpg岛等)的pcr引物;优化的pcr缓冲液和脱氧核苷酸;凝胶提取试剂盒;阳性对照引物;针对特定基因座的ms-snupe
tm
引物;反应缓冲液(针对ms-snupe反应);和标记的核苷酸。此外,亚硫酸氢盐转化试剂可能包括:dna变性缓冲液;磺化缓冲液;dna回收试剂或试剂盒(如沉淀、超滤、亲和柱);脱磺酸缓冲液;和dna回收组分。
[0264]
简化代表性亚硫酸氢盐测序(rrbs)从对核酸进行亚硫酸氢盐处理以将所有未甲基化的胞嘧啶转化为尿嘧啶开始,然后进行限制酶消化(例如,通过识别包括cg序列的位点的酶,如mspi)以及在与接头配体偶联后对片段进行完整测序。限制酶的选择可以富集cpg密集区域的片段,减少在分析过程中可能映射至多个基因位置的冗余序列的数目。因此,rrbs通过选择限制性片段的子集(例如,通过使用制备型凝胶电泳的大小选择)用于测序来降低核酸样品的复杂性。与全基因组亚硫酸氢盐测序相反,限制酶消化产生的每个片段都含有至少一个cpg二核苷酸的dna甲基化信息。因此,rrbs富集样品中在区域内具有高频率的限制酶切割位点的启动子、cpg岛和其它基因组特征,从而提供了一种评估一个或多个基因组基因座的甲基化状态的测定法。
[0265]
rrbs的典型方案包括使用限制酶(如mspi)消化核酸样品、填充悬垂和a尾、连接接头、亚硫酸氢盐转化和pcr的步骤。参见例如等人(2005)“genome-scale dna methylation mapping of clinical samples at single-nucleotide resolution”nat methods 7:133-6;meissner等人(2005)“reduced representation bisulfite sequencing for comparative high-resolution dna methylation analysis”nucleic acids res.33:5868-77。
[0266]
在一些实施方案中,使用定量等位基因特异性实时靶标和信号放大(quarts)测定来评估甲基化状态。在每个quarts测定中依次发生三个反应,包括初级反应中的扩增(反应1)和靶探针裂解(反应2);以及次级反应中的fret裂解和荧光信号生成(反应3)。当使用特定引物扩增目标核酸时,带有瓣序列的特定检测探针与扩增子松散地结合。靶结合位点处特定侵入性寡核苷酸的存在引起5'核酸酶,例如fen-1核酸内切酶,通过在检测探针和瓣序列之间切割来释放瓣序列。瓣序列与相应fret盒的非发夹部分互补。因此,瓣序列充当fret盒上的侵入性寡核苷酸,并在fret盒荧光团与猝灭剂之间实现裂解,产生荧光信号。裂解反应可以每个靶标切割多个探针,从而每个瓣释放多个荧光团,提供指数信号放大。quarts可以通过使用带有不同染料的fret盒来检测单个反应孔中的多个靶标。参见例如zou等人(2010)“sensitive quantification of methylated markers with a novel methylation specific technology”clin chem 56:a199),和美国专利no.8,361,720;8,715,937;8,916,344;以及9,212,392,每一个都通过引用的方式并入本文中,以达成所有目的。
[0267]
术语“亚硫酸氢盐试剂”是指包含亚硫酸氢盐(bisulfite)、亚硫酸氢盐(disulfite)、亚硫酸氢盐(hydrogen sulfite)或其组合的试剂,如本文所公开,其用于区分甲基化与未甲基化的cpg二核苷酸序列。所述处理方法是本领域已知的(例如pct/ep2004/011715和wo 2013/116375,各自通过引用的方式整体并入)。在一些实施方案中,亚硫酸氢盐处理在变性溶剂例如但不限于正烷二醇或二乙二醇二甲醚(dme)的存在下,或在二噁烷或二噁烷衍生物的存在下进行。在一些实施方案中,变性溶剂以介于1%与35%(v/v)之间的浓度使用。在一些实施方案中,亚硫酸氢盐反应在清除剂存在下进行,所述清除剂例如但不限于色烷衍生物,例如6-羟基-2,5,7,8,-四甲基色烷2-甲酸或三羟基苯甲酸和其衍生物,例如没食子酸(参见:pct/ep2004/011715,以引用的方式整体并入)。在某些优选的实施方案中,亚硫酸氢盐反应包括用亚硫酸氢铵处理,例如,如wo 2013/116375中所述。
[0268]
在一些实施方案中,使用根据本发明的引物寡核苷酸组(例如参见表1c和6b)和扩增酶扩增处理过的dna的片段。几个dna区段的扩增可以在同一个反应容器中同时进行。通常,使用聚合酶链式反应(pcr)进行扩增。扩增子的长度通常为100至2000个碱基对。
[0269]
在该方法的另一个实施方案中,可以通过使用甲基化特异性引物寡核苷酸来检测在包含dmr(例如dmr 1-560,表1a和6a)的标志物内或附近的cpg位置的甲基化状况。这种技术(msp)已在herman的美国专利no.6,265,171中描述。使用甲基化状况特异性引物扩增经过亚硫酸氢盐处理的dna可以区分甲基化与未甲基化的核酸。msp引物对含有至少一种与经过亚硫酸氢盐处理的cpg二核苷酸杂交的引物。因此,所述引物的序列包含至少一个cpg二核苷酸。对未甲基化的dna具有特异性的msp引物在cpg的c位置处含有“t”。
[0270]
通过扩增获得的片段可以带有直接或间接的可检测标记。在一些实施方案中,标记是荧光标记、放射性核素或具有可在质谱仪中检测到的典型质量的可分离分子片段。在所述标记是质量标记的情况下,一些实施方案提供标记的扩增子具有单个正或负净电荷,从而允许在质谱仪中具有更好的可检测性。可以通过例如基质辅助激光解吸/电离质谱法(maldi)或使用电喷雾质谱法(esi)来进行检测和可视化。
[0271]
适用于这些测定技术的分离dna的方法是本领域已知的。具体地说,一些实施方案包括分离核酸,如通过引用的方式整体并入本文中的美国专利申请序列号13/470,251(“isolation of nucleic acids”)中所述。
[0272]
在一些实施方案中,本文所述的标志物可用于对粪便样品进行的quarts测定。在一些实施方案中,提供了产生dna样品的方法,特别是产生如下dna样品的方法,所述dna样品包含小体积(例如,小于100微升、小于60微升)的高度纯化的低丰度核酸并且基本上和/或实际上不含抑制用于测试dna样品的测定(例如,pcr、invader、quarts测定等)的物质。这类dna样品可在定性检测在取自患者的样品中存在的基因、基因变体(例如等位基因)或基因修饰(例如甲基化)的存在或定量测量其活性、表达或数量的诊断分析中使用。例如,一些癌症与特定突变等位基因或特定甲基化状态的存在相关,因此检测和/或定量这类突变等位基因或甲基化状态在癌症的诊断和治疗中具有预测价值。许多有价值的遗传标志物以极低的量存在于样品中,并且产生这类标志物的许多事件非常罕见。因此,即使是灵敏的检测方法(例如pcr)也需要大量dna来提供足够的低丰度靶标,以满足或代替测定的检测阈值。此外,即使是少量抑制物质的存在也会损害这些旨在检测如此少量靶标的测定的准确性和精确度。因此,本文提供了对体积和浓度提供必要管理以产生这类dna样品的方法。
[0273]
在一些实施方案中,样品包含血液、血清、白细胞、血浆或唾液。在一些实施方案中,受试者是人。这类样品可以通过本领域已知的,例如熟练技术人员显而易见的多种方法获得。可以通过使样品经受本领域技术人员已知的各种技术,包括但不限于离心和过滤来获得无细胞或基本上无细胞的样品。尽管通常优选不使用侵入性技术来获得样品,但获得样品例如组织匀浆、组织切片和活检标本仍可能是优选的。这项技术不限于用于制备样品和提供用于测试的核酸的方法。例如,在一些实施方案中,使用直接基因捕获,例如,如美国专利no.8,808,990和9,169,511以及wo 2012/155072中所详述,或通过相关方法,从粪便样品或血液或血浆样品中分离dna。
[0274]
标志物的分析可以单独或与一个测试样品中的另外的标志物同时进行。例如,可以将几种标志物组合到一个测试中以有效处理多个样品并潜在地提供更高的诊断和/或预后准确性。此外,本领域技术人员会认识到测试来自同一受试者的多个样品(例如,在连续时间点)的价值。这类系列样品测试可以鉴定标志物甲基化状态随时间的变化。甲基化状态的变化以及甲基化状态没有变化可以提供有关疾病状态的有用信息,包括但不限于鉴定事件发生的大致时间、可挽救组织的存在和数量、药物疗法的适当性、各种疗法的有效性以及对受试者结果的鉴定,包括未来事件的风险。生物标志物的分析可以呈多种物理格式进行。例如,可以使用微量滴定板或自动化来促进大量测试样品的处理。可替代地,可以开发单一样品格式以促进以及时方式进行即刻治疗和诊断,例如在非卧床运输或急诊室环境中。
[0275]
预期以试剂盒的形式提供这项技术的实施方案。试剂盒包含本文所述的组合物、装置、设备等的实施方案,以及试剂盒的使用说明书。这类说明书描述了用于从样品制备分析物,例如用于收集样品和从样品制备核酸的合适方法。试剂盒的各个组分被包装在合适的容器和包装(例如,小瓶、盒子、泡罩包装、安瓿、广口瓶、瓶子、管等)中并且这些组分被一起包装在合适的容器(例如,一个盒子或多个盒子)中以方便试剂盒的用户存储、运输和/或使用。应当理解,液体组分(例如,缓冲液)可以呈冻干形式提供以供用户复原。试剂盒可以包括用于评估、验证和/或确保试剂盒性能的对照或参考。例如,用于测定样品中存在的核酸量的试剂盒可以包括对照,其包含已知浓度的用于比较的相同或另一种核酸,并且在一些实施方案中,对对照核酸具有特异性的检测试剂(例如引物)。试剂盒适用于临床环境,并且在一些实施方案中,适用于用户家中。在一些实施方案中,试剂盒的组件提供用于从样品制备核酸溶液的系统的功能。在一些实施方案中,系统的某些组件由用户提供。
[0276]
方法
[0277]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0278]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物包含dmr(例如,如例如表1a和6a中提供的dmr 1-560),以及
[0279]
2)检测卵巢癌,透明细胞oc、子宫内膜样oc、粘液性oc或浆液性oc(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0280]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0281]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:agrn_
a、atp10a_a、atp10a_b、atp10a_c、atp10a_d、bcat1、ccnd2_d、cmtm3_a、elmo1_a、elmo1_b、elmo1_c、emx1、eps8l2_a、eps8l2_b、eps8l2_c、eps8l2_d、faim2_a、flj34208_a、gprin1、gypc_a、ina_a、itga4_b、kcna3_a、kcna3_c、lbh、lime1_a、lime1_b、loc646278、lrrc4、lrrc41_a、max.chr1.110626771-110626832、max.chr1.147790358-147790381、max.chr1.161591532-161591608、max.chr15.28351937-28352173、max.chr15.28352203-28352671、max.chr15.29131258-29131734、max.chr4.8859995-8860062、max.chr5.42952182-42952292、mdfi、ncor2、nkx2-6、oplah_a、parp15、pde10a、ppp1r16b、rassf1_b、septin9、ski、slc12a8、src_a、ssbp4_b、st8sia1、tacc2_a、tshz3、ubtf、vim、vipr2_a、zbed4、zmiz1_a、zmiz1_b、zmiz1_c、znf382_a、znf469_b、atp6v1b1_a、bzrap1、gdf6、iffo1_a、iffo1_b、kcnab2、limd2、maml3_b、max.chr14.102172350-102172770、max.chr16.85482307-85482494、max.chr17.76254728-76254841、max.chr5.42993898-42994179和rasal3,以及
[0282]
2)检测卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0283]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0284]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、src(例如,src_a、src_b)、sim2(例如,sim2_a、sim2_b)、agrn(例如,agrn_a、agrn_b、agrn_c、agrn_8794)、faim2(例如,faim2_a、faim2_b)、celf2(例如,celf2_a、celf2_b)、dscr6、gypc(例如,gypc_a、gypc_b、gypc_c)、capn2(例如,capn2_a、capn2_b)和bcat1,以及
[0285]
2)检测卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0286]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0287]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:atp10a(例如,atp10a_a、atp10a_b、atp10a_c、atp10a_d、atp10a_e)、eps8l2(例如,eps8l2_a、eps8l2_b、eps8l2_c、eps8l2_d)、c1ql3(例如,c1ql3_a、c1ql3_b)、faim2(例如,faim2_a、faim2_b)、capn2_b、lbh、cmtm3(例如,cmtm3_a、cmtm3_b)、zmiz1(例如,zmiz1_a、zmiz1_b、zmiz1_c、zmiz1_d)、gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、gp5、dscr6、ski、sim2_a、agrn_8794、bcat1_6015、kcna3_7518、kcna3_7320、loc10013136、gypc_c、src(例如,src_a、src_b)、nr2f6、tshz3、celf2(例如,celf2_a、celf2_b)、tacc2(例如,tacc2_a、tacc2_b)、vipr2(例如,vipr2_a、vipr2_b)和spock2_74333,以及
[0288]
2)检测卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0289]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0290]
1)测量从受试者获得的血液样品(例如,血浆样品、全血样品、白细胞样品、血清样
品)内的ca-125水平;
[0291]
2)使核酸(例如,例如从获自受试者的血液样品(例如,血浆样品、全血样品、白细胞样品、血清样品)分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:atp10a(例如,atp10a_a、atp10a_b、atp10a_c、atp10a_d、atp10a_e)、eps8l2(例如,eps8l2_a、eps8l2_b、eps8l2_c、eps8l2_d)、c1ql3(例如,c1ql3_a、c1ql3_b)、faim2(例如,faim2_a、faim2_b)、capn2_b、lbh、cmtm3(例如,cmtm3_a、cmtm3_b)、zmiz1(例如,zmiz1_a、zmiz1_b、zmiz1_c、zmiz1_d)、gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、gp5、dscr6、ski和sim2_a,以及
[0292]
3)检测卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0293]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0294]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:max.chr16.85482307-85482494、gdf6、iffo_a、max.chr5.42993898-42994179、max.chr17.76254728-76254841、max.chr14.102172350-102172770、rasal3、bzrap1和limd2,以及
[0295]
2)检测卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0296]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0297]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:palld、prdm14、max.chr1.147790358-147790381、bcat1、maml3_a、ski、dnmt3a_a和c2cd4d,以及
[0298]
2)检测卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0299]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0300]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:tacc2_a、lrrc41_a、eps8l2、lbh、lime1_b、mdfi、faim2_a、gypc_a、agrn_b和zbed4,以及
[0301]
2)检测透明细胞卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0302]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0303]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:mt1a_
a、celf2_a、kcna3_a、mdfi、palld、prdm14、parp15、tacc2_a、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、agrn_b、max.chr6.10382190-10382225、dscr6、maml3_a、max.chr14.105512178-105512224、eps8l2_e、ski、gprin1_a、max.chr8.142215938-142216298、cdo1_a、dnmt3a_a、sim2_a、ski、mt1a_b、gypc_a、bcl2l11、pisd和c2cd4d,以及
[0304]
2)检测透明细胞卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0305]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0306]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:ncor2、mt1a_b、celf2_a、palld、prdm14、parp15、tacc2_a、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、agrn_b、max.chr6.10382190-10382225、dscr6、maml3_a、ski、gprin1_a、cdo1_a、sim2_a、iffo1_a、mt1a_b、gypc_a、bcl2l11、gdf6和c2cd4d,以及
[0307]
2)检测透明细胞卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0308]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0309]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:agrn_8794、bhlhe23_8339、eps8l2_f、rassf1_8293、mdfi_6321、ski、gypc_c、nkx2-6_4159、loc100131366、faim2_b、gprin1_b、lrrc41_b、tacc2_b、lbh、sim2_b、cdo1_a和dscr6,以及
[0310]
2)检测透明细胞卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0311]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0312]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:parp15、gprin1_a、gypc1_a、flj34208、max.chr1.147790358-147790381、faim2_a、sh2b3、kcnq5、irf4和bcat1,以及
[0313]
2)检测子宫内膜样卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0314]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0315]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:ncor2、celf2_a、palld、prdm14、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、maml3_a、ski、gprin1_a、ski、bcl2l11和c2cd4d,以及
[0316]
2)检测子宫内膜样卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0317]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0318]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:ncor2、palld、prdm14、max.chr1.147790358-147790381、max.chr11.14926602-14926671、dscr6、gprin1_a、cdo1_a、sim2_a、iffo1_a和c2cd4d,以及
[0319]
2)检测子宫内膜样卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0320]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0321]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:bcat1_6015、eps8l2_f、ski、nkx2-6_4159、c1ql3_b、gprin1_b、parp15、oxt_c、sim2_b、dnmt3a_a和celf2_a,以及
[0322]
2)检测子宫内膜样卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0323]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0324]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:cmtm3_a、atp10a_c、tshz3、zmiz1_b、atp10a_b、elmo1_b、tacc2_a、lrrc4、vim和znf382_a,以及
[0325]
2)检测粘液性卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0326]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0327]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:ncor2、mt1a_a、kcna3_a、zmiz1_c、tacc2_a、max.chr1.147790358-147790381、bcat1、agrn_b、ski、slc12a8、zmiz1_b、bcl2l11和gata2,以及
[0328]
2)检测粘液性卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0329]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0330]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:ncor2、palld、tacc2_a、bcat1、agrn_b、ski、slc12a8、zmiz1_b和bcl2l11,以及
[0331]
2)检测粘液性卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0332]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0333]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:bcat1_6015、elmo1_9100、kcna3_7518、kcna3_7320、mdfi_6321、ski、vipr_b、znf382_b、atp10a_e、cmtm3_b、zmiz1_d、src_b、hdgfrp3、tacc2_b、tshz3、lbh、dnmt3a_a,以及
[0334]
2)检测粘液性卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0335]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0336]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:max.chr1.147790358-147790381、maml3、nr2f6、dnmt3a_a、ski、sobp、ubtf、agrn_c、max.chr12.30975740-30975780和capn2_a,以及
[0337]
2)检测浆液性卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0338]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0339]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:palld、prdm14、max.chr1.147790358-147790381、capn2_a、max.chr6.10382190-10382225、ski、nr2f6、iffo1_a、mt1a_b、iffo1_b、gdf6和c2cd4d,以及
[0340]
2)检测浆液性卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0341]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0342]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:ncor2、max.chr1.147790358-147790381、max.chr6.10382190-10382225、iffo1_a、gdf6和c2cd4d,以及
[0343]
2)检测浆液性卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0344]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0345]
1)使从受试者获得的核酸(例如,例如从例如血液或血浆之体液或卵巢组织分离的基因组dna)与区分至少一种标志物内的甲基化与非甲基化cpg二核苷酸的至少一种试剂或一系列试剂接触,所述标志物选自具有选自由以下组成的组的注释的染色体区域:ski、pear1_b、capn2_b、sim2_b、dnmt3a_a、cdo1_a和nr2f6,以及
[0346]
2)检测浆液性卵巢癌(例如,以大于或等于80%的灵敏度和大于或等于80%的特异性提供)。
[0347]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0348]
1)通过用以甲基化特异性方式修饰dna的试剂(例如,其中所述试剂是亚硫酸氢盐试剂、甲基化敏感性限制酶或甲基化依赖性限制酶)处理人类个体的生物样品中的基因组dna,测量所述生物样品中一种或多种基因的甲基化水平,其中所述一种或多种基因选自以下组中的一组:
[0349]
·
agrn_a、atp10a_a、atp10a_b、atp10a_c、atp10a_d、bcat1、ccnd2_d、cmtm3_a、elmo1_a、elmo1_b、elmo1_c、emx1、eps8l2_a、eps8l2_b、eps8l2_c、eps8l2_d、faim2_a、flj34208_a、gprin1、gypc_a、ina_a、itga4_b、kcna3_a、kcna3_c、lbh、lime1_a、lime1_b、loc646278、lrrc4、lrrc41_a、max.chr1.110626771-110626832、max.chr1.147790358-147790381、max.chr1.161591532-161591608、max.chr15.28351937-28352173、max.chr15.28352203-28352671、max.chr15.29131258-29131734、max.chr4.8859995-8860062、max.chr5.42952182-42952292、mdfi、ncor2、nkx2-6、oplah_a、parp15、pde10a、ppp1r16b、rassf1_b、septin9、ski、slc12a8、src_a、ssbp4_b、st8sia1、tacc2_a、tshz3、ubtf、vim、vipr2_a、zbed4、zmiz1_a、zmiz1_b、zmiz1_c、znf382_a、znf469_b、atp6v1b1_a、bzrap1、gdf6、iffo1_a、iffo1_b、kcnab2、limd2、maml3_b、max.chr14.102172350-102172770、max.chr16.85482307-85482494、max.chr17.76254728-76254841、max.chr5.42993898-42994179和rasal3(参见表1a、1b、6a、6b;实施例i);
[0350]
·
max.chr16.85482307-85482494、gdf6、iffo_a、max.chr5.42993898-42994179、max.chr17.76254728-76254841、max.chr14.102172350-102172770、rasal3、bzrap1和limd2(参见表3;实施例i);
[0351]
·
palld、prdm14、max.chr1.147790358-147790381、bcat1、maml3_a、ski、dnmt3a_a和c2cd4d(参见表4a;实施例i);以及
[0352]
·
bcat1_6015、ski、sim2_b、dnmt3a_a、cdo1_a和dscr6(参见表8a;实施例ii);
[0353]
2)使用一组针对所选择的一种或多种基因的引物扩增经过处理的基因组dna;以及
[0354]
3)通过聚合酶链式反应、核酸测序、质谱法、甲基化特异性核酸酶、基于质量的分离以及靶标捕获确定所述一种或多种基因的甲基化水平。
[0355]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0356]
1)通过用以甲基化特异性方式修饰dna的试剂(例如,其中所述试剂是亚硫酸氢盐试剂、甲基化敏感性限制酶或甲基化依赖性限制酶)处理人类个体的生物样品(例如,血液样品、血浆样品)中的基因组dna,测量所述生物样品中一种或多种基因的甲基化水平,其中所述一种或多种基因选自gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、src(例如,src_a、src_b)、sim2(例如,sim2_a、sim2_b)、agrn(例如,agrn_a、agrn_b、agrn_c、agrn_8794)、faim2(例如,faim2_a、faim2_b)、celf2(例如,celf2_a、celf2_b)、dscr6、gypc(例如,gypc_a、gypc_b、gypc_c)、capn2(例如,capn2_a、capn2_b)和bcat1;
[0357]
2)使用一组针对所选择的一种或多种基因的引物扩增经过处理的基因组dna;以及
[0358]
3)通过聚合酶链式反应、核酸测序、质谱法、甲基化特异性核酸酶、基于质量的分离以及靶标捕获确定所述一种或多种基因的甲基化水平。
[0359]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0360]
1)通过用以甲基化特异性方式修饰dna的试剂(例如,其中所述试剂是亚硫酸氢盐试剂、甲基化敏感性限制酶或甲基化依赖性限制酶)处理人类个体的生物样品(例如,血液样品、血浆样品)中的基因组dna,测量所述生物样品中一种或多种基因的甲基化水平,其中所述一种或多种基因选自atp10a(例如,atp10a_a、atp10a_b、atp10a_c、atp10a_d、atp10a_e)、eps8l2(例如,eps8l2_a、eps8l2_b、eps8l2_c、eps8l2_d)、c1ql3(例如,c1ql3_a、c1ql3_b)、faim2(例如,faim2_a、faim2_b)、capn2_b、lbh、cmtm3(例如,cmtm3_a、cmtm3_b)、zmiz1(例如,zmiz1_a、zmiz1_b、zmiz1_c、zmiz1_d)、gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、gp5、dscr6、ski、sim2_a、agrn_8794、bcat1_6015、kcna3_7518、kcna3_7320、loc10013136、gypc_c、src(例如,src_a、src_b)、nr2f6、tshz3、celf2(例如,celf2_a、celf2_b)、tacc2(例如,tacc2_a、tacc2_b)、vipr2(例如,vipr2_a、vipr2_b)和spock2_74333;
[0361]
2)使用一组针对所选择的一种或多种基因的引物扩增经过处理的基因组dna;以及
[0362]
3)通过聚合酶链式反应、核酸测序、质谱法、甲基化特异性核酸酶、基于质量的分离以及靶标捕获确定所述一种或多种基因的甲基化水平。
[0363]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0364]
1)测量从人类个体获得的血液样品(例如,血浆样品、全血样品、白细胞样品、血清样品)内的ca-125水平;
[0365]
2)通过用以甲基化特异性方式修饰dna的试剂(例如,其中所述试剂是亚硫酸氢盐试剂、甲基化敏感性限制酶或甲基化依赖性限制酶)处理人类个体的生物样品血液样品(例如,血浆样品、全血样品、白细胞样品、血清样品)中的基因组dna,测量所述生物样品中一种或多种基因的甲基化水平,其中所述一种或多种基因选自atp10a_a、atp10a_b、atp10a_c、atp10a_d、atp10a_e)、eps8l2(例如,eps8l2_a、eps8l2_b、eps8l2_c、eps8l2_d)、c1ql3(例如,c1ql3_a、c1ql3_b)、faim2(例如,faim2_a、faim2_b)、capn2_b、lbh、cmtm3(例如,cmtm3_a、cmtm3_b)、zmiz1(例如,zmiz1_a、zmiz1_b、zmiz1_c、zmiz1_d)、gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、gp5、dscr6、ski和sim2_a;
[0366]
3)使用一组针对所选择的一种或多种基因的引物扩增经过处理的基因组dna;以及
[0367]
4)通过聚合酶链式反应、核酸测序、质谱法、甲基化特异性核酸酶、基于质量的分离以及靶标捕获确定所述一种或多种基因的甲基化水平。
[0368]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0369]
1)测量来自样品的dna中至少一种甲基化标志基因的量,其中所述一种或多种基因选自以下组中的一组:
[0370]
·
agrn_a、atp10a_a、atp10a_b、atp10a_c、atp10a_d、bcat1、ccnd2_d、cmtm3_a、elmo1_a、elmo1_b、elmo1_c、emx1、eps8l2_a、eps8l2_b、eps8l2_c、eps8l2_d、faim2_a、flj34208_a、gprin1、gypc_a、ina_a、itga4_b、kcna3_a、kcna3_c、lbh、lime1_a、lime1_b、
loc646278、lrrc4、lrrc41_a、max.chr1.110626771-110626832、max.chr1.147790358-147790381、max.chr1.161591532-161591608、max.chr15.28351937-28352173、max.chr15.28352203-28352671、max.chr15.29131258-29131734、max.chr4.8859995-8860062、max.chr5.42952182-42952292、mdfi、ncor2、nkx2-6、oplah_a、parp15、pde10a、ppp1r16b、rassf1_b、septin9、ski、slc12a8、src_a、ssbp4_b、st8sia1、tacc2_a、tshz3、ubtf、vim、vipr2_a、zbed4、zmiz1_a、zmiz1_b、zmiz1_c、znf382_a、znf469_b、atp6v1b1_a、bzrap1、gdf6、iffo1_a、iffo1_b、kcnab2、limd2、maml3_b、max.chr14.102172350-102172770、max.chr16.85482307-85482494、max.chr17.76254728-76254841、max.chr5.42993898-42994179和rasal3(参见表1a、1b、6a、6b;实施例i);
[0371]
·
max.chr16.85482307-85482494、gdf6、iffo_a、max.chr5.42993898-42994179、max.chr17.76254728-76254841、max.chr14.102172350-102172770、rasal3、bzrap1和limd2(参见表3;实施例i);
[0372]
·
gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、src(例如,src_a、src_b)、sim2(例如,sim2_a、sim2_b)、agrn(例如,agrn_a、agrn_b、agrn_c、agrn_8794)、faim2(例如,faim2_a、faim2_b)、celf2(例如,celf2_a、celf2_b)、dscr6、gypc(例如,gypc_a、gypc_b、gypc_c)、capn2(例如,capn2_a、capn2_b)和bcat1(参见表9;实施例iii);
[0373]
·
atp10a(例如,atp10a_a、atp10a_b、atp10a_c、atp10a_d、atp10a_e)、eps8l2(例如,eps8l2_a、eps8l2_b、eps8l2_c、eps8l2_d)、c1ql3(例如,c1ql3_a、c1ql3_b)、faim2(例如,faim2_a、faim2_b)、capn2_b、lbh、cmtm3(例如,cmtm3_a、cmtm3_b)、zmiz1(例如,zmiz1_a、zmiz1_b、zmiz1_c、zmiz1_d)、gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、gp5、dscr6、ski、sim2_a、agrn_8794、bcat1_6015、kcna3_7518、kcna3_7320、loc10013136、gypc_c、src(例如,src_a、src_b)、nr2f6、tshz3、celf2(例如,celf2_a、celf2_b)、tacc2(例如,tacc2_a、tacc2_b)、vipr2(例如,vipr2_a、vipr2_b)和spock2_74333(参见表10,实施例iii);
[0374]
·
palld、prdm14、max.chr1.147790358-147790381、bcat1、maml3_a、ski、dnmt3a_a和c2cd4d(参见表4a;实施例i);以及
[0375]
·
bcat1_6015、ski、sim2_b、dnmt3a_a、cdo1_a和dscr6(参见表8a;实施例ii);
[0376]
2)测量所述dna中的至少一种参考标志物的量;以及
[0377]
3)将在所述dna中测量的所述至少一种甲基化标志基因的量的值计算为在所述dna中测量的所述参考标志基因的量的百分比,其中所述值指示在所述样品中测量的所述至少一种甲基化标志dna的量。
[0378]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0379]
1)通过用亚硫酸氢盐以甲基化特异性方式修饰dna的试剂(例如,甲基化敏感性限制酶、甲基化依赖性限制酶和亚硫酸氢盐试剂)处理人类个体的生物样品中的基因组dna,测量所述生物样品中一种或多种基因的cpg位点的甲基化水平;
[0380]
2)使用一组针对所选择的一种或多种基因的引物扩增经过修饰的基因组dna;以及
[0381]
3)通过甲基化特异性pcr、定量甲基化特异性pcr、甲基化敏感性dna限制酶分析、
定量亚硫酸氢盐焦磷酸测序或亚硫酸氢盐基因组测序pcr确定所述cpg位点的甲基化水平;
[0382]
其中所述一种或多种基因选自以下组中的一组:
[0383]
·
agrn_a、atp10a_a、atp10a_b、atp10a_c、atp10a_d、bcat1、ccnd2_d、cmtm3_a、elmo1_a、elmo1_b、elmo1_c、emx1、eps8l2_a、eps8l2_b、eps8l2_c、eps8l2_d、faim2_a、flj34208_a、gprin1、gypc_a、ina_a、itga4_b、kcna3_a、kcna3_c、lbh、lime1_a、lime1_b、loc646278、lrrc4、lrrc41_a、max.chr1.110626771-110626832、max.chr1.147790358-147790381、max.chr1.161591532-161591608、max.chr15.28351937-28352173、max.chr15.28352203-28352671、max.chr15.29131258-29131734、max.chr4.8859995-8860062、max.chr5.42952182-42952292、mdfi、ncor2、nkx2-6、oplah_a、parp15、pde10a、ppp1r16b、rassf1_b、septin9、ski、slc12a8、src_a、ssbp4_b、st8sia1、tacc2_a、tshz3、ubtf、vim、vipr2_a、zbed4、zmiz1_a、zmiz1_b、zmiz1_c、znf382_a、znf469_b、atp6v1b1_a、bzrap1、gdf6、iffo1_a、iffo1_b、kcnab2、limd2、maml3_b、max.chr14.102172350-102172770、max.chr16.85482307-85482494、max.chr17.76254728-76254841、max.chr5.42993898-42994179和rasal3(参见表1a、1b、6a、6b;实施例i);
[0384]
·
gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、src(例如,src_a、src_b)、sim2(例如,sim2_a、sim2_b)、agrn(例如,agrn_a、agrn_b、agrn_c、agrn_8794)、faim2(例如,faim2_a、faim2_b)、celf2(例如,celf2_a、celf2_b)、dscr6、gypc(例如,gypc_a、gypc_b、gypc_c)、capn2(例如,capn2_a、capn2_b)和bcat1(参见表9;实施例iii);
[0385]
·
atp10a(例如,atp10a_a、atp10a_b、atp10a_c、atp10a_d、atp10a_e)、eps8l2(例如,eps8l2_a、eps8l2_b、eps8l2_c、eps8l2_d)、c1ql3(例如,c1ql3_a、c1ql3_b)、faim2(例如,faim2_a、faim2_b)、capn2_b、lbh、cmtm3(例如,cmtm3_a、cmtm3_b)、zmiz1(例如,zmiz1_a、zmiz1_b、zmiz1_c、zmiz1_d)、gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、gp5、dscr6、ski、sim2_a、agrn_8794、bcat1_6015、kcna3_7518、kcna3_7320、loc10013136、gypc_c、src(例如,src_a、src_b)、nr2f6、tshz3、celf2(例如,celf2_a、celf2_b)、tacc2(例如,tacc2_a、tacc2_b)、vipr2(例如,vipr2_a、vipr2_b)和spock2_74333(参见表10,实施例iii);
[0386]
·
max.chr16.85482307-85482494、gdf6、iffo_a、max.chr5.42993898-42994179、max.chr17.76254728-76254841、max.chr14.102172350-102172770、rasal3、bzrap1和limd2(参见表3;实施例i);
[0387]
·
palld、prdm14、max.chr1.147790358-147790381、bcat1、maml3_a、ski、dnmt3a_a和c2cd4d(参见表4a;实施例i);以及
[0388]
·
bcat1_6015、ski、sim2_b、dnmt3a_a、cdo1_a和dscr6(参见表8a;实施例ii)。
[0389]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0390]
1)通过用以甲基化特异性方式修饰dna的试剂(例如,其中所述试剂是亚硫酸氢盐试剂、甲基化敏感性限制酶或甲基化依赖性限制酶)处理人类个体的生物样品中的基因组dna,测量所述生物样品中一种或多种基因的甲基化水平,其中所述一种或多种基因选自以下组中的一组:
[0391]
·
tacc2_a、lrrc41_a、eps8l2、lbh、lime1_b、mdfi、faim2_a、gypc_a、agrn_b和
zbed4(参见表2a;实施例i);
[0392]
·
mt1a_a、celf2_a、kcna3_a、mdfi、palld、prdm14、parp15、tacc2_a、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、agrn_b、max.chr6.10382190-10382225、dscr6、maml3_a、max.chr14.105512178-105512224、eps8l2_e、ski、gprin1_a、max.chr8.142215938-142216298、cdo1_a、dnmt3a_a、sim2_a、ski、mt1a_b、gypc_a、bcl2l11、pisd和c2cd4d(参见表4b;实施例i);
[0393]
·
ncor2、mt1a_b、celf2_a、palld、prdm14、parp15、tacc2_a、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、agrn_b、max.chr6.10382190-10382225、dscr6、maml3_a、ski、gprin1_a、cdo1_a、sim2_a、iffo1_a、mt1a_b、gypc_a、bcl2l11、gdf6和c2cd4d(参见表5b;实施例i);以及
[0394]
·
agrn_8794、bhlhe23_8339、eps8l2_f、rassf1_8293、mdfi_6321、ski、gypc_c、nkx2-6_4159、loc100131366、faim2_b、gprin1_b、lrrc41_b、tacc2_b、lbh、sim2_b、cdo1_a和dscr6(参见表8b;实施例ii);
[0395]
2)使用一组针对所选择的一种或多种基因的引物扩增经过处理的基因组dna;以及
[0396]
3)通过聚合酶链式反应、核酸测序、质谱法、甲基化特异性核酸酶、基于质量的分离以及靶标捕获确定所述一种或多种基因的甲基化水平。
[0397]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0398]
1)测量来自样品的dna中至少一种甲基化标志基因的量,其中所述一种或多种基因选自以下组中的一组:
[0399]
·
tacc2_a、lrrc41_a、eps8l2、lbh、lime1_b、mdfi、faim2_a、gypc_a、agrn_b和zbed4(参见表2a;实施例i);
[0400]
·
mt1a_a、celf2_a、kcna3_a、mdfi、palld、prdm14、parp15、tacc2_a、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、agrn_b、max.chr6.10382190-10382225、dscr6、maml3_a、max.chr14.105512178-105512224、eps8l2_e、ski、gprin1_a、max.chr8.142215938-142216298、cdo1_a、dnmt3a_a、sim2_a、ski、mt1a_b、gypc_a、bcl2l11、pisd和c2cd4d(参见表4b;实施例i);
[0401]
·
ncor2、mt1a_b、celf2_a、palld、prdm14、parp15、tacc2_a、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、agrn_b、max.chr6.10382190-10382225、dscr6、maml3_a、ski、gprin1_a、cdo1_a、sim2_a、iffo1_a、mt1a_b、gypc_a、bcl2l11、gdf6和c2cd4d(参见表5b;实施例i);以及
[0402]
·
agrn_8794、bhlhe23_8339、eps8l2_f、rassf1_8293、mdfi_6321、ski、gypc_c、nkx2-6_4159、loc100131366、faim2_b、gprin1_b、lrrc41_b、tacc2_b、lbh、sim2_b、cdo1_a和dscr6(参见表8b;实施例ii);
[0403]
2)测量所述dna中的至少一种参考标志物的量;以及
[0404]
3)将在所述dna中测量的所述至少一种甲基化标志基因的量的值计算为在所述dna中测量的所述参考标志基因的量的百分比,其中所述值指示在所述样品中测量的所述至少一种甲基化标志dna的量。
[0405]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0406]
1)通过用亚硫酸氢盐以甲基化特异性方式修饰dna的试剂(例如,甲基化敏感性限制酶、甲基化依赖性限制酶和亚硫酸氢盐试剂)处理人类个体的生物样品中的基因组dna,测量所述生物样品中一种或多种基因的cpg位点的甲基化水平;
[0407]
2)使用一组针对所选择的一种或多种基因的引物扩增经过修饰的基因组dna;以及
[0408]
3)通过甲基化特异性pcr、定量甲基化特异性pcr、甲基化敏感性dna限制酶分析、定量亚硫酸氢盐焦磷酸测序或亚硫酸氢盐基因组测序pcr确定所述cpg位点的甲基化水平;
[0409]
其中所述一种或多种基因选自以下组中的一组:
[0410]
·
tacc2_a、lrrc41_a、eps8l2、lbh、lime1_b、mdfi、faim2_a、gypc_a、agrn_b和zbed4(参见表2a;实施例i);
[0411]
·
mt1a_a、celf2_a、kcna3_a、mdfi、palld、prdm14、parp15、tacc2_a、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、agrn_b、max.chr6.10382190-10382225、dscr6、maml3_a、max.chr14.105512178-105512224、eps8l2_e、ski、gprin1_a、max.chr8.142215938-142216298、cdo1_a、dnmt3a_a、sim2_a、ski、mt1a_b、gypc_a、bcl2l11、pisd和c2cd4d(参见表4b;实施例i);
[0412]
·
ncor2、mt1a_b、celf2_a、palld、prdm14、parp15、tacc2_a、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、agrn_b、max.chr6.10382190-10382225、dscr6、maml3_a、ski、gprin1_a、cdo1_a、sim2_a、iffo1_a、mt1a_b、gypc_a、bcl2l11、gdf6和c2cd4d(参见表5b;实施例i);以及
[0413]
·
agrn_8794、bhlhe23_8339、eps8l2_f、rassf1_8293、mdfi_6321、ski、gypc_c、nkx2-6_4159、loc100131366、faim2_b、gprin1_b、lrrc41_b、tacc2_b、lbh、sim2_b、cdo1_a和dscr6(参见表8b;实施例ii)。
[0414]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0415]
1)通过用以甲基化特异性方式修饰dna的试剂(例如,其中所述试剂是亚硫酸氢盐试剂、甲基化敏感性限制酶或甲基化依赖性限制酶)处理人类个体的生物样品中的基因组dna,测量所述生物样品中一种或多种基因的甲基化水平,其中所述一种或多种基因选自以下组中的一组:
[0416]
·
parp15、gprin1_a、gypc1_a、flj34208、max.chr1.147790358-147790381、faim2_a、sh2b3、kcnq5、irf4和bcat1(参见表2b;实施例i);
[0417]
·
ncor2、celf2_a、palld、prdm14、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、maml3_a、ski、gprin1_a、ski、bcl2l11和c2cd4d(参见表4c;实施例i);
[0418]
·
ncor2、palld、prdm14、max.chr1.147790358-147790381、max.chr11.14926602-14926671、dscr6、gprin1_a、cdo1_a、sim2_a、iffo1_a和c2cd4d(参见表5c;实施例i);以及
[0419]
·
bcat1_6015、eps8l2_f、ski、nkx2-6_4159、c1ql3_b、gprin1_b、parp15、oxt_c、sim2_b、dnmt3a_a和celf2_a(参见表8c;实施例ii);
[0420]
2)使用一组针对所选择的一种或多种基因的引物扩增经过处理的基因组dna;以及
[0421]
3)通过聚合酶链式反应、核酸测序、质谱法、甲基化特异性核酸酶、基于质量的分
离以及靶标捕获确定所述一种或多种基因的甲基化水平。
[0422]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0423]
1)测量来自样品的dna中至少一种甲基化标志基因的量,其中所述一种或多种基因选自以下组中的一组:
[0424]
·
parp15、gprin1_a、gypc1_a、flj34208、max.chr1.147790358-147790381、faim2_a、sh2b3、kcnq5、irf4和bcat1(参见表2b;实施例i);
[0425]
·
ncor2、celf2_a、palld、prdm14、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、maml3_a、ski、gprin1_a、ski、bcl2l11和c2cd4d(参见表4c;实施例i);
[0426]
·
ncor2、palld、prdm14、max.chr1.147790358-147790381、max.chr11.14926602-14926671、dscr6、gprin1_a、cdo1_a、sim2_a、iffo1_a和c2cd4d(参见表5c;实施例i);以及
[0427]
·
bcat1_6015、eps8l2_f、ski、nkx2-6_4159、c1ql3_b、gprin1_b、parp15、oxt_c、sim2_b、dnmt3a_a和celf2_a(参见表8c;实施例ii);
[0428]
2)测量所述dna中的至少一种参考标志物的量;以及
[0429]
3)将在所述dna中测量的所述至少一种甲基化标志基因的量的值计算为在所述dna中测量的所述参考标志基因的量的百分比,其中所述值指示在所述样品中测量的所述至少一种甲基化标志dna的量。
[0430]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0431]
1)通过用亚硫酸氢盐以甲基化特异性方式修饰dna的试剂(例如,甲基化敏感性限制酶、甲基化依赖性限制酶和亚硫酸氢盐试剂)处理人类个体的生物样品中的基因组dna,测量所述生物样品中一种或多种基因的cpg位点的甲基化水平;
[0432]
2)使用一组针对所选择的一种或多种基因的引物扩增经过修饰的基因组dna;以及
[0433]
3)通过甲基化特异性pcr、定量甲基化特异性pcr、甲基化敏感性dna限制酶分析、定量亚硫酸氢盐焦磷酸测序或亚硫酸氢盐基因组测序pcr确定所述cpg位点的甲基化水平;
[0434]
其中所述一种或多种基因选自以下组中的一组:
[0435]
·
parp15、gprin1_a、gypc1_a、flj34208、max.chr1.147790358-147790381、faim2_a、sh2b3、kcnq5、irf4和bcat1(参见表2b;实施例i);
[0436]
·
ncor2、celf2_a、palld、prdm14、max.chr1.147790358-147790381、bcat1、max.chr11.14926602-14926671、maml3_a、ski、gprin1_a、ski、bcl2l11和c2cd4d(参见表4c;实施例i);
[0437]
·
ncor2、palld、prdm14、max.chr1.147790358-147790381、max.chr11.14926602-14926671、dscr6、gprin1_a、cdo1_a、sim2_a、iffo1_a和c2cd4d(参见表5c;实施例i);以及
[0438]
·
bcat1_6015、eps8l2_f、ski、nkx2-6_4159、c1ql3_b、gprin1_b、parp15、oxt_c、sim2_b、dnmt3a_a和celf2_a(参见表8c;实施例ii)。
[0439]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0440]
1)通过用以甲基化特异性方式修饰dna的试剂(例如,其中所述试剂是亚硫酸氢盐试剂、甲基化敏感性限制酶或甲基化依赖性限制酶)处理人类个体的生物样品中的基因组dna,测量所述生物样品中一种或多种基因的甲基化水平,其中所述一种或多种基因选自以
下组中的一组:
[0441]
·
cmtm3_a、atp10a_c、tshz3、zmiz1_b、atp10a_b、elmo1_b、tacc2_a、lrrc4、vim和znf382_a(参见表2c;实施例i);
[0442]
·
ncor2、mt1a_a、kcna3_a、zmiz1_c、tacc2_a、max.chr1.147790358-147790381、bcat1、agrn_b、ski、slc12a8、zmiz1_b、bcl2l11和gata2(参见表4d;实施例i);
[0443]
·
ncor2、palld、tacc2_a、bcat1、agrn_b、ski、slc12a8、zmiz1_b和bcl2l11(参见表5d;实施例i);以及
[0444]
·
bcat1_6015、elmo1_9100、kcna3_7518、kcna3_7320、mdfi_6321、ski、vipr_b、znf382_b、atp10a_e、cmtm3_b、zmiz1_d、src_b、hdgfrp3、tacc2_b、tshz3、lbh、dnmt3a_a(参见表8d;实施例ii);
[0445]
2)使用一组针对所选择的一种或多种基因的引物扩增经过处理的基因组dna;以及
[0446]
3)通过聚合酶链式反应、核酸测序、质谱法、甲基化特异性核酸酶、基于质量的分离以及靶标捕获确定所述一种或多种基因的甲基化水平。
[0447]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0448]
1)测量来自样品的dna中至少一种甲基化标志基因的量,其中所述一种或多种基因选自以下组中的一组:
[0449]
·
cmtm3_a、atp10a_c、tshz3、zmiz1_b、atp10a_b、elmo1_b、tacc2_a、lrrc4、vim和znf382_a(参见表2c;实施例i);
[0450]
·
ncor2、mt1a_a、kcna3_a、zmiz1_c、tacc2_a、max.chr1.147790358-147790381、bcat1、agrn_b、ski、slc12a8、zmiz1_b、bcl2l11和gata2(参见表4d;实施例i);
[0451]
·
ncor2、palld、tacc2_a、bcat1、agrn_b、ski、slc12a8、zmiz1_b和bcl2l11(参见表5d;实施例i);以及
[0452]
·
bcat1_6015、elmo1_9100、kcna3_7518、kcna3_7320、mdfi_6321、ski、vipr_b、znf382_b、atp10a_e、cmtm3_b、zmiz1_d、src_b、hdgfrp3、tacc2_b、tshz3、lbh、dnmt3a_a(参见表8d;实施例ii);
[0453]
2)测量所述dna中的至少一种参考标志物的量;以及
[0454]
3)将在所述dna中测量的所述至少一种甲基化标志基因的量的值计算为在所述dna中测量的所述参考标志基因的量的百分比,其中所述值指示在所述样品中测量的所述至少一种甲基化标志dna的量。
[0455]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0456]
1)通过用亚硫酸氢盐以甲基化特异性方式修饰dna的试剂(例如,甲基化敏感性限制酶、甲基化依赖性限制酶和亚硫酸氢盐试剂)处理人类个体的生物样品中的基因组dna,测量所述生物样品中一种或多种基因的cpg位点的甲基化水平;
[0457]
2)使用一组针对所选择的一种或多种基因的引物扩增经过修饰的基因组dna;以及
[0458]
3)通过甲基化特异性pcr、定量甲基化特异性pcr、甲基化敏感性dna限制酶分析、定量亚硫酸氢盐焦磷酸测序或亚硫酸氢盐基因组测序pcr确定所述cpg位点的甲基化水平;
[0459]
其中所述一种或多种基因选自以下组中的一组:
[0460]
·
cmtm3_a、atp10a_c、tshz3、zmiz1_b、atp10a_b、elmo1_b、tacc2_a、lrrc4、vim和znf382_a(参见表2c;实施例i);
[0461]
·
ncor2、mt1a_a、kcna3_a、zmiz1_c、tacc2_a、max.chr1.147790358-147790381、bcat1、agrn_b、ski、slc12a8、zmiz1_b、bcl2l11和gata2(参见表4d;实施例i);
[0462]
·
ncor2、palld、tacc2_a、bcat1、agrn_b、ski、slc12a8、zmiz1_b和bcl2l11(参见表5d;实施例i);以及
[0463]
·
bcat1_6015、elmo1_9100、kcna3_7518、kcna3_7320、mdfi_6321、ski、vipr_b、znf382_b、atp10a_e、cmtm3_b、zmiz1_d、src_b、hdgfrp3、tacc2_b、tshz3、lbh、dnmt3a_a(参见表8d;实施例ii)。
[0464]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0465]
1)通过用以甲基化特异性方式修饰dna的试剂(例如,其中所述试剂是亚硫酸氢盐试剂、甲基化敏感性限制酶或甲基化依赖性限制酶)处理人类个体的生物样品中的基因组dna,测量所述生物样品中一种或多种基因的甲基化水平,其中所述一种或多种基因选自以下组中的一组:
[0466]
·
max.chr1.147790358-147790381、maml3、nr2f6、dnmt3a_a、ski、sobp、ubtf、agrn_c、max.chr12.30975740-30975780和capn2_a(参见表2d;实施例i);
[0467]
·
palld、prdm14、max.chr1.147790358-147790381、capn2_a、max.chr6.10382190-10382225、ski、nr2f6、iffo1_a、mt1a_b、iffo1_b、gdf6和c2cd4d(参见表4e;实施例i);
[0468]
·
ncor2、max.chr1.147790358-147790381、max.chr6.10382190-10382225、iffo1_a、gdf6和c2cd4d(参见表5a;实施例i);以及
[0469]
·
ski、pear1_b、capn2_b、sim2_b、dnmt3a_a、cdo1_a和nr2f6(参见表8e;实施例ii);
[0470]
2)使用一组针对所选择的一种或多种基因的引物扩增经过处理的基因组dna;以及
[0471]
3)通过聚合酶链式反应、核酸测序、质谱法、甲基化特异性核酸酶、基于质量的分离以及靶标捕获确定所述一种或多种基因的甲基化水平。
[0472]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0473]
1)测量来自样品的dna中至少一种甲基化标志基因的量,其中所述一种或多种基因选自以下组中的一组:
[0474]
·
max.chr1.147790358-147790381、maml3、nr2f6、dnmt3a_a、ski、sobp、ubtf、agrn_c、max.chr12.30975740-30975780和capn2_a(参见表2d;实施例i);
[0475]
·
palld、prdm14、max.chr1.147790358-147790381、capn2_a、max.chr6.10382190-10382225、ski、nr2f6、iffo1_a、mt1a_b、iffo1_b、gdf6和c2cd4d(参见表4e;实施例i);
[0476]
·
ncor2、max.chr1.147790358-147790381、max.chr6.10382190-10382225、iffo1_a、gdf6和c2cd4d(参见表5a;实施例i);以及
[0477]
·
ski、pear1_b、capn2_b、sim2_b、dnmt3a_a、cdo1_a和nr2f6(参见表8e;实施例ii);
[0478]
2)测量所述dna中的至少一种参考标志物的量;以及
[0479]
3)将在所述dna中测量的所述至少一种甲基化标志基因的量的值计算为在所述dna中测量的所述参考标志基因的量的百分比,其中所述值指示在所述样品中测量的所述至少一种甲基化标志dna的量。
[0480]
在这项技术的一些实施方案中,提供了包括以下步骤的方法:
[0481]
1)通过用亚硫酸氢盐以甲基化特异性方式修饰dna的试剂(例如,甲基化敏感性限制酶、甲基化依赖性限制酶和亚硫酸氢盐试剂)处理人类个体的生物样品中的基因组dna,测量所述生物样品中一种或多种基因的cpg位点的甲基化水平;
[0482]
2)使用一组针对所选择的一种或多种基因的引物扩增经过修饰的基因组dna;以及
[0483]
3)通过甲基化特异性pcr、定量甲基化特异性pcr、甲基化敏感性dna限制酶分析、定量亚硫酸氢盐焦磷酸测序或亚硫酸氢盐基因组测序pcr确定所述cpg位点的甲基化水平;
[0484]
其中所述一种或多种基因选自以下组中的一组:
[0485]
·
max.chr1.147790358-147790381、maml3、nr2f6、dnmt3a_a、ski、sobp、ubtf、agrn_c、max.chr12.30975740-30975780和capn2_a(参见表2d;实施例i);
[0486]
·
palld、prdm14、max.chr1.147790358-147790381、capn2_a、max.chr6.10382190-10382225、ski、nr2f6、iffo1_a、mt1a_b、iffo1_b、gdf6和c2cd4d(参见表4e;实施例i);
[0487]
·
ncor2、max.chr1.147790358-147790381、max.chr6.10382190-10382225、iffo1_a、gdf6和c2cd4d(参见表5a;实施例i);以及
[0488]
·
ski、pear1_b、capn2_b、sim2_b、dnmt3a_a、cdo1_a和nr2f6(参见表8e;实施例ii)。
[0489]
在任何此类方法中,确定任何此类标志物的甲基化水平是使用表1c或6b中列举的引物完成的。
[0490]
优选地,这类方法的灵敏度为约70%至约100%,或约80%至约90%,或约80%至约85%。优选地,特异性为约70%至约100%,或约80%至约90%,或约80%至约85%。
[0491]
基因组dna可以通过任何方式分离,包括使用市售试剂盒。简单地说,当感兴趣的dna被细胞膜包裹时,生物样品必须通过酶促、化学或机械方式进行破坏和溶解。然后可以例如通过用蛋白酶k消化来清除dna溶液中的蛋白质和其它污染物。然后从溶液中回收基因组dna。这可以通过多种方法进行,包括盐析、有机萃取或将dna结合到固相载体上。方法的选择将受到几种因素的影响,包括时间、费用和所需的dna数量。包含赘生物或肿瘤发生前物质的所有临床样品类型都适用于本发明的方法,例如细胞系、组织切片、活检、石蜡包埋组织、体液、粪便、卵巢组织、结肠流出物、尿液、血浆、血清、全血、分离的血细胞、从血液中分离的细胞以及它们的组合。
[0492]
这项技术不限于用于制备样品和提供用于测试的核酸的方法。例如,在一些实施方案中,使用直接基因捕获,例如,如美国专利申请序列号61/485386中所详述,或通过相关方法,从粪便样品或血液或血浆样品中分离dna。
[0493]
然后用至少一种试剂或一系列试剂处理基因组dna样品,所述试剂区分包含dmr(例如dmr 1-560,如表1a和6a所提供)的至少一种标志物内的甲基化与未甲基化的cpg二核
苷酸。
[0494]
在一些实施方案中,试剂将在5'-位置未甲基化的胞嘧啶碱基转化为尿嘧啶、胸腺嘧啶或在杂交行为方面与胞嘧啶不同的另一碱基。然而,在一些实施方案中,试剂可以是甲基化敏感性限制酶。
[0495]
在一些实施方案中,基因组dna样品通过如下方式进行处理,使得将在5'-位置未甲基化的胞嘧啶碱基转化为尿嘧啶、胸腺嘧啶或在杂交行为方面与胞嘧啶不同的另一碱基。在一些实施方案中,这种处理是用亚硫酸氢盐(亚硫酸氢盐、亚硫酸氢盐),然后碱水解进行的。
[0496]
然后分析处理过的核酸以确定靶基因序列(来自包含dmr,例如至少一种选自dmr 1-560(例如,如表1a和6a中提供)的dmr的标志物的至少一种基因、基因组序列或核苷酸)的甲基化状态。分析方法可选自本领域已知的那些,包括本文所列的那些,例如本文所述的quarts和msp。
[0497]
异常甲基化,更具体地,包含dmr(例如,dmr 1-560,例如,如表1a和6a所提供)的标志物的高甲基化与卵巢癌相关。
[0498]
这项技术涉及与卵巢癌相关的任何样品的分析。例如,在一些实施方案中,样品包含从患者获得的组织和/或生物流体。在一些实施方案中,样品包含分泌物。在一些实施方案中,样品包含血液、血清、血浆、胃分泌物、胰液、胃肠活检样品、来自卵巢组织活检的显微解剖细胞和/或从粪便中回收的细胞。在一些实施方案中,样品包含卵巢组织。在一些实施方案中,受试者是人。样品可以包括来自卵巢、乳房、肝脏、胆管、胰腺、胃、结肠、直肠、食道、小肠、阑尾、十二指肠、息肉、胆囊、肛门和/或腹膜的细胞、分泌物或组织。在一些实施方案中,样品包含细胞液、腹水、尿液、粪便、胰液、在内窥镜检查期间获得的流体、血液、粘液或唾液。在一些实施方案中,样品是粪便样品。
[0499]
这类样品可以通过本领域已知的,例如熟练技术人员显而易见的多种方法获得。例如,尿液和粪便样品很容易获得,而血液、腹水、血清或胰液样品可以通过使用例如针头和注射器以肠胃外方式获得。可以通过使样品经受本领域技术人员已知的各种技术,包括但不限于离心和过滤来获得无细胞或基本上无细胞的样品。尽管通常优选不使用侵入性技术来获得样品,但获得样品例如组织匀浆、组织切片和活检标本仍可能是优选的。
[0500]
在一些实施方案中,这项技术涉及一种治疗患者(例如,患有卵巢癌的患者)(例如,患有透明细胞oc、子宫内膜样oc、粘液性oc、浆液性oc的患者)的方法,该方法包括确定如本文提供的一种或多种dmr的甲基化状态并基于确定甲基化状态的结果对患者进行治疗。治疗可以是施用药物化合物、疫苗、进行手术、对患者进行成像、进行另一测试。优选地,所述使用是在临床筛查方法、预后评估方法、监测疗法结果的方法、鉴定最可能对特定治疗性治疗有反应的患者的方法、对患者或受试者进行成像的方法以及药物筛查和开发的方法中。
[0501]
在这项技术的一些实施方案中,提供了一种用于诊断受试者中的卵巢癌的方法。如本文所用,术语“诊断(diagnosing)”和“诊断(diagnosis)”是指熟练技术人员可以估计甚至确定受试者是否患有给定疾病或疾患或将来是否可能显现给定疾病或疾患的方法。熟练技术人员通常基于一种或多种诊断指标做出诊断,所述诊断指标例如生物标志物(例如,如本文公开的dmr),其甲基化状态指示疾患存在、严重性或不存在。
[0502]
连同诊断一起,临床癌症预后涉及确定癌症的侵袭性和肿瘤复发的可能性,以规划最有效的疗法。如果可以做出更准确的预后,或者甚至可以评估显现癌症的潜在风险,则可以为患者选择适当的疗法,在某些情况下,可以选择不太严重的疗法。癌症生物标志物的评估(例如,确定甲基化状态)可用于将不需要疗法或需要有限疗法的具有良好预后和/或显现癌症风险低的受试者与更可能显现癌症或遭受癌症复发的受益于更深入的治疗的受试者分开。
[0503]
因此,如本文所用,“做出诊断”或“诊断”还包括确定显现癌症的风险或确定预后,这可以基于本文公开的诊断生物标志物(例如,dmr)的测量预测临床结果(有或没有医学治疗)、选择适当的治疗(或治疗是否有效)或监测当前治疗并可能改变治疗。此外,在本公开主题的一些实施方案中,可以随时间对生物标志物进行多次测定以促进诊断和/或预后。生物标志物的时间变化可用于预测临床结果、监测卵巢癌的进展和/或监测针对癌症的适当疗法的功效。例如,在这样的实施方案中,可能期望在有效疗法过程期间的时间内看到生物样品中的一种或多种本文公开的生物标志物(例如dmr)(以及可能的一种或多种额外生物标志物,如果被监测)的甲基化状态的变化。
[0504]
在一些实施方案中,本发明公开的主题还提供了一种用于确定是否在受试者中开始或继续癌症的预防或治疗的方法。在一些实施方案中,该方法包括在一段时间内提供来自受试者的一系列生物样品;分析该系列生物样品以确定每个生物样品中至少一种本文公开的生物标志物的甲基化状态;以及比较每个生物样品中一种或多种生物标志物的甲基化状态的任何可测量变化。一段时间内生物标志物甲基化状态的任何变化都可用于预测显现癌症的风险、预测临床结果、确定是否开始或继续癌症的预防或疗法,以及当前疗法是否有效治疗癌症。例如,可以在开始治疗之前选择第一时间点并且可以在开始治疗之后的某个时间选择第二时间点。甲基化状态可以在取自不同时间点的每个样品中测量,并记录定性和/或定量差异。来自不同样品的生物标志物水平的甲基化状态的变化可与受试者中的卵巢癌风险、预后、确定治疗功效和/或癌症进展相关。
[0505]
在优选的实施方案中,本发明的方法和组合物用于在早期阶段,例如在疾病症状出现之前治疗或诊断疾病。在一些实施方案中,本发明的方法和组合物用于在临床阶段治疗或诊断疾病。
[0506]
如所述,在一些实施方案中,可以对一种或多种诊断或预后生物标志物进行多次测定,并且可以使用标志物的时间变化来确定诊断或预后。例如,可以在初始时间确定诊断标志物,并在第二时间再次确定。在这样的实施方案中,标志物从初始时间到第二时间的增加可以诊断癌症的特定类型或严重程度,或给定的预后。同样,标志物从初始时间到第二时间的减少可以指示癌症的特定类型或严重程度,或给定的预后。此外,一种或多种标志物的变化程度可能与癌症的严重程度和未来的不良事件有关。技术人员将理解,虽然在某些实施方案中可以在多个时间点对相同的生物标志物进行比较测量,但也可以在一个时间点测量给定的生物标志物,并在第二个时间点测量第二种生物标志物,并且比较这些标志物可以提供诊断信息。
[0507]
如本文所用,短语“确定预后”是指熟练技术人员可以预测受试者的疾患的进程或结果的方法。术语“预后”并不是指能够以100%的准确度预测疾患的进程或结果,甚至不是基于生物标志物(例如dmr)的甲基化状态大概预测给定的进程或结果发生的可能性。相反,
熟练技术人员会理解,术语“预后”是指某个过程或结果发生的可能性增加;也就是说,与未表现出给定疾患的那些个体相比,表现出疾患的受试者更可能发生过程或结果。例如,在未表现出疾患(例如,具有一种或多种dmr的正常甲基化状态)的个体中,给定结果(例如,患有卵巢癌)的机会可能非常低。
[0508]
在一些实施方案中,统计分析将预后指标与不利结果的倾向相关联。例如,在一些实施方案中,与从未患癌症的患者获得的正常对照样品中的甲基化状态不同的甲基化状态可以表示受试者比水平更类似于对照样品中的甲基化状态的受试者更可能患上癌症,如由统计显著性水平确定。此外,甲基化状态相对于基线(例如,“正常”)水平的变化可以反映受试者的预后,并且甲基化状态的变化程度可以与不良事件的严重程度相关。通常通过比较两个或更多个群体并确定置信区间和/或p值来确定统计显著性。参见例如dowdy和wearden,statistics for research,john wiley&sons,new york,1983,以引用的方式整体并入本文中。本发明主题的示例性置信区间为90%、95%、97.5%、98%、99%、99.5%、99.9%和99.99%,而示例性p值为0.1、0.05、0.025、0.02、0.01、0.005、0.001和0.0001。
[0509]
在其它实施方案中,可以建立本文公开的预后或诊断生物标志物(例如,dmr)的甲基化状态变化的阈值程度,并且简单地比较生物样品中生物标志物的甲基化状态变化程度与甲基化状态变化的阈值程度。本文提供的生物标志物的甲基化状态的优选阈值变化为约5%、约10%、约15%、约20%、约25%、约30%、约50%、约75%、约100%和约150%。在其它实施方案中,可以建立“列线图”,通过该“列线图”,预后或诊断指标(生物标志物或生物标志物的组合)的甲基化状态与给定结果的相关倾向直接相关。熟练技术人员熟悉使用这类列线图来关联两个数值,并理解该测量中的不确定度与标志物浓度中的不确定度相同,因为参考的是单个样品测量值,而不是总体平均值。
[0510]
在一些实施方案中,对照样品与生物样品同时分析,使得从生物样品获得的结果可以与从对照样品获得的结果进行比较。此外,预期可提供标准曲线,生物样品的测定结果可与之进行比较。如果使用荧光标记,则这类标准曲线将生物标志物的甲基化状态呈现为测定单位的函数,例如荧光信号强度。使用取自多个供体的样品,可以提供正常组织中一种或多种生物标志物的对照甲基化状态,以及取自具有化生的供体或患有卵巢癌的供体的组织中一种或多种生物标志物的“风险”水平的标准曲线。在该方法的某些实施方案中,在从受试者获得的生物样品中鉴定本文提供的一种或多种dmr的异常甲基化状态后,受试者被鉴定为具有化生。在该方法的其它实施方案中,在从受试者获得的生物样品中检测到一种或多种这类生物标志物的异常甲基化状态引起该受试者被鉴定为患有癌症。
[0511]
标志物的分析可以单独或与一个测试样品中的另外的标志物同时进行。例如,可以将几种标志物组合到一个测试中以有效处理多个样品并潜在地提供更高的诊断和/或预后准确性。此外,本领域技术人员会认识到测试来自同一受试者的多个样品(例如,在连续时间点)的价值。这类系列样品测试可以鉴定标志物甲基化状态随时间的变化。甲基化状态的变化以及甲基化状态没有变化可以提供有关疾病状态的有用信息,包括但不限于鉴定事件发生的大致时间、可挽救组织的存在和数量、药物疗法的适当性、各种疗法的有效性以及对受试者结果的鉴定,包括未来事件的风险。
[0512]
生物标志物的分析可以呈多种物理格式进行。例如,可以使用微量滴定板或自动化来促进大量测试样品的处理。可替代地,可以开发单一样品格式以促进以及时方式进行
即刻治疗和诊断,例如在非卧床运输或急诊室环境中。
[0513]
在一些实施方案中,如果与对照甲基化状态相比,样品中至少一种生物标志物的甲基化状态存在可测量的差异,则受试者被诊断为患有卵巢癌。相反,当在生物样品中未鉴定出甲基化状态的变化时,可以鉴定受试者为未患卵巢癌、没有患癌症的风险或具有低的患癌症的风险。在这点上,患有癌症或其风险的受试者可以与患有低至基本上没有癌症或其风险的受试者相区分。那些有显现卵巢癌风险的受试者可以进行更密集和/或定期的筛查计划,包括内窥镜监测。另一方面,那些具有低至基本上没有风险的受试者可以避免接受额外的卵巢癌测试(例如,侵入性程序),直到例如未来的筛查,例如根据本发明的技术进行的筛查表明在那些受试者中出现了卵巢癌风险的时间。
[0514]
如上所述,根据本发明的技术方法的实施方案,检测一种或多种生物标志物的甲基化状态的变化可以是定性测定,也可以是定量测定。因此,将受试者诊断为患有卵巢癌或有显现卵巢癌风险的步骤表明进行了某些阈值测量,例如,生物样品中一种或多种生物标志物的甲基化状态不同于预定的对照甲基化状态。在该方法的一些实施方案中,对照甲基化状态是生物标志物的任何可检测的甲基化状态。在对照样品与生物样品同时测试的方法的其它实施方案中,预定甲基化状态是对照样品中的甲基化状态。在该方法的其它实施方案中,预定甲基化状态基于标准曲线和/或由标准曲线鉴定。在该方法的其它实施方案中,预定甲基化状态是特定状态或状态范围。因此,可以在本领域技术人员显而易见的可接受限度内,部分地基于所实践的方法的实施方案和期望的特异性等来选择预定甲基化状态。
[0515]
进一步关于诊断方法,优选的受试者是脊椎动物受试者。优选的脊椎动物是温血动物;优选的温血脊椎动物是哺乳动物。优选的哺乳动物最优选是人。如本文所用,术语“受试者”包括人和动物受试者。因此,本文提供了兽医治疗用途。因此,本发明的技术提供了对哺乳动物(例如人类)以及以下动物的诊断:那些因濒危而重要的哺乳动物(例如东北虎);具有经济重要性的动物,例如在农场饲养供人类食用的动物;和/或对人类具有社会重要性的动物,例如作为宠物或在动物园饲养的动物。这种动物的实例包括但不限于:食肉动物,例如猫和狗;猪科动物,包括猪、肉猪和野猪;反刍动物和/或有蹄类动物,如牛、公牛、绵羊、长颈鹿、鹿、山羊、野牛和骆驼;和马。因此,还提供了家畜的诊断和治疗,包括但不限于家养猪、反刍动物、有蹄类动物、马(包括赛马)等。
[0516]
本发明公开的主题还包括用于诊断受试者中的卵巢癌和/或特定形式的卵巢癌(例如,透明细胞oc、子宫内膜样ec、粘液性oc、浆液性ec)的系统。例如,该系统可作为市售试剂盒提供,该试剂盒可用于筛查已收集生物样品的受试者患卵巢癌的风险或诊断其患卵巢癌。根据本发明的技术提供的示例性系统包括评估如表1a和6a中提供的dmr的甲基化状态。
[0517]
实施例
[0518]
实施例i.
[0519]
组织和血液从mayo clinic生物样本库获得,并接受机构irb监督。样本的选择严格遵守主题研究授权和纳入/排除标准。癌症亚型包括1)浆液性oc,2)透明细胞oc,3)粘液性oc,和4)子宫内膜样oc。对照物包括非赘生物输卵管组织和全血来源的白细胞。对组织进行宏观解剖并由专门的妇科学病理学家审查组织学。样品经过年龄匹配,随机化并且是盲样。分别使用qiaamp dna tissue mini试剂盒和qiaamp dna blood mini试剂盒(qiagen,
valencia ca)纯化来自77个冷冻组织(18个浆液性oc、15个透明细胞oc、6个粘液性oc、18个子宫内膜样oc、6个良性输卵管、14个良性输卵管刷取物)和19个无癌女性的血沉棕黄层的样品dna。dna用ampure xp珠(beckman-coulter,brea ca)再纯化,并通过picogreen(thermo-fisher,waltham ma)定量。使用qpcr评估dna完整性。还对4个卵巢癌细胞系进行测序(tov21g、skov3、ovcar3、caov3)。
[0520]
rrbs测序文库是按照meissner协议(gu等人nature protocols 2011年4月;6(4):468-81)并经过修改制备的。样品以4重形式合并,并通过mayo genomics facility在illumina hiseq 2500仪器(illumina,san diego ca)上进行测序。读数由illumina管道模块处理,用于图像分析和碱基判读。使用mayo开发的生物信息学套件saap-rrbs进行二次分析。简单地说,使用trim-galore清理读数,并与使用bsmap构建的grch37/hg19参考基因组比对。对于覆盖率≥10x并且碱基质量得分≥20的cpg,甲基化比率通过计算c/(c+t)或对于映射到反向链的读数,相反地,计算g/(g+a)来确定。
[0521]
单个cpg按高甲基化比率排序,即给定基因座的甲基化胞嘧啶数量占该基因座总胞嘧啶计数的比率。对于病例,要求比率≥0.20(20%);对于组织对照,≤0.05(5%);对于血沉棕黄层对照,≤0.01(1%)。不符合这些标准的cpg被丢弃。随后,候选cpg通过基因组定位被分入dmr(差异甲基化区域),范围在大约60-200bp,每个区域的最小截止值为5个cpg。cpg密度过高(》30%)的dmr被排除在外,以避免在验证阶段出现gc相关的扩增问题。对于每个候选区域,创建了一个2d矩阵,它针对病例和对照物,以样品间的方式对单个cpg进行比较。分析总体oc与所有良性卵巢组织和/或无癌血沉棕黄层,以及亚型比较。然后将这些cpg矩阵与参考序列进行比较,以评估在初始过滤过程中是否丢弃了基因组连续的甲基化位点。从这个区域子集中,最终选择要求在每个样品水平上跨dmr序列的单个cpg协调和连续的高甲基化(在病例下)。相反,对照样品的甲基化程度必须至少比病例低10倍,并且cpg模式必须更加随机且不那么协调。要求亚型队列中至少10%的癌症样品对dmr内的每个cpg位点具有至少50%的高甲基化比率。
[0522]
在单独的分析中,利用专有的dmr鉴定管道和回归包,根据cpg的平均甲基化值推导出dmr。比较oc病例、组织对照和血沉棕黄层对照之间平均甲基化百分比的差异;每个映射的cpg的100个碱基对内的平铺阅读框用于鉴定对照甲基化《5%的dmr;仅当覆盖的总深度为每个受试者平均10个读数并且亚组间的差异》0时才分析dmr。假设比值比的生物学相关增加》3x并且覆盖深度为10个读数,在双侧检验中,在5%的显著性水平和假设二项式方差膨胀因子为1下,每组需要≥18个样品才能达到80%的功效。
[0523]
回归后,dmr按p值、接受者操作特征曲线下面积(auc)和病例与所有对照之间的变化倍数差异排序。由于事先计划了独立验证,因此在此阶段没有对错误发现进行调整。
[0524]
使用样品制备、测序、分析管道和过滤器的专有方法来鉴定差异甲基化区域(dmr)并将其缩小到那些可以精确定位这些妇科癌症并在临床测试环境中表现出色的dmr。从组织到组织分析,鉴定了471个高甲基化卵巢癌(oc)dmr(表1a和1b)。它们包括oc特定区域、oc亚型特定区域以及针对更通用癌症谱的那些区域。表2a、2b、2c和2d中列出了排名最高的亚型dmr。组织对白细胞(血沉棕黄层)分析产生了55个高甲基化卵巢组织dmr,其中wbc中的噪音小于1%(表1a和1b中所示的dmr 472-525)。表3中列出了最高的总体血沉棕黄层dmr。从组织和血沉棕黄层标志物组中,选择了68种候选标志物作为初始试点。开发了甲基化特异
性pcr测定并在两轮组织样品上进行了测试;那些被测序的样品(冷冻)和更大的独立队列(ffpe)。短扩增子引物(《150bp)被设计成靶向dmr中最具辨别力的cpg,并在对照物上进行测试以确保完全甲基化的片段以线性方式稳健地扩增;而未甲基化和/或未转化的片段不会扩增。表1c中列出了136个引物序列。最终,进行了54个测定(14个测定未能通过qc并被放弃)。
[0525]
对阶段一验证的结果进行逻辑分析以确定auc和变化倍数。从以前的工作中认识到,器官内癌症亚型的表观遗传学不同,并且最好的组来自亚型标志物的组合。组织和血沉棕黄层对照的分析是分开进行的。结果在表4a、4b、4c、4d和4e中突出显示。许多测定对oc与血沉棕黄层样品具有100%的辨别率,并且在oc与良性输卵管比较中辨别率接近100%。
[0526]
这些结果为用于独立样品测试的高性能候选者提供了丰富的来源。在最初的54个测定中,选择33个。大多数都在0.90-1.00的auc范围内,但包括具有极高fc数(非常少的背景)的其它mdm和/或表现出与其它甲基化dna标志物(mdm)的互补性的那些mdm。所有测定都展示了高分析性能-线性、效率、序列特异性(使用熔化曲线分析评估)和强扩增。
[0527]
在第2轮验证中,与上一步一样,整个样品和标志物组在一个批次中运行。每种标志物运行约10ng ffpe来源的样品dna-总共350种。表5a、5b、5c和5d中列出了oc亚型对比正常组织和血沉棕黄层的个别mdm结果。与对照物相比,多种mdm在所有oc组织学中都显示出显著的甲基化变化倍数(10至》1000)。
[0528]
数据以热矩阵格式绘制,允许互补性可视化。交叉验证的2-mdm图源自于rpart模拟(c2cd4d、ncor2),其以99%特异性和97%灵敏度区分总体oc与良性输卵管组织。亚型rpart和随机森林模拟在所有组织学中产生了完美的区分(auc=1)。
[0529]
全甲基化组测序、严格的过滤标准和生物学验证得出针对卵巢癌的出色候选mdm。一些mdm以相对较高的灵敏度区分所有oc组织学与对照物,而另一些则准确地区分组织学。鉴于高鉴别性和易于测定,此类mdm值得进一步探索作为早期检测标志物的临床应用。
[0530]
表1a提供了dmr信息,包括此类标志物的染色体编号、基因注释和dmr起始/终止位置。表1b提供了p值、接受者操作特征曲线下面积(auc)和oc病例与所有对照物之间的变化倍数差异。表1c提供了表1a和1b中提供的各种标志物的引物序列信息。
[0531]
表1a.
[0532]
[0533]
[0534]
[0535]
[0536]
[0537]
[0538]
[0539]
[0540]
[0541]
[0542]
[0543][0544]
表1b.
[0545]
[0546]
[0547]
[0548]
[0549]
[0550]
[0551]
[0552]
[0553]
[0554]
[0555]
[0556][0557]
表1c.
[0558]
[0559]
[0560]
[0561]
[0562]
[0563][0564]
选择dmr的一个子集进行进一步开发。标准主要是逻辑推导的roc曲线下面积度量,它提供了对该区域辨别潜力的性能评估。选择0.85的auc作为截止值。此外,计算甲基化变化倍数比(平均癌症高甲基化比率/平均对照高甲基化比率),组织与组织比较采用下限10,并且组织与血沉棕黄层比较采用下限20。要求p值小于0.01。dmr必须在平均和单个cpg选择过程中列出。使用methprimer(li lc和dahiya r.bioinformatics 2002年11月;18(11):1427-31)为候选区域设计定量甲基化特异性pcr(qmsp)引物,并且对20ng(6250当量)的阳性和阴性基因组甲基化对照进行qc检查。测试多个退火温度以获得最佳辨别。在qmsp的两个阶段中进行验证。第一个阶段由重新测试已测序的dna样品组成。这样做是为了验证dmr是真正具有辨别力的,而不是过度拟合极大的下一代数据集的结果。第二个阶段使用了更大的独立样品集(浆液性oc-36个样品;透明细胞oc-21个样品;粘液性oc-14个样品;子宫
内膜样oc-23个样品;对照输卵管良性-29个样品;对照血沉棕黄层-28个样品)。
[0565]
组织像以前一样通过专家临床和病理审查进行鉴定。如前所述进行dna纯化。ez-96dna甲基化试剂盒(zymo research,irvine ca)用于亚硫酸氢盐转化步骤。在roche 480 lightcyclers(roche,basel switzerland)上使用sybr green检测扩增10ng转化的dna(每种标志物)。连续稀释的通用甲基化基因组dna(zymo research)用作定量标准。cpg不可知的actb(β-肌动蛋白)测定用作输入参考和标准化对照。结果表示为甲基化拷贝(特定标志物)/actb拷贝。
[0566]
对单个mdm(甲基化dna标志物)性能的结果进行逻辑分析。对于标志物的组合,使用两种技术。首先,将rpart技术应用于整个mdm集并仅限于3种mdm的组合,在此基础上计算出rpart预测的癌症概率。第二种方法使用随机森林回归(rforest),它生成500个单独的rpart模型,这些模型与原始数据的boot strap样品拟合(大约2/3数据用于训练)并用于估计整个mdm组的交叉验证误差(1/3数据用于测试),并重复500次,以避免低估或高估真实交叉验证度量的虚假分离。然后将结果在500次迭代中取平均值。
[0567]
表2a示出了区分透明细胞oc组织与血沉棕黄层对照和对照输卵管组织的十个甲基化区域(对照血沉棕黄层、对照输卵管组织和透明细胞oc组织的甲基化百分比)(auc和透明细胞组织甲基化%与对照输卵管甲基化%之间的p值)。
[0568]
表2a.区分透明细胞oc组织与血沉棕黄层对照、对照输卵管组织、透明细胞卵巢癌组织的十个甲基化区域。
[0569][0570]
表2b示出了区分子宫内膜样oc组织与血沉棕黄层对照和对照输卵管组织的十个甲基化区域(对照血沉棕黄层、对照输卵管组织和子宫内膜样oc组织的甲基化百分比)(auc和子宫内膜样组织甲基化%与对照输卵管甲基化%之间的p值)。
[0571]
表2b.区分子宫内膜样oc组织与血沉棕黄层对照、对照输卵管组织、子宫内膜样卵巢癌组织的十个甲基化区域。
[0572][0573]
表2c示出了区分粘液性oc组织与血沉棕黄层对照和对照输卵管组织的十个甲基化区域(对照血沉棕黄层、对照输卵管组织和粘液性oc组织的甲基化百分比)(auc和粘液性组织甲基化%与对照输卵管甲基化%之间的p值)。
[0574]
表2c.区分粘液性oc组织与血沉棕黄层对照、对照输卵管组织和粘液性卵巢癌组织的十个甲基化区域。
[0575][0576]
表2d示出了区分浆液性oc组织与血沉棕黄层对照和对照输卵管组织的十个甲基化区域(对照血沉棕黄层、对照输卵管组织和浆液性oc组织的甲基化百分比)(auc和浆液性组织甲基化%与对照输卵管甲基化%之间的p值)。
[0577]
表2d.区分浆液性oc组织与血沉棕黄层对照、对照输卵管组织、卵巢癌组织的十个甲基化区域。
[0578][0579][0580]
表3示出了区分oc组织与血沉棕黄层对照的前10个甲基化区域(提供了oc与对照血沉棕黄层之间的甲基化百分比差异;提供了oc与对照输卵管之间的甲基化百分比差异;提供了auc;提供了变化倍数差异;以及提供了p值。
[0581]
表3.
[0582][0583][0584]
表4a-e是初始组织验证的结果,其中从测序数据中选择了超过60个最高的dmr,并设计了qmsp测定。这些dmr在oc组织、透明细胞oc组织、子宫内膜样oc组织、粘液性oc组织、浆液性oc组织和对照输卵管组织上运行。接下来,进行了更大的独立组织验证,其中测试了新的未测试过的病例和对照物(参见表5)。
[0585]
表4a.
[0586]
[0587][0588]
表4b.
[0589]
[0590]
[0591][0592]
表4c.
[0593]
[0594][0595]
表4d.
[0596]
[0597][0598]
表4e.
[0599]
[0600][0601]
表5a示出了表1中区分浆液性oc组织与良性卵巢组织和血沉棕黄层的各种标志物的曲线下面积。
[0602]
表5a.
[0603]
[0604][0605]
表5b示出了表1中区分透明细胞oc组织与良性卵巢组织和血沉棕黄层的各种标志物的曲线下面积。
[0606]
表5b.
[0607]
[0608][0609]
表5c示出了表1中区分子宫内膜样oc组织与良性卵巢组织和血沉棕黄层的各种标志物的曲线下面积。
[0610]
表5c.
[0611]
[0612][0613]
表5d示出了表1中区分粘液性oc组织与良性卵巢组织和血沉棕黄层的各种标志物的曲线下面积。
[0614]
表5d.
[0615]
[0616][0617]
实施例ii.
[0618]
本实施例描述了卵巢癌组织标志物、透明细胞卵巢癌组织标志物、子宫内膜样卵巢癌组织标志物、粘液性卵巢癌组织标志物和浆液性卵巢癌组织标志物的鉴定。
[0619]
通过卵巢组织样品、透明细胞oc组织样品、子宫内膜样oc组织样品、粘液性oc组织样品、浆液性oc组织样品和正常卵巢组织样品的rrbs鉴定用于检测卵巢癌、透明细胞oc、子宫内膜样oc、粘液性oc和浆液性oc的候选甲基化标志物。为了鉴定甲基化dna标志物,每个患者组149个样品(参见表7)进行rrbs过程,然后与经过亚硫酸氢盐转化的人类基因组进行比对。选择卵巢癌、透明细胞oc、子宫内膜样oc、粘液性oc和浆液性oc中相对于正常卵巢组织和血沉棕黄层的甲基化比率高的cpg区域并映射到它们的基因名称。
[0620]
表7.
[0621]
样品类型数目i期ii期iii期iv期正常35nananana癌症57258195
ꢀꢀꢀꢀꢀꢀ
癌症亚型数目i期ii期iii期iv期透明细胞158430子宫内膜样1812330
粘液性64101浆液性1810134
[0622]
通过rrbs选择标志物后,共鉴定出49种甲基化标志物,并设计和订购了富集靶标的长探针定量放大信号测定(通用技术参见例如wo2017/075061和美国专利申请序列号wo2017/075061)。表6a示出了用于49种甲基化标志物的标志物染色体区域。表6b示出了标志物的引物信息和探针信息。图1还提供了用于49种甲基化标志物的标志物染色体区域以及相关的引物和探针信息。
[0623]
表6a.
[0624]
[0625][0626]
表6b.
[0627]
[0628]
[0629]
[0630]
[0631]
[0632]
[0633]
[0634][0635]
每种甲基化标志物的灵敏度以每个亚型的95%截止值计算并列于表8a(卵巢癌)、8b(透明细胞oc)、8c(子宫内膜样oc)、8d(粘液性oc)和8e(浆液性oc)中。表8a-e示出了表6a中所示的标志物针对oc、透明细胞oc、子宫内膜样oc、粘液性和浆液性oc在95%特异性下的卵巢癌和亚型组织灵敏度。
[0636]
表8a.
[0637]
[0638][0639]
表8b.
[0640]
[0641]
[0642][0643]
表8c.
[0644]
[0645][0646]
表8d.
[0647]
[0648][0649]
表8e.
[0650]
[0651][0652]
实施例iii.
[0653]
本实例描述了用于检测卵巢癌(oc)的血浆标志物的鉴定。
[0654]
dna甲基化是癌症发生的早期事件,可以在癌症患者的血浆样品中检测到。在从组织中提取的dna中,实验(在实施例i和ii中描述)首先在组织样品内发现了可辨别oc的甲基化dna标志物(mdm)候选者,然后进行了验证。随后的实验独立测试了患有oc和未患oc的女性的血浆,并鉴定、验证和证明了甲基化dna标志物用于oc血浆检测的临床可行性。
[0655]
为了发现,来自67个冷冻组织(18个高级别浆液性(hgs)、18个子宫内膜样、15个透明细胞(cc)、6个粘液性oc;10个良性输卵管上皮(fte);)和19个无癌女性的血沉棕黄层的dna进行简化代表性亚硫酸氢盐测序(rrbs)以鉴定与oc相关的mdm。候选mdm的选择是基于接受者操作特征(roc)区分、甲基化变化倍数和对照之间的低背景甲基化。使用msp对从来自oc(36个hgs、22个子宫内膜样、21个cc和14个粘液性)和29个fte的独立ffpe组织中提取的dna进行盲法生物验证。使用长探针定量信号测定在新诊断出患有oc的女性和人群抽样的健康女性的独立处理前血浆样品中测试在组织中性能最佳的mdm。进行随机森林建模分析以产生疾病的预测概率;结果是计算机交叉验证的500倍。
[0656]
在rrbs发现和生物验证后,33种mdm在所有oc组织学与fte中显示出显著的甲基化变化倍数(10至》1000)。对91名患有oc(76名(84%)hgs)和91名未患oc的女性的血浆测试前11种mdm(gprin1、cdo1、src、sim2、agrn、faim2、celf2、dscr6、gypc、capn2、bcat1);交叉验证的11-mdm小组高度区分oc与对照组(95%特异性;79%灵敏度和auc 0.91(0.86-0.96))。在hgs中,该小组正确鉴定了83%,包括5/6i/ii期,以及大多数其它亚型(表9)。
[0657]
全甲基化组测序、严格的过滤标准和生物学验证得出针对oc的出色候选mdm,在血浆中表现出有前景的高灵敏度和特异性。
[0658]
表9.
[0659][0660]
使用来自oc患者的66个血浆样品(例如,6个i期oc、3个ii期oc、27个iii期oc、12个iv期oc、18个nd)另外测试了以下标志物mdm,并与237个来自未患oc的患者的对照血浆进行了比较:atp10a(例如,atp10a_a、atp10a_b、atp10a_c、atp10a_d、atp10a_e)、eps8l2(例如,eps8l2_a、eps8l2_b、eps8l2_c、eps8l2_d)、c1ql3(例如,c1ql3_a、c1ql3_b)、faim2(例如,faim2_a、faim2_b)、capn2_b、lbh、cmtm3(例如,cmtm3_a、cmtm3_b)、zmiz1(例如,zmiz1_a、zmiz1_b、zmiz1_c、zmiz1_d)、gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、gp5、dscr6、ski、sim2_a、agrn_8794、bcat1_6015、kcna3_7518、kcna3_7320、loc10013136、gypc_c、src(例如,src_a、src_b)、nr2f6、tshz3、celf2(例如,celf2_a、celf2_b)、tacc2(例如,tacc2_a、tacc2_b)、vipr2(例如,vipr2_a、vipr2_b)和spock2_74333。表10示出了用于检测oc的每种标志物的灵敏度和特异性百分比。
[0661]
表10.
[0662][0663][0664]
随后的实验证明了通过检测以下组合来鉴定oc的临床可行性:1)与正常非癌性水平相比,癌抗原125(ca-125)水平增加,和2)与正常非癌性甲基化水平相比,以下标志物的测量的甲基化水平变化:atp10a(例如,atp10a_a、atp10a_b、atp10a_c、atp10a_d、atp10a_e)、eps8l2(例如,eps8l2_a、eps8l2_b、eps8l2_c、eps8l2_d)、c1ql3(例如,c1ql3_a、c1ql3_b)、faim2(例如,faim2_a、faim2_b)、capn2_b、lbh、cmtm3(例如,cmtm3_a、cmtm3_b)、zmiz1(例如,zmiz1_a、zmiz1_b、zmiz1_c、zmiz1_d)、gprin1(例如,gprin1_a、gprin1_b)、cdo1(例如,cdo1_a、cdo1_b)、gp5、dscr6、ski和sim2_a。
[0665]
使用来自oc患者的66个血浆样品(例如,6个i期oc、3个ii期oc、27个iii期oc、12个iv期oc、18个nd)测试了这类标志物mdm,并与237个来自未患oc的患者的对照血浆进行了比较。还在66个血浆样品和237个对照血浆样品中测量了ca-125的水平。表11示出了mdm检测oc的90%特异性。表12示出了ca-125检测oc的90%特异性。表13示出了mdm和ca-125检测oc的90%特异性。
[0666]
表11.制表
[0667][0668]
表12.制表
[0669][0670][0671]
表13.制表
[0672][0673]
以引用的方式并入
[0674]
本文中所提及的每一个专利文献和科技文章的全部公开内容都出于全部目的以引用的方式并入。
[0675]
等效方案
[0676]
在不脱离本发明的精神或基本特征的情况下,本发明能以其它具体形式来实施。因此,前述实施方案在所有方面都应被视为说明性的,而非是对本文中描述的本发明的限制。因此,本发明的范围是由随附权利要求书而非由上述描述所指示,并且属于权利要求书的等效含义和范围内的所有变化都意图包括在其中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1