Rps14和Foxg1调控内耳干细胞增殖分化方法及其应用
rps14和foxg1调控内耳干细胞增殖分化方法及其应用
技术领域
1.本发明涉及生物技术领域,具体的是rps14和foxg1调控内耳干细胞增殖分化方法及其应用。
背景技术:
2.随着人口老龄化、噪声、病毒感染、耳毒性药物滥用以及环境污染等不良因素的发展和加剧,耳聋及听力障碍人群的数量正逐步上升。耳聋已成为影响社会政治和经济的全球性健康问题,其中感音神经性聋约占耳聋患者的63%。然而,目前临床上尚无疗效确切的内耳靶向性药物可用于治疗感音神经性聋。由于哺乳动物耳蜗毛细胞不可再生,因此如何使毛细胞在损伤后修复和再生,从而在根本上治疗感音神经性聋是近年来听觉领域研究的重点。
3.干细胞是一类具有自我更新和分化潜能的细胞,它包括胚胎干细胞和成体干细胞。目前人类胚胎干细胞已可成功地在体外培养,成体干细胞可以横向分化为其他类型的细胞和组织,为干细胞的广泛应用提供了基础。有研究表明小鼠耳蜗中存在一类lgr5阳性的干细胞,具有分化为毛细胞的潜能,可以作为毛细胞的前体细胞,亦可被认为是潜在的耳蜗干细胞。研究发现,在离体培养中激活wnt信号通路可以促进lgr5阳性细胞的增殖,部分增殖后的lgr5阳性细胞可以分化成毛细胞,这表明耳蜗中lgr5阳性细胞具有再生毛细胞能力,可以作为耳蜗干细胞。
4.fox基因家族是一类转录因子蛋白家族,foxg1是fox家族的一个重要成员,现有的研究表明foxg1是胚胎大脑发育过程中前体细胞增殖、分化的关键调控基因。根据之前文献报道,foxg1在多个信号通路中发挥重要作用,例如在中枢神经系统发育过程中具有重要作用的reelin信号通路中,foxg1主要对接头蛋白dab1的表达进行抑制,从而阻断reelin信号。在端脑腹侧及嗅觉上皮发育的相关研究中发现foxg1与fgf信号通路具有协同作用,一方面foxg1可以诱导fgf8的表达,另一方面fgf信号也可通过akt对foxg1磷酸化将其向胞质输出并发挥作用(igf
‑
1信号通路也是通过这种方式对foxg1进行调控)。shh信号通路与foxg1也存在联系,shh信号主要通过下游效应因子gli对fgf表达调控实现对foxg1的间接影响,另外有文献报道foxg1缺失后也会对shh信号通路的靶基因表达产生影响。在wnt信号通路与foxg1关系的研究中,foxg1主要通过对wnt配体的抑制实现对wnt信号通路的调控。在神经发育过程中,foxg1在特定区域可以对wnt信号通路的进行条件性限制,当wnt配体受到foxg1抑制后,wnt信号通路就会处于非启动状态,干细胞的自我更新也会受到影响。
5.核糖体蛋白s14(rps14)属于核糖体蛋白s11p家族。核糖体是催化蛋白质合成的细胞器,由一个小的40s亚基和一个大的60s亚基组成。这些亚基一起由4种rna种类和大约80种结构不同的蛋白质组成。rps14编码核糖体蛋白,该蛋白是40s亚基的一个组成部分。它位于细胞质中。与编码核糖体蛋白的基因一样,该基因有多个经过加工的伪基因分布在基因组中。研究表明,rps14在卵巢与骨髓等中普遍表达。研究证实,rps14对正常人的红细胞生成至关重要。它的缺乏会导致p53激活,细胞凋亡增加。一些核糖体基因在人类中是密切协
同调控的,rps14单倍性不足导致红细胞中额外的核糖体基因下调。
6.现有技术中,内耳干细胞的分离筛选的难题是很难获得,并且效率低。小鼠耳蜗干细胞主要存在于毛细胞下面的支持细胞中,但并不是所有的支持细胞都是干细胞,只有部分可以具有再生或者分化为毛细胞的潜能,在本身量少的情况下,无法精确并高效的分离获得这些细胞。
技术实现要素:
7.为解决上述背景技术中提到的不足,本发明的目的在于提供rps14和foxg1调控内耳干细胞增殖分化方法及其应用,解决了内耳干细胞无法精确并高效的分离的缺陷。
8.本发明的目的可以通过以下技术方案实现:
9.rps14和foxg1调控内耳干细胞增殖分化方法,包括以下步骤:
10.一、rps14基因对lgr5+内耳干细胞增殖和分化的调控
11.1、oc
‑
1细胞培养
12.将小玻片放入24孔皿中,加1ml ddh2o或pbs,吹洗3遍,紫外照射半小时后进行种细胞,细胞量为200ul/大皿,画“8”字或“十”字分散细胞,置于33℃、5%co2的培养箱中;
13.2、sirna敲除rps14基因
14.采用n299、n196、n462三种不同的sirna敲减oc
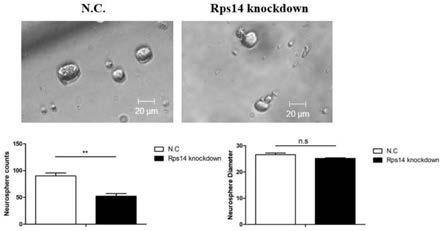
‑
1细胞中的rps14基因;
15.3、lgr5+祖细胞的分离培养及rps14基因敲除
16.消化成单细胞后,采用流式细胞分选技术进行分选,经培养后再rps14基因敲除;
17.4、rps14基因敲除的lgr5+祖细胞生物学效应
18.扫描电子显微镜观察评估lgr5+细胞的增殖能力和分化能力;
19.二、敲除lgr5+祖细胞foxg1对毛细胞增殖的影响
20.通过将lgr5
‑
egfp
‑
creert2小鼠与foxg1
‑
floxp小鼠杂交,在lgr5+祖细胞中有条件地敲除foxg1,向p1的lgr5
‑
egfp
creer/+
foxg1
loxp/loxp
小鼠和lgr5
‑
egfp
creer/+
小鼠腹膜内注射他莫昔芬并于p3解剖耳蜗,然后用胰蛋白酶消化耳蜗,将lgr5+祖细胞进行分选;
21.将分选的lgr5+祖细胞进行体外培养以形成球形,传代到3代,统计实验组和对照组细胞球的数量和大小。
22.进一步地,所述步骤一的步骤1中的dmem基本培养基:dmem 45ml、fbs 5ml、amp 50ul。
23.进一步地,所述步骤一的步骤3中消化成单细胞的方法为:取新生lgr5
‑
egfp小鼠耳蜗放入装有50ul 1
×
pbs的1.5ml ep管中,用50ul 0.25%胰酶
‑
edta在37℃下培养8
‑
12min后消化成单细胞。
24.进一步地,所述步骤一的步骤4通过扫描电子显微镜观察并量化球形的数量和直径来评估lgr5+细胞的增殖能力。
25.进一步地,所述步骤一的步骤4通过apollo,dapi,myosin7a染色后在激光扫描共聚焦显微镜下观察分化情况。
26.rps14和foxg1的应用,将rps14基因和foxg1基因应用在毛细胞再生中。
27.本发明的有益效果:
28.本发明将从foxg1与rps14两个基因调控方面着手研究其对内耳毛细胞再生的作
用,通过将lgr5
‑
egfp
‑
creert2小鼠与foxg1
‑
floxp小鼠杂交,在lgr5+祖细胞中有条件地敲除foxg1,发现lgr5+祖细胞中敲除foxg1能诱导新生小鼠耳蜗产生额外的ihcs。
29.通过oc
‑
1细胞利用不同sirna敲除rps14基因,rt
‑
qpcr检测转染效果;分离培养lgr5+内耳干细胞转染后检测增殖及分化,通过lgr5+干细胞上进行成球分化实验表明敲减rps14基因会抑制干细胞的增殖,对分化无影响。
附图说明
30.下面结合附图对本发明作进一步的说明。
31.图1是本发明rps14基因敲除/敲减对lgr5+内耳干细胞增殖和分化的影响示意图;
32.图2是本发明rps14基因敲除/敲减对lgr5+内耳干细胞再生毛细胞的作用示意图;
33.图3是本发明新生小鼠耳蜗lgr5+祖细胞中foxg1基因敲除对存活到p30的内毛细胞数量影响示意图;
34.图4是本发明探究新生小鼠耳蜗lgr5+祖细胞中foxg1基因敲除后细胞成球能力流程示意图;
35.图5是本发明lgr5
‑
egfp
creer/+
foxg1
loxp/loxp
小鼠和lgr5
‑
egfp
creer/+
小鼠lgr5+祖细胞球体示意图;
36.图6是本发明lgr5
‑
egfp
creer/+
foxg1
loxp/loxp
小鼠和lgr5
‑
egfp
creer/+
小鼠lgr5+祖细胞球体数量和球体直径统计图示意图。
具体实施方式
37.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
38.本发明在于提供一种rps14和foxg1调控内耳干细胞增殖分化方法及其应用,rps14和foxg1调控内耳干细胞增殖分化的方法包括以下步骤:
39.一、通过oc
‑
1细胞利用不同sirna敲除rps14基因,设计编码无义序列的shrna作为阴性对照,用与gfp结合的无义sirna评估转染效率,rt
‑
qpcr检测转染效果;
40.分离培养lgr5+内耳干细胞转染后检测增殖及分化,通过lgr5+干细胞上进行成球分化实验、edu染色实验表明敲减rps14基因会抑制干细胞的增殖,对分化无影响。
41.二、通过将lgr5
‑
egfp
‑
creert2小鼠与foxg1
‑
floxp小鼠杂交,在lgr5+祖细胞中有条件地敲除foxg1,发现lgr5+祖细胞中敲除foxg1能诱导新生小鼠耳蜗产生额外的ihcs;
42.向p1的lgr5
‑
egfp
creer/+
foxg1
loxp/loxp
小鼠和lgr5
‑
egfp
creer/+
小鼠腹膜内注射他莫昔芬并于p3解剖耳蜗,然后用胰蛋白酶消化耳蜗,将lgr5+祖细胞进行分选;
43.将分选的lgr5+祖细胞进行体外培养以形成球形,传代到3代,统计实验组和对照组细胞球的数量和大小,发现新生小鼠耳蜗lgr5+细胞中的foxg1
‑
ckd对lgr5+细胞增殖能力无明显影响。
44.具体的,rps14和foxg1调控内耳干细胞增殖分化的方法包括以下步骤:
45.一、rps14基因对lgr5+内耳干细胞增殖和分化的调控
46.1、oc
‑
1细胞培养
47.将小玻片放入24孔皿中,加1ml ddh2o或pbs,吹洗3遍。紫外照射半小时后进行种细胞,dmem基本培养基:dmem 45ml、fbs 5ml、amp 50ul,细胞量为200ul/大皿,画“8”字或“十”字分散细胞,置于33℃、5%co2的培养箱中。
48.2、sirna敲除rps14基因
49.本实验采用n299、n196、n462三种不同的sirna敲减oc
‑
1细胞中的rps14基因,设计编码无义序列的shrna作为阴性对照,用与gfp结合的无义sirna评估转染效率。简单地说,细胞以1*105个细胞/ml的密度接种于6孔板或96孔板中,以确保在播种后24小时达到80%的融合培养。按试剂盒说明进行转染,8h后用含胎牛血清的dmem试剂培养,33℃、5%co2的培养箱培养48h后,用新霉素处理细胞24h,然后制备样品进行分析。
50.3、lgr5+祖细胞的分离培养及rps14基因敲除
51.取新生lgr5
‑
egfp小鼠耳蜗放入装有50ul 1
×
pbs的1.5ml ep管中,用50ul0.25%胰酶
‑
edta在37℃下培养8
‑
12min后消化成单细胞。采用流式细胞分选技术从含有lgr5
‑
egfp细胞的单细胞悬液中分选出lgr5+细胞,在细胞培养皿中培养。用在oc
‑
1细胞中敲除效率最佳的sirna敲除lgr5+细胞中的rps14基因。
52.4、rps14基因敲除的lgr5+祖细胞生物学效应
53.增殖情况:将rps14基因敲减的lgr5+细胞接种在96孔皿上以2个/ul的密度培养5天,其中培养液含dmem/f12、2%b27、1%n2、igf、egf、b
‑
fgf、肝素、0.1%的氨苄青霉素。扫描电子显微镜观察并量化球形的数量和直径来评估lgr5+细胞的增殖能力。
54.分化情况:取对数生长期的细胞,以每孔4*103
‑
1*105细胞接种于96孔板中,培养至正常生长阶段。用细胞培养基按1000:1的比例稀释edu溶液(试剂a),制备适量的50μm edu培养基;每孔加入100μl edu培养基孵育2h,弃培养基;pbs清洗细胞1
‑
2次,每次5min。每孔加入50μl细胞固定液室温孵育30min,弃固定液;每孔加入50μl 2mg/ml甘氨酸,脱色摇床孵育5min后,弃甘氨酸溶液;每孔加入100μl渗透剂(0.5%tritonx
‑
100的pbs)脱色孵育10min,pbs清洗1次,5min。用apollo,dapi,myosin7a染色。激光扫描共聚焦显微镜下观察。
55.二、敲除lgr5+祖细胞foxg1对毛细胞增殖的影响
56.1、foxg1基因的敲除:将lgr5
‑
egfp
‑
creert2小鼠与foxg1
‑
floxp小鼠杂交产生lgr5
‑
egfp
creer/+
foxg1
loxp/loxp
双阳性小鼠,为了激活cre酶,在p1小鼠腹膜内按照3.5mg/25g的比例注射他莫昔芬,同时以lgr5
‑
egfp
creer/+
小鼠和foxg1
loxp/loxp
小鼠作为对照组也注射等量的他莫昔芬。
57.2、取p7、p14、p30小鼠耳蜗,用毛细胞标记物myosin7a分别对不同时间段小鼠耳蜗的顶端,中部和底部染色标记,统计额外ihc的数量。
58.3、向p1的lgr5
‑
egfp
creer/+
foxg1
loxp/loxp
小鼠和lgr5
‑
egfp
creer/+
小鼠腹膜内注射他莫昔芬并于p3解剖耳蜗,然后用胰蛋白酶消化耳蜗,将lgr5+祖细胞进行分选。然后将分选的lgr5+祖细胞进行体外培养以形成球形,传代到3代。统计实验组和对照组细胞球的数量和大小。
59.本发明从foxg1与rps14两个基因调控方面着手研究其对内耳毛细胞再生的作用,通过将lgr5
‑
egfp
‑
creert2小鼠与foxg1
‑
floxp小鼠杂交,在lgr5+祖细胞中有条件地敲除foxg1,发现lgr5+祖细胞中敲除foxg1能诱导新生小鼠耳蜗产生额外的ihcs。另外,通过oc
‑
1细胞利用不同sirna敲除rps14基因,rt
‑
qpcr检测转染效果,分离培养lgr5+内耳干细胞转染后检测增殖及分化,通过lgr5+干细胞上进行成球分化实验表明敲减rps14基因会抑制干细胞的增殖,对分化无影响。
60.以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1