红参多糖、提纯方法及联合顺铂在抗癌药物中的应用
本发明属于药物技术领域,尤其涉及红参多糖、提纯方法及联合顺铂在抗癌药物中的应用。
背景技术:
红参多糖是红参的主要活性成分之一,具有增强免疫系统功能、免疫抗肿瘤和辅助抗肿瘤、降血糖及调控血细胞生成的作用。目前,红参多糖提取物的制备通常是以水提醇沉,其中中性多糖、酸性多糖含量低。
但是,目前红参多糖的抗肿瘤、抗癌、增强免疫能力仅仅处于初步研究阶段,尚未见有关于红参多糖联合顺铂抗肿瘤、抗癌、增强免疫能力方面的报道。
技术实现要素:
本发明实施例的目的在于提供红参多糖、提纯方法及联合顺铂在抗癌药物中的应用,旨在解决背景技术中指出的现有技术存在的问题。
本发明实施例是这样实现的,红参多糖的提纯方法,包括以下步骤:
红参多糖的提取:
通过超声提取、乙醇沉淀、过滤、冻干处理,得到红参提取物;
红参提取物复水后,用乙醇分级醇沉得到多糖组分;
红参多糖的纯化:
多糖组分采用deae-纤维素离子交换层析和葡聚糖凝胶g-75过滤层析纯化,得到纯化后的红参多糖。
作为本发明实施例的另一种优选方案,采用40~45%浓度的乙醇分级醇沉。
本发明实施例的另一目的在于提供一种上述方法制备得到的红参多糖。
作为本发明实施例的另一种优选方案,所述红参多糖的分子量为27.4~28kda。
作为本发明实施例的另一种优选方案,所述红参多糖中多糖含量为90.3~97.6%。
作为本发明实施例的另一种优选方案,所述红参多糖的糖链中含有α型糖残基。
作为本发明实施例的另一种优选方案,所述红参多糖中包括以下单糖组分:葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖;葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖的质量比为(33.5~35.2):(6.3~7.1):(44.3~45.2):(9.1~9.8):(4.1~4.6)。
本发明实施例的另一目的在于提供一种红参多糖联合顺铂在抗癌药物中的应用。
本发明实施例的另一目的在于提供一种所述的红参多糖联合顺铂在抗肿瘤药物中的应用。
本发明实施例的另一目的在于提供一种所述的红参多糖联合顺铂在增强免疫力药物中的应用。
本发明提供一种红参多糖提纯方法,采用该方法制备得到的红参多糖与顺铂联合使用发生了协同作用,可用于治疗癌症、肿瘤、提高免疫力。
红参多糖与顺铂联合使用治疗肿瘤,可有效降低肿瘤体积和肿瘤质量。
红参多糖与顺铂联合使用治疗癌症,可对肺癌a549细胞增殖产生较强的抑制效应,且随着红参多糖浓度的增加协同作用增强;可使肺癌a549细胞阻滞于g0/g1期和g2/m期;可诱使肺癌a549凋亡率显著提高;可有效降低肺癌a549细胞内bcl-2基因mrna和蛋白表达水平;可显著升高肺癌a549细胞内bax表达水平。
红参多糖与顺铂联合使用增强免疫力,可升高脾指数,改善顺铂所致的免疫低下。
附图说明
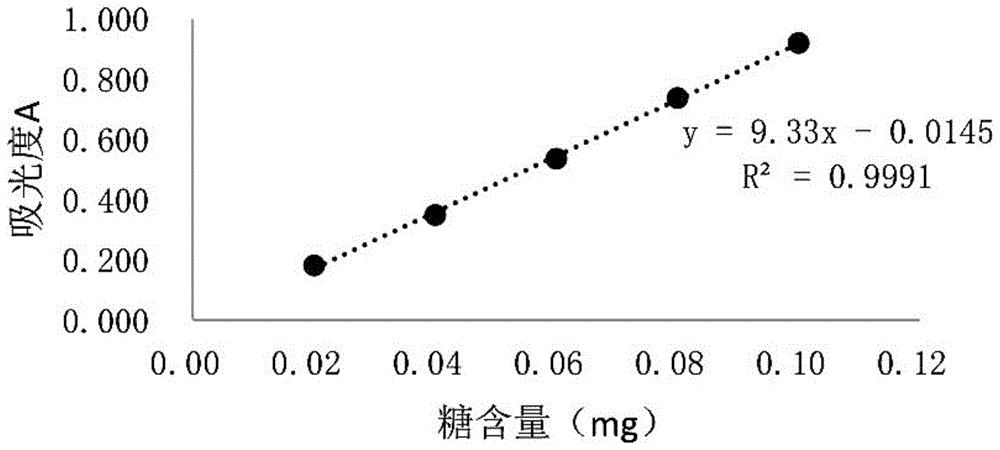
图1为葡萄糖标准曲线图;
图2为红参多糖的紫外扫描图谱;
图3为红参多糖的红外光谱图;
图4为各组细胞调亡检测结果对比图;
图5为各组肺癌肺癌a549细胞周期检测结果对比图;
图6为各组肺癌a549细胞中bcl-2基因mrna表达水平对比图;
图7为各组肺癌a549细胞中bcl-2蛋白表达水平对比图;
图8为各组肺癌肺癌a549细胞中bax基因mrna表达水平对比图;
图9为各组肺癌a549细胞中bax蛋白表达水平对比图;
图10为各组肿瘤体积结果对比图;
图11为各组肿瘤重量结果对比图;
图12为各组肿瘤对比图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
以下结合具体实施例对本发明的具体实现进行详细描述。
实施例1
该实施例提供了一种红参多糖的提纯方法,包括以下步骤:
(1)红参多糖(rgps)的提取:通过超声提取、乙醇沉淀、0.22um滤膜过滤、冻干处理,得到红参提取物,其收率为19.58%;红参提取物用蒸馏水复水后,用42%浓度的乙醇分级醇沉得到多糖组分;
(2)红参多糖的纯化:多糖组分采用deae-纤维素离子交换层析和葡聚糖凝胶g-75过滤层析纯化,得到纯化后的红参多糖(rgp-45),其收率为12.59%。
一、测定得到的红参多糖的分子量:
测试方法:高效液相色谱仪(安捷伦1260示差检测器),样品浓度及进样量(2mg/ml,20μl),色谱柱shodex805-804-802,凝胶柱(8×300mm)串联柱,流动相20mmch3coonh4,流速0.8ml/min,柱温箱40℃。
结果:随着洗脱时间的延长,红参多糖只出现一个单一的、对称的窄峰,表明五个多糖组分均为均一多糖,红参多糖的平均分子量(mw)为27.8kda。
二、测定得到的红参多糖的含量
葡萄糖标准贮备液的配制:葡萄糖使用前,放入105℃烘箱中恒温烘干至恒重后,精密称取50mg,用蒸馏水溶解混匀后定容于500ml容量瓶中,从而得到0.1mg/ml葡萄糖标准溶液贮备液。
葡萄糖标准曲线的绘制:分别吸取0.1mg/ml葡萄糖标准溶液0ml、0.2ml、0.4ml、0.6ml、0.8ml、1.0ml置于10ml带塞玻璃试管中,用蒸馏水补至1.0ml,分别向带塞玻璃试管中加入1.0ml5%的苯酚溶液,于涡旋振荡器上混匀后,分别逐滴匀速加入5ml浓硫酸溶液,充分混匀,置沸水浴中加热20min,取出后室温下冷却30min,以进行同样处理的蒸馏水为空白对照组,在波长为490nm条件下,测定其吸光度值。同一浓度的葡萄糖标准溶液分别重复测定3次,以葡萄糖含量为横坐标,以吸光度值为纵坐标,绘制葡萄糖标准曲线,见图1所示。
红参多糖的含量测定:按上述方法操作,平行测量3次,从回归方程中求出供试品溶液中葡萄糖的含量,按下式计算样品中多糖含量。
多糖含量=m0/m×100%
m0:由标准曲线查得的供试品溶液葡萄糖含量;m:供试品的质量。
结果:从图1可以看出,以葡萄糖含量(mg)为横坐标,吸光度a为纵坐标,得到标准曲线:y=7.605x+0.0039,相关系数r2=0.9996。红参多糖的多糖含量为91.57%,蛋白质含量为0。
三、测定得到的红参多糖的单糖组成
结果:所述红参多糖中包括以下单糖组分:葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖;其中葡萄糖醛酸和葡萄糖为主要单糖。葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖的质量比为34.6:6.8:44.9:9.5:4.3。
四、对得到的红参多糖进行uv光谱分析
红参多糖的紫外全波长扫描图谱见图2。从图2可以看出,样品在280nm和260nm处几乎没有紫外吸收,说明样品中几乎不含有蛋白质和核酸,纯度较髙。
五、对得到的红参多糖进行ft-ir分析
红参多糖的红外光谱检测结果见图3。可以看出,3411cm-1的宽峰代表o-h的伸缩振动峰。在2929cm-1处出现的弱吸收峰是糖类c-h伸缩振动,是糖类化合物的特征吸收峰。1605cm-1出现的吸收峰可能是多糖的水化物,如c=o的吸收峰。在1014、1083和1156cm-1、处的吸收峰表明存在吡喃环构型。849cm-1表明糖链中含有α型糖残基。
实施例2
该实施例提供了一种红参多糖的提纯方法,包括以下步骤:
(1)红参多糖(rgps)的提取:通过超声提取、乙醇沉淀、0.20um滤膜过滤、冻干处理,得到红参提取物;红参提取物用蒸馏水复水后,用40%浓度的乙醇分级醇沉得到多糖组分;
(2)红参多糖的纯化:多糖组分采用deae-纤维素离子交换层析和葡聚糖凝胶g-75过滤层析纯化,得到纯化后的红参多糖。
采用与实施例1相同的方法测定:所述红参多糖的分子量为27.4kda;所述红参多糖中多糖含量为92.8%;所述红参多糖的糖链中含有α型糖残基;所述红参多糖中包括以下单糖组分:葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖;葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖的质量比为33.5:6.3:44.3:9.1:4.1。
实施例3
该实施例提供了一种红参多糖的提纯方法,包括以下步骤:
(1)红参多糖(rgps)的提取:通过超声提取、乙醇沉淀、0.22um滤膜过滤、冻干处理,得到红参提取物;红参提取物用蒸馏水复水后,用44%浓度的乙醇分级醇沉得到多糖组分;
(2)红参多糖的纯化:多糖组分采用deae-纤维素离子交换层析和葡聚糖凝胶g-75过滤层析纯化,得到纯化后的红参多糖。
采用与实施例1相同的方法测定:所述红参多糖的分子量为28kda;所述红参多糖中多糖含量为90.3%;所述红参多糖的糖链中含有α型糖残基;所述红参多糖中包括以下单糖组分:葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖;葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖的质量比为35.2:6.8:44.5:9.8:4.3。
实施例4
该实施例提供了一种红参多糖的提纯方法,包括以下步骤:
(1)红参多糖(rgps)的提取:通过超声提取、乙醇沉淀、0.23um滤膜过滤、冻干处理,得到红参提取物;红参提取物用蒸馏水复水后,用45%浓度的乙醇分级醇沉得到多糖组分;
(2)红参多糖的纯化:多糖组分采用deae-纤维素离子交换层析和葡聚糖凝胶g-75过滤层析纯化,得到纯化后的红参多糖。
采用与实施例1相同的方法测定:所述红参多糖的分子量为27.6kda;所述红参多糖中多糖含量为95.3%;所述红参多糖的糖链中含有α型糖残基;所述红参多糖中包括以下单糖组分:葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖;葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖的质量比为33.5:6.8:44.3:9.3:4.1。
实施例5
该实施例提供了一种红参多糖的提纯方法,包括以下步骤:
(1)红参多糖(rgps)的提取:通过超声提取、乙醇沉淀、0.21um滤膜过滤、冻干处理,得到红参提取物;红参提取物用蒸馏水复水后,用42.5%浓度的乙醇分级醇沉得到多糖组分;
(2)红参多糖的纯化:多糖组分采用deae-纤维素离子交换层析和葡聚糖凝胶g-75过滤层析纯化,得到纯化后的红参多糖。
采用与实施例1相同的方法测定:所述红参多糖的分子量为27.9kda;所述红参多糖中多糖含量为96.6%;所述红参多糖的糖链中含有α型糖残基;所述红参多糖中包括以下单糖组分:葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖;葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖的质量比为35.1:7.1:44.5:9.1:4.6。
实施例6
该实施例提供了一种红参多糖的提纯方法,包括以下步骤:
(1)红参多糖(rgps)的提取:通过超声提取、乙醇沉淀、0.23um滤膜过滤、冻干处理,得到红参提取物;红参提取物用蒸馏水复水后,用43.5%浓度的乙醇分级醇沉得到多糖组分;
(2)红参多糖的纯化:多糖组分采用deae-纤维素离子交换层析和葡聚糖凝胶g-75过滤层析纯化,得到纯化后的红参多糖。
采用与实施例1相同的方法测定:所述红参多糖的分子量为27.6kda;所述红参多糖中多糖含量为92.6%;所述红参多糖的糖链中含有α型糖残基;所述红参多糖中包括以下单糖组分:葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖;葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖的质量比为33.7:6.3:45.2:9.6:4.3。
实施例7
该实施例提供了一种红参多糖的提纯方法,包括以下步骤:
(1)红参多糖(rgps)的提取:通过超声提取、乙醇沉淀、0.20um滤膜过滤、冻干处理,得到红参提取物;红参提取物用蒸馏水复水后,用45%浓度的乙醇分级醇沉得到多糖组分;
(2)红参多糖的纯化:多糖组分采用deae-纤维素离子交换层析和葡聚糖凝胶g-75过滤层析纯化,得到纯化后的红参多糖。
采用与实施例1相同的方法测定:所述红参多糖的分子量为27.7kda;所述红参多糖中多糖含量为97.6%;所述红参多糖的糖链中含有α型糖残基;所述红参多糖中包括以下单糖组分:葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖;葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖的质量比为35.2:6.6:45.2:9.5:4.2。
实施例8
该实施例提供了一种红参多糖的提纯方法,包括以下步骤:
(1)红参多糖(rgps)的提取:通过超声提取、乙醇沉淀、0.21um滤膜过滤、冻干处理,得到红参提取物;红参提取物用蒸馏水复水后,用44.5%浓度的乙醇分级醇沉得到多糖组分;
(2)红参多糖的纯化:多糖组分采用deae-纤维素离子交换层析和葡聚糖凝胶g-75过滤层析纯化,得到纯化后的红参多糖。
采用与实施例1相同的方法测定:所述红参多糖的分子量为27.55kda;所述红参多糖中多糖含量为90.4%;所述红参多糖的糖链中含有α型糖残基;所述红参多糖中包括以下单糖组分:葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖;葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖的质量比为33.7:6.4:44.4:9.7:4.5。
实施例9
采用实施例1制备的红参多糖联合顺铂研究对肺癌细胞增殖及调亡的影响。
一、红参多糖、顺铂单独和联合用药对肺癌a549细胞增殖的抑制作用实验实验结果见表1~3所示。
表1顺铂对肺腺癌a549细胞增殖的抑制作用
表2红参多糖对肺腺癌a549细朡增殖的抑制作用
表3红参多糖联合顺铂对肺癌a549细胞增殖的抑制作用
由表1~3可看出,与对照组相比,rgp-45组(rgp-45)和顺铂对肺癌a549细胞显示出良好的杀伤效果。5μg/ml顺铂作用肺癌a549细胞24h抑制率为38.86%。不同浓度的红参多糖对肺癌a549细胞生长的影响呈现出计量依赖性。50μg/ml,100μg/ml和200μg/ml的红参多糖作用肺癌a549细胞48h抑制率分别为-6.33%、32.79%、85.63%。红参多糖联合顺铂对肺癌a549细胞增殖抑制效应具有浓度依赖性,5μg/ml顺铂分别与50μg/ml、100μg/ml和200μg/ml的红参多糖作用肺癌a549细胞72h抑制率分别为17.16%、40.61%、88.79%,两药合用对肺癌a549细胞可以产生较好的协同作用,随着红参多糖药物浓度的增加协同作用增强。
二、红参多糖联合顺铂对肺癌a549凋亡率的影响实验
采用annexinv-fitc和pi双染色法考察红参多糖联合顺铂对肺癌a549细胞调亡的作用,流式细胞术检测细胞调亡结果如图4。
其中,a-阴性对照组;b-rgp-45组(100μg/ml);c-顺铂组(5μg/ml);d-联合给药组(rgp-45+顺铂=100μg/m+5μg/ml)。
实验结果:
阴性对照组:活细胞的数量最多,高达91.33±0.15%,早期调亡、晚期调亡和坏死细胞数量较少,分别为8.3±0.2%,0.3%和0%。
顺铂组:加入顺铂作用24h的肺癌a549细胞早期调亡,早期调亡的细胞数量达到31.13±1.04%(p<0.01),晚期调亡有所增加,细胞数量为0.03±0.06%(p<0.01),而活细胞数量明显减少,降低为68.1±1.08%(p<0.01)。
rgp-45组:加入红参多糖作用48h的肺癌a549细胞早期调亡和死亡的细胞明显增多,早期调亡的细胞数量达到25.07±0.32%(p<0.01),坏死细胞的细胞数量增加到0.8±0.2%(p<0.05),晚期调亡有所降低,细胞数量为0.03±0.06%(p<0.01),而活细胞数量明显减少,降低为74.03±0.35%(p<0.01)。
联合给药组:加入红参多糖和顺铂作用72h的肺癌a549细胞早期调亡、晚期调亡和死亡的细胞明显增多,早期调亡的细胞数量达到40.33±0.21%(p<0.01),晚期调亡细胞数量为0.76±0.06%(p<0.01),坏死细胞的细胞数量增加到0.6%(p<0.05),而活细胞数量明显减少,降低为58.27±0.21%(p<0.01)。
图4中,左上角(q1)为坏死细胞,右上角(q2)为晚期调亡细胞,左下角(q3)为活细胞,右下角(q4)为早期调亡细胞。计算右上角和右下角的细胞占总细胞的百分比即为肺癌a549细胞的调亡率。红参多糖浓度为100μg/ml时,肺癌a549细胞的调亡率为25.09%,顺铂浓度为5μg/ml时,肺癌a549细胞的调亡率为31.83%,当红参多糖与顺铂联合使用时,肺癌a549细胞的调亡率显著上升,提高至41.09%。结果表明,红参多糖及顺铂均能提高肺癌a549细胞的调亡率。联合使用后,调亡率显著提高,提示诱导肿瘤细胞调亡可能是两药发挥协同作用的机制之一。
三、红参多糖联合顺铂对肺癌a549细胞周期的影响实验
结果见表4和图5。其中,a-阴性对照组;b-顺铂组(5μg/ml);c-rgp-45组(100μg/ml);d-联合给药组(rgp-45+顺铂=100μg/m+5μg/ml)
表4红参多糖联合顺铂对a549细胞周期和凋亡率的影响
结果显示,与阴性对照组相比,顺铂组和rgp-45组处理肺癌a549细胞后,s期g2/m期细胞比例下降,g0/g1期细胞比例升高。提示肺癌a549细胞分裂增殖活动因细胞周期停滞而减弱,大部分细胞被阻滞在g0/g1期。联合给药组处理肺癌a549细胞后,s期细胞的百分数从37.67%下降到15.50%。g0/g1期和g2/m期细胞的百分数明显升高,分别从58.81%升高到79.00%,3.49%升高到5.82%。表明联合给药组可使肺癌a549细胞阻滞于g0/g1期和g2/m期。
四、凋亡相关因子bcl-2在各组肺癌a549细胞内的表达情况
4.1肺癌a549细胞中bcl-2表达水平
从图6可看出,纵坐标为目的基因mrna水平,设定阴性组为100%。与阴性对照组相比,顺铂组肺癌a549细胞内bcl-2基因mrna水平下降45.05%(p<0.01),rgp-45组下降17.24%,rgp-45+顺铂组下降67.79%(p<0.01)。顺铂组与rgp-45+顺铂组相比虽无显著性差异(p>0.05),但两药联用的降低能力略大于顺铂组。
从图7可看出,各组肺癌a549细胞内bcl-2蛋白的表达结果与检测mrna表达量的结果一致。图中,gapdh作为内参蛋白,1-阴性对照;2-顺铂组;3-rgp-45组;4-rgp-45+顺铂组。
综上说明,红参多糖可降低肺癌a549细胞内bcl-2基因mrna和蛋白表达水平,但其能力较顺铂低,两药联用时其降低水平达到最高。
4.2肺癌a549细胞中bax表达水平
从图8分析可知,与阴性对照相比,rgp-45组肺癌a549细胞内bax基因mrna表达水平只有略微提升,无显著性差异(p>0.05),顺铂组则能显著提升其表达(p<0.01),rgp-45+顺铂组肺癌a549细胞内bax基因mrna表达水平得到极显著升(p<0.01)。
从图9可看出,各组肺癌a549细胞内bax蛋白的表达结果与检测mrna表达量的结果一致。图中,gapdh作为内参蛋白,1-阴性对照;2-顺铂组;3-rgp-45组;4-rgp-45+顺铂组。
综上说明,顺铂可显著升高肺癌a549细胞内bax表达水平,其能力较红参多糖高,两药联用时其提升水平达到最高。
实施例10
采用实施例1制备的红参多糖联合顺铂对肺癌a549荷瘤小鼠肿瘤生长作用及其对免疫功能的影响。
一、红参多糖联合顺铂对肺癌a549荷瘤小鼠肿瘤生长的影响实验
实验方法:
1细胞培养
肺癌a549细胞采用含10%胎牛血清,1%双抗(青链霉素混合液)的dmem培养,置于37℃,5%co2的培养箱中进行培养。显微镜下观察细胞呈不规则形,为贴壁/半贴壁细胞,台盼蓝染色活细胞率达95%以上。
2接种
将不同组别的细胞用胰酶消化后,收集到一起。无血清的培养基洗涤一次后进行细胞计数。将计数好的细胞用无血清的培养基重悬调整细胞密度5×107/ml,待用。
20只鼠随机分为4组,全部接种a549细胞100μl(5×106个),先抓起裸鼠酒精棉球消毒后,皮下接种于腋下。接种后将不同组别的裸鼠分笼饲养,定期喂水和饲料,定期更换垫料。
3肿瘤生长观察
每三天对接种部位进行观察,查看肿瘤生长情况。并记录。待成瘤后,每三天对肿瘤游标卡尺测量瘤子大小。
4给药处理
成瘤后开始给药,模型对照组灌胃0.5ml生理盐水;顺铂组先灌胃生理盐水,6h注射顺铂(3mg/kg);rgp-45组每日灌胃红参多糖(150mg/kg);rgp-45+顺铂组每日灌胃红参多糖,6h注射顺铂(3mg/kg)。所有组别给药10d。
各组小鼠剥离肿瘤组织后,称重并记录肿瘤重量。
如图10所示,肿瘤体积和肿瘤重量的结果显示,顺铂组、rgp-45组、rgp-45+顺铂组的肿瘤重量均显著低于模型对照组(p<0.05)。rgp-45+顺铂组肿瘤生长显著低于顺铂组(p<0.05)。由图11可以看出,rgp-45+顺铂组的肿瘤生长速度最慢,并且第33日时肿瘤体积明显小于模型对照组和顺铂组,而顺铂组和rgp-45组肿瘤体积明显小于模型对照组(p<0.05)。同时从图12可以直观的看到,rgp-45+顺铂组小鼠的肿瘤体积明显小于模型对照组和顺铂组。
二、红参多糖联合顺铂对肺癌a549荷瘤小鼠白细胞计数的影响实验
结果见表5。
表5红参多糖联合顺铂对a549荷瘤小鼠白细胞的影响(n=10)
由表5可知,顺铂组治疗后毒副作用较大,外周血wbc数与阴性对照组比较显著降低(p<0.05)。rgp-45组可使小鼠外周血wbc数升高,与阴性对照组相比有显著差异(p<0.05)。同时,红参多糖和顺铂合用后,可使外周血升高,与顺铂组相比有统计学意义(p<0.05),说明红参多糖对免疫功能有促进作用。
三、红参多糖联合顺铂对肺癌a549荷瘤小鼠脾脏指数、胸腺指数的比较实验
结果见表6。
表6红参多糖联合顺铂对a549荷瘤小鼠脏器指数的影响(n=10)
从表6可知,与阴性对照组相比,顺铂组小鼠的脾脏指数显著降低(p<0.05)。与顺铂组相比,rgp-45组和rgp-45+顺铂组的脾脏指数有所升高,且差异显著(p<0.05)。结果表明,红参多糖联合顺铂给药可升高脾指数,改善顺铂所致的免疫低下。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!