一种消融液、试剂盒、消融方法、提取线粒体的方法及其应用与流程
1.本发明涉及化学试剂及处理方法技术领域,尤其涉及生物组织、细胞及细胞器的消融、提取技术领域,具体涉及一种消融液、试剂盒、消融方法及提取线粒体的方法。
背景技术:
2.单细胞化是诸多生物实验中的基础,涉及到生物组织的实验,几乎都需要制备单细胞悬液用于后续研究和试验。现有的单细胞悬液的制备常用方式中可分为两种:一种是最为传统的物理制备方式,就是用研磨器进行手工研磨,手工研磨的弊端在较多,譬如耗时长,单细胞悬液质量差,受污染相对严重等。另一种方式就是通过酶消化法,譬如胰蛋白酶是可以使细胞间的蛋白质水解从而使细胞离散。但是实际处理过程中,单纯的将组织块置入胰蛋白酶中并不能直接获取到单细胞悬液,且对于胰蛋白酶的浓度、消化处理时间对于组织的裂解影响是非常大,直接影响着单细胞的数量、完整度、以及存活率。而没有高存活率的单细胞往往将失去后续试验的意义。
3.进一步地,细胞的线粒体是维持基本的细胞功能,如能量生产,钙稳态,和调节细胞程序性死亡主要细胞器。大多数真核细胞拥有一群线粒体,这意味着线粒体mtdna在每个细胞中有多个拷贝,每个分子的序列可以不同。线粒体异质性,从根本上是细胞内线粒体脱氧核糖核酸mtdna的异质性往线粒体核糖核酸mtrna传递并体现的。但目前mtdna异质性往mtrna异质性的传递一致性和机制尚不清楚。无法开展mtrna异质性研究的主要原因线粒体转录水平对各种刺激敏感,比如缺氧,细胞损伤均会迅速改变线粒体rna含量,造成难以获得转录水平未被意外激活的单细胞悬液或分离的线粒体。
4.因此,在保证线粒体转录水平,功能,活性不变的情况下,将组织样品制备成单细胞悬液并确保细胞线粒体结构、功能无损并维持转录水平不变是极具现实意义的。所获得的单细胞悬液可以用于线粒体分离,对样品细胞异质性与线粒体rna异质性的相关性进行分析研究,从而通过这种方法学诊断细胞间异质性与线粒体异质性,并为线粒体疾病的治疗策略提供新的视角。
技术实现要素:
5.为了解决现有技术在制备单细胞悬液过程中存在的存活率低,活性低,以及对细胞及细胞器造成损伤导致不能进行后续的细胞异质性及线粒体异质性研究的问题,本技术提供一种消融液、试剂盒、消融方法及提取线粒体的方法能够在在保证线粒体转录水平,功能,活性不变的情况下,将组织样品制备成单细胞悬液并确保细胞线粒体结构,功能无损并维持转录水平不变。使得可以通过本发明提供的方法获得结构和功能与活体细胞无异的单细胞;以及进一步从单细胞中提取线粒体,使得提取的线粒体具有的转录水平、功能和活性与处于活体中的线粒体基本相同,为线粒体rna异质性研究提供必要基础。
6.本发明提供的组织消融方法旨在获得能够保持细胞原有功能和活性的单细胞;同时进一步提供了针对单细胞进行线粒体的提取方法,旨在获得具有与活体细胞中的线粒体
相当或者相同包括转录水平、功能和活性在内的主要功能的线粒体,从而使得针对线粒体异质性方面的后续研究具有多一种获取途径。
7.通过超声消融的手段将离体组织消融成单细胞的过程取决于两方面:第一是利用超声消融装置提供的高频物理作用,使得细胞与细胞之间实现分离;第二是通过消融液和松解液的共同作用使得细胞与细胞之间的粘附力降低,能够在尽可能温和的外力作用下实现分离。此处述及的温和是指作用于细胞的外力尚不足以对细胞造成实质性破坏和/或功能损害的力的作用;包括细胞本身的功能及细胞内部重要细胞器的功能,例如线粒体。针对超声消融装置而言,其输出的参数并非是固定的,需要配合消融液和松解液的混合液的实际作用效果以及针对需要消融的组织特性而定,但当配合消融的混合液浓度在相对一定的范围时,则超声消融装置的输出参数亦整体处于相对集中的范围内。当改变消融的混合液浓度及配方后,达到实质相同技术效果所需要调整的超声消融装置参数则具有明显且巨大的差异性。申请人经过长达数年的持续研究,虽不能穷尽一切可能实现的试剂与超声消融匹配的参数,但却获得了能够顺利获得保持原有组织细胞功能而获得单细胞的方法,以及适用于该方法的试剂配比,以及专用于该试剂配比的消融参数数据。
8.在进行消融时,须通过专有试剂盒配合超声消融装置实现。所述试剂盒由三种试剂液组成,分别为:
9.1、用于保护细胞组织的消融液,消融液具有极佳的组织保护作用,能够持续作用于离体组织,使得组织中的细胞功能活性得以持续和延续。本技术提供的消融液由0.3-0.4mm/l的kh2po4,0.14m/l的nacl,5.2-5.8mm/l的nahco3,4-4.5mm/l的kcl,浓度为0.4%的bsa,0.1-0.12g的na2hpo4·
h2o,3mm/l的cacl2,3mm/l的mgcl2和5-10ug/ml溴化乙锭组成。
10.2、用于混合消融液形成消融混合液的松解液,松解液起到的是细胞间的松解作用,使得在超声接入时,能够在保证细胞及细胞器原有功能活性不受损害的前提下完成细胞间的分离,以获得理想的单细胞。所述松解液由下述组分及含量组成:dispaseii:20mg/ml;collagenase:1000u/ml;kana:20mg/ml;kh2po4:0.45mm/l;nacl:0.14m/l;nahco3:4.2mm/l;kcl5.4mm/l;葡萄糖1.0g;na2hpo4
·
h2o0.06g;cacl2:3mm/l;mgcl2:3mm/l。
11.3、用于维持单细胞活力的细胞保护液,细胞保护液是保护并维持经消融后的单细胞活力的试剂,避免单细胞在短时间内降低活力、失去活力甚至死亡。其成分由pbs,10%fbs和浓度为0.1%的nan3组成。
12.为了获得理想的单细胞,本技术提供了一种消融方法,基于上述试剂盒配合超声消融装置实现,以获得细胞内线粒体转录水平、功能和活性不受损伤的高存活化单细胞,具体通过以下步骤实现:
13.步骤st100,在无菌条件下将获取待消融组织;
14.步骤st200,将步骤st100获取的组织转移至含有已经进行预冷处理的消融液的平皿中进行细化处理至2mm3的组织块,并利用消融液进行1-3次清洗,直到组织无血液渗出为止;
15.步骤st300,使用无菌眼科剪剔除目视可见非目标物;所述非目标物包括血管、结缔组织和纤维;
16.步骤st400,将步骤st300剔除非目标物后的组织置于盛装有消融液和松解液的ep管中,无菌环境下静止松解15分钟;其中,消融液和松解液体积比为4:1;
17.步骤st500,将经步骤st400松解后的组织利用超声消融装置进行消融6-8秒,消融频率为20khz,功率3-8w;
18.步骤st600,将消融后的细胞悬液进行常规过滤、离心处理后用细胞保护液重悬。
19.通过上述方法获得的单细胞具有完整的细胞功能,能够用于细胞异质性研究,亦是多种针对细胞后续研究的良好基础。
20.本技术还提供一种提取线粒体的方法,包括消融的步骤和提取分离线粒体的步骤;
21.所述消融的步骤采用上述步骤st100-st600的消融方法实现;
22.所述提取分离线粒体通过下述实现:
23.步骤st700,将步骤st600获得的单细胞悬液进行4℃,1000g离心10min,去上清将细胞重悬于1.5ml预冷的buffer中,进行破碎;
24.步骤st800,在4℃,1000g离心10min,转移上清至干净的1.5mlep管中,4℃,6000g离心10min,去上清,沉淀重悬到750ul的线粒体钝化buffer中;
25.步骤st900,吸取线粒体钝化buffer顶部的线粒体悬液,4℃,14000g离心15min;去上清,吸取底部的线粒体层转移到新ep管中,以1.5ml的线粒体储存液重悬,4℃,8000g离心10min;
26.步骤st1000,去上清,5ml线粒体储存液重悬,4℃,8000g离心10min,重复洗涤直至线粒体在管底部呈颗粒,重悬颗粒完成线粒体提取。所提取的线粒体可用于线粒体rna异质性研究,如线粒体的转录水平测定。
27.有益效果
28.本发明提供的组织消融获得单细胞悬液的方法,以及提取线粒体的方法分别获取的单细胞和线粒体均未因消融或者破碎提取操作而受到伤害,保持了细胞原有的功能和活力,能够用于所有的单细胞研究或者原代细胞培养。同时,保持原有功能活性的单细胞能够用于细胞异质性研究;良好的线粒体能够用于线粒体异质性研究,这为后续的研究工作提供了绝佳的物质条件。
附图说明
29.为了更清楚地说明本技术实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本技术的一些实施例,对于本领域技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
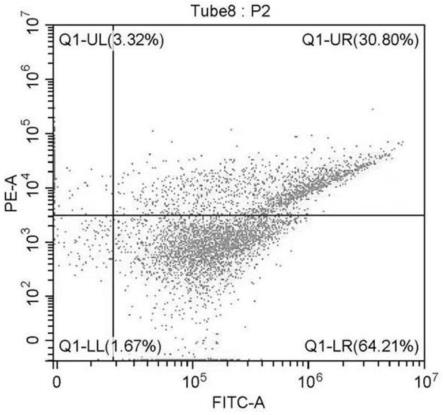
30.图1是实施例6中采用实施例3消融后所获得单细胞进行流式检测线粒体膜电位结果;
31.图2是实施例6中采用实施例4消融后所获得单细胞进行流式检测线粒体膜电位结果;
32.图3是实施例6中采用实施例5消融后获得的单细胞进行流式检测线粒体膜电位结果;
33.图4是实施例7中采用实施例3消融后所获得单细胞进行荧光分析线粒体膜通透性结果;
34.图5是实施例7中采用实施例4消融后所获得单细胞进行荧光分析线粒体膜通透性结果;
35.图6是实施例7中采用实施例5消融后获得的单细胞进行荧光分析线粒体膜通透性结果;
36.图7是atp浓度标准曲线;
37.图8是实施例9中本发明及现有技术消融获取的小鼠肝脏单细胞经rna提取后进行rt-qpcr检测对比图示;
38.图9是实施例9中发明及现有技术消融获取的小鼠心脏单细胞经rna提取后进行rt-qpcr检测对比图示;
39.图10是实施例9中发明及现有技术消融获取的小鼠肾脏单细胞经rna提取后进行rt-qpcr检测对比图示;
40.图11是实施例9中发明及现有技术消融获取的小鼠脾脏单细胞经rna提取后进行rt-qpcr检测对比图示;
41.图12是实施例9中发明及现有技术消融获取的小鼠脑组织单细胞经rna提取后进行rt-qpcr检测对比图示;
42.图13是实施例9中发明及现有技术消融获取的小鼠肺组织单细胞经rna提取后进行rt-qpcr检测对比图示;
43.图14是实施例9中发明及现有技术消融获取的小鼠肌肉组织单细胞经rna提取后进行rt-qpcr检测对比图示;
44.图15是实施例9中发明及现有技术消融获取的小鼠脂肪组织单细胞经rna提取后进行rt-qpcr检测对比图示。
具体实施方式
45.为使本技术实施例的目的、技术方案和优点更加清楚,下面将结合本技术实施例中的附图,对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本技术一部分实施例,而不是全部的实施例。通常在此处附图中描述和示出的本技术实施例的组件可以以各种不同的配置来布置和设计。
46.因此,以下对在附图中提供的本技术的实施例的详细描述并非旨在限制要求保护的本技术的范围,而是仅仅表示本技术的选定实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
47.实施例1:
48.本实施例提供一种试剂盒,试剂盒由三种试剂液组成,分别是:
49.试剂1:消融液
50.由0.3-0.4mm/l的kh2po4,0.14m/l的nacl,5.2-5.8mm/l的nahco3,4-4.5mm/l的kcl,浓度为0.4%的bsa,0.1-0.12g的na2hpo4·
h2o,3mm/l的cacl2,3mm/l的mgcl2和5-10ug/ml溴化乙锭组成。
51.试剂2:松解液
52.由下述组分及含量组成:dispaseii:20mg/ml;collagenase:1000u/ml;kana:
20mg/ml;kh2po4:0.45mm/l;nacl:0.14m/l;nahco3:4.2mm/l;kcl5.4mm/l;葡萄糖1.0g;na2hpo4
·
h2o0.06g;cacl2:3mm/l;mgcl2:3mm/l。
53.试剂3:细胞保护液
54.由pbs,10%fbs和浓度为0.1%的nan3组成。
55.上述试剂1-试剂3中的含量范围可根据需求灵活择选,获得的技术效果虽有差异,但并无实质变化,均可获得高活性的单细胞,且高活性单细胞可达到单细胞总数的90%以上。
56.实施例2:
57.本实施例提供一种优选的消融液,由0.3mm/l的kh2po4,0.14m/l的nacl,5.2mm/l的nahco3,4mm/l的kcl,浓度为0.4%的bsa,0.1g的na2hpo4·
h2o,3mm/l的cacl2,3mm/l的mgcl2和9.2ug/ml溴化乙锭组成。
58.同时,溴化乙锭的含量根据细胞品类的不同还可以选择5ug/ml、5.5ug/ml、6ug/ml、6.5ug/ml、7ug/ml、7.5ug/ml、8ug/ml、8.5ug/ml、9ug/ml、9.8ug/ml、10ug/ml等;但无论处于何种品类组织细胞,其最少含量不能低于5ug/ml且应当与0.4%的bsa共同使用。
59.实施例3:
60.本实施例提供一种消融方法,利用实施例1中的试剂盒,同时采用实施例2中的消融液配比进行如下消融操作。
61.步骤st100,在无菌条件下将小鼠肝脏取出;
62.步骤st200,将步骤st100获取的小鼠肝脏转移至含有已经进行预冷处理的消融液的平皿中进行细化处理至2mm3的组织块,并利用实施例2中的消融液进行1-3次清洗,直到小鼠肝脏无血液渗出为止;
63.步骤st300,使用无菌眼科剪剔除目视可见非目标物;所述非目标物包括血管、结缔组织和纤维;
64.步骤st400,将步骤st300剔除非目标物后的小鼠肝脏置于盛装有消融液和松解液的ep管中,无菌环境下静止松解15分钟;其中,消融液和松解液体积比为4:1;
65.步骤st500,将经步骤st400松解后的组织利用超声消融装置进行消融6-8秒,消融频率为20khz,功率4w;
66.步骤st600,将消融后的细胞悬液采用300目尼龙网过滤,1500r/min离心,去除上清液,取单细胞沉淀置于2ml细胞保护液中重悬,所获单细胞记为实验组1。本实施例中,所述超声消融装置采用本技术人发明的超声消融仪实现,其操作方式、工作原理在公开号为cn109652313a的专利文献中详有记载,国际公布号为wo/2020/156048。
67.实施例4:
68.本实施例与实施例3的主要区别是将消融时采用的消融试剂替换成本技术人公开号为cn111235090a中记载的松解保护剂进行消融获得单细胞悬液。
69.实施例5:
70.本实施例采用现有美天旎miltenyi公司生产的gentlemacs全自动组织单细胞处理器进行处理获得的单细胞悬液。
71.实施例6:
72.本实施例将对实施例3-实施例5中获得的单细胞悬液分别进行线粒体膜电位δψm
变化的流式检测,以获得线粒体膜电位正常的细胞比例,对比采用不同方法获得的单细胞对原有细胞活性和功能的保持性、继承性的完整度,或者体现不同单细胞化处理方法对细胞的损伤程度。
73.线粒体内膜两侧通常出现负电位差(-180mv~-200mv),称为线粒体膜电位δψm,其微量的变化会极大地影响线粒体的功能。监测δψm是评估线粒体功能状态的常用方法。
74.四甲基罗丹明甲酯(tmrm)能够被活细胞线粒体特异性地摄取,且摄取率与线粒体膜电位呈正相关。从而反映了线粒体膜电位的高低,具有较好的灵敏性。具体的测定方法如下:
75.①
取获得的单细胞约1x106/ml细胞,对照组加入50mm cccp 1μl,培养至细胞形态发生改变。
76.②
对于实验样品,加入1μl 20μm的tmrm试剂溶液,在37℃,5%co2条件下培养30分钟。
77.③
将细胞在1毫升培养基或pbs中清洗一次,在500μl的pbs(或其他适当的缓冲液)中进行细胞培养。
78.将实施例3-实施例5获得的单细胞分别进行上述测定试验,并在561nm激发的流式细胞仪上使用发射滤光片对细胞进行分析,获得如图1-图3所示结果。
79.对离体约一小时后的动物组织进行单细胞化处理,随即流式检测线粒体膜电位,右上区间表示线粒体膜电位正常的细胞比例。实施例3与实施例4分别为30.8%和27.49%,略微接近,但实施例3为本发明提供的全新方法更由于实施例4,而采用现有技术的实施例5仅为9.4%,不足本发明实施例3中参数的三分之一,反映出现有技术中实施例5中的线粒体膜电位明显异常,说明采用现有技术,如miltenyi全自动单细胞处理仪消融方法获得的单细胞并不能完整的保留线粒体的功能。相比而言,本发明提供的实施例3相较于现有技术的实施例5具有突出的实质性特点,在技术效果上存在令人满意的显著进步。
80.再者,采用本技术人老旧配方试剂处理的实施例4获得的技术效果相对本发明提供的最优方法实施例3而言,效果略微减少三个百分点,究其原因是本发明在消融试剂中改变了处理工艺,如洗涤及洗涤过程中的浸泡作用,以及消融液和松解液的全新优化配比的共同作用。其中消融液中加入了0.4%bsa和5-10ug/ml溴化乙锭,实验证明能够极大的对细胞器提供良好的保护作用,以使得组织消融过程中,细胞器能够在消融液中受到伤害。
81.该实验结果表明:与其他组织单细胞化方法如miltenyi全自动单细胞处理仪相比,采用本发明提供的超声消融装置及方法相较于细胞本身的作用更为温和,对细胞内线粒体损伤较小,适用于线粒体相关方向的研究。
82.实施例7:
83.本实施例将对实施例3-实施例5中获得的单细胞悬液分别进行5.3线粒体膜通透性分析,以获得不同单细胞处理方法对细胞内的重要细胞器线粒体是否存在伤害,检测线粒体是处于正常膜通透性还是处于异常或者病理状态,从而确定不同单细胞处理方法对细胞及其内部细胞器,如线粒体的功能保持情况。
84.线粒体膜通透性转换孔(mptp)是线粒体渗透转换功能的结构基础。mptp的开放会显著改变线粒体的通透性,导致细胞色素c的释放和线粒体膜电位的消失。通过一种利用钙黄绿素-钴的mptp荧光检测试剂能够检测mptp的开放状态。
85.在正常生理状态下,mptp也会存在着瞬时短暂的开闭,随着时间的延长,线粒体内的钙黄绿素会少量缓慢释放入线粒体外的细胞质内,被细胞质内的钴离子淬灭,即钙黄绿素荧光强度存在一个自然衰减的过程。而在病理状态下,大量线粒体膜mptp的进一步持续开放,使细胞质的钙黄绿素迅速被胞质内的氯化钴淬灭,表现为细胞内钙黄绿素的绿色荧光强度明显减弱。线粒体内钙黄绿素荧光的强度变化状态,能够表示膜通道孔的开放状态。作为荧光探针,它的优势极大,同时具有较高的灵敏度。
86.①
配置染色工作液。
87.②
取样品细胞制备单细胞悬液,每个样品中加入3μl工作液混匀。
88.③
加入5μl淬灭剂,混匀。
89.④
加入5μl通透剂,混匀。
90.⑤
没管中加入3ml 1x mptp染色buffer。
91.⑥
离心并收集细胞。
92.⑦
buffer重悬,将样品置于冰上,1小时内进行流式分析。
93.对动物组织进行单细胞化处理,若细胞线粒体膜通透性正常,则绿色荧光较强。若绿色荧光较弱,则表示线粒体膜通道孔mptp持续开放,呈现病理状态。用流式488发射器进行荧光分析获得如图4-图6所示结果。
94.从结果显示可知,采用本发明提供的消融方法获得的单细胞中线粒体的膜通透性正常度高于本技术人的在先研究,并获得突出的技术效果;同时,更明显优于其他现有技术所获得的单细胞,如miltenyi全自动单细胞处理仪处理获得的单细胞。说明在线粒体的膜通透性方面,本发明提供的方法能够完整的将线粒体功能予以保留,不会引起线粒体的异常甚至失活的问题。
95.实施例8:
96.在实施例3-实施例5制备单细胞悬液的基础上,进一步提供一种提取线粒体的方法,具体包括消融的步骤和提取分离线粒体的步骤;
97.所述消融的步骤采用实施例3-实施例5中所述的消融方法实现;
98.所述提取分离线粒体通过下述实现:
99.步骤st700,将步骤st600获得的单细胞悬液进行4℃,1000g离心10min,去上清将细胞重悬于1.5ml预冷的buffer中,进行破碎;
100.步骤st800,在4℃,1000g离心10min,转移上清至干净的1.5mlep管中,4℃,6000g离心10min,去上清,沉淀重悬到750ul的线粒体钝化buffer中;
101.步骤st900,吸取线粒体钝化buffer顶部的线粒体悬液,4℃,14000g离心15min;去上清,吸取底部的线粒体层转移到新ep管中,以1.5ml的线粒体储存液重悬,4℃,8000g离心10min;
102.步骤st1000,去上清,5ml线粒体储存液重悬,4℃,8000g离心10min,重复洗涤直至线粒体在管底部呈颗粒,重悬颗粒完成线粒体提取。
103.本实施例将针对提取的线粒体进行ca
2+
和atp测定,具体如下:
104.关于ca
2+
的测定:线粒体中的ca
2+
被称为氧化磷酸化的中心调节剂,其在氧化磷酸化中发挥着重要作用。线粒体ca
2+
积累会触发线粒体中atp合成的增加,并增强细胞质中的atp水平。相反,线粒体ca
2+
积累的减少会导致线粒体atp浓度降低。测定线粒体中的ca
2+
水
平,能够有效反映线粒体的功能。因此,测定有效的atp浓度即可客观的反应线粒体的活性状态或存活占比。
105.关于atp的测定:线粒体呼吸是将底物能量转化为atp的过程。因而,对线粒体atp水平的测定是评估线粒体功能的重要指标之一。
106.①
配置1.0ml的1x反应缓冲液。
107.②
将10mm的d-luciferin原液加入至1毫升1x的反应缓冲液中。
108.③
加入1.62毫升水至25mgddt中,配制100 mm dtt储存液。
109.④
稀释法配制低浓度的atp标准溶液。
110.⑤
配置标准反应溶液,轻轻翻转试管,不要涡旋。
[0111][0112]
表1为atp标准溶液浓度表
[0113]
根据表1中的标准浓度参数绘制atp浓度标准曲线,具体如图7所示。
[0114]
其中,a1代表第一次吸光度测定数值;a2代表第二次吸光度测定数值;a3代表第三次吸光度测定数值;meana代表平均吸光度测定数值;
△
a代表相邻两个浓度之间的吸光度差值。
[0115]
将本实施例中分别将实施例3-实施例5中所获小鼠肝脏单细胞悬液进行线粒体提取后进行线粒体吸光度测定,重复进行三次并分别记录相应数值计算平均数值如下表2所示:
[0116]
名称实施例3实施例4实施例5第一次10000100009216第二次10000100009164第三次9988100009396平均值9996100009258.667δa2916.6672920.6672179.333浓度(nm)354.2647354.8974237.6368
[0117]
表2为样品atp测定浓度表
[0118]
由上表2可知,实施例3和实施例4消融所获单细胞的atp浓度相当,明显高于实施例5的atp浓度约117nm,具有显著进步。充分说明了采用本技术提供的消融试剂盒及其消融方法获得的单细胞能够极佳的保留细胞的原有活性,不会因消融过程而导致细胞器,如线粒体的损伤或死亡。
[0119]
值得说明的是,当线粒体受到外界伤害损伤或者死亡后则不能继续合成atp,将导致atp的浓度急剧降低,同时已合成的atp将分解导致无法检测到,故而通过检测atp浓度就能够获知线粒体的活性程度,获知在整个处理过程中对细胞及细胞器是否具有伤害性。
[0120]
实施例9:
[0121]
本实施例是检测线粒体相关基因的转录水平情况,从而判定线粒体是否在组织消融过程中受到异常刺激或者伤害,导致线粒体转录水平异常或者根本丧失。
[0122]
分别从小鼠肝脏,心脏,肾脏,脾脏,脑组织,肺组织,肌肉脂肪组织单细胞样品中提取rna,并与用qiagen直接从组织中提取的rna作对比,由于用qiagen直接从组织中提取的rna能够保证其线粒体相关基因表达水平的真实性,因此,通过rt-qpcr,比较各单细胞样品中线粒体相关基因的表达水平与qiagen提取的组织rna中的线粒体相关基因表达水平的差异,能够对比qiagen法、本发明、miltenyi法之间对细胞线粒体相关基因表达情况的影响。
[0123]
①
对肝脏,心脏,肾脏,脾脏,脑组织,肺组织,肌肉脂肪组织单细胞化处理后的样品分别采用相同的现有技术进行rna提取。
[0124]
②
使用qiagen直接对肝脏,心脏,肾脏,脾脏,脑组织,肺组织,肌肉脂肪组织进行rna提取。
[0125]
③
去除基因组dna反应:
[0126]
按如下成分于冰上配制反应混合液,为了保证反应液配制的准确性,进行各项反应时,应先按反应数+2的量配制master mix,然后再分装到每个反应管中,最后加入rna样品。
[0127][0128]
20μl反转录反应体系中,tb green qpcr法最多可使用1μg的total rna,探针qpcr分析法最多可使用2μg的total rna。配置好反应体系后,42℃2min,4℃+∞。
[0129]
④
反转录反应:
[0130]
反应液配制要在冰上进行。
[0131]
为了保证反应液配制的准确性,进行各项反应时,应先按反应数+2的量配制master mix,然后再分装10μl到每个反应管中。轻柔混匀后立即进行反转录反应。
[0132]
采用tb green qpcr法,使用的试剂及用量如下:
[0133][0134]
反应条件:37℃15min
*6
[0135]
85℃5sec
[0136]
4℃
*7
[0137]
⑤
real time pcr:
[0138]
tb green premix ex tag ii(2x)(tli rnaseh plus),bulk使用量:10.0μl;终浓度1x
[0139][0140]
反应条件:
[0141]
holding stage
[0142]
step 1:95℃30sec
[0143]
cycling stage
[0144]
number of cycles:40
[0145]
step 1:95℃3sec
[0146]
step 2:60℃30sec
[0147]
melt curve stage
[0148]
⑥
反应结束后确认real time pcr的扩增曲线和融解曲线,制作标准曲线,并进行结果分析。其中,肝脏,心脏,脾脏,肾脏,肌肉,肺和脂肪组织转录水平结果分析如图8-图15所示。其中附图中:
[0149]
a表示用qiagen法直接提取rna;
[0150]
b表示利用实施例2中提供消融仪配合本发明实施例3提供的消融方法获取的单细
胞后提取的rna;
[0151]
c表示实施例4获取的单细胞后提取的rna;
[0152]
d表示miltenyi方法获取的单细胞后提取的rna;
[0153]
通过图8-图15可以看出,本发明提供的方案与miltenyi单细胞化方法处理后的样品所提取的rna与qiagen直接提取的组织rna比较,其线粒体相关基因的表达情况存在明显差异,采用本发明消融试剂及方法处理获得的单细胞样品所提取的rna与qiagen直接提取的组织rna比较,其线粒体相关基因的表情情况基本相当,表明本发明实验方法对组织单细胞化处理后对细胞线粒体基因表达不造成影响,适合用于细胞或组织异质性实验研究。其中实施例4获得的单细胞试验结果鉴于qiagen直接提取方法与本发明之间,究其原因在于实施例4与本发明采用的消融混合试剂存在差异。最为主要的区别在于增加了微量的溴化乙锭。从多大8中组织的基因表达实验中均充分表面,增加了适量的溴化乙锭后,如5-10ug/ml,在不同组织的基因表达实验中均可获得与qiagen直接提取的组织rna比较基本相当的结果,说明采用本发明所述消融试剂及方法获得的单细胞充分的保留了细胞原有的功能和活性,至少在rna的基因表达方面得到了完整的保留。
[0154]
以上所述仅为本技术的优选实施例而已,并不用于限制本技术,对于本领域的技术人员来说,本技术可以有各种更改和变化。凡在本技术的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1