一种壳聚糖-二氢卟吩e6抗菌剂及其制备方法
本发明属于抗菌剂制备领域,具体涉及到一种壳聚糖-二氢卟吩e6抗菌剂的制备方法。
背景技术:
光动力学杀菌是一种利用光敏剂、光和氧气产生活性氧杀菌的方法。光动力学抗菌剂是一类在特定波长光照射下能够对细菌产生杀灭效果的物质,由于其具有可控性及高效性的优点,近年来被广泛研究。
二氢卟吩e6是一种高效的光敏剂,主要由叶绿素ⅱ提取物制备得到。二氢卟吩e6具有优良的活性氧产生效率,可被近红外光激发并且具有低暗毒性。但是二氢卟吩e6的低水溶性和低细菌亲和性限制了它的应用,需要寻找合适的载体。
壳聚糖是一种来源广泛、无毒、具有抗菌性的多糖,它是生物界中大量存在的唯一的一种阳离子多糖,可通过甲壳素脱乙酰制备而成。壳聚糖有一定抗菌性,但其抗菌性相对于市场上的抗菌物质效果差,因此为扩大壳聚糖的应用范围,开发出具有优良性能的新化合物,需要对壳聚糖进行各种改性研究,目前研究应用较多的是化学改性。
目前,尚无将壳聚糖与二氢卟吩e6结合作为抗菌剂的研究报道。
技术实现要素:
本部分的目的在于概述本发明的实施例的一些方面以及简要介绍一些较佳实施例。在本部分以及本申请的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
鉴于上述和/或现有抗菌剂领域的技术空白,提出了本发明。
因此,本发明其中的一个目的是解决现有技术中的不足,提供了一种壳聚糖-二氢卟吩e6抗菌剂。
为解决上述技术问题,本发明提供了如下技术方案:一种壳聚糖-二氢卟吩e6抗菌剂,所述壳聚糖-二氢卟吩e6抗菌剂,其化学结构式如下i-a所示:
其中,x为下式i-b的基团,并于d点同壳聚糖的氮连接;
所述壳聚糖-二氢卟吩e6的氨基取代度为6.44%~11.68%,二氢卟吩e6占抗菌剂总重量的13.48%~22.04%。
作为本发明所述壳聚糖-二氢卟吩e6抗菌剂的一种优选方案,其中:所述壳聚糖分子量为50kda,脱乙酰度为90%以上。
因此,本发明其中的再一个目的是解决现有技术中的不足,提供了一种壳聚糖-二氢卟吩e6抗菌剂的制备方法。
为解决上述技术问题,本发明提供了如下技术方案:一种壳聚糖-二氢卟吩e6抗菌剂的制备方法,包括,
将壳聚糖溶解在醋酸溶液中,将其ph调至5.8~6.0,得到壳聚糖溶液;
将1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐edc和n-羟基琥珀酰亚胺nhs溶解在吗啉乙磺酸mes缓冲液中,得到edc/nhs的mes溶液;
将二氢卟吩e6溶解在二甲亚砜中,加入到edc/nhs的mes溶液中,室温条件下避光搅拌;
将搅拌结束后所得的混合溶液,滴加至壳聚糖溶液中,室温条件下避光搅拌,将所得混合液用超纯水透析,透析结束后,将所得溶液在-80℃预冻过夜,冻干,得到产物充分研磨成粉末,即得所述壳聚糖-二氢卟吩e6抗菌剂。
作为本发明所述壳聚糖-二氢卟吩e6抗菌剂制备方法的一种优选方案,其中:所述将壳聚糖溶解在醋酸溶液中,其中,醋酸溶液的体积浓度为1%,壳聚糖和醋酸溶液的质量体积比以mg:ml计为6:5。
作为本发明所述壳聚糖-二氢卟吩e6抗菌剂制备方法的一种优选方案,其中:所述将其ph调至5.8~6.0,得到壳聚糖溶液,其中,ph调节剂为1mol/l氢氧化钠溶液,壳聚糖溶液浓度为1mg/ml。
作为本发明所述壳聚糖-二氢卟吩e6抗菌剂制备方法的一种优选方案,其中:所述将1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐edc和n-羟基琥珀酰亚胺nhs溶解在吗啉乙磺酸mes缓冲液中,其中,edc与nhs质量比为55:66,mes缓冲液与edc体积质量比以ml:mg计为1:11。
作为本发明所述壳聚糖-二氢卟吩e6抗菌剂制备方法的一种优选方案,其中:所述将二氢卟吩e6溶解在二甲亚砜中,加入到edc/nhs的mes溶液,其中,二氢卟吩e6与二甲亚砜质量体积比mg:ml为14~56:5,二甲亚砜与edc/nhs的mes溶液体积比为1:1。
作为本发明所述壳聚糖-二氢卟吩e6抗菌剂制备方法的一种优选方案,其中:所述壳聚糖-二氢卟吩e6,其中,二氢卟吩e6与壳聚糖氨基的摩尔比为5~20:100,所述超纯水透析,其时间为3天,透析袋截断分子量为8000da~14000da。
作为本发明所述壳聚糖-二氢卟吩e6抗菌剂制备方法的一种优选方案,其中:所述室温为25℃,冻干温度为-80℃,过夜时间为12h,所述冻干为在冻干机中冻干48h。
本发明其中的另一个目的是解决现有技术中的不足,提供了一种壳聚糖-二氢卟吩e6作为抗菌活性成分在抗菌领域中的应用。
本发明有益效果:
本发明提供了一种新型物质壳聚糖-二氢卟吩e6的制备方法,制备方法简单、成本低、提纯方法简便,得到的壳聚糖衍生物具有良好的热稳定性和抗菌活性,对金黄色葡萄球菌和大肠杆菌等均具有很好的抑制作用,在农业、医药等领域都有很好的应用前景。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
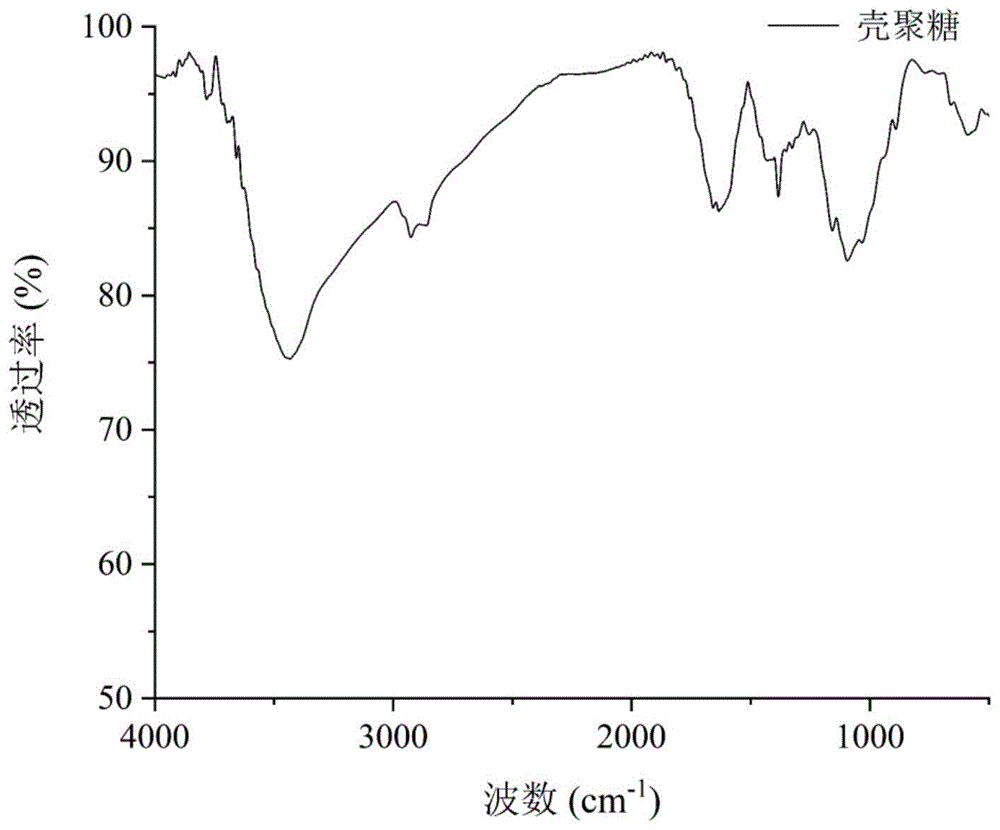
图1是壳聚糖的红外谱图。
图2是本发明实施例中制备的壳聚糖-二氢卟吩e6的红外谱图。
图3是壳聚糖的1h核磁共振图谱。
图4是本发明实施例中制备的壳聚糖-二氢卟吩e6的1h核磁共振图谱。
图5是实施例4中产物的1h核磁共振图谱。
图6是壳聚糖、二氢卟吩e6、壳聚糖-二氢卟吩e6的热失重率曲线图(tg)。
图7是壳聚糖、二氢卟吩e6、壳聚糖-二氢卟吩e6的热失重率曲线图的一阶导数曲线图(dtg)。
图8是壳聚糖和壳聚糖-二氢卟吩e6使1,3-二苯基异苯并呋喃(dpbf)的降解情况。
图9是壳聚糖和壳聚糖-二氢卟吩e6对金黄色葡萄球菌和大肠杆菌的抑制效果对比图,其中,(a)金黄色葡萄球菌;(b)大肠杆菌。
图10是壳聚糖-二氢卟吩e6的合成路线图。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合说明书实施例对本发明的具体实施方式做详细的说明。
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
其次,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
本发明所述的壳聚糖-二氢卟吩e6的制备方法如下:在ph6.0的条件下,首先利用edc/nhs化学体系对二氢卟吩e6的羧基进行活化,然后使其与壳聚糖的氨基反应。产物经过透析纯化、冻干后得到最终产物壳聚糖-二氢卟吩e6,其合成路线如图10。
实施例1:
壳聚糖-二氢卟吩e6的制备方法包括以下步骤:
利用edc/nhs法合成壳聚糖-二氢卟吩e6。
首先,将壳聚糖(120mg)溶解在100ml醋酸溶液(1%,v/v)中,用1mol/l氢氧化钠溶液将其ph调至6.0左右,加超纯水至120ml得到1mg/ml的壳聚糖溶液。
然后,将edc(55mg)和nhs(66mg)溶解在5mlmes缓冲液(mes:0.05mol/l;用1mol/l氢氧化钠溶液调整ph至6.0)中,将二氢卟吩e6(56mg)分别溶解在5ml二甲亚砜中,所得二氢卟吩e6溶液加入到edc/nhs的mes溶液中,室温条件下避光搅拌4h,转速为400rpm。
将搅拌结束后所得的混合溶液滴加至上述壳聚糖溶液中,室温条件下避光搅拌24h,将所得混合液对超纯水透析3天,所用透析袋截断分子量为8000da~14000da。透析结束后,将所得溶液在-80℃预冻过夜,放入冻干机中冻干48h,得到产物后充分研磨成粉末,产物得率在65%,产品取代度为11.68%。
图1为壳聚糖的红外光谱。其中,3433cm-1处的宽峰由o-h和n-h伸缩振动引起,2926cm-1和1384cm-1处的峰由c-h伸缩振动引起,1635cm-1处的峰由壳聚糖中c=o的伸缩振动引起,即酰胺ⅰ的峰,1095cm-1处的峰由c-o伸缩振动引起,1158cm-1附近的峰由醚氧键(c-o-c)的不对称伸缩振动引起,592cm-1附近的峰由壳聚糖糖环振动引起。
图2是本实施例中制备的壳聚糖-二氢卟吩e6的红外谱图。其中,1635cm-1处酰胺ⅰ的峰强度明显增强,初步表明产物的成功合成。
图3是壳聚糖的1h核磁共振图谱。壳聚糖中葡萄糖环上的氢原子的特征峰出现在3.25ppm~4.19ppm;n-乙酰基单体上甲基氢原子的特征峰出现在2.07ppm;δ=5.02ppm为溶剂峰。
图4是本实施例中制备的壳聚糖-二氢卟吩e6的1h核磁共振图谱。δ=9.00ppm、δ=8.64ppm、δ=7.72ppm分别为属于二氢卟吩e6卟吩环上氢的吸收峰;核磁结果与红外结果一致,表明壳聚糖-二氢卟吩e6的成功合成。
实施例2:
首先,将壳聚糖(120mg)溶解在100ml醋酸溶液(1%,v/v)中,加超纯水至120ml得到1mg/ml的壳聚糖溶液。
然后,将二氢卟吩e6(56mg)分别溶解在5ml二甲亚砜中,加入edc(55mg)和nhs(66mg),室温条件下避光搅拌4h,转速为400rpm。
将搅拌结束后所得的混合溶液滴加至上述壳聚糖溶液中,室温条件下避光搅拌24h。在14000rpm下离心20min提纯产物,但由于产物在体系中可溶无法得到目标产物。
实施例3:
首先,将壳聚糖(120mg)溶解在100ml醋酸溶液(1%,v/v)中,加超纯水至120ml得到1mg/ml的壳聚糖溶液。
然后,将二氢卟吩e6(56mg)分别溶解在5ml二甲亚砜中,加入edc(55mg)和nhs(66mg),室温条件下避光搅拌4h,转速为400rpm。
将搅拌结束后所得的混合溶液滴加至上述壳聚糖溶液中,室温条件下避光搅拌24h。加入三倍反应体系的丙酮使产物沉淀,然后在14000rpm下离心20min提纯产物。但加入丙酮后体系体积过大,需要使用多根离心管进行离心,在混合过程中产物损失较大导致产物收率过低只有20%左右。
实施例4:
首先,将壳聚糖(120mg)溶解在100ml醋酸溶液(1%,v/v)中,加超纯水至120ml得到1mg/ml的壳聚糖溶液。
然后,将二氢卟吩e6(56mg)分别溶解在5ml二甲亚砜中,加入edc(55mg)和nhs(66mg),室温条件下避光搅拌4h,转速为400rpm。
将搅拌结束后所得的混合溶液滴加至上述壳聚糖溶液中,室温条件下避光搅拌24h,将所得混合液对超纯水透析3天,所用透析袋截断分子量为8000da~14000da。
透析结束后,将所得溶液在-80℃预冻过夜,放入冻干机中冻干48h,得到产物后充分研磨成粉末。
图5为实施例4中终产物的1h核磁图谱,从图中可以看出没有出现二氢卟吩e6的特征峰,推测其原因可能是羧基活化过程中ph以及和氨基反应过程中ph未得到控制,中间产物降解导致的氨基和羧基反应成功率过低,因此1h核磁中体现不出二氢卟吩e6的信号。
实施例5:
壳聚糖、二氢卟吩e6及壳聚糖-二氢卟吩e6的热稳定性测定:
利用tga2热分析系统对壳聚糖、二氢卟吩e6及壳聚糖-二氢卟吩e6的热稳定性进行分析。
精密称量5mg左右样品于坩埚中,测定条件为n2流速20ml/min,升温速率20℃/min,测定温度范围为25℃~450℃。
图6是本实施例中制备的壳聚糖-二氢卟吩e6的tg曲线。可以看出,壳聚糖和壳聚糖-二氢卟吩e6随温度的升高,逐渐失重。
图7是本实施例中制备的壳聚糖-二氢卟吩e6的dtg曲线。可以看出,二氢卟吩e6在25℃~450℃之间存在一个失重阶段,发生于140℃~250℃,壳聚糖在25℃~450℃之间存在两个失重阶段。一阶失重发生于40℃~160℃,二阶失重发生于230℃~380℃。改性后的壳聚糖-二氢卟吩e6在25℃~450℃之间也存在两个失重阶段。其中一阶失重在40℃~160℃,与壳聚糖相同,二阶失重在220℃~390℃,与壳聚糖相近。由此可见,壳聚糖-二氢卟吩e6的热稳定性与壳聚糖相近,较二氢卟吩e6有所提高。
实施例6:
壳聚糖-二氢卟吩e6产活性氧能力测定
产物产生活性氧的能力利用dpbf作为活性氧探针测定。dpbf溶于二甲亚砜,配制25μg/ml的dpbf溶液。取dpbf溶液150μl与3ml样品溶液(100μg/ml)均匀混合后,在660nm激光源下以13mw/cm2的光密度照射。每照射1min,测定混合液的紫外-可见吸收光谱。不加任何样品的超纯水设置为空白对照。
本实施例中的活性氧测定结果如图8所示,壳聚糖-二氢卟吩e6具有良好的活性氧产生能力。
实施例7:壳聚糖-二氢卟吩e6抗菌性测定
通过测定壳聚糖、二氢卟吩e6及壳聚糖-二氢卟吩e6对大肠杆菌和金黄色葡萄球菌的最小抑菌浓度(mic)和最小杀菌浓度(mbc),对产物的抗菌性进行测定。
mic和mbc的测定采用肉汤微稀释法,具体测定步骤如下:
菌种活化:取出-80℃冰箱中的保藏菌种使其融化,在安全柜中操作,以2%接种量接种于lb液体培养基。置于37℃摇床中过夜培养活化,摇床转速为160rpm,将活化后的菌液以2%接种量接种于新鲜lb培养基,摇床培养至菌液浊度与0.5麦氏比浊管相当(5h~6h)。
菌液制备:将上述所得菌液用mh液体培养基稀释1000倍,即可得到抗菌实验所用菌液(菌液浓度≈1.5×105cfu/ml)。
抗菌样品液:将样品溶于1%(v/v)醋酸溶液,用1mol/l氢氧化钠溶液调节其ph为6.0左右,分别配制成浓度为2.0mg/ml的壳聚糖溶液和壳聚糖-二氢卟吩e6溶液,0.3mg/ml的二氢卟吩e6溶液。
样品液梯度稀释:在96孔板每行的第一孔加200μl抗菌样品液,取100μl至第二孔,向第二孔加100μl无菌生理盐水,混合均匀后吸取100μl至第三孔,以此类推,连续稀释至第十孔,丢弃最后100μl,最终得到浓度范围为1000~2μg/ml的壳聚糖和壳聚糖-二氢卟吩e6溶液以及浓度范围为300~0.6μg/ml的二氢卟吩e6溶液。
混合:向96孔板每孔加入100μl菌液,以无菌生理盐水作为空白,每个样品设置3组平行,实验重复3次。混合均匀后在避光的37℃培养箱中放置30min。
光照:将96孔板放置在660nm激光源下进行光照,光照强度为200mw/cm2,光照时间为5min,光照后将96孔板放置在37℃培养箱中培养24h,每块板设置对应的无光组,确定黑暗条件下样品对细菌生长的影响。
mic和mbc确定:将目测清澈的孔中最小浓度记为该样品的mic值,将所有目测清澈的孔吸取100μl涂布在mh琼脂平板上,37℃培养24h后,将无菌落生长的最大浓度记为mbc。
壳聚糖、二氢卟吩e6及各种取代度的壳聚糖-二氢卟吩e6的mic和mbc如表1所示。
表1.各产物的mic和mbc
其中,产物1是在实施例1的条件下,将二氢卟吩e6的含量替换为14mg,其他步骤同实施例1制得;产物2是在实施例1的条件下,将二氢卟吩e6的含量替换为28mg,其他步骤同实施例1制得。
在本实施例中对产物取代度进行了优选,对比3种二氢卟吩e6取代度产物(6.44%、821%、11.68%)的mic和mbc,选择抗菌性最好的作为目标产物,此时二氢卟吩e6对壳聚糖的氨基取代度为11.68%。同时,壳聚糖-二氢卟吩e6明显具有比壳聚糖和二氢卟吩e6更低的mic和mbc,表明壳聚糖-二氢卟吩e6具有更强的抗菌效果。
实施例8:
壳聚糖-二氢卟吩e6抗菌效果测定
为了能够更加清楚地了解产物的抗菌效果差异,利用平板法对初始浓度为100μg/ml的壳聚糖、壳聚糖-二氢卟吩e6和50μg/ml的二氢卟吩e6进行了抗菌效果的测定。
实验方法如下:制备浓度约为105cfu/ml的菌液,将菌液与样液按照1:1的体积比混合均匀后在37℃培养箱中放置30min,在660nm激光源下以200mw/cm2的光密度照射5min,随后吸取100μl混合液涂布在lb琼脂平板上,37℃培养箱中培养24h后观察细菌生长情况。
壳聚糖、二氢卟吩e6及壳聚糖-二氢卟吩e6对金黄色葡萄球菌和大肠杆菌的抑制效果,在图9中显示。
据观察,改性后的材料有良好的抗菌性,并且相对于壳聚糖和二氢卟吩e6,对细菌的抑制效果明显增强。
本发明利用了光敏剂在光照下产生活性氧杀菌的原理(即光动力学原理),得到的抗菌剂不会产生耐药性,杀菌作用强,并且可以通过控制光照来控制杀菌效果;同时,对于ce6的羧基活化处理尝试过直接将edc和nhs溶解在水里然后调ph去做合成,但是反应成功率不高,基本没有得到产物。
壳聚糖上有三个改性位点,分别为c-2位氨基、c-3位羟基、c-6羟基,二氢卟吩e6上含有羧基,通过氨基与羧基之间的反应,可以将二氢卟吩e6修饰在壳聚糖上,对壳聚糖进行化学改性,壳聚糖作为二氢卟吩e6的载体,二者结合可以作为一种新型光动力学抗菌剂应用于杀菌领域。
鉴于以上,本设计人以期创设一种壳聚糖-二氢卟吩e6抗菌剂的制备方法,提高壳聚糖和二氢卟吩e6在抗菌领域中的应用价值。本发明提供了一种新型物质壳聚糖-二氢卟吩e6的制备方法,制备方法简单、成本低、提纯方法简便,得到的壳聚糖衍生物具有良好的热稳定性和抗菌活性,对金黄色葡萄球菌和大肠杆菌等均具有很好的抑制作用,在农业、医药等领域都有很好的应用前景。
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!