一种可被OGT识别的半乳糖修饰检测探针
本发明涉及生物活体标记领域,具体涉及一种半乳糖修饰水平检测探针。
背景技术:
glcnac糖基化是将单个n-乙酰葡萄糖胺(n-acetylglucosamine,glcnac)分子连接在蛋白质丝氨酸或苏氨酸的羟基上的一种动态可逆的翻译后修饰,在细胞转录、信号转导、蛋白质降解和凋亡等生物进程中发挥关键作用。o-glcnac糖基化作为一种重要的蛋白质翻译后修饰,是由o-glcnac转移酶(o-glcnactransferase,ogt)和o-glcnac糖苷水解酶(o-glcnacase,oga)动态调控的。细胞内o-glcnac糖基化的供体底物udp-glcnac主要是由营养物质代谢后通过己糖胺合成途径(hexosaminebiosyntheticpathway,hbp)而来。人体中,大约有2%~5%葡萄糖通过hbp信号通路进入udp-glcnac的生物合成。除此之外udp-glcnac的生物合成也需要氨基酸、脂肪酸和核苷酸的参与,研究表明,ogt活性及o-glcnac糖基化水平很大程度上依赖于细胞中供体底物udp-glcnac的水平。细胞内o-glcnac糖基化的程度通常反映了udp-glcnac水平的改变,被认为是人体营养物质代谢水平的传感器。
近年来o-glcnac异常糖基化在肿瘤发病机制和治疗靶点研究领域成为热点,通过对特定生物大分子的化学标记,可以从分子、细胞和个体等多个层次揭示生物大分子动态修饰的特征和调控机制。随着蛋白质组学和质谱检测技术的快速发展,已鉴定到大量的o-glcnac修饰蛋白和位点,而其中多数蛋白质o-glcnac糖基化修饰的生理功能亟需通过探针进一步研究。针对o-glcnac糖基化特定位点的动态调控开发高效特异的个性化分子探针,对进一步揭示o-glcnac在疾病发生发展过程中的作用至关重要,也是实现临床分子诊断并进行靶向干预的关键。
bertozzi课题组利用hbp补救途径先后开发了两种经典探针全乙酰化叠氮基乙酰葡萄糖胺ac4glcnaz(1)和全乙酰化叠氮基乙酰半乳糖胺ac4galnaz(2);pratt课题组开发的6-炔基-6-脱氧-乙酰氨基半乳糖(6alkac3glcnac,3)可以特异性标记胞内蛋白,并且发现caspase-8发生o-glcnac糖基化后可以抑制其活化进而减少细胞凋亡;vocadlo课题组将具有荧光性能的硝基苯恶二唑(nitrobenzoxadiazole,nbd)与氨基葡萄糖的二位氨基相连制备glcn-nbd,该探针可以在细胞内一步标记o-glcnac糖基化修饰蛋白;北京大学陈兴教授课题组最近报道了两种部分丙酰基修饰的非天然糖1,3-pr2galnaz(4)和1,6-pr2galnaz,他们发现,galnaz羟基的部分酰基化能够显著提高galnaz的代谢标记效率,同时避免s-糖基化副反应的发生。利用这种新型的非天然糖,他们在小鼠胚胎干细胞中鉴定出一种esrrb转录因子能够被o-glcnac糖基化修饰,该esrrb的o-glcnac糖基化对在mesc的再生和多能性中发挥关键的作用;此外,陈兴教授课题组前期还利用脂质体靶向策略实现了对肿瘤选择性的标记。
虽然已经开发了很多用于研究o-glcnac糖基化修饰的探针分子,其主要结构是在glcnac的2位、4位或者6位进行修饰(这些修饰基团包括叠氮基,炔基,羰基,双吖丙啶等)。然而最近研究发现调控o-glcnac糖基化修饰的ogt转移酶对底物具有混乱性,可以识别非glcnac为底物的udp-sugar,比如udp-6-n3-glucose。
技术实现要素:
为解决上述问题,本发明提供了一种半乳糖修饰水平检测探针。
为实现上述目的,本发明采取的技术方案为:
一种半乳糖修饰水平检测探针,该检测探针为6azac4galactose,化学结构如下:
所述修饰受o-glcnac糖基转移酶ogt和o-glcnac糖基水解酶oga调控。ogt通过识别udp-6azgalatcose发生相应的糖基化修饰实现半乳糖修饰水平的检测。
本发明所开发的6azac4galactose探针可以在检测半乳糖在病理生理等条件下修饰水平的变化,对半乳糖代谢相关疾病的诊断治疗提供可靠方法。
附图说明
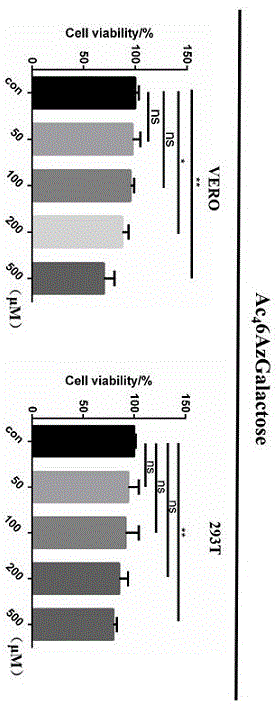
图1为ac46azgalactose对vero和293t细胞的毒性测试结果图。
图2为ac46azgalactose代谢标记对浓度和时间的依赖性的示意图。
图3为ac46azgalactose代谢标记受ogt和oga调控示意图。
图4为leloir通路中关键酶galt和gale对ac46azgalactose代谢标记的影响示意图。
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。
实验例1
(1)细胞培养
将hek293t和vero细胞接种在含有dmem完全培养基(90%dme,10%fbs和1%ps)的培养皿中,在37℃,5%co2细胞培养箱中培养至密度90%左右,弃去培养基用pbs洗一遍,加入胰酶进行消化至细胞收缩变圆后加入dmem完全培养基终止消化。用移液枪将细胞轻轻吹下后,转移至15ml离心管,500rpm,5min离心收集细胞,弃去上清,用dmem完全培养基重悬为5×104cfu/ml,用于细胞毒性分析。
(2)cck-8法测ac46azgalactose的细胞毒性
将上述处理好的细胞悬液加入96孔板中,每孔100μl即每孔1000个细胞,放于细胞培养箱中。细胞培养4h左右贴壁后,弃去培养基,换上低糖dmem完全培养基,然后每孔以终浓度梯度0、50、100、200、500和1000μm的ac46azgalactose进行处理,样品周围孔加入100μl的pbs,每组设置三个平行组。加盖培养板后放入细胞培养箱孵育48h。然后每孔加入10μlcck-8溶液,37℃孵育2h,全程避光,检测450nm处的吸光度。所得统计数据用graphpadprime6软件进行数据分析
结果1:ac46azgalactose在200um浓度下没有明显的细胞毒性
实验例2:ac46azgalactose浓度依赖性实验
(1)将处理好的hek293t细胞悬液以每孔均匀密度接种在含有dmem完全培养基(90%dmem,10%fbs和1%ps)的6孔板培养皿(corning)中,在37℃,5%co2细胞培养箱中培养至密度70%左右。
(2)弃去培养基,换上低糖dmem完全培养基,然后每孔加入ac46azgalactose,使每孔终浓度依次为0、100、200、500μm进行标记处理,然后在37℃,5%co2细胞培养箱中孵育16h。
(3)收集细胞蛋白:提前配置好lysisbuffer细胞裂解液(1%np-40、150mmnacl、2mmmgcl2、10%甘油、tritonx-100和50mmtris,ph=7.4)其中裂解液中还包括1%蛋白酶抑制剂和1%pmsf,弃去培养基,用1mlpbs洗一遍,每孔加200μl的细胞裂解液,冰上4℃用细胞刮刮取细胞,转移至已标记好的1.5ml离心管管,进行4℃裂解30min。然后4℃12000rpm离心20min。将上清转移至已标记好的新的1.5ml离心管管中,进行蛋白定量。
(4)使用bca蛋白浓度测定法测定:按照bca蛋白定量检测试剂盒说明书进行蛋白浓度测定。
(5)click标记反应:取以定量好的蛋白于1.5ml离心管,每个样品蛋白量200μg,以lysisbuffer裂解液将每个蛋白样体积补至180μl,然后依照体系每管样品依次加入cuso40.2μl和thpta0.4μl混匀,再加入biotin-peg4-alkyne0.2μl混匀,再加入navc20μl混匀,室温避光轻轻震荡孵育2h。然后每管加入500μl冰甲醇放于-80℃冰箱2小时,析出蛋白。
(6)样品制备:将上步处理好的样品进行4℃10000g离心10min,弃去上清,加入1ml冰甲醇充分重悬蛋白,进行洗涤,此操作重复两次。之后弃去上清,打开管盖,进行常温晾干蛋白。然后每管加入40μl4%sds蛋白溶解液,待蛋白充分溶解后加10μl5×loadingbuffer,混匀后沸水煮10min,冷却至室温后,12000rpm离心5min,于-20℃保存。
(7)westernblot检测:制备好浓度为10%的蛋白胶,每孔上20μl蛋白样品。然后电泳跑胶2h,以恒流280ma转膜2h,之后用含5%脱脂奶粉的tbst在摇床上室温封闭2h。然后将膜用以1:10000稀释的streptavidin-hrp抗体进行室温孵育2h。孵育后将膜放于tbst中,在摇床上洗3次,每次10min。最后进行曝片,分析结果。
结果2:不同浓度的ac46azgalactose对a549细胞的标记效果,结果表明,随着浓度的升高,ac46azgalactose标记效果越强,具有浓度依赖性。
实验例3:ogt和oga抑制剂对ac46azgalactose代谢标记影响实验
(1)将处理好的hek293t细胞悬液以每孔均匀密度接种在含有dmem完全培养基(90%dmem,10%fbs和1%ps)的6孔板培养皿(corning)中,在37℃,5%co2细胞培养箱中培养至密度70%左右。
(2)弃去培养基,换上低糖dmem完全培养基,然后每孔加入终浓度为200μm的ac46azgalactose进行标记处理,同时选取两个孔分别加入ogt抑制剂omsi终浓度为50μm和oga抑制剂o-(2-乙酰氨基-2-脱氧-d-吡喃葡萄糖亚基氨基)-n-苯基氨基甲酸酯(pugnac)终浓度为50μm,然后在37℃,5%co2细胞培养箱中孵育20h。
(3)收集细胞蛋白:提前配置好lysisbuffer细胞裂解液(1%np-40、150mmnacl、2mmmgcl2、10%甘油、tritonx-100和50mmtris,ph=7.4)其中裂解液中还包括1%蛋白酶抑制剂和1%pmsf,弃去培养基,用1mlpbs洗一遍,每孔加200μl的细胞裂解液,冰上4℃用细胞刮刮取细胞,转移至已标记好的1.5ml离心管管,进行4℃裂解30min。然后4℃12000rpm离心20min。将上清转移至已标记好的新的1.5ml离心管管中,进行蛋白定量。
(4)使用bca蛋白浓度测定法测定:按照bca蛋白定量检测试剂盒说明书进行蛋白浓度测定。
(5)click标记反应:取以定量好的蛋白于1.5ml离心管,每个样品蛋白量200μg,以lysisbuffer裂解液将每个蛋白样体积补至180μl,然后依照体系每管样品依次加入cuso40.2μl和thpta0.4μl混匀,再加入biotin-peg4-alkyne0.2μl混匀,再加入navc20μl混匀,室温避光轻轻震荡孵育2h。然后每管加入500μl冰甲醇放于-80℃冰箱2小时,析出蛋白。
(6)样品制备:将上步处理好的样品进行4℃10000g离心10min,弃去上清,加入1ml冰甲醇充分重悬蛋白,进行洗涤,此操作重复两次。之后弃去上清,打开管盖,进行常温晾干蛋白。然后每管加入40μl4%sds蛋白溶解液,待蛋白充分溶解后加10μl5×loadingbuffer,混匀后沸水煮10min,冷却至室温后,12000rpm离心5min,于-20℃保存。
(7)westernblot检测:制备好浓度为10%的蛋白胶,每孔上20μl蛋白样品。然后电泳跑胶2h,以恒流280ma转膜2h,之后用含5%脱脂奶粉的tbst在摇床上室温封闭2h。然后将膜用以1:10000稀释的streptavidin-hrp抗体进行室温孵育2h。孵育后将膜放于tbst中,在摇床上洗3次,每次10min。最后进行曝片,分析结果。
结果3:ogt和oga抑制剂对ac46azgalactose代谢标记的影响。结果表明,ogt抑制剂omsi可以显著抑制其标记效果,而oga抑制剂可以增强其标记效果,以上结果进一步表明,该探针标记效率受ogt和oga调控。
实验例4:检测udp-galactose合成通路中相关酶半乳糖糖苷转移酶(galactosylepimerase,gale)和半乳糖糖苷转移酶(galactosyltransferase,galt)对ac46azgalactose代谢标记的影响
(1)干扰rna验证:首先我们对于两种酶合成了三个rna序列,galt(si893、si1019和si1043)和gale(si324、si899和si1100)。并通过q-ocr检测其三种rna的干扰效率均为70%以上。在后续的实验中我们选取了一对为galesi1100和galtsi1043。rna合成序列分别为galesi1100正向序列:5’-ggaagaagaucccguacaatt-3’反向序列:5’-uuguacgggaucuucctt-3’。galtsi1043正向序列:5’-gcuacgaaaugcuugcucatt-3’反向序列:
5’-ugagcaagcauuucguagctt-3’。sinc正向序列-uucuccgaacgugu
cacgutt-3’反向序列:5’-acgugacacguucggagaatt-3’。值得注意的是,序列两端的tt作为dna黏性末端,能更好的与靶基因序列互补结合,增加其稳定性。
(2)将处理好的hek293t细胞悬液以每孔均匀密度接种在含有dmem完全培养基(90%dmem,10%fbs和1%ps)的6孔板培养皿(corning)中,在37℃,5%co2细胞培养箱中培养至密度60%左右。
(3)干扰rna准备:a液(150μl的dmem中加入5μlgaltsi1043使终浓度为50nm、150μl的dmem中加入5μlgalesi1100使终浓度为50nm、150μl的dmem中加入2.5μlsinc使终浓度为50nm),b液(150μl的dmem中加入6μlrnamix、150μl的dmem中加入6μlrnamix、150μl的dmem中加入3μlrnamix)。然后依次对应的将b液加于a液中,用枪头上下轻柔混匀8次,静置5min,最后将混合液加于准备好的细胞中,放于细胞培养箱进行孵育6h后,换新的dmem完全培养基,继续作用48h。
(4)弃去培养基,换上低糖dmem完全培养基,然后每孔加入终浓度为200μm的ac46azgalactose进行标记处理,然后在37℃,5%co2细胞培养箱中孵育16h。
(5)收集细胞蛋白:提前配置好lysisbuffer细胞裂解液(1%np-40、150mmnacl、2mmmgcl2、10%甘油、tritonx-100和50mmtris,ph=7.4)其中裂解液中还包括1%蛋白酶抑制剂和1%pmsf,弃去培养基,用1mlpbs洗一遍,每孔加200μl的细胞裂解液,冰上4℃用细胞刮刮取细胞,转移至已标记好的1.5ml离心管,进行4℃裂解30min。然后4℃12000rpm离心20min。将上清转移至已标记好的新的1.5ml离心管管中,进行蛋白定量。
(6)使用bca蛋白浓度测定法测定:按照bca蛋白定量检测试剂盒说明书进行蛋白浓度测定。
(7)click标记反应:取以定量好的蛋白于1.5ml离心管,每个样品蛋白量200μg,以lysisbuffer裂解液将每个蛋白样体积补至180μl,然后依照体系每管样品依次加入cuso40.2μl和thpta0.4μl混匀,再加入biotin-peg4-alkyne0.2μl混匀,再加入navc20μl混匀,室温避光轻轻震荡孵育2h。然后每管加入500μl冰甲醇放于-80℃冰箱,析出蛋白。
(8)样品制备:将上步处理好的样品进行4℃10000g离心10min,弃去上清,加入1ml冰甲醇充分重悬蛋白,进行洗涤,此操作重复两次。之后弃去上清,打开管盖,进行常温晾干蛋白。然后每管加入40μl4%sds蛋白溶解液,待蛋白充分溶解后加10μl5×loadingbuffer,混匀后沸水煮10min,冷却至室温后,12000rpm离心5min,于-20℃保存。
(9)westernblot检测:制备好浓度为10%的蛋白胶,每孔上20μl蛋白样品。然后电泳跑胶2h,以恒流280ma转膜2h,之后用含5%脱脂奶粉的tbst在摇床上室温封闭2h。然后将膜用以1:10000稀释的streptavidin-hrp抗体进行室温孵育2h。孵育后将膜放于tbst中,在摇床上洗3次,每次10min。最后进行曝片,分析结果。
结果4:udp-galactose合成通路中相关酶galt和gale对ac46azgalactose代谢标记的影响。结果表明,在代谢标记体系中加入galt和gale的干扰rna,可以显著降低其标记情况,表明ac46azgalactose代谢标记首先是由通路中相关酶转化成相应的udp-6azgalactose进而被ogt识别,除此之外还可以受其他相关酶调控进行o-glcnac竞争性以外的糖基化修饰。
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变化或修改,这并不影响本发明的实质内容。在不冲突的情况下,本申请的实施例和实施例中的特征可以任意相互组合。
序列表
<110>河南大学
<120>一种可被ogt识别的半乳糖修饰检测探针
<130>1
<160>6
<170>siposequencelisting1.0
<210>1
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>1
ggaagaagaucccguacaa19
<210>2
<211>16
<212>rna
<213>人工序列(artificialsequence)
<400>2
uuguacgggaucuucc16
<210>3
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>3
gcuacgaaaugcuugcuca19
<210>4
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>4
ugagcaagcauuucguagc19
<210>5
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>5
uucuccgaacgugucacgu19
<210>6
<211>19
<212>rna
<213>人工序列(artificialsequence)
<400>6
acgugacacguucggagaa19
- 还没有人留言评论。精彩留言会获得点赞!