一种高产酸型槐糖脂的补料发酵方法
本发明涉及生物发酵技术领域,具体涉及一种高产酸型槐糖脂的发酵方法。
背景技术:
生物表面活性剂是一种由微生物在一定条件下代谢合成的表面活性剂,不仅具有增溶、乳化、发泡、润湿等特性,并且与传统的石油合成的化学表面活性剂相比,还具有较好的生理活性和可生物降解性。它一般由亲水性基团—糖基和疏水性基团—脂肪酸链构成。
槐糖脂是由两分子葡萄糖和饱和或不饱和脂肪酸链构成,一般是由酵母以糖和油为双碳源,在一定发酵工艺下生产的次级代谢产物通常,并且通常是混合物。除了具备常规的生物表面活性剂的通用性能,其还具有无毒、耐盐、耐高温、ph适应范围广的特性,并且还具有较好的生物可降解性和抗菌特性。
槐糖脂分为酸型和内酯型两种,内酯型具有较好的抗菌活性,而酸型具有更降低表面活性的能力。并且,酸型槐糖脂具有更强的溶解性及发泡能力,在工业和生活中有着广泛的应用。然而,目前工业生产的槐糖脂多以内酯型为主,酸型槐糖脂占比低。因此,开发高产酸型槐糖脂的发酵工艺具有重要的实际意义。
技术实现要素:
为解决上述技术问题,本发明通过发酵培养基设计结合发酵罐补料发酵条件调控,提供了一种高产酸型槐糖脂的发酵方法,该方法安全环保并且操作简单,解决了酸型槐糖脂产量占比低的问题。
为实现上述目的,本发明采用如下技术方案:
一种高产酸型槐糖脂的补料发酵方法,包括如下步骤:
(1)取槐糖脂生产菌株接种于培养基上,进行二次活化培养;
(2)取活化的单菌落接种至种子培养基培养得到种子液;
(3)将种子液接种至发酵培养基中,发酵培养基以酵母提取物为氮源,葡萄糖、菜籽油为碳源,无机盐组分为kh2po4、na2hpo4,cacl2和mgso4,葡萄糖、菜籽油初始浓度为30~90g/l;
在发酵罐中加入发酵培养基,进行发酵反应;
发酵反应时控制溶氧20%以上,葡萄糖自然消耗或补加葡萄糖维持浓度在30g/l以上;监控菜籽油浓度,在菜籽油浓度≤30g/l时补加60g菜籽油;
(4)发酵完成后,发酵液经高温处理后分离、纯化,得到槐糖脂。
本发明的方法,所述槐糖脂生产菌株为熊蜂生假丝酵母candidabombicolaatcc22214。
所述活化培养的方式为:将菌株在ypd琼脂平板上划线,平板在恒温培养箱中倒置培养24~48h后,挑取单菌落转接到ypd琼脂平板上进行二次活化,倒置培养24~48h至平板上长出清晰的单菌落。
进一步的,活化培养条件为:28~30℃,200rpm。
进一步的,发酵培养时,按照体积比2~4%的接种量将种子液接种到发酵培养基中。发酵培养基初始ph值为5.6~5.8,72h后ph控制为2.7~3.0;发酵罐搅拌速率为400~600rpm;发酵温度为25℃;发酵时间为144~192h。
优选的,发酵条件为:发酵时间为192h;发酵液初始ph值为5.6~5.8,72h后ph控制为2.8;发酵罐搅拌速率为600rpm。
槐糖脂发酵液处理的方法为:将发酵液115℃高压灭菌处理后倒入分液漏斗静置分层12h,发酵液分层,上层为未利用的油脂层,中间层为发酵液,下层为槐糖脂层。
本发明的有益效果:
1、本发明操作简便、易于控制且安全环保。
2、在以葡萄糖和菜籽油为双碳源、酵母提取物为氮源、无机盐组分为kh2po4、na2hpo4,cacl2和mgso4的发酵培养基中进行发酵培养,结合发酵条件调控,提高了底物的利用率与酸型槐糖脂的产率,并能够选择性地高产酸型槐糖脂,产物中酸型槐糖脂占比稳定在80%左右。
附图说明
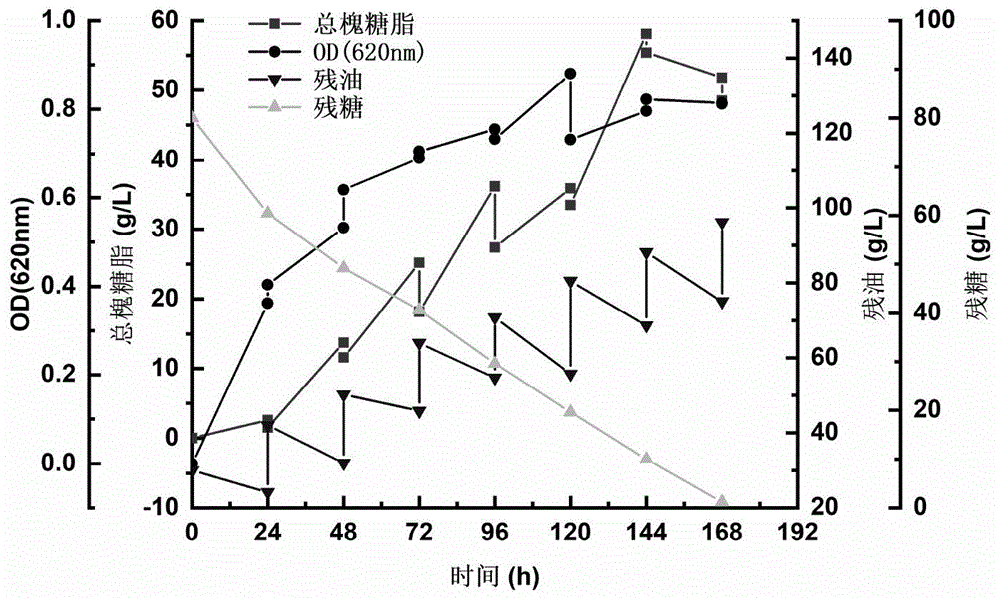
图1为实施例1中分批补料发酵动力学曲线。
图2为实施例2中分批补料发酵动力学曲线。
图3为实施例3中分批补料发酵动力学曲线。
图4为实施例4和分批补料发酵动力学曲线。
具体实施方式
下述通过实施例对本发明内容作进一步说明,如无特殊说明,所用实验方法均为常规方法,所用实验材料均为常规生化试剂。
实施例1
(1)平板活化:配制ypd固体培养基50ml,置于250ml三角瓶中,115℃高压蒸汽灭菌20min,完成后自然冷却至60℃左右,于超净台中倒入一次性培养皿冷却凝固。将保种管从-80℃取出,置于4℃冰箱缓慢融化,然后用无菌接种环蘸取融化后的菌液,在ypd琼脂平板上划线。平板在30℃恒温培养箱中,倒置培养24~48h后,挑取单菌落转接到ypd琼脂平板上进行二次活化,30℃倒置培养24~~48h至平板上长出清晰的单菌落。
(2)种子液制备:配制ypd液体培养基120ml,置于500ml三角瓶中,115℃高压蒸汽灭菌20min,完成自然冷却。接种环挑取上述纯化平板的单菌落,接种于ypd液体培养基中,置于30℃恒温振荡器,200rpm培养24h后得到种子液。
(3)上述种子液接种至经高压灭菌的5l发酵罐中,发酵培养基组分为:酵母提取物1g/l,kh2po42g/l,na2hpo42g/l,cacl20.1g/l,mgso42g/l;初始碳源为:葡萄糖30g/l,菜籽油50g/l;蒸馏水定容至3l,初始ph值为5.6~5.8,将培养基于115℃灭菌15min后冷却,发酵温度为25℃,转速为600rpm,溶氧控制在20%以上,发酵时间192h。
(4)发酵24h-168h,每隔24h补加20g/l菜籽油;葡萄糖自然消耗,不进行补加。控制溶氧20%以上,ph值2.8。
(5)发酵结束后,用与发酵液等体积的乙酸乙酯提取内酯型槐糖脂,用与发酵液等体积的乙醇提取总槐糖脂,并用蒽酮-硫酸法分别测定内酯型槐糖脂和总槐糖脂,酸型槐糖脂含量即总糖含量减去内酯型槐糖脂。测得总槐糖脂含量为59.1g/l,酸型槐糖脂为47.2g/l,酸型槐糖脂占比79.8%。
实施例2
(1)平板活化:配制ypd固体培养基50ml,置于250ml三角瓶中,115℃高压蒸汽灭菌20min,完成后自然冷却至60℃左右,于超净台中倒入一次性培养皿冷却凝固。将保种管从-80℃取出,置于4℃冰箱缓慢融化,然后用无菌接种环蘸取融化后的菌液,在ypd琼脂平板上划线。平板在30℃恒温培养箱中,倒置培养24~48h后,挑取单菌落转接到ypd琼脂平板上进行二次活化,30℃倒置培养24~~48h至平板上长出清晰的单菌落。
(2)种子液制备:配制ypd液体培养基120ml,置于500ml三角瓶中,115℃高压蒸汽灭菌20min,完成自然冷却。接种环挑取上述纯化平板的单菌落,接种于ypd液体培养基中,置于30℃恒温振荡器,200rpm培养24h后得到种子液。
(3)上述种子液接种至经高压灭菌的5l发酵罐中,发酵培养基组分为:酵母提取物1g/l,kh2po42g/l,na2hpo42g/l,cacl20.1g/l,mgso42g/l;初始碳源为:葡萄糖30g/l,菜籽油30g/l;蒸馏水定容至3l,初始ph值为5.6~5.8,将培养基于115℃灭菌15min后冷却,发酵温度为25℃,转速为600rpm,溶氧控制在20%以上,发酵时间192h。
(4)发酵24h-192h,根据槐糖脂消耗情况分别在24、60、96和144h补加20g/l菜籽油,补加葡萄糖维持浓度在30g/l以上。控制溶氧20%以上,ph值2.8。
(5)发酵结束后,用与发酵液等体积的乙酸乙酯提取内酯型槐糖脂,用与发酵液等体积的乙醇提取总槐糖脂,并用蒽酮-硫酸法分别测定内酯型槐糖脂和总槐糖脂,酸型槐糖脂含量即总糖含量减去内酯型槐糖脂。测得总槐糖脂含量为96.4g/l,酸型槐糖脂为77.3g/l,酸型槐糖脂占比80.2%。
实施例3
(1)平板活化:配制ypd固体培养基50ml,置于250ml三角瓶中,115℃高压蒸汽灭菌20min,完成后自然冷却至60℃左右,于超净台中倒入一次性培养皿冷却凝固。将保种管从-80℃取出,置于4℃冰箱缓慢融化,然后用无菌接种环蘸取融化后的菌液,在ypd琼脂平板上划线。平板在30℃恒温培养箱中,倒置培养24~48h后,挑取单菌落转接到ypd琼脂平板上进行二次活化,30℃倒置培养24~~48h至平板上长出清晰的单菌落。
(2)种子液制备:配制ypd液体培养基120ml,置于500ml三角瓶中,115℃高压蒸汽灭菌20min,完成自然冷却。接种环挑取上述纯化平板的单菌落,接种于ypd液体培养基中,置于30℃恒温振荡器,200rpm培养24h后得到种子液。
(3)上述种子液接种至经高压灭菌的5l发酵罐中,发酵培养基组分为:酵母提取物1g/l,kh2po42g/l,na2hpo42g/l,cacl20.1g/l,mgso42g/l;初始碳源为:葡萄糖60g/l,菜籽油60g/l;蒸馏水定容至3l,初始ph值为5.6~5.8,将培养基于115℃灭菌15min后冷却,发酵温度为25℃,转速为600rpm,溶氧控制在20%以上,发酵时间192h。
(4)发酵24h-192h,在36、72、96、120和144h补加20g/l菜籽油,补加葡萄糖维持浓度在30g/l以上。控制溶氧20%以上,ph值2.8。
(5)发酵结束后,用与发酵液等体积的乙酸乙酯提取内酯型槐糖脂,用与发酵液等体积的乙醇提取总槐糖脂,并用蒽酮-硫酸法分别测定内酯型槐糖脂和总槐糖脂,酸型槐糖脂含量即总糖含量减去内酯型槐糖脂。测得总槐糖脂含量为131.2g/l,酸型槐糖脂为106.5g/l,酸型槐糖脂占比81.2%。
实施例4
(1)平板活化:配制ypd固体培养基50ml,置于250ml三角瓶中,115℃高压蒸汽灭菌20min,完成后自然冷却至60℃左右,于超净台中倒入一次性培养皿冷却凝固。将保种管从-80℃取出,置于4℃冰箱缓慢融化,然后用无菌接种环蘸取融化后的菌液,在ypd琼脂平板上划线。平板在30℃恒温培养箱中,倒置培养24~48h后,挑取单菌落转接到ypd琼脂平板上进行二次活化,30℃倒置培养24~~48h至平板上长出清晰的单菌落。
(2)种子液制备:配制ypd液体培养基120ml,置于500ml三角瓶中,115℃高压蒸汽灭菌20min,完成自然冷却。接种环挑取上述纯化平板的单菌落,接种于ypd液体培养基中,置于30℃恒温振荡器,200rpm培养24h后得到种子液。
(3)上述种子液接种至经高压灭菌的5l发酵罐中,发酵培养基组分为:酵母提取物1g/l,kh2po42g/l,na2hpo42g/l,cacl20.1g/l,mgso42g/l;初始碳源为:葡萄糖90g/l,菜籽油90g/l;蒸馏水定容至3l,初始ph值为5.6~5.8,将培养基于115℃灭菌15min后冷却,发酵温度为25℃,转速为600rpm,溶氧控制在20%以上,发酵时间192h。
(4)发酵24h-192h,在144h补加20g/l菜籽油,补加葡萄糖维持浓度在30g/l以上。控制溶氧20%以上,ph值2.8。
发酵结束后,用与发酵液等体积的乙酸乙酯提取内酯型槐糖脂,用与发酵液等体积的乙醇提取总槐糖脂,并用蒽酮-硫酸法分别测定内酯型槐糖脂和总槐糖脂,酸型槐糖脂含量即总糖含量减去内酯型槐糖脂。测得总槐糖脂含量为102.3g/l,酸型槐糖脂为82.4g/l,酸型槐糖脂占比80.5%。
- 还没有人留言评论。精彩留言会获得点赞!