一种家蚕抗菌肽BMGlvA2重组蛋白制备方法及其应用
一种家蚕抗菌肽bmglva2重组蛋白制备方法及其应用
技术领域
1.本发明属于基因工程和分子生物学领域,特别涉及家蚕抗菌肽bmglva2重组蛋白制备方法及其应用
背景技术:
2.随着养殖业的不断发展,抗生素的过度使用导致耐药菌株出现,使得抗生素禁用政策逐步出台。由于抗菌肽具有广泛的来源和较强的抗菌活性,抗菌肽已备受关注成为潜在的抗生素替代品。现已报道的抗菌肽被证实对革兰氏阳性和阴性菌、真菌等均有抑制作用,其中在养殖业中作为饲料添加剂应用最广泛的是昆虫抗菌肽,主要来源于家蚕等,均属于天蚕素家族抗菌肽,其特征具有独特的α
‑
螺旋结构和序列,富含特异性氨基酸。
3.抗菌肽bmglva2来源于家蚕,属于天蚕素家族抗菌肽。其研究的生产方式主要有分离提取,这种高成本的生产严重限制了其工业化生产和应用。此外通过基因工程手段生产该抗菌肽主要也在原核和酵母表达水平,目前丝状真菌里氏木霉已逐渐被引入作为重组蛋白表达的高度优势宿主,它具有强大的表达启动子和优越的糖基化和蛋白加工能力,为工业蛋白生产提供了更有价值的选择。
4.在养殖业中养猪业是不可缺少的一部分,由于仔猪免疫系统生长不够完善,仔猪腹泻是猪养殖中一种典型的疾病,给其造成巨大经济损失。造成仔猪腹泻的主要原因是细菌性腹泻,病原菌包括肠毒素性大肠杆菌、沙门氏菌和c型产气荚膜梭菌。家蚕抗菌肽bmglva2被证明对革兰氏阴性和阳性菌均有一定抑制作用,但对该三种病原菌同时的抑制活性的表征具有显著意义。
技术实现要素:
5.本发明的目的在于提供一种家蚕抗菌肽bmglva2重组蛋白,在饲料及其他领域具有更为良好的应用潜力。
6.具体而言,本发明针对一种基于易错pcr方法获得的家蚕抗菌肽bmglva2重组蛋白,通过基因工程技术进行异源表达,进一步挖掘其重组蛋白的抑菌特性和相关机制。养殖行业中造成仔猪腹泻、幼鸡腹泻的致病菌主要有大肠杆菌、沙门氏菌和产气荚膜梭菌,而目前对该抗菌肽bmglva2的抑菌活性研究并未覆盖此三种病原菌。因此该抗菌肽在饲料行业中的应用价值还需进一步挖掘。
7.为了优化该抗菌肽的重组序列,根据本发明选取的表达宿主,通过易错pcr方法得到了一个该抗菌肽的重组蛋白,其氨基酸序列如seq id no.1所示。通过分析其对大肠杆菌、沙门氏菌和产气荚膜梭菌的抑菌活性,进一步扩充其抑菌范围。本发明不仅得到了抗菌肽bmglva2重组蛋白,验证了其对三种致病菌的抑菌活性,还探究了其对产气荚膜梭菌的抑制机制。
8.本发明的再一目的是提供包含上述抗菌肽的重组载体。
9.本发明的再一目的是提供包含上述抗菌肽的重组菌株,所述重组菌株为里氏木霉
tu6。
10.本发明还提供所述抗菌肽在饲料或饲料添加剂中的应用。
11.本发明还提供所述重组菌株在饲料或饲料添加剂中的应用。
12.本发明还提供所述重组载体在饲料或饲料添加剂中的应用。
13.根据本发明的技术方案,家蚕抗菌肽bmglva2重组蛋白的氨基酸序列如seq id no.1所示。
14.seq id no.1:
15.efmnsnlfyifattlvcvnaevygpsdyaedysisgqssrrhprdvtwdkqmgggkvfgtlgqnddglfgkagynkeifnddrgkltgqaygtrilgpggdstnyggrldwanknaqatidlnrqiggrsgmtasgsgvwdldknthfsaggmvskefghkrpdvglqaeirhdwaa
16.本发明通过以下技术手段来实现:
17.一种家蚕抗菌肽bmglva2重组蛋白,其氨基酸序列如seq id no.1所示。
18.上述抗菌肽在抑制大肠杆菌、沙门氏菌和产气荚膜梭菌中的应用。
19.首先通过pcr反应对抗菌肽目的片段进行扩增,经琼脂糖凝胶电泳检验后获得易错pcr片段。使用高保真酶制备表达载体的线性化片段,经琼脂糖凝胶电泳检验和产物回收纯化后与制备的目的pcr片段进行同源重组连接,热激法转入大肠杆菌dh5α感受态构建大肠杆菌突变体库。
20.将筛选的阳性转化子均转入表达宿主里氏木霉tu6中,进行第二轮阳性转化子的筛选。筛选出的转化子通过摇瓶发酵获得表达产物,经96孔板对其抑菌活性验证后,筛选得到本发明提供的家蚕抗菌肽bmglva2重组蛋白。经sds
‑
page蛋白电泳条带验证后,获得抗菌肽bmglva2重组蛋白表达产物。
21.随后对该家蚕抗菌肽bmglva2重组蛋白进行进一步具体的抑菌活性检测和验证。本发明所选取的致病菌有大肠杆菌、沙门氏菌和产气荚膜梭菌这三种造成养殖腹泻的主要病原菌,分别测定该家蚕抗菌肽bmglva2重组蛋白对其的最低抑菌浓度mic和最低杀菌浓度mbc,确定抗菌肽bmglva2重组蛋白对三种致病菌均有抑制效果。
22.其次,测定该家蚕抗菌肽bmglva2重组蛋白的相关特性,包括温度稳定性,盐离子稳定性,消化酶稳定性,抑菌动力学,溶血活性等,以表征其在饲料行业中的应用潜力和需要满足的特性要求。此外,本发明还表征了该家蚕抗菌肽bmglva2重组蛋白对产气荚膜梭菌的抑制机制,从细胞膜通透性、核酸泄露、蛋白质泄露及电导率变化方面提供对该菌的抑制机制,通过扫描电镜sem表征该细菌受到该抗菌肽的干预后细菌形态发生的变化。
23.本发明得到的有益效果有:
24.(1)通过易错pcr方法得到了一种家蚕抗菌肽bmglva2重组蛋白,其氨基酸序列如seq id no.1所示。
25.(2)本发明将该家蚕抗菌肽bmglva2重组蛋白通过表达宿主里氏木霉进行表达,得到了该抗菌肽的发酵表达产物。
26.(3)本发明对该家蚕抗菌肽bmglva2重组蛋白进行抑菌活性检测,以大肠杆菌、沙门氏菌和产气荚膜梭菌同时作为三种指示菌,表征了该抗菌肽对其均有抑制效果。
27.(4)本发明同时保存了该家蚕抗菌肽bmglva2重组蛋白的其他优良特性,以表征其在饲料行业中的应用潜力和需要满足的特性要求。
28.(5)本发明以产气荚膜梭菌为指示菌,表征了该家蚕抗菌肽bmglva2重组蛋白对其的抑制机制。
附图说明
29.图1为家蚕抗菌肽bmglva2重组蛋白在里氏木霉中表达产物的sds
‑
page检测图示。bmglva2为bmglva2的分子量图示;tu6为空宿主发酵液的sds
‑
page图示
30.图2为家蚕抗菌肽bmglva2重组蛋白的热稳定性分析图示
31.图3为家蚕抗菌肽bmglva2重组蛋白的抑菌动力学分析图示
32.图4为家蚕抗菌肽bmglva2重组蛋白的溶血活性分析图示
33.图5a为家蚕抗菌肽bmglva2重组蛋白的胃蛋白酶稳定性分析图示
34.图5b为家蚕抗菌肽bmglva2重组蛋白的胰蛋白酶稳定性分析图示
35.图6为家蚕抗菌肽bmglva2重组蛋白对产气荚膜梭菌抑制机制中膜通透性的分析图示
36.图7为家蚕抗菌肽bmglva2重组蛋白对产气荚膜梭菌抑制机制中核酸泄露、蛋白质泄露和电导率变化的分析图示
37.图8a为正常产气荚膜梭菌细菌生长形态的sem电镜分析图示
38.图8b为产气荚膜梭菌经抗菌肽bmglva2重组蛋白干预后的细菌生长形态的sem电镜分析图示,放大倍率为10.0kx
39.图8c为产气荚膜梭菌经抗菌肽bmglva2重组蛋白干预后的细菌生长形态的sem电镜分析图示,放大倍率为20.0kx
具体实施方式
40.下面结合附图和具体实施例对本发明的技术方案做进一步详细的说明。以下结合实施实例对本发明做进一步说明,需要指出的是,本实施例仅用于解释本发明,而非对本发明范围的限制。
41.如图1
‑
8c所示:
42.一种家蚕抗菌肽bmglva2重组蛋白制备方法,所述重组蛋白通过易错pcr方法筛选获得。
43.所述pcr方法包含以下步骤:
44.s1;通过pcr反应对抗菌肽目的片段进行扩增,经琼脂糖凝胶电泳检验后获得易错pcr片段;
45.s2:使用高保真酶制备表达载体的线性化片段,经琼脂糖凝胶电泳检验和产物回收纯化后与制备的目的pcr片段进行同源重组连接,热激法转入大肠杆菌dh5α感受态构建大肠杆菌突变体库;
46.s3:将筛选的阳性转化子均转入表达宿主里氏木霉tu6中,进行第二轮阳性转化子的筛选;
47.s4:筛选出的转化子通过摇瓶发酵获得表达产物,经96孔板对其抑菌活性验证后,筛选得到所述提供的家蚕抗菌肽bmglva2重组蛋白。
48.所述重组蛋白的氨基酸序列。
49.所述重组蛋白表达的的重组载体。
50.所述重组蛋白的重组菌株,所述重组菌株的宿主为里氏木霉tu6。
51.所述重组抗菌肽在饲料或饲料添加剂中的应用。
52.所述重组菌株在饲料或饲料添加剂中的应用。
53.所述重组载体在饲料或饲料添加剂中的应用。
54.实验材料和试剂
55.1.菌株和载体:
56.表达宿主里氏木霉tu6,由本实验室保存;表达载体pcbhg,由本实验室之前构建及储存;大肠杆菌dh5α,购自invitrogen公司;大肠杆菌o 157、沙门氏菌、产气荚膜梭菌,购自;细胞壁裂解酶、amp、尿嘧啶,购自invitrogen公司。
57.2.酶与试剂盒:
58.pcr酶及连接酶购买自takara公司,质粒提取试剂盒及胶回收试剂盒购自omega公司。
59.3.培养基:
60.lb培养基:1%胰蛋白胨、0.5%酵母提取物、1%nacl;
61.pda培养基:20%去皮马铃薯、2%葡萄糖、2%琼脂;
62.pda+u培养基:20%去皮马铃薯、2%葡萄糖、2%琼脂、0.2%尿嘧啶;
63.yeg培养基:2%葡萄糖、0.5%酵母粉、0.2%尿嘧啶;
64.发酵培养基:0.6%硫酸铵、0.1%硫酸镁、0.07%一水合柠檬酸、0.1%氯化钙、2%葡萄糖、2%乳糖、2%磷酸二氢钾、0.2%磷酸氢二铵、0.07%七水合硫酸亚铁、0.5%玉米粉、0.01%微量元素(七水合硫酸锌、五水合硫酸铜、一水合硫酸锰、硼酸)。
65.说明:以下实施例中未作具体说明的分子生物学实验方法,均参照《分子克隆实验指南》第三版j.萨姆布鲁克一书中所列的具体方法进行,或者按照试剂盒和产品说明书进行。
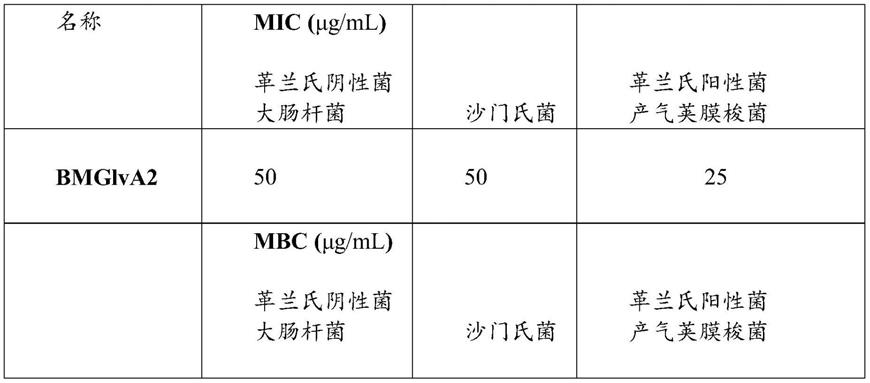
66.实验方法
67.实施例1
68.抗菌肽bmglva2工程菌的构建
69.(1)抗菌肽bmglva2重组蛋白氨基酸序列的确定
70.以家蚕bombyx mori(domestic silkworm)来源的抗菌肽bmglva2在genbank中公开的氨基酸序列no.ab239448为原始氨基酸序列,通过易错pcr方法筛选得到该抗菌肽bmglva2重组蛋白的氨基酸序列,如seq id no.1所示。
71.(2)重组表达载体的构建
72.将抗菌肽bmglva2重组蛋白合成序列使用pcr高保真合成酶通过pcr反应进行扩增。pcr扩增程序为95℃预变性5min,95℃变性30s,60℃退火30s,72℃延伸30s,共35个循环,再72℃延伸10min。将扩增片段与木霉表达载体在体外重组连接后转入大肠杆菌感受态细胞dh5α,并将产物在lb+amp固体培养基上进行涂布,于37℃条件下培养12
‑
16小时直至出现菌落生长。将生长的单菌落挑取进行阳性克隆验证,经测序检验后的重组表达载体保存用于后续实验。
73.实施例2
74.抗菌肽bmglva2重组蛋白在里氏木霉中的表达
75.(1)重组质粒在里氏木霉中的转化
76.将里氏木霉宿主菌株在pda+u固体培养基平板上传代培养,条件为30℃5
‑
6天。将成熟的里氏木霉宿主菌株接种至yeg培养基,30℃、180rpm的条件下培养20h作为表达宿主。
77.培养成熟的表达宿主收集其菌丝,并用无菌水冲洗。称取1
‑
2g洗涤的菌丝至100ml锥形瓶中备用,将其在30℃、90rpm的条件下裂解,每30min取样在显微镜下用血球计数板计算制备的原生质体数量,直至达到108cfu/ml停止裂解。将裂解液过滤后收集滤液,不断离心并用山梨醇溶液洗涤,收集木霉原生质体。
78.(2)重组质粒在里氏木霉中的摇瓶发酵表达
79.构建的重组表达载体使用质粒提取试剂盒提取其质粒,将重组质粒转移至制备的木霉原生质体中,加入聚乙二醇溶液,于冰上孵育30min,之后将其倒入pda固体培养基平板上,置于30℃条件下培养5
‑
6天。
80.观察转化子生长状态,有大量转化子生长时挑取转化子至新的平板上进行筛选,待新生长出的转化子成熟后,挑取其进行阳性验证。将验证成功的转化子接种至发酵培养基中于30℃、180rpm条件下发酵表达,时间为5
‑
6天。将发酵液离心去除菌体,收集上清表达液,采用sds
‑
page进行表达产物分子量条带检测,其分子量约为20kda左右,结果如图1所示。
81.实施例3
82.抗菌肽bmglva2重组蛋白抑菌活性的检测
83.(1)抗菌肽bmglva2重组蛋白对致病菌mic的测定
84.mic的测定采用微量二倍稀释法进行。主要包括菌悬液的制备,抗菌肽bmglva2重组蛋白的处理,检测。
85.菌悬液的制备:将大肠杆菌、沙门氏菌在lb液体培养基中培养至生长对数期,产气荚膜梭菌在bhi液体培养基中同样培养至生长对数期。将三种致病菌分别用相应的液体培养基稀释菌体,直至浓度为105cfu/ml。
86.抗菌肽bmglva2重组蛋白的处理:将发酵产物过滤除菌后,冻干成粉末。称取一定量的样品粉末在无菌水中复溶。在96孔板中各添加100μl相应致病菌的液体培养基,将复溶的抗菌肽液体取100μl至96孔板,依次连续二倍稀释,成浓度梯度。
87.检测:稀释的菌悬液添加100μl至96孔板连续二倍稀释的抗菌肽溶液中,至于37℃培养箱中孵育16h,肉眼观察96孔板中澄清的孔洞,其中能使孔洞澄清的最小浓度即为该抗菌肽bmglva2重组蛋白对各致病菌的最小抑菌浓度。结果如表1所示。
88.(2)抗菌肽bmglva2重组蛋白对致病菌mbc的测定
89.根据mic测定结果中能使孔洞呈现澄清状的抗菌肽浓度,将其分别取样涂至各致病菌相应的固体培养平板上,培养16h后能抑制99.9%细菌生长的抗菌肽浓度为其对各致病菌的最小杀菌浓度。结果如表1所示。
90.表1 抗菌肽bmglva2重组蛋白对不同细菌的最小抑菌浓度和最小杀菌浓度
[0091][0092][0093]
实施例4
[0094]
抗菌肽bmglva2重组蛋白相关特性的表征
[0095]
(1)抗菌肽bmglva2重组蛋白温度稳定性的测定
[0096]
将抗菌肽bmglva2重组蛋白分别在沸水中处理5分钟、10分钟、15分钟、20分钟、25分钟和30分钟后作为测定样品。将三种细菌分别培养至生长对数期后用相应培养基稀释至105cfu/ml的浓度备用。将经过不同时间处理的抗菌肽溶液分别与三种稀释后的细菌混合,混合后的样品置于37℃下孵育18h,并在600nm处测定其吸光值。
[0097]
温度稳定性的结果如图2所示,抗菌肽bmglva2重组蛋白在高温条件下加热时间在20min以内时均不会影响其对三种细菌的抑制作用。处理30min后其对大肠杆菌、沙门氏菌和产气荚膜梭菌的抑菌活性分别下降了58.0%、34.1%和53.8%。结果说明抗菌肽bmglva2重组蛋白经过普通时间内的高温处理后其抑菌活性并不会发生明显变化,且对高温环境能显示出一定的耐受性。
[0098]
(2)抗菌肽bmglva2重组蛋白盐离子稳定性的测定
[0099]
以大肠杆菌、沙门氏菌和产气荚膜梭菌为指示菌,测定抗菌肽bmglva2重组蛋白在不同盐离子环境下的稳定性。本发明测定的盐溶液有nacl(150mm)、kcl(4.5mm)、nh4cl(6.0μm)、zncl2(8.0μm)、mgcl2(1.0mm)和fecl3(4.0μm),其浓度均为各盐离子的最适生理特性浓度。抗菌肽bmglva2重组蛋白样品溶液在96孔板中使用各盐溶液进行连续二倍稀释,将三种细菌培养至生长对数期并用各自相应的液体培养基稀释至浓度为105cfu/ml后添加至96孔板中,将其置于37℃培养16h,观察抗菌肽在不同盐离子环境下对三种细菌的mic值的影响。
[0100]
结果如表2所示,在不同离子环境下bmglva2对三种被测细菌的mic受到一定影响,其中对沙门氏菌的mic均不被盐离子影响,而对大肠杆菌和产气荚膜梭菌的mic发生一定变化。且na
+
、zn
2+
和fe
3+
三种不同价态的离子均能促进bmglva2对大肠杆菌和产气荚膜菌的抑菌活性,而k+对三种细菌的抑菌活性均无影响。
[0101]
表2 抗菌肽bmglva2重组蛋白在不同离子环境下对不同细菌的最小抑菌浓度
[0102][0103]
(3)抗菌肽bmglva2重组蛋白的抑菌动力学
[0104]
大肠杆菌、沙门氏菌和产气荚膜梭菌被培养至对数生长期后稀释至105cfu/ml,稀释后的三种细菌悬液中分别添加抗菌肽bmglva2样品至终浓度为mic,混合的样品于37℃培养。分别在培养的30min、60min、90min、120min和180min取样,均匀的涂布于相应细菌生长所需的固体培养基上,于37℃孵育18h后计数生长的可见菌落。
[0105]
结果如图3所示,三种菌液中加入bmglva2后,随着孵育的时间延长,其生长均会不同程度的受到抑制。处理30min后,产气荚膜梭菌的生长菌落数下降至log
10 3.8cfu/ml,大肠杆菌和沙门氏菌的生长菌落数分别为log
10 4.8cfu/ml和log
10 4.5cfu/ml。且孵育2
‑
3h后,沙门氏菌和产气荚膜梭菌的生长几乎被完全抑制,但处理3h后,仍有近log
10 0.8cfu/ml的大肠杆菌菌落存活。本结果说明抗菌肽bmglva2重组蛋白可以在2
‑
3h内对该三种细菌发挥较为完全的抑制作用。
[0106]
(4)抗菌肽bmglva2重组蛋白的溶血活性
[0107]
使用新鲜的兔红细胞表征本发明抗菌肽bmglva2的溶血活性。用pbs溶液反复洗涤和重悬新鲜的兔红细胞,并取50μl收集的红细胞与在96孔板中连续二倍稀释的bmglva2溶液混合。37℃孵育1h后,在1200rpm下离心10min,转移上清液,在570nm处测定其吸光度。本发明使用0.1%triton x
‑
100为阳性对照,其溶血率为100%;使用pbs溶液为阴性对照,其溶血率为0。根据公式定义,溶血率(%)=(bmglva2的od570nm
–
pbs的od570nm)/(0.1%triton x
‑
100的od 570nm
–
pbs的od 570nm)*100%。
[0108]
结果如图4所示,以抗菌肽bmglva2重组蛋白对大肠杆菌的mic为基准,其浓度为mic时其溶血率为5.0%,因此本发明中的抗菌肽在可以发挥抗菌活性的浓度下并不会因为溶血现象而影响其抑菌活性。
[0109]
(5)抗菌肽bmglva2重组蛋白的消化酶稳定性
[0110]
本发明使用胃蛋白酶和胰蛋白酶对抗菌肽bmglva2重组蛋白进行消化酶稳定性测定。用ph为2.0的gly
‑
hcl缓冲液稀释胃蛋白酶至3000u/ml,用ph为8.0的tris
‑
hcl缓冲液稀释胰蛋白酶至250u/ml。将bmglva2溶液的浓度分别用胃蛋白酶(3000u/ml,ph 2.0)和胰蛋白酶(250u/mg,ph 8.0)稀释至mic。之后将稀释后的bmglva2溶液在37℃下孵育30
‑
180min作为待测样品。各取50μl加入稀释的三种细菌悬液(105cfu/ml)中,于37℃培养18h后测定od600nm,并计算不同处理时间下抗菌肽bmglva2重组蛋白保留的相对抗菌活性。
[0111]
结果如图5所示,抗菌肽bmglva2重组蛋白对胃蛋白酶环境的适应性较强,而对胰蛋白酶环境的敏感性较高。经胃蛋白酶处理3h后,其对大肠杆菌、沙门氏菌和产气荚膜梭菌的抑菌活性仍分别保持82.6%、71.8%和78.1%。而经胰蛋白酶处理15min后,bmglva2重组蛋白对沙门氏菌的抑菌活性下降至28.1%,对大肠杆菌和产气荚膜梭菌的抑菌活性影响较
小,分别为87.9%和79.5%。本发明的结果显示抗菌肽bmglva2重组蛋白对消化酶的耐受性较好,几乎不会限制其在饲料领域中的应用。
[0112]
实施例5
[0113]
抗菌肽bmglva2重组蛋白对产气荚膜梭菌的抑制机制表征
[0114]
(1)抗菌肽bmglva2重组蛋白对产气荚膜梭菌的膜通透性影响
[0115]
将产气荚膜梭菌接种至bhi液体培养基中培养至对数生长期,离心去除上清保留菌体沉淀,并用pbs溶液反复洗涤,调整至菌体浓度为106cfu/ml。使用荧光分光光度计进行检查,在比色皿中分别添加稀释后的细菌悬液、荧光染料npn(终浓度为10μm)、抗菌肽bmglva2样品(终浓度为mic,将不添加抗菌肽的样品作为阴性对照),每间隔2分钟测量其荧光强度发生的变化,测定条件为激发波长350nm和发射波长420nm。
[0116]
结果如图6所示,随着抗菌肽bmglva2样品的添加时间逐渐延长,其od 420nm逐渐增大,意味着在抗菌肽bmglva2的干预下,产气荚膜梭菌的细胞膜通透性逐渐增大,细菌逐渐被抑制和破坏。
[0117]
(2)抗菌肽bmglva2重组蛋白抑制产气荚膜梭菌的核酸泄露、蛋白质泄露和电导率变化
[0118]
本发明表征了产气荚膜梭菌在抗菌肽bmglva2重组蛋白的干预下其生长过程中细菌悬液的核酸泄露、蛋白质泄露及电导率的变化。将产气荚膜梭菌培养至生长对数期后使用pbs溶液洗涤和重悬,调整菌浓度为108cfu/ml,并将其与bmglva2溶液混合至抗菌肽的终浓度为mic。混合物置于37℃下孵育24h,每间隔2h取样进行蛋白质浓度、核酸含量和菌液电导率的测定。蛋白质浓度通过考马斯亮蓝g
‑
250比色法进行测定;核酸含量通过od260nm定量;菌液电导率通过电导仪测定。
[0119]
结果如图7所示,随着加入抗菌肽bmglva2样品后的孵育时间增加,其菌液中的蛋白质含量和核酸含量逐渐增加,且菌液的电导率逐渐增大,意味着产气荚膜梭菌的生长逐渐被抑制,细胞被破坏,导致内溶物不断流出。
[0120]
(3)sem表征在抗菌肽bmglva2重组蛋白的干预下产气荚膜梭菌细菌形态发生的变化
[0121]
产气荚膜梭菌培养至对数生长期后,在实验组和对照组中分别加入终浓度为mic的抗菌肽bmglva2重组蛋白和无菌水使细菌悬液的浓度为106–
107cfu/ml。继续孵育2h后,离心10min收集菌体,离心条件为4℃、3000rpm,并用0.01m的pbs缓冲液不断洗涤、重悬和离心得到最终的菌体沉淀。最后将2.5%的戊二醛添加至最终的菌体沉淀中,在4℃条件下过夜固定,将样品使用电子扫描显微镜观察对照组和实验组的细菌形态。
[0122]
结果如图8所示,产气荚膜梭菌的正常生长形态为较为光滑的杆状细菌,而在抗菌肽bmglva2重组蛋白的干预下,细菌形态发生了较为明显的变化,细菌分泌大量粘液,细胞表面逐渐出现褶皱状态,细胞膜呈现萎缩状态,且有的细菌发生破裂,完全被破坏。
[0123]
本文中应用了具体个例对本发明的原理及实施方式进行了阐述,以上实例的说明只是用于帮助理解本发明的方法及其核心思想。以上所述仅是本发明的优选实施方式,应当指出,由于文字表达的有限性,而客观上存在无限的具体结构,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进、润饰或变化,也可以将上述技术特征以适当的方式进行组合;这些改进润饰、变化或组合,或未经改进将发明的构
思和技术方案直接应用于其它场合的,均应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1