融合蛋白及其制备方法、应用、表达系统和疫苗与流程
融合蛋白及其制备方法、应用、表达系统和疫苗
1.本技术是申请日为2018年09月19日,申请号为201811104817.8,发明名称为“融合蛋白及其制备方法、应用、表达系统和疫苗”的分案申请。
技术领域
2.本发明涉及生物技术领域,尤其是涉及一种融合蛋白及其制备方法、应用、表达系统和疫苗。
背景技术:
3.猪圆环病毒(porcinecircovirus,pcv)属于圆环病毒科,单链、环状dna病毒。主要分为无致病性的猪圆环病毒型(pcv1)和致病性的猪圆环病毒型(pcv2)。目前已知,cap蛋白是pcv的结构蛋白,具有良好的免疫原性。2016年10月,美国kansas州立大学的r.palinski和加州大学sanfrancisco分校t.g.phan等均报道一个新的pcv基因型,即称为pcv3。该病毒从发病母猪或仔猪中分离得到,同时pcv2检测为阴性。基因组序列分析发现,pcv3基因组包含2000个碱基,具有与pcvl和pcv2相似的基因组结构,主要编码cap和rep两个基因。猪圆环病毒型3在我国的猪场病例中被检测到,从流产母猪及发生皮炎肾病的小猪上发现大量的病毒数量,而且与猪圆环病毒型同时感染发病,引起较大的危害。
4.pcv相关的疾病(pcvassociateddiseases,pcvad)包括断奶仔猪多系统衰竭综合征(postweaningmultisystemicwastingsyndrome,pmws)、猪皮炎肾病综合征(porcinedermatitisandnephropathysyndrome,pdns)、呼吸系统疾病(respiratorydisease)、繁殖障碍(reproductivefailure)和肠道疾病(entericdisease)等。特别是断奶仔猪多系统衰竭综合征(pmws)的主要病原,导致猪群免疫抑制,给养猪业造成了巨大的经济损失。
5.猪圆环病毒感染造成淋巴细胞的减少和淋巴细胞亚群比例失衡,造成免疫抑制。pcv主要在淋巴组织中增殖,感染可造成淋巴细胞衰竭、淋巴细胞凋亡。树突状细胞(dendriticcells;dcs)在机体天然免疫和获得性免疫中都具有重要的作用。vincent等发现80%的树突状细胞可与pcv相互作用,pcv可在树突状细胞中长期存在并维持感染性,但不会导致树突状细胞的病变和死亡,这是一种逃避dcs降解作用的新途径,也为病毒逃避免疫提出了一种新的机制。
6.pcv感染后淋巴细胞产生抗体的能力下降,细胞免疫力下降,肺泡巨噬细胞对病原的吞噬和清除能力也下降,抑制性t细胞的活动增强,导致机体抗病力下降,从而使其他病原体更容易侵入,可继发感染猪繁殖与呼吸综合征、支原体等,从而导致多种疫苗接种失败。
7.猪圆环病毒全病毒灭活疫苗和亚单位疫苗在机体的体液免疫方面发挥着一定的作用,但对于猪圆环病毒这种以细胞免疫为主的病原,如何通过细胞免疫来清除病毒是从根本上进行疾病预防的方向。
8.有鉴于此,特提出本发明。
技术实现要素:
9.本发明的第一个目的在于提供一种融合蛋白,以至少缓解现有技术中存在的技术问题之一。
10.本发明的另一个目的在于提供一种上述融合蛋白答制备方法,该制备方法可以实现大量表达高质量的上述融合蛋白。
11.本发明的另一个目的在于提供一种能够表达上述融合蛋白的蛋白表达系统,可以直接快速大量得到上述融合蛋白。
12.本发明的另一个目的在于提供上述融合蛋白的应用。
13.本发明的另一个目的在于提供一种含有上述融合蛋白的疫苗,该疫苗免疫原性好,效价高,以缓解现有技术中疫苗安全性低,效力差或不稳定,生产成本高并且保护率低等技术问题。
14.为了实现本发明的上述目的,特采用以下技术方案:
15.本发明提供了一种融合蛋白,所述融合蛋白包括假单胞杆菌外毒素a结构域区段、猪圆环病毒2型cap蛋白优势抗原表位区段、猪圆环病毒3型cap蛋白优势抗原表位区段和羧基末端部分;
16.其中,所述单胞杆菌外毒素a结构域包括假单胞杆菌外毒素a结构域ⅰ和假单胞杆菌外毒素a结构域ⅱ。
17.进一步地,所述假单胞杆菌外毒素a结构域区段由seq id no.1所示的核苷酸序列表达,所述猪圆环病毒2型cap蛋白优势抗原表位区段由seq id no.2所示的核苷酸序列表达,所述猪圆环病毒3型cap蛋白优势抗原表位区段由seq id no.3所示的核苷酸序列表达,所述羧基末端部分由包括seq id no.4所示的核苷酸序列的核苷酸序列表达;
18.优选地,所述羧基末端部分由seq id no.4、seq id no.5或seq id no.6所示的核苷酸序列表达。
19.进一步地,所述假单胞杆菌外毒素a结构域区段、猪圆环病毒2型cap蛋白优势抗原表位区段、猪圆环病毒3型cap蛋白优势抗原表位区段和羧基末端部分的排列顺序为pea
‑
pcv2 cap
‑
pcv3 cap
‑
羧基末端,通过柔性氨基酸连接;
20.优选地,所述柔性氨基酸具有如seq id no.7所示的氨基酸序列。
21.进一步地,在所述假单胞杆菌外毒素a结构域区段和所述猪圆环病毒2型cap蛋白优势抗原表位区段之间还包括补体蛋白c3d;c3d可识别非己抗原,并促进抗原提呈细胞对抗原的摄取、提呈,促进免疫应答格局的转变、抗体类型的改变、提高中和抗体水平,是连接固有免疫和特异性免疫的桥梁。
22.优选地,所述补体蛋白c3d由seq id no.8所示的核苷酸序列表达。
23.本发明还提供了上述的融合蛋白的制备方法,将编码所述融合蛋白的基因在宿主中表达。
24.进一步地,使用哺乳动物表达系统表达编码所述融合蛋白的基因;
25.优选地,使用cho细胞表达系统表达编码所述融合蛋白的基因;
26.优选地,提供包含编码所述融合蛋白的基因的表达载体,将所述表达载体导入cho细胞中,然后对cho细胞进行筛选,得到稳定表达所述融合蛋白的cho细胞株,所述cho细胞株表达得到所述融合蛋白;
27.优选地,所述筛选包括加压筛选和单克隆筛选;
28.优选地,所述制备方法中还包括将稳定表达所述融合蛋白的cho细胞驯化为悬浮培养的步骤。
29.本发明还提供了一种能够表达上述融合蛋白的蛋白表达系统。
30.本发明还提供了上述的融合蛋白或上述的制备方法制备得到的融合蛋白在如下(a)
‑
(d)任一项中的应用:
31.a)制备猪圆环病毒疫苗;
32.b)制备猪圆环病毒的抗体;
33.c)制备检测猪圆环病毒的试剂盒;
34.d)制备猪圆环病毒诊断抗原。
35.另外,本发明还提供了一种含有上述的融合蛋白的疫苗。
36.进一步地,所述疫苗中的融合蛋白的浓度为10
‑
100μg/ml,优选为20
‑
80μg/ml,更优选为50μg/ml;
37.优选地,所述疫苗还包括辅料,所述辅料包括疫苗佐剂、稳定剂和抗生素中的至少一种;
38.优选地,所述疫苗佐剂包括氢氧化铝胶、弗氏完全佐剂、弗氏不完全佐剂、白油佐剂、mf59佐剂或isa201rvg,优选使用isa201rvg。
39.本发明提供的融合蛋白,包括假单胞杆菌外毒素a结构域区段、猪圆环病毒2型cap蛋白优势抗原表位区段、猪圆环病毒3型cap蛋白优势抗原表位区段和羧基末端部分。本发明通过筛选出去除pcv2和pcv3 cap蛋白的优势抗原表位,其抗原性好,易高表达,然后将各优势表位与pea部分功能性片段融合,同时在融合蛋白c端加入了羧基末端序列以及增强免疫原性,增加了融合蛋白的可溶性。得到的融合蛋白具有抗原性好,表达量高的优点。将该融合蛋白作为抗原制备疫苗具有安全性好,效价稳定,无毒副作用的优势。
40.本发明提供上述融合蛋白的制备方法,该方法将编码上述融合蛋白的基因序列在宿主中表达即可,具有制备方法简单、成本低廉、疫苗功能强大等优点。
41.本发明提供能够表达上述融合蛋白的蛋白表达系统,该表达系统可以但不限为重组载体,重组细胞等含有表达上述融合蛋白基因序列的系统,利用该蛋白表达系统可以简便快捷地纯化得到大量的上述融合蛋白。
42.本发明提供的上述含有上述融合蛋白的疫苗,该疫苗不涉及到强毒,没有致病性,安全性好,不会引起不良反应,不会产生无关的抗体,同时效价高并且稳定性好,能够在临床使用后产生较高的免疫原性,降低了疫苗的生产成本,保护率高。
附图说明
43.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
44.图1为本发明实施例1提供的pet
‑
pa
‑
c3d
‑
cap(pcv2)质粒图谱。
45.图2为本发明实施例1提供的pet
‑
pa
‑
c3d
‑
cap(pcv3)质粒图谱。
46.图3为本发明实施例1提供的pet
‑
pa
‑
c3d
‑
cap(pcv2/pcv3)质粒图谱。
47.图4为本发明实施例1提供的pet
‑
pa
‑
c3d
‑
cap
‑
k重组阳性质粒酶切鉴定结果。
48.图5为本发明实施例3提供的疫苗免疫攻毒后免疫组化检测结果。
具体实施方式
49.下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。
50.本发明提供了一种融合蛋白,所述融合蛋白包括假单胞杆菌外毒素a结构域区段、猪圆环病毒2型cap蛋白优势抗原表位区段、猪圆环病毒3型cap蛋白优势抗原表位区段和羧基末端部分;
51.其中,所述单胞杆菌外毒素a结构域包括假单胞杆菌外毒素a结构域ⅰ和假单胞杆菌外毒素a结构域ⅱ。
52.通过假单胞杆菌外毒素a(pea)载体与细胞表面受体结合和跨膜转运的特殊功能将pcv2和pcv3的cap蛋白优势抗原表位定向导入树突状细胞内特定位置,经递呈后以内源性抗原形式将优势抗原表位展现在细胞表面,介导细胞免疫应答。
53.在一个实施方式中,假单胞杆菌外毒素a结构域ⅰ分为假单胞杆菌外毒素a结构域ⅰa和假单胞杆菌外毒素a结构域ⅰb。其中,假单胞杆菌外毒素a结构域ⅰb其大部分氨基酸的缺失并不影响pea的活性。
54.本发明所述羧基末端部分为内质网受体结合序列。所用术语“内质网受体结合序列”是指一组多肽分子,其具有与细胞内质网膜结合的相似羧基端,并进一步具有可将该蛋白质留存于内质网腔中以实现酪基化作用的能力,以便融合抗原更接近外源蛋白的肽片段。通常,该羧基端的长度介于4~13个残基之间。
55.本发明通过筛选出去除pcv2和pcv3 cap蛋白的优势抗原表位,其抗原性好,易高表达,然后将各优势表位与pea部分功能性片段融合,同时在融合蛋白c端加入了羧基末端序列以及增强免疫原性,增加了融合蛋白的可溶性。得到的融合蛋白具有抗原性好,表达量高的优点。将该融合蛋白作为抗原制备疫苗具有安全性好,效价稳定,无毒副作用的优势。
56.在一些优选的实施方式中,所述假单胞杆菌外毒素a结构域区段由seq id no.1所示的核苷酸序列表达,所述猪圆环病毒2型cap蛋白优势抗原表位区段由seq id no.2所示的核苷酸序列表达,所述猪圆环病毒3型cap蛋白优势抗原表位区段由seq id no.3所示的核苷酸序列表达,所述羧基末端部分由包括seq id no.4所示的核苷酸序列的核苷酸序列表达。
57.优选地,所述羧基末端部分由seq id no.4、seq id no.5或seq id no.6所示的核苷酸序列表达。
58.假单胞杆菌外毒素a结构域区段由seq id no.1所示的核苷酸序列表达,得到seq id no.9所示的氨基酸序列;猪圆环病毒2型cap蛋白优势抗原表位区段由seq id no.2所示的核苷酸序列表达,得到seq id no.10所示的氨基酸序列;猪圆环病毒3型cap蛋白优势抗原表位区段由seq id no.3所示的核苷酸序列表达,得到seq id no.11所示的氨基酸序列;羧基末端部分分别由seq id no.4、seq id no.5或seq id no.6所示的核苷酸序列表达,分
别得到seq id no.12、seq id no.13和seq id no.14所示的氨基酸序列。
59.在一些优选的实施方式中,所述假单胞杆菌外毒素a结构域区段、猪圆环病毒2型cap蛋白优势抗原表位区段、猪圆环病毒3型cap蛋白优势抗原表位区段和羧基末端部分的排列顺序为pea
‑
pcv2 cap
‑
pcv3 cap
‑
羧基末端,通过柔性氨基酸连接。
60.通过用柔性氨基酸将假单胞杆菌外毒素a结构域区段、猪圆环病毒2型cap蛋白优势抗原表位区段、猪圆环病毒3型cap蛋白优势抗原表位区段和羧基末端部分进行连接,既达到了蛋白重组的目的,又避免了各区段各自的高级结构形成的相互影响。
61.优选地,所述柔性氨基酸具有如seq id no.7所示的氨基酸序列。
62.在一些优选的实施方式中,在所述假单胞杆菌外毒素a结构域区段和所述猪圆环病毒2型cap蛋白优势抗原表位区段之间还包括补体蛋白c3d。
63.补体蛋白c3d分子为一种新型佐剂,在流感病毒基因免疫中具有促进作用。在本发明提供的融合蛋白中连接补体蛋白c3d,对提高疫苗的抗体滴度,激活机体的细胞免疫应答具有重要的作用。
64.优选地,所述补体蛋白c3d由seq id no.8所示的核苷酸序列表达。
65.补体蛋白c3d由seq id no.8所示的核苷酸序列表达,得到seq id no.15所示的氨基酸序列。
66.一种上述融合蛋白的制备方法,将编码所述融合蛋白的基因在宿主中表达。
67.该方法具有制备方法简单、成本低廉、疫苗功能强大等优点。
68.本发明中的宿主可以但不限于为在大肠杆菌表达系统、酵母表达系统、昆虫表达系统、植物表达系统或者哺乳动物表达系统。由于哺乳动物细胞表达的蛋白经翻译加工后,其结构与生物学特性更接近于天然蛋白,因此本发明优选使用哺乳动物表达系统表达编码上述融合蛋白的基因。
69.在本发明一个优选地实施方式中,使用哺乳动物表达系统表达编码所述融合蛋白的基因。由于哺乳动物细胞表达的蛋白经翻译加工后,其结构与生物学特性更接近于天然蛋白,因此本发明优选使用哺乳动物表达系统表达编码上述融合蛋白的基因。
70.在本发明一个更优选的实施方式中,使用cho细胞表达系统表达编码上述融合蛋白的基因。cho细胞即中国仓鼠卵巢细胞(chinese hamster ovary),具有如下优点:
71.(1)具有准确的翻译后折叠及修饰功能,表达的蛋白在分子结构,理化特性和生物学功能方面最接近于天然蛋白分子。
72.(2)具有产物胞外分泌功能,便于下游产物分离纯化。
73.(3)具有重组基因的高效扩增和表达能力。
74.(4)具有贴壁生长特性,具有较高的耐受剪切力和渗透压能力。也可以进行悬浮培养,表达水平较高。
75.(5)cho属于成纤维细胞,很少分泌自身的内源蛋白质,利于外源蛋白的分离。
76.在本发明一些实施方式中,提供包含编码上述融合蛋白的基因的表达载体,将表达载体导入cho细胞中,然后对cho细胞进行筛选,得到稳定表达融合蛋白的cho细胞株,cho细胞株表达得到融合蛋白。该方法简便,易操作,可以成功筛选出稳定、高表达融合蛋白的真核细胞株,为后续利用得到的真核细胞株做各项研究包括制备疫苗等应用提供了可行的技术方案,打下了良好的基础。
77.在本发明一些实施方式中,筛选包括加压筛选和单克隆筛选。本发明中,可以选择g418进行加压筛选。
78.在本发明一个优选地实施方式中,制备方法中还包括将稳定表达所述融合蛋白的cho细胞驯化为悬浮培养的步骤。cho一般条件下为贴壁生长,这样限制了细胞量的增长和融合蛋白的表达,将贴壁细胞驯化为可悬浮培养的细胞株可以有效地解决这一问题,增加融合蛋白表达量,减少疫苗成本。
79.在一个具体的实施方式中,上述融合蛋白的制备方法例如可以为:
80.(1)人工合成pea基因、猪圆环病毒优势抗原表位cap蛋白基因,将其基因片段之间选择柔性氨基酸连接,并在基因片段的3’端插入羧基末端后分别连接至克隆载体中以获得含pea、猪圆环病毒优势抗原表位cap蛋白基因以及羧基末端的克隆载体pmd18
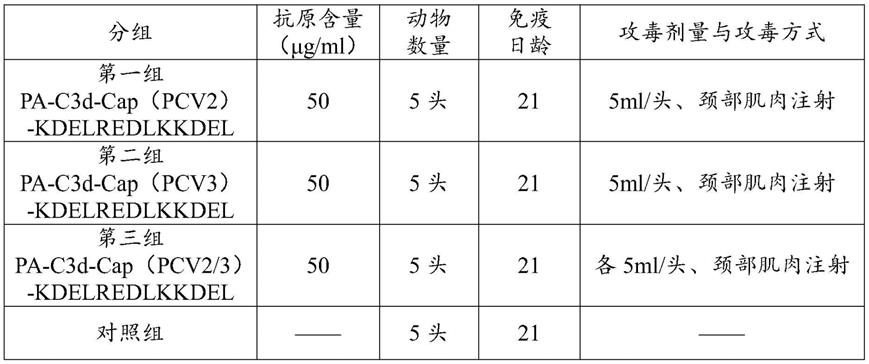
‑
t;(2)将含pea、猪圆环病毒优势抗原表位cap蛋白基因以及羧基末端的克隆载体通过酶切,构建同时包含pea、猪圆环病毒优势抗原表位cap蛋白基因以及羧基末端的表达载体,即猪圆环病毒融合蛋白的表达载体pet32a;将猪圆环病毒融合蛋白的表达载体导入受体菌bl21进行诱导表达;(3)阳性质粒转染cho细胞,通过g418加压筛选后,获得的表达融合蛋白的cho细胞,将上清液通过0.45um滤器过滤,再将用ni+柱纯化融合蛋白,得到猪圆环病毒融合蛋白。
81.其中,典型的双酶切位点可以为ecor i和hind iii;典型的培养基的主要成分可以为葡萄糖、胰蛋白脉、酵母浸出粉、酪蛋白脉、维生素b1、nacl和mgso4。
82.使用pet
‑
32a载体作为表达载体,形成的融合蛋白,标签较小,无需切割得到的纯化蛋白接近天然结构,达到较高的免疫原性。
83.一种能够表达上述融合蛋白的蛋白表达系统。该蛋白表达系统可以但不限为重组载体,重组细胞等含有表达上述融合蛋白基因序列的系统,利用该蛋白表达系统可以简便快捷地纯化得到大量的上述融合蛋白。
84.上述融合蛋白或上述制备方法制备得到的融合蛋白在如下(a)
‑
(d)中的至少一种的应用:
85.a)制备猪圆环病毒疫苗;
86.b)制备猪圆环病毒的抗体;
87.c)制备检测猪圆环病毒的试剂盒;
88.d)制备猪圆环病毒诊断抗原。
89.由于本发明提供的融合蛋白具有较好的免疫原性,因此可以用以制备疫苗,免疫动物后可产生较高的抗体的滴度。使用该融合蛋白制备的猪圆环病毒的抗体以及该融合蛋白可以应用于制备多种检测试剂和试剂盒,用于检测猪圆环病毒或抗体。例如,使用含有猪圆环病毒抗体的elisa试剂盒检测猪圆环病毒,或者使用含有该融合蛋白的胶体金免疫层析试纸检测待测样品中的猪圆环病毒抗体含量。
90.具体地,上述融合蛋白或上述制备方法制备得到的融合蛋白可用于制备预防由pcv2和/或pcv3感染导致的疾病的产品;
91.优选地,所述由pcv2和/或pcv3感染导致的疾病包括断奶仔猪多系统衰竭综合征或猪皮炎肾病综合征。
92.一种含有上述融合蛋白的疫苗。该疫苗安全性好,不会引起不良反应,不会产生无关的抗体,同时效价高并且稳定性好,降低了猪圆环病毒疫苗的生产成本。该疫苗免疫动物
后可以产生较高的抗体滴度,使动物获得较好的保护效果。
93.在一些优选的实施方式中,所述疫苗中的融合蛋白的浓度为10
‑
100μg/ml,例如可以为,但不限于10μg/ml、20μg/ml、30μg/ml、40μg/ml、50μg/ml、60μg/ml、70μg/ml、80μg/ml、90μg/ml或100μg/ml,优选为20
‑
80μg/ml,更优选为50μg/ml。
94.优选地,所述疫苗还包括辅料,所述辅料包括疫苗佐剂、稳定剂和抗生素中的至少一种;
95.优选地,所述疫苗佐剂包括氢氧化铝胶、弗氏完全佐剂、弗氏不完全佐剂、白油佐剂、mf59佐剂或isa201rvg,优选使用isa201rvg。
96.在一个具体的实施方式中,含有上述融合蛋白的疫苗的制备方法包括:
97.将制备好的融合蛋白无菌过滤,进行浓度测定,按照浓度剂量设定稀释好蛋白融合蛋白,然后与佐剂混合、乳化,获得猪圆环病毒疫苗。
98.为了有助于进一步理解本发明,现结合优选实施例对本发明的技术方案进行详细说明。
99.如无特殊说明,本发明实施例中所用仪器或试剂均可从商业途径获得。本发明实施例中所用的试验方法如无特殊说明,均为常规方法。
100.本发明的主要试剂及药品来源如下:
101.pet
‑
32a表达载体和cho细胞均购自invitrogen公司;m2培养基、胎牛血清、胰蛋白酶均购自hyclone公司;ecori、xhoi、t4 dna连接酶、rna酶等,均购自neb公司。一抗购自韩国金诺jbt公司;辣根过氧化物酶标记羊抗鼠血清、购自sigma公司;氢氧化铝胶、弗氏完全佐剂、弗氏不完全佐剂均购自sigma公司;白油佐剂或isa201rvg购自赛比克公司;
102.tris、urea、yeast extract、tryptone购自oxoid公司。iptg为promega产品,氨苄青霉素(amp)、卡那霉素(kan)、琼脂粉、dab、sds、temed、琼脂糖、低熔点琼脂糖、过硫酸铵、丙烯酰胺等购自华美生物工程公司。无水乙醇、酚、氯仿、tween
‑
20、柠檬酸等为分析纯;nacl、mgso4、nahco3、na2co3、kh2po4、na2hpo4、kc1、葡萄糖、胰蛋白脉、酵母浸出粉、酪蛋白胨、维生素b1均购自新疆宝信生物工程有限公司。
103.实施例1融合蛋白pa
‑
c3d
‑
cap
‑
k的表达、鉴定与纯化
104.根据ncbi报道的假单胞杆菌外毒素a(pseudomonas aeruginosapa,登录号:cp007224.1,见seq id no.1)基因序列、猪补体c3d(见seq id no.8)基因序列、pcv2
‑
addlpp 10069株(登录号:eu594437.1)的cap蛋白基因序列(见seq id no.2)以及pcv3
‑
us/mn株(ncbi登录号为:kx898030.1)的cap蛋白基因序列(见seq id no.3)进行分析,最终设计将假单胞杆菌外毒素a(pea)结构域i和ii蛋白、猪补体c3d、猪圆环病毒cap蛋白优势抗原表位以及羧基末端部分含seq id no.4多肽选择柔性氨基酸(seq id no.7)将它们按一定组合串联起来,表达具有良好免疫原性的融合蛋白。
105.1.1pea结构域i和ii与cap基因克隆载体的构建及鉴定
106.根据选取的pea结构域i和ii基因序列、猪补体c3d序列以及cap基因序列,经cho细胞密码子优化后,委托上海生工公司人工合成用融合蛋白基因序列,并插入到pmd18
‑
t中,获得的重组质粒分别命名为pmd18
‑
pa
‑
cap
‑
k和pmd18
‑
pa
‑
c3d
‑
cap
‑
k克隆载体。
107.1.2pet
‑
pa
‑
cap
‑
k表达载体的构建及鉴定
108.将pmd18
‑
pa
‑
cap
‑
k克隆载体、pet
‑
32a表达载体,分别使用ecor i和hind iii双酶
切,酶切产物电泳后使用dna回收试剂盒回收pa
‑
cap
‑
k,pet
‑
32a基因片段,使用dna连接试剂盒,将pa
‑
cap
‑
k和pet
‑
32a酶切片段基因连接过夜,构建pet
‑
pa
‑
cap
‑
k表达载体。将表达载体导入bl21感受态细胞并使用lb培养基培养过夜。使用质粒提取试剂盒提取培养菌质粒,并使用ecori、hindiii双酶切鉴定,将鉴定的阳性质粒送基因公司进行测序分析,测序结果表明:pet
‑
pa
‑
cap
‑
k构建正确。
109.1.3pet
‑
pa
‑
c3d
‑
cap
‑
k表达载体的构建及鉴定
110.将pmd18
‑
pa
‑
c3d
‑
cap
‑
k克隆载体、pet
‑
32a表达载体,分别使用ecor i和hind iii双酶切,酶切产物电泳后使用dna回收试剂盒回收pa
‑
c3d
‑
cap
‑
k,pet
‑
32a基因片段,使用dna连接试剂盒,将pa
‑
c3d
‑
cap
‑
k和pet
‑
32a酶切片段基因连接过夜,构建pet
‑
pa
‑
c3d
‑
cap
‑
k表达载体。将表达载体导入bl21感受态细胞并使用lb培养基培养过夜。使用质粒提取试剂盒提取培养菌质粒,并使用ecori、hindiii双酶切鉴定,鉴定结果显示:酶切后,出现6000bp左右的载体片段和2500bp左右的目的条带,如图4所示,其中,泳道1为pet
‑
pa
‑
c3d
‑
cap(pcv2),泳道2为pet
‑
pa
‑
c3d
‑
cap(pcv3),泳道3为pet
‑
pa
‑
c3d
‑
cap(pcv2/pcv3)。将阳性质粒送基因公司进行测序分析,测序结果表明:pet
‑
pa
‑
c3d
‑
cap
‑
k构建正确。
111.其中,所构建的pet
‑
pa
‑
c3d
‑
cap
‑
k质粒,包括如图1所示的pet
‑
pa
‑
c3d
‑
cap(pcv2)质粒图谱,如图2所示的pet
‑
pa
‑
c3d
‑
cap(pcv3)质粒图谱和如图3所示的pet
‑
pa
‑
c3d
‑
cap(pcv2/pcv3)质粒图谱。
112.1.4表达细胞的建立与筛选
113.1.4.1转染
114.质粒的准备:将重组构建的质粒利用提取试剂盒进行提取(依照试剂盒说明书),得到的质粒12000rpm下离心10min后待用;cho细胞的收集:将悬浮培养的cho细胞进行离心,并利用pbs溶液清洗一次后离心收集;
115.电转反应体系(200ul):3
×
106个cho细胞、20ug质粒;电转条件及培养:将含有细胞和质粒的电转反应体系加入电击杯中,以1500v、10ms条件电击三次,电击后细胞转入两个含有10ml贴壁培养基的10cm平板中,以37℃、5%co2培养1天。
116.1.4.2阳性克隆挑选
117.药物筛选:将培养1天的电击细胞培养平板换液,培养2天后加入终浓度1.8mg/ml的g418,培养2天后换入新的贴壁培养基培养7天;
118.阳性克隆挑选和检测:培养7天后的平板中,将贴壁生长的细胞挑至96孔板中,利用贴壁培养基,37℃、5%co2培养7天后,加入100μl悬浮培养基m2表达培养2天,空板中培养基用于点杂交检测,将其中高表达克隆转至24孔板,利用贴壁培养基培养2天后换为m2培养,培养基用于蛋白质印迹法(westernblot,wb)检测,根据实验结果最终得到高表达克隆。
119.1.4.3重组阳性克隆细胞的摇瓶培养
120.贴壁培养:将t75方瓶中培养的cho细胞利用胰酶消化后,加入10ml m2培养基悬静置37℃、5%co2培养至单层,连续传代培养;
121.500ml锥形瓶悬浮培养:将t75方瓶中培养的cho细胞利用胰酶消化后,加入10ml无血清m2培养基悬浮静置2天后,离心收集细胞并转至摇瓶中以转速100rpm,37℃、5%co2条件下培养;然后将悬浮培养的重组cho细胞以1
×
106个/ml终浓度接入装有100mlm2培养基的500ml锥形瓶中,培养基中加入终浓度1mg/l维生素k,以转速100rpm,37℃、5%co2,每天
取样检测培养基中细胞密度、融合蛋白浓度和葡萄糖浓度。
122.5l生物反应器发酵培养:将悬浮培养的重组cho细胞以1
×
106个/ml终浓度接入装有3lm2培养基的生物反应器中,一般进行5~8倍放大,放大到特定体积时进行抗原的表达,在37℃培养至第5日将温度降至32℃,ph调整至7.5
±
0.1,并以适宜转速进行培养,在第4日和第9日加入10%起始工作体积的efficientfeed,每日检测葡萄糖浓度,当葡萄糖浓度低于2.5g/l时,补充葡萄糖到3~4g/l。当细胞活率低于75%时,收获上清即为所需抗原。
123.通过优化该细胞株的培养条件、补料时间,补料量最终获得了1.0mg/ml的融合蛋白表达。
124.1.4.4融合蛋白的表达、鉴定
125.蛋白质凝胶电泳:sds
‑
page胶为上层5%浓缩胶和下层10%分离胶,以100v电压、400ma条件电泳10min,然后以150v电压、400ma电泳1h。
126.免疫印迹:将样品经sds
‑
page凝胶分离后在转膜缓冲液中转至pdvf膜中,转膜条件为100v电压、400ma电流1h,pdvf膜经封闭和孵育cap蛋白单克隆抗体作用4h后,加入hrp标记羊抗鼠二抗稀释液,室温孵育2h,经pbst清洗三次,每次10min,最后利用dab显色液进行显色检测。
127.1.4.5融合蛋白的纯化
128.将表达的融合蛋白样品8000rpm离心10min,收集上清后,使用ni
+
亲和层析柱进行纯化,纯化蛋白使用生理盐水进行透析,使用sds
‑
page对其进行鉴定。鉴定结果表明:纯化产物经sds
‑
page电泳后,目的蛋白片段与预期大小相符。融合蛋白含量为0.8mg/ml,于
‑
80℃冻存。
129.实施例2猪圆环病毒疫苗的制备
130.将实施例1制备的融合蛋白使用pbs溶液稀释,将稀释后的融合蛋白溶液与seppic isa201r vg佐剂按质量分数为50%比例混合在一起,以8000r/min的转速搅拌10min,在终止搅拌前加入0.01%(体积比)硫柳汞溶液,使其终浓度不超过万分之一,充分振荡混匀后,按照现行版中国兽药典附录要求无菌检验、粘度测定、稳定性测定合格后,放置于4℃备用。
131.实施例3猪圆环病毒疫苗组的应用
132.用实施例1和2提供的方法制备不同成分的猪圆环病毒亚单位疫苗,按照不同成分进行分组免疫仔猪(pcv2抗体效价不高于1:64),分组见表1。免后采血,应用间接免疫荧光试验(ifa)进行pcv抗体效价,评估抗体水平变化规律,首免后14日,进行二次免疫。首免后28日,进行攻毒,评价疫苗效力。
133.表1仔猪免疫猪圆环病毒疫苗组合物分组情况
[0134][0135]
疫苗免疫后,pcv cap蛋白抗体水平相较于对照组有显著差异,各免疫组抗体水平均有转阳,pcv2抗体平均效价均不低于1:1024;各免疫组pcv2抗体效价水平相当。其中,本发明中的融合蛋白产生的pcv2抗体效价与单一蛋白组相当,但pcv3抗体效价明显高于单一蛋白组(第二组),表明本技术融合蛋白对于pcv3病毒免疫具有出乎意料的效果。对照组均未转阳,pcv2抗体平均效价均不高于1:64,具体试验结果见表2。
[0136]
表2猪圆环病毒疫苗组合物免后28日pcv抗体ifa检测结果
[0137][0138]
将不同形式表达的抗原配制成疫苗后,进行疫苗的免疫效力试验。攻毒试验结果显示,疫苗免疫组病毒血症、猪只体重以及组织细胞中抗原定性结果(根据免疫组化检测结果评分获得)见表3,具体免疫组化检测结果见图5。
[0139]
表3猪圆环病毒疫苗组合物pcv2效力试验结果
[0140][0141][0142]
注:pcv2发病判定标准参考武汉中博生物制品股份有限公司《猪圆环病毒ii型杆状病毒载体灭活疫苗(cp08)株》质量标准,发病猪判定标准具体内容如下:
[0143]
(1)仔猪相对增重率≥5%则判为仔猪发育不良,有pcv2感染的临床症状;
[0144]
(2)攻毒后血液中有pcv2抗原检测为阳性反应;
[0145]
(3)攻毒后28日,剖检猪组织中pcv2抗原呈阳性反应。
[0146]
3条中符合以上2条则判为发病。
[0147]
其中,仔猪相对增重率的计算方式为:
[0148][0149]
疫苗免疫攻毒保护标准为:疫苗免疫组实验猪4/5保护,判定疫苗合格;攻毒对照组5/5发病。
[0150]
由表3可知,免疫组免后28日,经pcv2种毒感染后,免疫组仔猪攻毒后所有仔猪的血清中和组织中pcv2评价结果均为阴性;
[0151]
各免疫组相对增重率均不高于5%,说明仔猪生长正常。从各组中实验猪平均日增重分析可知,第三组实验猪为
‑
2.458%,明显优于其他两免疫组;说明本技术中的融合蛋白疫苗免疫实验猪后产生抗体的效果比单一蛋白组明显,能够较好的抵御病毒对机体的损伤,减轻对体重的影响。
[0152]
从图5中的具体组织免疫组化(ihc)检测结果可以看出,各免疫组实验猪淋巴结中病毒抗原均明显少于对照组,其中第三组实验猪淋巴结检测中细胞染色均为蓝色,未检测到阳性抗原,细胞分布均匀,未见细胞脱落,说明病毒对组织器官未造成严重损伤,而单一蛋白组中均有不同程度的阳性抗原检出,细胞数量明显较少且均匀度较差,存在一定细胞脱落。
[0153]
实施例4疫苗结构实验
[0154]
用实施例1和2提供的方法制备序列不同的猪圆环病毒亚单位疫苗,具体序列情况如表4所示。
[0155]
表4不同猪圆环病毒亚单位疫苗抗原核苷酸序列
[0156]
组别序列第一组no.16第二组no.17第三组no.18
[0157]
按照实施例1
‑
2中的方法制备和验证下表5不同分组中的疫苗组合物,并对其免疫后的抗体效价、抗原稳定性、可溶性蛋白含量进行检测,检测结果分别如表5、表6、表7所示。
[0158]
表5仔猪免疫各组合结构的猪圆环病毒疫苗免疫后抗体检测情况
[0159][0160]
表6仔猪免疫各组合结构的猪圆环病毒疫苗免疫后抗体检测情况
[0161][0162]
表7各组合蛋白纯化后的稳定性分析分析结果
[0163][0164]
通过上述检测结果可知,各种形式组合制备出疫苗免疫实验猪后,抗体水平产生情况存在一定差异。本发明的组合形式,从抗体产生情况、抗原保存、表达量以及稳定性方面均有较好的效果。
[0165]
以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1