免疫原性细胞死亡相关基因在头颈鳞癌生存预后及放疗应答性中的应用
1.本发明属于疾病预后和分子生物学技术领域,具体涉及免疫原性细胞死亡相关基因在头颈鳞癌生存预后及放疗应答性中的应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.头颈鳞状细胞癌(head and neck squamous cell carcinoma,hnscc)发病率和死亡率均较高,肿瘤异质性大,目前尚缺乏有效的特异性诊断。hnscc主要治疗方式为手术、放疗和化疗,但患者治疗应答率较低,预后较差。
4.免疫原性细胞死亡(immunogenic cell death,icd)是维持机体稳态的重要生物学过程,诱导炎性和免疫应答。近年来研究发现,一些抗肿瘤药物除了直接细胞毒性以外,还可通过多种机制诱导肿瘤免疫原性细胞死亡,释放损伤相关分子模式,并增强抗肿瘤免疫效应。肿瘤细胞发生免疫原性死亡需要一系列信号分子和细胞因子的参与,包括细胞膜表面信号分子表达水平的改变,促免疫效应因子的合成与释放等,因此,免疫原性细胞死亡相关基因与肿瘤的发生发展紧密相关。然而,目前,免疫原性细胞死亡相关基因在头颈鳞状细胞癌中作用的相关研究仍然较少,因此有必要探寻免疫原性细胞死亡相关基因与头颈鳞状细胞癌之间的关系,为头颈鳞状细胞癌的诊断、预后等奠定基础。
技术实现要素:
5.针对现有技术存在的不足,本发明提供免疫原性细胞死亡相关基因在头颈鳞癌生存预后及放疗应答性中的应用。本发明通过筛选头颈鳞癌预后相关基因,构建免疫原性细胞死亡相关基因预测指数(immunogenic cell death
‑
related genetic prognostic index,icdrgpi),证明其对hnscc患者生存有较好的预测作用,且icdrgpi高低患者放疗后生存存在明显差异,icdrgpi可用于hnscc预后预测且可辅助临床放疗决策。
6.具体的,本发明涉及以下技术方案:
7.本发明的第一个方面,提供一种用于头颈鳞癌生存预后评估和/或放疗应答性的标志物,所述标志物包括选自下列基因中的任意一种或多种:
8.atf6、becn1、csnk2a2、cttn、fbxo7、nlrp1、plaa、rfpl1、rubcnl、sptlc1、srpx、stk24、tp53inp1、triml2和vps37c。
9.进一步的,所述标志物为上述atf6、becn1、csnk2a2、cttn、fbxo7、nlrp1、plaa、rfpl1、rubcnl、sptlc1、srpx、stk24、tp53inp1、triml2和vps37c组成的组。
10.其中,所述预后评估具体包括对头颈鳞癌患者总生存期(os)的评估。
11.本发明的第二个方面,提供检测上述标志物的表达水平的试剂在制备产品中的应
用,所述产品用于头颈鳞癌生存预后评估和/或放疗应答性。
12.本发明的第三个方面,提供一种产品,所述产品包含检测上述用于头颈鳞癌生存预后评估和/或放疗应答性的标志物的物质,所述产品用于头颈鳞癌生存预后评估和/或放疗应答性。
13.所述产品可以为试剂盒。
14.本发明的第四个方面,提供一种用于头颈鳞癌生存预后评估和/或放疗应答性的系统,所述系统包括:
15.i)分析模块,所述分析模块包含:用于确定受试者的待测样品中选自上述免疫原性细胞死亡相关基因表达水平的检测物质,以及;
16.ii)评估模块,所述评估模块包含:根据i)中确定的所述免疫原性细胞死亡相关基因表达水平对所述受试者进行生存预后评估和/或放疗应答性判断;
17.其中,所述步骤i)分析模块中,所述免疫原性细胞死亡相关基因包括选自下列基因中的任意一种或多种:
18.atf6、becn1、csnk2a2、cttn、fbxo7、nlrp1、plaa、rfpl1、rubcnl、sptlc1、srpx、stk24、tp53inp1、triml2和vps37c。
19.进一步的,所述标志物为上述atf6、becn1、csnk2a2、cttn、fbxo7、nlrp1、plaa、rfpl1、rubcnl、sptlc1、srpx、stk24、tp53inp1、triml2和vps37c组成的组。
20.所述步骤ii)评估模块具体评估流程包括:根据i)中确定的所述免疫原性细胞死亡相关基因表达水平,基于免疫原性细胞死亡相关基因预测指数icdrgpi进行生存预后评估和/或放疗应答性判断;
21.其中,所述icdrgpi,其计算公式=(0.34*atf6基因表达量)+(0.70*becn1基因表达量)+(0.32*csnk2a2基因表达量)+(0.06*cttn基因表达量)+(0.64*fbxo7基因表达量)
‑
(0.27*nlrp1基因表达量)+(0.26*plaa基因表达量)
‑
(0.15*rfpl1基因表达量)
‑
(0.11*rubcnl基因表达量)+(0.27*sptlc1基因表达量)+(0.09*srpx基因表达量)+(0.16*stk24基因表达量)
–
(0.05*tp53inp1基因表达量)+(0.10*triml2基因表达量)
–
(0.38*vps37c基因表达量)。
22.更进一步的,
23.受试者icdrgpi指数高于阈值时为高表达,则指示受试者预后较差(总生存期较短),对放疗敏感(即可以从放疗中获益);
24.受试者icdrgpi指数低于阈值时为低表达,则指示受试者预后较好(总生存期较长),对放疗不敏感(即不能从放疗中获益)。
25.所述阈值为利用“surv_cutpoint”函数计算os生存资料中icdrgpi的截断值。
26.本发明的第五个方面,提供一种头颈鳞癌患者预后风险评估和/或放疗应答性的方法,所述方法包括使用上述标志物和/或上述系统进行评估;
27.所述预后风险评估包括对受试者的总生存期(os)进行预测评估。
28.以上一个或多个技术方案的有益技术效果:
29.上述技术方案通过基于tcga数据库中hnscc临床和rna
‑
seq数据构建新的免疫原性细胞死亡相关预测指数icdrgpi,以预测生存和放疗疗效,经试验证明,免疫原性细胞死亡相关基因预测指数icdrgpi对hnscc生存有较好的预测作用,且icdrgpi高低患者放疗后
生存存在明显差异。icdrgpi的预后预测作用在验证队列中得到进一步验证。icdrgpi可用于hnscc预后预测且可辅助临床放疗决策,因此具有良好的实际应用之价值。
附图说明
30.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
31.图1是本发明实施例中免疫原性细胞死亡相关基因预测指数构建系列图,其中,a是本发明实施例中单因素cox回归分析与总生存(overall survival,os)显著相关基因及临床特征聚类分析图;b为本发明实施例中将os显著相关基因构建lasso回归模型;c为本发明实施例中lasso回归模型中一倍se为界值选取建模基因;d为本发明实施例中免疫原性细胞死亡相关基因预测指数icdrgpi各基因表达情况。
32.图2是本发明实施例中icdrgpi预后预测分析及放疗疗效情况分析图;其中,a是本发明实施例中免疫原性细胞死亡相关基因预测指数icdrgpi对不同os的roc分析图;b是本发明实施例中高、低icdrgpi指数与os预后分析图;c是本发明实施例中高、低icdrgpi指数与放疗疗效情况分析图。
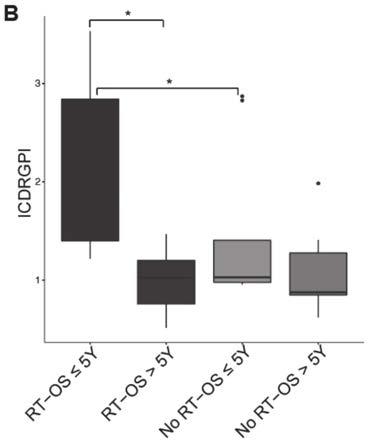
33.图3是本发明实施例中验证队列中预后预测分析相关图,其中,a是本发明实施例中验证队列中os小于等于5年和大于5年两组患者icdrgpi差异;b是本发明实施例中验证队列中os小于等于5年和大于5年联合放疗各组icdrgpi差异。
34.图4为本发明实施例差异基因筛选及指数构建技术框架图。
具体实施方式
35.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
36.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本技术的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。下列具体实施方式中如果未注明具体条件的实验方法,通常按照本领域技术内的分子生物学的常规方法和条件,这种技术和条件在文献中有完整解释。参见例如sambrook等人,《分子克隆:实验手册》中所述的技术和条件,或按照制造厂商所建议的条件。
37.结合具体实例对本发明作进一步的说明,以下实例仅是为了解释本发明,并不对其内容进行限定。如果实施例中未注明的实验具体条件,通常按照常规条件,或按照销售公司所推荐的条件;实施例中所用的材料、试剂等,如无特殊说明,均可通过商业途径购买得到。
38.术语“标志物”,是指“一种可客观检测和评价的特性,可作为正常生物学过程、病理过程或治疗干预药理学反应的指示因子”。例如,核酸标志物(也可以称为基因标志物,例如dna),蛋白质标志物,细胞因子标记物,趋化因子标记物,碳水化合物标志物,抗原标志物,抗体标志物等。其中,核酸标志物的含义并不局限于现有可以表达为具有生物活性的蛋
白质的基因,还包括任何核酸片段,可以为dna,也可以为rna,可以是经过修饰的dna或者rna,也可以是未经修饰的dna或者rna,以及由它们组成的集合。
39.术语指标的水平“上调”、“升高”或“提高”是指与参照相比,样品中这样的指标的水平升高。
40.术语指标的水平“下调”、“降低”或“下降”是指与参照相比,样品中这样的指标的水平降低。
41.如本发明所使用的术语“试剂盒”是指优选地单独提供或提供在单个容器内的上述组分的集合。容器还优选地包含有用于实施本发明方法的说明。在本说明书中已经给出了试剂盒的这些组分的实例及其使用方法。优选地,试剂盒包含在即用型制剂中的上述组分。优选地,试剂盒可另外地包括说明书,例如用于调节组分(例如,检测剂的浓度)以及用于解释关于通过本发明方法所提供诊断的任何测定的结果的用户手册。特别地,这样的手册可以包括用于将确定基因产物的量分配至诊断类型的信息。细节见于本说明书的别处。此外,这样的用户手册可以提供关于正确地使用试剂盒组分用于确定相应生物标志物的量的说明。用户手册可以以纸质或电子形式提供(例如,存储在cd或cd rom上)。本发明还涉及所述试剂盒在根据本发明的任何方法中的用途。
42.本发明的一个典型具体实施方式中,提供一种用于头颈鳞癌生存预后评估和/或放疗应答性的标志物,所述标志物包括选自下列基因中的任意一种或多种:
43.atf6、becn1、csnk2a2、cttn、fbxo7、nlrp1、plaa、rfpl1、rubcnl、sptlc1、srpx、stk24、tp53inp1、triml2和vps37c。
44.进一步的,所述标志物为上述atf6、becn1、csnk2a2、cttn、fbxo7、nlrp1、plaa、rfpl1、rubcnl、sptlc1、srpx、stk24、tp53inp1、triml2和vps37c组成的组。
45.其中,所述预后评估具体包括对头颈鳞癌患者总生存期(os)的评估。
46.本发明的第二个方面,提供检测上述标志物的表达水平的试剂在制备产品中的应用,所述产品用于头颈鳞癌生存预后评估和/或放疗应答性。
47.本发明的第三个方面,提供一种产品,所述产品包含检测上述用于头颈鳞癌生存预后评估和/或放疗应答性的标志物的物质,所述产品用于头颈鳞癌生存预后评估和/或放疗应答性。
48.所述产品包括但不限于检测待测样本中所述免疫原性细胞死亡相关基因表达水平的引物、探针、芯片、核酸膜条、制剂或试剂盒。
49.所述待测样本可为人源样本,更具体的,所述待测样本包括受试者头颈鳞癌组织和/或细胞。
50.所述产品可以为试剂盒。
51.本发明的第四个方面,提供一种用于头颈鳞癌生存预后评估和/或放疗应答性的系统,所述系统包括:
52.i)分析模块,所述分析模块包含:用于确定受试者的待测样品中选自上述免疫原性细胞死亡相关基因表达水平的检测物质,以及;
53.ii)评估模块,所述评估模块包含:根据i)中确定的所述免疫原性细胞死亡相关基因表达水平对所述受试者进行生存预后评估和/或放疗应答性判断;
54.其中,所述步骤i)分析模块中,所述免疫原性细胞死亡相关基因包括选自下列基
因中的任意一种或多种:
55.atf6、becn1、csnk2a2、cttn、fbxo7、nlrp1、plaa、rfpl1、rubcnl、sptlc1、srpx、stk24、tp53inp1、triml2和vps37c。
56.进一步的,所述标志物为上述atf6、becn1、csnk2a2、cttn、fbxo7、nlrp1、plaa、rfpl1、rubcnl、sptlc1、srpx、stk24、tp53inp1、triml2和vps37c组成的组。
57.所述步骤ii)评估模块具体评估流程包括:根据i)中确定的所述免疫原性细胞死亡相关基因表达水平基于免疫原性细胞死亡相关基因预测指数icdrgpi进行生存预后评估和/或放疗应答性判断;
58.其中,所述icdrgpi,其计算公式=(0.34*atf6基因表达量)+(0.70*becn1基因表达量)+(0.32*csnk2a2基因表达量)+(0.06*cttn基因表达量)+(0.64*fbxo7基因表达量)
‑
(0.27*nlrp1基因表达量)+(0.26*plaa基因表达量)
‑
(0.15*rfpl1基因表达量)
‑
(0.11*rubcnl基因表达量)+(0.27*sptlc1基因表达量)+(0.09*srpx基因表达量)+(0.16*stk24基因表达量)
–
(0.05*tp53inp1基因表达量)+(0.10*triml2基因表达量)
–
(0.38*vps37c基因表达量)。
59.更进一步的,
60.受试者icdrgpi指数高于阈值时为高表达,则指示受试者预后较差(总生存期较短),对放疗敏感(即可以从放疗中获益);
61.受试者icdrgpi指数低于阈值时为低表达,则指示受试者预后较好(总生存期较长),对放疗不敏感(即不能从放疗中获益)。
62.所述阈值为利用“surv_cutpoint”函数计算os生存资料中icdrgpi的截断值。
63.本发明的第五个方面,提供一种头颈鳞癌患者预后风险评估和/或放疗应答性的方法,所述方法包括使用上述标志物和/或上述系统进行评估;
64.所述预后风险评估包括对受试者的总生存期(os)进行预测评估。
65.以下通过实施例对本发明做进一步解释说明,但不构成对本发明的限制。应理解这些实施例仅用于说明本发明而不用于限制本发明的范围。
66.实施例
67.实验方法
68.1.研究方案
69.差异基因筛选及指数构建技术框架见图4。
70.2.头颈癌患者队列公共数据及免疫原性细胞死亡相关基因下载
71.头颈癌临床病理信息和rna
‑
seq数据从tcga数据库(https://portal.gdc.cancer.gov/)下载。分别以“pyroptosis”,“apoptosis”,和“autophagy”为关键词从go数据库(http://amigo.geneontology.org/amigo/landing)获取666个免疫原性细胞死亡相关基因。
72.3.免疫原性细胞死亡相关基因预测指数(immunogenic cell death
‑
related genetic prognostic index,icdrgpi)构建
73.从528头颈癌患者中将既往有恶性肿瘤病史,放化疗治疗史,非鳞状细胞癌和无生存信息等患者剔除,得451例原发头颈鳞状细胞癌患者,临床病理特征见表1;单因素cox回归分析选取与(overall survival,os)显著相关基因(p<0.05),共103个与生存显著相关基
因(表2);其次,利用least absolute shrinkage and selection operator(lasso)回归分析,以one standard error(se)为界值进一步筛选预后相关基因,得33个基因列表;然后,基于向前向后逐步回归方法筛选16个更显著基因;剔除1个不满足proportional hazards(ph)检验基因,最后将15个免疫原性细胞死亡相关基因根据多因素cox回归分析得到的回归系数乘以基因表达量构建免疫原性细胞死亡相关基因预测指数(immunogenic cell death
‑
related genetic prognostic index,icdrgpi),icdrgpi=σcoef*expression。
74.表1
[0075][0076][0077]
注:na代表对应信息不可用;p
*
适用于除na之外的其他病患。
[0078]
表2
[0079]
[0080]
[0081]
[0082][0083]
4.roc分析
[0084]
使用受试者工作特征(receiver operating characteristic,roc)曲线分析预测指数对1年,3年,5年和10年总生存的诊断效能。选择诊断的最佳临界点——截断值(cut off)比较auc(area under the roc curve,roc曲线下的面积)、敏感度(sensitivity,se)、特异度(specificity,sp)、youden指数(youden
′
s index,yi)。p<0.05为差异有统计学意义。
[0085]
5.生存分析
[0086]
利用“surv_cutpoint”函数计算os生存资料中预测指数的截断值,基于截断值将头颈鳞癌患者分为指数高表达和低表达组并绘制os生存曲线,分析指数高低两组总生存差异;随后,我们进一步对指数高低表达两组放疗疗效进行生存分析,分别对两组患者放疗与否进行log
‑
rank统计分析,分析指数对放疗应答性的预测作用。
[0087]
6.在实际病例队列中进行验证
[0088]
选取齐鲁医院28例原发头颈鳞癌患者作为验证队列,根据公式构建icdrgpi,剔除2例异常icdrgpi高表达值,得26例hnscc验证队列,临床病理特征见表3。分别分析os小于等于5年和大于5年患者icdrgpi值,验证指数对os预测作用。进一步分析os小于等于5年和os大于5年联合放疗各组患者icdrgpi值,验证指数对患者放疗应答的预测作用。
[0089]
表3
[0090][0091]
实验结果
[0092]
1.免疫原性细胞死亡相关基因预测指数(immunogenic cell death
‑
related genetic prognostic index,icdrgpi)构建
[0093]
单因素cox回归分析与总生存(overall survival,os)显著相关基因及临床特征聚类分析见图1a;least absolute shrinkage and selection operator(lasso)回归分析进一步筛选预后相关基因(图1b和1c);根据多因素cox回归分析,构建免疫原性细胞死亡相关基因预测指数icdrgpi,计算公式=(0.34*atf6基因表达量)+(0.70*becn1基因表达量)+(0.32*csnk2a2基因表达量)+(0.06*cttn基因表达量)+(0.64*fbxo7基因表达量)
‑
(0.27*nlrp1基因表达量)+(0.26*plaa基因表达量)
‑
(0.15*rfpl1基因表达量)
‑
(0.11*rubcnl基因表达量)+(0.27*sptlc1基因表达量)+(0.09*srpx基因表达量)+(0.16*stk24基因表达量)
–
(0.05*tp53inp1基因表达量)+(0.10*triml2基因表达量)
–
(0.38*vps37c基因表达
量),各基因表达如图1d所示。
[0094]
2.icdrgpi预后预测分析
[0095]
roc分析提示icdrgpi对os的预测精度较高(1年,3年,5年和10年auc分别为0.740,0.748,0.738,0.764;图2a);生存分析示低icdrgpi患者有较长os,预后较好(p<0.0001,图2b)。
[0096]
3.放疗疗效分析
[0097]
分别对icdrgpi高低两组是否接受放疗进行生存分析,结果如图2c所示,高icdrgpi患者可从放疗中获益,但低icdrgpi患者放疗不获益。
[0098]
4.验证队列预后预测分析
[0099]
验证队列中,os小于等于5年患者icdrgpi值明显高于os大于5年组患者(p<0.05;图3a),提示icdrgpi高表达患者预后较差;其次,os联合放疗分析显示,接受放疗患者,os小于等于5年患者icdrgpi值明显高于os大于5年患者(p<0.05;图3b)。
[0100]
免疫原性细胞死亡相关基因预测指数icdrgpi对hnscc生存有较好的预测作用,且icdrgpi高低患者放疗后生存存在明显差异,icdrgpi可用于hnscc预后预测且可辅助临床放疗决策。
[0101]
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1