单臂I型和II型受体融合蛋白和其用途的制作方法
单臂i型和ii型受体融合蛋白和其用途
1.本技术是申请日为2016年4月6日的中国专利申请201680033054.5“单臂i型和ii型受体融合蛋白和其用途”的分案申请。
2.相关申请的交叉引用
3.本技术要求2015年4月6日提交的美国临时申请系列号62/143,579和2015年11月24日提交的62/259,422的优先权。前述申请的公开内容通过引用以其整体结合到本文中。
背景技术:
4.转化生长因子
‑
β(tgf
‑
β)超家族包含各种生长因子,其享有共同的序列元件和结构基序。这些蛋白已知在脊椎动物和无脊椎动物二者中对多种细胞类型发挥生物学作用。超家族的成员在胚胎发育期间在模式形成和组织特化中执行重要的功能,和可影响各种分化过程,包括脂肪生成、肌生成、软骨发生、心脏发生、血细胞生成、神经发生和上皮细胞分化。超家族分成两个概括的系统发生进化枝:更近进化的超家族成员,其包括tgf
‑
β、活化素和nodal,和更远相关的超家族蛋白的进化枝,其包括许多bmp和gdf。hinck(2012)febs letters586:1860
‑
1870。tgf
‑
β超家族成员具有多样的,通常互补的生物学作用。通过操纵tgf
‑
β超家族的成员的活性,通常有可能引起生物体的显著生理学变化。例如,piedmontese和belgian blue牛品种带有gdf8(亦称为肌抑素)基因的功能丢失突变,其导致肌肉质量显著增加。grobet等(1997)nat genet.,17(1):71
‑
4。此外,在人中,gdf8的失活的等位基因与肌肉质量增加有关,并据报道,与异常的力量有关。schuelke等(2004)n engl jmed,350:2682
‑
8。
5.肌肉、骨、脂肪、红细胞和其它组织的变化可通过增强或抑制由tgf
‑
β超家族的配体介导的信号传导(例如,smad 1、2、3、5和/或8)来实现。因此,对调节tgf
‑
β超家族的各种配体的活性的试剂存在需要。
技术实现要素:
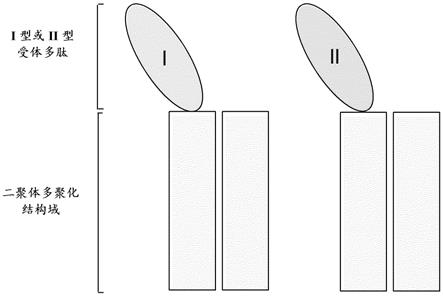
6.部分地,本公开内容提供了异多聚体复合物,其包含单一tgf
‑
β超家族i型或ii型丝氨酸/苏氨酸激酶受体多肽(例如,alk1、alk2、alk3、alk4、alk5、alk6、alk7、actriia、actriib、tgfbrii、bmprii或misrii多肽),包括其片段和变体。这些构建体在本文可被称为“单臂”多肽复合物。任选地,与相应的同二聚体复合物(例如,actriib同二聚体,例如actriib
‑
fc:actriib
‑
fc)相比,本文公开的单臂多肽复合物(例如,单臂actriib多肽复合物,例如actriib
‑
fc:fc异二聚体)具有不同的配体
‑
结合特异性/特征。包含tgf
‑
β超家族i型或ii型丝氨酸/苏氨酸激酶受体多肽的单一结构域的异多聚体多肽复合物显示了新的性质,如本文的实施例所示。
7.异多聚体结构包括例如,异二聚体、异三聚体和更高级的复合物。优选地,本文所述的tgf
‑
β超家族i型和ii型受体多肽包含受体的配体
‑
结合结构域,例如tgf
‑
β超家族i型或ii型受体的细胞外结构域。因此,在某些方面,本文所述的蛋白复合物包含选自actriia、actriib、tgfbrii、bmprii和misrii的ii型tgf
‑
β超家族受体的细胞外结构域,以及其截短
和变体,或选自alk1、alk2、alk3、alk4、alk5、alk6和alk7的i型tgf
‑
β超家族受体的细胞外结构域,以及其截短和变体。优选地,本文所述的tgf
‑
β超家族i型和ii型多肽,以及包含其的蛋白复合物,是可溶性的。在某些方面,本公开内容的异多聚体复合物结合一种或多种tgf
‑
β超家族配体(例如,bmp2、bmp2/7、bmp3、bmp4、bmp4/7、bmp5、bmp6、bmp7、bmp8a、bmp8b、bmp9、bmp10、gdf3、gdf5、gdf6/bmp13、gdf7、gdf8、gdf9b/bmp15、gdf11/bmp11、gdf15/mic1、tgf
‑
β1、tgf
‑
β2、tgf
‑
β3、活化素a、活化素b、活化素c、活化素e、活化素ab、活化素ac、活化素ae、活化素bc、活化素be、nodal、神经胶质细胞衍生的神经营养因子(gdnf)、neurturin、artemin、persephin、m
ü
llerian
‑
抑制物质(mis)和lefty)。任选地,本公开内容的蛋白复合物以小于或等于10
‑8、10
‑9、10
‑
10
、10
‑
11
或10
‑
12
的k
d
结合一种或多种这些配体。一般而言,本公开内容的异多聚体复合物拮抗(抑制)至少一种tgf
‑
β超家族配体的一种或多种活性,和这样的活性改变可使用本领域已知的各种测定法测量,包括例如,本文所述的基于细胞的测定法。优选地,本公开内容的蛋白复合物在哺乳动物(例如,小鼠或人)中显示至少4、6、12、24、36、48或72小时的血清半寿期。任选地,本公开内容的蛋白复合物在哺乳动物(例如,小鼠或人)中可显示至少6、8、10、12、14、20、25或30天的血清半寿期。
8.在某些方面,本文所述的蛋白复合物包含与第二多肽共价或非共价缔合的第一多肽,其中第一多肽包含tgf
‑
β超家族i型或ii型受体多肽的氨基酸序列和相互作用对的第一成员的氨基酸序列,和第二多肽包含相互作用对的第二成员和不包含tgf
‑
β超家族i型或ii型受体多肽的氨基酸序列。任选地,除了相互作用对的第二成员之外,第二多肽包含另外的多肽序列,其不是tgf
‑
β超家族i型或ii型受体多肽和可任选地包含不超过5、10、15、20、30、40、50、100、200、300、400或500个氨基酸。任选地,tgf
‑
β超家族i型或ii型受体多肽直接连接至相互作用对的第一成员,或者间插序列,例如接头,可位于tgf
‑
β超家族i型或ii型受体多肽的氨基酸序列和相互作用对的第一成员的氨基酸序列之间。接头的实例包括但不限于序列tggg、tgggg、sgggg、ggggs和ggg。
9.本文所述的相互作用对经设计以促进二聚化或形成更高级多聚体。在一些实施方案中,相互作用对可以是相互作用以形成复合物、特别是异二聚体复合物的任何两个多肽序列,但有效的实施方案也可使用形成同二聚体复合物的相互作用对。相互作用对的第一和第二成员可以是不对称的对,意思是该对的成员优先彼此缔合,而非自缔合。因此,不对称的相互作用对的第一和第二成员可缔合形成异二聚体复合物。或者,相互作用对可以是非引导的,意思是该对的成员可彼此缔合或自缔合,没有实质的偏好,因此可具有相同或不同的氨基酸序列。因此,非引导的相互作用对的第一和第二成员可缔合形成同二聚体复合物或异二聚体复合物。任选地,相互作用对的第一成员(例如,不对称的对或非引导的相互作用对)与相互作用对的第二成员共价缔合。任选地,相互作用对的第一成员(例如,不对称的对或非引导的相互作用对)与相互作用对的第二成员非共价缔合。
10.传统的fc融合蛋白和抗体是非引导的相互作用对的实例,而各种工程改造的fc结构域经设计作为不对称的相互作用对。因此,本文所述的相互作用对的第一成员和/或第二成员可包含免疫球蛋白的恒定结构域,包括例如免疫球蛋白的fc部分。任选地,相互作用对的第一成员可包含源自igg1、igg2、igg3或igg4免疫球蛋白的fc结构域的氨基酸序列。例如,相互作用对的第一成员可包含与seq id no:200
‑
214中任一个具有至少80%,85%,90%,91%,92%,93%,94%,95%,96%,97%,98%,99%或100%同一性的氨基酸序列,基
本上由其组成,或由其组成。任选地,相互作用对的第二成员可包含源自igg1、igg2、igg3或igg4的fc结构域的氨基酸序列。例如,相互作用对的第二成员可包含与seq id no:200
‑
214中任一个具有至少80%,85%,90%,91%,92%,93%,94%,95%,96%,97%,98%,99%或100%同一性的氨基酸序列,基本上由其组成,或由其组成。在一些实施方案中,相互作用对的第一成员和第二成员包含源自相同的免疫球蛋白类型和亚型的fc结构域。在其它实施方案中,相互作用对的第一成员和第二成员包含源自不同的免疫球蛋白类型或亚型的fc结构域。任选地,相互作用对的第一成员和/或第二成员(例如,不对称的对或非引导的相互作用对)包含免疫球蛋白的修饰的恒定结构域,包括例如,免疫球蛋白的修饰的fc部分。例如,本公开内容的蛋白复合物可包含igg的第一fc部分,其包含与选自seq id no:200
‑
214的氨基酸序列具有至少80%,85%,90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的氨基酸序列;和igg的第二fc部分,其可以与igg的第一修饰的fc部分的氨基酸序列相同或不同,包含与选自seq id no:200
‑
214的氨基酸序列具有至少80%,85%,90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的氨基酸序列。
11.在一些实施方案中,本公开内容提供了包含单一i型或ii型tgf
‑
β超家族受体多肽的异聚多肽复合物,其中tgf
‑
β超家族受体多肽源自actriia受体。例如,actriia多肽可包含与本文公开的actriia序列(例如,seq id no:9,10,11,101,103,401,和402)具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列,基本上由其组成,或由其组成。任选地,actriia多肽可包含与以下多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列,基本上由其组成,或由其组成:a)以seq id no:9的氨基酸21
‑
30中任一个(例如,氨基酸残基21,22,23,24,25,26,27,28,29,或30)开始,和b)以seq id no:9的氨基酸110
‑
135中任一个(例如,110,111,112,113,114,115,116,117,118,119,120,121,122,123,124,125,126,127,128,129,130,131,132,133,134或135)结束。任选地,本公开内容的actriia多肽可以是融合蛋白,其进一步包含与actriia异源的一个或多个部分(结构域)。例如,actriia多肽可与包含多聚化结构域的异源多肽融合,任选地含位于actriia多肽和异源多肽(例如,seq id no:101,103,401,和402)之间的接头结构域。在一些实施方案中,本文所述的多聚化结构域包含相互作用对的一个组分。包含actriia多肽的异聚复合物不包含另一i型或ii型tgf
‑
β超家族受体多肽,但可包含不是i型或ii型tgf
‑
β超家族受体多肽的另外的多肽。
12.在一些实施方案中,本公开内容提供了包含i型或ii型tgf
‑
β超家族受体多肽的异聚多肽复合物,其中tgf
‑
β超家族受体多肽源自actriib受体。例如,actriib多肽可包含与本文公开的actriib序列(例如,seq id no:1,2,3,4,5,6,104,106,403,和404)具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列,基本上由其组成,或由其组成。任选地,actriib多肽可包含与以下多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列:a)以seq id no:1的氨基酸20
‑
29(例如,氨基酸残基20,21,22,23,24,25,26,27,28,或29)的任一个开始,和b)以seq id no:1的氨基酸109
‑
134(例如,氨基酸残基109,110,111,112,113,114,115,116,117,118,119,120,121,122,123,124,125,126,127,128,129,130,131,132,133,或134的任一个结束;基本上由其组成,或由其组成。任选地,本公开内容的actriib多肽可以是融合蛋白,其进一步包含对actriib异源的一个或多个部分(结构域)。例如,actriib多肽可融合至包含多聚化结构
域的异源多肽,任选地含位于actriib多肽和异源多肽(例如,seq id no:104,106,403,和404)之间的接头结构域。在一些实施方案中,本文所述的多聚化结构域包含相互作用对的一个组分。包含actriib多肽的异聚复合物不包含另一i型或ii型tgf
‑
β超家族受体多肽,但可包含不是i型或ii型tgf
‑
β超家族受体多肽的另外的多肽。
13.在一些实施方案中,本公开内容提供了包含i型或ii型tgf
‑
β超家族受体多肽的异聚多肽复合物,其中tgf
‑
β超家族受体多肽源自tgfbrii受体。例如,tgfbrii多肽可包含与本文公开的tgfbrii序列(例如,seq id no:42,43,67,68,113,115,409,和410)具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列,基本上由其组成,或由其组成。任选地,tgfbrii多肽可包含与以下多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列:a)以seq id no:42的氨基酸23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50或51的任一个开始,和b)以seq id no:42的氨基酸143,144,145,146,147,148,149,150,151,152,153,154,155,156,157,158,159,160,161,162,163,164,165或166的任一个结束;基本上由其组成,或由其组成。任选地,tgfbrii多肽可包含与以下多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列:a)以seq id no:67的氨基酸23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43或44的任一个开始,和b)以seq id no:67的氨基酸163,164,165,166,167,168,169,170,171,172,173,174,175,176,177,178,179,180,181,182,183,184,185,186,187,188,189,190或191的任一个结束;基本上由其组成,或由其组成。任选地,本公开内容的tgfbrii多肽可以是融合蛋白,其进一步包含对tgfbrii异源的一个或多个部分(结构域)。例如,tgfbrii多肽可融合至包含多聚化结构域的异源多肽,任选地含位于tgfbrii多肽和异源多肽(例如,seq id no:113,115,409,和410)之间的接头结构域。在一些实施方案中,本文所述的多聚化结构域包含相互作用对的一个组分。包含tgfbrii多肽的异聚复合物不包含另一i型或ii型tgf
‑
β超家族受体多肽,但可包含不是i型或ii型tgf
‑
β超家族受体多肽的另外的多肽。
14.在一些实施方案中,本公开内容提供了包含i型或ii型tgf
‑
β超家族受体多肽的异聚多肽复合物,其中tgf
‑
β超家族受体多肽源自bmprii受体。例如,bmprii多肽可包含与本文公开的bmprii序列(例如,seq id no:46,47,71,72,107,109,405,和406)具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列,基本上由其组成,或由其组成。任选地,bmprii多肽可包含与以下多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列:a)以seq id no:46或71的氨基酸27
‑
34(例如,氨基酸残基27,28,29,30,31,32,33,和34)的任一个开始,和b)以seq id no:46或71的氨基酸123
‑
150(例如,氨基酸残基123,124,125,126,127,128,129,130,131,132,133,134,135,136,137,138,139,140,141,142,143,144,145,146,147,148,149,和150)的任一个结束;基本上由其组成,或由其组成。任选地,本公开内容的bmprii多肽可以是融合蛋白,其进一步包含对bmprii异源的一个或多个部分(结构域)。例如,bmprii多肽可融合至包含多聚化结构域的异源多肽,任选地含位于bmprii多肽和异源多肽(例如,seq id nos:107,109,405,和406)之间的接头结构域。包含bmprii多肽的异聚复合物不包含另一i型或ii型tgf
‑
β超家族受体多肽,但可包含不是i型或ii型tgf
‑
β超家族受体多肽的另外的多肽。
15.在一些实施方案中,本公开内容提供了包含i型或ii型tgf
‑
β超家族受体多肽的异
聚多肽复合物,其中tgf
‑
β超家族受体多肽源自misrii受体。例如,misrii多肽可包含与本文公开的misrii序列(例如,seq id nos:50,51,75,76,79,80,110,112,407,和408)具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列,基本上由其组成,或由其组成。任选地,misrii多肽可包含与以下多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列:a)以seq id no:50,75,或79的氨基酸17
‑
24(例如,氨基酸残基17,18,19,20,21,22,23,和24)的任一个开始,和b)以seq id no:50,75,或79的氨基酸116
‑
149(例如,氨基酸残基116,117,118,119,120,121,122123,124,125,126,127,128,129,130,131,132,133,134,135,136,137,138,139,140,141,142,143,144,145,146,147,148,和149)的任一个结束;基本上由其组成,或由其组成。任选地,本公开内容的misrii多肽可以是融合蛋白,其进一步包含对misrii异源的一个或多个部分(结构域)。例如,misrii多肽可融合至包含多聚化结构域的异源多肽,任选地含位于misrii多肽和异源多肽(例如,seq id nos:110,112,407,和408)之间的接头结构域。在一些实施方案中,本文所述的多聚化结构域包含相互作用对的一个组分。包含misrii多肽的异聚复合物不包含另一i型或ii型tgf
‑
β超家族受体多肽,但可包含不是i型或ii型tgf
‑
β超家族受体多肽的另外的多肽。
16.在一些实施方案中,本公开内容提供了包含i型或ii型tgf
‑
β超家族受体多肽的异聚多肽复合物,其中tgf
‑
β超家族受体多肽源自alk1受体。例如,alk1多肽可包含与本文公开的alk1序列(例如,seq id nos:14,15,116,118,411,和412)具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列,基本上由其组成,或由其组成。任选地,alk1多肽可包含与以下多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列:a)以seq id no:14的氨基酸22
‑
34(例如,氨基酸残基22,23,24,25,26,27,28,29,30,31,32,33,和34)的任一个开始,和b)以seq id no:14的氨基酸95
‑
118(例如,氨基酸残基95,96,97,98,99,100,101,102,103,104,105,106,107,108,109,110,111,112,113,114,115,116,117,和118)的任一个结束;基本上由其组成,或由其组成。任选地,本公开内容的alk1多肽可以是融合蛋白,其进一步包含对alk1异源的一个或多个部分(结构域)。例如,alk1多肽可融合至包含多聚化结构域的异源多肽,任选地含位于alk1多肽和异源多肽(例如,seq id nos:116,118,411,和412)之间的接头结构域。包含alk1多肽的异聚复合物不包含另一i型或ii型tgf
‑
β超家族受体多肽,但可包含不是i型或ii型tgf
‑
β超家族受体多肽的另外的多肽。
17.在一些实施方案中,本公开内容提供了包含i型或ii型tgf
‑
β超家族受体多肽的异聚多肽复合物,其中tgf
‑
β超家族受体多肽源自alk2受体。例如,alk2多肽可包含与本文公开的alk2序列(例如,seq id nos:18,19,119,121,413,和414)具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列,基本上由其组成,或由其组成。任选地,alk2多肽可包含与以下多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列:a)以seq id no:18的氨基酸21
‑
35(例如,氨基酸残基21,22,23,24,25,26,27,28,29,30,31,32,33,34,和35)的任一个开始,和b)以seq id no:18的氨基酸99
‑
123(例如,氨基酸残基99,100,101,102,103,104,105,106,107,108,109,110,111,112,113,114,115,116,117,118,119,120,121,122,和123)的任一个结束,基本上由其组成,或由其组成。任选地,本公开内容的alk2多肽可以是融合蛋白,其进一步包含对
alk2异源的一个或多个部分(结构域)。例如,alk2多肽可融合至包含多聚化结构域的异源多肽,任选地含位于alk2多肽和异源多肽(例如,seq id nos:119,121,413,和414)之间的接头结构域。包含alk2多肽的异聚复合物不包含另一i型或ii型tgf
‑
β超家族受体多肽,但可包含不是i型或ii型tgf
‑
β超家族受体多肽的另外的多肽。
18.在一些实施方案中,本公开内容提供了包含i型或ii型tgf
‑
β超家族受体多肽的异聚多肽复合物,其中tgf
‑
β超家族受体多肽源自alk3受体。例如,alk3多肽可包含与本文公开的alk3序列(例如,seq id nos:22,23,122,124,415,和416)具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列,基本上由其组成,或由其组成。任选地,alk3多肽可包含与以下多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列:a)以seq id no:22的氨基酸24
‑
61(例如,氨基酸残基24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,和61)的任一个开始,和b)以seq id no:22的氨基酸130
‑
152(例如,氨基酸残基130,131,132,133,134,135,136,137,138,139,140,141,142,143,144,145,146,147,148,149,150,151,和152)的任一个结束;基本上由其组成,或由其组成。任选地,本公开内容的alk3多肽可以是融合蛋白,其进一步包含对alk3异源的一个或多个部分(结构域)。例如,alk3多肽可融合至包含多聚化结构域的异源多肽,任选地含位于alk3多肽和异源多肽(例如,seq id nos:122,124,415,和416)之间的接头结构域。包含alk3多肽的异聚复合物不包含另一i型或ii型tgf
‑
β超家族受体多肽,但可包含不是i型或ii型tgf
‑
β超家族受体多肽的另外的多肽。
19.在一些实施方案中,本公开内容提供了包含i型或ii型tgf
‑
β超家族受体多肽的异聚多肽复合物,其中tgf
‑
β超家族受体多肽源自alk4受体。例如,alk4多肽可包含与本文公开的alk4序列(例如,seq id nos:26,27,83,84,125,127,417,和418)具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列,基本上由其组成,或由其组成。任选地,alk4多肽可包含与以下多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列:a)以seq id no:26或83的氨基酸23
‑
34(例如,氨基酸残基23,24,25,26,27,28,29,30,31,32,33,34)的任一个开始,和b)以seq id no:26或83的氨基酸101
‑
126(例如,氨基酸残基101,102,103,104,105,106,107,108,109,110,111,112,113,114,115,116,117,118,119,120,121,122,123,124,125,和126)的任一个结束;基本上由其组成,或由其组成。任选地,本公开内容的alk4多肽可以是融合蛋白,其进一步包含对alk4异源的一个或多个部分(结构域)。例如,alk4多肽可融合至包含多聚化结构域的异源多肽,任选地含位于alk4多肽和异源多肽(例如,seq id nos:125,127,417,和418)之间的接头结构域。包含alk4多肽的异聚复合物不包含另一i型或ii型tgf
‑
β超家族受体多肽,但可包含不是i型或ii型tgf
‑
β超家族受体多肽的另外的多肽。
20.在一些实施方案中,本公开内容提供了包含i型或ii型tgf
‑
β超家族受体多肽的异聚多肽复合物,其中tgf
‑
β超家族受体多肽源自alk5受体。例如,alk5多肽可包含与本文公开的alk5序列(例如,seq id nos:30,31,87,88,128,130,419,和420)具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列,基本上由其组成,或由其组成。任选地,alk5多肽可包含与以下多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列:a)以seq id no:30或87的氨基酸25
‑
36(例如,氨
基酸残基25,26,27,28,29,30,31,32,33,34,35,和36)的任一个开始,和b)以seq id no:30或87的氨基酸106
‑
126(例如,氨基酸残基106,107,108,109,110,111,112,113,114,115,116,117,118,119,120,121,122,123,124,125,和126)的任一个结束;基本上由其组成,或由其组成。任选地,本公开内容的alk5多肽可以是融合蛋白,其进一步包含对alk5异源的一个或多个部分(结构域)。例如,alk5多肽可融合至包含多聚化结构域的异源多肽,任选地含位于alk5多肽和异源多肽(例如,seq id nos:128,130,419,和420)之间的接头结构域。包含alk5多肽的异聚复合物不包含另一i型或ii型tgf
‑
β超家族受体多肽,但可包含不是i型或ii型tgf
‑
β超家族受体多肽的另外的多肽。
21.在一些实施方案中,本公开内容提供了包含i型或ii型tgf
‑
β超家族受体多肽的异聚多肽复合物,其中tgf
‑
β超家族受体多肽源自alk6受体。例如,alk6多肽可包含与本文公开的alk6序列(例如,seq id nos:34,35,91,92,131,133,421,和422)具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列,基本上由其组成,或由其组成。任选地,alk6多肽可包含与以下多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列:a)以seq id no:34的氨基酸14
‑
32(例如,氨基酸残基14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,和32)的任一个开始,和b)以seq id no:34的氨基酸102
‑
126(例如,氨基酸残基102,103,104,105,106,107,108,109,110,111,112,113,114,115,116,117,118,119,120,121,122,123,124,125,和126)的任一个结束;基本上由其组成,或由其组成。任选地,alk6多肽可包含与以下多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列:a)以seq id no:91的氨基酸26
‑
62(例如,氨基酸残基26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,52,53,54,55,56,57,58,59,60,61,和62)的任一个开始,和b)以seq id no:91的氨基酸132
‑
156(例如,氨基酸残基132,133,134,135,136,137,138,139,140,141,142,143,144,145,146,147,148,149,150,151,152,153,154,155,和156)的任一个结束;基本上由其组成,或由其组成。任选地,本公开内容的alk6多肽可以是融合蛋白,其进一步包含对alk6异源的一个或多个部分(结构域)。例如,alk6多肽可融合至包含多聚化结构域的异源多肽,任选地含位于alk6多肽和异源多肽(例如,seq id nos:131,133,421,和422)之间的接头结构域。包含alk6多肽的异聚复合物不包含另一i型或ii型tgf
‑
β超家族受体多肽,但可包含不是i型或ii型tgf
‑
β超家族受体多肽的另外的多肽。
22.在一些实施方案中,本公开内容提供了包含i型或ii型tgf
‑
β超家族受体多肽的异聚多肽复合物,其中tgf
‑
β超家族受体多肽源自alk7受体。例如,alk7多肽可包含与本文公开的alk7序列(例如,seq id nos:38,39,134,136,301,302,305,306,309,310,313,423,和424)具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列,基本上由其组成,或由其组成。任选地,alk7多肽可包含与以下多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列:以seq id no:38的氨基酸21
‑
28(例如,氨基酸21,22,23,24,25,26,27,或28)的任一个开始和以seq id no:38的氨基酸92
‑
113(例如,氨基酸92,93,94,95,96,97,98,99,100,101,102,103,104,105,106,107,108,109,110,111,112,或113of seq id no:38)的任一个结束;基本上由其组成,或由其组成。任选地,本公开内容的alk7多肽可以是融合蛋白,其进一步包含对alk7异源的一个或多个部分(结构域)。例如,alk7多肽可融合至包含多聚化结构域的异源多肽,任选地含位于
alk7多肽和异源多肽(例如,seq id nos:134,136,423,和424)之间的接头结构域。包含alk7多肽的异聚复合物不包含另一i型或ii型tgf
‑
β超家族受体多肽,但可包含不是i型或ii型tgf
‑
β超家族受体多肽的另外的多肽。
23.在一些实施方案中,本文公开的tgf
‑
β超家族i型和/或ii型受体多肽包含一个或多个修饰的氨基酸残基,其选自:糖基化氨基酸、peg化氨基酸、法呢基化氨基酸、乙酰基化氨基酸、生物素化氨基酸、与脂质部分缀合的氨基酸和与有机衍生剂缀合的氨基酸。在一些实施方案中,本文所述的tgf
‑
β超家族i型和/或ii型多肽被糖基化,和具有可获自在哺乳动物细胞,包括例如cho细胞中多肽表达的糖基化模式。
24.在某些方面,本公开内容提供了编码任何本文所述的tgf
‑
β超家族i型和/或ii型多肽(包括包含相互作用对的成员的任何融合蛋白)的核酸。本文公开的核酸可以与用于表达的启动子可操作连接,和本公开内容进一步提供了用这样的重组多核苷酸转化的细胞。优选地,细胞是哺乳动物细胞,例如cos细胞或cho细胞。
25.在某些方面,本公开内容提供了用于制备任何本文所述的tgf
‑
β超家族i型和/或ii型多肽以及包含这样的多肽的蛋白复合物的方法。这样的方法可包括在合适的细胞(例如,cho细胞或cos细胞)中表达任何本文公开的核酸。这样的方法可包括:a)在适合于表达本文所述的tgf
‑
β超家族i型或ii型多肽的条件下培养细胞,其中所述细胞用表达i型或ii型多肽的构建体转化;和b)回收如此表达的i型或ii型多肽。本文所述的tgf
‑
β超家族i型和/或ii型多肽以及所述tgf
‑
β超家族i型和/或ii型多肽的蛋白复合物,可使用用于从细胞培养物获得蛋白的任何众所周知的技术,作为粗制、部分纯化或高度纯化的级分回收。
26.任何本文所述的蛋白复合物可掺入药物制剂。任选地,关于其它多肽组分,这样的药物制剂是至少80%,85%,90%,95%,97%,98%或99%纯的。任选地,本文公开的药物制剂可包含一种或多种另外的活性剂。
27.本公开内容进一步提供了使用本文所述的蛋白复合物和药物制剂治疗或预防各种tgf
‑
β相关病况的方法,包括但不限于与例如,癌症、肌肉、骨、脂肪、红细胞、代谢、纤维化和受tgf
‑
β超家族的一种或多种配体影响的其它组织的相关的疾病和病症。
附图说明
28.图1显示包含i型受体多肽或ii型受体多肽的单臂异聚蛋白复合物的示意性实例。这样的复合物可通过每个多肽链内包含的多聚化结构域共价或非共价装配。两个装配的多聚化结构域构成相互作用对,其可以是引导的或非引导的。
29.图2显示包含i型受体多肽(显示为“i”)(例如,与人或其它物种的alk1,alk2,alk3,alk4,alk5,alk6或alk7蛋白的细胞外结构域具有至少80%,85%,90%,95%,97%,98%,99%或100%同一性的多肽)或ii型受体多肽(显示为“ii”)(例如,与人或其它物种的actriia,actriib,misrii,bmprii,或tgfbrii蛋白的细胞外结构域具有至少80%,85%,90%,95%,97%,98%,99%或100%同一性的多肽)的单臂异聚蛋白复合物的示意性实例。在该说明性的实施方案中,i型或ii型受体多肽是包含与相互作用对的第二成员(“c”)缔合的相互作用对的第一成员(“b”)的融合多肽的一部分。在融合多肽中,接头可位于i型或ii型受体多肽和相互作用对的相应成员之间。相互作用对的第一和第二成员(b,c)可以是引导的(不对称的)对,意思是该对的成员优先彼此缔合,而非自缔合;或相互作用对可以是非
引导的,意思是该对的成员可彼此缔合或自缔合,没有实质的偏好,和可具有相同的或不同的氨基酸序列。传统的fc融合蛋白和抗体是非引导的相互作用对的实例,而各种工程改造的fc结构域已被设计为引导的(不对称的)相互作用对。
30.图3显示人actriia(seq id no:500)和人actriib(seq id no:2)的细胞外结构域的比对,其中根据多个actriib和actriia晶体结构的复合分析,本文推论直接接触配体的残基用框盒表示。
31.图4显示不含其细胞内结构域的各种脊椎动物actriib前体蛋白(分别为seq id nos:501,502,503,504,505,和506)、不含其细胞内结构域的人actriia前体蛋白(seq id no:507)和共有序列actrii前体蛋白(seq id no:508)的多个序列比对。
32.图5显示使用clustal 2.1,人igg同种型的fc结构域的多个序列比对。铰链区用虚下划线表示。双下划线表示在igg1 fc中经工程改造以促进不对称的链配对的位置和关于其它同种型igg2、igg3和igg4的相应位置的实例。
33.图6显示与actriib
‑
fc同二聚体相比,单臂actriib
‑
fc:fc异二聚体蛋白复合物的配体结合数据。对于各蛋白复合物,配体通过离解速率(k
off
或k
d
),一个与配体信号传导抑制充分相关的动力学常数排序,和以结合亲和力的递减顺序列出(最紧密结合的配体在顶部列出)。在左侧,黄色、红色、绿色和蓝色的线表示离解速率常数的量级。特别感兴趣的配体以粗体突出显示,而其它以灰色表示,和实黑线表示与同二聚体相比,与异二聚体的结合增强或未变化的配体,而虚线表示与同二聚体相比显著降低的结合。如所示的,actriib
‑
fc同二聚体以类似的高亲和力与5个高亲和力配体的每一个结合,而单臂actriib
‑
fc更容易区别这些配体。因此,单臂actriib
‑
fc强烈结合活化素b和gdf11,和以中等强度结合gdf8和活化素a。与actriib
‑
fc同二聚体进一步形成对比,单臂actriib
‑
fc仅显示对bmp10的弱结合和不显示对bmp9的结合。这些数据表示单臂actriib
‑
fc具有比同二聚体actriib
‑
fc更大的配体选择性。
34.图7显示与alk3
‑
fc同二聚体相比,单臂alk3
‑
fc:fc异二聚体蛋白复合物的配体结合数据。格式与图6相同。如所示的,单臂alk3
‑
fc异二聚体保持对bmp4特别紧密的结合,如alk3
‑
fc同二聚体所观察到的,而它显示对bmp2降低强度的结合,因此比alk3
‑
fc同二聚体更好地区分bmp4和bmp2。与以非常类似的强度(全部中等)结合这三种配体的alk3
‑
fc同二聚体相比,单臂alk3
‑
fc还更好地区分bmp5(中等结合)、gdf7(弱结合)和gdf6(无结合)。这些数据表示单臂alk3
‑
fc具有比同二聚体alk3
‑
fc更大的配体选择性。
35.图8显示与actriia
‑
fc同二聚体相比,单臂actriia
‑
fc:fc异二聚体蛋白复合物的配体结合数据。格式与图6相同。如所示的,与对活化素a和gdf11的强结合相比,actriia
‑
fc同二聚体显示对活化素b的优先结合,而单臂actriia
‑
fc具有对活化素a超过活化素b的逆转的偏好,以及对活化素a超过gdf11(弱结合剂)的极大提高的选择性。这些数据表示单臂actriia
‑
fc具有比同二聚体actriia
‑
fc显著不同的配体选择性。
36.发明详述
37.1.概述
38.部分地,本公开内容涉及包含tgfβ超家族i型受体多肽的细胞外结构域或tgfβ超家族ii型受体多肽的细胞外结构域的单臂异多聚体复合物,制备这样的单臂异多聚体复合物的方法和其用途。本文所述的,单臂异多聚体复合物可包含选自alk1,alk2,alk3,alk4,
alk5,alk6和alk7的tgfβ超家族i型受体多肽的细胞外结构域,或选自actriia,actriib,tgfbrii,bmprii和misrii的tgfβ超家族ii型受体多肽的细胞外结构域。在某些优选的实施方案中,相对于相应的同多聚体复合物,本公开内容的异多聚体复合物具有改变的结合tgfβ超家族配体的特征(例如,actriib
‑
fc:fc异二聚体对比actriib
‑
fc:actriib
‑
fc同二聚体复合物)。
39.tgf
‑
β超家族包含超过三十种分泌的因子,包括tgf
‑
β、活化素、nodal、骨形态发生蛋白(bmp)、生长和分化因子(gdf)和抗苗勒管激素(amh)。参见例如,weiss等(2013)developmental biology,2(1):47
‑
63。存在于脊椎动物和无脊椎动物二者中的该超家族的成员,在各种组织中广泛表达和在整个动物寿命的最早发育阶段期间发挥功能。事实上,tgf
‑
β超家族蛋白是干细胞自我更新、原肠胚形成、分化、器官形态发生和成年组织体内稳态的重要介质。与这种广泛的活性一致,异常的tgf
‑
β超家族信号传导与广泛的人病理学有关,包括例如,自身免疫疾病、心血管疾病、纤维化疾病和癌症。
40.tgf
‑
β超家族的配体共有相同的二聚体结构,其中一个单体的中心3
‑
1/2转角螺旋紧靠另一单体的β
‑
链形成的凹面挤入。大部分tgf
‑
β家族成员通过分子间二硫键进一步稳定。该二硫键穿过由两个其它二硫键形成的环,产生所谓的“半胱氨酸结”基序。参见例如,lin等,(2006)reproduction 132:179
‑
190和hinck(2012)febs letters 586:1860
‑
1870。
41.tgf
‑
β超家族信号传导由i型和ii型丝氨酸/苏氨酸激酶受体的异聚复合物介导,在配体刺激后其磷酸化和活化下游smad蛋白(例如,smad蛋白1,2,3,5,和8)。参见例如,massagu
é
(2000)nat.rev.mol.cell biol.1:169
‑
178。这些i型和ii型受体是跨膜蛋白,由具有富含半胱氨酸的区域的配体
‑
结合细胞外结构域、跨膜结构域和具有预期的丝氨酸/苏氨酸激酶特异性的胞质结构域构成。一般而言,i型受体介导细胞内信号传导,而ii型受体是结合tgf
‑
β超家族配体所需要的。在配体结合后i型和ii受体形成稳定的复合物,导致i型受体被ii型受体磷酸化。
42.基于它们结合的i型受体和它们活化的smad蛋白,tgf
‑
β家族可分为两个系统发生分支。一个是较近进化的分支,其包括例如,tgf
‑
β、活化素、gdf8、gdf9、gdf11、bmp3和nodal。另一分支包括较远相关的超家族蛋白,和包括例如,bmp2、bmp4、bmp5、bmp6、bmp7、bmp8a、bmp8b、bmp9、bmp10、gdf1、gdf5、gdf6和gdf7。参见例如,hinck(2012)febs letters 586:1860
‑
1870。
43.tgf
‑
β同种型是确定的tgf
‑
β超家族成员,其中在哺乳动物中存在3个已知同种型,称为tgf
‑
β1、tgf
‑
β2和tgf
‑
β3。成熟的生物活性tgf
‑
β配体作为同二聚体起作用,和主要通过i型受体alk5发出信号,但还已发现在内皮细胞中通过alk1发出信号。参见例如,goumans等(2003)mol cell 12(4):817
‑
828。tgf
‑
β1是最丰富和遍在表达的同种型。已知tgf
‑
β1在伤口愈合中具有重要的作用,和表达组成型活性的tgf
‑
β1转基因的小鼠发生纤维化。参见例如,clouthier等,(1997)j clin.invest.100(11):2697
‑
2713。tgf
‑
β1还参与t细胞活化和t调节细胞的维持。参见例如,li等,(2006)immunity 25(3):455
‑
471。tgf
‑
β2表达首先描述于人成胶质细胞瘤细胞中,和在胚胎神经系统的神经元和星形胶质细胞中发生。还已知tgf
‑
β2抑制t淋巴细胞的白细胞介素
‑2‑
依赖性生长。tgf
‑
β3最初从人横纹肌肉瘤细胞系分离,后来在肺腺癌和肾癌细胞系中发现。已知tgf
‑
β3对于腭和肺形态发生是重要的。参见例如,kubiczkova等,(2012)journal of translational medicine 10:183。
44.活化素是tgf
‑
β超家族的成员,其最初作为促卵泡成熟激素分泌的调节物发现,但随后表征了各种生殖和非
‑
生殖作用。主要的活化素形式a、b和ab是两个紧密相关的β亚基的同/异二聚体(分别为β
a
β
a
、β
b
β
b
和β
a
β
b
)。人基因组还编码活化素c和活化素e,其主要在肝脏中表达,和包含β
c
或β
e
的异二聚体形式也是已知的。在tgf
‑
β超家族中,活化素是独特和多功能的因子,其可在卵巢和胎盘细胞中刺激激素产生,支持神经元细胞存活,根据细胞类型正面或负面影响细胞周期进展,和至少在两栖动物胚胎中诱导中胚层分化。参见例如,depaolo等(1991)proc soc ep biol med.198:500
‑
512;dyson等(1997)curr biol.7:81
‑
84;和woodruff(1998)biochem pharmacol.55:953
‑
963。在数种组织中,活化素信号传导被其相关的异二聚体抑制素拮抗。例如,在从脑垂体的促卵泡成熟激素(fsh)分泌的调节中,活化素促进fsh合成和分泌,而抑制素减少fsh合成和分泌。可调节活化素生物活性和/或结合活化素的其它蛋白包括卵泡抑素(fs)、卵泡抑素
‑
相关蛋白(fsrp,亦称为flrg或fstl3)和α2‑
巨球蛋白。
45.本文所述的结合“活化素a”的试剂是特异性结合β
a
亚基的试剂,无论是在分离的β
a
亚基的情况下还是作为二聚体复合物(例如,β
a
β
a
同二聚体或β
a
β
b
异二聚体)。在异二聚体复合物(例如,β
a
β
b
异二聚体)的情况下,结合“活化素a”的试剂对β
a
亚基内存在的表位是特异性的,但不结合复合物的非
‑
β
a
亚基(例如,复合物的β
b
亚基)内存在的表位。类似地,本文公开的拮抗(抑制)“活化素a”的试剂是抑制由β
a
亚基介导的一种或多种活性的试剂,无论是在分离的β
a
亚基的情况下还是作为二聚体复合物(例如,β
a
β
a
同二聚体或β
a
β
b
异二聚体)。在β
a
β
b
异二聚体的情况下,抑制“活化素a”的试剂是特异性抑制β
a
亚基的一种或多种活性,但不抑制复合物的非
‑
β
a
亚基(例如,复合物的β
b
亚基)的活性的试剂。该原理也适用于结合和/或抑制“活化素b”、“活化素c”和“活化素e”的试剂。本文公开的拮抗“活化素ab”的试剂是抑制由β
a
亚基介导的一种或多种活性和由β
b
亚基介导的一种或多种活性的试剂。
46.bmp和gdf一起形成半胱氨酸
‑
结细胞因子的家族,其共有tgf
‑
β超家族的特征性折叠。参见例如,rider等(2010)biochem j.,429(1):1
‑
12。该家族包括例如,bmp2,bmp4,bmp6,bmp7,bmp2a,bmp3,bmp3b(亦称为gdf10),bmp4,bmp5,bmp6,bmp7,bmp8,bmp8a,bmp8b,bmp9(亦称为gdf2),bmp10,bmp11(亦称为gdf11),bmp12(亦称为gdf7),bmp13(亦称为gdf6),bmp14(亦称为gdf5),bmp15,gdf1,gdf3(亦称为vgr2),gdf8(亦称为肌抑素),gdf9,gdf15和decapentaplegic。除了诱导骨形成的能力(这给予bmp其名称)之外,bmp/gdf还显示在各种组织的发育中的形态发生活性。bmp/gdf同和异二聚体与i型和ii型受体二聚体的组合相互作用,以产生多种可能的信号传导复合物,导致两个竞争性的smad转录因子组之一的活化。bmp/gdf具有高度特异性和局部的功能。它们以许多方式受到调节,包括bmp/gdf表达的发育限制,和通过数种蛋白的分泌,所述蛋白以高亲和力结合某些tgf
‑
β超家族配体,从而抑制配体活性。难以理解的是,这些内源拮抗剂中的一些类似于tgf
‑
β超家族配体本身。
47.生长和分化因子
‑
8(gdf8)亦称为肌抑素。gdf8是骨骼肌肉质量的负调节剂,和在发育和成年骨骼肌肉中高度表达。在转基因小鼠中gdf8无效突变的特征为骨骼肌肉的显著肥大和增生。参见例如,mcpherron等,nature(1997)387:83
‑
90。在牛中以及出人意料地在人中,在天然存在的gdf8突变中骨骼肌肉质量的类似增加是明显的。参见例如,ashmore等(1974)growth,38:501
‑
507;swatland和kieffer,j.anim.sci.(1994)38:752
‑
757;
mcpherron和lee,proc.natl.acad.sci.usa(1997)94:12457
‑
12461;kambadur等,genome res.(1997)7:910
‑
915;和schuelke等(2004)n engl j med,350:2682
‑
8。研究已经表明,在人中与hiv
‑
感染有关的肌肉消瘦伴随有gdf8蛋白表达的增加。参见例如,gonzalez
‑
cadavid等,pnas(1998)95:14938
‑
43。此外,gdf8可调节肌肉
‑
特异性的酶(例如,肌酸激酶)的产生和调节成肌细胞细胞增殖。参见例如,国际专利申请公布号wo 00/43781)。gdf8前肽可非共价结合成熟的gdf8结构域二聚体,灭活其生物学活性。参见例如,miyazono等(1988)j.biol.chem.,263:6407
‑
6415;wakefield等(1988)j.biol.chem.,263;7646
‑
7654;和brown等(1990)growthfactors,3:35
‑
43。结合gdf8或结构相关蛋白和抑制它们的生物学活性的其它蛋白包括卵泡抑素,和可能地,卵泡抑素
‑
相关蛋白。参见例如,gamer等(1999)dev.biol.,208:222
‑
232。
48.gdf11,亦称为bmp11,是一种在小鼠发育期间在尾芽、肢芽、上颌和下颌弓和背根神经节中表达的分泌蛋白。参见例如,mcpherron等(1999)nat.genet.,22:260
‑
264;和nakashima等(1999)mech.dev.,80:185
‑
189。gdf11在中胚层和神经组织二者的图式发育中起独特的作用。参见例如,gamer等(1999)dev biol.,208:222
‑
32。gdf11已表明是在鸡翼发育中软骨发生和肌生成的负调节剂。参见例如,gamer等(2001)dev biol.,229:407
‑
20。gdf11在肌肉中的表达也表明其以类似于gdf8的方式在调节肌肉生长中的作用。此外,gdf11在脑中的表达表明gdf11还可具有与神经系统的功能有关的活性。有趣的是,发现gdf11在嗅上皮中抑制神经发生。参见例如,wu等(2003)neuron.,37:197
‑
207。因此,gdf11可具有在治疗疾病例如肌肉疾病和神经变性疾病(例如,肌萎缩侧索硬化)中的体外和体内应用。
49.bmp7,亦称为成骨蛋白
‑
1(op
‑
1),众所周知诱导软骨和骨形成。此外,bmp7调节各种生理学过程。例如,bmp7可以是负责上皮骨发生的现象的骨诱导性因子。还发现,bmp7在钙调节和骨体内稳态中起作用。同活化素一样,bmp7结合ii型受体,actriia和actriib。然而,bmp7和活化素募集不同的i型受体至异聚受体复合物。观察到的主要bmp7 i型受体是alk2,而活化素排他地结合alk4(actriib)。bmp7和活化素引起不同的生物学反应和活化不同的smad途径。参见例如,macias
‑
silva等(1998)j biol chem.273:25628
‑
36。
50.抗苗勒管激素(amh),亦称为苗勒管
‑
抑制物质(mis),是一种tgf
‑
β家族糖蛋白。一种amh
‑
相关ii型受体已被鉴定,称为amhrii或者misrii。amh在人雄性胚胎中诱导苗勒管退化。amh在生殖年龄的女性中表达,不随周期或妊娠而波动,但发现随卵母细胞数量和质量二者降低而逐渐降低,表明amh可用作卵巢生理学的标记物。参见例如,zec等,(2011)biochemiamedica 21(3):219
‑
30。
51.活化素受体
‑
样激酶
‑
1(alk1),备选称为acvrlk1的acvrl1基因的产物,是一种表达主要限于内皮细胞的i型受体。参见例如,omim entry 601284。alk1通过结合tgf
‑
β家族配体例如bmp9和bmp10而活化,和alk1信号传导在调节发育和病理血管形成二者中是重要的。在早期小鼠发育中alk1表达与脉管发生和血管发生的部位重叠,和alk1敲除小鼠在大约胚胎第11.5天因为严重血管异常而死亡(参见例如,cunha和pietras(2011)blood 117(26):6999
‑
7006)。alk1表达还已在其它细胞类型,例如肝星形细胞和软骨细胞中描述。另外,已发现alk1与活化素受体
‑
样激酶
‑
2(alk2)一起对于在间质干细胞中bmp9
‑
诱导的成骨信号传导是重要的。参见例如,cunha和pietras(2011)blood 117(26):6999
‑
7006。
52.alk2,备选称为actria或acvrlk2的acvr1基因的产物,是一种已表明结合活化素和bmp的i型受体。alk2对于胚胎发生是关键的,因为alk2敲除小鼠在原肠胚形成后不久死亡。参见例如,mishina等(1999)dev biol.213:314
‑
326和omim entry 102576。alk2的组成型活性突变与进行性骨化性纤维发育不良(fop)有关,其为一种罕见的遗传病症,导致纤维组织,包括肌肉、腱和韧带自发或当损伤时骨化。alk2的位置206的精氨酸至组氨酸的突变是在人中与fop有关的天然存在的突变。通过alk2而不结合配体,该突变诱导bmp
‑
特异性信号传导。参见例如,fukuda等,(2009)j biol chem.284(11):7149
‑
7156和kaplan等,(2011)annn.y.acad sci.1237:5
‑
10。
53.活化素受体
‑
样激酶
‑
3(alk3),备选称为acvrlk3的bmpr1a基因的产物,是一种介导bmp家族的多个配体的作用的i型受体。不像数种具有遍在组织表达的i型受体,alk3显示受限制的表达模式,与较专门的功能性一致。参见例如,ten dijke(1993)oncogene,8:2879
‑
2887和omim entry 601299。alk3被公认为是bmp家族的bmp2、bmp4、bmp7和其它成员的高亲和力受体。bmp2和bmp7是成骨细胞分化的有效的刺激物,目前在临床上用于在脊柱融合术和某些非连接骨折中诱导骨形成。alk3被认为是在成骨细胞中介导bmp2和bmp4信号传导的关键受体。参见例如,lavery等(2008)j.biol.chem.283:20948
‑
20958。纯合alk3敲除小鼠在胚胎发生早期(大约第9.5天)死亡,然而,在成骨细胞中带有alk3的条件破坏的成年小鼠最近已报道显示增加的骨质量,尽管新形成的骨显示结构破坏的迹象。参见例如,kamiya(2008)j.bone miner.res.,23:2007
‑
2017;和kamiya(2008)development 135:3801
‑
3811。这一发现与在临床应用中作为骨构建剂的bmp2和bmp7(alk3的配体)的功效形成惊人对比。
54.活化素受体
‑
样激酶
‑
4(alk4),备选称为acvrlk4的acvr1b基因的产物,是一种转导许多tgf
‑
β家族配体(包括活化素、nodal和gdf)的信号传导的i型受体。alk4突变与胰腺癌有关,和主要的负截短的alk4同种型的表达在人脑垂体肿瘤中高度表达。参见例如,tsuchida等,(2008)endocrine journal 55(1):11
‑
21和omim entry601300。
55.活化素受体
‑
样激酶
‑
5(alk5),tgfbr1基因的产物,在大多数细胞类型中广泛表达。数种tgf
‑
β超家族配体,包括tgf
‑
β、活化素和gdf
‑
8,通过alk5发信号和活化下游的smad2和smad 3。alk5缺陷的小鼠显示在卵黄囊和胎盘的血管发育中的严重缺陷,缺少循环红细胞和在妊娠中途死亡。已发现,这些胚胎具有正常的生血潜力,但提高内皮细胞的增殖和不适当的迁移。因此,alk5
‑
依赖性信号传导对于血管发生是重要的,但对于生血祖细胞的发育和功能性血细胞生成不是如此。参见例如,larsson等,(2001)the embo journal,20(7):1663
‑
1673和omim entry 190181。在内皮细胞中,alk5协作发挥作用,与alk1信号传导相反。alk5抑制细胞迁移和增殖,特别地与alk1的作用相反。参见例如,goumans等(2003)mol cell 12(4):817
‑
828。另外,认为alk5负调节肌肉生长。发现在肌肉中alk5敲减的肌营养不良小鼠模型减少纤维化和增加与肌肉生长有关的基因的表达。参见例如,kemaladewi等,(2014)mol thernucleic acids 3,e156。
56.活化素受体
‑
样激酶
‑
6(alk6)是bmpr1b基因的产物,在人和小鼠二者中其缺陷与软骨发育异常和四肢缺陷有关。参见例如,demirhan等,(2005)jmed genet.42:314
‑
317。alk6在整个发育的骨骼中广泛表达,和是小鼠的软骨发生所需要的。参见例如,yi等,(2000)development 127:621
‑
630和omim entry 603248。
57.活化素受体
‑
样激酶
‑
7(alk7)是acvr1c基因的产物。alk7缺失小鼠是能存活的,能繁殖的,和未显示骨骼或四肢畸形。通过alk7的gdf3信号传导显示在胰岛素敏感性和肥胖中起作用。这通过alk7缺失小鼠显示减少的脂肪累积和抵抗饮食
‑
诱导的肥胖的结果得到支持。参见例如,andersson等,(2008)pnas 105(20):7252
‑
7256。alk7
‑
介导nodal信号传导涉及在各种不同的癌症细胞系中具有肿瘤促进和肿瘤抑制作用二者。参见例如,de silva等,(2012)frontiers in endocrinology 3:59和omim entry 608981。
58.如本文所用的,术语“actrii”是指ii型活化素受体家族。该家族包括由acvr2a基因编码的活化素受体ii型a(actriia)和由acvr2b基因编码的活化素受体ii型b(actriib)二者。actrii受体是tgf
‑
β超家族ii型受体,其结合各种tgf
‑
β超家族配体,包括活化素、gdf8(肌抑素)、gdf11和bmp的亚组,特别是bmp6和bmp7。actrii受体涉及各种生物学病症,包括肌肉和神经肌肉病症(例如,肌营养不良、肌萎缩侧索硬化(als)和肌肉萎缩)、不需要的骨/软骨生长、脂肪组织病症(例如,肥胖)、代谢病症(例如,2型糖尿病)和神经变性病症。参见例如,tsuchida等,(2008)endocrine journal 55(1):11
‑
21,knopf等,u.s.8,252,900,和omim entries 102581和602730。
59.由tgfbr2基因编码的转化生长因子β受体ii(tgfbrii)是一种ii型受体,其已知结合tgf
‑
β配体和活化下游smad 2和smad 3效应物。参见例如,hinck(2012)febs letters 586:1860
‑
1870和omim entry 190182。通过tgfbrii的tgf
‑
β信号传导在t
‑
细胞增殖、t调节细胞的维持和前软骨干细胞的增殖中是关键的。参见例如,li等,(2006)immunity 25(3):455
‑
471和cheng等,int.j.mol.sci.2014,15,12665
‑
12676。
60.由bmpr2基因编码的骨形态发生蛋白受体ii(bmprii)是一种ii型受体,其已知结合bmp配体,包括bmp7和bmp4。与bmprii的有效的配体结合取决于合适的tgfbr i型受体的存在。参见例如,rosenzweig等,(1995)pnas 92:7632
‑
7636。bmprii的突变在人中与肺高血压有关。参见omim entry 600799。
61.苗勒管
‑
抑制物质受体ii(misrii),备选称为抗
‑
苗勒管激素ii型受体的amhr2基因的产物,是一种ii型tgf
‑
β超家族受体。misrii结合mis配体,但需要合适的i型受体,例如alk3或alk6的存在,用于信号转导。参见例如,hinck(2012)febs letters 586:1860
‑
1870和omim entry 600956。misrii参与在人中的性别分化,是人类雄性中苗勒管退化所需要的。amh在生殖年龄的女性中表达,不随周期或妊娠而波动,但发现随卵母细胞数量和质量二者降低而逐渐降低,表明amh可用作卵巢生理学的标记物。参见例如,zec等,(2011)biochemia medica 21(3):219
‑
30和omim entry 600956。
62.在某些方面,本公开内容涉及包含tgfβ超家族i型受体多肽(例如,alk1,alk2,alk3,alk4,alk5,alk6,和alk7)的细胞外结构域或tgfβ超家族ii型受体多肽(例如,actriia,actriib,tgfbrii,bmprii,和misrii)的细胞外结构域的单臂异多聚体复合物,优选地可溶性异多聚体复合物,拮抗由一种或多种tgfβ超家族配体(例如,活化素a,活化素b,活化素c,活化素e,活化素ab,活化素ac,活化素ae,活化素bc,活化素be,nodal,gdf8,gdf11,bmp6和/或bmp7)引发的细胞内信号传导转导(例如,smad 2/3和/或smad 1/5/8信号传导)的用途。本文所述的这样的拮抗剂单臂异多聚体复合物可用于治疗或预防各种tgf
‑
β相关病况,包括但不限于与例如,癌症、肌肉、骨、脂肪、红细胞、代谢、纤维化和受tgf
‑
β超家族的一种或多种配体影响的其它组织有关的疾病和病症。
63.特别地,本公开内容的数据证实了与它们相应的同多聚体复合物相比,包含tgfβ超家族i型受体多肽的细胞外结构域或tgfβ超家族ii型受体多肽的细胞外结构域的单臂异多聚体复合物具有不同的配体选择性特征。
64.在本公开内容的上下文中和在使用每个术语的特定语境中,本说明书中使用的术语通常具有其在本领域中的普通含义。下文或说明书他处论述了某些术语,以在描述本公开内容的组合物和方法和如何制备和使用它们方面,向实施者提供另外的指导。术语的任何使用的范围或含义将根据使用其的具体上下文而显而易见。
65.术语“异聚体”或“异多聚体”是至少包含第一多肽和第二多肽的复合物,其中在氨基酸序列方面第二多肽与第一多肽差别至少一个氨基酸残基。异聚体可包含由第一和第二多肽形成的“异二聚体”,或可形成更高级结构,其中存在除了第一和第二多肽之外的多肽。异多聚体的实例性结构包括异二聚体、异三聚体、异四聚体和其它寡聚体结构。异二聚体在本文中称为x:y或等同地x
‑
y,其中x表示第一多肽链和y表示第二多肽链。更高级异聚体和寡聚体结构在本文中以相应的方式命名。在某些实施方案中,异多聚体是重组的(例如,一种或多种多肽组分可以是重组蛋白)、分离的和/或纯化的。
[0066]“同源的”,以其所有的语法形式和拼写变化,是指两种蛋白之间的关系,所述蛋白具有“共同的进化来源”,包括来自相同的物种的生物体的超家族的蛋白,以及来自不同物种的生物体的同源蛋白。这样的蛋白(和它们的编码核酸)具有序列同源性,如通过它们的序列相似性所反映的,无论是在同一性百分比方面,还是通过特定残基或基序和保守位置的存在。然而,在通常使用中和在本技术中,术语“同源的”当被副词例如“高度地”修饰时,可以指序列相似性,和可能或可能不涉及共同的进化来源。
[0067]
术语“序列相似性”,以其所有的语法形式,是指核酸或氨基酸序列之间同一性或一致性的程度,所述序列可能或可能不享有共同的进化来源。
[0068]
相对于参比多肽(或核苷酸)序列的"百分比(%)序列同一性"定义为在比对序列和如果需要,引入空位以实现最大百分比序列同一性,和不考虑任何保守置换作为序列同一性的一部分后,在候选序列中与在参比多肽(核苷酸)序列中氨基酸残基(或核酸)相同的氨基酸残基(或核酸)的百分数。为确定百分比氨基酸序列同一性的目的的比对可以在本领域的技能范围内的各种方式实现,例如,使用公开可得的计算机软件,例如blast、blast
‑
2、align或megalign(dnastar)软件。本领域技术人员可确定合适的参数以比对序列,包括在所比较的序列的整个长度上实现最大比对所需的任何算法。为本文目的,然而,%氨基酸(核酸)序列同一性值使用序列比较计算机程序align
‑
2产生。align
‑
2序列比较计算机程序由genentech,inc.创造,和源代码已使用用户文档提交至u.s.copyright office,washington d.c.,20559,其中它注册为u.s.copyright registration no.txu510087。align
‑
2程序可公开获自genentech,inc.,south san francisco,calif.,或可从源代码编译。align
‑
2程序应经编译在unix操作系统上使用,包括digital unix v4.0d。所有的序列比较参数通过align
‑
2程序设定,和不改变。
[0069]
如本文所用的,“基本上不结合x”意指试剂对“x”具有大于约10
‑7、10
‑6、10
‑5、10
‑4或更大的k
d
(例如,通过用于检测k
d
的测定法无法检测的结合)。
[0070]
2.包含单臂tgfβ超家族受体多肽的异多聚体复合物
[0071]
在某些方面,本公开内容涉及包含一种或多种单臂tgf
‑
β超家族i型或ii型受体多
肽的异多聚体蛋白复合物。在某些实施方案中本文公开的多肽可形成包含与第二多肽共价或非共价缔合的第一多肽的蛋白复合物,其中第一多肽包含i型或ii型受体多肽的氨基酸序列和相互作用对的第一成员的氨基酸序列;和第二多肽包含相互作用对的第二成员的氨基酸序列,和其中第二多肽不包含i型或ii型受体多肽。相互作用对可以是任何两个多肽序列,其相互作用以形成复合物,特别是异二聚体复合物,尽管有效的实施方案也可使用形成同二聚体序列的相互作用对。如本文所述的,相互作用对的一个成员可融合至i型或ii型受体多肽,例如包含与seq id nos:1,2,3,4,5,6,9,10,11,14,15,18,19,22,23,26,27,30,31,34,35,38,39,42,43,46,47,50,51,67,68,71,72,75,76,79,80,83,84,87,88,91,92,301,302,305,306,309,310,和313的任一个的序列具有至少80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列的多肽。优选地,相对于i型或ii型受体多肽的单体形式,相互作用对经选择以赋予改进的血清半寿期,或作为另一部分、例如聚乙二醇部分与其连接的接头起作用,以提供改进的血清半寿期。
[0072]
如本文所示的,与它们相应的同二聚体形式相比,tgf
‑
β超家族i型或ii型受体的单体(单臂)形式可显示显著改变的配体
‑
结合选择性,但单体形式趋于具有短的血清停留时间(半寿期),这在治疗背景下是不理想的。改进血清半寿期的常见机制是作为含igg的恒定结构域部分(例如,fc部分)的同二聚体融合蛋白来表达多肽。然而,作为同二聚体蛋白表达的tgf
‑
β超家族受体多肽(例如,以fc融合构建体)可能不显示与单体形式相同的活性特征。如本文所示的,该问题可通过将单体形式融合至半寿期延长部分来解决,和令人惊讶地,这可通过作为不对称的异二聚体融合蛋白来表达这样的蛋白而容易地实现,其中相互作用对的一个成员融合至tgf
‑
β超家族受体多肽,和相互作用对的另一成员不融合至任何部分,或融合至异源部分,导致新的配体
‑
结合特征加上由相互作用对赋予的血清半寿期的改进。
[0073]
在某些方面,本公开内容涉及单臂异多聚体复合物,其包含至少一种tgf
‑
β超家族i型受体多肽(例如,alk1,alk2,alk3,alk4,alk5,alk6,和alk7以及seq id nos:14,15,18,19,22,23,26,27,30,31,34,35,38,39,83,84,87,88,91,92,301,302,305,306,309,310,313)或至少一种tgf
‑
β超家族ii型受体多肽(例如,actriia,actriib,tgfbrii,bmprii,和misrii以及seq id nos:1,2,3,4,5,6,9,10,11,42,43,46,47,50,51,67,68,71,72,75,76,79,和80),其在本文通常称为“本公开内容的单臂异多聚体复合物”或“tgf
‑
β超家族受体单臂异多聚体复合物”。优选地,本公开内容的单臂异多聚体复合物是可溶性的,例如,单臂异多聚体复合物包含至少一种tgfβ超家族i型受体多肽的可溶性部分或至少一种tgfβ超家族ii型受体多肽的可溶性部分。一般而言,tgfβ超家族i型和ii型受体的细胞外结构域对应于i型或ii型受体的可溶性部分。因此,在一些实施方案中,本公开内容的单臂异多聚体复合物包含tgfβ超家族i型受体多肽的细胞外结构域(例如,alk1,alk2,alk3,alk4,alk5,alk6,和/或alk7受体细胞外结构域的一种或多种)或tgfβ超家族ii型受体多肽的细胞外结构域(例如,actriia,actriib,tgfbrii,bmprii,和/或misrii受体细胞外结构域的一种或多种)。alk1,alk2,alk3,alk4,alk5,alk6,alk7,actriia,actriib,tgfbrii,bmprii,和misrii的实例性的细胞外结构域在本文公开,和这样的序列以及其片段、功能变体和修饰形式可根据本公开内容的发明来使用(例如,单臂异多聚体复合物组合物和其用途)。
[0074]
称为三指毒素折叠的限定结构基序对于i型和ii型受体的配体结合是重要的,和
通过10、12或14个位于每个单体受体的细胞外结构域内的不同位置的保守半胱氨酸残基形成。参见例如,greenwald等(1999)nat structbiol 6:18
‑
22;hinck(2012)febs lett 586:1860
‑
1870。本文所述的任何异聚复合物可包含tgf
‑
β超家族的i型或ii型受体的这样的结构域。tgfβ超家族受体的核心配体
‑
结合结构域,如通过这些保守半胱氨酸的最外方所划界的,对应于seq id no:1(actriib前体)的位置29
‑
109;seq id no:9(actriia前体)的位置30
‑
110;seq id no:14(alk1前体)的位置34
‑
95;seq id no:18(alk2前体)的位置35
‑
99;seq id no:22(alk3前体)的位置61
‑
130;seq id nos:26和83(alk4前体)的位置34
‑
101;seq id nos:30和87(alk 5前体)的位置36
‑
106;seq id no:34(alk6同种型b前体)的位置32
‑
102;seq id nos:38,305和309(alk7前体)的位置28
‑
92;seq id no:42(tgfbrii同种型b前体)的位置51
‑
143;seq id no:46和71(bmprii前体)的位置34
‑
123;seq id no:50,75,和79(misrii前体)的位置24
‑
116;seq id no:67(tgfbrii同种型a前体)的位置44
‑
168;和seq id no:91(alk6同种型a前体)的位置62
‑
132。侧连这些半胱氨酸划界的核心序列的结构上较低有序的氨基酸可在任一末端被截短1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36或37个残基,而不一定改变配体结合。n
‑
末端和/或c
‑
末端截短的实例性的细胞外结构域包括seq id nos:2,3,5,6,10,1115,19,23,27,31,35,39,43,47,51,68,72,76,80,84,88,92,302,306,310,和313。
[0075]
在其它优选的实施方案中,本公开内容的单臂异多聚体复合物结合和抑制(拮抗)一种或多种tgf
‑
β超家族配体的活性,所述配体包括但不限于,bmp2,bmp2/7,bmp3,bmp4,bmp4/7,bmp5,bmp6,bmp7,bmp8a,bmp8b,bmp9,bmp10,gdf3,gdf5,gdf6/bmp13,gdf7,gdf8,gdf9b/bmp15,gdf11/bmp11,gdf15/mic1,tgf
‑
β1,tgf
‑
β2,tgf
‑
β3,活化素a,活化素b,活化素c,活化素e,活化素ab,活化素ac,活化素ae,活化素bc,活化素be,nodal,神经胶质细胞衍生的神经营养因子(gdnf),neurturin,artemin,persephin,mis和lefty。特别地,本公开内容的单臂异多聚体复合物可用于拮抗由一种或多种tgfβ超家族配体引发的细胞内信号传导转导(例如,smad 2/3和/或smad 1/5/8信号传导)。如本文所述的,这样的拮抗剂异多聚体复合物可用于治疗或预防各种tgf
‑
β相关病况,包括但不限于与例如,癌症、肌肉、骨、脂肪、红细胞、代谢、纤维化和受tgf
‑
β超家族的一种或多种配体影响的其它组织有关的疾病和病症。在一些实施方案中,与它们相应的同多聚体复合物相比,本公开内容的单臂异多聚体复合物具有不同的配体
‑
结合特征(例如,actriib
‑
fc:fc异二聚体对比相应的actriib
‑
fc:actriib
‑
fc或fc:fc同二聚体)。如本文所述的,本公开内容的单臂异多聚体复合物包括例如,异二聚体、异三聚体、异四聚体和基于单臂单元复合物的另外的寡聚体结构。在某些优选的实施方案中,本公开内容的单臂异多聚体复合物是异二聚体。
[0076]
如本文所用的,术语“actriib”是指来自任何物种的活化素受体ii型b(actriib)蛋白家族,和通过诱变或其它修饰源自这样的actriib蛋白的变体。本文提及actriib应理解为提及任何一个目前鉴定的形式。actriib家族的成员通常是跨膜蛋白,由包含富含半胱氨酸的区域的配体
‑
结合细胞外结构域、跨膜结构域和具有预期的丝氨酸/苏氨酸激酶活性的胞质结构域构成。
[0077]
术语“actriib多肽”包括包含actriib家族成员的任何天然存在的多肽以及其保留有用活性的任何变体(包括突变体、片段、融合物和拟肽形式)的多肽。这样的变体
actriib多肽的实例在本公开内容全文以及国际专利申请公布号wo 2006/012627中提供,其通过引用以其整体结合到本文中。本文所述的所有actriib
‑
相关多肽的氨基酸编号基于下文提供的人actriib前体蛋白序列的编号(seq id no:1),除非另外特别指出。
[0078]
人actriib前体蛋白序列如下:
[0079][0080]
信号肽用单下划线表示;细胞外结构域以粗体表示;和潜在的内源n
‑
连接的糖基化位点用双下划线表示。
[0081]
加工的细胞外actriib多肽序列如下:
[0082]
grgeaetreciyynanwelertnqsglercegeqdkrlhcyaswrnssgtielvkkgcwlddfncydrqecvateenpqvyfcccegnfcnerfthlpeaggpevtyeppptapt(seq id no:2)
[0083]
在一些实施方案中,所述蛋白可以“sgr
…”
序列在n
‑
末端而产生。细胞外结构域的c
‑
末端“尾”通过单下划线表示。“尾”缺失的序列(δ15序列)如下:
[0084]
grgeaetreciyynanwelertnqsglercegeqdkrlhcyaswrnssgtielvkkgcwlddfncydrqecvateenpqvyfcccegnfcnerfthlpea(seq id no:3).
[0085]
seq id no:1的位置64为丙氨酸(a64)的actriib形式也在文献中报道。参见例如,hilden等(1994)blood,83(8):2163
‑
2170。申请人已经确定,包含a64置换的actriib细胞外结构域的actriib
‑
fc融合蛋白具有对活化素和gdf11相对低的亲和力。相比之下,位置64为精氨酸(r64)的相同的actriib
‑
fc融合蛋白具有对活化素和gdf11的低纳摩尔至高皮摩尔范围的亲和力。因此,在本公开内容中,具有r64的序列用作人actriib的“野生型”参比序列。
[0086]
位置64为丙氨酸的actriib形式如下:
[0087][0088]
信号肽通过单下划线表示和细胞外结构域通过粗体表示。
[0089]
可选的a64形式的加工的细胞外actriib多肽序列如下:
[0090]
grgeaetreciyynanwelertnqsglercegeqdkrlhcyaswanssgtielvkkgcwlddfncydrqecvateenpqvyfcccegnfcnerfthlpeaggpevtyeppptapt(seq id no:5)
[0091]
在一些实施方案中,所述蛋白可以“sgr
…”
序列在n
‑
末端而产生。细胞外结构域的c
‑
末端“尾”通过单下划线表示。“尾”缺失的序列(δ15序列)如下:
[0092]
grgeaetreciyynanwelertnqsglercegeqdkrlhcyaswanssgtielvkkgcwlddfncydrqecvateenpqvyfcccegnfcnerfthlpea(seq id no:6)
[0093]
编码人actriib前体蛋白的核酸序列在下文显示(seq id no:7),其由genbank参比序列nm_001106.3的核苷酸25
‑
1560组成,这些核苷酸编码actriib前体的氨基酸1
‑
513。所示的序列提供了位置64的精氨酸,和可经修饰以代替提供丙氨酸。信号序列用下划线表示。
[0094]
[0095][0096]
编码加工的细胞外人actriib多肽的核酸序列如下(seq id no:8)。所示的序列提供了位置64的精氨酸,和可经修饰以代替提供丙氨酸。
[0097][0098]
人actriib可溶性细胞外结构域和人actriia可溶性细胞外结构域的氨基酸序列比对示于图3。该比对显示两种受体内被认为直接接触actrii配体的氨基酸残基。图4描述了各种脊椎动物actriib蛋白和人actriia的多个
‑
序列比对。根据这些比对,有可能预测配体
‑
结合结构域内对于正常的actrii
‑
配体结合活性是重要的关键氨基酸位置,以及预测可能容许置换而不显著改变正常的actrii
‑
配体结合活性的氨基酸位置。在结构和功能特征方面,特别是关于配体结合,actrii蛋白已在本领域中被表征。参见例如,attisano等(1992)cell68(1):97
‑
108;greenwald等(1999)nature structural biology 6(1):18
‑
22;allendorph等(2006)pnas 103(20:7643
‑
7648;thompson等(2003)the embo journal 22(7):1555
‑
1566;以及美国专利号:7,709,605,7,612,041,和7,842,663。
[0099]
例如,attisano等表明actriib的细胞外结构域的c
‑
末端的脯氨酸结的缺失减少受体对活化素的亲和力。相对于包含脯氨酸结区域和完整的近膜结构域的actriib(20
‑
134)
‑
fc,包含本发明的seq id no:1的氨基酸20
‑
119的actriib
‑
fc融合蛋白,“actriib(20
‑
119)
‑
fc”,具有减少的对df11和活化素的结合(参见例如,美国专利号7,842,663)。然而,相对于野生型,actriib(20
‑
129)
‑
fc蛋白保留类似的但略微减少的活性,即使脯氨酸结区域被破坏。因此,在氨基酸134,133,132,131,130和129处停止(相对于seq id no:1)的actriib细胞外结构域全部预期是有活性的,但在134或133处停止的构建体可最具有活性。类似地,残基129
‑
134的任一个处的突变(相对于seq id no:1)在很大程度上不预期改变配体
‑
结合亲和力。为支持此观点,本领域已知p129和p130的突变(相对于seq id no:1)基本上不降低配体结合。因此,本公开内容的actriib多肽可早在氨基酸109(最后一个半胱氨酸)终止,然而,在109和119或其之间(例如,109,110,111,112,113,114,115,116,117,118,或119)终止的形式预期具有减少的配体结合。氨基酸119(相对于本发明的seq id no:1)保守性差,因此容易改变或截短。在128(相对于seq id no:1)或更后终止的actriib多肽和基于actriib的gdf捕捉物(trap)应保留配体
‑
结合活性。相对于seq id no:1在119和127或其之间(例如,119,120,121,122,123,124,125,126,或127)终止的actriib多肽和基于actriib的gdf捕捉物将具有中等结合能力。任何这些形式可能对于根据临床或实验背景的
应用是期望的。
[0100]
在actriib的n
‑
末端,预期在氨基酸29或之前(相对于seq id no:1)开始的蛋白将保留配体
‑
结合活性。氨基酸29表示最初的半胱氨酸。位置24(相对于seq id no:1)的丙氨酸至天冬酰胺突变引入n
‑
连接的糖基化序列,基本上不影响配体结合。参见例如,美国专利号7,842,663。这证实了信号裂解肽和半胱氨酸交联区之间的区域(对应于氨基酸20
‑
29)中的突变是充分容许的(tolerated)。特别地,在位置20,21,22,23,和24(相对于seq id no:1)开始的actriib多肽和基于actriib的gdf捕捉物应保留大致的配体
‑
结合活性,和在位置25,26,27,28,和29(相对于seq id no:1)开始的actriib多肽和基于actriib的gdf捕捉物也被预期保留配体
‑
结合活性。令人惊讶地,在例如,美国专利号7,842,663中显示的数据证实了在22,23,24,或25开始的actriib构建体将具有最大活性。
[0101]
总之,actriib的活性部分(例如,配体
‑
结合部分)包含seq id no:1的氨基酸29
‑
109。因此,本公开内容的actriib多肽可例如包含与在对应于seq id no:1的氨基酸20
‑
29的残基开始(例如,在氨基酸20,21,22,23,24,25,26,27,28,或29开始)和在对应于seq id no:1的氨基酸109
‑
134的位置结束(例如,在氨基酸109,110,111,112,113,114,115,116,117,118,119,120,121,122,123,124,125,126,127,128,129,130,131,132,133,或134结束)的actriib的部分具有至少80%,85%,90%,95%,96%,97%,98%,99%,或100%同一性的氨基酸序列。其它实例包括在位置20
‑
29(例如,位置20,21,22,23,24,25,26,27,28,或29)或21
‑
29(例如,位置21,22,23,24,25,26,27,28,或29)开始和在seq id no:1的位置119
‑
134(例如,119,120,121,122,123,124,125,126,127,128,129,130,131,132,133,或134),119
‑
133(例如,119,120,121,122,123,124,125,126,127,128,129,130,131,132,或133),129
‑
134(例如,129,130,131,132,133,或134),或129
‑
133(例如,129,130,131,132,或133)结束的多肽。其它实例包括在位置20
‑
24(例如,20,21,22,23,或24),21
‑
24(例如,21,22,23,或24),或22
‑
25(例如,22,22,23,或25)开始和在seq id no:1的位置109
‑
134(例如,109,110,111,112,113,114,115,116,117,118,119,120,121,122,123,124,125,126,127,128,129,130,131,132,133,或134),119
‑
134(例如,119,120,121,122,123,124,125,126,127,128,129,130,131,132,133,或134)或129
‑
134(例如,129,130,131,132,133,或134)结束的构建体。在这些范围内的变体也是预期的,特别是与seq id no:1的相应部分具有至少80%,85%,90%,95%,96%,97%,98%,99%,或100%同一性的那些。
[0102]
本公开内容包括图3所示的复合actriib结构的分析结果,证实了配体
‑
结合口袋部分地由残基y31,n33,n35,l38至t41,e47,e50,q53至k55,l57,h58,y60,s62,k74,w78至n83,y85,r87,a92,和e94至f101定义。在这些位置,预期保守突变将是容许的。在非洲蟾蜍中r40是k,表明在该位置的碱性氨基酸将是容许的。在牛actriib中q53是r和在非洲蟾蜍actriib中是k,因此在该位置包括r,k,q,n和h的氨基酸将是容许的。因此,本公开内容的actriib多肽的通式是包含与seq id no:1的氨基酸29
‑
109具有至少80%,85%,90%,95%,96%,97%,98%,99%,或100%同一性的氨基酸序列的通式,任选地在范围20
‑
24(例如,20,21,22,23,或24)或22
‑
25(例如,22,23,24,或25)的位置开始和在范围129
‑
134(例如,129,130,131,132,133,或134)的位置结束,和包含在配体
‑
结合口袋中不超过1,2,5,10或15个保守氨基酸变化,和在配体
‑
结合口袋的位置40,53,55,74,79和/或82的零、一种或多种非
‑
保守改变。变异性可特别地被充分容许的结合口袋外的位点包括细胞外结构域的
氨基和羧基末端(如上所述)和位置42
‑
46和65
‑
73(相对于seq id no:1)。在a64背景下位置65的天冬酰胺至丙氨酸改变(n65a)实际上改进配体结合,因此预期在r64背景下对配体结合没有有害影响。参见例如,美国专利号7,842,663。在a64背景下该变化可能消除n65的糖基化,因此证实该区域中的显著变化可能是容许的。尽管r64a变化容许性差,但r64k良好被容许,因此另一碱性残基,例如h在位置64可被容许。参见例如,美国专利号7,842,663。
[0103]
actriib在几乎所有脊椎动物间是充分保守的,具有完全保守的一大段的细胞外结构域。结合actriib的许多配体也是高度保守的。因此,来自各种脊椎动物生物体的actriib序列的比较提供对可被改变的残基的深入了解。因此,根据本发明的方法可用的活性人actriib变体多肽可包括在来自另一脊椎动物actriib的序列的相应位置的一种或多种氨基酸,或可包括类似于人或其它脊椎动物序列的残基。以下实例表明这种定义活性actriib变体的方法。在非洲蟾蜍actriib中l46是缬氨酸,因此该位置可改变,和任选地可改变为另一疏水残基,例如v、i或f,或非极性残基,例如a。在非洲蟾蜍中e52是k,表明该位点可容许各种变化,包括极性残基,例如e,d,k,r,h,s,t,p,g,y和可能a。在非洲蟾蜍中t93是k,表明在该位置广泛的结构变化是容许的,极性残基是有利的,例如s,k,r,e,d,h,g,p,g和y。在非洲蟾蜍中f108是y,因此y或其它疏水基团,例如i、v或l应是容许的。在非洲蟾蜍中e111是k,表明在该位置改变的残基将是容许的,包括d,r,k和h,以及q和n。在非洲蟾蜍中r112是k,表明碱性残基在该位置是容许的,包括r和h。位置119的a相对是保守差的,和在啮齿动物中作为p出现和在非洲蟾蜍中作为v出现,因此在该位置基本上任何氨基酸应是容许的。
[0104]
本文所述的变化可以各种方式组合。另外,本领域描述的诱变程序的结果表明在actriib中存在通常有利于保守的氨基酸位置。相对于seq id no:1,它们包括位置64(碱性氨基酸),位置80(酸性或疏水氨基酸),位置78(疏水的,和特别是色氨酸),位置37(酸性的,和特别是天冬氨酸或谷氨酸),位置56(碱性氨基酸),位置60(疏水氨基酸,特别是苯丙氨酸或酪氨酸)。因此,在本文公开的actriib多肽中,本公开内容提供了可为保守的氨基酸的框架。对于保守可能是理想的其它位置如下:位置52(酸性氨基酸),位置55(碱性氨基酸),位置81(酸性),98(极性或带电荷,特别是e,d,r或k),全部相对于seq id no:1。
[0105]
在某些实施方案中,本公开内容涉及包含至少一种actriib多肽的单臂异多聚体复合物,所述多肽包括其片段、功能变体和修饰形式。优选地,根据本公开内容的发明使用的actriib多肽(例如,包含actriib多肽的单臂异多聚体复合物和其用途)是可溶性的(例如,actriib的细胞外结构域)。在其它优选的实施方案中,根据本公开内容的发明使用的actriib多肽结合一种或多种tgf
‑
β超家族配体和/或抑制(拮抗)其活性(例如,诱导smad2/3和/或smad 1/5/8信号传导)。在一些实施方案中,本公开内容的单臂异多聚体复合物包含至少一种actriib多肽,其包含以下的氨基酸序列,由其组成,或基本上由其组成:与开始于对应于seq id no:1的氨基酸20
‑
29的残基(例如,开始于氨基酸20,21,22,23,24,25,26,27,28,或29)和结束于对应于seq id no:1的氨基酸109
‑
134的位置(例如,结束于氨基酸109,110,111,112,113,114,115,116,117,118,119,120,121,122,123,124,125,126,127,128,129,130,131,132,133,或134)的actriib部分具有至少80%,85%,90%,95%,96%,97%,98%,99%,或100%同一性。在一些实施方案中,本公开内容的单臂异多聚体复合物包含至少一种actriib多肽,其包含以下氨基酸序列,由其组成,或基本上由其组成:与开始
于对应于seq id no:1的氨基酸20
‑
29的残基(例如,开始于氨基酸20,21,22,23,24,25,26,27,28,或29)和结束于对应于seq id no:1的氨基酸109
‑
134的位置(例如,结束于氨基酸109,110,111,112,113,114,115,116,117,118,119,120,121,122,123,124,125,126,127,128,129,130,131,132,133,或134)的actriib部分具有至少80%,85%,90%,95%,96%,97%,98%,99%,或100%同一性,其中对应于seq id no:1的l79的位置是酸性氨基酸(即,d或e氨基酸残基)。在某些优选的实施方案中,本公开内容的单臂异多聚体复合物包含至少一种actriib多肽,其包含以下氨基酸序列,由其组成,或基本上由其组成:与seq id no:1的氨基酸29
‑
109具有至少80%,85%,90%,95%,96%,97%,98%,99%,或100%同一性。在其它优选的实施方案中,本公开内容的单臂异多聚体复合物包含至少一种actriib多肽,其包含以下氨基酸序列,由其组成,或基本上由其组成:与seq id no:1的氨基酸29
‑
109具有至少80%,85%,90%,95%,96%,97%,98%,99%,或100%同一性,其中对应于seq id no:1的l79的位置是酸性氨基酸(即,d或e氨基酸残基)。在一些实施方案中,本公开内容的单臂异多聚体复合物包含至少一种actriib多肽,其与seq id nos:1,2,3,4,5,6,104,106,403,或404中任一个的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。在一些实施方案中,本公开内容的单臂异多聚体复合物包含至少一种actriib多肽,其与seq id nos:1,2,3,4,5,6,104,106,403,或404中任一个的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性,其中对应于seq id no:1的l79的位置是酸性氨基酸(即,d或e氨基酸残基)。在一些实施方案中,本公开内容的单臂异多聚体复合物包含至少一种actriib多肽,由其组成或基本上由其组成,所述多肽与seq id nos:1,2,3,4,5,6,104,106,403,或404中任一个的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。在一些实施方案中,本公开内容的单臂异多聚体复合物包含至少一种actriib多肽,由其组成或基本上由其组成,所述多肽与seq id nos:1,2,3,4,5,6,104,106,403,或404中任一个的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性,其中对应于seq id no:1的l79的位置是酸性氨基酸(即,d或e氨基酸残基)。
[0106]
在某些实施方案中,本公开内容涉及包含actriia多肽的蛋白复合物。如本文所用的,术语“actriia”是指来自任何物种的活化素受体ii型a(actriia)蛋白家族和通过诱变或其它修饰源自这样的actriia蛋白的变体。本文提及actriia应理解为提及任何一种当前鉴定的形式。actriia家族的成员通常是跨膜蛋白,由包含富含半胱氨酸的区域的配体
‑
结合细胞外结构域、跨膜结构域和具有预期的丝氨酸/苏氨酸激酶活性的胞质结构域构成。
[0107]
术语“actriia多肽”包括包含actriia家族成员的任何天然存在的多肽以及其保留有用活性的任何变体(包括突变体、片段、融合物和拟肽形式)的多肽。这样的变体actriia多肽的实例在本公开内容全文以及在国际专利申请公布号wo 2006/012627中提供,其通过引用以其整体结合到本文中。本文所述的所有actriia
‑
相关多肽的氨基酸编号基于下文提供的人actriia前体蛋白序列的编号(seq id no:9),除非另外特别指出。
[0108]
人actriia前体蛋白序列如下:
[0109]
[0110][0111]
信号肽由单下划线表示;细胞外结构域以粗体表示;和潜在的内源n
‑
连接的糖基化位点由双下划线表示。
[0112]
加工的细胞外人actriia多肽序列如下:
[0113]
ilgrsetqeclffnanwekdrtnqtgvepcygdkdkrrhcfatwknisgsieivkqgcwlddincydrtdcvekkdspevyfcccegnmcnekfsyfpemevtqptsnpvtpkpp(seq id no:10)
[0114]
细胞外结构域的c
‑
末端“尾”由单下划线表示。“尾”缺失的序列(δ15序列)如下:
[0115]
ilgrsetqeclffnanwekdrtnqtgvepcygdkdkrrhcfatwknisgsieivkqgcwlddincydrtdcvekkdspevyfcccegnmcnekfsyfpem(seq id no:11)
[0116]
编码人actriia前体蛋白的核酸序列在下文显示(seq id no:12),对应于genbank参比序列nm_001616.4的核苷酸159
‑
1700。信号序列用下划线表示。
[0117]
[0118]
[0119][0120]
编码加工的细胞外actriia多肽的核酸序列如下:
[0121][0122]
活性(例如,配体结合)actriia多肽的通式是包含开始于seq id no:9的氨基酸30和结束于氨基酸110的多肽的通式。因此,本公开内容的actriia多肽可包含与seq id no:9的氨基酸30
‑
110具有至少80%,85%,90%,95%,96%,97%,98%,99%,或100%同一性的多肽。任选地,本公开内容的actriia多肽包含以下多肽,其与seq id no:9的氨基酸12
‑
82
具有至少80%,85%,90%,95%,96%,97%,98%,99%,或100%同一性,任选地分别开始于范围1
‑
5(例如,1,2,3,4,或5)或3
‑
5(例如,3,4,或5)的位置和结束于范围110
‑
116(例如,110,111,112,113,114,115,或116)或110
‑
115(例如,110,111,112,113,114,或115)的位置,和相对于seq id no:9,包含在配体结合口袋中不超过1,2,5,10或15个保守氨基酸变化,和配体
‑
结合口袋的位置40,53,55,74,79和/或82的零、一种或多种非保守改变。
[0123]
在某些实施方案中,本公开内容涉及包含至少一种actriia多肽的单臂异多聚体复合物,所述多肽包括其片段、功能变体和修饰形式。优选地,根据本公开内容的发明使用的actriia多肽(例如,包含actriia多肽的单臂异多聚体复合物和其用途)是可溶性的(例如,actriia的细胞外结构域)。在其它优选的实施方案中,根据本公开内容的发明使用的actriia多肽结合一种或多种tgf
‑
β超家族配体和/或抑制(拮抗)其活性(例如,诱导smad2/3和/或smad 1/5/8信号传导)。在一些实施方案中,本公开内容的单臂异多聚体复合物包含至少一种actriia多肽,其与seq id nos:9,10,11,101,103,401,或402中任一个的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。在一些实施方案中,本公开内容的单臂异多聚体复合物包含至少一种actriia多肽,由其组成或基本上由其组成,所述多肽与seq id nos:9,10,11,101,103,401,或402中任一个的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。
[0124]
在某些方面,本公开内容涉及包含tgfbrii多肽的蛋白复合物。如本文所用的,术语“tgfbrii”是指来自任何物种的转化生长因子
‑
β受体ii(tgfbrii)蛋白家族和通过诱变或其它修饰源自这样的蛋白的变体。本文提及tgfbrii应理解为提及任何一种当前鉴定的形式。tgfbrii家族的成员通常是跨膜蛋白,由具有富含半胱氨酸的区域的配体
‑
结合细胞外结构域、跨膜结构域和具有预期的丝氨酸/苏氨酸激酶活性的胞质结构域构成。
[0125]
术语“tgfbrii多肽”包括包含tgfbrii家族成员的任何天然存在的多肽以及其保留有用活性的任何变体(包括突变体、片段、融合物和拟肽形式)的多肽。本文所述的所有tgfbrii
‑
相关多肽的氨基酸编号基于下文人tgfbrii前体蛋白序列(seq id no:42)的编号,除非另外特别指出。
[0126]
标准的人tgfbrii前体蛋白序列(ncbi ref seq np_003233.4)如下:
[0127][0128]
信号肽由单下划线表示和细胞外结构域以粗体表示。
[0129]
加工的细胞外tgfbrii多肽序列如下:
[0130]
tipphvqksvnndmivtdnngavkfpqlckfcdvrfstcdnqkscmsncsitsicekpqevcvavwrkndenitletvchdpklpyhdfiledaaspkcimkekkkpgetffmcscssdecndniifseeyntsnpdlllvifq(seq id no:43)
[0131]
编码tgfbrii前体蛋白的核酸序列在下文显示(seq id no:44),对应于genbank参比序列nm_003242.5的核苷酸383
‑
2083。信号序列用下划线表示。
[0132][0133]
编码加工的细胞外tgfbrii多肽的核酸序列如下:
[0134]
acgatcccaccgcacgttcagaagtcggttaataacgacatgatagtcactgacaacaacggtgcagtcaagtttccacaactgtgtaaattttgtgatgtgagattttccacctgtgacaaccagaaatcctgcatgagcaactgcagcatcacctccatctgtgagaagccacaggaagtctgtgtggctgtatggagaaagaatgacgagaacataacactagagacagtttgccatgaccccaagctcccctaccatgactttattctggaagatgctgcttctccaaagtgcattatgaaggaaaaaaaaaagcctggtgagactttcttcatgtgttcctgtagctctgatgagtgcaatgacaacatcatcttctcagaagaatataacaccagcaatcctgacttgttgctagtcatatttcaa(seq id no:45)
[0135]
tgfbrii的可选同种型,同种型a(np_001020018.1),如下:
[0136][0137]
信号肽由单下划线表示和细胞外结构域以粗体表示。
[0138]
加工的细胞外tgfbrii多肽序列(同种型a)如下:
[0139]
tipphvqksdvemeaqkdeiicpscnrtahplrhinndmivtdnngavkfpqlckfcdvrfstcdnqkscmsncsitsicekpqevcvavwrkndenitletvchdpklpyhdfiledaaspkcimkekkkpgetffmcscssdecndniifseeyntsnpdlllvifq(seq id no:68)
[0140]
编码tgfbrii前体蛋白(同种型a)的核酸序列在下文显示(seq id no:69),对应于genbank参比序列nm_001024847.2的核苷酸383
‑
2158。信号序列用下划线表示。
[0141][0142]
编码加工的细胞外tgfbrii多肽(同种型a)的核酸序列如下:
[0143]
acgatcccaccgcacgttcagaagtcggatgtggaaatggaggcccagaaagatgaaatcatctgccccagctgtaataggactgcccatccactgagacatattaataacgacatgatagtcactgacaacaacggtgcagtcaagtttccacaactgtgtaaattttgtgatgtgagattttccacctgtgacaaccagaaatcctgcatgagcaactgcagcatcacctccatctgtgagaagccacaggaagtctgtgtggctgtatggagaaagaatgacgagaacataacactagagacagtttgccatgaccccaagctcccctaccatgactttattctggaagatgctgcttctccaaagtgcattatgaaggaaaaaaaaaagcctggtgagactttcttcatgtgttcctgtagctctgatgagtgcaatgacaacatcatcttctcagaagaatataacaccagcaatcctgacttgttgctagtcatatttcaa(seq id no:70)
[0144]
任一前述tgfβrii同种型(seq id nos:42,43,67和68)可在位于tgfβrii ecd的c
‑
末端附近的谷氨酸残基对之间(seq id no:42的位置151和152;seq id no:43的位置129和130;seq id no:67的位置176和177;或seq id no:68的位置154和155)掺有36个氨基酸(seq id no:95)的插入,如在tgfβrii同种型c中天然存在的(konrad等,bmc genomics 8:318,2007)。
[0145]
grckirhigs nnrlqrstcq ntgwesahvm ktpgfr(seq id no:95)
[0146]
在某些实施方案中,本公开内容涉及包含至少一种tgfbrii多肽的单臂异多聚体复合物,所述多肽包括其片段、功能变体和修饰形式。优选地,根据本公开内容的发明使用的tgfbrii多肽(例如,包含tgfbrii多肽的单臂异多聚体复合物和其用途)是可溶性的(例如,tgfbrii的细胞外结构域)。在其它优选的实施方案中,根据本公开内容的发明使用的tgfbrii多肽结合一种或多种tgf
‑
β超家族配体和/或抑制(拮抗)其活性(例如,诱导smad 2/3和/或smad 1/5/8信号传导)。在一些实施方案中,本公开内容的单臂异多聚体复合物包含至少一种tgfbrii多肽,其与seq id nos:42,43,67,68,113,115,409或410的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%或99%同一性。在一些实施方案中,本公开内容的单臂异多聚体复合物包含至少一种tgfbrii多肽,其与seq id nos:42,43,67,68,113,115,409或410的任何氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%或99%同一性,其中在配对的谷氨酸残基之间插入seq id no:95,如上文所述。在一些实施方案中,本公开内容的单臂异多聚体复合物由至少一种tgfbrii多肽组成或基本上由其组成,所述多肽与seq id nos:42,43,67,68,113,115,409,或410的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。
[0147]
在某些方面,本公开内容涉及包含bmprii多肽的蛋白复合物。如本文所用的,术语“bmprii”是指来自任何物种的骨形态发生蛋白受体ii型(bmprii)蛋白家族和通过诱变或其它修饰而源自这样的bmprii蛋白的变体。本文提及bmprii应理解为提及任何一种当前鉴定的形式。bmprii家族的成员通常是跨膜蛋白,由具有富含半胱氨酸的区域的配体
‑
结合细胞外结构域、跨膜结构域和具有预期的丝氨酸/苏氨酸激酶活性的胞质结构域构成。
[0148]
术语“bmprii多肽”包括包含bmprii家族成员的任何天然存在的多肽以及其保留有用活性的任何变体(包括突变体、片段、融合物和拟肽形式)的多肽。本文所述的所有bmprii
‑
相关多肽的氨基酸编号基于下文人bmprii前体蛋白序列(seq id no:46)的编号,除非另外特别指出。
[0149]
标准的人bmprii前体蛋白序列(ncbi ref seq np_001195.2)如下:
[0150]
[0151][0152]
信号肽由单下划线表示和细胞外结构域以粗体表示。
[0153]
加工的细胞外bmprii多肽序列如下:
[0154]
sqnqerlcafkdpyqqdlgigesrishengtilcskgstcyglwekskgdinlvkqgcwshigdpqechyeecvvtttppsiqngtyrfcccstdlcnvnftenfpppdttplspphsfnrdet(seq id no:47)
[0155]
编码bmprii前体蛋白的核酸序列在下文显示(seq id no:48),对应于genbank参比序列nm_001204.6的核苷酸1149
‑
4262。信号序列用下划线表示。
[0156]
atgacttcctcgctgcagcggccctggcgggtgccctggctaccatggaccatcctgctggtcagcactgcggctgcttcgcagaatcaagaacggctatgtgcgtttaaagatccgtatcagcaagaccttgggataggtgagagtagaatctctcatgaaaatgggacaatattatgctcgaaaggtagcacctgctatggcctttgggagaaatcaaaaggggacataaatcttgtaaaacaaggatgttggtctcacattggagatccccaagagtgtcactatgaagaatgtgtagtaactaccactcctccctcaattcagaatggaacataccgtttctgctgttgtagcacagatttatgtaat
gtcaactttactgagaattttccacctcctgacacaacaccactcagtccacctcattcatttaaccgagatgagacaataatcattgctttggcatcagtctctgtattagctgttttgatagttgccttatgctttggatacagaatgttgacaggagaccgtaaacaaggtcttcacagtatgaacatgatggaggcagcagcatccgaaccctctcttgatctagataatctgaaactgttggagctgattggccgaggtcgatatggagcagtatataaaggctccttggatgagcgtccagttgctgtaaaagtgttttcctttgcaaaccgtcagaattttatcaacgaaaagaacatttacagagtgcctttgatggaacatgacaacattgcccgctttatagttggagatgagagagtcactgcagatggacgcatggaatatttgcttgtgatggagtactatcccaatggatctttatgcaagtatttaagtctccacacaagtgactgggtaagctcttgccgtcttgctcattctgttactagaggactggcttatcttcacacagaattaccacgaggagatcattataaacctgcaatttcccatcgagatttaaacagcagaaatgtcctagtgaaaaatgatggaacctgtgttattagtgactttggactgtccatgaggctgactggaaatagactggtgcgcccaggggaggaagataatgcagccataagcgaggttggcactatcagatatatggcaccagaagtgctagaaggagctgtgaacttgagggactgtgaatcagctttgaaacaagtagacatgtatgctcttggactaatctattgggagatatttatgagatgtacagacctcttcccaggggaatccgtaccagagtaccagatggcttttcagacagaggttggaaaccatcccacttttgaggatatgcaggttctcgtgtctagggaaaaacagagacccaagttcccagaagcctggaaagaaaatagcctggcagtgaggtcactcaaggagacaatcgaagactgttgggaccaggatgcagaggctcggcttactgcacagtgtgctgaggaaaggatggctgaacttatgatgatttgggaaagaaacaaatctgtgagcccaacagtcaatccaatgtctactgctatgcagaatgaacgcaacctgtcacataataggcgtgtgccaaaaattggtccttatccagattattcttcctcctcatacattgaagactctatccatcatactgacagcatcgtgaagaatatttcctctgagcattctatgtccagcacacctttgactataggggaaaaaaaccgaaattcaattaactatgaacgacagcaagcacaagctcgaatccccagccctgaaacaagtgtcaccagcctctccaccaacacaacaaccacaaacaccacaggactcacgccaagtactggcatgactactatatctgagatgccatacccagatgaaacaaatctgcataccacaaatgttgcacagtcaattgggccaacccctgtctgcttacagctgacagaagaagacttggaaaccaacaagctagacccaaaagaagttgataagaacctcaaggaaagctctgatgagaatctcatggagcactctcttaaacagttcagtggcccagacccactgagcagtactagttctagcttgctttacccactcataaaacttgcagtagaagcaactggacagcaggacttcacacagactgcaaatggccaagcatgtttgattcctgatgttctgcctactcagatctatcctctccccaagcagcagaaccttcccaagagacctactagtttgcctttgaacaccaaaaattcaacaaaagagccccggctaaaatttggcagcaagcacaaatcaaacttgaaacaagtcgaaactggagttgccaagatgaatacaatcaatgcagcagaacctcatgtggtgacagtcaccatgaatggtgtggcaggtagaaaccacagtgttaactcccatgctgccacaacccaatatgccaatgggacagtactatctggccaaacaaccaacatagtgacacatagggcccaagaaatgttgcagaatcagtttattggtgaggacacccggctgaatattaattccagtcctgatgagcatgagcctttactgagacgagagcaacaagctggccatgatgaaggtgttctggatcgtcttgtggacaggagggaacggccactagaaggtggccgaactaattccaataacaacaacagcaatccatgttcagaacaagatgttcttgcacagggtgttccaagcacagcagcagatcctgggccatcaaagcccagaagagcacagaggcctaattctctggatctttcagccacaaatgtcctggatggcagcagtatacagataggtgagtcaacacaagatggcaaatcaggatcaggtgaaaagatcaagaaacgtgtgaaaactccctattctcttaagcggtggcgcccctccacctgggtcatctccactgaatcgctggactgtgaagtcaacaataatggcagtaacagggcagttcattccaaatccagcactgctgtttaccttgcagaaggaggcactgctacaaccatggtgtctaaagatataggaatgaactgtctg(seq id no:48)
[0157]
编码细胞外bmprii多肽的核酸序列如下:
[0158]
tcgcagaatcaagaacggctatgtgcgtttaaagatccgtatcagcaagaccttgggataggtgagag
tagaatctctcatgaaaatgggacaatattatgctcgaaaggtagcacctgctatggcctttgggagaaatcaaaaggggacataaatcttgtaaaacaaggatgttggtctcacattggagatccccaagagtgtcactatgaagaatgtgtagtaactaccactcctccctcaattcagaatggaacataccgtttctgctgttgtagcacagatttatgtaatgtcaactttactgagaattttccacctcctgacacaacaccactcagtccacctcattcatttaaccgagatgagaca(seq id no:49)
[0159]
bmprii的可选同种型,同种型2(genbank:aaa86519.1)如下:
[0160][0161][0162]
信号肽由单下划线表示和细胞外结构域以粗体表示。
[0163]
加工的细胞外bmprii多肽序列(同种型2)如下:
[0164]
sqnqerlcafkdpyqqdlgigesrishengtilcskgstcyglwekskgdinlvkqgcwshigdpqechyeecvvtttppsiqngtyrfcccstdlcnvnftenfpppdttplspphsfnrdet(seq id no:72)
[0165]
编码人bmprii前体蛋白(同种型2)的核酸序列在下文显示(seq id no:73),对应于genbank参比序列u25110.1的核苷酸163
‑
1752。
[0166]
信号序列用下划线表示。
[0167]
atgacttcctcgctgcagcggccctggcgggtgccctggctaccatggaccatcctgctggtcagcactgcggctgcttcgcagaatcaagaacggctatgtgcgtttaaagatccgtatcagcaagaccttgggataggtgagagtagaatctctcatgaaaatgggacaatattatgctcgaaaggtagcacctgctatggcctttgggagaaatcaaaaggggacataaatcttgtaaaacaaggatgttggtctcacattggagatccccaagagtgtcactatgaagaatgtgtagtaactaccactcctccctcaattcagaatggaacataccgtttctgctgttgtagcacagatttatgtaatgtcaactttactgagaattttccacctcctgacacaacaccactcagtccacctcattcatttaaccgagatgaga
caataatcattgctttggcatcagtctctgtattagctgttttgatagttgccttatgctttggatacagaatgttgacaggagaccgtaaacaaggtcttcacagtatgaacatgatggaggcagcagcatccgaaccctctcttgatctagataatctgaaactgttggagctgattggccgaggtcgatatggagcagtatataaaggctccttggatgagcgtccagttgctgtaaaagtgttttcctttgcaaaccgtcagaattttatcaacgaaaagaacatttacagagtgcctttgatggaacatgacaacattgcccgctttatagttggagatgagagagtcactgcagatggacgcatggaatatttgcttgtgatggagtactatcccaatggatctttatgcaagtatttaagtctccacacaagtgactgggtaagctcttgccgtcttgctcattctgttactagaggactggcttatcttcacacagaattaccacgaggagatcattataaacctgcaatttcccatcgagatttaaacagcagaaatgtcctagtgaaaaatgatggaacctgtgttattagtgactttggactgtccatgaggctgactggaaatagactggtgcgcccaggggaggaagataatgcagccataagcgaggttggcactatcagatatatggcaccagaagtgctagaaggagctgtgaacttgagggactgtgaatcagctttgaaacaagtagacatgtatgctcttggactaatctattgggagatatttatgagatgtacagacctcttcccaggggaatccgtaccagagtaccagatggcttttcagacagaggttggaaaccatcccacttttgaggatatgcaggttctcgtgtctagggaaaaacagagacccaagttcccagaagcctggaaagaaaatagcctggcagtgaggtcactcaaggagacaatcgaagactgttgggaccaggatgcagaggctcggcttactgcacagtgtgctgaggaaaggatggctgaacttatgatgatttgggaaagaaacaaatctgtgagcccaacagtcaatccaatgtctactgctatgcagaatgaacgtagg(seq id no:73)
[0168]
编码细胞外bmprii多肽(同种型2)的核酸序列如下:
[0169]
tcgcagaatcaagaacggctatgtgcgtttaaagatccgtatcagcaagaccttgggataggtgagagtagaatctctcatgaaaatgggacaatattatgctcgaaaggtagcacctgctatggcctttgggagaaatcaaaaggggacataaatcttgtaaaacaaggatgttggtctcacattggagatccccaagagtgtcactatgaagaatgtgtagtaactaccactcctccctcaattcagaatggaacataccgtttctgctgttgtagcacagatttatgtaatgtcaactttactgagaattttccacctcctgacacaacaccactcagtccacctcattcatttaaccgagatgagaca(seq id no:74)
[0170]
在某些实施方案中,本公开内容涉及包含至少一种bmprii多肽的单臂异多聚体复合物,所述多肽包括其片段、功能变体和修饰形式。优选地,根据本公开内容的发明使用的bmprii多肽(例如,包含bmprii多肽的单臂异多聚体复合物和其用途)是可溶性的(例如,bmprii的细胞外结构域)。在其它优选的实施方案中,根据本公开内容的发明使用的bmprii多肽结合一种或多种tgf
‑
β超家族配体和/或抑制(拮抗)其活性(例如,诱导smad2/3和/或smad 1/5/8信号传导)。在一些实施方案中,本公开内容的单臂异多聚体复合物包含至少一种bmprii多肽,其与seq id no:46,47,71,72,107,109,405或406的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。在一些实施方案中,本公开内容的单臂异多聚体复合物由至少一种bmprii多肽组成或基本上由其组成,所述多肽与seq id no:46,47,71,72,107,109,405或406的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。
[0171]
在某些方面,本公开内容涉及包含misrii多肽的蛋白复合物。如本文所用的,术语“misrii”是指来自任何物种的苗勒管抑制物质受体ii型(misrii)蛋白家族和通过诱变或其它修饰而源自这样的misrii蛋白的变体。本文提及misrii应理解为提及任何一种当前鉴定的形式。misrii家族的成员通常是跨膜蛋白,由具有富含半胱氨酸的区域的配体
‑
结合细胞外结构域、跨膜结构域和具有预期的丝氨酸/苏氨酸激酶活性的胞质结构域构成。
[0172]
术语“misrii多肽”包括包含misrii家族成员的任何天然存在的多肽以及其保留有用活性的任何变体(包括突变体、片段、融合物和拟肽形式)的多肽。本文所述的所有misrii
‑
相关多肽的氨基酸编号基于下文人misrii前体蛋白序列(seq id no:50)的编号,除非另外特别指出。
[0173]
标准的人misrii前体蛋白序列(ncbi refseq np_065434.1)如下:
[0174][0175]
信号肽由单下划线表示和细胞外结构域以粗体表示。
[0176]
加工的细胞外misrii多肽序列如下:
[0177]
ppnrrtcvffeapgvrgstktlgelldtgtelprairclysrccfgiwnltqdraqvemqgcrdsdepgceslhcdpsprahpspgstlftcscgtdfcnanyshlpppgspgtpgsqgpqaapgesiwmal(seq id no:51)
[0178]
编码misrii前体蛋白的核酸序列在下文显示(seq id no:52),对应于genbank参比序列nm_020547.2的核苷酸81
‑
1799。信号序列用下划线表示。
[0179][0180]
编码细胞外人misrii多肽的核酸序列如下:
[0181]
cccccaaacaggcgaacctgtgtgttctttgaggcccctggagtgcggggaagcacaaagacactgggagagctgctagatacaggcacagagctccccagagctatccgctgcctctacagccgctgctgctttgggatctggaacctgacccaagaccgggcacaggtggaaatgcaaggatgccgagacagtgatgagccaggctgtgagtccctccactgtgacccaagtccccgagcccaccccagccctggctccactctcttcacctgctcctgtggcactgacttctgcaatgccaattacagccatctgcctcctccagggagccctgggactcctggctcccagggtccccaggctgccccaggtgagtccatctggatggcactg(seq id no:53)
[0182]
人misrii前体蛋白序列的可选同种型,同种型2(ncbi refseq np_001158162.1),如下:
[0183][0184]
信号肽由单下划线表示和细胞外结构域以粗体表示。
[0185]
加工的细胞外misrii多肽序列(同种型2)如下:
[0186]
ppnrrtcvffeapgvrgstktlgelldtgtelprairclysrccfgiwnltqdraqvemqgcrdsdepgceslhcdpsprahpspgstlftcscgtdfcnanyshlpppgspgtpgsqgpqaapgesiwmal(seq id no:76)
[0187]
编码misrii前体蛋白(同种型2)的核酸序列在下文显示(seq id no:77),对应于genbank参比序列nm_001164690.1的核苷酸81
‑
1514。信号序列用下划线表示。
[0188]
atgctagggtctttggggctttgggcattacttcccacagctgtggaagcacccccaaacaggcgaacctgtgtgttctttgaggcccctggagtgcggggaagcacaaagacactgggagagctgctagatacaggcacagagctccccagagctatccgctgcctctacagccgctgctgctttgggatctggaacctgacccaagaccgggcacaggtggaaatgcaaggatgccgagacagtgatgagccaggctgtgagtccctccactgtgacccaagtccccgagcccaccccagccctggctccactctcttcacctgctcctgtggcactgacttctgcaatgccaattacagccatctgcctcctccagggagccctgggactcctggctcccagggtccccaggctgccccaggtgagtccatctggatggcactggtgctgctggggctgttcctcctcctcctgctgctgctgggcagcatcatcttggccctgctacagcgaaagaactacagagtgcgaggtgagccagtgccagagccaaggccagactcaggcagggactggagtgtggagctgcaggagctgcctgagctgtgtttctcccaggtaatccgggaaggaggtcatgcagtggtttgggccgggcagctgcaaggaaaactggttgccatcaaggccttcccaccgaggtctgtggctcagttccaagctgagagagcattgtacgaacttccaggcctacagcacgaccacattgtccgatttatcactgccagccgggggggtcctggccgcctgctctctgggcccctgctggtactggaactgcatcccaagggctccctgtgccactacttgacccagtacaccagtgactggggaagttccctgcggatggcactgtccctggcccagggcctggcatttctccatgaggagcgctggcagaatggccaatataaaccaggtattgcccaccgagatctgagcagccagaatgtgctcattcgggaagatggatcgtgtgccattggagacctg
ggccttgccttggtgctccctggcctcactcagccccctgcctggacccctactcaaccacaaggcccagctgccatcatggaagctggcacccagaggtacatggcaccagagctcttggacaagactctggacctacaggattggggcatggccctccgacgagctgatatttactctttggctctgctcctgtgggagatactgagccgctgcccagatttgaggcctgcagtccaccacccttccaactggcctatgaggcagaactgggcaatacccctacctctgatgagctatgggccttggcagtgcaggagaggaggcgtccctacatcccatccacctggcgctgctttgccacagaccctgatgggc(seq id no:77)
[0189]
编码加工的可溶性(细胞外)人misrii多肽(同种型2)的核酸序列如下:
[0190]
cccccaaacaggcgaacctgtgtgttctttgaggcccctggagtgcggggaagcacaaagacactgggagagctgctagatacaggcacagagctccccagagctatccgctgcctctacagccgctgctgctttgggatctggaacctgacccaagaccgggcacaggtggaaatgcaaggatgccgagacagtgatgagccaggctgtgagtccctccactgtgacccaagtccccgagcccaccccagccctggctccactctcttcacctgctcctgtggcactgacttctgcaatgccaattacagccatctgcctcctccagggagccctgggactcctggctcccagggtccccaggctgccccaggtgagtccatctggatggcactg(seq id no:78)
[0191]
人misrii前体蛋白序列的可选同种型,同种型3(ncbi ref seq np_001158163.1),如下:
[0192][0193]
信号肽由单下划线表示和细胞外结构域以粗体表示。
[0194]
加工的细胞外misrii多肽序列(同种型3)如下:
[0195]
ppnrrtcvffeapgvrgstktlgelldtgtelprairclysrccfgiwnltqdraqvemqgcrdsdepgceslhcdpsprahpspgstlftcscgtdfcnanyshlpppgspgtpgsqgpqaapgesiwmal(seq id no:80)
[0196]
编码人misrii前体蛋白(同种型3)的核酸序列在下文显示(seq id no:81),对应
于genbank参比序列nm_001164691.1的核苷酸81
‑
1514。信号序列用下划线表示。
[0197]
atgctagggtctttggggctttgggcattacttcccacagctgtggaagcacccccaaacaggcgaacctgtgtgttctttgaggcccctggagtgcggggaagcacaaagacactgggagagctgctagatacaggcacagagctccccagagctatccgctgcctctacagccgctgctgctttgggatctggaacctgacccaagaccgggcacaggtggaaatgcaaggatgccgagacagtgatgagccaggctgtgagtccctccactgtgacccaagtccccgagcccaccccagccctggctccactctcttcacctgctcctgtggcactgacttctgcaatgccaattacagccatctgcctcctccagggagccctgggactcctggctcccagggtccccaggctgccccaggtgagtccatctggatggcactggtgctgctggggctgttcctcctcctcctgctgctgctgggcagcatcatcttggccctgctacagcgaaagaactacagagtgcgaggtgagccagtgccagagccaaggccagactcaggcagggactggagtgtggagctgcaggagctgcctgagctgtgtttctcccaggtaatccgggaaggaggtcatgcagtggtttgggccgggcagctgcaaggaaaactggttgccatcaaggccttcccaccgaggtctgtggctcagttccaagctgagagagcattgtacgaacttccaggcctacagcacgaccacattgtccgatttatcactgccagccgggggggtcctggccgcctgctctctgggcccctgctggtactggaactgcatcccaagggctccctgtgccactacttgacccagtacaccagtgactggggaagttccctgcggatggcactgtccctggcccagggcctggcatttctccatgaggagcgctggcagaatggccaatataaaccaggtattgcccaccgagatctgagcagccagaatgtgctcattcgggaagatggatcgtgtgccattggagacctgggccttgccttggtgctccctggcctcactcagccccctgcctggacccctactcaaccacaaggcccagctgccatcatggaagaccctgatgggctgagggagctcctagaagactgttgggatgcagacccagaagcacggctgacagctgagtgtgtacagcagcgcctggctgccttggcccatcctcaagagagccacccctttccagagagctgtccacgtggctgcccacctctctgcccagaagactgtacttcaattcctgcccctaccatcctcccctgtaggcctcagcggagtgcctgccacttcagcgttcagcaaggcccttgttccaggaatcctcagcctgcctgtaccctttctcctgtg(seq id no:81)
[0198]
编码加工的可溶性(细胞外)人misrii多肽(同种型3)的核酸序列如下:
[0199]
cccccaaacaggcgaacctgtgtgttctttgaggcccctggagtgcggggaagcacaaagacactgggagagctgctagatacaggcacagagctccccagagctatccgctgcctctacagccgctgctgctttgggatctggaacctgacccaagaccgggcacaggtggaaatgcaaggatgccgagacagtgatgagccaggctgtgagtccctccactgtgacccaagtccccgagcccaccccagccctggctccactctcttcacctgctcctgtggcactgacttctgcaatgccaattacagccatctgcctcctccagggagccctgggactcctggctcccagggtccccaggctgccccaggtgagtccatctggatggcactg(seq id no:82)
[0200]
在某些实施方案中,本公开内容涉及包含至少一种misrii多肽的单臂异多聚体复合物,所述多肽包括其片段、功能变体和修饰形式。优选地,根据本公开内容的发明使用的misrii多肽(例如,包含misrii多肽的单臂异多聚体复合物和其用途)是可溶性的(例如,misrii的细胞外结构域)。在其它优选的实施方案中,根据本公开内容的发明使用的misrii多肽结合一种或多种tgf
‑
β超家族配体和/或抑制(拮抗)其活性(例如,诱导smad 2/3和/或smad 1/5/8信号传导)。在一些实施方案中,本公开内容的单臂异多聚体复合物包含至少一种misrii多肽,其与seq id nos:50,51,75,76,79,80,110,112,407,或408的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。在一些实施方案中,本公开内容的单臂异多聚体复合物由至少一种misrii多肽组成或基本上由其组成,所述多肽与seq id nos:50,51,75,76,79,80,110,112,407,或408的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。
[0201]
在某些方面,本公开内容涉及包含alk1多肽的蛋白复合物。如本文所用的,术语“alk1”是指来自任何物种的活化素受体
‑
样激酶
‑
1蛋白家族和通过诱变或其它修饰而源自这样的alk1蛋白的变体。本文提及alk1应理解为提及任何一种当前鉴定的形式。alk1家族的成员通常是跨膜蛋白,由具有富含半胱氨酸的区域的配体
‑
结合细胞外结构域、跨膜结构域和具有预期的丝氨酸/苏氨酸激酶活性的胞质结构域构成。
[0202]
术语“alk1多肽”包括包含alk1家族成员的任何天然存在的多肽以及其保留有用活性的任何变体(包括突变体、片段、融合物和拟肽形式)的多肽。本文所述的所有alk1
‑
相关多肽的氨基酸编号基于下文人alk1前体蛋白序列(seq id no:14)的编号,除非另外特别指出。
[0203]
人alk1前体蛋白序列(ncbi refseqnp_000011.2)如下:
[0204][0205][0206]
信号肽由单下划线表示和细胞外结构域以粗体表示。
[0207]
加工的细胞外alk1多肽序列如下:
[0208]
dpvkpsrgplvtctcesphckgptcrgawctvvlvreegrhpqehrgcgnlhrelcrgrptefvnhyccdshlcnhnvslvleatqppseqpgtdgq(seq id no:15)
[0209]
编码人alk1前体蛋白的核酸序列在下文显示(seq id no:16),对应于genbank参比序列nm_000020.2的核苷酸284
‑
1792。信号序列用下划线表示。
[0210][0211][0212]
编码加工的细胞外alk1多肽的核酸序列如下:
[0213]
gaccctgtgaagccgtctcggggcccgctggtgacctgcacgtgtgagagcccacattgcaaggggcctacctgccggggggcctggtgcacagtagtgctggtgcgggaggaggggaggcacccccaggaacatcggggctgcgggaacttgcacagggagctctgcagggggcgccccaccgagttcgtcaaccactactgctgcgacagccacctctgcaaccacaacgtgtccctggtgctggaggccacccaacctccttcggagcagccgggaacagatggccag(seq id no:17)
[0214]
在某些实施方案中,本公开内容涉及包含至少一种alk1多肽的单臂异多聚体复合物,所述多肽包括其片段、功能变体和修饰形式。优选地,根据本公开内容的发明使用的alk1多肽(例如,包含alk1多肽的单臂异多聚体复合物和其用途)是可溶性的(例如,alk1的细胞外结构域)。在其它优选的实施方案中,根据本公开内容的发明使用的alk1多肽结合一种或多种tgf
‑
β超家族配体和/或抑制(拮抗)其活性(例如,诱导smad2/3和/或smad 1/5/8信号传导)。在一些实施方案中,本公开内容的单臂异多聚体复合物包含至少一种alk1多
肽,其与seq id no:14,15,116,118,411,或412的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。在一些实施方案中,本公开内容的单臂异多聚体复合物由至少一种alk1多肽组成或基本上由其组成,所述多肽与seq id no:14,15,116,118,411,或412的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。
[0215]
在某些方面,本公开内容涉及包含alk2多肽的蛋白复合物。如本文所用的,术语“alk2”是指来自任何物种的活化素受体
‑
样激酶
‑
2蛋白家族和通过诱变或其它修饰而源自这样的alk2蛋白的变体。本文提及alk2应理解为提及任何一种当前鉴定的形式。alk2家族的成员通常是跨膜蛋白,由具有富含半胱氨酸的区域的配体
‑
结合细胞外结构域、跨膜结构域和具有预期的丝氨酸/苏氨酸激酶活性的胞质结构域构成。
[0216]
术语“alk2多肽”包括包含alk2家族成员的任何天然存在的多肽以及其保留有用活性的任何变体(包括突变体、片段、融合物和拟肽形式)的多肽。本文所述的所有alk2
‑
相关多肽的氨基酸编号基于下文人alk2前体蛋白序列(seq id no:18)的编号,除非另外特别指出。
[0217]
人alk2前体蛋白序列(ncbi refseqnp_001096.1)如下:
[0218][0219]
信号肽由单下划线表示和细胞外结构域以粗体表示。
[0220]
加工的细胞外alk2多肽序列如下:
[0221]
medekpkvnpklymcvceglscgnedhcegqqcfsslsindgfhvyqkgcfqvyeqgkmtcktppspgqaveccqgdwcnrnitaqlptkgksfpgtqnfhle(seq id no:19)
[0222]
编码人alk2前体蛋白的核酸序列在下文显示(seq id no:20),对应于genbank参比序列nm_001105.4的核苷酸431
‑
1957。信号序列用下划线表示。
[0223][0224]
编码细胞外alk2多肽的核酸序列如下:
[0225]
atggaagatgagaagcccaaggtcaaccccaaactctacatgtgtgtgtgtgaaggtctctcctgcggtaatgaggaccactgtgaaggccagcagtgcttttcctcactgagcatcaacgatggcttccacgtctaccagaaaggctgcttccaggtttatgagcagggaaagatgacctgtaagaccccgccgtcccctggccaagccgtggagtgctgccaaggggactggtgtaacaggaacatcacggcccagctgcccactaaaggaaaatccttccctggaacacagaatttccacttggag(seq id no:21)
[0226]
在某些实施方案中,本公开内容涉及包含至少一种alk2多肽的单臂异多聚体复合物,所述多肽包括其片段、功能变体和修饰形式。优选地,根据本公开内容的发明使用的alk2多肽(例如,包含alk2多肽的单臂异多聚体复合物和其用途)是可溶性的(例如,alk2的细胞外结构域)。在其它优选的实施方案中,根据本公开内容的发明使用的alk2多肽结合一
种或多种tgf
‑
β超家族配体和/或抑制(拮抗)其活性(例如,诱导smad2/3和/或smad 1/5/8信号传导)。在一些实施方案中,本公开内容的单臂异多聚体复合物包含至少一种alk2多肽,其与seq id no:18,19,119,121,413,或414的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。在一些实施方案中,本公开内容的单臂异多聚体复合物由至少一种alk2多肽组成或基本上由其组成,其与seq id no:18,19,119,121,413,或414的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。
[0227]
在某些方面,本公开内容涉及包含alk3多肽的蛋白复合物。如本文所用的,术语“alk3”是指来自任何物种的活化素受体
‑
样激酶
‑
3蛋白家族和通过诱变或其它修饰而源自这样的alk3蛋白的变体。本文提及alk3应理解为提及任何一种当前鉴定的形式。alk3家族的成员通常是跨膜蛋白,由具有富含半胱氨酸的区域的配体
‑
结合细胞外结构域、跨膜结构域和具有预期的丝氨酸/苏氨酸激酶活性的胞质结构域构成。
[0228]
术语“alk3多肽”包括包含alk3家族成员的任何天然存在的多肽以及其保留有用活性的任何变体(包括突变体、片段、融合物和拟肽形式)的多肽。本文所述的所有alk3
‑
相关多肽的氨基酸编号基于下文人alk3前体蛋白序列(seq id no:22)的编号,除非另外特别指出。
[0229]
人alk3前体蛋白序列(ncbi refseqnp_004320.2)如下:
[0230][0231][0232]
信号肽由单下划线表示和细胞外结构域以粗体表示。
[0233]
加工的细胞外alk3多肽序列如下:
[0234][0235]
编码人alk3前体蛋白的核酸序列在下文显示(seq id no:24),对应于genbank参
比序列nm_004329.2的核苷酸549
‑
2144。信号序列用下划线表示和细胞外结构域以粗体表示。
[0236]
[0237][0238]
编码细胞外人alk3多肽的核酸序列如下:
[0239]
[0240][0241]
活性(例如,配体结合)alk3多肽的通式是包含开始于seq id no:22的任何氨基酸位置25
‑
31(即,位置25,26,27,28,29,30,或31)和结束于seq id no:22的任何氨基酸位置140
‑
152(即,140,141,142,143,144,145,146,147,148,149,150,151,或152)的多肽的通式。参见美国专利8,338,377,其教导通过引用以其整体结合到本文中。
[0242]
在某些实施方案中,本公开内容涉及包含至少一种alk3多肽的单臂异多聚体复合物,所述多肽包括其片段、功能变体和修饰形式。优选地,根据本公开内容的发明使用的alk3多肽(例如,包含alk3多肽的单臂异多聚体复合物和其用途)是可溶性的(例如,alk3的细胞外结构域)。在其它优选的实施方案中,根据本公开内容的发明使用的alk3多肽结合一种或多种tgf
‑
β超家族配体和/或抑制(拮抗)其活性(例如,诱导smad2/3和/或smad 1/5/8信号传导)。在一些实施方案中,本公开内容的单臂异多聚体复合物包含至少一种alk3多肽,其包含开始于seq id no:22的任何氨基酸位置25
‑
31(即,位置25,26,27,28,29,30,或31)和结束于seq id no:22的任何氨基酸位置140
‑
153(即,140,141,142,143,144,145,146,147,148,149,150,151,或152)的氨基酸,由其组成,或基本上由其组成。在一些实施方案中,本公开内容的单臂异多聚体复合物包含至少一种alk3多肽,其与seq id no:22,23,122,124,415,或416的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。在一些实施方案中,本公开内容的单臂异多聚体复合物由至少一种alk3多肽组成或基本上由其组成,其与seq id no:22,23,122,124,415,或416的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。
[0243]
在某些方面,本公开内容涉及包含alk4多肽的蛋白复合物。如本文所用的,术语“alk4”是指来自任何物种的活化素受体
‑
样激酶
‑
4蛋白家族和通过诱变或其它修饰而源自这样的alk4蛋白的变体。本文提及alk4应理解为提及任何一种当前鉴定的形式。alk4家族的成员通常是跨膜蛋白,由具有富含半胱氨酸的区域的配体
‑
结合细胞外结构域、跨膜结构域和具有预期的丝氨酸/苏氨酸激酶活性的胞质结构域构成。
[0244]
术语“alk4多肽”包括包含alk4家族成员的任何天然存在的多肽以及其保留有用活性的任何变体(包括突变体、片段、融合物和拟肽形式)的多肽。本文所述的所有alk4
‑
相关多肽的氨基酸编号基于下文人alk4前体蛋白序列(seq id no:26)的编号,除非另外特别指出。
[0245]
标准的人alk4前体(同种型a,ncbi refseqnp_004293)的蛋白序列如下:
[0246][0247]
信号肽由单下划线表示和细胞外结构域以粗体表示。
[0248]
加工的细胞外人alk4多肽序列如下:
[0249]
sgprgvqallcactsclqanytcetdgacmvsifnldgmehhvrtcipkvelvpagkpfyclssedlrnthccytdycnridlrvpsghlkepehpsmwgpve(seq id no:27)
[0250]
编码alk4前体蛋白的核酸序列在下文显示(seq id no:28),对应于genbank参比序列nm_004302.4的核苷酸78
‑
1592。信号序列用下划线表示和细胞外结构域以粗体表示。
[0251][0252]
编码细胞外alk4多肽的核酸序列如下:
[0253]
tccgggccccggggggtccaggctctgctgtgtgcgtgcaccagctgcctccaggccaactacacgtgtgagacagatggggcctgcatggtttccattttcaatctggatgggatggagcaccatgtgcgcacctgcatccccaaagtggagctggtccctgccgggaagcccttctactgcctgagctcggaggacctgcgcaacacccactgctgctacactgactactgcaacaggatcgacttgagggtgcccagtggtcacctcaaggagcctgagcacccgtccatgtggggcccggtggag(seq id no:29)
[0254]
人alk4前体的可选同种型,同种型b(ncbi ref seq np_064732.3),如下:
[0255][0256]
细胞外结构域以粗体表示。
[0257]
细胞外alk4多肽序列(同种型b)如下:
[0258]
mvsifnldgmehhvrtcipkvelvpagkpfyclssedlrnthccytdycnridlrvpsghlkepehpsmwgpve(seq id no:84)
[0259]
编码alk4前体蛋白的同种型b的核酸序列在下文显示(seq id no:85),对应于genbank参比序列nm_020327.3的核苷酸186
‑
1547。
[0260]
细胞外结构域以粗体表示。
[0261]
[0262][0263]
编码alk4多肽(同种型b)的细胞外结构域的核酸序列如下:atggtttccattttcaatctggatgggatggagcaccatgtgcgcacctgcatccccaaagtggagctggtccctgccgggaagcccttctactgcctgagctcggaggacctgcgcaacacccactgctgctacactgactactgcaacaggatcgacttgagggtgcccagtggtcacctcaaggagcctgagcacccgtccatgtggggcccggtggag(seq id no:86)
[0264]
在某些实施方案中,本公开内容涉及包含至少一种alk4多肽的单臂异多聚体复合物,所述多肽包括其片段、功能变体和修饰形式。优选地,根据本公开内容的发明使用的alk4多肽(例如,包含alk4多肽的单臂异多聚体复合物和其用途)是可溶性的(例如,alk4的细胞外结构域)。在其它优选的实施方案中,根据本公开内容的发明使用的alk4多肽结合一种或多种tgf
‑
β超家族配体和/或抑制(拮抗)其活性(例如,诱导smad2/3和/或smad 1/5/8信号传导)。在一些实施方案中,本公开内容的单臂异多聚体复合物包含至少一种alk4多肽,其与seq id no:26,27,83,84,125,127,417,或418的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。在一些实施方案中,本公开内容的单臂异多聚体复合物由至少一种alk4多肽组成或基本上由其组成,其与seq id no:26,27,83,84,125,127,417,或418的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。
[0265]
在某些方面,本公开内容涉及包含alk5多肽的蛋白复合物。如本文所用的,术语“alk5”是指来自任何物种的活化素受体
‑
样激酶
‑
5蛋白家族和通过诱变或其它修饰而源自这样的alk4蛋白的变体。本文提及alk5应理解为提及任何一种当前鉴定的形式。alk5家族的成员通常是跨膜蛋白,由具有富含半胱氨酸的区域的配体
‑
结合细胞外结构域、跨膜结构域和具有预期的丝氨酸/苏氨酸激酶活性的胞质结构域构成。
[0266]
术语“alk5多肽”包括包含alk5家族成员的任何天然存在的多肽以及其保留有用活性的任何变体(包括突变体、片段、融合物和拟肽形式)的多肽。本文所述的所有alk5
‑
相关多肽的氨基酸编号基于下文人alk5前体蛋白序列(seq id no:30)的编号,除非另外特别指出。
[0267]
标准的人alk5前体蛋白序列(ncbi refseqnp_004603.1)如下:
[0268][0269]
信号肽由单下划线表示和细胞外结构域以粗体表示。
[0270]
加工的细胞外alk5多肽序列如下:
[0271]
aallpgatalqcfchlctkdnftcvtdglcfvsvtettdkvihnsmciaeidliprdrpfvcapssktgsvtttyccnqdhcnkielpttvksspglgpvel(seq id no:31)
[0272]
编码alk5前体蛋白的核酸序列在下文显示(seq id no:32),对应于genbank参比序列nm_004612.2的核苷酸77
‑
1585。信号序列用下划线表示和细胞外结构域以粗体表示。
[0273][0274]
编码细胞外人alk5多肽的核酸序列如下:
[0275]
gcggcgctgctcccgggggcgacggcgttacagtgtttctgccacctctgtacaaaagacaattttacttgtgtgacagatgggctctgctttgtctctgtcacagagaccacagacaaagttatacacaacagcatgtgtatagctgaaattgacttaattcctcgagataggccgtttgtatgtgcaccctcttcaaaaactgggtctgtgactacaacatattgctgcaatcaggaccattgcaataaaatagaacttccaactactgtaaagtcatcacctggccttggtcctgtggaactg(seq id no:33)
[0276]
人alk5前体蛋白序列的可选同种型,同种型2(ncbi ref seq xp_005252207.1),如下:
[0277][0278]
信号肽由单下划线表示和细胞外结构域以粗体表示。
[0279]
加工的细胞外alk5多肽序列(同种型2)如下:
[0280]
aallpgatalqcfchlctkdnftcvtdglcfvsvtettdkvihnsmciaeidliprdrpfvcapssktgsvtttyccnqdhcnkielpttgpfsvksspglgpvel(seq id no:88)
[0281]
编码人alk5前体蛋白(同种型2)的核酸序列在下文显示(seq id no:89),对应于genbank参比序列xm_005252150.1的核苷酸77
‑
1597。
[0282]
信号序列用下划线表示和细胞外结构域以粗体表示。
[0283]
[0284][0285]
编码加工的细胞外alk5多肽的核酸序列如下:
[0286]
gcggcgctgctcccgggggcgacggcgttacagtgtttctgccacctctgtacaaaagacaattttacttgtgtgacagatgggctctgctttgtctctgtcacagagaccacagacaaagttatacacaacagcatgtgtatagctgaaattgacttaattcctcgagataggccgtttgtatgtgcaccctcttcaaaaactgggtctgtgactacaacatattgctgcaatcaggaccattgcaataaaatagaacttccaactactggccctttttcagtaaagtcatcacctggccttggtcctgtggaactg(seq id no:90)
[0287]
在某些实施方案中,本公开内容涉及包含至少一种alk5多肽的单臂异多聚体复合物,所述多肽包括其片段、功能变体和修饰形式。优选地,根据本公开内容的发明使用的alk5多肽(例如,包含alk5多肽的单臂异多聚体复合物和其用途)是可溶性的(例如,alk5的细胞外结构域)。在其它优选的实施方案中,根据本公开内容的发明使用的alk5多肽结合一种或多种tgf
‑
β超家族配体和/或抑制(拮抗)其活性(例如,诱导smad2/3和/或smad 1/5/8信号传导)。在一些实施方案中,本公开内容的单臂异多聚体复合物包含至少一种alk5多肽,其与seq id no:30,31,87,88,128,130,419,或420的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。在一些实施方案中,本公开内容的单臂异多聚体复合物由至少一种alk5多肽组成或基本上由其组成,其与seq id no:30,31,87,88,128,130,419,或420的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。
[0288]
在某些方面,本公开内容涉及包含alk6多肽的蛋白复合物。如本文所用的,术语“alk6”是指来自任何物种的活化素受体
‑
样激酶
‑
6蛋白家族和通过诱变或其它修饰而源自
这样的alk6蛋白的变体。本文提及alk6应理解为提及任何一种当前鉴定的形式。alk6家族的成员通常是跨膜蛋白,由具有富含半胱氨酸的区域的配体
‑
结合细胞外结构域、跨膜结构域和具有预期的丝氨酸/苏氨酸激酶活性的胞质结构域构成。
[0289]
术语“alk6多肽”包括包含alk6家族成员的任何天然存在的多肽以及其保留有用活性的任何变体(包括突变体、片段、融合物和拟肽形式)的多肽。本文所述的所有alk6
‑
相关多肽的氨基酸编号基于下文人alk6前体蛋白序列(seq id no:34)的编号,除非另外特别指出。
[0290]
标准的人alk6前体蛋白序列(ncbi refseqnp_001194.1)如下:
[0291][0292][0293]
信号肽由单下划线表示和细胞外结构域以粗体表示。
[0294]
加工的细胞外alk6多肽序列如下:
[0295]
kkedgestaptprpkvlrckchhhcpedsvnnicstdgycftmieeddsglpvvtsgclglegsdfqcrdtpiphqrrsieccternecnkdlhptlpplknrdfvdgpihhr(seq id no:35)
[0296]
编码alk6前体蛋白的核酸序列在下文显示(seq id no:36),对应于genbank参比序列nm_001203.2的核苷酸275
‑
1780。信号序列用下划线表示和细胞外结构域以粗体表示。
[0297][0298][0299]
编码加工的细胞外alk6多肽的核酸序列如下:
[0300]
aagaaagaggatggtgagagtacagcccccaccccccgtccaaaggtcttgcgttgtaaatgccaccaccattgtccagaagactcagtcaacaatatttgcagcacagacggatattgtttcacgatgatagaagaggatgactctgggttgcctgtggtcacttctggttgcctaggactagaaggctcagattttcagtgtcgggacactcccattcctcatcaaagaagatcaattgaatgctgcacagaaaggaacgaatgtaataaagacctacaccctacactgcctccattgaaaaacagagattttgttgatggacctatacaccacagg(seq id no:37)
[0301]
人alk6前体蛋白序列的可选同种型,同种型2(ncbi ref seq np_001243722.1)如下:
[0302][0303]
信号肽由单下划线表示和细胞外结构域以粗体表示。
[0304]
加工的细胞外alk6多肽序列(同种型2)如下:
[0305]
nfldnmllrsagklnvgtkkedgestaptprpkvlrckchhhcpedsvnnicstdgycftmieeddsglpvvtsgclglegsdfqcrdtpiphqrrsieccternecnkdlhptlpplknrdfvdgpihhr(seq id no:92)
[0306]
编码人alk6前体蛋白(同种型2)的核酸序列在下文显示,对应于genbank参比序列nm_001256793.1的核苷酸22
‑
1617。信号序列用下划线表示和细胞外结构域以粗体表示。
[0307][0308]
编码加工的细胞外alk6多肽的核酸序列如下:
[0309]
aacttccttgataacatgcttttgcgaagtgcaggaaaattaaatgtgggcaccaagaaagaggatggtgagagtacagcccccaccccccgtccaaaggtcttgcgttgtaaatgccaccaccattgtccagaagactcagtcaacaatatttgcagcacagacggatattgtttcacgatgatagaagaggatgactctgggttgcctgtggtcacttctggttgcctaggactagaaggctcagattttcagtgtcgggacactcccattcctcatcaaagaagatcaattgaatgctgcacagaaaggaacgaatgtaataaagacctacaccctacactgcctccattgaaaaacagagattttgttgatggacctatacaccacagg(seq id no:94)
[0310]
在某些实施方案中,本公开内容涉及包含至少一种alk6多肽的单臂异多聚体复合物,所述多肽包括其片段、功能变体和修饰形式。优选地,根据本公开内容的发明使用的alk6多肽(例如,包含alk6多肽的单臂异多聚体复合物和其用途)是可溶性的(例如,alk6的细胞外结构域)。在其它优选的实施方案中,根据本公开内容的发明使用的alk6多肽结合一
种或多种tgf
‑
β超家族配体和/或抑制(拮抗)其活性(例如,诱导smad2/3和/或smad 1/5/8信号传导)。在一些实施方案中,本公开内容的单臂异多聚体复合物包含至少一种alk6多肽,其与seq id no:34,35,91,92,131,133,421,或422的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。在一些实施方案中,本公开内容的单臂异多聚体复合物由至少一种alk6多肽组成或基本上由其组成,其与seq id no:34,35,91,92,131,133,421,或422的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。
[0311]
在某些方面,本公开内容涉及包含alk7多肽的蛋白复合物。如本文所用的,术语“alk7”是指来自任何物种的活化素受体
‑
样激酶
‑
7蛋白家族和通过诱变或其它修饰而源自这样的alk7蛋白的变体。本文提及alk7应理解为提及任何一种当前鉴定的形式。alk7家族的成员通常是跨膜蛋白,由具有富含半胱氨酸的区域的配体
‑
结合细胞外结构域、跨膜结构域和具有预期的丝氨酸/苏氨酸激酶活性的胞质结构域构成。
[0312]
术语“alk7多肽”包括包含alk7家族成员的任何天然存在的多肽以及其保留有用活性的任何变体(包括突变体、片段、融合物和拟肽形式)的多肽。本文所述的所有alk7
‑
相关多肽的氨基酸编号基于下文人alk7前体蛋白序列(seq id no:38)的编号,除非另外特别指出。
[0313]
已经描述了人alk7的数个天然存在的同种型。标准的人alk7同种型1前体蛋白(ncbi refseqnp_660302.2)的序列如下:
[0314][0315]
信号肽由单下划线表示和细胞外结构域以粗体表示。
[0316]
加工的细胞外alk7同种型1多肽序列如下:
[0317]
elspglkcvcllcdssnftcqtegacwasvmltngkeqvikscvslpelnaqvfchssnnvtkteccftdfcnnitlhlptaspnapklgpme(seq id no:39)
[0318]
编码人alk7同种型1前体蛋白的核酸序列在下文显示(seq id no:40),对应于genbank参比序列nm_145259.2的核苷酸244
‑
1722。
[0319]
信号序列用下划线表示和细胞外结构域以粗体表示。
[0320][0321][0322]
编码加工的细胞外alk7多肽(同种型1)的核酸序列如下:gagctctcgccaggactgaagtgtgtatgtcttttgtgtgattcttcaaactttacctgccaaacagaaggagcatgttgggcatcagtcatgctaaccaatggaaaagagcaggtgatcaaatcctgtgtctcccttccagaactgaatgctcaagtcttctgtcatagttccaacaatgttaccaaaaccgaatgctgcttcacagatttttgcaacaacataacactgcaccttccaacagcatcaccaaatgccccaaaacttggacccatggag(seq id no:41)
[0323]
人alk7的可选同种型,同种型2(ncbi refseqnp_001104501.1)的氨基酸序列以其加工形式显示如下(seq id no:301),其中细胞外结构域以粗体表示。
[0324][0325][0326]
细胞外alk7多肽(同种型2)的氨基酸序列如下:
[0327]
mltngkeqvikscvslpelnaqvfchssnnvtkteccftdfcnnitlhlptaspnapklgpme(seq id no:302)
[0328]
编码加工的alk7多肽(同种型2)的核酸序列在下文显示(seq id no:303),对应于ncbi参比序列nm_001111031.1的核苷酸279
‑
1607。
[0329]
细胞外结构域以粗体表示。
[0330][0331]
编码细胞外alk7多肽(同种型2)的核酸序列如下(seq id no:304):
[0332]
atgctaaccaatggaaaagagcaggtgatcaaatcctgtgtctcccttccagaactgaatgctcaagtcttctgtcatagttccaacaatgttaccaaaaccgaatgctgcttcacagatttttgcaacaacataacactgcaccttccaacagcatcaccaaatgccccaaaacttggacccatggag(seq id no:304)
[0333]
可选的人alk7前体蛋白,同种型3(ncbi ref seq np_001104502.1)的氨基酸序列显示如下(seq id no:305),其中信号肽由单下划线表示。
[0334][0335]
加工的alk7多肽(同种型3)的氨基酸序列如下(seq id no:306)。该同种型缺少跨膜结构域,因此被提议以其整体是可溶性的(roberts等,2003,biol reprod 68:1719
‑
1726)。seq id no:306的n
‑
末端变体按下文所述预测。
[0336][0337][0338]
编码未加工的alk7多肽前体蛋白(同种型3)的核酸序列在下文显示(seq id no:307),对应于ncbi参比序列nm_001111032.1的核苷酸244
‑
1482。信号序列以实下划线表示。
[0339]
atgacccgggcgctctgctcagcgctccgccaggctctcctgctgctcgcagcggccgccgagctctcgccaggactgaagtgtgtatgtcttttgtgtgattcttcaaactttacctgccaaacagaaggagcatgttgggcatcagtcatgctaaccaatggaaaagagcaggtgatcaaatcctgtgtctcccttccagaactgaatgctcaagtcttctgtcatagttccaacaatgttaccaaaaccgaatgctgcttcacagatttttgcaacaacataacactgcaccttccaacaggtctacctctgttggttcaaaggacaattgcaaggacgattgtgcttcaggaaatagtaggaaaaggtagatttggtgaggtgtggcatggaagatggtgtggggaagatgtggctgtgaaaatattctcctccagagatgaaa
gatcttggtttcgtgaggcagaaatttaccagacggtcatgctgcgacatgaaaacatccttggtttcattgctgctgacaacaaagataatggaacttggactcaactttggctggtatctgaatatcatgaacagggctccttatatgactatttgaatagaaatatagtgaccgtggctggaatgatcaagctggcgctctcaattgctagtggtctggcacaccttcatatggagattgttggtacacaaggtaaacctgctattgctcatcgagacataaaatcaaagaatatcttagtgaaaaagtgtgaaacttgtgccatagcggacttagggttggctgtgaagcatgattcaatactgaacactatcgacatacctcagaatcctaaagtgggaaccaagaggtatatggctcctgaaatgcttgatgatacaatgaatgtgaatatctttgagtccttcaaacgagctgacatctattctgttggtctggtttactgggaaatagcccggaggtgttcagtcggaggaattgttgaggagtaccaattgccttattatgacatggtgccttcagatccctcgatagaggaaatgagaaaggttgtttgtgaccagaagtttcgaccaagtatcccaaaccagtggcaaagttgtgaagcactccgagtcatggggagaataatgcgtgagtgttggtatgccaacggagcggcccgcctaactgctcttcgtattaagaagactatatctcaactttgtgtcaaagaagactgcaaagcc(seq id no:307)
[0340]
编码加工的alk7多肽(同种型3)的核酸序列如下(seq id no:308):
[0341]
gagctctcgccaggactgaagtgtgtatgtcttttgtgtgattcttcaaactttacctgccaaacagaaggagcatgttgggcatcagtcatgctaaccaatggaaaagagcaggtgatcaaatcctgtgtctcccttccagaactgaatgctcaagtcttctgtcatagttccaacaatgttaccaaaaccgaatgctgcttcacagatttttgcaacaacataacactgcaccttccaacaggtctacctctgttggttcaaaggacaattgcaaggacgattgtgcttcaggaaatagtaggaaaaggtagatttggtgaggtgtggcatggaagatggtgtggggaagatgtggctgtgaaaatattctcctccagagatgaaagatcttggtttcgtgaggcagaaatttaccagacggtcatgctgcgacatgaaaacatccttggtttcattgctgctgacaacaaagataatggaacttggactcaactttggctggtatctgaatatcatgaacagggctccttatatgactatttgaatagaaatatagtgaccgtggctggaatgatcaagctggcgctctcaattgctagtggtctggcacaccttcatatggagattgttggtacacaaggtaaacctgctattgctcatcgagacataaaatcaaagaatatcttagtgaaaaagtgtgaaacttgtgccatagcggacttagggttggctgtgaagcatgattcaatactgaacactatcgacatacctcagaatcctaaagtgggaaccaagaggtatatggctcctgaaatgcttgatgatacaatgaatgtgaatatctttgagtccttcaaacgagctgacatctattctgttggtctggtttactgggaaatagcccggaggtgttcagtcggaggaattgttgaggagtaccaattgccttattatgacatggtgccttcagatccctcgatagaggaaatgagaaaggttgtttgtgaccagaagtttcgaccaagtatcccaaaccagtggcaaagttgtgaagcactccgagtcatggggagaataatgcgtgagtgttggtatgccaacggagcggcccgcctaactgctcttcgtattaagaagactatatctcaactttgtgtcaaagaagactgcaaagcc(seq id no:308)
[0342]
可选的人alk7前体蛋白,同种型4(ncbi ref seq np_001104503.1)的氨基酸序列显示如下(seq id no:309),其中信号肽由单下划线表示。
[0343][0344]
加工的alk7多肽(同种型4)的氨基酸序列如下(seq id no:310)。像alk7同种型3,同种型4缺少跨膜结构域,因此被提议以其整体是可溶性的(roberts等,2003,biol reprod 68:1719
‑
1726)。seq id no:310的n
‑
末端变体按下文所述预测。
[0345][0346][0347]
编码未加工的alk7多肽前体蛋白(同种型4)的核酸序列在下文显示(seq id no:311),对应于ncbi参比序列nm_001111033.1的核苷酸244
‑
1244。信号序列由实下划线表示。
[0348]
atgacccgggcgctctgctcagcgctccgccaggctctcctgctgctcgcagcggccgccgagctctcgccaggactgaagtgtgtatgtcttttgtgtgattcttcaaactttacctgccaaacagaaggagcatgttgggcatcagtcatgctaaccaatggaaaagagcaggtgatcaaatcctgtgtctcccttccagaactgaatgctcaagtcttctgtcatagttccaacaatgttaccaaaaccgaatgctgcttcacagatttttgcaacaacataacactgcaccttccaacagataatggaacttggactcaactttggctggtatctgaatatcatgaacagggctccttatatgactatttgaatagaaatatagtgaccgtggctggaatgatcaagctggcgctctcaattgctagtggtctggcacaccttcatatggagattgttggtacacaaggtaaacctgctattgctcatcgagacataaaatcaaagaatatcttagtgaaaaagtgtgaaacttgtgccatagcggacttagggttggctgtgaagcatgattcaatactgaacactatcgacatacctcagaatcctaaagtgggaaccaagaggtatatggctcctgaaatgcttgatgatacaatgaatgtgaatatctttgagtccttcaaacgagctgacatctattctgttggtctggtttactgggaaatagcccggaggtgttcagtcggaggaattgttgaggagtaccaattgccttattatgacatggtgccttcagatccctcgatagaggaaatgagaaaggttgtttgtgaccagaagtttcgaccaagtatcccaaaccagtggcaaagttgtgaagcactccgagtcatgggga
gaataatgcgtgagtgttggtatgccaacggagcggcccgcctaactgctcttcgtattaagaagactatatctcaactttgtgtcaaagaagactgcaaagcctaa(seq id no:311)
[0349]
编码加工的alk7多肽(同种型4)的核酸序列如下(seq id no:312):
[0350]
gagctctcgccaggactgaagtgtgtatgtcttttgtgtgattcttcaaactttacctgccaaacagaaggagcatgttgggcatcagtcatgctaaccaatggaaaagagcaggtgatcaaatcctgtgtctcccttccagaactgaatgctcaagtcttctgtcatagttccaacaatgttaccaaaaccgaatgctgcttcacagatttttgcaacaacataacactgcaccttccaacagataatggaacttggactcaactttggctggtatctgaatatcatgaacagggctccttatatgactatttgaatagaaatatagtgaccgtggctggaatgatcaagctggcgctctcaattgctagtggtctggcacaccttcatatggagattgttggtacacaaggtaaacctgctattgctcatcgagacataaaatcaaagaatatcttagtgaaaaagtgtgaaacttgtgccatagcggacttagggttggctgtgaagcatgattcaatactgaacactatcgacatacctcagaatcctaaagtgggaaccaagaggtatatggctcctgaaatgcttgatgatacaatgaatgtgaatatctttgagtccttcaaacgagctgacatctattctgttggtctggtttactgggaaatagcccggaggtgttcagtcggaggaattgttgaggagtaccaattgccttattatgacatggtgccttcagatccctcgatagaggaaatgagaaaggttgtttgtgaccagaagtttcgaccaagtatcccaaaccagtggcaaagttgtgaagcactccgagtcatggggagaataatgcgtgagtgttggtatgccaacggagcggcccgcctaactgctcttcgtattaagaagactatatctcaactttgtgtcaaagaagactgcaaagcctaa(seq id no:312)
[0351]
基于在大鼠中全长alk7(同种型1)的信号序列(参见ncbi参比序列np_620790.1)和在人和大鼠alk7之间高程度的序列同一性,预测加工形式的人alk7同种型1如下(seq id no:313)。
[0352][0353]
预测了加工的alk7同种型1的活性变体,其中seq id no:39在n
‑
末端被截短1,2,3,4,5,6或7个氨基酸和seq id no:313在n
‑
末端被截短1或2个氨基酸。与seq id no:313一致,进一步预期亮氨酸是加工形式的人alk7同种型3(seq id no:306)和人alk7同种型4(seq id no:310)的n
‑
末端氨基酸。
[0354]
在某些实施方案中,本公开内容涉及包含至少一种alk7多肽的单臂异多聚体复合物,所述多肽包括其片段、功能变体和修饰形式。优选地,根据本公开内容的发明使用的alk7多肽(例如,包含alk7多肽的单臂异多聚体复合物和其用途)是可溶性的(例如,alk7的细胞外结构域)。在其它优选的实施方案中,根据本公开内容的发明使用的alk7多肽结合一种或多种tgf
‑
β超家族配体和/或抑制(拮抗)其活性(例如,诱导smad2/3和/或smad 1/5/8信号传导)。在一些实施方案中,本公开内容的单臂异多聚体复合物包含至少一种alk7多肽,其与seq id no:38,39,134,136,301,302,305,306,309,310,313,423,或424的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。在一些实施方案中,本公开内容的单臂异多聚体复合物由至少一种alk7多肽组成或基本上由其组成,其与seq id no:38,39,134,136,301,302,305,306,309,310,313,423,或424的氨基酸序列具有至少70%,75%,80%,85%,90%,95%,97%,98%,或99%同一性。
[0355]
在一些实施方案中,为例如增强治疗功效或稳定性(例如,保存期限和对体内蛋白水解降解的抗性)的目的,本公开内容考虑通过修饰tgf
‑
β超家族i型受体多肽(例如,alk1,
alk2,alk3,alk4,alk5,alk6,和alk7)或tgf
‑
β超家族ii型受体多肽(例如,actriia,actriib,tgfbrii,bmprii,和misrii)的结构来制备功能变体。变体可通过氨基酸置换、缺失、添加或其组合产生。例如,合理的是预期单独置换亮氨酸为异亮氨酸或缬氨酸、天冬氨酸为谷氨酸、苏氨酸为丝氨酸或类似置换氨基酸为结构相关的氨基酸(例如,保守突变)对得到的分子的生物学活性不将具有显著影响。保守置换是在其侧链上相关的氨基酸家族内发生的那些。本公开内容的多肽的氨基酸序列的变化是否产生功能同系物可通过评价变体多肽在细胞中以类似于野生型多肽的方式产生反应,或结合一种或多种tgf
‑
β配体,包括例如bmp2,bmp2/7,bmp3,bmp4,bmp4/7,bmp5,bmp6,bmp7,bmp8a,bmp8b,bmp9,bmp10,gdf3,gdf5,gdf6/bmp13,gdf7,gdf8,gdf9b/bmp15,gdf11/bmp11,gdf15/mic1,tgf
‑
β1,tgf
‑
β2,tgf
‑
β3,活化素a,活化素b,活化素c,活化素e,活化素ab,活化素ac,nodal,gdnf,neurturin,artemin,persephin,mis和lefty的能力,容易地确定。
[0356]
在某些实施方案中,本公开内容考虑本公开内容的tgf
‑
β超家族i型受体多肽(例如,alk1,alk2,alk3,alk4,alk5,alk6,和alk7)或tgf
‑
β超家族ii型受体多肽(例如,actriia,actriib,tgfbrii,bmprii,和misrii)的特定突变,以改变多肽的糖基化。这样的突变可经选择,以引入或消除一个或多个糖基化位点,例如o
‑
连接或n
‑
连接的糖基化位点。天冬酰胺
‑
连接的糖基化识别位点通常包含三肽序列,天冬酰胺
‑
x
‑
苏氨酸或天冬酰胺
‑
x
‑
丝氨酸(其中“x”是任何氨基酸),其被合适的细胞糖基化酶特异性识别。还可通过添加一个或多个丝氨酸或苏氨酸残基至多肽的序列或通过一个或多个丝氨酸或苏氨酸残基置换多肽的序列进行改变(对于o
‑
连接的糖基化位点)。糖基化识别位点的第一或第三氨基酸位置的一个或两个处的各种氨基酸置换或缺失(和/或第二位置处的氨基酸缺失),导致在修饰的三肽序列处非
‑
糖基化。增加多肽上的碳水化合物部分的数量的另一方法是通过糖苷化学或酶偶联至多肽。根据使用的偶联模式,糖可连接至(a)精氨酸和组氨酸;(b)游离的羧基;(c)游离的巯基,例如半胱氨酸的那些;(d)游离的羟基,例如丝氨酸、苏氨酸或羟基脯氨酸的那些;(e)芳香族残基,例如苯丙氨酸、酪氨酸或色氨酸的那些;或(f)谷氨酰胺的酰胺基。除去多肽上存在的一个或多个碳水化合物部分可经化学和/或酶促实现。化学去糖基化可包括例如,将多肽暴露于化合物三氟甲磺酸或等效的化合物。这种处理导致大部分或所有的糖裂解,除了连接糖(n
‑
乙酰基葡糖胺或n
‑
乙酰基半乳糖胺)之外,同时保留氨基酸序列完整。多肽上碳水化合物部分的酶裂解可通过使用各种内切和外切糖苷酶实现,如thotakura等[meth.enzymol.(1987)138:350]所述。在合适时,多肽的序列可根据使用的表达系统的类型调整,因为哺乳动物、酵母、昆虫和植物细胞可全都引入可受所述肽的氨基酸序列影响的不同糖基化模式。一般而言,在人中使用的本公开内容的tgf
‑
β超家族i和ii型受体单臂复合物可在提供合适糖基化的哺乳动物细胞系中表达,例如hek293或cho细胞系,尽管其它哺乳动物表达细胞系预期也可使用。
[0357]
本公开内容进一步考虑产生本公开内容的tgf
‑
β超家族i型受体多肽(例如,alk1,alk2,alk3,alk4,alk5,alk6,和alk7)或tgf
‑
β超家族ii型受体多肽(例如,actriia,actriib,tgfbrii,bmprii,和misrii)的突变体,特别是组合的突变体组,以及截短的突变体的方法。组合的突变体库可特别用于鉴定tgf
‑
β超家族i型或tgf
‑
β超家族ii型受体序列。筛选这样的组合文库的目的可以是产生例如,具有改变的性质,例如改变的药代动力学或改变的配体结合的多肽变体。各种筛选测定法在下文提供,和这样的测定法可用于评价变
体。例如,可筛选tgf
‑
β超家族i型或ii型受体多肽变体结合tgf
‑
β超家族配体(例如,bmp2,bmp2/7,bmp3,bmp4,bmp4/7,bmp5,bmp6,bmp7,bmp8a,bmp8b,bmp9,bmp10,gdf3,gdf5,gdf6/bmp13,gdf7,gdf8,gdf9b/bmp15,gdf11/bmp11,gdf15/mic1,tgf
‑
β1,tgf
‑
β2,tgf
‑
β3,活化素a,活化素b,活化素c,活化素e,活化素ab,活化素ac,活化素ae,活化素bc,活化素be,nodal,gdnf,neurturin,artemin,persephin,mis,和lefty),阻止tgf
‑
β超家族配体与tgf
‑
β超家族受体结合,和/或干扰由tgf
‑
β超家族配体引起的信号传导的能力。
[0358]
本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物的活性还可在基于细胞测定法或体内测定法中测试。例如,可评价单臂异多聚体复合物对在肌肉细胞中参与肌肉产生的基因表达的影响。按需要,这可在一种或多种重组tgf
‑
β超家族配体蛋白(例如,bmp2,bmp2/7,bmp3,bmp4,bmp4/7,bmp5,bmp6,bmp7,bmp8a,bmp8b,bmp9,bmp10,gdf3,gdf5,gdf6/bmp13,gdf7,gdf8,gdf9b/bmp15,gdf11/bmp11,gdf15/mic1,tgf
‑
β1,tgf
‑
β2,tgf
‑
β3,活化素a,活化素b,活化素c,活化素e,活化素ab,活化素ac,活化素ae,活化素bc,活化素be,nodal,gdnf,neurturin,artemin,persephin,mis,和lefty)的存在下进行,和细胞可经转染,以产生tgf
‑
β超家族i型或ii型受体单臂复合物,和任选地,tgf
‑
β超家族配体。同样地,本公开内容的单臂异多聚体复合物可给予小鼠或其它动物,和可使用公认的方法评价一种或多种度量,例如肌肉形成和强度。类似地,tgf
‑
β超家族受体多肽或其变体的活性可在成骨细胞、脂肪细胞和/或神经元细胞中测试对这些细胞的生长的任何影响,例如,通过本文所述的测定法和本领域众所周知的那些。可在这样的细胞系中使用smad
‑
应答报告基因以监测对下游信号传导的影响。
[0359]
可产生组合来源的变体,相对于参比tgf
‑
β超家族受体单臂异多聚体复合物,其具有增加的选择性或普遍增加的效力。这样的变体,当从重组dna构建体表达时,可用于基因治疗方案。同样地,诱变可产生变体,其具有显著不同于相应的未修饰的tgf
‑
β超家族受体单臂异多聚体复合物的细胞外半寿期。例如,改变的蛋白可被赋予对蛋白水解降解或导致未修饰多肽的破坏或以其他方式失活的其它细胞过程更稳定或更不稳定。这样的变体和编码它们的基因,可通过调节多肽的半寿期,用于改变多肽复合物水平。例如,短的半寿期可产生更短暂的生物学作用,并且当诱导型表达系统的一部分时,可允许更紧密控制细胞外的重组多肽复合物水平。在fc融合蛋白中,可在接头(如果有的话)和/或fc部分中进行突变以改变tgf
‑
β超家族受体单臂异多聚体复合物的半寿期。
[0360]
组合文库可通过编码多肽文库的简并基因文库产生,所述多肽各自至少包括潜在的tgf
‑
β超家族i型或ii型受体序列的一部分。例如,合成的寡核苷酸的混合物可经酶促连接至基因序列,使得潜在的tgf
‑
β超家族i型或ii型受体编码核苷酸序列的简并组可作为各个多肽表达,或者,作为较大的融合蛋白组表达(例如,对于噬菌体展示)。
[0361]
存在许多可自简并寡核苷酸序列产生潜在的同系物的文库的方法。简并基因序列的化学合成可在自动dna合成仪中进行,和合成的基因然后可连接至合适的载体用于表达。简并寡核苷酸的合成是本领域众所周知的。参见例如,narang,sa(1983)tetrahedron 39:3;itakura等(1981)recombinant dna,proc.3rd cleveland sympos.macromolecules,ed.ag walton,amsterdam:elsevier pp273
‑
289;itakura等(1984)annu.rev.biochem.53:323;itakura等(1984)science198:1056;ike等(1983)nucleic acid res.11:477。这样的技术已经用于其它蛋白的定向进化。参见例如,scott等,(1990)science249:386
‑
390;
roberts等(1992)pnas usa 89:2429
‑
2433;devlin等(1990)science 249:404
‑
406;cwirla等,(1990)pnas usa 87:6378
‑
6382;以及美国专利号:5,223,409,5,198,346,和5,096,815。
[0362]
或者,其它形式的诱变可用于产生组合文库。例如,本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物可通过筛选,使用例如,丙氨酸扫描诱变[参见例如,ruf等(1994)biochemistry 33:1565
‑
1572;wang等(1994)j.biol.chem.269:3095
‑
3099;balint等(1993)gene137:109
‑
118;grodberg等(1993)eur.j.biochem.218:597
‑
601;nagashima等(1993)j.biol.chem.268:2888
‑
2892;lowman等(1991)biochemistry 30:10832
‑
10838;和cunningham等(1989)science244:1081
‑
1085],通过接头扫描诱变[参见例如,gustin等(1993)virology 193:653
‑
660;和brown等(1992)mol.cell biol.12:2644
‑
2652;mcknight等(1982)science 232:316],通过饱和诱变[参见例如,meyers等,(1986)science 232:613];通过pcr诱变[参见例如,leung等(1989)method cell mol biol 1:11
‑
19];或通过随机诱变,包括化学诱变[参见例如,miller等(1992)a short course in bacterial genetics,cshl press,cold spring harbor,ny;和greener等(1994)strategies in mol biol7:32
‑
34],从文库产生和分离。接头扫描诱变,特别是在组合的背景下,是一种用于鉴定截短(生物活性)形式的tgf
‑
β超家族i型或ii型受体多肽的有吸引力的方法。
[0363]
本领域已知用于筛选通过点突变和截短制备的组合文库的基因产物的各种技术,和在这方面,用于筛选具有一定性质的基因产物的cdna文库的各种技术。这样的技术一般可适用于通过本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物的组合诱变产生的基因文库的快速筛选。用于筛选大基因文库的最广泛使用的技术通常包括克隆基因文库至可复制表达载体,用得到的载体文库转化合适的细胞,和在其中所需活性的检测促进相对容易的分离编码其产物被检测的基因的载体的条件下表达组合基因。优选的测定法包括用于tgf
‑
β超家族配体(例如,bmp2,bmp2/7,bmp3,bmp4,bmp4/7,bmp5,bmp6,bmp7,bmp8a,bmp8b,bmp9,bmp10,gdf3,gdf5,gdf6/bmp13,gdf7,gdf8,gdf9b/bmp15,gdf11/bmp11,gdf15/mic1,tgf
‑
β1,tgf
‑
β2,tgf
‑
β3,活化素a,活化素b,活化素c,活化素e,活化素ab,活化素ac,活化素ae,活化素bc,活化素be,nodal,gdnf,neurturin,artemin,persephin,mis和lefty)的结合测定法和/或细胞
‑
信号传导测定法。
[0364]
在某些实施方案中,除了在tgf
‑
β超家族i型或ii型受体多肽中天然存在的任何修饰之外,本公开内容的tgf
‑
β超家族i型和ii型受体单臂异多聚体复合物可进一步包含翻译后修饰。这样的修饰包括但不限于,乙酰基化、羧基化、糖基化、磷酸化、脂质化和酰基化。结果,tgf
‑
β超家族i型或ii型受体单臂异多聚体复合物可包含非
‑
氨基酸元件,例如聚乙二醇、脂质、多糖或单糖和磷酸酯。这样的非
‑
氨基酸元件对单臂异多聚体复合物的功能性的影响可按本文对于其它单臂异多聚体复合物变体所述的进行测试。当本公开内容的多肽在细胞中通过裂解新生形式的多肽产生时,翻译后加工也可能对于蛋白的正确折叠和/或功能是重要的。不同的细胞(例如,cho,hela,mdck,293,wi38,nih
‑
3t3或hek293)具有用于这样的翻译后活性的特定细胞机器和特征性机制,和可经选择以确保tgf
‑
β超家族i型或ii型受体多肽的正确修饰和加工。
[0365]
在某些方面,本文公开的多肽可形成蛋白复合物,其包含与包含相互作用对的互补成员的至少一种多肽共价或非共价缔合的至少一种tgf
‑
β超家族i型或ii型受体多肽。优
选地,本文公开的多肽形成单臂异二聚体复合物,尽管还包括更高级的异多聚体复合物(异多聚体),例如,但不限于,异三聚体、异四聚体和另外的寡聚体结构(参见例如,图1)。在一些实施方案中,本公开内容的tgf
‑
β超家族i型或ii型受体多肽包含至少一个多聚化结构域。如本文公开的,术语“多聚化结构域”是指促进至少第一多肽和至少第二多肽之间的共价或非共价相互作用的氨基酸或氨基酸序列。本文公开的多肽可共价或非共价连接至多聚化结构域。优选地,多聚化结构域促进在单臂多肽(例如,包含tgf
‑
β超家族i型受体多肽或tgf
‑
β超家族ii型受体多肽的融合多肽)和相互作用对的互补成员之间的相互作用以促进异多聚体形成(例如,异二聚体形成),和任选地妨碍或以其他方式不利于同多聚体形成(例如,同二聚体形成),从而增加所需的异多聚体的收率(参见例如,图2)。
[0366]
本领域已知的许多方法可用于产生本公开内容的tgf
‑
β超家族受体单臂复合物。例如,非天然存在的二硫键可通过替换第一多肽(例如,包含tgf
‑
β超家族i型或ii型受体多肽的融合多肽)上的天然存在的氨基酸为游离的含硫醇残基,例如半胱氨酸构建,使得游离的硫醇与第二多肽(例如,相互作用对的互补成员)上的另一游离的含硫醇残基相互作用,以致在第一和第二多肽之间形成二硫键。促进异多聚体形成的相互作用的另外的实例包括但不限于,离子相互作用,例如描述于kjaergaard等,wo2007147901;静电导引作用,例如描述于kannan等,u.s.8,592,562;盘绕线圈相互作用,例如描述于christensen等,u.s.20120302737;亮氨酸拉链,例如描述于pack&plueckthun,(1992)biochemistry 31:1579
‑
1584;和螺旋
‑
转角
‑
螺旋基序,例如描述于pack等,(1993)bio/technology 11:1271
‑
1277。各种区段的连接可通过例如共价结合,例如通过化学交联、肽接头、二硫桥等或亲和相互作用,例如通过亲和素
‑
生物素或亮氨酸拉链技术获得。
[0367]
在某些方面,多聚化结构域可包含相互作用对的一个组分。在一些实施方案中,本文公开的多肽可形成蛋白复合物,其包含与第二多肽共价或非共价缔合的第一多肽,其中第一多肽包含tgf
‑
β超家族i型或ii型受体多肽的氨基酸序列和相互作用对的第一成员的氨基酸序列;和第二多肽,其包含相互作用对的第二成员的氨基酸序列。相互作用对可以是任何两个多肽序列,其相互作用以形成复合物、特别是异二聚体复合物,尽管有效的实施方案也可使用可形成同二聚体复合物的相互作用对。相互作用对的一个成员可融合至本文所述的tgf
‑
β超家族i型或ii型受体多肽,包括例如,包含与seq id nos:2,3,5,6,10,11,15,19,23,27,31,35,39,43,47,51,68,72,76,80,84,88,92,302,306,310,和313的任何一个的序列具有至少80%,85%,90%,95%,96%,97%,98%,99%,或100%同一性的氨基酸序列的多肽序列,基本上由其组成或由其组成。相互作用对可经选择以赋予改进的性质/活性,例如增加的血清半寿期,或作为接头起作用,另一部分与接头连接以提供改进的性质/活性。例如,聚乙二醇部分可连接至相互作用对的一个或两个组分以提供改进的性质/活性,例如改进的血清半寿期。
[0368]
相互作用对的第一和第二成员可以是不对称的对,意味着该对的成员优先彼此缔合,而非自缔合。因此,不对称的相互作用对的第一和第二成员可缔合形成异二聚体相互作用
‑
对复合物(参见例如,图2)。或者,相互作用对可以是非引导的,意味着该对的成员可彼此缔合或自缔合,没有实质的偏好,因此可具有相同的或不同的氨基酸序列。因此,非引导的相互作用对的第一和第二成员可缔合形成同二聚体相互作用
‑
对复合物或异二聚体作用
‑
对复合物。任选地,相互作用对(例如,不对称的对或非引导的相互作用对)的第一成员
与相互作用对的第二成员共价缔合。任选地,相互作用对(例如,不对称的对或非引导的相互作用对)的第一成员与相互作用对的第二成员非共价缔合。
[0369]
作为特定的实例,本公开内容提供了融合蛋白复合物,其包含融合至包含免疫球蛋白的恒定结构域例如免疫球蛋白的ch1、ch2或ch3结构域或fc结构域的多肽的至少一种tgf
‑
β超家族i型或ii型受体多肽。本文提供了源自人igg1,igg2,igg3和igg4的fc结构域。已知减少cdc或adcc活性的其它突变,总的来说,任何这些变体包括在本公开内容内,和可用作本公开内容的单臂异多聚体复合物的有利组分。任选地,seq id no:208的igg1 fc结构域在残基例如asp
‑
265,lys
‑
322和asn
‑
434处具有一个或多个突变(根据相应的全长igg1编号)。在某些情况下,相对于野生型fc结构域,具有一个或多个这些突变(例如,asp
‑
265突变)的突变体fc结构域具有减少的结合fcγ受体的能力。在其它情况下,相对于野生型fc结构域,具有一个或多个这些突变(例如,asn
‑
434突变)的突变体fc结构域具有增加的结合mhc i类相关fc
‑
受体(fcrn)的能力。
[0370]
可用于人igg1的fc部分(g1fc)的天然氨基酸序列的实例在下文显示(seq id no:208)。虚下划线表示铰链区,和实下划线表示具有天然存在的变体的位置。部分地,本公开内容提供了包含与seq id no:208具有80%,85%,90%,95%,96%,97%,98%,或99%同一性的氨基酸序列的多肽。根据seq id no:208使用的编号系统,g1fc的天然存在的变体包括e134d和m136l(参见uniprotp01857)。
[0371][0372]
可用于人igg2的fc部分(g2fc)的天然氨基酸序列的实例在下文显示(seq id no:209)。虚下划线表示铰链区和双下划线表示其中在序列(根据uniprotp01859)中存在数据库冲突的位置。部分地,本公开内容提供了包含与seq id no:209具有80%,85%,90%,95%,96%,97%,98%,或99%同一性的氨基酸序列的多肽。
[0373][0374]
可用于人igg3的fc部分(g3fc)的氨基酸序列的两个实例在下文显示。g3fc的铰链区可达到其它fc链的4倍长,和包含三个相同的15
‑
残基区段,前面是类似的17
‑
残基区段。在下文显示的第一g3fc序列(seq id no:210)包含由单一15
‑
残基区段组成的短的铰链区,而第二g3fc序列(seq id no:211)包含全长铰链区。在各情况下,虚下划线表示铰链区,和实下划线表示根据uniprot p01859具有天然存在的变体的位置。部分地,本公开内容提供了包含与seq id nos:210和211具有80%,85%,90%,95%,96%,97%,98%,或99%同一性的氨基酸序列的多肽。
[0375][0376][0377]
当转化为seq id no:210中使用的编号系统时,g3fc(例如,参见uniprot p01860)的天然存在的变体包括e68q,p76l,e79q,y81f,d97n,n100d,t124a,s169n,s169del,f221y,和本公开内容提供了包含g3fc结构域的融合蛋白,所述结构域包含一个或多个这些变化。此外,人免疫球蛋白igg3基因(ighg3)显示特征为不同的铰链长度的结构多态性[参见uniprot p01859]。特别地,变体wis缺少大部分v区和所有的ch1区。除了铰链区的位置11正常存在的链间二硫键之外,在位置7处具有额外的链间二硫键。变体zuc缺少大部分v区、所有的ch1区和部分的铰链。变体omm可表示等位基因形式或另一γ链亚类。本公开内容提供了包含g3fc结构域的另外的融合蛋白,所述结构域包含一种或多种这些变体。
[0378]
可用于人igg4的fc部分(g4fc)的天然氨基酸序列的实例在下文显示(seq id no:212)。虚下划线表示铰链区。部分地,本公开内容提供了包含与seq id no:212具有80%,85%,90%,95%,96%,97%,98%,或99%同一性的氨基酸序列的多肽。
[0379][0380]
对于g1fc序列(seq id no:208),本文提供了fc结构域的各种工程改造的突变,和g2fc,g3fc和g4fc中的类似突变可源自在图5中它们与g1fc的比对。由于不等的铰链长度,基于同种型比对(图5)的类似的fc位置在seq id nos:208,209,210和212中具有不同的氨基酸编号。还可理解,在由铰链、c
h
2和c
h
3区组成的免疫球蛋白序列(例如,seq id nos:208,209,210,211,或212)中给定的氨基酸位置将通过与当编号包括uniprot数据库中整个igg1重链恒定结构域(由c
h
1,铰链,c
h
2,和c
h
3区组成)时的相同位置不同的编号来鉴定。例如,在人g1fc序列(seq id no:208)、人igg1重链恒定结构域(uniprot p01857)和人igg1重链中选择的c
h
3位置之间的对应关系如下。
[0381][0382]
从单一细胞系大规模生产不对称的基于免疫球蛋白的蛋白产生的问题被称为“链缔合问题”。如在产生双特异性抗体中所主要面临的,链缔合问题涉及从当不同的重链和/或轻链在单一细胞系中产生时固有产生的多个组合中有效产生需要的多链蛋白的挑战[参见例如,klein等(2012)mabs 4:653
‑
663]。当两种不同的重链和两种不同的轻链在相同的细胞中产生时,该问题是极其明显的,在该情况下存在总共16种可能的链组合(尽管这些中的一些是相同的),此时仅一种可能通常是需要的。然而,相同的原理说明了掺有仅两种不同的(不对称的)重链的所需多链融合蛋白的降低的收率。
[0383]
在单一细胞系中增加含fc融合多肽链的所需配对以可接受的收率产生优选的不对称的融合蛋白的各种方法是本领域已知的[参见例如,klein等(2012)mabs 4:653
‑
663]。获得需要的含fc链的配对的方法包括但不限于,基于电荷的配对(静电导引)、“结进孔”空间配对、seedbody配对和基于亮氨酸拉链的配对。参见例如,ridgway等(1996)protein eng 9:617
‑
621;merchant等(1998)nat biotech 16:677
‑
681;davis等(2010)protein eng des sel 23:195
‑
202;gunasekaran等(2010);285:19637
‑
19646;wranik等(2012)j biol chem 287:43331
‑
43339;us5932448;wo 1993/011162;wo 2009/089004,和wo 2011/034605。
[0384]
例如,可促进特定多肽之间的相互作用的一种方法是通过改造结节进洞(结进孔)互补区,例如描述于arathoon等,u.s.7,183,076和carter等,u.s.5,731,168。“结节”通过用较大的侧链(例如,酪氨酸或色氨酸)替换来自第一多肽(例如,第一相互作用对)的界面的小的氨基酸侧链构建。与结节相同或类似大小的互补“洞”在第二多肽(例如,第二相互作用对)的界面上任选地通过用较小的氨基酸侧链(例如,丙氨酸或苏氨酸)替换大的氨基酸侧链产生。在合适定位和尺寸的结节或洞存在于第一或第二多肽的界面处时,只需要在邻近界面处各自改造相应的洞或结节。
[0385]
在中性ph(7.0)时,天冬氨酸和谷氨酸带负电荷,和赖氨酸、精氨酸和组氨酸带正电荷。这些带电荷残基可用于促进异二聚体形成,同时妨碍同二聚体形成。吸引相互作用在相反电荷之间发生,和排斥相互作用在相同电荷之间发生。部分地,通过进行带电荷界面残基的定点诱变,本文公开的蛋白复合物利用吸引相互作用以促进异多聚体形成(例如,异二聚体形成),和任选地利用排斥相互作用以妨碍同二聚体形成(例如,同二聚体形成)。
[0386]
例如,igg1 ch3结构域界面包含四个独特的带电荷残基对,其参与结构域
‑
结构域相互作用:asp356
‑
lys439’,glu357
‑
lys370’,lys392
‑
asp399’和asp399
‑
lys409’[第二链中的残基编号通过(’)表示]。应注意,此处用于指定igg1 ch3结构域中的残基的编号方案符合kabat的eu编号方案。由于ch3
‑
ch3结构域相互作用中存在的2
‑
倍对称,每个独特的相互作用在结构中将出现两次(例如,asp
‑
399
‑
lys409’和lys409
‑
asp399’)。在野生型序列中,k409
‑
d399’有利于异二聚体和同二聚体二者形成。第一链中改变电荷极性的单一突变(例如,k409e;正电荷至负电荷)导致对形成第一链同二聚体不利的相互作用。该不利的相互作用由于在相同电荷之间发生的排斥相互作用(负
‑
负;k409e
‑
d399’和d399
‑
k409e’)而产生。第二链中改变电荷极性的类似的突变(d399k’;负电荷至正电荷)导致对于第二链同二聚体形成不利的相互作用(k409
’‑
d399k’和d399k
‑
k409’)。但同时,这两个突变(k409e和d399k’)导致对于异二聚体形成有利的相互作用(k409e
‑
d399k’和d399
‑
k409’)。
[0387]
对异二聚体形成和同二聚体阻碍的静电导引作用可进一步通过另外的带电荷残基的突变来增强,所述残基可以与或可以不与第二链中的相反电荷残基,包括例如,arg355和lys360配对。下表列出了可使用的可能的电荷改变突变(单独或组合),以增强本文公开的肽复合物的异多聚体形成。
[0388][0389]
在一些实施方案中,构成本技术的融合蛋白中的ch3
‑
ch3界面的一个或多个残基被带电荷氨基酸替换,使得相互作用成为静电不利的。例如,界面中的带正电荷氨基酸(例如,赖氨酸、精氨酸或组氨酸)被带负电荷氨基酸(例如,天冬氨酸或谷氨酸)替换。或者,或与前述置换组合,界面中的带负电荷氨基酸被带正电荷氨基酸替换。在某些实施方案中,氨基酸被具有所需的电荷性质的非天然存在的氨基酸替换。应注意,将带负电荷残基(asp或
glu)突变为his导致侧链体积增加,这可引起空间问题。此外,his质子供体
‑
和受体
‑
形式取决于局部环境。设计策略应考虑这些问题。因为界面残基在人和小鼠igg亚类中高度保守,本文公开的静电导引作用可适用于人和小鼠igg1,igg2,igg3和igg4。该策略还可经延伸以改变ch3结构域界面处的不带电荷的残基为带电荷的残基。
[0390]
部分地,使用经工程改造以根据电荷配对互补(静电导引)的fc序列,本公开内容提供了需要的不对称的含fc多肽链的配对。具有静电互补性的一对fc序列之一可任意地融合至构建体的tgf
‑
β超家族i型或ii型受体多肽,含或不含任选的接头,以产生tgf
‑
β超家族i型或ii型受体融合多肽。该单一链可在选择的细胞中同与第一fc互补的fc序列一起共表达,以利于所需的多链构建体(例如,tgf
‑
β超家族受体单臂异聚复合物)的产生。在基于静电导引的该实例中,seq id no:200[人g1fc(e134k/d177k)]和seq id no:201[人g1fc(k170d/k187d)]是互补fc序列的实例,其中工程改造的氨基酸置换用双下划线表示,和构建体的tgf
‑
β超家族i型或ii型受体多肽可融合至seq id no:200或seq id no:201,但不是二者。鉴于在天然hg1fc,天然hg2fc,天然hg3fc和天然hg4fc之间的高程度的氨基酸序列同一性,可以理解在hg2fc,hg3fc或hg4fc的相应位置处的氨基酸置换(见图5)将产生互补fc对,其可代替下文的互补hg1fc对(seq id nos:200和201)而使用。
[0391][0392][0393]
部分地,使用对空间互补性工程改造的fc序列,本公开内容提供了所需的不对称的含fc多肽链的配对。部分地,本公开内容提供了结进孔配对作为空间互补性的实例。具有空间互补性的一对fc序列之一可任意地融合至构建体的tgf
‑
β超家族i型或ii型受体多肽,含或不含任选的接头,以产生tgf
‑
β超家族i型或ii型受体融合多肽。该单一链可在选择的细胞中同与第一fc互补的fc序列一起共表达,以利于所需的多链构建体(例如,tgf
‑
β超家族受体单臂异聚复合物)的产生。在基于结进孔配对的该实例中,seq id no:202[人g1fc(t144y)]和seq id no:203[人g1fc(y185t)]是互补fc序列的实例,其中工程改造的氨基酸置换用双下划线表示,和构建体的tgf
‑
β超家族i型或ii型多肽可融合至seq id no:202或seq id no:203,但不是二者。鉴于在天然hg1fc,天然hg2fc,天然hg3fc和天然hg4fc之间高程度的氨基酸序列同一性,可以理解,在hg2fc,hg3fc,或hg4fc的相应位置处的氨基酸置换(见图5)将产生互补fc对,其可代替下文的互补hg1fc对(seq id nos:202和203)而使用。
[0394][0395]
基于结进孔配对与工程改造的二硫键组合的fc互补性的实例公开于seq id no:204[hg1fc(s132c/t144w)]和seq id no:205[hg1fc(y127c/t144s/l146a/y185v)]。这些序列中的工程改造的氨基酸置换用双下划线表示,和构建体的tgf
‑
β超家族i型或ii型多肽可融合至seq id no:204或seq id no:205,但不是二者。鉴于在天然hg1fc,天然hg2fc,天然hg3fc和天然hg4fc之间高程度的氨基酸序列同一性,可以理解,在hg2fc,hg3fc或hg4fc的相应位置处的氨基酸置换(见图5)将产生互补fc对,其可代替下文的互补hg1fc对(seq id nos:204和205)而使用。
[0396][0397]
部分地,使用经工程改造以产生人igg和iga c
h
3结构域的互相交叉β
‑
链区段的fc序列,本公开内容提供了所需的不对称的含fc多肽链的配对。这样的方法包括使用链交换工程改造结构域(seed)c
h
3异二聚体,其允许形成seedbody融合蛋白[参见例如,davis等(2010)protein eng design sel 23:195
‑
202]。具有seedbody互补性的一对fc序列之一可任意地融合至构建体的tgf
‑
β超家族i型或ii型受体多肽,含或不含任选的接头,以产生tgf
‑
β超家族i型或ii型受体融合多肽。该单一链可在选择的细胞中同与第一fc互补的fc序列一起共表达以有利于所需多链构建体的产生。在基于seedbody(sb)配对的该实例中,seq id no:206[hg1fc(sb
ag
)]和seq id no:207[hg1fc(sb
ga
)]是互补iggfc序列的实例,其中来自iga fc的工程改造的氨基酸置换用双下划线表示,和构建体的tgf
‑
β超家族i型或ii型受体多肽可融合至seq id no:206或seq id no:207,但不是二者。鉴于在天然hg1fc,天然hg2fc,天然hg3fc和天然hg4fc之间高程度的氨基酸序列同一性,可以理解,在hg1fc,hg2fc,hg3fc或hg4fc的相应位置处的氨基酸置换(见图5)将产生fc单体,其可用于下文的
互补igg
‑
iga对(seq id nos:206和207)。
[0398][0399]
部分地,本公开内容提供了所需的不对称的含fc多肽链的配对,其中可裂解的亮氨酸拉链结构域连接至fc c
h
3结构域的c
‑
末端。亮氨酸拉链的连接足以引起异二聚体抗体重链的优先装配。参见例如,wranik等(2012)j biol chem 287:43331
‑
43339。如本文公开的,连接至亮氨酸拉链
‑
形成链的一对fc序列之一可任意地融合至构建体的tgf
‑
β超家族i型或ii型受体多肽,含或不含任选的接头,以产生tgf
‑
β超家族i型或ii型受体融合多肽。该单一链可在选择的细胞中同连接至互补亮氨酸拉链
‑
形成链的fc序列一起共表达,以利于所需多链构建体的产生。纯化后构建体用细菌内切蛋白酶lys
‑
c进行蛋白水解消化可释放亮氨酸拉链结构域,产生fc构建体,其结构与天然
[0400]
fc相同。在基于亮氨酸拉链配对的该实例中,seq id no:213
[0401]
[hg1fc
‑
ap1(酸性)]和seq id no:214[hg1fc
‑
bp1(碱性)]是互补igg fc序列的实例,其中工程改造的互补亮氨酸拉链序列用下划线表示,和构建体的tgf
‑
β超家族i型或ii型受体多肽可融合至seq id no:213或seq id no:214,但不是二者。鉴于在天然hg1fc,天然hg2fc,天然hg3fc和天然hg4fc之间高程度的氨基酸序列同一性,可以理解,连接至hg1fc,hg2fc,hg3fc或hg4fc的亮氨酸拉链
‑
形成序列(含或不含任选的接头)(见图5)将产生fc单体,其可用于下文的互补亮氨酸拉链
‑
形成对(seq id nos:213和214)。
[0402][0403]
应理解,融合蛋白(例如,免疫球蛋白fc融合蛋白)的不同的元件可以与所需功能
性一致的任何方式排列。例如,tgf
‑
β超家族i型或ii型受体多肽结构域可位于异源的结构域的c
‑
末端,或者,异源的结构域可位于tgf
‑
β超家族i型或ii型受体多肽结构域的c
‑
末端。tgf
‑
β超家族i型或ii型受体多肽结构域和异源的结构域在融合蛋白中不需要相邻,和另外的结构域或氨基酸序列可包括在任一结构域的c
‑
或n
‑
末端或在结构域之间。
[0404]
例如,tgf
‑
β超家族i型或ii型受体融合多肽可包含式a
‑
b
‑
c所示的氨基酸序列。b部分对应于tgf
‑
β超家族i型或ii型受体多肽结构域。a和c部分可独立地是零、一个或超过一个氨基酸,和a和c部分二者当存在时对b是异源的。a和/或c部分可通过接头序列连接至b部分。接头可以富含甘氨酸(例如,2
‑
10,2
‑
5,2
‑
4,2
‑
3个甘氨酸残基)或甘氨酸和脯氨酸残基,和可例如包含苏氨酸/丝氨酸和甘氨酸的单一序列,或苏氨酸/丝氨酸和/或甘氨酸的重复序列,例如,ggg(seq id no:58),gggg(seq id no:59),tg4(seq id no:60),sg4(seq id no:61),tg3(seq id no:62),或sg3(seq id no:63)单一态或重复。在某些实施方案中,tgf
‑
β超家族i型或ii型受体融合多肽包含式a
‑
b
‑
c所示的氨基酸序列,其中a是前导(信号)序列,b由tgf
‑
β超家族i型或ii型受体多肽结构域组成,和c是增强体内稳定性、体内半寿期、摄取/给药、组织定位或分布、蛋白复合物形成和/或纯化的一项或多项的多肽部分。在某些实施方案中,tgf
‑
β超家族i型或ii型受体融合多肽包含式a
‑
b
‑
c所示的氨基酸序列,其中a是tpa前导序列,b由tgf
‑
β超家族i型或ii型受体多肽结构域组成,和c是免疫球蛋白fc结构域。优选的融合多肽包含seq id nos:101,103,104,106,107,109,110,112,113,115,116,118,119,121,122,124,125,127,128,130,131,133,134,136,和401
‑
424的任一个所示的氨基酸序列。
[0405]
在一些实施方案中,本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物进一步包含一个或多个异源的部分(结构域)以赋予需要的性质。例如,一些融合结构域可特别用于通过亲和色谱分离融合蛋白。这样的融合结构域的众所周知的实例包括但不限于多组氨酸、glu
‑
glu、谷胱甘肽s
‑
转移酶(gst)、硫氧还蛋白、蛋白a、蛋白g、免疫球蛋白重链恒定区(fc)、麦芽糖结合蛋白(mbp)或人血清白蛋白。为了亲和纯化的目的,使用亲和色谱的相关基质,例如谷胱甘肽
‑
、淀粉酶
‑
和镍
‑
或钴
‑
缀合的树脂。许多这样的基质可以“试剂盒”的形式获得,例如pharmacia gst纯化系统和与(his6)融合配偶体一起使用的qiaexpress
tm
系统(qiagen)。作为另一实例,融合结构域可经选择,以促进配体捕捉物多肽的检测。这样的检测结构域的实例包括各种荧光蛋白(例如,gfp)以及“表位标签”,其通常是特异性抗体可利用的短的肽序列。特异性单克隆抗体可容易利用的众所周知的表位标签包括flag、流感病毒血球凝集素(ha)和c
‑
myc标签。在一些情况下,融合结构域具有蛋白酶裂解位点,例如对于因子xa或凝血酶,其允许相关的蛋白酶部分地消化融合蛋白,从而从其中释放重组蛋白。释放的蛋白然后可通过随后的色谱分离,从融合结构域分离。
[0406]
在某些实施方案中,本公开内容的tgf
‑
β超家族i型和/或ii型受体多肽包含能够使多肽稳定的一种或多种修饰。例如,这样的修饰增强多肽的体外半寿期,增强多肽的循环半寿期和/或减少多肽的蛋白水解降解。这样的稳定修饰包括但不限于,融合多肽(包括例如,包含tgf
‑
β超家族i型或ii型受体多肽结构域和稳定剂结构域的融合多肽),糖基化位点的修饰(包括例如,添加糖基化位点至本公开内容的多肽)和碳水化合物部分的修饰(包括例如,从本公开内容的多肽除去碳水化合物部分)。如本文所用的,术语“稳定剂结构域”不仅是指在融合多肽的情况下的融合结构域(例如,免疫球蛋白fc结构域),而且包括非蛋白
性修饰,例如碳水化合物部分或非蛋白性部分,例如聚乙二醇。
[0407]
在优选的实施方案中,根据本文所述的方法使用的tgf
‑
β超家族受体单臂异多聚体复合物是分离的多肽复合物。如本文所用的,分离的蛋白(或蛋白复合物)或多肽(或多肽复合物)是已经与其天然环境的组分分离的蛋白或多肽。在一些实施方案中,本公开内容的单臂异多聚体复合物被纯化至大于95%,96%,97%,98%,或99%纯度,如通过例如,电泳(例如,sds
‑
page、等电点聚焦(ief)、毛细管电泳)或色谱(例如,离子交换或反相hplc)所测定的。用于评估抗体纯度的方法是本领域众所周知的[参见例如,flatman等,(2007)j.chromatogr.b848:79
‑
87]。
[0408]
在某些实施方案中,本公开内容的tgf
‑
β超家族i型或ii型受体多肽以及其单臂异多聚体复合物可通过各种本领域已知的技术产生。例如,本公开内容的多肽可使用标准蛋白化学技术合成,例如描述于bodansky,m.principles of peptide synthesis,springer verlag,berlin(1993)和grant g.a.(ed.),synthetic peptides:a user's guide,w.h.freeman and company,new york(1992)的那些。此外,自动肽合成仪可市售获得(参见例如,advanced chemtech model 396;milligen/biosearch 9600)。或者,本公开内容的多肽和复合物,包括其片段或变体,可使用各种表达系统[例如,大肠杆菌、中国仓鼠卵巢(cho)细胞、cos细胞、杆状病毒]经重组产生,如本领域众所周知的。在进一步的实施方案中,本公开内容的修饰或未修饰的多肽可通过使用例如,蛋白酶,例如,胰蛋白酶、嗜热菌蛋白酶、糜蛋白酶、胃蛋白酶或配对的碱性氨基酸转换酶(pace),消化重组产生的全长tgfβ超家族i型或ii型受体多肽产生。计算机分析(使用市售可得的软件,例如,macvector,omega,pcgene,molecular simulation,inc.)可用于鉴定蛋白水解裂解位点。
[0409]
3.编码tgfβ超家族受体多肽的核酸
[0410]
在某些实施方案中,本公开内容提供了编码本文公开的tgfβ超家族i型或ii型受体(包括其片段、功能变体和融合蛋白)的分离和/或重组的核酸。例如,seq id no:12编码天然存在的人actriia前体多肽,而seq id no:13编码actriia的加工的细胞外结构域。主题的核酸可以是单链的或双链的。这样的核酸可以是dna或rna分子。这些核酸可用于例如,制备本公开内容的tgf
‑
β超家族单臂异多聚体复合物的方法。
[0411]
如本文所用的,分离的核酸是指已经与其天然环境的组分分开的核酸分子。分离的核酸包括在正常包含核酸分子的细胞中包含的核酸分子,但所述核酸分子存在于染色体外或不同于其天然的染色体位置的染色体位置。
[0412]
在某些实施方案中,编码本公开内容的tgfβ超家族i型或ii型受体多肽的核酸应理解为包括作为seq id nos:7,8,12,13,16,17,20,21,24,25,28,29,32,33,36,37,40,41,44,45,48,49,52,53,69,70,73,74,77,78,81,82,85,86,89,90,93,94,102,105,108,114,117,120,123,126,129,132,135,303,304,307,308,311和312的任何一个的变体的核酸。变体核苷酸序列包括差异一个或多个核苷酸置换、添加或缺失的序列,包括等位基因变体,因此包括不同于seq id nos:7,8,12,13,16,17,20,21,24,25,28,29,32,33,36,37,40,41,44,45,48,49,52,53,69,70,73,74,77,78,81,82,85,86,89,90,93,94,102,105,108,114,117,120,123,126,129,132,135,303,304,307,308,311和312的任何一个指定的核苷酸序列的编码序列。
[0413]
在某些实施方案中,本公开内容的tgfβ超家族i型或ii型受体多肽由分离或重组
的核酸序列编码,所述核酸序列与seq id nos:7,8,12,13,16,17,20,21,24,25,28,29,32,33,36,37,40,41,44,45,48,49,52,53,69,70,73,74,77,78,81,82,85,86,89,90,93,94,102,105,108,114,117,120,123,126,129,132,135,303,304,307,308,311和312具有至少80%,85%,90%,95%,97%,98%,或99%同一性。本领域普通技术人员将理解,与互补于seq id nos:7,8,12,13,16,17,20,21,24,25,28,29,32,33,36,37,40,41,44,45,48,49,52,53,69,70,73,74,77,78,81,82,85,86,89,90,93,94,102,105,108,114,117,120,123,126,129,132,135,303,304,307,308,311和312的序列具有至少80%,85%,90%,95%,97%,98%,或99%同一性的核酸序列也在本公开内容的范围内。在另外的实施方案中,本公开内容的核酸序列可以是分离的,重组的,和/或与异源的核苷酸序列融合,或在dna文库中。
[0414]
在其它实施方案中,本公开内容的核酸还包括在高严格性条件下与seq id nos:7,8,12,13,16,17,20,21,24,25,28,29,32,33,36,37,40,41,44,45,48,49,52,53,69,70,73,74,77,78,81,82,85,86,89,90,93,94,102,105,108,114,117,120,123,126,129,132,135,303,304,307,308,311,和312指定的核苷酸序列、seq id nos:7,8,12,13,16,17,20,21,24,25,28,29,32,33,36,37,40,41,44,45,48,49,52,53,69,70,73,74,77,78,81,82,85,86,89,90,93,94,102,105,108,114,117,120,123,126,129,132,135,303,304,307,308,311,和312的互补序列或其片段杂交的核苷酸序列。本领域普通技术人员将容易理解,促进dna杂交的合适的严格性条件可以改变。例如,可在6.0x氯化钠/柠檬酸钠(ssc)中在约45℃下进行杂交,接着在50℃下用2.0x ssc洗涤。例如,在洗涤步骤中盐浓度可选自在50℃下约2.0x ssc的低严格性至在50℃下约0.2x ssc的高严格性。此外,在洗涤步骤中温度可从在室温约22℃下的低严格性条件增加至在约65℃下的高严格性条件。温度和盐二者可以改变,或温度或盐浓度可以保持恒定,而改变其它变量。在一个实施方案中,本公开内容提供了核酸,其在室温下6x ssc的低严格性条件下杂交,接着在室温下用2x ssc洗涤。
[0415]
由于遗传密码的简并性而不同于seq id nos:7,8,12,13,16,17,20,21,24,25,28,29,32,33,36,37,40,41,44,45,48,49,52,53,69,70,73,74,77,78,81,82,85,86,89,90,93,94,102,105,108,114,117,120,123,126,129,132,135,303,304,307,308,311,和312所示的核酸的分离的核酸也在本公开内容的范围内。例如,许多氨基酸由超过一个三联体指定。规定相同的氨基酸的密码子,或同物异名(例如,cau和cac是组氨酸的同物异名)可导致“沉默”突变,其不影响蛋白的氨基酸序列。然而,预期确实导致主题蛋白的氨基酸序列变化的dna序列多态性将存在于哺乳动物细胞中。本领域技术人员将理解,由于天然等位基因变异,编码特定蛋白的核酸的一个或多个核苷酸(至多约3
‑
5%的核苷酸)的这些变化可存在于给定物种的个体中。任何和所有这样的核苷酸变化和产生的氨基酸多态性在本公开内容的范围内。
[0416]
在某些实施方案中,本公开内容的重组核酸可以与在表达构建体中的一种或多种调节性核苷酸序列可操作连接。调节性核苷酸序列通常适合于用于表达的宿主细胞。对于各种宿主细胞,许多类型的合适表达载体和合适的调节性序列是本领域已知的。通常,所述一种或多种调节性核苷酸序列可包括但不限于,启动子序列、前导或信号序列、核糖体结合位点、转录起始和终止序列、翻译起始和终止序列、和增强子或激活物序列。本公开内容设想了本领域已知的组成型或诱导型启动子。启动子可以是天然存在的启动子,或合并了超
过一个启动子的元件的杂合启动子。表达构建体可存在于细胞的附加体上,例如质粒,或表达构建体可插入染色体中。在一些实施方案中,表达载体包含可选择标记基因以允许选择转化的宿主细胞。可选择标记基因是本领域众所周知的和随使用的宿主细胞而改变。
[0417]
在本公开内容的某些方面,在表达载体中提供主题核酸,所述载体包含编码tgfβ超家族i型或ii型受体多肽和可操作连接至至少一种调节性序列的核苷酸序列。调节性序列是公认的和经选择以指导tgfβ超家族i型或ii型受体多肽的表达。因此,术语调节性序列包括启动子、增强子和其它表达控制元件。实例性调节性序列描述于goeddel;gene expression technology:methods in enzymology,academic press,san diego,ca(1990)。例如,当与其可操作连接时控制dna序列表达的各种表达控制序列的任何一种可用于这些载体以表达编码tgfβ超家族i型或ii型受体多肽的dna序列。这样的可用的表达控制序列包括例如,sv40的早期和晚期启动子、tet启动子、腺病毒或巨细胞病毒立即早期启动子、rsv启动子、lac系统、trp系统、tac或trc系统、表达受t7 rna聚合酶指导的t7启动子、噬菌体λ的主要操纵基因和启动子区、fd外壳蛋白的控制区、3
‑
磷酸甘油酸激酶或其它糖酵解的酶的启动子、酸性磷酸酶(例如,pho5)的启动子、酵母α
‑
交配因子的启动子、杆状病毒系统的多面体启动子和已知控制原核或真核细胞或它们的病毒的基因表达的其它序列,和其各种组合。应理解,表达载体的设计可取决于例如待转化的宿主细胞的选择和/或需要表达的蛋白类型等因素。此外,还应考虑载体的拷贝数、控制拷贝数的能力和由载体编码的任何其它蛋白的表达,例如抗生素标记。
[0418]
本公开内容的重组核酸可通过将克隆的基因或其部分连接至适合于在原核细胞、真核细胞(酵母、禽、昆虫或哺乳动物)或二者中表达的载体来产生。用于产生重组tgfβ超家族i型或ii型受体多肽的表达载体包括质粒和其它载体。例如,合适的载体包括以下类型的质粒:pbr322
‑
衍生的质粒、pembl
‑
衍生的质粒、pex
‑
衍生的质粒、pbtac
‑
衍生的质粒和puc
‑
衍生的质粒,用于在原核细胞例如大肠杆菌中表达。
[0419]
一些哺乳动物表达载体同时包含促进载体在细菌中增殖的原核序列和在真核细胞中表达的一个或多个真核转录单元。pcdnai/amp、pcdnai/neo、prc/cmv、psv2gpt、psv2neo、psv2
‑
dhfr、ptk2、prsvneo、pmsg、psvt7、pko
‑
neo和phyg衍生的载体是适合于转染真核细胞的哺乳动物表达载体的实例。这些载体的一些用来自细菌质粒、例如pbr322的序列修饰,以促进在原核和真核细胞中复制和耐药性选择。或者,病毒例如牛乳头瘤病毒(bpv
‑
1)或爱泼斯坦
‑
巴尔病毒(phebo、prep
‑
衍生的和p205)的衍生株可用于在真核细胞中蛋白瞬时表达。其它病毒(包括逆转录病毒)表达系统的实例可见于下文的基因疗法递送系统的描述。用于制备质粒和转化宿主生物体的各种方法是本领域众所周知的。对于原核和真核细胞二者的其它合适的表达系统,以及通用的重组程序,参见例如,molecular cloning a laboratorymanual,第3版,sambrook,fritsch和maniatis编辑(cold spring harbor laboratory press,2001)。在一些实例中,可能需要通过使用杆状病毒表达系统来表达重组多肽。这样的杆状病毒表达系统的实例包括pvl
‑
衍生的载体(例如pvl1392、pvl1393和pvl941)、pacuw
‑
衍生的载体(例如pacuw1)和pbluebac
‑
衍生的载体(例如包含β
‑
gal的pbluebac iii)。
[0420]
在优选的实施方案中,载体经设计以在cho细胞中产生主题tgfβ超家族i型或ii型受体多肽,例如pcmv
‑
script载体(stratagene,la jolla,calif.)、pcdna4载体
(invitrogen,carlsbad,calif.)和pci
‑
neo载体(promega,madison,wisc.)。如显而易见的,主题基因构建体可用于导致主题tgfβ超家族i型或ii型受体多肽在培养增殖的细胞中表达,例如,以产生蛋白,包括融合蛋白或变体蛋白,用于纯化。
[0421]
本公开内容还涉及用重组基因转染的宿主细胞,所述基因包括一种或多种主题tgfβ超家族i型或ii型受体多肽的编码序列。宿主细胞可以是任何原核或真核细胞。例如,本公开内容的tgfβ超家族i型或ii型受体多肽可在细菌细胞例如大肠杆菌、昆虫细胞(例如,使用杆状病毒表达系统)、酵母或哺乳动物细胞[例如,中国仓鼠卵巢(cho)细胞系]中表达。其它合适的宿主细胞是本领域技术人员已知的。
[0422]
因此,本公开内容还涉及产生主题tgfβ超家族i型或ii型受体多肽的方法。例如,用编码tgfβ超家族i型或ii型受体多肽的表达载体转染的宿主细胞可在合适的条件下培养,以允许表达tgfβ超家族i型或ii型受体多肽发生。多肽可经分泌并从细胞和包含多肽的培养基的混合物分离。或者,tgfβ超家族i型或ii型受体多肽可从收获和裂解的细胞获得的胞质或膜部分分离。细胞培养物包括宿主细胞、培养基和其它副产物。用于细胞培养的合适培养基是本领域众所周知的。主题多肽可使用本领域已知用于纯化蛋白的技术从细胞培养基、宿主细胞或二者分离,所述技术包括离子交换色谱、凝胶过滤色谱、超滤、电泳、用对tgfβ超家族i型或ii型受体多肽的特定表位特异性的抗体的免疫亲和纯化、和用结合融合至tgfβ超家族i型或ii型受体多肽的结构域的试剂的亲和纯化(例如,蛋白a柱可用于纯化tgfβ超家族i型受体
‑
fc或ii型受体
‑
fc融合多肽或蛋白复合物)。在一些实施方案中,tgfβ超家族i型或ii型受体多肽是包含促进其纯化的结构域的融合多肽或蛋白复合物。
[0423]
在一些实施方案中,纯化通过一系列柱色谱步骤实现,包括例如,以任何次序的以下的三种或更多种:蛋白a色谱、q琼脂糖凝胶(sepharose)色谱、苯基琼脂糖凝胶色谱、分子排阻色谱和阳离子交换色谱。纯化可以用病毒过滤和缓冲液交换完成。tgfβ超家族i型受体
‑
fc或ii型受体
‑
fc融合多肽或蛋白复合物可纯化至>90%,>95%,>96%,>98%或>99%的纯度,如通过分子排阻色谱所测定的,和>90%,>95%,>96%,>98%或>99%的纯度,如通过sds page所测定的。目标水平的纯度应该是足以在哺乳动物系统、特别是非
‑
人灵长类动物、啮齿动物(小鼠)和人中实现需要的结果的纯度。
[0424]
在另一实施方案中,编码在重组tgfβ超家族i型或ii型受体多肽的所需部分的n
‑
末端的纯化前导序列、例如聚
‑
(his)/肠激酶裂解位点序列的融合基因,可允许通过亲和色谱使用ni
2+
金属树脂纯化表达的融合蛋白。纯化前导序列然后可随后通过用肠激酶处理除去,以提供纯化的tgfβ超家族i型或ii型受体多肽或蛋白复合物。参见例如,hochuli等(1987)j.chromatography 411:177;和janknecht等(1991)pnas usa 88:8972。
[0425]
用于制备融合基因的技术是众所周知的。基本上,编码不同多肽序列的各种dna片段的连接根据常规技术进行,使用平端或交错端末端连接,限制性酶消化以提供合适的末端,合适时粘端填充,碱性磷酸酶处理以避免不需要的连接,和酶连接。在另一实施方案中,融合基因可通过常规技术合成,包括自动dna合成仪。或者,基因片段的pcr扩增可使用锚定引物进行,其在两个相邻的基因片段之间产生互补的突出端,其可随后被退火以产生嵌合基因序列。参见例如,current protocols in molecular biology,ausubel等编辑,john wiley&sons:1992。
[0426]
4.筛选测定法
[0427]
在某些方面,本公开内容涉及tgfβ超家族i型和ii型受体单臂异多聚体复合物鉴定作为tgfβ超家族受体的激动剂或拮抗剂的化合物(试剂)的用途。通过该筛选鉴定的化合物可经测试以评价其调节组织例如骨、软骨、肌肉、脂肪和/或神经元的能力,评价其体内或体外调节组织生长的能力。这些化合物可例如,在动物模型中测试。
[0428]
存在许多方法来筛选通过靶向tgfβ超家族配体信号传导(例如,smad 2/3和/或smad 1/5/8信号传导)调节组织生长的治疗剂。在某些实施方案中,可进行化合物的高通量筛选以鉴定干扰tgfβ超家族受体
‑
介导的对选择的细胞系的作用的试剂。在某些实施方案中,进行所述测定法以筛选和鉴定特异性抑制或减少tgf
‑
β超家族受体单臂异多聚体复合物与其结合配偶体、例如tgfβ超家族配体(例如,bmp2,bmp2/7,bmp3,bmp4,bmp4/7,bmp5,bmp6,bmp7,bmp8a,bmp8b,bmp9,bmp10,gdf3,gdf5,gdf6/bmp13,gdf7,gdf8,gdf9b/bmp15,gdf11/bmp11,gdf15/mic1,tgf
‑
β1,tgf
‑
β2,tgf
‑
β3,活化素a,活化素b,活化素c,活化素e,活化素ab,活化素ac,活化素ae,活化素bc,活化素be,nodal,gdnf,neurturin,artemin,persephin,mis和lefty)结合的化合物。或者,所述测定法可用于鉴定增强tgf
‑
β超家族受体单臂异多聚体复合物与其结合配偶体例如tgfβ超家族配体结合的化合物。在进一步的实施方案中,化合物可通过其与本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物相互作用的能力来鉴定。
[0429]
各种测定法形式符合要求,并且根据本公开内容,本文未明确描述的那些将仍然被本领域普通技术人员所理解。如本文所述的,本发明的试验化合物(试剂)可通过任何组合化学方法产生。或者,主题化合物可以是体内或体外合成的天然存在的生物分子。待测试作为组织生长的调节剂的能力的化合物(试剂)可例如,通过细菌、酵母、植物或其它生物体产生(例如,天然产物),通过化学产生(例如,小分子,包括拟肽)或通过重组产生。本发明考虑的试验化合物包括无肽基有机分子、肽、多肽、拟肽、糖、激素和核酸分子。在某些实施方案中,试验试剂是具有小于约2,000道尔顿的分子量的小的有机分子。
[0430]
本公开内容的试验化合物可作为单一的离散实体提供,或在较大复杂性的文库(例如通过组合化学制备)中提供。这些文库可包含,例如,醇、烷基卤化物、胺、酰胺、酯、醛、醚和其它类型的有机化合物。试验化合物至试验系统的呈递可以为分离的形式或作为化合物的混合物,由其是在初始筛选步骤中。任选地,化合物可任选地用其它化合物衍生,和具有促进化合物的分离的衍生基团。衍生基团的非限制性实例包括生物素、荧光素、洋地黄毒苷、绿色荧光蛋白、同位素、多组氨酸、磁珠、谷胱甘肽s
‑
转移酶(gst)、光可激活交联剂或其任何组合。
[0431]
在测试化合物的文库和天然提取物的许多药物
‑
筛选程序中,需要高通量测定法以最大化在给定的时间内调查的化合物的数量。在无细胞系统中进行的测定法(例如可用纯化或半纯化的蛋白得到),通常优选作为“初级”筛选,因为它们可经产生以允许由试验化合物介导的分子靶标改变的快速发展和相对容易检测。此外,试验化合物的细胞毒性或生物利用率的影响在体外系统中一般可忽略,该测定法而是主要关注药物对分子靶标的影响,如可以在tgf
‑
β超家族受体单臂异多聚体复合物和其结合配偶体(例如,bmp2,bmp2/7,bmp3,bmp4,bmp4/7,bmp5,bmp6,bmp7,bmp8a,bmp8b,bmp9,bmp10,gdf3,gdf5,gdf6/bmp13,gdf7,gdf8,gdf9b/bmp15,gdf11/bmp11,gdf15/mic1,tgf
‑
β1,tgf
‑
β2,tgf
‑
β3,活化素a,活化素b,活化素c,活化素e,活化素ab,活化素ac,活化素ae,活化素bc,活化素be,nodal,
gdnf,neurturin,artemin,persephin,mis和lefty)之间的结合亲和力的改变所证明的。
[0432]
仅为说明,在本公开内容的实例性筛选测定法中,对于测定法的目的在合适时,目的化合物与通常能够结合tgf
‑
β超家族配体的分离和纯化的tgf
‑
β超家族受体单臂异多聚体复合物接触。然后向化合物和tgf
‑
β超家族受体单臂异多聚体复合物的混合物中加入合适的tgf
‑
β超家族配体(例如,bmp2,bmp2/7,bmp3,bmp4,bmp4/7,bmp5,bmp6,bmp7,bmp8a,bmp8b,bmp9,bmp10,gdf3,gdf5,gdf6/bmp13,gdf7,gdf8,gdf9b/bmp15,gdf11/bmp11,gdf15/mic1,tgf
‑
β1,tgf
‑
β2,tgf
‑
β3,活化素a,活化素b,活化素c,活化素e,活化素ab,活化素ac,活化素ae,活化素bc,活化素be,nodal,gdnf,neurturin,artemin,persephin,mis和lefty)。单臂异多聚体和超家族配体之间的复合物的检测和定量提供了用于测定化合物抑制(或加强)tgf
‑
β超家族受体单臂异多聚体复合物和其结合蛋白之间的复合物形成的功效的工具。化合物的功效可通过从使用各种浓度的试验化合物获得的数据产生剂量
‑
反应曲线进行评价。此外,还可进行对照测定以提供用于比较的基线。例如,在对照测定中,将分离和纯化的tgf
‑
β超家族配体加入包含tgf
‑
β超家族受体单臂异多聚体复合物的组合物中,和在缺少试验化合物的情况下量化异多聚体
‑
配体复合物的形成。将理解,一般而言,反应物可混合的顺序可以改变,和可以同时混合。此外,代替纯化的蛋白,细胞提取物和裂解物可用于呈递合适的无细胞测定系统。
[0433]
tgf
‑
β超家族受体单臂异多聚体复合物与另一蛋白的结合可通过各种技术检测。例如,复合物形成的调节可使用例如,可检测标记的蛋白例如放射性标记的(例如,
32
p,
35
s,
14
c或3h)、荧光标记的(例如,fitc)或酶标记的tgf
‑
β超家族受体单臂异多聚体复合物和其结合蛋白,通过免疫测定法或通过色谱检测来量化。
[0434]
在某些实施方案中,本公开内容考虑了荧光极化测定法和荧光共振能量转移(fret)测定法在直接或间接测量tgf
‑
β超家族受体单臂异多聚体复合物和其结合蛋白之间相互作用的程度中的用途。此外,其它检测模式,例如基于光波导的那些(参见例如,pct公布wo96/26432和美国专利号5,677,196)、表面等离子体共振(spr)、表面电荷传感器和表面力传感器,与本公开内容的许多实施方案相容。
[0435]
此外,本公开内容考虑了相互作用俘获测定法,亦称为“双杂交测定法”用于鉴定破坏或增强tgf
‑
β超家族受体单臂异多聚体复合物和其结合配偶体之间相互作用的试剂的用途。参见例如,美国专利号5,283,317;zervos等(1993)cell 72:223
‑
232;madura等(1993)j biol chem 268:12046
‑
12054;bartel等(1993)biotechniques 14:920
‑
924;和iwabuchi等(1993)oncogene 8:1693
‑
1696)。在特定的实施方案中,本公开内容考虑了反转双杂交系统鉴定离解tgf
‑
β超家族受体单臂异多聚体复合物和其结合蛋白之间相互作用的化合物(例如,小分子或肽)的用途[参见例如,vidal和legrain,(1999)nucleic acids res 27:919
‑
29;vidal和legrain,(1999)trends biotechnol 17:374
‑
81;和美国专利号5,525,490;5,955,280;和5,965,368]。
[0436]
在某些实施方案中,主题化合物通过其与本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物相互作用的能力来鉴定。在化合物和tgf
‑
β超家族受体单臂异多聚体复合物之间的相互作用可以是共价或非共价的。例如,这样的相互作用可在蛋白水平上使用体外生物化学方法,包括光交联、放射性标记的配体结合和亲和色谱鉴定。参见例如,jakobywb等(1974)methods in enzymology 46:1。在某些情况下,化合物可在基于机制的测定法中
筛选,例如检测结合tgf
‑
β超家族受体单臂异多聚体复合物的化合物的测定法。这可包括固相或液相结合事件。或者,编码tgf
‑
β超家族受体单臂异多聚体复合物的基因可用报告系统(例如,β
‑
半乳糖苷酶、萤光素酶或绿色荧光蛋白)转染至细胞和针对文库优选地通过高通量筛选或以文库的各个成员进行筛选。可使用其它基于机制的结合测定法;例如,检测自由能变化的结合测定法。结合测定法可用固定至孔、珠或芯片的,或通过固定的抗体捕获的,或通过毛细管电泳解析的靶标进行。结合的化合物可通常使用比色终点或荧光或表面等离子体共振检测。
[0437]
5.实例性治疗用途
[0438]
在某些实施方案中,本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合可用于治疗或预防与tgfβ超家族受体(例如,alk1,alk2,alk3,alk4,alk5,alk6,alk7,actriia,actriib,bmprii,tgfbrii,和misrii)和/或tgfβ超家族配体(例如,bmp2,bmp2/7,bmp3,bmp4,bmp4/7,bmp5,bmp6,bmp7,bmp8a,bmp8b,bmp9,bmp10,gdf3,gdf5,gdf6/bmp13,gdf7,gdf8,gdf9b/bmp15,gdf11/bmp11,gdf15/mic1,tgf
‑
β1,tgf
‑
β2,tgf
‑
β3,活化素a,活化素b,活化素c,活化素e,活化素ab,活化素ac,活化素ae,活化素bc,活化素be,nodal,gdnf,neurturin,artemin,persephin,mis和lefty)的异常活性有关的疾病或病况。这些疾病、病症或病况在本文通常称为“tgfβ超家族
‑
相关病况”。在某些实施方案中,本发明提供了通过给予有需要的个体治疗有效量的本文所述的tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合,治疗或预防所述个体的方法。术语"受试者"、"个体"或"患者"在说明书全文中可互换。本公开内容的任何tgf
‑
β超家族受体单臂异多聚体复合物可潜在地单独或组合使用,用于本文公开的治疗用途。这些方法的目的特别在于治疗性和预防性治疗哺乳动物,包括例如,啮齿动物、灵长类动物和人。
[0439]
如本文所用的,“预防”病症或病况的治疗剂是指在统计学样品中,相对于未治疗的对照样品在治疗的样品中减少病症或病况的发生,或相对于未治疗的对照样品延迟病症或病况的一种或多种症状的发生或减少其严重性的化合物。如本文所用的术语“治疗”包括一旦已经确立,则改善或消除病况。在任一情况下,预防或治疗可在由医生或其它健康护理提供者提供的诊断和给予治疗剂的预期结果中辨别。
[0440]
天然tgfβ超家族受体
‑
配体复合物在组织生长以及早期发育过程,例如各种结构的正确形成中或在一种或多种发育后能力,包括性发育、脑垂体激素产生以及骨和软骨产生中起重要作用。因此,tgfβ超家族
‑
相关病况/病症包括异常组织生长和发育缺陷。此外,tgfβ超家族
‑
相关病况包括但不限于,细胞生长和分化的病症,例如炎症、变态反应、自身免疫疾病、感染性疾病和肿瘤。
[0441]
实例性tgfβ超家族
‑
相关病况包括神经肌肉病症(例如,肌营养不良和肌肉萎缩)、充血性阻塞性肺病(和与copd有关的肌肉消瘦)、肌肉消瘦综合征、肌少症、恶病质、脂肪组织病症(例如,肥胖)、2型糖尿病(niddm、成年型糖尿病)和骨退化疾病(例如,骨质疏松症)。其它实例性tgfβ超家族
‑
相关病况包括肌肉退化和神经肌肉病症、组织修复(例如,伤口愈合)、神经变性疾病(例如,肌萎缩侧索硬化)和免疫学病症(例如,与淋巴细胞的异常增殖或功能有关的病症)。
[0442]
在某些实施方案中,本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β
超家族受体单臂异多聚体复合物的组合用作肌营养不良的治疗的一部分。术语“肌营养不良”是指一组退化肌肉疾病,特征为逐渐虚弱,和骨骼肌肉,有时心脏和呼吸肌肉的退化。肌营养不良是遗传病症,特征为渐进性肌肉消瘦和虚弱,其以肌肉的微观变化开始。因为肌肉随时间退化,人的肌肉力量下降。可用包括主题tgf
‑
β超家族受体单臂异多聚体复合物的方案治疗的实例性肌营养不良包括:杜氏肌营养不良(dmd)、贝克肌营养不良(bmd)、埃
‑
德二氏肌营养不良(edmd)、角膜缘带肌营养不良(lgmd)、面肩胛肱骨营养不良(fsh或fshd)(亦称为landouzy
‑
dejerine)、强直性肌营养不良(mmd;亦称为斯太纳特氏病)、眼咽肌营养不良(opmd)、远端肌营养不良(dd)、先天性肌营养不良(cmd)。
[0443]
杜氏肌营养不良(dmd)在19世纪60年代首次由法国神经学家guillaume benjamin amandduchenne描述。贝克肌营养不良(bmd)根据德国医生peter emil becker命名,其在20世纪50年代首次描述了这种dmd变体。dmd是在男性中最频繁遗传的疾病之一,影响1/3,500的男孩。当位于x染色体的短臂上的肌养蛋白基因缺陷时,dmd发生。因为男性仅携带一个拷贝的x染色体,因此他们仅具有一个拷贝的肌养蛋白基因。没有肌养蛋白,在收缩和舒张循环期间肌肉容易受到损害。尽管在疾病早期肌肉通过再生得到补偿,但晚期在肌肉上祖细胞不能跟上进行中的损害和健康肌肉被无功能的纤维脂肪组织代替。
[0444]
bmd由肌养蛋白基因的不同突变产生。bmd患者具有一些肌养蛋白,但其数量不足或质量差。一些肌养蛋白的存在保护bmd患者的肌肉免于与dmd患者一样严重或快速地退化。
[0445]
动物中的研究表明,抑制gdf8信号传导途径可有效地治疗dmd和bmd患者的各种方面的疾病(bogdanovich等,2002,nature420:418
‑
421;pistilli等,2011,am jpathol 178:1287
‑
1297)。因此,本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物可用作gdf8抑制剂(拮抗剂),和构成在dmd和bmd患者体内通过gdf8和/或相关的tgfβ超家族配体阻断信号传导的可选方式。
[0446]
类似地,本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物可提供在需要肌肉生长的其它疾病情况下增加肌肉质量的有效方式。例如,肌萎缩侧索硬化(als),亦称为lou gehrig病或运动神经元疾病,是一种慢性的渐进性和难治的cns病症,其攻击作为起始骨骼肌肉收缩所需的中枢神经系统的组分的运动神经元。在als中,运动神经元退化和最终死亡,和虽然人脑正常保持完整功能和警觉,但肌肉收缩的起始在脊椎水平上被阻断。发生als的个体通常在40
‑
70岁,和退化的第一运动神经元是神经支配臂或腿的那些。als患者可具有行走障碍,可掉东西,跌倒,口齿不清,和不受控制地笑或哭。随着疾病进展,四肢的肌肉开始从不使用到萎缩。肌肉虚弱变得衰弱,和患者最终需要轮椅或限制于床上。大多数als患者在疾病发作后3
‑
5年死于呼吸衰竭或呼吸机辅助样肺炎的并发症。
[0447]
通过tgf
‑
β超家族受体单臂异多聚体复合物促进肌肉质量增加还可能使患有肌肉消瘦疾病的那些患者获益。gonzalez
‑
cadavid等(同上)报道了gdf8表达与人中的无脂肪体重负相关,和gdf8基因的表达增加与aids消瘦综合征的男性中体重减轻有关。通过抑制aids患者中的gdf8功能,如果没有完全消除的话,aids的至少某些症状可得到减轻,因此显著改进aids患者的生活质量。
[0448]
因为gdf8功能丢失还涉及在没有减少营养物摄入的情况下脂肪减少(zimmers等,同上;mcpherron和lee,同上),主题tgf
‑
β超家族受体单臂异多聚体复合物可进一步用作减
慢或预防肥胖和2型糖尿病的发生的治疗剂。
[0449]
癌症食欲缺乏
‑
恶病质综合征是癌症的最虚弱和威胁生命的方面。该综合征是许多类型的癌症的共同特征(存在于大约80%的死亡癌症患者中),并且不仅是生活质量差和对化学疗法反应差的原因,而且是比具有相当的肿瘤但没有体重减轻的患者更短存活时间的原因。如果在6个月时间内大于5%的发病前体重的无意体重减轻发生,则通常认为恶病质在癌症患者中。与食欲缺乏、脂肪和肌肉组织消瘦以及心理苦恼有关,恶病质从癌症和宿主之间的复杂相互作用产生。癌症恶病质影响细胞因子产生、脂质运动和蛋白水解
‑
诱导因子的释放和中间代谢的改变。尽管食欲缺乏是常见的,但仅食物摄入降低不能够解释癌症患者中见到的身体组成的变化,和增加营养物摄入不能逆转消瘦综合征。目前,没有控制或逆转恶病质过程的治疗。因为发现在成年小鼠中gdf8的系统过量表达诱导显著的肌肉和脂肪损失,类似于人恶病质综合征中所见到的(zimmers等,同上),因此主题tgf
‑
β超家族受体单臂异多聚体复合物药物组合物可有利地用于预防、治疗或减轻其中需要肌肉生长的恶病质综合征的症状。
[0450]
在某些实施方案中,本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合可用于诱导骨和/或软骨形成,预防骨丢失,增加骨矿化,预防骨的去矿化和/或增加骨密度的方法。tgf
‑
β超家族受体单臂异多聚体复合物可用于经诊断有亚临床低骨密度的患者,作为针对发生骨质疏松症的保护措施。
[0451]
在一些实施方案中,本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合可在人和其它动物中在骨折和软骨缺陷的治愈中发现医学功用。主题方法和组合物还可在关闭以及打开骨折复位术中以及在人工关节的改进固定中具有预防用途。由成骨剂诱导的从新骨形成可用于修复先天的、创伤
‑
诱导的或由肿瘤切除引起的颅面缺损,和还可用于美容整形手术。此外,本发明的方法和组合物可用于治疗牙周疾病和其它牙齿修复过程。在某些情况下,tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合可提供吸引骨
‑
形成细胞、刺激骨
‑
形成细胞的生长或诱导骨
‑
形成细胞的祖细胞分化的环境。本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物还可用于治疗骨质疏松症。此外,tgf
‑
β超家族受体单臂异多聚体复合物可用于修复软骨缺陷和预防/逆转骨关节炎。
[0452]
rosen等(编辑)primer on the metabolic bone diseases and disorders of mineral metabolism,第7版.american society for bone and mineral research,washington d.c.(通过引用并入本文)提供了可用tgf
‑
β超家族受体单臂异多聚体复合物或用tgf
‑
β超家族受体单臂异多聚体复合物的组合治疗的骨病症的深入讨论。本文提供了部分列表。本发明的方法和组合物可应用于特征为或引起骨丢失的病况,例如骨质疏松症(包括继发性骨质疏松症)、甲状旁腺功能亢进、慢性肾病矿物骨病症、性激素丧失或消除(例如,雄激素和/或雌激素)、糖皮质激素治疗、类风湿性关节炎、重度烧伤、甲状旁腺功能亢进、高钙血症、低钙血症、低磷酸盐血症、骨软化症(包括肿瘤
‑
诱导的骨软化症)、高磷酸盐血症、维生素d缺乏、甲状旁腺功能亢进(包括家族性甲状旁腺功能亢进)和假性甲状旁腺功能减退症、肿瘤转移至骨、因为肿瘤或化学疗法导致的骨丢失、骨和骨髓的肿瘤(例如,多发性骨髓瘤)、缺血性骨病症、牙周疾病和口腔骨丢失、库兴氏病、佩吉特病、甲状腺毒症、慢性腹泻体质或吸收不良、肾小管性酸中毒或神经性厌食。本发明的方法和组合物还可应用
于特征为不能骨形成或愈合的病况,包括非连接骨折、以其他方式减慢愈合的骨折、胎儿和新生儿骨发育异常(例如,低钙血症、高钙血症、钙受体缺陷和维生素d缺乏)、骨坏死(包括颚的骨坏死)和骨发生不全。另外,合成代谢作用将导致这样的拮抗剂减少与骨损坏或侵蚀有关的骨疼痛。作为抗
‑
再吸收作用的结果,这样的拮抗剂可用于治疗异常骨形成的病症,例如成骨细胞肿瘤转移(例如,与原发性前列腺或乳腺癌有关)、成骨骨肉瘤、骨硬化症、进行性骨干发育异常、骨内膜骨质增生、骨斑症和肢骨纹状肥大。可治疗的其它病症包括纤维性结构不良和软骨发育异常。
[0453]
在另一具体的实施方案中,本公开内容提供了用于修复骨折和与软骨和/或骨缺陷有关的其它病况或牙周疾病的治疗方法和组合物。本发明进一步提供了用于伤口愈合和组织修复的治疗方法和组合物。伤口的类型包括但不限于,烧伤、切伤和溃疡。参见例如,pct公布号wo 84/01106。这样的组合物包含治疗有效量的至少一种本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物与药学上可接受的溶媒、载体或基质的混合物。
[0454]
在一些实施方案中,本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合可应用于引起骨丢失的病况,例如骨质疏松症、甲状旁腺功能亢进、库兴氏病、甲状腺毒症、慢性腹泻体质或吸收不良、肾小管性酸中毒或神经性厌食。通常应理解,作为女性,具有低体重和导致久坐生活方式是骨质疏松症的风险因素(骨矿物密度丢失,导致骨折风险)。然而,骨质疏松症也可自长期使用某些药物产生。自药物或另一医学病况产生的骨质疏松症被称为继发性骨质疏松症。在库兴氏病中,身体产生的过量皮质醇导致骨质疏松症和骨折。与继发性骨质疏松症有关的最常见的药物是皮质类固醇,一类像皮质醇(由肾上腺天然产生的激素)一样起作用的药物。尽管需要足够水平的甲状腺激素以发育骨骼,但过量的甲状腺激素可随时间减少骨量。包含铝的抗酸药当有肾问题的人、特别是经过透析的那些人以高剂量服用时,可导致骨丢失。可引起继发性骨质疏松症的其它药物包括用于预防癫痫的苯妥英(dilantin)和巴比妥类;甲氨蝶呤(rheumatrex,immunex,folex pfs),一些类型的关节炎、癌症和免疫病症的药物;环孢霉素(sandimmune,neoral),用于治疗一些自身免疫疾病和在器官移植患者中抑制免疫系统的药物;黄体化激素
‑
释放激素激动剂(lupron,zoladex),用于治疗前列腺癌和子宫内膜异位症;肝素(calciparine,liquaemin),一种抗凝血药物;和考来烯胺(questran)和考来替泊(colestid),用于治疗高胆固醇。自癌症疗法产生的骨丢失是广泛公认的,和被称为癌症疗法
‑
诱导的骨丢失(ctibl)。骨转移可在骨中产生洞,其可通过用tgf
‑
β超家族异多聚体复合物治疗来纠正。骨丢失也可由牙龈疾病引起,一种其中位于牙龈隐窝中的细菌产生毒素和有害的酶的慢性感染。
[0455]
在进一步的实施方案中,本公开内容提供了用于治疗与异常或不需要的骨生长有关的疾病或病症的方法和治疗剂。例如,具有先天性病症进行性骨化性纤维发育不良(fop)的患者受累于在软组织中自发地或响应于组织创伤的进行性异位骨生长,对生活质量具有重大影响。另外,异常骨生长可在髋置换手术后发生,因此破坏手术结果。这是较常见的病理性骨生长的实例,和其中主题方法和组合物可在治疗上有用的情况。所述方法和组合物也可用于治疗其它形式的异常骨生长(例如,创伤、烧伤或脊椎损伤后骨的病理性生长)和用于治疗或预防结合转移性前列腺癌或骨肉瘤所见到的与异常骨生长有关的不需要的病况。
[0456]
在某些实施方案中,本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合可用于在癌症患者中促进骨形成。因为肿瘤
‑
诱导的骨丢失、骨转移和治疗剂,具有某些肿瘤(例如,前列腺、乳腺、多发性骨髓瘤或引起甲状旁腺功能亢进的任何肿瘤)的患者对于骨丢失是高风险的。这样的患者可用tgf
‑
β超家族受体单臂异多聚体复合物或复合物的组合治疗,甚至在不存在骨丢失或骨转移的证据时。还可监测患者的骨丢失或骨转移的证据,和在指示物表明风险增加的情况下,可用tgf
‑
β超家族受体单臂异多聚体复合物治疗患者。一般而言,dexa扫描用于评价骨密度的变化,而骨重塑的指示物可用于评价骨转移的可能性。可监测血清标记。骨特异性碱性磷酸酶(bsap)是存在于成骨细胞中的酶。bsap的血液水平在具有骨转移和导致骨重塑增加的其它病况的患者中增加。鲑鱼降钙素注射剂和前胶原肽也与骨形成和骨转移有关。在由前列腺癌引起的骨转移的患者中,和在较小程度上在来自乳腺癌的骨转移中,已检测到bsap增加。bmp7水平在已转移至骨的前列腺癌中很高,但在由于膀胱、皮肤、肝脏或肺癌导致的骨转移中不高。i型羧基
‑
末端尾肽(ictp)是一种在骨的再吸收期间形成的胶原中存在的交键。因为骨经常打破和再形成,ictp存在于整个身体内。然而,在骨转移的部位,水平显著高于正常骨的区域。ictp以高水平存在于由于前列腺、肺和乳腺癌导致的骨转移中。另一胶原交键,i型n
‑
末端尾肽(ntx),在骨周转期间与ictp一起产生。ntx的量在由许多不同类型的癌症引起的骨转移中增加,所述癌症包括肺、前列腺和乳腺癌。此外,ntx的水平随骨转移的进展而增加。因此,该标记可用于检测转移以及测量疾病的程度。再吸收的其它标记包括吡啶诺林和脱氧吡啶诺林。再吸收标记或骨转移标记的任何增加表明在患者中对用tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合的疗法的需要。
[0457]
在另一实施方案中,tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合可用于慢性肾病矿物骨病症(ckd
‑
mbd)的患者,其为一种自肾病产生的相关骨骼、心血管和矿物
‑
代谢病症的广泛综合征。ckd
‑
mbd包括各种骨骼病理,通常称为肾骨营养不良(rod),其是用tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合治疗的优选实施方案。根据不同的病原性因子的相对贡献,rod表现为多样的骨重塑病理模式(hruska等,2008,chronic kidney disease mineral bone disorder(ckd
‑
mbd);in rosen等(编辑)primer on the metabolic bone diseases and disorders ofmineral metabolism,7th ed.american society for bone and mineral research,washington d.c.,pp 343
‑
349)。范围的一端是具有尿毒症骨营养不良和低骨周转的rod,特征为低数量的活性重塑部位,明显抑制的骨形成和低骨再吸收。另外一端是具有甲状旁腺功能亢进、高骨周转和纤维性骨炎的rod。鉴于tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合可发挥合成代谢和抗再吸收作用,这些试剂可用于在rod病理范围内的患者。
[0458]
本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合可与其它骨
‑
活性药剂联合给予。联合给予可通过给予单一共制剂,通过同时给予,或通过以分开的时间给予来实现。如果与其它骨
‑
活性剂一起给予,tgf
‑
β超家族受体单臂异多聚体复合物可能是特别有利的。患者可获益于联合接受tgf
‑
β超家族受体单臂异多聚体复合物和服用钙补充剂、维生素d、合适的运动和/或,在一些情况下,其它药物。其它药物的实例包括,二膦酸盐(阿伦膦酸盐、伊班膦酸盐和利塞膦酸盐)、降钙素、雌激
素、甲状旁腺激素和雷洛昔芬。二膦酸盐(阿伦膦酸盐、伊班膦酸盐和利塞膦酸盐)、降钙素、雌激素和雷洛昔芬影响骨重塑周期,和分类为抗
‑
再吸收药物。骨重塑由两个不同阶段组成:骨再吸收和骨形成。抗
‑
再吸收药物减慢或停止骨
‑
重塑周期的骨
‑
再吸收部分,但不减慢周期的骨
‑
形成部分。结果是,新形成以比骨再吸收更大的速率继续进行,和骨密度可随时间而增加。特立帕肽,一种甲状旁腺激素形式,增加在骨重塑周期中骨形成的速率。阿伦膦酸盐经批准用于预防(5mg每天或35mg每周一次)和治疗(10mg每天或70mg每周一次)经绝后骨质疏松症。阿伦膦酸盐减少骨丢失,增加骨密度和减少脊柱、腕和髋骨折的风险。阿伦膦酸盐还经批准用于治疗在男性和女性中由于长期使用这些药物(即,泼尼松和可的松)导致的糖皮质激素
‑
诱导的骨质疏松症和用于治疗男性的骨质疏松症。阿伦膦酸盐加维生素d经批准用于治疗经绝后女性的骨质疏松症(70mg每周一次加维生素d),和用于治疗以改进骨质疏松症的男性的骨量。伊班膦酸盐经批准用于预防和治疗经绝后骨质疏松症。作为每月一次丸剂(150mg)服用,伊班膦酸盐应在每月的同一天服用。伊班膦酸盐减少骨丢失,增加骨密度和减少脊柱骨折的风险。利塞膦酸盐经批准用于预防和治疗经绝后骨质疏松症。每日(5mg剂量)或每周(35mg剂量或35mg剂量与钙)服用,利塞膦酸盐减慢骨丢失,增加骨密度和减少脊柱和非
‑
脊柱骨折的风险。利塞膦酸盐还经批准用于男性和女性使用以预防和/或治疗自长期使用这些药物(即,泼尼松或可的松)产生的糖皮质激素
‑
诱导的骨质疏松症。降钙素是天然存在的激素,其参与钙调节和骨代谢。在绝经期后超过5年的女性中,降钙素减慢骨丢失,增加脊椎骨密度,和可减轻与骨折有关的疼痛。降钙素减少脊椎骨折的风险。降钙素可作为注射剂(50
‑
100iu每日)或鼻喷雾剂(200iu每日)获得。
[0459]
患者还可获益于联合接受tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合和另外的骨
‑
活性药物。雌激素疗法(et)/激素疗法(ht)经批准用于预防骨质疏松症。et已表明减少骨丢失,增加在脊柱和髋二者中的骨密度和在经绝后女性中减少髋和脊椎骨折的风险。et最常见以递送大约0.3mg每日的低剂量或大约0.625mg每日的标准剂量的丸剂或皮肤贴剂的形式给予,和甚至当70岁后开始也是有效的。当雌激素单独服用时,其可增加女性发生子宫衬里的癌症(子宫内膜癌症)的风险。为了消除该风险,健康护理提供者为具有完整子宫的那些女性处方激素黄体酮与雌激素的组合(激素置换疗法或ht)。et/ht减轻绝经期症状和已表明对骨健康具有有益作用。副作用可包括阴道出血、乳房触痛、情绪障碍和胆囊疾病。雷洛昔芬,60mg每天,经批准用于预防和治疗经绝后骨质疏松症。已开发一类称为选择性雌激素受体调节剂(serm)的药物来提供雌激素的有益作用,而没有其潜在的缺点。雷洛昔芬增加骨量和减少脊柱骨折的风险。尚未获得数据来证实雷洛昔芬可减少髋和其它非
‑
脊柱骨折的风险。特立帕肽,一种甲状旁腺激素形式,经批准用于在经绝后女性和具有骨折高风险的男性中治疗骨质疏松症。该药物刺激新骨形成和显著增加骨矿物密度。在经绝后女性中,在脊柱、髋、足、肋骨和腕中注意到骨折减少。在男性中,在脊柱中注意到骨折减少,但没有足够的数据评价在其它部位的骨折减少。特立帕肽作为每日注射剂经自我
‑
给予至多24个月。
[0460]
在其它实施方案中,tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合可用于在动物中调节体脂肪含量和用于治疗或预防与其相关的病况,和特别是,与其相关的危及健康的病况。根据本发明,调节(控制)体重可以指减少或增加体重,减少或增加体重增加速率,或增加或减少体重减轻速率,和还包括有效维持或不
显著改变体重(例如,对抗可以其他方式增加或减少体重的外部或内部影响)。本公开内容的一个实施方案涉及通过给予有需要的动物(例如,人)本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合来调节体重。
[0461]
在一些实施方案中,本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合可用于在动物中减少体重和/或减少体重获得,和更特别是用于治疗或改善有肥胖风险或患有肥胖的患者的肥胖。在另一具体的实施方案中,本发明涉及用于治疗不能获得或保持体重的动物(例如,具有消瘦综合征的动物)的方法和化合物。这样的方法有效增加体重和/或质量,或减少体重和/或质量损失,或改进与不需要的低(例如,不健康)体重和/或质量有关的病况,或由其引起的病况。此外,高胆固醇病症(例如,高胆固醇血症或血脂紊乱)可用本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合治疗
[0462]
在某些方面,本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合可用于在有需要的受试者中增加红细胞水平,治疗或预防贫血,和/或治疗或预防无效的红细胞生成。在某些方面,本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合可与用于增加红细胞水平的常规治疗方法组合使用,特别是用于治疗多因素来源的贫血的那些治疗方法。用于增加红细胞水平的常规治疗方法包括例如,红细胞输注、给予一种或多种epo受体激活剂、生血干细胞移植、免疫抑制性生物制剂和药物(例如,皮质类固醇)。在某些实施方案中,本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合可用于在有需要的受试者中治疗或预防无效的红细胞生成和/或与无效的红细胞生成有关的病症。在某些方面,本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合可与用于治疗或预防贫血或无效的红细胞生成病症的常规治疗方法组合使用,特别是用于治疗多因素来源的贫血的那些治疗方法。
[0463]
一般而言,治疗或预防描述于本公开内容的疾病或病况通过以"有效量"给予本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合实现。试剂的有效量是指以需要的剂量和时间,有效实现所需的治疗或预防结果的量。本公开内容的试剂的"治疗有效量"可根据因素例如个体的疾病状态、年龄、性别和体重,和试剂在个体中引发所需的反应的能力而改变。"预防有效量"是指以需要的剂量和时间,有效实现所需的预防结果的量。
[0464]
在某些实施方案中,tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合,任选地与epo受体激活剂组合,可用于在健康个体和选择的患者群中增加红细胞、血红蛋白或网织红细胞水平。合适的患者群的实例包括具有不需要的低红细胞或血红蛋白水平的那些,例如具有贫血的患者,和有风险发生不需要的低红细胞或血红蛋白水平的那些,例如将要经历重大手术或可导致明显血液损失的其它程序的那些患者。在一个实施方案中,具有足够的红细胞水平的患者用tgf
‑
β超家族受体单臂异多聚体复合物或tgf
‑
β超家族受体单臂异多聚体复合物的组合治疗,以增加红细胞水平,然后抽血和贮存用于后面输注使用。
[0465]
本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物,任选地与epo受体激活剂组合,可用于在具有贫血的患者中增加红细胞水平、血红蛋白水平和/或血细胞比
容水平。当在人中观察血红蛋白和/或血细胞比容水平时,尽管考虑个体变化,但对于合适的年龄和性别类别,小于正常的水平可表明贫血。例如,10
‑
12.5g/dl和通常约11.0g/dl的血红蛋白水平被认为在健康成人的正常范围内,尽管关于疗法,较低的目标水平可引起较少的心血管副作用[参见例如,jacobs等(2000)nephrol dial transplant 15,15
‑
19]。或者,血细胞比容水平(细胞占据血液样品的体积百分数)可用作贫血的度量。健康个体的血细胞比容水平范围对于成年男性为约41
‑
51%和对于成年女性为35
‑
45%。在某些实施方案中,患者可用意欲恢复患者至目标水平的红细胞、血红蛋白和/或血细胞比容的剂量方案治疗。因为血红蛋白和血细胞比容水平在人之间变化,最优的是,目标血红蛋白和/或血细胞比容水平可对每个患者个性化。
[0466]
贫血经常在具有组织损伤、感染和/或慢性疾病、特别是癌症的患者中观察到。在一些受试者中,贫血通过在骨髓中低红细胞生成素水平和/或对红细胞生成素的反应不足判别[参见例如,adamson(2008)harrison’s principles ofinternal medicine,17th ed.;mcgraw hill,new york,pp 628
‑
634]。贫血的潜在原因包括例如,失血、营养缺乏(例如,蛋白的饮食摄取减少)、药物反应、与骨髓有关的各种问题和许多疾病。更特别地,贫血与各种病症和病况有关,包括例如,骨髓移植;实体瘤(例如,乳腺癌、肺癌和结肠癌);淋巴系统的肿瘤(例如,慢性淋巴细胞性白血病、非霍奇金淋巴瘤和霍奇金淋巴瘤);生血系统的肿瘤(例如,白血病、骨髓增生异常综合征和多发性骨髓瘤);放射疗法;化学疗法(例如,包含铂的方案);炎性和自身免疫疾病,包括但不限于,类风湿性关节炎、其它炎性关节炎、系统性红斑狼疮(sle)、急性或慢性皮肤疾病(例如,银屑病)、炎性肠病(例如,克罗恩病和溃疡性结肠炎);急性或慢性肾疾病或衰竭,包括特发性或先天性病况;急性或慢性肝脏疾病;急性或慢性初血;其中由于患者异体
‑
或自身
‑
抗体导致和/或因为宗教原因(例如,一些耶和华见证会会员)输注红细胞是不可能的情况;感染(例如,疟疾和骨髓炎);血红蛋白病,包括例如,镰状细胞疾病(贫血)、地中海贫血;药物使用或滥用(例如,酒精滥用);具有因任何原因而无法输注的贫血的儿科患者;和老年患者或具有潜在的心肺疾病的患者,其具有由于关于循环过载的顾虑而不能接受输注的贫血[参见例如,adamson(2008)harrison’s principles of internal medicine,17th ed.;mcgrawhill,new york,pp 628
‑
634]。
[0467]
许多因素可促进癌症
‑
相关的贫血。一些与疾病过程本身以及炎性细胞因子例如白细胞介素
‑
1、干扰素
‑
γ和肿瘤坏死因子的产生有关[bron等(2001)semin oncol 28(suppl 8):1
‑
6]。在其影响中,炎症诱导重要的铁
‑
调节性肽hepcidin,从而抑制铁从巨噬细胞输出和总体上限制铁用于红细胞生成的利用率[参见例如,ganz(2007)j am soc nephrol 18:394
‑
400]。通过各种途径的失血也可促进癌症
‑
相关的贫血。由于癌症进展导致的贫血的流行率随癌症类型而改变,范围为前列腺癌的5%直至多发性骨髓瘤的90%。癌症
‑
相关的贫血对于患者具有重大后果,包括疲劳和生活质量减少、治疗功效减少和死亡率增加。在一些实施方案中,本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物,任选地与epo受体激活剂组合,可用于治疗癌症
‑
相关的贫血。
[0468]
增殖不足性贫血可由骨髓的原发性功能障碍或衰竭引起。增殖不足性贫血包括:慢性疾病的贫血、肾疾病的贫血、与代谢减退状态有关的贫血和与癌症有关的贫血。在每种这些类型中,对于观察到的贫血程度,内源红细胞生成素水平不适当地低。其它增殖不足性贫血包括:早期铁
‑
缺乏性贫血和由对骨髓的损害引起的贫血。在这些类型中,对于观察到
的贫血程度,内源红细胞生成素水平适当地升高。突出的实例是由癌症和/或化学治疗药物或癌症放射疗法引起的骨髓抑制。临床试验的广泛评审发现,在化学疗法后轻度贫血可在100%的患者中发生,而更严重的贫血可在至多80%的所述患者中发生[参见例如,groopman等(1999)j natl cancer inst 91:1616
‑
1634]。骨髓抑制性药物包括例如:1)烷基化剂,例如氮芥(例如,美法仑)和亚硝基脲(例如,链佐星);2)抗代谢物,例如叶酸拮抗剂(例如,甲氨蝶呤)、嘌呤类似物(例如,硫鸟嘌呤)和嘧啶类似物(例如,吉西他滨);3)细胞毒性抗生素,例如蒽环类抗生素(例如,多柔比星);4)激酶抑制剂(例如,吉非替尼);5)有丝分裂抑制剂,例如紫杉烷类(例如,紫杉醇)和长春花碱类(例如,长春瑞滨);6)单克隆抗体(例如,利妥昔单抗);和7)拓扑异构酶抑制剂(例如,托泊替康和依托泊苷)。此外,导致低代谢速率的病况可产生轻度至中度的增殖不足性贫血。在这些病况中包括内分泌缺乏状态。例如,贫血可在阿狄森氏病、甲状腺功能减退症、甲状旁腺功能亢进或经阉割或用雌激素治疗的男性中发生。在一些实施方案中,本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物,任选地与epo受体激活剂组合,可用于治疗过度增殖性贫血。
[0469]
慢性肾疾病有时与增殖不足性贫血有关,和贫血的程度随肾损伤的水平的严重性而改变。这样的贫血主要是由于红细胞生成素的产生不足和红细胞的存活减少导致。慢性肾疾病通常在数年或数十年的时间内逐渐进行至晚期(阶段5)疾病,此时对于患者存活需要透析或肾移植。贫血经常在该过程的早期发生和随疾病进展而恶化。肾疾病的贫血的临床结果被充分记载,和包括发生左心室肥大、认知功能受损、生活质量减少和免疫功能改变[参见例如,levin等(1999)am jkidney dis 27:347
‑
354;nissenson(1992)am j kidney dis 20(suppl 1):21
‑
24;revicki等(1995)am jkidneydis 25:548
‑
554;gafter等,(1994)kidney int45:224
‑
231]。在一些实施方案中,本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物,任选地与epo受体激活剂组合,可用于治疗与急性或慢性肾疾病或衰竭有关的贫血。
[0470]
由足够体积的急性失血、例如创伤或产后出血导致的贫血被称为急性出血后贫血。急性失血最初导致没有贫血的血容量不足,因为存在成比例消耗的rbc以及其它血液成分。然而,血容量不足快速触发将流体从血管外转移至血管腔隙的生理机制,其导致血液稀释和贫血。如果长期这样,失血逐渐消耗体铁贮存和最终导致铁缺乏。在一些实施方案中,本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物,任选地与epo受体激活剂组合,可用于治疗由急性失血导致的贫血。
[0471]
铁
‑
缺乏性贫血是增加铁缺乏的分级进展的最终阶段,其包括负铁平衡和铁
‑
缺乏性红细胞生成为中间阶段。铁缺乏可自增加的铁需求、减少的铁摄取或增加的铁损失导致,如在病况例如妊娠、饮食不足、肠吸收不良、急性或慢性炎症和急性或慢性失血中例举的。以轻度至中度的该类型贫血,骨髓保持增殖不足,和rbc形态主要是正常的;然而,甚至轻度贫血可产生一些小红细胞性血红蛋白过少rbc,和至重度铁
‑
缺乏性贫血的转变伴随有骨髓的过度增殖和逐渐增加的流行性小红细胞性和血红蛋白过少rbc[参见例如,adamson(2008)harrison’s principles ofinternal medicine,17th ed.;mcgraw hill,new york,pp 628
‑
634]。对于铁
‑
缺乏性贫血的合适疗法取决于其原因和严重性,以口服铁制剂、胃肠外铁制剂和rbc输注作为主要的常规选项。在一些实施方案中,本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物,任选地与epo受体激活剂组合,可用于治疗
慢性铁
‑
缺乏。
[0472]
骨髓增生异常综合征(mds)是血液学病况的多样化合集,特征为骨髓血细胞的无效产生和转化为急性骨髓性白血病的风险。在mds患者中,血液干细胞不成熟为健康的红细胞、白细胞或血小板。mds病症包括例如,难治性贫血、具有环形铁粒幼红细胞的难治性贫血、具有过量的胚细胞的难治性贫血、具有转化中的过量胚细胞的难治性贫血、具有多谱系发育异常的难治性血细胞减少和与分离的5q染色体异常有关的骨髓增生异常综合征。因为这些病症表现为生血细胞的数量和质量的不可逆缺陷,大多数mds患者患有慢性贫血。因此,mds患者最终需要血液输注和/或用生长因子(例如,红细胞生成素或g
‑
csf)治疗以增加红细胞水平。然而,许多mds患者由于这样的疗法的频率而产生副作用。例如,接受频繁红细胞输注的患者由于累积过多的铁可显示组织和器官损伤。因此,本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物,可用于治疗具有mds的患者。在某些实施方案中,患有mds的患者可使用本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物,任选地与epo受体激活剂组合治疗。在其它实施方案中,患有mds的患者可使用本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物和一种或多种另外的治疗mds的治疗剂的组合治疗,所述另外的治疗剂包括例如,沙利度胺、lenalidomide、azacitadine、地西他滨、红细胞生成素、去铁胺、抗胸腺细胞球蛋白和filgrastrim(g
‑
csf)。
[0473]
最初根据铁动力学研究与再生障碍性贫血、出血或外周溶血区分[参见例如,ricketts等(1978)clin nucl med 3:159
‑
164],无效的红细胞生成描述了一组多样化的贫血,其中成熟的rbc的产生小于鉴于骨髓中存在的红细胞前体(成红细胞)的数量所预期的[tanno等(2010)adv hematol 2010:358283]。在这样的贫血中,尽管红细胞生成素水平升高,但由于成熟的rbc的无效产生,组织持续缺氧。最终发生恶性循环,其中升高的红细胞生成素水平驱动成红细胞的大量扩增,潜在地导致由于髓外红细胞生成产生的脾大(脾脏增大)[参见例如,aizawa等(2003)am j hematol 74:68
‑
72]、成红细胞
‑
诱导的骨病理[参见例如,di matteo等(2008)j biol regul homeost agents 22:211
‑
216]和组织铁过载,甚至在缺少治疗性rbc输注的情况下[参见例如,pippard等(1979)lancet 2:819
‑
821]。因此,通过增加红细胞生成的有效性,本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物可打破前述循环,因此不仅减轻潜在的贫血,而且还减轻升高的红细胞生成素水平、脾大、骨病理和组织铁过载的相关并发症。在一些实施方案中,本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物可用于治疗或预防无效的红细胞生成,包括贫血和升高的epo水平以及并发症例如脾大、成红细胞
‑
诱导的骨病理、铁过载和它们伴随的病理。随脾大一起,这样的病理包括胸或腹疼痛和网状内皮增生。髓外血细胞生成可不仅在脾中发生,而且还潜在地在其它组织中以髓外生血假肿瘤的形式发生[参见例如,musallam等(2012)cold spring harb perspectmed2:a013482]。随成红细胞
‑
诱导的骨病理一起,伴随的病理包括低骨矿物密度、骨质疏松症和骨疼痛[参见例如,haidar等(2011)bone 48:425
‑
432]。随铁过载一起,伴随的病理包括hepcidin抑制和膳食铁吸收过多[参见例如,musallam等(2012)blood rev 26(suppl 1):s16
‑
s19]、多种内分泌病和肝脏纤维化/硬化[参见例如,galanello等(2010)orphanet j rare dis 5:11]和铁
‑
过载心肌病[lekawanvijit等,2009,can j cardiol 25:213
‑
218]。
[0474]
无效红细胞生成的最常见的原因是地中海贫血综合征,遗传性血红蛋白病,其中
完整α
‑
和β
‑
血红蛋白链的产生的不平衡导致在成红细胞成熟期间细胞凋亡增加[参见例如,schrier(2002)curr opinhematol9:123
‑
126]。总的来说,地中海贫血是全世界最常见的遗传病症之一,具有改变的流行病学模式,其预期促进美国和全球的增长中的公众健康问题[vichinsky(2005)annnyacad sci 1054:18
‑
24]。地中海贫血综合征根据其严重性来命名。因此,α
‑
地中海贫血包括轻型α
‑
地中海贫血(亦称为α
‑
地中海贫血特征;两个受影响的α
‑
球蛋白基因)、血红蛋白h疾病(三个受影响的α
‑
球蛋白基因)和重型α
‑
地中海贫血(亦称为胎儿水肿;四个受影响的α
‑
球蛋白基因)。β
‑
地中海贫血包括轻型β
‑
地中海贫血(亦称为β
‑
地中海贫血特征;一个受影响的β
‑
球蛋白基因)、中间型β
‑
地中海贫血(两个受影响的β
‑
球蛋白基因)、血红蛋白e地中海贫血(两个受影响的β
‑
球蛋白基因)和重型β
‑
地中海贫血(亦称为库利氏贫血;两个受影响的β
‑
球蛋白基因,导致完全缺失β
‑
球蛋白蛋白)。β
‑
地中海贫血影响多个器官,与重大的发病率和死亡率有关,并且目前需要终生护理。尽管在最近几年由于使用定期血液输注结合铁螯合作用,β
‑
地中海贫血患者的预期寿命已增加,但由于输注和铁的过度胃肠吸收导致的铁过载可引起严重的并发症,例如心脏病、血栓症、性腺功能减退症、甲状腺功能减退症、糖尿病、骨质疏松症和骨质减少[参见例如,rund等(2005)n engl j med 353:1135
‑
1146]。在某些实施方案中,本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物,任选地与epo受体激活剂组合,可用于治疗或预防地中海贫血综合征。
[0475]
在一些实施方案中,本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物,任选地与epo受体激活剂组合,除了地中海贫血综合征以外还可用于治疗无效红细胞生成的病症。这样的病症包括铁粒幼细胞贫血(遗传性的或获得性的);红细胞生成异常贫血(i和ii型);镰状细胞贫血;遗传性球形细胞增多症;丙酮酸激酶缺乏;巨幼红细胞性贫血,潜在地由病况例如叶酸缺乏(由于先天性疾病、摄取减少或需求增加)、钴胺素缺乏(由于先天性疾病、恶性贫血、吸收受损、胰腺机能不全或摄取减少)、某些药物或不清楚原因(先天性红细胞生成异常贫血、难治性巨幼红细胞性贫血或红白血病)引起;骨髓痨性贫血,包括例如,骨髓纤维化(骨髓化生)和脊髓痨;先天性红细胞生成卟啉病;和铅中毒。
[0476]
在某些实施方案中,本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物可与无效红细胞生成的支持性疗法组合使用。这样的疗法包括用红细胞或全血输注输注以治疗贫血。在慢性或遗传性贫血中,铁体内稳态的正常机制由于重复输注而破坏,最终导致毒性和在重要组织例如心脏、肝脏和内分泌腺中可能致命的铁累积。因此,用于长期受累于无效红细胞生成的患者的支持性疗法还包括用于一种或多种铁
‑
螯合分子治疗以促进在尿和/或粪便中的铁排泄,从而阻止或逆转组织铁过载[参见例如,hershko(2006)haematologica91:1307
‑
1312;cao等(2011),pediatr rep 3(2):e17]。有效的铁
‑
螯合剂应该能够选择性地结合和中和三价铁,无
‑
运铁蛋白结合的铁的氧化形式,其通过催化产生羟基和氧化产物而可能是大多数铁毒性的原因[参见例如,esposito等(2003)blood 102:2670
‑
2677]。这些试剂在结构上是不同的,但全都具有氧或氮供体原子,其能够以1:1(六齿螯合剂)、2:1(三齿螯合剂)或3:1(二齿螯合剂)的化学计量与单个铁原子形成中和性八面体配位复合物[kalinowski等(2005)pharmacol rev57:547
‑
583]。一般而言,有效的铁
‑
螯合剂还是相对低分子量的(例如,小于700道尔顿),在水和脂质二者中的溶解度能够接近受累组织。铁
‑
螯合分子的具体实例包括需要每日胃肠外给予的去铁胺(一种细菌来源的六齿
螯合剂),和口服活性的合成试剂去铁酮(二齿螯合物)和地拉罗斯(三齿螯合物)。由同日给予两种铁
‑
螯合剂组成的组合疗法显示在对螯合单一疗法无响应的患者中以及在克服用单独的去铁胺的患者顺应性差的问题中具有前途[cao等(2011)pediatr rep 3(2):e17;galanello等(2010)annnyacad sci 1202:79
‑
86]。
[0477]
如本文所用的,“与
……
组合”或“联合给予”是指任何形式的给予,使得第二疗法在体内仍有效(例如,两种化合物在患者中同时有效,其可包括两种化合物的协同作用)。有效性可能不关联到试剂在血液、血清或血浆中可测量的浓度。例如,不同的治疗化合物可在相同的制剂中或在分开的制剂中同时或序贯地,和以不同的时间表给予。因此,接受这样的治疗的个体可获益于不同的疗法的组合效果。本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物可与一种或多种其它另外的试剂或支持性疗法同时、在其之前或随后给予。一般而言,各治疗剂以对该特定试剂所确定的剂量和/或时间表给予。在方案中使用的特定组合应考虑本公开内容的拮抗剂与疗法和/或待实现的需要的治疗效果的相容性。
[0478]
在某些实施方案中,本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物可与用于无效红细胞生成的hepcidin或hepcidin激动剂组合使用。主要在肝脏中产生的循环多肽hepcidin因为其诱导铁转运蛋白(一种位于吸收性肠细胞、肝细胞和巨噬细胞上的铁
‑
输出蛋白)降解的能力而被认为是一种铁代谢的主要调节剂。广义地讲,hepcidin减少细胞外铁的利用率,因此hepcidin激动剂可有益于无效红细胞生成的治疗[参见例如,nemeth(2010)adv hematol2010:750643]。该观点得到了在β
‑
地中海贫血的小鼠模型中增加的hepcidin表达的有益作用的支持[gardenghi等(2010)j clin invest120:4466
‑
4477]。
[0479]
本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物,任选地与epo受体激活剂组合,还适合于治疗混乱的rbc成熟的贫血,其特征部分地在于尺寸过小(小红细胞性)、尺寸过大(大红细胞性)、畸形或异常变色(血红蛋白过少)的rbc。
[0480]
在某些实施方案中,本公开内容提供了在有需要的个体中通过给予个体治疗有效量的本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物和epo受体激活剂治疗或预防贫血的方法。在某些实施方案中,本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物可与epo受体激活剂组合使用以在对epo的不良反应易感的患者中减少这些激活剂的需要的剂量。这些方法可用于患者的治疗性和预防性治疗。
[0481]
本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物可与epo受体激活剂组合使用以实现红细胞增加,特别是在较低剂量范围的epo受体激活剂的情况下。这在减少已知的脱靶作用和与高剂量的epo受体激活剂有关的风险方面可能是有利的。epo的主要不良反应包括例如,血细胞比容或血红蛋白水平的过度增加,和红细胞增多症。升高的血细胞比容水平可导致高血压(更特别是高血压的加重)和血管血栓症。已报道的epo的其它不良反应,其中一些涉及高血压,是头痛、流感
‑
样综合征、分流堵塞、心肌梗死和大脑惊厥(由于血栓症导致)、高血压脑病和红细胞血细胞发育不全。参见例如,singibarti(1994)j.clin investig 72(suppl 6),s36
‑
s43;horl等(2000)nephrol dial transplant 15(suppl 4),51
‑
56;delanty等(1997)neurology49,686
‑
689;和bunn(2002)n engl jmed 346(7),522
‑
523)。
[0482]
鉴于本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物通过与epo不同的机制
起作用,这些拮抗剂可用于增加对epo响应不良的患者中的红细胞和血红蛋白水平。例如,本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物可对其中给予正常至增加剂量的epo(>300iu/kg/周)不导致血红蛋白水平增加达到目标水平的患者是有益的。具有不足的epo响应的患者见于所有类型的贫血,但更多数量的无响应者已在具有癌症的患者和具有晚期肾疾病的患者中特别频繁地见到。不足的epo响应可以是组成性的(在用epo首次治疗时观察到)或获得性的(在用epo重复治疗时观察到)。
[0483]
在某些实施方案中,本公开内容提供了用于管理已用本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物治疗或是用本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物治疗的候选者的患者的方法,其通过测量患者的一个或多个血液学参数进行。血液学参数可用于评价对于作为用本公开内容的拮抗剂治疗的候选者的患者合适的剂量,在治疗期间监测血液学参数,评价在用本公开内容的一种或多种拮抗剂治疗期间是否调整剂量,和/或评价本公开内容的一种或多种拮抗剂的合适的维持剂量。如果一个或多个血液学参数在正常水平之外,本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物的剂量可减少、延迟或终止。
[0484]
可根据本文提供的方法测量的血液学参数包括例如,红细胞水平、血压、铁贮量和在体液中存在的与增加的红细胞水平有关的其它因素,使用公认的方法进行。这样的参数可使用来自患者的血液样品测定。红细胞水平、血红蛋白水平和/或血细胞比容水平的增加可引起血压增加。
[0485]
在一个实施方案中,如果在作为用本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物治疗的候选者的患者中一个或多个血液学参数在正常范围之外或在正常值的高侧,则开始给予本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物可被延迟,直至血液学参数自然或通过治疗干预已返回正常或可接受的水平。例如,如果候选患者是高血压的或前
‑
高血压的,则患者可用降低血压的试剂治疗以降低患者的血压。可使用适合用于个体患者的病况的任何降低血压的试剂,包括例如,利尿剂、肾上腺素能抑制剂(包括α阻滞剂和β阻滞剂)、血管舒张剂、钙通道阻滞剂、增压素
‑
转换酶(ace)抑制剂或增压素ii受体阻滞剂。或者,血压可使用饮食和运动方案治疗。类似地,如果候选患者具有低于正常值或在正常值的低侧的铁贮量,则患者可用合适的饮食方案和/或铁补充剂治疗,直至患者的铁贮量已回到正常或可接受的水平。对于具有高于正常红细胞水平和/或血红蛋白水平的患者,则给予本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物可被延迟,直至水平已回到正常或可接受的水平。
[0486]
在某些实施方案中,如果在作为用本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物治疗的候选者的患者中一个或多个血液学参数在正常范围之外或在正常值的高侧,则开始给予可不被延迟。然而,本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物的剂量或给药频率可设定在减少在给予本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物时产生的血液学参数不可接受的增加的风险的量。或者,可为患者开发治疗方案,其合并了本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物与解决不需要的血液学参数水平的治疗剂。例如,如果患者具有升高的血压,则可设计包括给予本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物和降低血压的试剂的治疗方案。对于具有低于需要的铁贮量的患者,可开发本公开内容的一种或多种
tgf
‑
β超家族受体单臂异多聚体复合物和铁补充的治疗方案。
[0487]
在一个实施方案中,可对作为用本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物治疗的候选者的患者建立一个或多个血液学参数的基线参数,和基于该基线值对患者建立合适的剂量方案。或者,基于患者的病史建立的基线参数可用于获悉对患者合适的剂量方案。例如,如果健康的患者具有建立的高于定义的正常范围的基线血压读出,在用本公开内容的一种或多种tgf
‑
β超家族异多聚体复合物治疗之前使患者的血压在对于一般群体认为是正常的范围内可能不是需要的。在用本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物治疗前,对于一个或多个血液学参数,患者的基线值还可用作相关的比较值以监测在用本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物治疗期间血液学参数的任何变化。
[0488]
在某些实施方案中,在正用本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物治疗的患者中测量一个或多个血液学参数。血液学参数可用于在治疗期间监测患者,和允许调整或终止本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物的剂量或另一治疗剂的另外剂量。例如,如果给予本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物导致血压、红细胞水平或血红蛋白水平增加,或铁贮量减少,则本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物的剂量可在量或频率方面减少以降低本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物对一个或多个血液学参数的影响。如果给予本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物导致不利于患者的一个或多个血液学参数变化,则本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物的剂量可被临时终止,直到血液学参数回到可接受的水平,或永久终止。类似地,如果在减少给予本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物的剂量或频率后一个或多个血液学参数不在可接受的范围内,则可终止剂量。作为减少或终止本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物的剂量的备选方案,或除了减少或终止本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物的剂量的之外,患者可给予解决不需要的血液学参数水平的另外的治疗剂,例如降低血压的试剂或铁补充剂。例如,如果用本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物治疗的患者具有升高的血压,则本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物的剂量可以相同的水平继续进行,和将降低血压的试剂加入至治疗方案;本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物的剂量可减少(例如,在量和/或频率方面),和将降低血压的试剂加入至治疗方案;或本公开内容的一种或多种tgf
‑
β超家族受体单臂异多聚体复合物的剂量可终止,和患者可用降低血压的试剂治疗。
[0489]
6.药物组合物
[0490]
在某些方面,本公开内容的tgf
‑
β超家族受体单臂异多聚体复合物可单独或作为药物制剂(亦称为治疗组合物或药物组合物)的组分给予。药物制剂是指呈允许其中包含的活性成分(例如,本公开内容的试剂)的生物学活性是有效的形式和不包含对制剂所给予的受试者有不可接受的毒性的另外的组分的制剂。主题化合物可经配制以对人或兽医药物使用方便的任何方式给予。例如,本公开内容的一种或多种试剂可用药学上可接受的载体配制。药学上可接受的载体是指药物制剂中并非活性成分的成分,其通常对受试者是无毒的。药学上可接受的载体包括但不限于,缓冲剂、赋形剂、稳定剂和/或防腐剂。一般而言,本公
开内容使用的药物制剂当给予受试者时是无热原、生理学可接受的形式。并非本文所述的那些的治疗上有用的试剂,其可任选地包括在上述制剂中,可在本公开内容的方法中与主题试剂组合给予。
[0491]
在某些实施方案中,组合物将胃肠外给予[例如,通过静脉内(i.v.)注射、动脉内注射、骨内注射、肌内注射、鞘内注射、皮下注射或皮内注射]。适合于胃肠外给予的药物组合物可包含本公开内容的一种或多种试剂与一种或多种药学上可接受的无菌等渗水性或非水性溶液、分散液、混悬液或乳液、或可在临用前重构成无菌可注射溶液或分散液的无菌粉末的组合。可注射溶液或分散液可包含抗氧化剂、缓冲剂、抑菌剂、助悬剂、增稠剂或赋予制剂与预期受体的血液等渗的溶质。可用于本公开内容的药物制剂的合适的水性和非水性载体的实例包括水、乙醇、多元醇(例如,甘油、丙二醇、聚乙二醇等)、植物油(例如,橄榄油)、可注射有机酯(例如,油酸乙酯)和其合适的混合物。适当的流动性可例如,通过使用包衣材料(例如,卵磷脂),在分散液的情况下通过维持需要的粒度,和通过使用表面活性剂来维持。
[0492]
在一些实施方案中,本公开内容的治疗方法包括从植入物或装置,系统或局部给予药物组合物。此外,药物组合物可以递送至靶组织部位(例如,骨髓或肌肉)的形式被包封或注射。在某些实施方案中,本公开内容的组合物可包括能够递送本公开内容的一种或多种试剂至靶组织部位(例如,骨髓或肌肉),提供用于开发的组织的结构,和最好能够再吸收至体内的基质。例如,基质可提供本公开内容的一种或多种试剂的减慢释放。这样的基质可由目前用于其它植入的医学应用的材料构成。
[0493]
基质材料的选择可基于以下一项或多项进行:生物相容性、生物降解能力、机械性质、美容外观和界面性质。主题组合物的特定应用将定义合适的制剂。用于组合物的潜在基质可以是生物可降解的和化学上确定的硫酸钙、磷酸三钙、羟基磷灰石、聚乳酸和聚酐。其它潜在的材料是生物可降解的和生物学上充分确定的,包括例如,骨或皮肤胶原。其它基质包括纯的蛋白或细胞外基质组分。其它潜在的基质是非
‑
生物可降解的和化学上确定的,包括例如,烧结的羟基磷灰石、生物玻璃、铝酸盐或其它陶瓷。基质可包含任何上述类型的材料的组合,包括例如,聚乳酸和羟基磷灰石或胶原和磷酸三钙。生物陶瓷可在组分中改变(例如,钙
‑
铝酸盐
‑
磷酸盐)和经加工以改变孔径、粒度、颗粒形状和生物降解能力的一项或多项。
[0494]
在某些实施方案中,本公开内容的药物组合物可经局部给予。“局部应用”或“局部地”意指药物组合物与身体表面(包括例如,皮肤、伤口部位和粘膜)接触。局部药物组合物可具有各种应用形式,和通常包括含药物层,在局部给予组合物后其适合位于组织附近或与组织直接接触。适合于局部给予的药物组合物可包含组合配制为液体、凝胶、霜剂、洗剂、软膏剂、泡沫、糊剂、擦剂(putty)、半固体或固体的本公开内容的一种或多种tgfβ超家族受体单臂异多聚体复合物。呈液体、凝胶、霜剂、洗剂、软膏剂、泡沫、糊剂或擦剂形式的组合物可通过涂覆、喷雾、涂抹、轻拍或滚擦组合物至靶组织上来施用。组合物还可被浸渍至无菌敷料、透皮贴剂、石膏和绷带中。擦剂、半固体或固体形式的组合物可以是可变形的。它们可以是弹性的或非弹性的(例如,柔性或刚性)。在某些方面,组合物形成复合材料的一部分,和可包括纤维、颗粒或具有相同或不同的组分的多个层。
[0495]
呈液体形式的局部组合物可包括药学上可接受的溶液剂、乳剂、微乳剂和混悬剂。
除了活性成分外,液体剂量形式可包含本领域常用的惰性稀释剂,包括例如,水或其它溶剂、增溶剂和/或乳化剂[例如,乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苯甲醇、苯甲酸苯甲酯、丙二醇或1,3
‑
丁二醇、油(例如,棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油和芝麻油)、甘油、四氢呋喃甲醇、聚乙二醇、去水山梨糖醇的脂肪酸酯和其混合物]。
[0496]
局部凝胶、霜剂、洗剂、软膏剂、半固体或固体组合物可包括一种或多种增稠剂,例如多糖、合成的聚合物或基于蛋白的聚合物。在本发明的一个实施方案中,在本文中胶凝剂是一种合适地是无毒的和产生需要的粘度的试剂。增稠剂可包括聚合物、共聚物和其单体:乙烯基吡咯烷酮、甲基丙烯酰胺、丙烯酰胺n
‑
乙烯基咪唑、羧基乙烯基、乙烯基酯、乙烯基醚、硅酮、聚环氧乙烷、聚乙二醇、乙烯基醇、丙烯酸钠、丙烯酸酯、马来酸、nn
‑
二甲基丙烯酰胺、双丙酮丙烯酰胺、丙烯酰胺、丙烯酰基吗啉、普卢兰尼克、胶原、聚丙烯酰胺、聚丙烯酸酯、聚乙烯基醇、聚乙烯、聚乙烯基硅酸酯、被糖(例如,蔗糖、葡萄糖、葡糖胺、半乳糖、海藻糖、甘露糖或乳糖)取代的聚丙烯酸酯、酰胺基丙烷磺酸、四甲氧基原硅酸酯、甲基三甲氧基原硅酸酯、四烷氧基原硅酸酯、三烷氧基原硅酸酯、二醇、丙二醇、甘油、多糖、藻酸盐、葡聚糖、环糊精、纤维素、改性纤维素、氧化纤维素、壳聚糖、甲壳质、瓜儿胶、角叉菜胶、透明质酸、菊糖、淀粉、改性淀粉、琼脂糖、甲基纤维素、植物树胶、hylaronans、水凝胶、明胶、氨基葡聚糖、羧基甲基纤维素、羟基乙基纤维素、羟基丙基甲基纤维素、果胶、低
‑
甲氧基果胶、交联葡聚糖、淀粉
‑
丙烯腈接枝共聚物、淀粉钠聚丙烯酸酯、羟基乙基甲基丙烯酸酯、羟基乙基丙烯酸酯、聚乙烯、聚乙基乙烯基醚、聚甲基甲基丙烯酸酯、聚苯乙烯、聚氨酯、聚烷酸酯、聚乳酸、聚乳酸酯、聚(3
‑
羟基丁酸酯)、磺酸化水凝胶、amps(2
‑
丙烯酰胺基
‑2‑
甲基
‑1‑
丙磺酸)、sem(磺基乙基甲基丙烯酸酯)、spm(磺基丙基甲基丙烯酸酯)、spa(磺基丙基丙烯酸酯)、n,n
‑
二甲基
‑
n
‑
甲基丙烯基氧基乙基
‑
n
‑
(3
‑
磺基丙基)铵甜菜碱、甲基丙烯酸酰胺基丙基
‑
二甲基铵磺基甜菜碱、spi(衣康酸
‑
双(1
‑
丙基磺酸
‑
3)酯二钾盐)、衣康酸、ambc(3
‑
丙烯酰胺基
‑3‑
甲基丁酸)、β
‑
羧基乙基丙烯酸酯(丙烯酸二聚体)和马来酸酐
‑
甲基乙烯基醚聚合物、其衍生物、其盐、其酸和其组合。在某些实施方案中,本公开内容的药物组合物可口服给予,例如,以胶囊剂、扁囊剂、丸剂、片剂、锭剂(使用矫味基质,例如蔗糖和阿拉伯胶或西黄蓍胶)、粉剂、颗粒剂、在水性或非水性液体中溶液剂或混悬剂、水包油或油包水液体乳剂、或酏剂或糖浆剂、或软锭剂(使用惰性基质,例如明胶和甘油,或蔗糖和阿拉伯胶)和/或口腔洗剂的形式,各自包含预定量的本公开内容的化合物和任选地一种或多种其它活性成分。本公开内容的化合物和任选地一种或多种其它活性成分还可作为巨丸剂、药糖剂或糊剂给予。
[0497]
在用于口腔给予的固体剂型(例如,胶囊剂、片剂、丸剂、糖锭剂、粉剂和颗粒剂)中,本公开内容的一种或多种化合物可与一种或多种药学上可接受的载体混合,其包括例如,柠檬酸钠、磷酸二钙、填充剂或膨胀剂(例如,淀粉、乳糖、蔗糖、葡萄糖、甘露糖和硅酸)、结合剂(例如,羧基甲基纤维素、藻酸盐、明胶、聚乙烯基吡咯烷酮、蔗糖和阿拉伯胶)、湿润剂(例如,甘油)、崩解剂(例如,琼脂、碳酸钙、马铃薯或木薯淀粉、藻酸、硅酸盐和碳酸钠)、溶解阻滞剂(例如,石蜡)、吸收加速剂(例如,季铵化合物)、浸湿剂(例如,鲸蜡醇和甘油单硬脂酸酯)、吸收剂(例如,高岭土和膨润土)、润滑剂(例如,滑石粉、硬脂酸钙、硬脂酸镁、固体聚乙二醇、月桂基硫酸钠)、着色剂和其混合物。在胶囊剂、片剂和丸剂的情况下,药物制剂(组合物)还可包含缓冲剂。类似类型的固体组合物也可用作软和硬填充明胶胶囊的填充
物,使用一种或多种赋形剂包括例如,乳糖(lactose)或乳糖(milk sugar)以及高分子量聚乙二醇。
[0498]
用于口腔给予药物组合物的液体剂型可包括药学上可接受的乳剂、微乳剂、溶液剂、混悬剂、糖浆剂和酏剂。除了活性成分外,液体剂型可包含本领域常用的惰性稀释剂,包括例如,水或其它溶剂、增溶剂和/或乳化剂[例如,乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苯甲醇、苯甲酸苯甲酯、丙二醇或1,3
‑
丁二醇、油(例如,棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油和芝麻油)、甘油、四氢呋喃甲醇、聚乙二醇、去水山梨糖醇的脂肪酸酯和其混合物]。除了惰性稀释剂外,口服制剂还可包括助剂,包括例如,浸湿剂、乳化剂和助悬剂、甜味剂、矫味剂、着色剂、芳香剂、防腐剂和其组合。
[0499]
混悬剂,除了活性化合物外,还可包含助悬剂,包括例如,乙氧基化异硬脂醇、聚氧乙烯山梨醇、去水山梨糖醇酯、微晶纤维素、偏氢氧化铝、膨润土、琼脂、西黄蓍胶和其组合。
[0500]
微生物的作用和/或生长的预防可通过包括各种抗细菌剂和抗真菌剂来确保,其包括例如,对羟基苯甲酸酯、氯丁醇和苯酚山梨酸。
[0501]
在某些实施方案中,组合物中可能需要包括等渗剂,包括例如,糖或氯化钠。此外,可通过包括延迟吸收的试剂包括,例如,单硬脂酸铝和明胶导致可注射药物形式的延长吸收。
[0502]
应理解,剂量方案由主治医生考虑各种因素来确定,所述因素改变本公开内容的一种或多种试剂的作用。在促进红细胞形成的tgf
‑
β超家族受体单臂异多聚体复合物的情况下,各种因素可包括但不限于,患者的红细胞计数、血红蛋白水平、需要的目标红细胞计数、患者的年龄、患者的性别、患者的饮食、可促进红细胞水平降低的任何疾病的严重性、给予次数和其它临床因素。添加其它已知的活性剂至最终组合物中也可影响剂量。可通过定期评估红细胞水平、血红蛋白水平、网织红细胞水平和生血过程的其它指示物中的一项或多项监测进展。
[0503]
在某些实施方案中,本公开内容还提供了用于体内产生本公开内容的一种或多种试剂的基因疗法。这样的疗法通过引入试剂序列至具有上文列出的一种或多种病症的细胞或组织来实现其治疗效果。递送试剂序列可例如,通过使用重组表达载体例如嵌合病毒或胶体分散系统来实现。本公开内容的一种或多种试剂序列的优选的治疗递送使用靶向脂质体进行。
[0504]
本文教导的可用于基因疗法的各种病毒载体包括腺病毒、疱疹病毒、牛痘或rna病毒(例如,逆转录病毒)。逆转录病毒载体可以是鼠或禽逆转录病毒的衍生株。其中可插入单一外源基因的逆转录病毒载体的实例包括但不限于:莫洛尼鼠白血病病毒(momulv)、哈维鼠肉瘤病毒(hamusv)、鼠乳腺肿瘤病毒(mumtv)和劳斯肉瘤病毒(rsv)。许多另外的逆转录病毒载体可掺有多种基因。所有这些载体可传递或掺有用于可选择标记的基因,使得转导的细胞可鉴定和产生。通过连接例如,糖、糖脂或蛋白,可使得逆转录病毒载体为靶标特异性的。优选的靶向通过使用抗体实现。本领域技术人员将认识到,特定的多核苷酸序列可插入逆转录病毒基因组或连接至病毒被膜以允许包含本公开内容的一种或多种试剂的逆转录病毒载体的靶标特异性递送。
[0505]
或者,组织培养细胞可通过常规磷酸钙转染,用编码逆转录病毒结构基因(gag、pol和env)的质粒,直接转染。然后这些细胞用包含目的基因的载体质粒转染。得到的细胞
释放逆转录病毒载体至培养基。
[0506]
用于本公开内容的一种或多种试剂的另一靶向递送系统是胶体分散系统。胶体分散系统包括例如,大分子复合物、纳米胶囊、微球、珠和基于脂质的系统,包括水包油乳剂、胶束、混合型胶束和脂质体。在某些实施方案中,本公开内容的优选的胶体系统是脂质体。脂质体是人造膜囊,其可体外和体内用作递送载体。rna、dna和完整的病毒体可包封在水性内心内和以生物活性形式递送至细胞。参见例如,fraley,等(1981)trends biochem.sci.,6:77。使用脂质体载体的有效基因传递的方法是本领域已知的。参见例如,mannino,等(1988)biotechniques,6:682,1988。
[0507]
脂质体组分通常是磷脂的组合,其可包括甾族化合物(例如,胆固醇)。脂质体的物理特征取决于ph、离子强度和二价阳离子的存在。其它磷脂或其它脂质也可使用,包括例如磷脂酰基化合物(例如,磷脂酰基甘油、磷脂酰基胆碱、磷脂酰基丝氨酸、磷脂酰基乙醇胺、鞘脂、脑苷脂和神经节苷脂)、卵磷脂酰基胆碱、二棕榈酰基磷脂酰基胆碱和二硬脂酰基磷脂酰基胆碱。脂质体的靶向还可能基于例如,器官
‑
特异性、细胞
‑
特异性和细胞器
‑
特异性,并且是本领域已知的。
具体实施方式
[0508]
本技术还涉及以下实施方案:
[0509]
1.包含与第二多肽共价或非共价缔合的第一多肽的蛋白复合物,其中:
[0510]
a.第一多肽包含相互作用对的第一成员的氨基酸序列和tgfβ超家族i型或ii型受体多肽的氨基酸序列,其中tgfβ超家族i型或ii型受体多肽选自:alk1、alk2、alk3、alk4、alk5、alk6、alk7、actriia、actriib、tgfbrii、bmprii和misrii多肽;和
[0511]
b.第二多肽包含相互作用对的第二成员的氨基酸序列,和其中第二多肽不包含tgfβ超家族i型或ii型受体多肽。
[0512]
2.实施方案1的蛋白复合物,其中tgfβ超家族i型或ii型受体多肽是actriia多肽。
[0513]
3.实施方案1的蛋白复合物,其中tgfβ超家族i型或ii型受体多肽是actriib多肽。
[0514]
4.实施方案1的蛋白复合物,其中tgfβ超家族i型或ii型受体多肽是bmprii多肽。
[0515]
5.实施方案1的蛋白复合物,其中tgfβ超家族i型或ii型受体多肽是tgfbrii多肽。
[0516]
6.实施方案1的蛋白复合物,其中tgfβ超家族i型或ii型受体多肽是misrii多肽。
[0517]
7.实施方案1的蛋白复合物,其中tgfβ超家族i型或ii型受体多肽是alk1多肽。
[0518]
8.实施方案1的蛋白复合物,其中tgfβ超家族i型或ii型受体多肽是alk2多肽。
[0519]
9.实施方案1的蛋白复合物,其中tgfβ超家族i型或ii型受体多肽是alk3多肽。
[0520]
10.实施方案1的蛋白复合物,其中tgfβ超家族i型或ii型受体多肽是alk4多肽。
[0521]
11.实施方案1的蛋白复合物,其中tgfβ超家族i型或ii型受体多肽是alk5多肽。
[0522]
12.实施方案1的蛋白复合物,其中tgfβ超家族i型或ii型受体多肽是alk6多肽。
[0523]
13.实施方案1的蛋白复合物,其中tgfβ超家族i型或ii型受体多肽是alk7多肽。
[0524]
14.实施方案2的蛋白复合物,其中actriia多肽包含以下氨基酸序列,由其组成,或基本上由其组成:
[0525]
a.与seq id no:9,10和11中任一个的序列具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性;或
[0526]
b.与以seq id no:9的氨基酸21,22,23,24,25,26,27,28,29或30的任一个开始和以seq id no:9的氨基酸110,111,112,113,114,115,116,117,118,119,120,121,122,123,124,125,126,127,128,129,130,131,132,133,134或135的任一个结束的多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性。
[0527]
15.实施方案3的蛋白复合物,其中actriib多肽包含以下氨基酸序列,由其组成,或基本上由其组成:
[0528]
a.与seq id no:1,2,3,4,5和6中任一个的序列具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性;或
[0529]
b.与以seq id no:1的氨基酸20,21,22,23,24,25,26,27,28,或29的任一个开始和以seq id no:1的氨基酸109,110,111,112,113,114,115,116,117,118,119,120,121,122,123,124,125,126,127,128,129,130,131,132,133,或134的任一个结束的多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性。
[0530]
16.实施方案4的蛋白复合物,其中bmprii多肽包含以下氨基酸序列,由其组成,或基本上由其组成:
[0531]
a.与seq id no:46,47,71,和72中任一个的序列具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性;或
[0532]
b.与以seq id no:46或71的任一个的氨基酸27,28,29,30,31,32,33,和34的任一个开始和以seq id no:46或71的任一个的氨基酸123,124,125,126,127,128,129,130,131,132,133,134,135,136,137,138,139,140,141,142,143,144,145,146,147,148,149,和150的任一个结束的多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性。
[0533]
17.实施方案5的蛋白复合物,其中tgfbrii多肽包含以下氨基酸序列,由其组成,或基本上由其组成:
[0534]
a.与seq id no:42,43,67,和68中任一个的序列具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性;或
[0535]
b.与以seq id no:42的氨基酸23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50或51的任一个开始和以seq id no:42的氨基酸143,144,145,146,147,148,149,150,151,152,153,154,155,156,157,158,159,160,161,162,163,164,165或166的任一个结束的多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性;或
[0536]
c.与以seq id no:67的氨基酸23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43或44的任一个开始和以seq id no:67的氨基酸163,164,165,166,167,168,169,170,171,172,173,174,175,176,177,178,179,180,181,182,183,184,185,186,187,188,189,190或191的任一个结束的多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性。
[0537]
18.实施方案6的蛋白复合物,其中misrii多肽包含以下氨基酸序列,由其组成,或基本上由其组成:
[0538]
a.与seq id no:50,51,75,76,79,和80中任一个的序列具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性;或
[0539]
b.与以下多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性:a)以seq id no:50,75,或79的任一个的氨基酸17,18,19,20,21,22,23,和24的任一个开始和以seq id no:50,75,或79的任一个的氨基酸116,117,118,119,120,121,122123,124,125,126,127,128,129,130,131,132,133,134,135,136,137,138,139,140,141,142,143,144,145,146,147,148,和149的任一个结束。
[0540]
19.实施方案7的蛋白复合物,其中alk1多肽包含以下氨基酸序列,由其组成,或基本上由其组成:
[0541]
a.与seq id no:14和15中任一个的序列具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性;或
[0542]
b.与以seq id no:14的氨基酸22,23,24,25,26,27,28,29,30,31,32,33,和34的任一个开始和以seq id no:14的氨基酸95,96,97,98,99,100,101,102,103,104,105,106,107,108,109,110,111,112,113,114,115,116,117,和118的任一个结束的多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性。
[0543]
20.实施方案8的蛋白复合物,其中alk2多肽包含以下氨基酸序列,由其组成,或基本上由其组成:
[0544]
a.与seq id no:18和19中任一个的序列具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性;或
[0545]
b.与以seq id no:18的氨基酸21,22,23,24,25,26,27,28,29,30,31,32,33,34,和35的任一个开始和以seq id no:18的氨基酸99,100,101,102,103,104,105,106,107,108,109,110,111,112,113,114,115,116,117,118,119,120,121,122,和123的任一个结束的多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性。
[0546]
21.实施方案9的蛋白复合物,其中alk3多肽包含以下氨基酸序列,由其组成,或基本上由其组成:
[0547]
a.与seq id no:22和23中任一个的序列具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性;或
[0548]
b.与以seq id no:22的氨基酸24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,和61的任一个开始和以seq id no:22的氨基酸130,131,132,133,134,135,136,137,138,139,140,141,142,143,144,145,146,147,148,149,150,151,和152的任一个结束的多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性。
[0549]
22.实施方案10的蛋白复合物,其中alk4多肽包含以下氨基酸序列,由其组成,或基本上由其组成:
[0550]
a.与seq id no:26,27,83,和84中任一个的序列具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性;或
[0551]
b.与以seq id no:26或83的任一个的氨基酸23,24,25,26,27,28,29,30,31,32,33,34的任一个开始和以seq id no:26或83的任一个的氨基酸101,102,103,104,105,106,107,108,109,110,111,112,113,114,115,116,117,118,119,120,121,122,123,124,125,和126的任一个结束的多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性。
[0552]
23.实施方案11的蛋白复合物,其中alk5多肽包含以下氨基酸序列,由其组成,或基本上由其组成:
[0553]
a.与seq id no:30,31,87,和88中任一个的序列具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性;或
[0554]
b.与以seq id no:30或87的任一个的氨基酸25,26,27,28,29,30,31,32,33,34,35,和36的任一个开始和以seq id no:30或87的任一个的氨基酸106,107,108,109,110,111,112,113,114,115,116,117,118,119,120,121,122,123,124,125,和126的任一个结束的多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性。
[0555]
24.实施方案12的蛋白复合物,其中alk6多肽包含以下氨基酸序列,由其组成,或基本上由其组成:
[0556]
a.与seq id no:34,35,91,和92中任一个的序列具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性;或
[0557]
b.与以seq id no:34的氨基酸14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,和32的任一个开始和以seq id no:34的氨基酸102,103,104,105,106,107,108,109,110,111,112,113,114,115,116,117,118,119,120,121,122,123,124,125,和126的任一个结束的多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性;或
[0558]
c.与以seq id no:91的氨基酸26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,52,53,54,55,56,57,58,59,60,61,和62的任一个开始和以seq id no:91的氨基酸132,133,134,135,136,137,138,139,140,141,142,143,144,145,146,147,148,149,150,151,152,153,154,155,和156的任一个结束的多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性。
[0559]
25.实施方案13的蛋白复合物,其中alk7多肽包含以下氨基酸序列,由其组成,或基本上由其组成:
[0560]
a.与seq id no:38,39,301,302,305,306,309,310,和313中任一个的序列具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性;或
[0561]
b.与以seq id no:38的氨基酸21,22,23,24,25,26,27,或28的任一个开始和以seq id no:38的氨基酸92,93,94,95,96,97,98,99,100,101,102,103,104,105,106,107,108,109,110,111,112,或113的任一个结束的多肽具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性。
[0562]
26.实施方案1
‑
25中任一项的蛋白复合物,其中蛋白复合物是重组异二聚体。
[0563]
27.实施方案1
‑
26中任一项的蛋白复合物,其中相互作用对的第一成员包含来自igg重链的第一恒定区。
[0564]
28.实施方案1
‑
27中任一项的蛋白复合物,其中相互作用对的第二成员包含来自igg重链的第二恒定区。
[0565]
29.实施方案27的蛋白复合物,其中来自igg重链的第一恒定区是第一免疫球蛋白fc结构域。
[0566]
30.实施方案28的蛋白复合物,其中来自igg重链的第二恒定区是第一免疫球蛋白fc结构域。
[0567]
31.实施方案27的蛋白复合物,其中来自igg重链的第一恒定区包含与选自seq id no:200
‑
214中任一个的序列具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列。
[0568]
32.实施方案28的蛋白复合物,其中来自igg重链的第二恒定区包含与选自seq id no:200
‑
214中任一个的序列具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列。
[0569]
33.实施方案1
‑
32中任一项的蛋白复合物,其中第一多肽包含与选自seq id no:101,103,104,106,107,109,110,112,113,115,116,118,119,121,122,124,125,127,128,130,131,133,134,136,401,402,403,404,405,406,407,408,409,410,411,412,413,414,415,416,417,418,419,420,421,422,423,和424中任一个的序列具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列。
[0570]
34.实施方案1
‑
33中任一项的蛋白复合物,其中第二多肽包含与选自seq id no:137,139,140,142,425,426,427,和428中任一个的序列具有至少70%,80%,85%,90%,95%,97%,98%,99%或100%同一性的氨基酸序列。
[0571]
35.实施方案1
‑
34中任一项的蛋白复合物,其中第一多肽和/或第二多肽包含一个或多个修饰的氨基酸残基,其选自:糖基化氨基酸、peg化氨基酸、法呢基化氨基酸、乙酰基化氨基酸、生物素化氨基酸、与脂质部分缀合的氨基酸和与有机衍生剂缀合的氨基酸。
[0572]
36.实施方案1
‑
35中任一项的蛋白复合物,其中第一多肽和/或第二多肽被糖基化和具有可获自在cho细胞中i型受体多肽的表达的糖基化模式。
[0573]
37.实施方案1
‑
36中任一项的蛋白复合物,其中蛋白复合物具有一个或多个以下特征:i)以小于或等于10
‑7、10
‑8、10
‑9或10
‑
10
m的k
d
结合tgf
‑
β超家族配体;和ii)在细胞中抑制tgf
‑
β超家族i型和/或ii型受体
‑
介导的信号传导。
[0574]
38.实施方案1
‑
37中任一项的蛋白复合物,其中蛋白复合物结合以下一种或多种:bmp2、bmp2/7、bmp3、bmp4、bmp4/7、bmp5、bmp6、bmp7、bmp8a、bmp8b、bmp9、bmp10、gdf3、gdf5、gdf6/bmp13、gdf7、gdf8、gdf9b/bmp15、gdf11/bmp11、gdf15/mic1、tgf
‑
β1、tgf
‑
β2、tgf
‑
β3、活化素a、活化素b、活化素c、活化素e、活化素ab、活化素ac、活化素ae、活化素bc、活化素be、nodal、gdnf、neurturin、artemin、persephin、mis和lefty。
[0575]
39.实施方案1
‑
38中任一项的蛋白复合物,其中在基于细胞的测定法中,蛋白复合物抑制一种或多种tgf
‑
β超家族配体的活性。
[0576]
40.实施方案1
‑
39中任一项的蛋白复合物,其中tgf
‑
β超家族配体选自:bmp2、bmp2/7、bmp3、bmp4、bmp4/7、bmp5、bmp6、bmp7、bmp8a、bmp8b、bmp9、bmp10、gdf3、gdf5、gdf6/bmp13、gdf7、gdf8、gdf9b/bmp15、gdf11/bmp11、gdf15/mic1、tgf
‑
β1、tgf
‑
β2、tgf
‑
β3、活化素a、活化素b、活化素c、活化素e、活化素ab、活化素ac、活化素ae、活化素bc、活化素be、nodal、gdnf、neurturin、artemin、persephin、mis和lefty。
[0577]
41.药物制剂,其包含实施方案1
‑
40中任一项的蛋白复合物和药学上可接受的载体。
[0578]
42.治疗具有tgfβ超家族相关病况的患者的方法。
[0579]
43.实施方案42的方法,其中tgfβ超家族相关病况选自:肌肉病症、红细胞病症、贫血、骨病症、骨丢失、纤维化病症、慢性肾病、代谢疾病、ii型糖尿病、肥胖和心血管病症。
[0580]
例证
[0581]
本发明已总体上进行了描述,参照以下实施例将更容易理解,实施例仅为说明本发明的某些实施方案的目的包括在内,和不意图限制本发明。
[0582]
实施例1.单臂actriib
‑
fc异二聚体的产生和表征
[0583]
申请人构建了可溶性单臂actriib
‑
fc异二聚体复合物,其包含具有短的n
‑
末端延伸的单体fc多肽和第二多肽,其中人actriib的细胞外结构域用位于细胞外结构域和单独的fc结构域之间的接头融合至该第二fc结构域。各个构建体分别称为单体fc多肽和actriib
‑
fc融合多肽,和各自的序列在下文提供。
[0584]
用于促进actriib
‑
fc:fc异聚复合物而不是actriib
‑
fc:actriib
‑
fc或fc:fc同二聚体复合物的形成的方法是在fc结构域的氨基酸序列中引入改变以指导不对称的异聚复合物的形成。使用fc结构域制备不对称的相互作用对的许多不同的方法描述于本公开内容。
[0585]
在一种方法中,以分别为seq id nos:104
‑
106和137
‑
139的actriib
‑
fc和单体fc多肽序列举例说明,一个fc结构域经改变以在相互作用界面处引入阳离子氨基酸,而另一个fc结构域经改变以在相互作用界面处引入阴离子氨基酸。actriib
‑
fc融合多肽和单体fc多肽各自使用组织纤溶酶原激活剂(tpa)前导序列:mdamkrglccvlllcgavfvsp(seq id no:100)。
[0586]
actriib
‑
fc多肽序列(seq id no:104)显示如下:
[0587][0588]
前导(信号)序列和接头用下划线表示。为了促进actriib
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物(actriib
‑
fc:actriib
‑
fc或fc:fc)的形成,两个氨基酸置换(用赖氨酸替换酸性氨基酸)可被引入至actriib融合蛋白的fc结构域,如上文通过表示的。seq id no:104的氨基酸序列可任选地以c
‑
末端赖氨酸(k)被除去来提供。
[0589]
该actriib
‑
fc融合多肽由以下核酸序列(seq id no:105)编码:
[0590]
[0591][0592]
成熟的actriib
‑
fc融合多肽(seq id no:106)如下和可任选地以c
‑
末端赖氨酸被除去来提供。
[0593][0594]
互补人g1fc多肽(seq id no:137)使用tpa前导序列和如下:
[0595][0596]
前导序列以下划线表示,和fc多肽的任选的n
‑
末端延伸通过末端延伸通过表示。为了促进形成actriib
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用阴离子残基替换赖氨酸)可被引入至单体fc多肽,如上文通过表示的。seq id no:137的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。
[0597]
该互补fc多肽通过以下核酸(seq id no:138)编码。
[0598][0599]
成熟的单体fc多肽的序列如下(seq id no:139)和可任选地以c
‑
末端赖氨酸被除去来提供。
[0600][0601]
[0602]
分别为seq id no:106和seq id no:139的actriib
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含actriib
‑
fc:fc的单臂异聚蛋白复合物。
[0603]
在促进使用不对称的fc融合多肽的异多聚体复合物的形成的另一方法中,fc结构域经改变以引入互补疏水相互作用和另外的分子间二硫键,如在分别为seq id nos:403
‑
404和425
‑
426的actriib
‑
fc和单体fc多肽序列中举例说明的。
[0604]
actriib
‑
fc多肽序列(seq id no:403)使用tpa前导序列和显示如下:
[0605][0606]
前导序列和接头用下划线表示。为促进形成actriib
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用半胱氨酸替换丝氨酸和用色氨酸替换苏氨酸)可被引入至融合蛋白的fc结构域,如上文通过表示的。seq id no:403的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。
[0607]
成熟的actriib
‑
fc融合多肽如下:
[0608][0609][0610]
互补形式的单体fc多肽(seq id no:425)使用tpa前导序列和如下。
[0611][0612]
前导序列用下划线表示,和fc多肽的任选的n
‑
末端延伸通过末端延伸通过表示。为了促进形成actriib
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,四个氨基酸置换可被引入至单体fc多肽,如上文通过表示的。seq id no:425的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。
[0613]
成熟的单体fc多肽序列(seq id no:426)如下和可任选地以c
‑
末端赖氨酸被除去来提供。
[0614][0615]
分别为seq id no:404和seq id no:426的actriib
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生单臂异聚蛋白复合物包含actriib
‑
fc:fc。
[0616]
各种actriib
‑
fc:fc复合物的纯化可通过一系列柱色谱步骤实现,包括例如,以任何次序的三个或更多个以下步骤:蛋白a色谱、q琼脂糖凝胶色谱、苯基琼脂糖凝胶色谱、分子排阻色谱和阳离子交换色谱。纯化可以病毒过滤和缓冲液交换完成。
[0617]
基于biacore
tm
‑
的结合测定法用于比较上述的单臂actriib
‑
fc异二聚体复合物的配体结合选择性与actriib
‑
fc同二聚体复合物的配体结合选择性。使用抗
‑
fc抗体将单臂actriib
‑
fc和同二聚体actriib
‑
fc独立地捕获在系统上。注入配体和允许流经捕获的受体蛋白。结果在下表中概述,其中通常与最有效的配体捕捉物有关的配体离解速率(k
d
)通过灰色阴影表示。
[0618][0619]
这些比较的结合数据证实,单臂actriib
‑
fc具有比同二聚体actriib
‑
fc更大的配体选择性。尽管actriib
‑
fc同二聚体与五个重要的配体(见图6中活化素a,活化素b,bmp10,gdf8和gdf11的聚类)强结合,但单臂actriib
‑
fc更容易区分这些配体。因此,单臂actriib
‑
fc与活化素b和gdf11强结合,和与gdf8和活化素a中等强度结合。与actriib
‑
fc同二聚体另外形成对比,单臂actriib
‑
fc显示与bmp10仅弱结合,和与bmp9没有结合。参见图6。
[0620]
这些结果表明,单臂actriib
‑
fc是比actriib
‑
fc同二聚体更有选择性的拮抗剂。因此,在其中这样的选择性拮抗作用是有利的某些应用中单臂actriib
‑
fc将比actriib
‑
fc
同二聚体更有用。实例包括治疗应用,其中需要保留活化素a,活化素b,gdf8和gdf11的一种或多种的拮抗作用,但使bmp9,bmp10,bmp6和gdf3的一种或多种的拮抗作用最小化。在前一组中配体的选择性抑制在治疗上是特别有利的,因为它们构成了在功能上倾向不同于后一组和其相关的临床病况组的亚家族。
[0621]
实施例2.单臂alk3
‑
fc异二聚体的产生和表征
[0622]
申请人构建了可溶性单臂alk3
‑
fc异二聚体复合物,其包含具有短的n
‑
末端延伸的单体fc多肽和第二多肽,其中人alk3的细胞外结构域用位于细胞外结构域和单独的fc结构域之间的接头融合至该第二fc结构域。各个构建体分别被称为单体fc多肽和alk3
‑
fc融合多肽,和各自的序列在下文提供。
[0623]
单臂alk3
‑
fc异二聚体的形成可通过类似于实施例1中对于单臂actriib
‑
fc异二聚体所述的方法的方法指导。在第一方法中,以分别为seq id nos:122
‑
124和140
‑
142的alk3
‑
fc和单体fc多肽序列举例说明,一个fc结构域经改变以在相互作用界面处引入阳离子氨基酸,而另一个fc结构域经改变以在相互作用界面处引入阴离子氨基酸。
[0624]
alk3
‑
fc融合多肽使用tpa前导序列和如下:
[0625][0626]
前导和接头序列用下划线表示。为了促进形成alk3
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物(alk3
‑
fc:alk3
‑
fc或fc:fc,两个氨基酸置换(用阴离子氨基酸替换赖氨酸)可被引入至融合蛋白的fc结构域,如上文通过表示的。seq id no:122的氨基酸序列可任选地以在c
‑
末端添加赖氨酸来提供。
[0627]
该alk3
‑
fc融合多肽通过以下核酸(seq id no:123)编码。
[0628]
[0629][0630]
成熟的alk3
‑
fc融合多肽序列如下(seq id no:124)和可任选地以在c
‑
末端添加赖氨酸来提供。
[0631][0632]
互补人g1fc多肽(seq id no:140)使用tpa前导序列和如下:
[0633]
[0634][0635]
前导序列用下划线表示,和fc多肽的任选的n
‑
末端延伸通过末端延伸通过表示。为了促进形成alk3
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用赖氨酸替换阴离子残基)可被引入至单体fc多肽,如上文通过表示的。seq id no:140的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。
[0636]
该互补fc多肽通过以下核酸(seq id no:141)编码。
[0637]
[0638][0639]
成熟的单体fc多肽的序列如下(seq id no:142)和可任选地以c
‑
末端赖氨酸被除去来提供。
[0640][0641]
分别为seq id no:124和seq id no:142的alk3
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含alk3
‑
fc:fc的单臂异聚蛋白复合物。
[0642]
在促进使用不对称的fc融合多肽的异多聚体复合物的形成的另一方法中,fc结构域经改变以引入互补疏水相互作用和另外的分子间二硫键,如在分别为seq id nos:415
‑
416和427
‑
428的alk3
‑
fc和fc多肽序列中举例说明的。
[0643]
alk3
‑
fc融合多肽(seq id no:415)使用tpa前导序列和如下:
[0644][0645]
前导序列和接头用下划线表示。为了促进形成alk3
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,四个氨基酸置换可被引入至alk3融合多肽的fc结构域,如上文通过表示的。seq id no:415的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。
[0646]
成熟的alk3
‑
fc融合多肽(seq id no:416)如下和可任选地以c
‑
末端赖氨酸被除去来提供。
[0647]
[0648]
互补形式的单体g1fc多肽(seq id no:427)使用tpa前导序列和如下:
[0649][0650]
前导序列用下划线表示,和fc多肽的任选的n
‑
末端延伸通过末端延伸通过表示。为了促进形成alk3
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用半胱氨酸替换丝氨酸和用色氨酸替换苏氨酸)可被引入至单体fc多肽,如上文通过表示的。seq id no:427的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。
[0651]
成熟的单体fc多肽的序列如下(seq id no:428)和可任选地以c
‑
末端赖氨酸被除去来提供。
[0652][0653]
分别为seq id no:416和seq id no:428的alk3
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含alk3
‑
fc:fc的单臂异聚复合物。
[0654]
各种alk3
‑
fc:fc复合物的纯化可通过一系列柱色谱步骤实现,包括例如,以任何次序的三个或更多个以下步骤:蛋白a色谱、q琼脂糖凝胶色谱、苯基琼脂糖凝胶色谱、分子排阻色谱和阳离子交换色谱。纯化可以病毒过滤和缓冲液交换完成。
[0655]
基于biacore
tm
‑
的结合测定法用于比较上述的单臂alk3
‑
fc异二聚体复合物的配体结合选择性与alk3
‑
fc同二聚体复合物的配体结合选择性。使用抗
‑
fc抗体,将单臂alk3
‑
fc和同二聚体alk3
‑
fc独立地捕获在系统上。注入配体和允许流经捕获的受体蛋白。结果在下表中概述,其中通常与最有效的配体捕捉物有关的配体离解速率(k
d
)通过灰色阴影表示。
[0656][0657]
这些比较的数据表明单臂alk3
‑
fc具有比同二聚体alk3
‑
fc更大的配体选择性。尽管单臂alk3
‑
fc异二聚体保留以alk3
‑
fc同二聚体观察到的与bmp4特别紧密的结合,但其显示与bmp2减少强度的结合,因此比alk3
‑
fc同二聚体更好地区分bmp4和bmp2(仍是强的结合剂)。与以非常类似的强度(全部中等)结合这三种配体的alk3
‑
fc同二聚体比较,单臂alk3
‑
fc还更好地区分bmp5(中等结合)、gdf7(弱结合)和gdf6(无结合)。参见图7。不像实施例1中公开的构建体,单臂alk3
‑
fc和同二聚体alk3
‑
fc均不结合活化素,gdf8,gdf11,或bmp10。
[0658]
这些结果因此表明单臂alk3
‑
fc是比alk3
‑
fc同二聚体更有选择性的bmp4的拮抗剂。与alk3
‑
fc同二聚体比较,单臂alk3
‑
fc可预期以更加靶向的方式拮抗bmp4,其中bmp2或bmp5和特别是gdf6或gdf7的同时拮抗作用减少。因此,在其中这样的选择性拮抗作用是有利的某些应用中,单臂alk3
‑
fc比alk3
‑
fc同二聚体更有用。实例包括治疗应用,其中需要保留bmp4,bmp2和潜在地bmp5的一种或多种的拮抗作用,但使bmp6,gdf6,和gdf7的一种或多种的拮抗作用最小化。
[0659]
实施例3.单臂actriia
‑
fc异二聚体的产生和表征
[0660]
申请人构建了可溶性单臂actriia
‑
fc异二聚体复合物,其包含具有短的n
‑
末端延
伸的单体fc多肽和第二多肽,其中人actriia的细胞外结构域用位于细胞外结构域和单独的fc结构域之间的接头融合至该第二fc结构域。各个构建体分别被称为单体fc多肽和actriia
‑
fc融合多肽,和各自的序列在下文提供。
[0661]
单臂actriia
‑
fc异二聚体的形成可通过类似于实施例1中对于单臂actriib
‑
fc异二聚体所述的方法的方法指导。在第一方法中,以分别为seq id nos:101
‑
103和137
‑
139的actriia
‑
fc和单体fc多肽序列举例说明,一个fc结构域经改变以在相互作用界面处引入阳离子氨基酸,而另一个fc结构域经改变以在相互作用界面处引入阴离子氨基酸。
[0662]
actriia
‑
fc融合多肽使用tpa前导序列和如下:
[0663][0664]
前导和接头序列用下划线表示。为了促进形成actriia
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物(actriia
‑
fc:actriia
‑
fc或fc
‑
fc),两个氨基酸置换(用赖氨酸替换阴离子残基)可被引入至融合多肽的fc结构域,如上文同构表示的。seq id no:101的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。
[0665]
该actriia
‑
fc融合多肽通过以下核酸(seq id no:102)编码。
id no:137的氨基酸序列可任选地以没有c
‑
末端赖氨酸来提供。该互补fc多肽通过seq id no:138的核酸编码,和成熟的单体fc多肽(seq id no:139)可任选地以c
‑
末端赖氨酸被除去来提供。
[0670]
分别为seq id no:103和seq id no:139的actriia
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含actriia
‑
fc:fc的单臂异聚蛋白复合物。
[0671]
在促进使用不对称的fc融合多肽的异多聚体复合物的形成的另一方法中,fc结构域经改变以引入互补疏水相互作用和另外的分子间二硫键,如在分别为seq id nos:401
‑
402和425
‑
426的actriia
‑
fc和fc多肽序列中举例说明的。
[0672]
actriia
‑
fc融合多肽(seq id no:401)使用tpa前导序列和如下:
[0673][0674][0675]
前导序列和接头用下划线表示。为了促进形成actriia
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用半胱氨酸替换丝氨酸和用色氨酸替换苏氨酸)可被引入至actriia融合多肽的fc结构域,如上文通过表示的。seq id no:401的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。
[0676]
成熟的actriia
‑
fc融合多肽(seq id no:402)如下和可任选地以c
‑
末端赖氨酸被除去来提供。
[0677][0678]
如实施例1所述的,互补形式的单体人g1fc多肽(seq id no:425)使用tpa前导序列和掺有任选的n
‑
末端延伸。为了促进形成actriia
‑
fc:fc异二聚体而不是任一可能的同
二聚体复合物,四个氨基酸置换可按所示被引入至单体fc多肽。seq id no:425的氨基酸序列和成熟的g1fc多肽(seq id no:426)可任选地以c
‑
末端赖氨酸被除去来提供。
[0679]
分别为seq id no:402和seq id no:426的actriia
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含actriia
‑
fc:fc的单臂异聚蛋白复合物。
[0680]
各种actriia
‑
fc:fc复合物的纯化可通过一系列柱色谱步骤实现,包括例如,以任何次序的三个或更多个以下步骤:蛋白a色谱、q琼脂糖凝胶色谱、苯基琼脂糖凝胶色谱、分子排阻色谱和阳离子交换色谱。纯化可以病毒过滤和缓冲液交换完成。
[0681]
基于biacore
tm
‑
的结合测定法用于比较上述的单臂actriia
‑
fc异二聚体复合物的配体结合选择性与actriia
‑
fc同二聚体复合物的配体结合选择性。使用抗
‑
fc抗体将单臂actriia
‑
fc和同二聚体actriia
‑
fc独立地捕获在系统上。注入配体和允许流经捕获的受体蛋白。结果在下表中概述,其中通常与最有效的配体捕捉物有关的配体离解速率(k
d
)通过灰色阴影表示。
[0682][0683]
这些比较的结合数据表明单臂actriia
‑
fc具有与同二聚体actriia
‑
fc不同的配体选择性(并且还具有与单臂actriib
‑
fc或同聚actriib
‑
fc不同的配体选择性
–
参见实施例1)。尽管actriia
‑
fc同二聚体显示优先结合活化素b以及强结合活化素a和gdf11,但单臂actriia
‑
fc具有对活化素a超过活化素b的相反偏好,以及极大增强的对活化素a超过gdf11(弱结合剂)的选择性。参见图8。此外,单臂actriia
‑
fc很大程度上保留对gdf8和bmp10的中等结合,如actriia
‑
fc同二聚体所观察到的。
[0684]
这些结果表明与actriia
‑
fc同二聚体比较,单臂actriia
‑
fc异二聚体是具有显著改变的配体选择性的拮抗剂。因此,在其中这样的拮抗作用是有利的某些应用中,单臂actriia
‑
fc比actriia
‑
fc同二聚体更有用。实例包括治疗应用,其中需要优先拮抗活化素a超过活化素b,同时使gdf11的拮抗作用最小化。
[0685]
总之,前述实施例证实,i型或ii型受体多肽当处于单臂异聚蛋白复合物的情况下时,形成新的结合口袋,其显示相对于任一类型的同聚蛋白复合物改变的选择性,允许形成可能用作治疗剂的新的蛋白试剂。
[0686]
实施例4.单臂bmprii
‑
fc异二聚体的产生和表征
[0687]
申请人构建了可溶性单臂bmprii
‑
fc异二聚体复合物,其包含具有短的n
‑
末端延伸的单体fc多肽和第二多肽,其中人bmprii的细胞外结构域用位于细胞外结构域和单独的fc结构域之间的接头融合至该第二fc结构域。各个构建体分别被称为单体fc多肽和bmprii
‑
fc融合多肽,和各自的序列在下文提供。申请人还构思了另外的单臂bmprii
‑
fc异二聚体复合物,其包含bmprii同种型a的细胞外结构域(seq id no:72)。
[0688]
单臂bmprii
‑
fc异二聚体的形成可通过类似于实施例1中对于单臂actriib
‑
fc异二聚体所述的方法的方法指导。在第一方法中,以分别为seq id nos:107
‑
109和137
‑
139的bmprii
‑
fc和单体fc多肽序列举例说明,一个fc结构域经改变以在相互作用界面处引入阳离子氨基酸,而另一个fc结构域经改变以在相互作用界面处引入阴离子氨基酸。
[0689]
bmprii
‑
fc融合多肽使用tpa前导序列和如下:
[0690][0691][0692]
前导和接头序列用下划线表示。为了促进形成bmprii
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物(bmprii
‑
fc:bmprii
‑
fc或fc:fc),两个氨基酸置换(用赖氨酸替换阴离子残基)可被引入至融合多肽的fc结构域,如上文提供表示的。seq id no:107的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。
[0693]
该bmprii
‑
fc融合多肽通过以下核酸(seq id no:108)编码。
[0694][0695]
成熟的bmprii
‑
fc融合多肽序列如下(seq id no:109)和可任选地以c
‑
末端赖氨酸被除去来提供。
[0696][0697][0698]
如实施例1所述的,互补形式的单体人g1fc多肽(seq id no:137)使用tpa前导序列和掺有任选的n
‑
末端延伸。为了促进形成bmprii
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用阴离子残基替换赖氨酸)可被引入至单体fc多肽。seq id no:137的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。该互补fc多肽通过seq id no:138)的核酸编码,和成熟的单体fc多肽(seq id no:139)可任选地以c
‑
末端赖氨酸被除去来提供。
[0699]
分别为seq id no:103和seq id no:139的bmprii
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含bmprii
‑
fc:fc的单臂异聚蛋白复合物。
[0700]
在促进使用不对称的fc融合多肽的异多聚体复合物的形成的另一方法中,fc结构
域经改变以引入互补疏水相互作用和另外的分子间二硫键,如在分别为seq id nos:405
‑
406和425
‑
426的bmprii
‑
fc和fc多肽序列中举例说明的。
[0701]
bmprii
‑
fc融合多肽(seq id no:405)使用tpa前导序列和如下:
[0702][0703]
前导序列和接头用下划线表示。为了促进形成bmprii
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用半胱氨酸替换丝氨酸和用色氨酸替换苏氨酸)可被引入至bmprii融合多肽的fc结构域,如上文通过表示的。seq id no:405的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。
[0704]
成熟的bmprii
‑
fc融合多肽(seq id no:406)如下和可任选地以c
‑
末端赖氨酸被除去来提供。
[0705][0706]
如实施例1所述的,互补形式的单体g1fc多肽(seq id no:425)使用tpa前导序列和掺有任选的n
‑
末端延伸。为了促进形成bmprii
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,四个氨基酸置换可按所示被引入至单体fc多肽。seq id no:425的氨基酸序列和成熟的fc多肽(seq id no:426)可任选地以c
‑
末端赖氨酸被除去来提供。
[0707]
分别为seq id no:406和seq id no:426的bmprii
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含bmprii
‑
fc:fc的单臂异聚蛋白复合物。
[0708]
各种bmprii
‑
fc:fc复合物的纯化可通过一系列柱色谱步骤实现,包括例如,以任何次序的三个或更多个以下步骤:蛋白a色谱、q琼脂糖凝胶色谱、苯基琼脂糖凝胶色谱、分子排阻色谱和阳离子交换色谱。纯化可以病毒过滤和缓冲液交换完成。
[0709]
基于biacore
tm
‑
的结合测定法用于比较上述的单臂bmprii
‑
fc异二聚体复合物的配体结合选择性与bmprii
‑
fc同二聚体复合物的配体结合选择性。使用抗
‑
fc抗体将单臂bmprii
‑
fc和同二聚体bmprii
‑
fc独立地捕获在系统上。注入配体和允许流经捕获的受体蛋白。结果在下表中概述。
[0710][0711][0712]
这些比较的结合数据表明单臂bmprii
‑
fc异二聚体保留对由bmprii
‑
fc同二聚体结合的配体的仅一亚组的结合。特别地,尽管单臂bmprii
‑
fc异二聚体保留对bmp10和bmp15的结合,但对bmp9的结合基本上被消除。
[0713]
实施例5.单臂misrii
‑
fc异二聚体的产生
[0714]
申请人构思了可溶性单臂misrii
‑
fc异二聚体复合物的构建,其包含具有短的n
‑
末端延伸的单体fc多肽和第二多肽,其中人misrii的细胞外结构域用位于细胞外结构域和单独的fc结构域之间的接头融合至该第二fc结构域。各个构建体分别被称为单体fc多肽和misrii
‑
fc融合多肽,和各自的序列在下文提供。申请人还构思了另外的单臂misrii
‑
fc异二聚体复合物,其包含misrii同种型2或3的细胞外结构域(seq id nos:76,80)。
[0715]
单臂misrii
‑
fc异二聚体的形成可通过类似于实施例1中对于单臂actriib
‑
fc异二聚体所述的方法的方法指导。在第一方法中,以分别为seq id nos:110
‑
112和137
‑
139的misrii
‑
fc和单体fc多肽序列举例说明,一个fc结构域经改变以在相互作用界面处引入阳离子氨基酸,而另一个fc结构域经改变以在相互作用界面处引入阴离子氨基酸。
[0716]
misrii
‑
fc融合多肽使用tpa前导序列和如下:
[0717][0718]
前导和接头序列用下划线表示。为了促进形成misrii
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物(misrii
‑
fc:misrii
‑
fc或fc:fc),两个氨基酸置换(用赖氨酸替换阴离子残基)可被引入至融合多肽的fc结构域,如上文通过表示的。seq id no:110的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。
[0719]
成熟的misrii
‑
fc融合多肽序列如下(seq id no:112)和可任选地以c
‑
末端赖氨酸被除去来提供。
[0720][0721]
如实施例1所述的,互补形式的单体人g1fc多肽(seq id no:137)使用tpa前导序列和掺有任选的n
‑
末端延伸。为了促进形成misrii
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用阴离子残基替换赖氨酸)可按所示被引入至单体fc多肽。seq id no:137的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。该互补fc多肽通过seq id no:138的核酸编码,和成熟的单体fc多肽(seq id no:139)可任选地以c
‑
末端赖氨酸被除去来提供。
[0722]
分别为seq id no:112和seq id no:139的misrii
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含misrii
‑
fc:fc的单臂异聚蛋白复合物。
[0723]
在促进使用不对称的fc融合多肽的异多聚体复合物的形成的另一方法中,fc结构域经改变以引入互补疏水相互作用和另外的分子间二硫键,如在分别为seq id nos:407
‑
408和425
‑
426的misrii
‑
fc和fc多肽序列中举例说明的。
[0724]
misrii
‑
fc融合多肽(seq id no:407)使用tpa前导序列和如下:
[0725][0726]
前导序列和接头用下划线表示。为了促进形成misrii
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用半胱氨酸替换丝氨酸和用色氨酸替换苏氨酸)可被引入至misrii融合多肽的fc结构域,如上文通过表示的。seq id no:407的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。
[0727]
成熟的misrii
‑
fc融合多肽(seq id no:408)如下和可任选地以c
‑
末端赖氨酸被除去来提供。
[0728][0729]
如实施例1所述的,互补形式的单体g1fc多肽(seq id no:425)使用tpa前导序列和掺有任选的n
‑
末端延伸。为了促进形成misrii
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,四个氨基酸置换可按所示被引入至单体fc多肽。seq id no:425的氨基酸序列和成熟的fc多肽(seq id no:426)可任选地以c
‑
末端赖氨酸被除去来提供。
[0730]
分别为seq id no:408和seq id no:426的misrii
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含misrii
‑
fc:fc的单臂异聚蛋白复合物。
[0731]
各种misrii
‑
fc:fc复合物的纯化可通过一系列柱色谱步骤实现,包括例如,以任何次序的三个或更多个以下步骤:蛋白a色谱、q琼脂糖凝胶色谱、苯基琼脂糖凝胶色谱、分子排阻色谱和阳离子交换色谱。纯化可以病毒过滤和缓冲液交换完成。
[0732]
实施例6.单臂tgfβrii
‑
fc异二聚体的产生和表征
[0733]
申请人构建了可溶性单臂tgfβrii
‑
fc异二聚体复合物,其包含具有短的n
‑
末端延伸的单体fc多肽和第二多肽,其中人tgfβrii的细胞外结构域(短同种型,seq id no:43)用位于细胞外结构域和单独的fc结构域之间的接头融合至该第二fc结构域。各个构建体分别被称为单体fc多肽和tgfβrii
‑
fc融合多肽,和各自的序列在下文提供。申请人还构思了另外的单臂tgfβrii
‑
fc复合物,其包含tgfβrii同种型a的细胞外结构域(seq id no:68)以及单臂tgfβrii
‑
fc复合物,其中标准的tgfβrii的细胞外结构域(短同种型,seq id no:43)或tgfβrii同种型a的细胞外结构域(seq id no:68)包含源自本文所述的tgfβrii同种型c的
36个氨基酸插入(seq id no:95)。
[0734]
单臂tgfβrii
‑
fc异二聚体的形成可通过类似于实施例1中对于单臂actriib
‑
fc异二聚体所述的方法的方法指导。在第一方法中,以分别为seq id nos:113
‑
115和137
‑
139的tgfβrii
‑
fc和单体fc多肽序列举例说明,一个fc结构域经改变以在相互作用界面处引入阳离子氨基酸,而另一个fc结构域经改变以在相互作用界面处引入阴离子氨基酸。
[0735]
tgfβrii
‑
fc融合多肽使用tpa前导序列和如下:
[0736][0737]
前导和接头序列用下划线表示。为了促进形成tgfβrii
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物(tgfβrii
‑
fc:tgfβrii
‑
fc或fc:fc),两个氨基酸置换(用赖氨酸替换阴离子残基)可被引入至融合多肽的fc结构域,如上文通过表示的。seq id no:113的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。
[0738]
该tgfβrii
‑
fc融合多肽通过以下核酸(seq id no:114)编码。
[0739]
[0740][0741]
成熟的tgfβrii
‑
fc融合多肽序列如下(seq id no:115)和可任选地以c
‑
末端赖氨酸被除去来提供。
[0742][0743]
如实施例1所述的,互补形式的单体人g1fc多肽(seq id no:137)使用tpa前导序列和掺有任选的n
‑
末端延伸。为了促进形成tgfβrii
‑
fc:fc异二聚体而不是任一可能的同
二聚体复合物,两个氨基酸置换(用阴离子残基替换赖氨酸)可按所示被引入至单体fc多肽。seq id no:137的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。该互补fc多肽通过seq id no:138的核酸编码,和成熟的单体fc多肽(seq id no:139)可任选地以c
‑
末端赖氨酸被除去来提供。
[0744]
分别为seq id no:115和seq id no:139的tgfβrii
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含tgfβrii
‑
fc:fc的单臂异聚蛋白复合物。
[0745]
在促进使用不对称的fc融合多肽的异多聚体复合物的形成的另一方法中,fc结构域经改变以引入互补疏水相互作用和另外的分子间二硫键,如在分别为seq id nos:409
‑
410和425
‑
426的tgfβrii
‑
fc和fc多肽序列中举例说明的。
[0746]
tgfβrii
‑
fc融合多肽(seq id no:409)使用tpa前导序列和如下:
[0747][0748]
前导序列和接头用下划线表示。为了促进形成tgfβrii
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用半胱氨酸替换丝氨酸和用色氨酸替换苏氨酸)可被引入至tgfβrii融合多肽的fc结构域,如上文通过表示的。seq id no:409的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。
[0749]
成熟的tgfβrii
‑
fc融合多肽(seq id no:410)如下和可任选地以c
‑
末端赖氨酸被除去来提供。
[0750][0751][0752]
如实施例1所述的,互补形式的单体g1fc多肽(seq id no:425)使用tpa前导序列和掺有任选的n
‑
末端延伸。为了促进形成tgfβrii
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,四个氨基酸置换可按所示被引入至单体fc多肽。seq id no:425的氨基酸序列和成熟的单体fc多肽(seq id no:426)可任选地以c
‑
末端赖氨酸被除去来提供。
[0753]
分别为seq id no:410和seq id no:426的tgfβrii
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含tgfβrii
‑
fc:fc的单臂异聚蛋白复合物。
[0754]
各种tgfβrii
‑
fc:fc复合物的纯化可通过一系列柱色谱步骤实现,包括例如,以任
何次序的三个或更多个以下步骤:蛋白a色谱、q琼脂糖凝胶色谱、苯基琼脂糖凝胶色谱、分子排阻色谱和阳离子交换色谱。纯化可以病毒过滤和缓冲液交换完成。
[0755]
基于biacore
tm
‑
的结合测定法用于比较上述的单臂tgfβrii
‑
fc异二聚体复合物的配体结合选择性与tgfβrii
‑
fc同二聚体复合物的配体结合选择性。使用抗
‑
fc抗体将单臂tgfβrii
‑
fc和同二聚体tgfβrii
‑
fc独立地捕获在系统上。注入配体和允许流经捕获的受体蛋白。结果在下表中概述。
[0756][0757][0758]
实施例7.单臂alk1
‑
fc异二聚体的产生和表征
[0759]
申请人构建了可溶性单臂alk1
‑
fc异二聚体复合物,其包含具有短的n
‑
末端延伸的单体fc多肽和第二多肽,其中人alk1的细胞外结构域用位于细胞外结构域和单独的fc结构域之间的接头融合至该第二fc结构域。各个构建体分别被称为单体fc多肽和alk1
‑
fc融合多肽,和各自的序列在下文提供。
[0760]
单臂alk1
‑
fc异二聚体的形成可通过类似于实施例1中对于单臂actriib
‑
fc异二聚体所述的方法的方法指导。在第一方法中,以分别为seq id nos:116
‑
118和140
‑
142的alk1
‑
fc和单体fc多肽序列举例说明,一个fc结构域经改变以在相互作用界面处引入阳离子氨基酸,而另一个fc结构域经改变以在相互作用界面处引入阴离子氨基酸。
[0761]
alk1
‑
fc融合多肽使用tpa前导序列和如下:
[0762][0763]
前导和接头序列用下划线表示。为了促进形成alk1
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物(alk1
‑
fc:alk1
‑
fc或fc:fc),两个氨基酸置换(用阴离子氨基酸替换赖氨酸)可被引入至融合多肽的fc结构域,如上文通过表示的。seq id no:116的氨基酸序列可任选地以在c
‑
末端添加赖氨酸来提供。
[0764]
该alk1
‑
fc融合多肽通过以下核酸(seq id no:117)编码。
[0765]
[0766]
[0767][0768]
成熟的alk1
‑
fc融合多肽序列如下(seq id no:118)和可任选地以在c
‑
末端添加赖氨酸来提供。
[0769][0770]
如在实施例2中所描述的,互补形式的单体人g1fc多肽(seq id no:140)使用tpa前导序列和掺有任选的n
‑
末端延伸。为了促进形成alk1
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用赖氨酸替换阴离子残基)可按所示被引入至单体fc多肽。seq id no:140的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。该互补fc多肽通过seq id no:141的核酸编码,和成熟的单体fc多肽(seq id no:142)可任选地以c
‑
末端赖氨酸被除去来提供。
[0771]
分别为seq id no:118和seq id no:142的alk1
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含alk1
‑
fc:fc的单臂异聚蛋白复合物。
[0772]
在促进使用不对称的fc融合蛋白的异多聚体复合物的形成的另一方法中,fc结构域经改变以引入互补疏水相互作用和另外的分子间二硫键,如在分别为seq id nos:411
‑
412和427
‑
428的alk1
‑
fc和fc多肽序列中举例说明的。
[0773]
alk1
‑
fc融合多肽(seq id no:411)使用tpa前导序列和如下:
[0774][0775][0776]
前导序列和接头用下划线表示。为了促进形成alk1
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,四个氨基酸置换可被引入至alk1融合多肽的fc结构域,如上文通过表示的。seq id no:411的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。
[0777]
成熟的alk1
‑
fc融合多肽(seq id no:412)如下和可任选地以c
‑
末端赖氨酸被除去来提供。
[0778][0779]
如实施例2中所述的,互补形式的单体g1fc多肽(seq id no:427)使用tpa前导序列和掺有任选的n
‑
末端延伸。为了促进形成alk1
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用半胱氨酸替换丝氨酸和用色氨酸替换苏氨酸)可按所示被引入至单体fc多肽。seq id no:427的氨基酸序列和成熟的fc多肽(seq id no:428)可任选地以c
‑
末端赖氨酸被除去来提供。
[0780]
分别为seq id no:412和seq id no:428的alk1
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含alk1
‑
fc:fc的单臂异聚蛋白复合物。
[0781]
各种alk1
‑
fc:fc复合物的纯化可通过一系列柱色谱步骤实现,包括例如,以任何次序的三个或更多个以下步骤:蛋白a色谱、q琼脂糖凝胶色谱、苯基琼脂糖凝胶色谱、分子排阻色谱和阳离子交换色谱。纯化可以病毒过滤和缓冲液交换完成。
[0782]
基于biacore
tm
‑
的结合测定法用于比较上述的单臂alk1
‑
fc异二聚体复合物的配体结合选择性与alk1
‑
fc同二聚体复合物的配体结合选择性。使用抗
‑
fc抗体将单臂alk1
‑
fc和同二聚体alk1
‑
fc独立地捕获在系统上。注入配体和允许流经捕获的受体蛋白。结果在下表中概述,其中通常与最有效的配体捕捉物有关的配体离解速率(k
d
)通过灰色阴影表示。
[0783][0784]
这些比较的结合数据表明与同二聚体alk1
‑
fc比较,单臂alk1
‑
fc具有改变的配体选择性。单臂alk1
‑
frc保留与bmp10的强结合,如同二聚体alk1
‑
fc所观察到的,而比alk1
‑
fc同二聚体更不紧密地结合bmp9,因为bmp9结合单臂alk1
‑
fc的离解速率为其结合同二聚体ak1
‑
fc的大约10倍。这些结果表明单臂alk1
‑
fc是比actriib
‑
fc同二聚体更有选择性的拮抗剂。因此,在其中这样的选择性拮抗作用是有利的某些应用中,单臂alk1
‑
fc比同二聚体alk1
‑
fc更有用。实例包括治疗应用,其中需要保留bmp10的拮抗作用,但减少bmp9的拮抗作用。
[0785]
实施例8.单臂alk2
‑
fc异二聚体的产生
[0786]
申请人构思了可溶性单臂alk2
‑
fc异二聚体复合物的构建,其包含具有短的n
‑
末端延伸的单体fc多肽和第二多肽,其中人alk2的细胞外结构域用位于细胞外结构域和单独
的fc结构域之间的接头融合至该第二fc结构域。各个构建体分别被称为单体fc多肽和alk2
‑
fc融合多肽,和各自的序列在下文提供。
[0787]
单臂alk2
‑
fc异二聚体的形成可通过类似于实施例1中对于单臂actriib
‑
fc异二聚体所述的方法的方法指导。在第一方法中,以分别为seq id nos:119
‑
121和140
‑
142的alk2
‑
fc和单体fc多肽序列举例说明,一个fc结构域经改变以在相互作用界面处引入阳离子氨基酸,而另一个fc结构域经改变以在相互作用界面处引入阴离子氨基酸。
[0788]
alk2
‑
fc融合多肽使用tpa前导序列和如下:
[0789][0790]
前导和接头序列用下划线表示。为了促进形成alk2
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物(alk2
‑
fc:alk2
‑
fc或fc:fc),两个氨基酸置换(用阴离子氨基酸替换赖氨酸)可被引入至融合多肽的fc结构域,如上文通过表示的。seq id no:119的氨基酸序列可任选地以在c
‑
末端添加赖氨酸来提供。
[0791]
该alk2
‑
fc融合多肽通过以下核酸(seq id no:120)编码。
[0792]
[0793][0794]
成熟的alk2
‑
fc融合多肽序列如下(seq id no:121)和可任选地以在c
‑
末端添加赖氨酸来提供。
[0795][0796]
如实施例2中所述的,互补形式的单体人g1fc多肽(seq id no:140)使用tpa前导序列和掺有任选的n
‑
末端延伸。为了促进形成alk2
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用赖氨酸替换阴离子残基)可按所示的被引入至单体fc多肽。seq id no:140的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。该互补fc多肽通过seq id no:141的核酸编码,和成熟的单体fc多肽(seq id no:142)可任选地以c
‑
末端赖氨酸被除去来提供。
[0797]
分别为seq id no:121和seq id no:142的alk2
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含alk2
‑
fc:fc的单臂异聚蛋白复合物。
[0798]
在促进使用不对称的fc融合多肽的异多聚体复合物的形成的另一方法中,fc结构域经改变以引入互补疏水相互作用和另外的分子间二硫键,如在分别为seq id nos:413
‑
414和427
‑
428的alk2
‑
fc和fc多肽序列中举例说明的。
[0799]
alk2
‑
fc融合多肽(seq id no:413)使用tpa前导序列和如下:
[0800][0801][0802]
前导序列和接头用下划线表示。为了促进形成alk2
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,四个氨基酸置换可被引入至alk2融合多肽的fc结构域,如上文通过表示的。seq id no:413的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。
[0803]
成熟的alk2
‑
fc融合多肽(seq id no:414)如下和可任选地以c
‑
末端赖氨酸被除
去来提供。
[0804][0805]
如实施例2中所述的,互补形式的单体g1fc多肽(seq id no:427)使用tpa前导序列和掺有任选的n
‑
末端延伸。为了促进形成alk2
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用半胱氨酸替换丝氨酸和用色氨酸替换苏氨酸)可按所示的被引入至单体fc多肽。seq id no:427的氨基酸序列和成熟的fc多肽(seq id no:428)可任选地以c
‑
末端赖氨酸被除去来提供。
[0806]
分别为seq id no:414和seq id no:428的alk2
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含alk2
‑
fc:fc的单臂异聚蛋白复合物。
[0807]
各种alk2
‑
fc:fc复合物的纯化可通过一系列柱色谱步骤实现,包括例如,以任何次序的三个或更多个以下步骤:蛋白a色谱、q琼脂糖凝胶色谱、苯基琼脂糖凝胶色谱、分子排阻色谱和阳离子交换色谱。纯化可以病毒过滤和缓冲液交换完成。
[0808]
实施例9.单臂alk4
‑
fc异二聚体的产生
[0809]
申请人构思了可溶性单臂alk4
‑
fc异二聚体复合物的构建,其包含具有短的n
‑
末端延伸的单体fc多肽和其中人alk4的细胞外结构域用位于细胞外结构域和单独的fc结构域之间的接头融合至该第二fc结构域的第二多肽。各个构建体分别被称为单体fc多肽和alk4
‑
fc融合多肽,和各自的序列在下文提供。申请人还构思了另外的单臂alk4
‑
fc异二聚体复合物,其包含alk4同种型b的细胞外结构域(seq id no:84)。
[0810]
单臂alk4
‑
fc异二聚体的形成可通过类似于实施例1中对于单臂actriib
‑
fc异二聚体所述的方法的方法指导。在第一方法中,以分别为seq id nos:125
‑
127和140
‑
142的alk4
‑
fc和单体fc多肽序列举例说明,一个fc结构域经改变以在相互作用界面处引入阳离子氨基酸,而另一个fc结构域经改变以在相互作用界面处引入阴离子氨基酸。
[0811]
alk4
‑
fc融合多肽使用tpa前导序列和如下:
[0812][0813]
前导和接头序列用下划线表示。为了促进形成alk4
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物(alk4
‑
fc:alk4
‑
fc或fc:fc),两个氨基酸置换(用阴离子氨基酸替换赖氨酸)可被引入至融合多肽的fc结构域,如上文通过表示的。seq id no:125
的氨基酸序列可任选地以在c
‑
末端添加赖氨酸来提供。
[0814]
该alk4
‑
fc融合多肽通过以下核酸(seq id no:126)编码。
[0815]
[0816][0817]
[0818]
成熟的alk4
‑
fc融合多肽序列如下(seq id no:127)和可任选地以在c
‑
末端添加赖氨酸来提供。
[0819][0820]
如实施例2中所述的,互补形式的单体人g1fc多肽(seq id no:140)使用tpa前导序列和掺有任选的n
‑
末端延伸。为了促进形成alk4
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用赖氨酸替换阴离子残基)可按所示的被引入至单体fc多肽。seq id no:140的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。该互补fc多肽通过seq id no:141的核酸编码,和成熟的单体fc多肽(seq id no:142)可任选地以c
‑
末端赖氨酸被除去来提供。
[0821]
分别为seq id no:127和seq id no:142的alk4
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含alk4
‑
fc:fc的单臂异聚蛋白复合物。
[0822]
在促进使用不对称的fc融合多肽的异多聚体复合物的形成的另一方法中,fc结构域经改变以引入互补疏水相互作用和另外的分子间二硫键,如在分别为seq id nos:417
‑
418和427
‑
428的alk4
‑
fc和fc多肽序列中举例说明的。
[0823]
alk4
‑
fc融合多肽(seq id no:417)使用tpa前导序列和如下:
[0824][0825]
前导序列和接头用下划线表示。为了促进形成alk4
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,四个氨基酸置换可被引入至alk4融合多肽的fc结构域,如上文通过表示的。seq id no:417的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。
[0826]
成熟的alk4
‑
fc融合多肽(seq id no:418)如下和可任选地以c
‑
末端赖氨酸被除去来提供。
[0827][0828]
如实施例2中所述的,互补形式的单体g1fc多肽(seq id no:427)使用tpa前导序列和掺有任选的n
‑
末端延伸。为了促进形成alk4
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用半胱氨酸替换丝氨酸和用色氨酸替换苏氨酸)可按所示的被引入至单体fc多肽。seq id no:427的氨基酸序列和成熟的fc多肽(seq id no:428)可任选地以c
‑
末端赖氨酸被除去来提供。
[0829]
分别为seq id no:418和seq id no:428的alk4
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含alk4
‑
fc:fc的单臂异聚蛋白复合物。
[0830]
各种alk4
‑
fc:fc复合物的纯化可通过一系列柱色谱步骤实现,包括例如,以任何次序的三个或更多个以下步骤:蛋白a色谱、q琼脂糖凝胶色谱、苯基琼脂糖凝胶色谱、分子排阻色谱和阳离子交换色谱。纯化可以病毒过滤和缓冲液交换完成。
[0831]
实施例10.单臂alk5
‑
fc异二聚体的产生
[0832]
申请人构思了可溶性单臂alk5
‑
fc异二聚体复合物的构建,其包含具有短的n
‑
末端延伸的单体fc多肽和其中人alk5的细胞外结构域用位于细胞外结构域和单独的fc结构域之间的接头融合至该第二fc结构域的第二多肽。各个构建体分别被称为单体fc多肽和alk5
‑
fc融合多肽,和各自的序列在下文提供。申请人还构思了另外的单臂alk5
‑
fc异二聚体复合物,其包含alk5同种型2的细胞外结构域(seq id no:88)。
[0833]
单臂alk5
‑
fc异二聚体的形成可通过类似于实施例1中对于单臂actriib
‑
fc异二聚体所述的方法的方法指导。在第一方法中,以分别为seq id no:128
‑
130和140
‑
142的alk5
‑
fc和单体fc多肽序列举例说明,一个fc结构域经改变以在相互作用界面处引入阳离子氨基酸,而另一个fc结构域经改变以在相互作用界面处引入阴离子氨基酸。
[0834]
alk5
‑
fc融合多肽使用tpa前导序列和如下:
[0835][0836][0837]
前导和接头序列用下划线表示。为了促进形成alk5
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物(alk5
‑
fc:alk5
‑
fc或fc:fc),两个氨基酸置换(用阴离子氨基酸替换赖氨酸)可按所示的被引入至融合多肽的fc结构域。seq id no:128的氨基酸序列可任选地以在c
‑
末端添加赖氨酸来提供。
[0838]
该alk5
‑
fc融合多肽通过以下核酸(seq id no:129)编码。
[0839]
[0840][0841]
成熟的alk5
‑
fc融合多肽序列如下(seq id no:130)和可任选地以在c
‑
末端添加赖氨酸来提供。
[0842]
[0843][0844]
如实施例2中所述的,互补形式的单体人g1fc多肽(seq id no:140)使用tpa前导序列和掺有任选的n
‑
末端延伸。为了促进形成alk5
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用赖氨酸替换阴离子残基)可按所示的被引入至单体fc多肽。seq id no:140的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。该互补fc多肽通过seq id no:141的核酸编码,和成熟的单体fc多肽(seq id no:142)可任选地以c
‑
末端赖氨酸被除去来提供。
[0845]
分别为seq id no:130和seq id no:142的alk5
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含alk5
‑
fc:fc的单臂异聚蛋白复合物。
[0846]
在促进使用不对称的fc融合多肽的异多聚体复合物的形成的另一方法中,fc结构域经改变以引入互补疏水相互作用和另外的分子间二硫键,如在分别为seq id nos:419
‑
420和427
‑
428的alk5
‑
fc和fc多肽序列中举例说明的。
[0847]
alk5
‑
fc融合多肽(seq id no:419)使用tpa前导序列和如下:
[0848][0849]
前导序列和接头用下划线表示。为了促进形成alk5
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,四个氨基酸置换可被引入至alk5融合多肽的fc结构域,如上文通过表示的。seq id no:419的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。
[0850]
成熟的alk5
‑
fc融合多肽(seq id no:420)如下和可任选地以c
‑
末端赖氨酸被除去来提供。
[0851][0852]
如实施例2中所述的,互补形式的单体g1fc多肽(seq id no:427)使用tpa前导序列和掺有任选的n
‑
末端延伸。为了促进形成alk5
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用半胱氨酸替换丝氨酸和用色氨酸替换苏氨酸)可按所示的被引入至单体fc多肽。seq id no:427的氨基酸序列和成熟的单体g1fc多肽(seq id no:428)可任选地以c
‑
末端赖氨酸被除去来提供。
[0853]
分别为seq id no:420和seq id no:428的alk5
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含alk5
‑
fc:fc的单臂异聚蛋白复合物。
[0854]
各种alk5
‑
fc:fc复合物的纯化可通过一系列柱色谱步骤实现,包括例如,以任何次序的三个或更多个以下步骤:蛋白a色谱、q琼脂糖凝胶色谱、苯基琼脂糖凝胶色谱、分子排阻色谱和阳离子交换色谱。纯化可以病毒过滤和缓冲液交换完成。
[0855]
实施例11.单臂alk6
‑
fc异二聚体的产生
[0856]
申请人构思了可溶性单臂alk6
‑
fc异二聚体复合物的构建,其包含具有短的n
‑
末端延伸的单体fc多肽和第二多肽,其中人alk6的细胞外结构域用位于细胞外结构域和单独的fc结构域之间的接头融合至该第二fc结构域。各个构建体分别被称为单体fc多肽和alk6
‑
fc融合多肽,和各自的序列在下文提供。申请人还构思了另外的单臂alk6
‑
fc异二聚体复合物,其包含alk6同种型2的细胞外结构域(seq id no:92)。
[0857]
单臂alk6
‑
fc异二聚体的形成可通过类似于实施例1中对于单臂actriib
‑
fc异二聚体所述的方法的方法指导。在第一方法中,以分别为seq id nos:131
‑
133和140
‑
142的alk6
‑
fc和单体fc多肽序列举例说明,一个fc结构域经改变以在相互作用界面处引入阳离子氨基酸,而另一个fc结构域经改变以在相互作用界面处引入阴离子氨基酸。
[0858]
alk6
‑
fc融合多肽使用tpa前导序列和如下:
[0859][0860]
前导和接头序列用下划线表示。为了促进形成alk6
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物(alk6
‑
fc:alk6
‑
fc或fc:fc),两个氨基酸置换(用阴离子氨基酸替换赖氨酸)可被引入至融合多肽的fc结构域,如上文通过表示的。seq id no:131的氨基酸序列可任选地以在c
‑
末端添加赖氨酸来提供。
[0861]
该alk6
‑
fc融合多肽通过以下核酸(seq id no:132)编码。
[0862]
[0863]
[0864][0865]
成熟的alk6
‑
fc融合多肽序列如下(seq id no:133)和可任选地以在c
‑
末端添加赖氨酸来提供。
[0866][0867]
如实施例2中所述的,互补形式的单体人g1fc多肽(seq id no:140)使用tpa前导序列和掺有任选的n
‑
末端延伸。为了促进形成alk6
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用赖氨酸替换阴离子残基)可按所示的被引入至单体fc多肽。seq id no:140的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。该互补fc多肽通过seq id no:141的核酸编码,和成熟的单体fc蛋白(seq id no:142)可任选地以c
‑
末端赖氨酸被除去来提供。
[0868]
分别为seq id no:133和seq id no:142的alk6
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含alk6
‑
fc:fc的单臂异聚蛋白复合物。
[0869]
在促进使用不对称的fc融合多肽的异多聚体复合物的形成的另一方法中,fc结构域经改变以引入互补疏水相互作用和另外的分子间二硫键,如在分别为seq id nos:421
‑
422和427
‑
428的alk6
‑
fc和fc多肽序列中举例说明的。
[0870]
alk6
‑
fc融合多肽(seq id no:421)使用tpa前导序列和如下:
[0871][0872]
前导序列和接头用下划线表示。为了促进形成alk6
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,四个氨基酸置换可被引入至alk6融合多肽的fc结构域,如上文通过表示的。seq id no:421的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。
[0873]
成熟的alk6
‑
fc融合多肽(seq id no:422)如下和可任选地以c
‑
末端赖氨酸被除去来提供。
[0874][0875]
如实施例2中所述的,互补形式的单体g1fc多肽(seq id no:427)使用tpa前导序列和掺有任选的n
‑
末端延伸。为了促进形成alk6
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用半胱氨酸替换丝氨酸和用色氨酸替换苏氨酸)可按所示的被引入至单体fc多肽。seq id no:427的氨基酸序列和成熟的单体g1fc多肽(seq id no:428)可任选地以c
‑
末端赖氨酸被除去来提供。
[0876]
分别为seq id no:422和seq id no:428的alk6
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含alk6
‑
fc:fc的单臂异聚蛋白复合物。
[0877]
各种alk6
‑
fc:fc复合物的纯化可通过一系列柱色谱步骤实现,包括例如,以任何次序的三个或更多个以下步骤:蛋白a色谱、q琼脂糖凝胶色谱、苯基琼脂糖凝胶色谱、分子排阻色谱和阳离子交换色谱。纯化可以病毒过滤和缓冲液交换完成。
[0878]
实施例12.单臂alk7
‑
fc异二聚体的产生
[0879]
申请人构思了可溶性单臂alk7
‑
fc异二聚体复合物的构建,其包含具有短的n
‑
末端延伸的单体fc多肽和其中人alk7的n
‑
末端截短(nδ4)的细胞外结构域用位于细胞外结
构域和单独的fc结构域之间的接头融合至该第二fc结构域的第二多肽。各个构建体分别被称为单体fc多肽和alk7
‑
fc融合多肽,和各自的序列在下文提供。申请人还构思了另外的单臂alk7
‑
fc异二聚体复合物,其包含alk7同种型1的其它n
‑
末端截短变体(例如,nδ5变体)(seq id no:313)、alk7同种型2的细胞外结构域(seq id no:302)或alk7同种型3和4的天然加工序列(seq id nos:306,310)。
[0880]
单臂alk7
‑
fc异二聚体的形成可通过类似于实施例1中对于单臂actriib
‑
fc异二聚体所述的方法的方法指导。在第一方法中,以分别为seq id nos:134
‑
136和140
‑
142的alk7
‑
fc和单体fc多肽序列举例说明,一个fc结构域经改变以在相互作用界面处引入阳离子氨基酸,而另一个fc结构域经改变以在相互作用界面处引入阴离子氨基酸。
[0881]
alk7
‑
fc融合多肽使用tpa前导序列和如下:
[0882][0883][0884]
前导和接头序列用下划线表示。为了促进形成alk7
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物(alk7
‑
fc:alk7
‑
fc或fc:fc),两个氨基酸置换(用阴离子氨基酸替换赖氨酸)可被引入至融合多肽的fc结构域,如上文通过表示的。seq id no:134的氨基酸序列可任选地以在c
‑
末端添加赖氨酸来提供。
[0885]
该alk7
‑
fc融合多肽通过以下核酸(seq id no:135)编码。
[0886]
[0887][0888]
成熟的alk7
‑
fc融合多肽序列预期如下(seq id no:136)和可任选地以在c
‑
末端添加赖氨酸来提供。
[0889][0890][0891]
如实施例2中所述的,互补形式的单体人g1fc多肽(seq id no:140)使用tpa前导
序列和掺有任选的n
‑
末端延伸。为了促进形成alk7
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用赖氨酸替换阴离子残基)可按所示的被引入至单体fc多肽。seq id no:140的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。该互补fc多肽通过seq id no:141的核酸编码,和成熟的单体fc多肽(seq id no:142)可任选地以c
‑
末端赖氨酸被除去来提供。
[0892]
分别为seq id no:136和seq id no:142的alk7
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含alk7
‑
fc:fc的单臂异聚蛋白复合物。
[0893]
在促进使用不对称的fc融合多肽的异多聚体复合物的形成的另一方法中,fc结构域经改变以引入互补疏水相互作用和另外的分子间二硫键,如在分别为seq id nos:423
‑
424和427
‑
428的alk7
‑
fc和fc多肽序列中举例说明的。
[0894]
alk7
‑
fc融合多肽(seq id no:423)使用tpa前导序列和如下:
[0895][0896]
前导序列和接头用下划线表示。为了促进形成alk7
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,四个氨基酸置换可被引入至alk7融合多肽的fc结构域,如上文通过表示的。seq id no:423的氨基酸序列可任选地以c
‑
末端赖氨酸被除去来提供。
[0897]
成熟的alk7
‑
fc融合多肽(seq id no:424)预期如下和可任选地以c
‑
末端赖氨酸被除去来提供。
[0898][0899][0900]
如实施例2中所述的,互补形式的单体g1fc多肽(seq id no:427)使用tpa前导序列和掺有任选的n
‑
末端延伸。为了促进形成alk7
‑
fc:fc异二聚体而不是任一可能的同二聚体复合物,两个氨基酸置换(用半胱氨酸替换丝氨酸和用色氨酸替换苏氨酸)可按所示的被引入至单体fc多肽。seq id no:427的氨基酸序列和成熟的单体g1fc多肽(seq id no:428)可任选地以c
‑
末端赖氨酸被除去来提供。
[0901]
分别为seq id no:424和seq id no:428的alk7
‑
fc融合多肽和单体fc多肽可自cho细胞系共
‑
表达和纯化以产生包含alk7
‑
fc:fc的单臂异聚蛋白复合物。
[0902]
各种alk7
‑
fc:fc复合物的纯化可通过一系列柱色谱步骤实现,包括例如,以任何
次序的三个或更多个以下步骤:蛋白a色谱、q琼脂糖凝胶色谱、苯基琼脂糖凝胶色谱、分子排阻色谱和阳离子交换色谱。纯化可以病毒过滤和缓冲液交换完成。
[0903]
总之,这些实施例证实了i型或ii型受体多肽,当处于单臂异聚蛋白复合物的情况下时,形成新的结合口袋,其相对于相同的受体多肽的同二聚体复合物显示改变的选择性,允许形成可能用作治疗剂的新的蛋白试剂。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1