一种多取代吡唑类化合物的合成方法与流程
1.本发明属于有机合成技术领域,具体涉及一种多取代吡唑类化合物的合成方法。
背景技术:
2.吡唑是一类重要的五元含氮杂环化合物,广泛存在于许多天然产物、生物活性分子和药物分子中,而且是一类重要的有机合成中间体。
3.现有技术中,多取代吡唑类化合物的制备方法主要有两种:一种是利用knorr吡唑合成法制备,二是通过亲电或者亲核取代反应来对吡唑类化合物进行结构修饰。对于前者而言,反应催化剂为浓酸且反应温度要求较高,这对于生产安全和绿色发展有较大的冲突。对于后者来说,由于吡唑环独特的空间结构和电子效应,使得反应想要在特定位点引入目标基团会很困难,因此限制了其在生产中的广泛运用。
4.腙作为一类很好的试剂已经被广泛应用于有机合成中构建各种各样的环类化合物,腙可以在碱的作用下失去质子,进行结构互变,然后和烯醛进行michael加成得到中间体,随后发生分子内环化而得到多取代吡唑类化合物。但现有技术,采用腙作为起始原料只能合成一种吡唑类化合物,并且存在合成路线冗长、原子不经济、环境不友好、操作繁琐的问题。
5.因此,提供一种多取代吡唑类化合物的合成方法,能同时合成不止一种吡唑类化合物,且操作简单,成本低廉,对环境友好,成为了本领域技术人亟待解决的问题。
技术实现要素:
6.本发明的目的在于,提供一种多取代吡唑类化合物的合成方法,以廉价易得的商品为原料,在非常便宜的碱催化及环境无害的溶剂作用下,只需要常温反应即可同时构建了1,3,4-三取代及1,3,4,5-四取代多取代吡唑类化合物;解决了该类化合物骨架在合成过程中路线冗长、原子不经济、环境不友好、操作繁琐等问题。
7.为实现上述目的,本发明采用的技术方案如下:
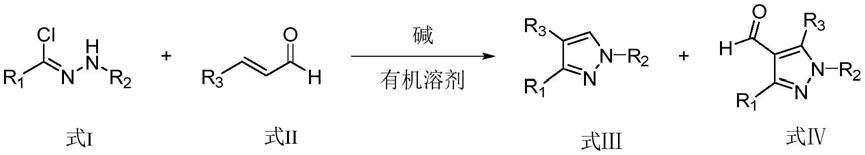
8.本发明公开的多取代吡唑类化合物的合成方法,式i化合物与式ii化合物在碱性条件下反应,生成式ⅲ化合物和式ⅳ化合物,其反应式为:
[0009][0010]
;其中r1选自取代或未取代的苯基、萘基、茚基、呋喃基、嘧啶基、吲哚基、噻唑基或噻吩基;
[0011]
r2选自取代或未取代的苯基、萘基、茚基、呋喃基、嘧啶基、吲哚基、噻唑基或噻吩基;
[0012]
r3选自取代或未取代的苯基、萘基、茚基、呋喃基、嘧啶基、吲哚基、噻唑基或噻吩
基。
[0013]
本发明方法能够同时合成1,3,4-三取代及1,3,4,5-四取代吡唑两种吡唑类化合物。对于合成产物1,3,4,5-四取代吡唑化合物,可以对4位醛基进行结构修饰,从而引入目标官能团而具有不同的生物活性。
[0014]
本发明的部分实施方案中,r1的取代基选自卤素或甲氧基;优选地,选自氯、氟、溴、甲氧基中的至少一种;更优选地,r1的取代基不同位。
[0015]
本发明的部分实施方案中,r2的取代基选自卤素、甲基或甲氧基;优选地,选自氯、氟、甲基、甲氧基中的至少一种;更优选地,r2的取代基不同位。
[0016]
本发明的部分实施方案中,r3的取代基选自卤素或甲氧基;优选地,选自氯、溴、甲氧基中的至少一种;更优选地,r3的取代基为对位取代。
[0017]
本发明的部分实施方案中,所述有机溶剂选自四氢呋喃、乙酸乙酯、乙腈、二氯甲烷、乙醇中的至少一种;优选为乙醇。
[0018]
本发明的部分实施方案中,所述碱选自et3n、cs2co3、k2co3、dbu、dipea中的任意一种;优选为k2co3。
[0019]
本发明的部分实施方案中,所述式i化合物、式ii化合物、碱的质量比为1:1.2:0.5-1:1.2:2.5;优选为1:1.2:2.5。
[0020]
本发明的部分实施方案中,反应温度为10~40℃,优选为室温。
[0021]
本发明的部分实施方案中,还包括精制步骤,优选地,所述精制步骤包括柱层析、重结晶。
[0022]
本发明所述的室温为10~30℃。
[0023]
与现有技术相比,本发明具有以下有益效果:
[0024]
本发明设计科学,构思巧妙,方法简单,操作简便。采用本发明方法能合成含有多种取代基的吡唑类化合物,副产物较少,易于纯化。且本发明方法能够同时合成1,3,4-三取代及1,3,4,5-四取代吡唑两种吡唑类化合物,解决了已知生产方法中只能合成一种吡唑类化合物的限制,增加了此方法的适用范围。
[0025]
对于合成产物1,3,4,5-四取代吡唑化合物,可以对4位醛基进行结构修饰,从而引入目标官能团而具有不同的生物活性。
[0026]
本发明原料廉价易得,有效地降低了反应成本,溶剂无毒无害,不需要金属催化剂,绿色环保;反应条件简单,不需要加热或者惰性气体保护,常温空气中即可以高产率得到目标化合物,为含此类骨架活性分子合成提供了新的路线选择,具有很好的工业化应用前景。
附图说明
[0027]
附图1为实施例7制得的式
ⅲ‑
6化合物的氢谱图;
[0028]
附图2为实施例7制得的式
ⅲ‑
6化合物的碳谱图;
[0029]
附图3为实施例7制得的式
ⅳ‑
6化合物的氢谱图;
[0030]
附图4为实施例7制得的式
ⅳ‑
6化合物的碳谱图;
[0031]
附图5为实施例7制得的式
ⅲ‑
6化合物的质谱图;
[0032]
附图6为实施例7制得的式
ⅳ‑
6化合物的质谱图。
具体实施方式
[0033]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0034]
实施例1
[0035]
本实施例以式i-1化合物n-苯基苯并腙酰氯与式ii-1化合物肉桂醛为标准底物,制备式
ⅲ‑
1化合物1,3,4-三苯基-1h-吡唑和式
ⅳ‑
1化合物1,3,5-三苯基-1h-吡唑-4-甲醛,其反应式为:
[0036][0037]
具体操作为:将10ml反应管和磁力搅拌子预先干燥,然后向反应管中分别加入100mgn-苯基苯并腙酰氯(0.435mmol)和150.2mg k2co3(1.087mmol),再加入2.2ml乙醇溶剂,最后加入69.00mg肉桂醛(0.522mmol),将整个反应置于常温下反应,tlc监测整个反应进程,反应结束后,将溶剂浓缩,所得粗产品用石油醚和乙酸乙酯混合液(30/1,v/v)作洗脱剂,以300-400目硅胶为分离树脂进行柱层析分离得到1,3,4-三苯基-1h-吡唑(59.18mg,淡黄色油状)与1,3,5-三苯基-1h-吡唑-4-甲醛(74.64mg,黄色固体),式
ⅲ‑
1化合物产率为45.99%,式
ⅳ‑
1化合物产率为53.00%。
[0038]
式
ⅲ‑
1化合物:1h nmr(600mhz,cdcl3)δ8.02(s,1h),7.82
–
7.78(m,2h),7.64
–
7.57(m,2h),7.50
–
7.45(m,2h),7.38
–
7.31(m,7h),7.31
–
7.27(m,2h).
13
c nmr(151mhz,cdcl3)δ150.26,139.70,132.89,132.63,129.25,128.48,128.32,128.24,128.11,127.70,126.73,126.44,126.25,122.71,118.74.hrms-esi(m/z):[m+h]
+
calcd for c
21h17n2 297.1392;found,297.1385.
[0039]
式
ⅳ‑
1化合物:1h nmr(600mhz,cdcl3)δ9.87(s,1h),7.97
–
7.92(m,2h),7.50
–
7.39(m,6h),7.37
–
7.34(m,2h),7.34
–
7.28(m,5h).
13
c nmr(151mhz,cdcl3)δ185.66,153.84,149.15,138.73,131.52,130.63,129.84,129.27,129.17,129.03,128.65,128.36,128.27,127.72,125.39,118.73.hrms-esi(m/z):[m+h]
+
calcd for c
22h17
n2o 325.1341;found,325.1333.
[0040]
实施例2
[0041]
本实施例以式i-1化合物n-苯基苯并腙酰氯与式ii-1化合物肉桂醛为标准底物,对碱催化的多取代吡唑类化合物合成的反应条件进行研究,其反应式为:
[0042][0043]
反应条件、及结果如表1所示:
[0044]
表1
[0045][0046]
表1中,“equiv”表示当量;温度“rt”为室温;a为反应体系中加入了2.5当量ddq;b为无水无氧条件。
[0047]
实施例3
[0048]
本实施例公开了式
ⅲ‑
2化合物(4-溴苯基)-1,3-二苯基-1h-吡唑与式
ⅳ‑
2化合物5-(4-溴苯基)-3-(环己-1,3-二烯-1-基)-1-苯基-1h-吡唑-4-甲醛的制备:
[0049][0050]
将10ml反应管和磁力搅拌子预先干燥,然后向反应管中分别加入100mgn-苯基苯并腙酰氯(0.435mmol)和150.2mg k2co3(1.087mmol),再加入2.2ml乙醇溶剂,最后加入110.17mg对溴肉桂醛(0.522mmol),将整个反应置于常温下反应,tlc监测整个反应进程,反应结束后,将溶剂浓缩,所得粗产品用石油醚和乙酸乙酯混合液(30/1,v/v)作洗脱剂,以300-400目硅胶为分离树脂进行柱层析分离得到(4-溴苯基)-1,3-二苯基-1h-吡唑(47.4mg,淡黄色油状)与5-(4-溴苯基)-3-(环己-1,3-二烯-1-基)-1-苯基-1h-吡唑-4-甲醛(75.7mg,黄色固体),产率:式
ⅲ‑
2为29.15%,式
ⅳ‑
2为43.51%。
[0051]
式
ⅲ‑
2化合物:1h nmr(600mhz,cdcl3)δ8.01(s,1h),7.81
–
7.77(m,2h),7.60
–
7.54(m,2h),7.51
–
7.44(m,4h),7.38
–
7.33(m,3h),7.33
–
7.29(m,1h),7.24
–
7.19(m,2h).
13
c nmr(151mhz,cdcl3)δ149.11,138.46,131.46,130.48,130.37,128.89,128.17,127.12,126.78,125.31,125.24,120.39,119.60,117.68.hrms-esi(m/z):[m+h]
+
calcd for c
21h16
brn
2 375.0497;found,375.0489.
[0052]
式
ⅳ‑
2化合物:1h nmr(600mhz,cdcl3)δ9.90(s,1h),7.90
–
7.86(m,2h),7.55
–
7.52(m,2h),7.51
–
7.44(m,3h),7.38
–
7.34(m,3h),7.32
–
7.28(m,2h),7.25
–
7.22(m,2h).
13
c nmr(151mhz,cdcl3)δ185.49,154.56,146.93,138.47,132.14,131.89,131.23,129.30,129.23,128.56,128.51,126.69,125.47,124.50,118.62.hrms-esi(m/z):[m+na]
+
calcd for c
22h15
brn2nao 425.0265;found,425.0258.
[0053]
实施例4
[0054]
本实施例公开了式
ⅲ‑
3化合物1,4-二苯基-3-(噻吩-2-基)-1h-吡唑与式
ⅳ‑
3化合物1,5-二苯基-3-(噻吩-2-基)-1h-吡唑-4-甲醛的制备:
[0055][0056]
将10ml反应管和磁力搅拌子预先干燥,然后向反应管中分别加入100mgn-苯基噻吩-2-碳腙酰氯(0.42mmol)和145.18mg k2co3(1.05mmol),再加入2.1ml乙醇溶剂,最后加入66.61mg肉桂醛(0.504mmol),将整个反应置于常温下反应,tlc监测整个反应进程,反应结束后,将溶剂浓缩,所得粗产品用石油醚和乙酸乙酯混合液(30/1,v/v)作洗脱剂,以300-400目硅胶为分离树脂进行柱层析分离得到1,4-二苯基-3-(噻吩-2-基)-1h-吡唑(21.7mg,橘色固体)与1,5-二苯基-3-(噻吩-2-基)-1h-吡唑-4-甲醛(56.2mg,棕褐色油状),产率:式
ⅲ‑
3为16.96%,式
ⅳ‑
3为40.43%。
[0057]
式
ⅲ‑
3化合物:1h nmr(600mhz,cdcl3)δ7.95(s,1h),7.80
–
7.75(m,2h),7.52
–
7.43(m,4h),7.43
–
7.38(m,2h),7.38
–
7.34(m,1h),7.33
–
7.28(m,1h),7.27
–
7.24(m,1h),7.08(dd,j=3.6,1.2hz,1h),6.95(dd,j=5.1,3.6hz,1h).
13
c nmr(151mhz,cdcl3)δ145.21,
139.72,135.29,132.48,129.49,129.29,128.57,127.49,127.27,126.96,126.56,125.98,125.31,122.71,118.96.hrms-esi(m/z):[m+h]
+
calcd for c
19h15
n2s 303.0956;found,303.0949.
[0058]
式
ⅳ‑
3化合物:1h nmr(600mhz,cdcl3)δ9.83(s,1h),8.29(dd,j=3.7,1.2hz,1h),7.48
–
7.44(m,1h),7.44
–
7.38(m,3h),7.35
–
7.30(m,5h),7.29(dt,j=7.1,2.2hz,2h),7.15(dd,j=5.1,3.7hz,1h).
13
c nmr(151mhz,cdcl3)δ185.27,150.34,147.37,138.44,133.82,130.63,130.01,129.70,129.05,128.81,128.35,127.70,127.43,127.06,125.34,118.35.hrms-esi(m/z):[m+h]
+
calcd for c
20h15
n2os 331.0905;found,331.0897.
[0059]
实施例5
[0060]
本实施例公开了式
ⅲ‑
4化合物1-(4-甲氧基苯基)-3-(萘-2-基)-4-苯基-1h-吡唑与式
ⅳ‑
4化合物1-(4-甲氧基苯基)-3-(萘-2-基)-5-苯基-1h-吡唑-4-甲醛的制备:
[0061][0062]
将10ml反应管和磁力搅拌子预先干燥,然后向反应管中分别加入100mgn-(4-甲氧基苯基)-2-萘基腙酰氯(0.323mmol)和111.46mg k2co3(0.806mmol),再加入2.1ml乙醇溶剂,最后加入51.23mg肉桂醛(0.39mmol),将整个反应置于常温下反应,tlc监测整个反应进程,反应结束后,将溶剂浓缩,所得粗产品用石油醚和乙酸乙酯混合液(30/1,v/v)作洗脱剂,以300-400目硅胶为分离树脂进行柱层析分离得到1-(4-甲氧基苯基)-3-(萘-2-基)-4-苯基-1h-吡唑(46.7mg,黄色油状)与1-(4-甲氧基苯基)-3-(萘-2-基)-5-苯基-1h-吡唑-4-甲醛(63.9mg,红色固体),产率:式
ⅲ‑
4为38.50%,式
ⅳ‑
4为49.15%。
[0063]
式
ⅲ‑
4:1h nmr(600mhz,cdcl3)δ8.12
–
8.09(m,1h),7.97(s,1h),7.87
–
7.81(m,1h),7.81
–
7.75(m,2h),7.77
–
7.71(m,2h),7.69(dd,j=8.5,1.7hz,1h),7.49
–
7.42(m,2h),7.40
–
7.35(m,2h),7.35
–
7.27(m,3h),7.05
–
6.99(m,2h),3.87(s,3h).
13
c nmr(151mhz,cdcl3)δ158.35,149.93,133.76,133.41,132.97,132.95,130.77,128.73,128.58,128.35,127.80,127.66,127.33,126.97,126.94,126.58,126.01,125.99,122.77,120.80,114.60,55.63.hrms-esi(m/z):[m+h]
+
calcd for c
26h21
n2o 377.1654;found,377.1648.
[0064]
式
ⅳ‑
4:1h nmr(600mhz,cdcl3)δ9.91(s,1h),8.52(d,j=1.7hz,1h),8.06(dd,j=8.5,1.8hz,1h),7.98
–
7.91(m,2h),7.89
–
7.82(m,1h),7.54
–
7.48(m,2h),7.46
–
7.38(m,3h),7.37
–
7.32(m,2h),7.31
–
7.21(m,2h),6.85
–
6.78(m,2h),3.77(s,3h).
13
c nmr(151mhz,cdcl3)δ184.10,157.73,151.85,147.77,132.04,131.62,130.15,129.06,128.17,127.42,127.28,127.10,127.03,126.28,126.14,126.11,125.17,125.10,124.97,124.61,117.07,112.60,53.90.hrms-esi(m/z):[m+h]
+
calcd for c
27h21
n2o
2 405.1603;found,405.1600.
[0065]
实施例6
[0066]
本实施例公开了式
ⅲ‑
5化合物4-(4-氯苯基)-3-(3-氟苯基)-1-均三甲苯基-1h-吡唑与式
ⅳ‑
5化合物5-(4-氯苯基)-3-(3-氟苯基)-1-均三甲苯基-1h-吡唑-4-甲醛的制备:
[0067][0068]
将10ml反应管和磁力搅拌子预先干燥,然后向反应管中分别加入100mg3-氟-n-均三甲基苯基苯并腙酰氯(0.344mmol)和118.74mg k2co3(0.859mmol),再加入1.7ml乙醇溶剂,最后加入68.78mg对氯肉桂醛(0.413mmol),将整个反应置于常温下反应,tlc监测整个反应进程,反应结束后,将溶剂浓缩,所得粗产品用石油醚和乙酸乙酯混合液(30/1,v/v)作洗脱剂,以300-400目硅胶为分离树脂进行柱层析分离得到4-(4-氯苯基)-3-(3-氟苯基)-1-均三甲苯基-1h-吡唑(35.00mg,黄色油状)与5-(4-氯苯基)-3-(3-氟苯基)-1-均三甲苯基-1h-吡唑-4-甲醛(95.7mg,黄色固体),产率:式
ⅲ‑
5为26.12%,式
ⅳ‑
5为66.64%。
[0069]
式
ⅲ‑
5化合物:1h nmr(600mhz,cdcl3)δ7.52(s,1h),7.35
–
7.26(m,7h),7.03
–
6.97(m,3h),2.34(s,3h),2.11(s,6h).
13
c nmr(151mhz,cdcl3)δ161.99(d,j=245.1hz),147.22(d,j=2.4hz),138.39,135.67,134.86,134.57(d,j=8.1hz),132.01,130.56,130.53,129.20,129.02(d,j=8.4hz),128.17,128.02,123.26(d,j=2.8hz),119.26,114.41(d,j=22.5hz),113.84(d,j=21.0hz),20.34,16.69.hrms-esi(m/z):[m+h]
+
calcd for c
24h21
clfn
2 391.1377;found,391.1373.
[0070]
式
ⅳ‑
5化合物:1h nmr(600mhz,cdcl3)δ9.92(s,1h),7.75(dt,j=7.7,1.2hz,1h),7.72
–
7.67(m,1h),7.44(td,j=8.0,5.8hz,1h),7.34
–
7.29(m,2h),7.24
–
7.18(m,2h),7.17
–
7.11(m,1h),6.89(s,2h),2.29(s,3h),1.98(s,6h).
13
c nmr(151mhz,cdcl3)δ185.22,162.70(d,j=245.7hz),152.99(d,j=2.7hz),149.23,139.87,136.25,135.36,134.03,133.62(d,j=8.4hz),131.12,129.87(d,j=8.3hz),129.28,128.82,125.55,125.05(d,j=2.9hz),117.28,116.22(d,j=22.6hz),116.08(d,j=20.7hz),21.15,17.78.hrms-esi(m/z):[m+h]
+
calcd for c
25h21
clfn2o 419.1326;found,419.1321.
[0071]
实施例7
[0072]
本实施例公开了式
ⅲ‑
6化合物3-(3-氯苯基)-1,4-双(4-甲氧基苯基)-1h-吡唑与式
ⅳ‑
6化合物3-(3-氯苯基)-1,5-双(4-甲氧基苯基)-1h-吡唑-4-甲醛的制备:
[0073][0074]
将10ml反应管和磁力搅拌子预先干燥,然后向反应管中分别加入100mg3-氯-n-(4-甲氧基苯基)苯并腙酰氯(0.340mmol)和117.53mg k2co3(0.850mmol),再加入1.7ml乙醇溶剂,最后加入66.18mg对甲氧基肉桂醛(0.41mmol),将整个反应置于常温下反应,tlc监测整个反应进程,反应结束后,将溶剂浓缩,所得粗产品用石油醚和乙酸乙酯混合液(30/1,v/
v)作洗脱剂,以300-400目硅胶为分离树脂进行柱层析分离得到3-(3-氯苯基)-1,4-双(4-甲氧基苯基)-1h-吡唑(38.80mg,淡黄色油状)与3-(3-氯苯基)-1,5-双(4-甲氧基苯基)-1h-吡唑-4-甲醛(74.30mg,红色固体)的制备,产率:式
ⅲ‑
6为29.24%,式
ⅳ‑
6为52.25%;
[0075]
式
ⅲ‑
6化合物:1h nmr(600mhz,cdcl3)δ7.86(d,j=1.5hz,1h),7.71
–
7.65(m,3h),7.40(dq,j=7.6,1.5hz,1h),7.33
–
7.16(m,4h),6.99(dd,j=8.9,1.6hz,2h),6.89(dd,j=8.6,1.7hz,2h),3.86(d,j=1.4hz,3h),3.84(d,j=1.5hz,3h).
13
c nmr(151mhz,cdcl3)δ158.82,158.37,148.39,135.21,134.24,133.62,129.87,129.48,128.20,127.74,126.73,126.49,124.87,122.35,120.67,114.58,114.09,55.62,55.31.hrms-esi(m/z):[m+h]
+
calcd for c
23h20
cln2o2391.1213;found,391.1205.
[0076]
式
ⅳ‑
6化合物:1h nmr(600mhz,cdcl3)δ9.82(s,1h),7.98(dt,j=1.7,1.1hz,1h),7.88(pd,j=4.5,1.6hz,1h),7.43
–
7.37(m,2h),7.28
–
7.23(m,2h),7.25
–
7.19(m,2h),6.95
–
6.89(m,2h),6.88
–
6.82(m,2h),3.84(s,3h),3.80(s,3h).
13
c nmr(151mhz,cdcl3)δ185.53,160.69,159.32,151.87,149.69,134.19,133.51,132.05,131.73,129.50,129.09,129.07,127.52,126.70,119.38,118.28,114.24,114.19,55.53,55.37.hrms-esi(m/z):[m+na]
+
calcd for c
24h19
cln2nao3441.0982;found,441.0980.
[0077]
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1