可溶性人源IL-6Rα蛋白的制备方法
可溶性人源il-6r
α
蛋白的制备方法
技术领域
1.本发明涉及分子生物学以及生物工程领域,具体涉及一种可溶性人源il-6rα蛋白的制备方法。
背景技术:
2.早期研究发现il-6可以作为b细胞刺激分化因子,诱导b细胞分泌免疫球蛋白。目前已公认il-6是一种多效性的细胞因子,参与多种细胞的生长与分化,且可以有效调节机体的免疫反应,尤其在急性期反应中有重要作用。il-6的多效性作用主要体现在以下几个方面:在肝急性期反应中,il-6可以诱导c反应蛋白、补体蛋白、血清淀粉样蛋白生成,促使肝转移,其次在血管中il-6可以导致血管内皮生长因子过量生成,从而使血管渗透性增强。在适应性免疫应答中,il-6参与了cd4+t细胞的特异性分化,包括th17细胞分化增强,treg细胞分化减弱,导致这两者的比例失调,引起自身免疫性疾病。正是由于il-6的多效性,il-6过多产生或者持续性表达都会导致一系列慢性疾病以及自身免疫疾病,如castleman病中il-6过多与淋巴结肿大有关;类风湿性关节炎患者的滑液中il-6过多导致血管渗透性增强,易骨质疏松;视神经脊髓炎患者中会因为il-6支持成纤维细胞的存活而产生抗水通道蛋白抗体。因此靶向il-6的信号通路成为有效治疗手段。
3.il-6信号通路有三条路径:经典信号通路、反式信号通路以及反式呈递。在经典信号通路中,il-6与膜结合性il-6rα结合,诱使gp130发生二聚化,从而诱导胞内信号级联反应;在反式信号通路中,膜结合性il-6rα经金属蛋白酶切割后成为可溶性il-6rα,而gp130+细胞是普遍存在的,因此相比经典信号来说作用范围更广;反式呈递则是体现细胞间的相互作用;这三条路径最终结果是引起胞内信号级联反应。目前研究表明针对以上il-6信号通路已开发出抗il-6、抗il-6rα单克隆抗体以及sgp130-fc进行治疗,但美中不足的是这些单克隆抗体分子量大,不易透过血脑屏障、胎儿屏障,与之相反的是纳米抗体分子量小又稳定,能透过血胎屏障,为治疗与il-6相关疾病提供更广泛的治疗策略。天然纳米抗体的产生条件是需要将免疫蛋白免疫羊驼,因此本发明是想表达出可溶性il-6rα蛋白,纯度高,不含有标签,免疫羊驼后可产生该蛋白的特异性纳米抗体,也就为后续纳米抗体研究提供了重要基础。
4.由于原核生物表达系统表达真核蛋白时不能进行相关修饰,缺乏辅助因子,该系统表达的蛋白易形成包涵体,或者不表达,而真核表达系统具有复杂的调控系统,使表达产物适当修饰。然而真核表达方法众多,所表达的蛋白有所不一样,目前所报道的cho(中国仓鼠卵巢细胞)真核表达系统纯化工艺较为复杂,耗时长,成本高,而且目前售卖的真核表达的可溶性人源il-6rα蛋白价格非常昂贵,10ug就接近3000元。此外,目前市售的真核表达的可溶性人源il-6rα蛋白通常含有标签,不利于特异性纳米抗体的开发。迄今为止,本领域尚未提供一种用于制备纯度高并且不含标签的可溶性人源il-6rα蛋白的制备方法。
技术实现要素:
5.有鉴于此,本发明的目的在于提供一种可溶性人源il-6rα蛋白的制备方法。
6.为实现上述目的,本发明提供了一种可溶性人源il-6rα蛋白的制备方法,其特征在于利用gibson assembly快速将可溶性人源il-6rα基因片段组装到线性化ptt5载体,构建真核表达载体ptt5-h-il-6rα-fc,采用真核表达系统表达融合蛋白h-il-6rα-fc,进行tev酶切过夜后过蛋白a-ni-nta混合柱纯化分离得到可溶性人源h-il-6rα蛋白,步骤如下:
7.a.以人的cdna文库为模板,克隆扩增出含有线性化ptt5载体同源序列的可溶性人源il-6rα基因片段;
8.b.利用gibson assembly快速将可溶性人源il-6rα基因片段组装到线性化ptt5载体,构建真核表达载体ptt5-h-il-6rα-fc;
9.c.将构建成功且测序正确的质粒ptt5-h-il-6rα-fc利用pei瞬时转染入hek293f细胞,之后大量悬浮培养hek293f细胞;
10.d.收集培养基上清,利用蛋白a柱亲和层析提取培养基上清中的融合蛋白h-il-6rα-fc,0.1m乙酸梯度洗脱下来,进行tev酶切过夜,再经蛋白a-ni-nta流穿得到可溶性人源il-6rα蛋白。
11.更进一步地,所述步骤a中扩增含有线性化ptt5载体同源序列的可溶性人源il-6rα基因片段的引物序列为:
12.上游引物:
13.aagtcaagctgctctctgggcgtcgacctggccccaaggcgctgccctg,如seq id no:1所示;
14.下游引物:
15.ttggaaataaagattctcagaacctctagatgggaggcttgtcgcatttgcagaatctctg,如seq id no:2所示。
16.更进一步地,所述步骤a中含有线性化ptt5载体同源序列的可溶性人源il-6rα基因片段序列如seq id no:4所示。
17.更进一步地,所述步骤b中gibson assembly快速组装基因需要5
×
t5外切酶,且gibson连接的合适温度为50℃18min,真核表达载体为改造后的线性化载体ptt5-tev-fc。
18.更进一步地,所述步骤c中测序验证载体是否构建成功,将构建成功的载体进行细胞转染,而hek293f细胞为悬浮细胞,用含青霉素-链霉素的无血清培养基进行培养,转染密度为2
×
10
6-3
×
106个/ml,且每100ml hek293f细胞需要0.1mg质粒,0.4mg pei(1mg/ml),5ml dmem高糖。
19.更进一步地,所述步骤d中蛋白a柱亲和层析提取培养上清中的融合蛋白时采用的离心参数为4℃5000rpm离心20min,蛋白a柱提取蛋白时流速为2.5ml/min,蛋白a-ni-nta纯化时流速为2ml/min。
20.本发明的可溶性人源il-6rα蛋白制备方法中,克隆扩增出可溶性人源il-6rα基因片段,gibson assembly快速将可溶性人源il-6rα基因片段组装到线性化ptt5载体,构建真核表达载体ptt5-h-il-6rα-fc,采用真核表达系统表达融合蛋白h-il-6rα-fc,进行tev酶切过夜后过蛋白a-ni-nta混合柱纯化分离得到可溶性人源il-6rα蛋白,具体步骤如下:
21.以人的cdna为模板,克隆扩增出含有线性化ptt5载体上同源片段的可溶性人源il-6rα基因片段,gibson assembly快速组装到改造后的真核表达载体ptt5-tev-fc上,转
化感受态dh5α细胞,挑取单克隆进行菌液pcr后选取阳性克隆去测序,进一步验证质粒构建的正确性;
22.对正确构建的质粒,选用该质粒的冻存菌液以进行大批量培养活化,准备大提质粒,以准备更多的质粒进行细胞转染;
23.细胞转染方式为pei瞬转,转染时细胞密度为2
×
10
6-3
×
106个/ml,且每100ml hek293f细胞需要0.1mg质粒,0.4mg pei(1mg/ml),5ml dmem高糖;
24.转染完毕,利用蛋白a柱提取培养基上清中的融合蛋白,利用tev酶进行酶切以去除fc,再用蛋白a-ni-nta进一步纯化分离得到可溶性人源il-6rα蛋白;
25.将得到的可溶性人源il-6rα蛋白用3kd超滤浓缩管进行进一步浓缩收集,以使蛋白浓度高。
26.本发明具有以下优点及有益效果:
27.1、本发明实现了融合蛋白h-il-6rα-fc的富集以及纯化,提供了潜在的可溶性人源il-6rα蛋白的制备方法,为制备相关抗体提供了条件。
28.2、本发明中hek293f(人胚胎肾上皮细胞)表达系统能够表达可溶性人源il-6rα蛋白,而且与cho(中国仓鼠卵巢细胞)表达系统(表达量10ng/ml)、大肠杆菌表达系统(表达量2-4mg/l)相比,该系统表达量高,高达4.47mg/l。
29.3、本发明采用hek293f表达系统和聚合试剂聚乙烯亚胺(pei)进行瞬时转染,操作非常简单、快速而又廉价,约有50%-80%的细胞表达目的蛋白,转染效率高而且表达的产物几乎近似于天然蛋白质,适用于研究蛋白质的结构生物学特征,便于蛋白商业生产化。
30.4、本发明中所纯化的蛋白纯度高(95%以上),且不带任何标签,可以应用于免疫动物产生该蛋白的特异性抗体,排除其他干扰。
31.5、本发明所生产的蛋白所用的技术较为简单方便,且周期短。
附图说明
32.图1是ptt5-h-il-6rα-fc的质粒图谱和线性化载体ptt5-tev-fc(以下称为“线性化ptt5载体”)的图谱,其中图1a是ptt5-h-il-6rα-fc的质粒图谱;图1b是线性化ptt5载体的图谱,可在sai 1和xba 1之间插入目的基因序列(即,h-il-6rα基因序列)即可构成ptt5-h-il-6rα-fc的质粒。
33.图2是以人的cdna文库为模板克隆扩增的含有线性化ptt5载体的同源序列的可溶性人源il-6rα基因片段的pcr电泳结果图,第一泳道为250bp+dna分子量标准,第二泳道至第六泳道均为pcr产物。
34.图3是重组质粒ptt5-h-il-6rα-fc的菌液pcr结果及测序结果验证图,其中图3a为重组质粒ptt5-h-il-6rα-fc的菌液pcr结果,第一泳道为250bp+dna分子量标准,第二泳道至第七泳道为序号1#至序号6#单克隆的菌液pcr产物;图3b为序号4#重组质粒ptt5-h-il-6rα-fc的测序结果,其中上图为f向测序引物的结果图,下图为r向测序引物的结果图。
35.图4是经蛋白a柱富集洗脱的融合蛋白h-il-6rα-fc的蛋白纯化图,其中%b指的是0.1m乙酸。
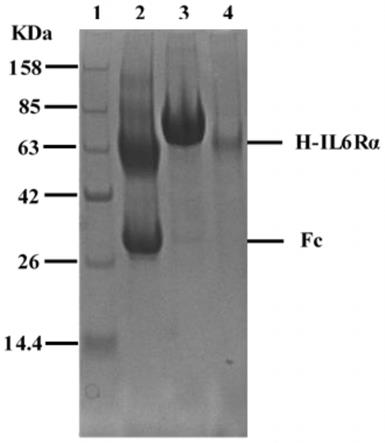
36.图5是可溶性人源il-6rα蛋白的sds-page图,第一泳道是蛋白marker,第二泳道是酶切后的可溶性蛋白h-il-6rα及fc,第三泳道是酶切之前的融合蛋白h-il-6rα-fc,第四泳
道是纯化后的可溶性人源il-6rα蛋白。
37.图6是测定抗原可溶性人源il-6rα蛋白与纳米抗体结合力的elisa以及ec50结果图,其中图6a是抗原可溶性人源il-6rα蛋白与纳米抗体(2s3-3d-fc、1s-7g-fc、1s-12d-fc)的elisa结果图,图6b为抗原可溶性人源il-6rα蛋白与纳米抗体结合的ec50值。
具体实施方式
38.下面结合实例以及附图对本发明做进一步的阐述,有助于本领域的研究人员理解,但本发明的实施方式不限于此。
39.以下人的cdna文库购自clonetech公司,线性化ptt5载体取自中国科学技术大学结构免疫生物学实验室(金腾川老师课题组),大肠杆菌dh5α购自北京擎科生物科技有限公司。
40.以下冰醋酸、乙二胺四乙酸(edta)、tris、盐酸(hcl)、异丙醇、氢氧化钠、十二烷基硫酸钠(sds)、乙酸钾、乙酸钠、氯化钠、磷酸氢二钠、甘油、葡萄糖、磷酸二氢钾、氯化钾、吐温-20、浓硫酸等购自北京国药集团化学试剂有限公司,0.22μm滤膜购自biosharp公司,酵母提取物、蛋白胨购自oxoid公司,3kd/10kd超滤浓缩管购自millipore公司,氨苄抗生素购自索莱宝公司,5
×
t5外切酶购自上海沪震实业有限公司,蛋白a柱、ni-nta、pfu酶取自中国科学技术大学结构免疫生物学实验室(金腾川老师课题组自制),羊抗人igg-fc二抗(hrp)购自义翘神州,高蛋白脱脂高钙奶粉购自伊利,f96 maxisorp nunc-immuno plate购自thermo fisher scientific,纳米抗体2s3-3d-fc、1s-7g-fc、1s-12d-fc由本发明人将抗原(本发明方法制备的可溶性人源il-6rα蛋白)免疫羊驼后筛选并表达而来。其余未特殊说明的试剂均为市售获得的。
41.实施例1一种真核表达载体ptt5-h-il-6rα-fc的构建
42.构建载体ptt5-h-il-6rα-fc,如图1所示,具体步骤如下:
43.1.1pcr克隆扩增目的基因
44.根据人的可溶性il-6rα基因序列(gene id:3570),如seq id no:3所示,设计引物使其含有线性化载体ptt5的同源区段,由生工生物工程(上海)股份有限公司合成:
45.上游引物:
46.aagtcaagctgctctctgggcgtcgacctggccccaaggcgctgccctg;
47.下游引物:
48.ttggaaataaagattctcagaacctctagatgggaggcttgtcgcatttgcagaatctctg。
49.以人的cdna为模板,配制pcr反应体系:
50.[0051][0052]
本发明使用100ul pcr反应体系,按上面体系等比例添加即可。
[0053]
pcr反应条件为:
[0054][0055]
2-4重复30个循环
[0056]
5.72℃
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5min
[0057]
6.4℃
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5min
[0058]
1.2 pcr产物回收目的片段
[0059]
pcr产物经1%琼脂糖凝胶电泳检测,如图2所示,将有正确条带(1065bp)的pcr产物用omega bio-tek公司e.z.n.a.cycle-pure kit(货号d6492-02)进行回收,操作步骤按说明书进行操作即可。
[0060]
1.3重组表达载体的构建、筛选以及鉴定
[0061]
将上述pcr产物回收的dna片段,先取2.5ul纯水在scandrop(核酸蛋白测定仪)进行校准,再取2.5ul回收的pcr产物去测浓度,并读取a260/a280=1.80,浓度为54.12ng/ul,再与线性化载体ptt5按照gibson assembly的连接体系进行连接:
[0062][0063]
加样前后都要混匀,50℃反应15min。
[0064]
将gibson assembly连接好的产物5ul转化50ul感受态dh5α细胞,混匀冰上孵育放置25min,42℃水浴90s,再冰上孵育2min,加入950ul无菌无抗性的lb,摇床37℃200rpm 1h,期间观察菌体浑浊程度,浑浊程度高为好,再4000rpm离心5min,取离心后的上清50ul,倒掉其余上清,再将已吸取的50ul上清液重悬沉淀,涂lb/amp平板,于生化培养箱37℃倒置培养过夜。次日挑取单个克隆序号1#至6#于5ml lb/amp培养基37℃200rpm 6h,吸取2ul菌液进行菌液pcr,体系如下:
[0065][0066]
pcr反应程序:
[0067][0068]
2-4重复30个循环
[0069]
5.72℃
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5min
[0070]
6.4℃
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5min
[0071]
经1%琼脂糖凝胶电泳后,结果如图3所示,序号4#可见目的片段为菌液pcr阳性,序号6#为菌液pcr假阳性,对序号4#进行保菌并测序。图3b为序号4#重组质粒ptt5-h-il-6rα-fc的测序结果,其中上图为f向测序引物的结果图,下图为r向测序引物的结果图。
[0072]
实施例2载体质粒ptt5-h-il-6rα-fc的扩增提取
[0073]
采用实施例1的方法得到测序结果正确的菌液ptt5-h-il-6rα-fc,取10ul菌液转接于5ml lb/amp培养基中进行37℃200rpm 6-8h活化,再将该管5ml菌液转接到300ml 2ty/amp培养基中大摇过夜,次日用omega bio-tek公司e.z.n.a.plasmid maxi kit(货号d6922-02)提取质粒,同样在scandrop(核酸蛋白测定仪)进行检测并读取a260/a280=1.81,质粒浓度为564.87ng/ul,保存于-20℃冰箱。
[0074]
实施例3向hek293f细胞转染质粒ptt5-h-il-6rα-fc
[0075]
采用实施例2的方法得到了质粒ptt5-h-il-6rα-fc,利用聚合试剂聚乙烯亚胺(pei)瞬时转染的方式转染给hek293f细胞(来源于永联生物科技(上海)有限公司),使其表达蛋白,具体步骤如下:
[0076]
3.1通过细胞计数的方式确定hek293f细胞的密度为2
×
10
6-3
×
106个/ml,且活细胞率达95%左右。
[0077]
3.2计算好要转染的细胞体积(本次转染体积为600ml),并按照每100ml hek293f细胞需要0.1mg质粒,0.4mg pei(1mg/ml),5ml dmem高糖(提前预热至37℃)。配置好质粒混合液:质粒和预热的dmem高糖,pei混合液:pei和预热的dmem高糖,配置好后混匀静置5min,将pei混合液加入到质粒混合液中,颠倒混匀静置20min,期间间歇性颠倒混匀,静置20min完毕后倒入所需体积的hek293f细胞中,调摇床条件为温度37℃,速度为0rpm,co2浓度为5%,湿度为23%,静置30min后调速度为120rpm,其他条件不变,转染3-4天后可提蛋白。
[0078]
实施例4融合蛋白h-il-6rα-fc的提取以及进一步纯化
[0079]
4.1融合蛋白h-il-6rα-fc的提取
[0080]
采用实施例3的方法可使600mlhek293f细胞经4℃5000rpm 30min离心收集约600ml上清,上清含有蛋白,利用蛋白a亲和层析富集融合蛋白h-il-6rα-fc,该操作如下:设置好泵的流速为2.5ml/min,纯水洗蛋白a柱6min,0.1m乙酸洗6min,水洗6min,流动的缓冲液(0.15m nacl,20mm na2hpo4,调ph 7.0,5%甘油)洗15min,平衡蛋白a。经0.22um滤膜过滤后,将上清过蛋白a,然后上akta仪器将蛋白a柱中的蛋白洗脱下来,洗脱液为0.1m乙酸,如图4所示。
[0081]
4.2目的蛋白可溶性人源il-6rα蛋白的纯化
[0082]
将洗脱下来的蛋白收集到50ml离心管中,添加适量tev酶、终浓度5mm dtt、1mm edta,放在冰里埋起来再放在4℃冰箱酶切3h后将该管溶液放入透析袋里进行透析,期间更换透析液,透析12h后0.22um滤膜过滤,然后过蛋白a-ni-nta混合柱收集流穿液,即为目的蛋白人源性il-6rα蛋白,进行sds-page电泳鉴定,如图5所示,最终收集到的目的蛋白条带单一,表明纯度很高(95%以上),且蛋白获得率为4.13mg/l(计算方式为:a280值(3.33a)/该蛋白摩尔消光系数(1.867)=1.784mg/ml,1.784mg/ml
×
蛋白体积(1.5ml)=2.676mg,以上用600ml hek293f细胞提取纯化而来,换算1l体积可得到约4.47mg/l)。
[0083]
实施例5浓缩收集蛋白
[0084]
采用实施例4的方法可得到经蛋白a-ni-nta混合柱收集的流穿液,约40ml左右,此时的目的蛋白浓度较低,约0.3a左右,需要用浓缩管浓缩稀的流穿液来得到高浓度的蛋白,具体操作如下:
[0085]
5.1该实验需要截留住目的蛋白,故选择截留分子量不应大于目的蛋白分子量的1/3,比如目的蛋白分子量为35kda,就可以选择10kda截留分子量的超滤管,但是如果10kda截留分子量的超滤管容易漏的时候就需要换用3kda超滤浓缩管,故本发明采用3kda超滤浓缩管。
[0086]
5.2使用超滤浓缩管时需要加10ml流动的缓冲液进行验漏,然后加入稀的流穿液10ml置于4℃离心机3000rpm离心30min,并在浓缩过程中分别检测浓缩管上液和下液的浓度,相当于再次验漏,其次在浓缩过程中可反复颠倒浓缩管使回收率高。
[0087]
5.3直至所有稀的流穿液浓缩至200-500ul体积皆可(可根据自己需要进行调整体积),用200ul枪取浓缩管中的蛋白到1.5ml ep管里,做好标记,并取2.5ul蛋白液上scandrop(核酸蛋白测定仪)测a280值,根据蛋白的摩尔消光系数进行相应计算得到浓度1.784mg/ml,在该ep管上做好标记,并且液氮速冻后-80℃冰箱保存。
[0088]
实施例6抗原与纳米抗体的结合力-elisa
[0089]
采用实施例5的方法可得到高浓度的可溶性人源il-6rα蛋白作为抗原,检测抗原可溶性人源il-6rα蛋白与纳米抗体2s3-3d-fc、1s-7g-fc、1s-12d-fc(上述纳米抗体通过将此抗原免疫羊驼筛选抗体表达而来,纳米抗体的制备方法采用本领域已知的方式制备,例如,可参见严昊等人,纳米抗体的制备与临床应用研究进展[j].中国畜牧兽医,2021,48(2):685-694)的结合能力情况,具体步骤操作如下:
[0090]
6.1将抗原可溶性人源il-6rα蛋白(1ug/ml,1
×
pbs(氯化钠8g,磷酸氢二钠3.58g,磷酸二氢钾0.24g,氯化钾0.2g,ph7.4,纯水补足至1l)配制)包被在96孔nunc-immuno plate中,100ul/孔,4℃过夜(12-14h)。
[0091]
6.2 1
×
pbs 260ul/孔,洗2次后加入封闭液(1
×
pbs配5%的脱脂牛奶),270ul/
孔,在小型摇床调100rpm,室温摇2h。
[0092]
6.3另取一块普通的96孔板,配制一抗孵育液即纳米抗体孵育液(用封闭液配制),初始浓度为200nm,4倍梯度稀释,稀释11个梯度,阴性对照为封闭液。
[0093]
6.4倒掉封闭液,加入纳米抗孵育液,100ul/孔,小型摇床调100rpm摇1h。
[0094]
6.5 0.1%pbst(1
×
pbs+吐温-20配)260ul/孔,洗3次后加入100ul/孔的羊抗人igg-fc二抗(hrp)(用封闭液1:6000稀释配),小型摇床室温调100rpm摇1h。
[0095]
6.6 0.1%pbst(1
×
pbs+吐温-20配)260ul/孔,洗3次。
[0096]
6.7加入100ul/孔tmb显色液,避光孵育7min。
[0097]
6.8加入50ul/孔1m h2so4终止显色,于酶标仪检测读取od450值,用graphpad prism 7软件处理作图。
[0098]
半最大效应浓度(concentration for 50%of maximal effect,ec50)是指能引起50%最大效应的浓度,因此根据ec50值可知道与抗原结合力最好的纳米抗体为2s3-3d-fc。结果如图6所示。因此,本发明中制备的可溶性人源il-6rα蛋白可以作为抗原,用于特异性纳米抗体的制备。
[0099]
上述实施例是本发明较佳的实施方式,但本发明的实施方式并非是一个独立的技术方案,若在此基础上进行适当调整以及进一步优化,均为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1