精细胞的处理的制作方法
精细胞的处理
1.相关申请
2.本技术是中国专利申请201380025467.5号的分案申请,并且要求2012年3 月16日提交的英国申请gb1204722.1号和2012年3月19日提交的英国申请 gb1204819.5号的优先权。
3.发明背景
4.据估计1/7的夫妻有怀孕问题。估计可归因于男性伴侣的不孕情形的百分比 为25%-50%,这取决于人群。男性不育的主要原因是精液质量不良。精液质量 不良可由精子(“精细胞”)数目减少和/或存在的那些细胞的活动性降低(弱精子症) 引起。多种治疗可用于男性和女性不育,包括宫颈管内授精(ici)和子宫内授精 (iui)。本质上讲,这些方案涉及通过人工方式将近来收集的精子或冷冻并解冻 的精子放入子宫颈中,或通常在洗涤后放入子宫。iui具有用于当前通过体外授 精(ivf)治疗的许多不育情形的巨大潜力。然而,iui通常具有低成功率,这主要 归因于低的精液质量。
5.此类技术在兽医中也具有重要用途,包括家畜繁育和保存生物学,其中不 良的动物生育力可能阻碍商业或保存目的。如果使用的精细胞能具有最高的可 能质量,则iui治疗引起怀孕的几率会极大增加。可通过如下的任何一种或所有 的手段来提高质量:
[0006]-预“洗涤”精子,例如在无l-谷氨酰胺的hams f-10培养基中洗涤,以去除 精液、白细胞和不活动的精子;
[0007]-分离技术使样品富集较高质量的细胞,例如通过不连续梯度结构或电泳 (参见,例如wo2005/033295);
[0008]-用化学试剂离体处理细胞,以增加活动性或提高其受精能力。
[0009]
在用化学试剂预处理细胞以提高受精能力后通常进行洗涤步骤,以防止女 性伴侣、受精卵和胚胎暴露于该化学试剂,并防止精细胞“耗尽精力(burn out)”, 这可在精细胞活动性被刺激过长时间以致当受精发生时精细胞已“精疲力尽 (exhausted)”或已经历了顶体反应的过早触发时发生。
[0010]
所有预处理方案的共同特点在于必须尽快实施方案(因为精子质量随离体时 间增加而下降),并且必须尽可能避免可能损伤细胞的物理和化学创伤(例如剪切 力)。
[0011]
john aitken教授和同事开发出了用于分离人精子的电泳系统(其中称为
ꢀ“
aitken法”或“aitken技术”)(参见ainsworth et al.2005,hum.repro. 20(8)2261-2270;和aitken et al.2011.hum.repro.26(8)1955-1964),其产生用于 受精的样品,包含相比用于细胞准备的常规密度梯度离心技术具有较少dna损 伤的细胞。本质上讲,aitken技术包括使用分离盒,其包含通过离子和精细胞 通透性的膜隔开的两个装有缓冲液的室。将精液样品放在一个室中,并布置横 跨该盒的电场。精细胞在几秒内在电场中迁移穿过膜进入第二室。精细胞的小 尺寸使得它们在电场中活动特别轻松,且细胞表面的唾液酸造成迁移至阳极。 污染细胞如白细胞和受损细胞和/或死细胞和/或不恰当成熟的细胞活动较困难, 由此可针对高质量精细胞富集所述样品用于随后的不孕治疗。
[0012]
本发明基于对aitken技术的调整,以通过电泳从精细胞去除化学试剂,其 中电泳
作为独立的技术或有利地,与aitken技术组合使用,由此针对高质量细 胞富集细胞,并同时洗除了预处理化学试剂。因此,本发明特别适合用于这样 的方法,其涉及用化合物离体处理精细胞以增加它们的受精能力,然后去除处 理化合物。
[0013]
发明概述
[0014]
在第一方面,本发明提供了通过电泳使精细胞与化合物分离的方法,包括 使所述精细胞接受阴极和阳极之间的电势,使得所述精细胞与所述化合物分离。
[0015]
本发明还提供了根据本发明第一方面的方法通过电泳与化合物分离的精细 胞在子宫内授精(iui)、体外授精(ivf)或胞浆内精子注射(icsi)中的用途。
[0016]
本发明还提供了用化合物处理精细胞以增加精细胞的受精能力的方法,包 括使精细胞与化合物接触,然后通过电泳使所述精细胞与所述化合物分离,包 括使所述精细胞接受阴极和阳极之间的电势,使得所述精细胞与所述化合物分 离。
[0017]
作为非限制性实例,本技术提供了以下实施方案:
[0018]
1.通过电泳使精细胞与化合物分离的方法,包括使所述精细胞接受阴极和 阳极间的电势,使得所述精细胞与所述化合物分离。
[0019]
2.如实施方案1所述的方法,其中通过离子通透性屏障进行所述分离。
[0020]
3.如实施方案1或实施方案2所述的方法,其中所述化合物带电荷。
[0021]
4.如实施方案1、2或3所述的方法,其中所述化合物带正电荷,并因此在 所述电势的作用下朝所述阴极迁移。
[0022]
5.如实施方案1、2、3或4所述的方法,其中所述精细胞或一部分所述精 细胞在所述电势的作用下朝所述阳极迁移。
[0023]
6.如实施方案5所述的方法,其中所述精细胞穿过精细胞通透性膜迁移, 所述精细胞通透性膜排除其他细胞类型,例如白细胞。
[0024]
7.如实施方案1、2、3、5、6、7或8所述的方法,其中所述化合物带负电 荷,并因此在所述电势的作用下朝所述阳极迁移,其与所述精细胞迁移的方向 相同,但其中所述化合物穿过所述精细胞不能通过的化合物通透性膜迁移。
[0025]
8.如实施方案1、2、3、4、5、6或7所述的方法,包括以下步骤:
[0026]
b,将于离子溶液中的精液或精细胞离体样品放入电泳盒的样品输入室中, 其中所述样品输入室通过第一膜与样品输出室隔开,所述第一膜对离子和精细 胞均为通透性的;
[0027]
c,使用电极施加横越所述样品输入室和样品输出室的电势,使得所述样品 输出室具有比所述样品输入室更高的(更多正电荷的)电势;
[0028]
d,使所述精细胞或一部分所述精细胞从所述样品输入室迁移至所述样品输 出室;
[0029]
e,提供靠近所述样品输出室的阳极室,所述阳极室与所述样品输出室通过 离子通透性膜“第二膜”隔开,所述第二膜为精细胞不能透过的,使得精细胞不能 接触所述阳极,
[0030]
其中所述方法具有在步骤b之前还包括步骤a的特征:
[0031]
a,用提高精细胞质量的化合物预处理精液或精细胞的离体样品,其中所述 化合物在溶液中带正电荷或负电荷,并因此能够电泳移动;
[0032]
其中所述方法还具有以下特征,如果存在带负电荷的化合物,其在所述电 势的作用下从所述样品输入室迁移至所述样品输出室,然后从所述样品输出室 穿过所述第二膜迁移至所述阳极室,从而实现所述精细胞与所述带负电荷的化 合物的分离;并且其中如果存在带正电荷的化合物,其在所述电势的作用下从 所述样品输入室迁移至靠近所述样品输入室提供并通过第三膜与所述样品输入 室隔开的阴极室,从而实现所述精细胞与所述带正电荷的化合物的分离,所述 第三膜对所述化合物通透,但对精细胞不通透。
[0033]
9.如实施方案1、2、3、4、5、6、7或8所述的方法,其中所述电势被施 加少于5分钟,以实现精细胞或一部分精细胞与所述化合物的分离。
[0034]
10.如实施方案8或9所述的方法,其中所述第一膜具有4-10μmol/l的孔 径。
[0035]
11.如实施方案1、2、3、4、5、6、7、8、9或10所述的方法,还包括以 下步骤:从所述输出室移走精细胞并将其准备用于子宫内授精。
[0036]
12.如实施方案11所述的方法,还包括以下步骤:使用准备用于子宫内授 精的精细胞。
[0037]
13.用化合物处理精细胞以增加所述精细胞的受精能力的方法,包括使所述 精细胞与化合物接触,然后通过电泳使所述精细胞与所述化合物分离,包括使 精细胞接受阴极和阳极之间的电势,使得精细胞与所述化合物分离。
[0038]
14.如实施方案1-12中任一项所述的方法,或者如实施方案13所述的方法, 其中所述化合物为所述精细胞被离体暴露于其,用以辅助冷冻或提高精细胞质 量的化合物,如活动性促进剂,或用以滋养、保护或增强细胞的功能、存活或 健康的化合物。
附图说明
[0039]
图1的图显示了精细胞和带电化合物的电泳运动原理。
[0040]
图2的图显示了离子通透性和化合物通透性膜的应用,以根据本发明使精 细胞与化合物分离。
[0041]
图3的图显示了本发明方法与针对质量富集精细胞的aitken法的联合应用。
[0042]
发明详述
[0043]
本发明提供了通过电泳使精细胞与化合物分离的方法,包括使所述精细胞 接受阴极和阳极之间的电势,使得所述精细胞与所述化合物分离。
[0044]
精细胞
[0045]
用于本发明的精细胞通常通过任何合适的方法,包括自主取精、前列腺按 摩、人工阴道(例如作为用于从雄性马、牛或其他非人的动物采集的繁育工具 (breeding mount)的一部分)的使用、振动刺激射精(vibroejaculation)和电刺激射 精(electroejaculation),采集自雄性动物(例如人个体)。在一些情形下,采集可涉 及使用采集安全套,或通过睾丸取精术(tese)从睾丸直接获取。通常优选涉及 射精的采集,因为其将产生悬浮在精液中的精细胞样品,并因此恰当成熟的可 能性更大。精细胞可“新鲜”采集,或可在之前采集并在储存期间冷冻,然后在需 要使用时解冻。它们可在用于本发明方法或方法(process or method)前任选地接 受预处理步骤。
[0046]
精细胞来源
[0047]
本发明的各个方面主要涉及人。然而,它们可适用于其他动物(特别是其他 哺乳
动物),包括牲畜(特别是马、牛、猪)、竞赛动物(特别是马和骆驼)、宠物(包 括猫和狗)、野生动物(包括大型猫科动物、羚羊和熊猫)和研究动物(包括啮齿类 如兔、小鼠和大鼠)。
[0048]
化合物
[0049]
化合物通常为细胞被离体暴露与其,用以辅助冷冻或提高精细胞质量的化 合物,如活动性促进剂,或用以滋养、保护或增强细胞的功能、存活或健康的 化合物。在将细胞用于授精前从该细胞去除化合物通常是有利的。可将细胞暴 露于多于一种化合物,且所述化合物在溶液中通常具有电荷(在生理合适的条件 下),其可为正电荷或负电荷,使得所述化合物在暴露于电势时展现电泳迁移。 化合物可具有内在电荷(例如它们可为酸或碱)或者可通过用带电部分将分子衍 生化来引入电荷。优选地,化合物具有足够低的分子量(例如,少于50、20或 10kda),以允许其电泳穿过具有足以阻止精细胞(例如人精细胞)电泳穿过的孔径 的尺寸排阻膜。
[0050]
精细胞的电泳迁移
[0051]
健康和恰当成熟的精细胞在其表面上表达唾液酸残基,这给予它们表面负 电荷并在接受电势时允许它们电泳迁移。精细胞特别适合用于采用电泳迁移的 技术,这是由于它们具有表面电荷,且它们还具有相对小的尺寸,意味着它们 在电场中通常比较大的细胞类型移动更快。它们的相对小的尺寸还允许它们穿 过具有可截留其他大细胞类型的孔径的膜。精细胞响应电势迁移的快速性是有 利的,因为其允许参与精细胞响应电场而移动的电泳技术快速进行,并因此可 能对细胞活力具有很小的影响。
[0052]
使细胞与化合物简单分离
[0053]
本发明的最基本的形式涉及将精细胞与化合物的混合物暴露于造成化合物 朝较高或较低电势迁移(取决于该化合物携带正电荷还是负电荷)的电势下。
[0054]
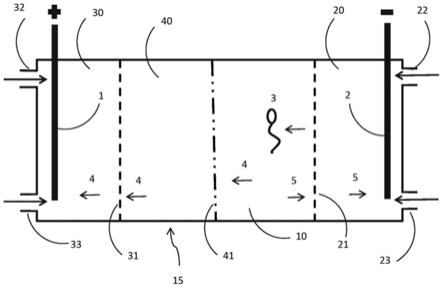
例如,参照图1:
[0055]
可提供室(10),其具有其间施加有电压的阳极(1)和阴极(2),且含有离子溶 液,例如生理介质。表达表面唾液酸的精细胞(3)会朝阳极迁移。具有负电荷(4) 的化合物会朝阳极迁移,且具有正电荷的化合物(5)会朝阴极迁移。
[0056]
在实施时,室(10)优选被提供为包括多个室的盒(25)的一部分,例如图2中 显示的盒(15):
[0057]
将精细胞样品引入样品输入室(10),且如参照图1所显示的,该细胞在电势 的作用下迁移。阴极(2)和阳极(1)被提供在单独的填充电解质的室(30)和(20)中, 室(30)和(20)为离子性的,并因此能与样品输入室(10)进行电荷交流。室(30)和(10) 以及(10)和(20)通过精细胞不能透过的离子通透性膜(31、21)隔开。提供阳极室(30) 和阴极室(20)具有的优势在于能使细胞远离电极,还在于可通过输入口和输出口 (32、33以及22、23)在电极上淋浴(bath)新鲜电解质。由此,可按wo 01/78878 中所描述地安排电极室的电解质供给,所述申请通过引用并入本文。
[0058]
如果膜(31)被制成为对带负电荷的化合物(4)通透性的,但对精细胞(3)不通 透,可看到带负电荷的化合物(4)会从室(10)迁移至室(30),并与截留在室(10)中 的细胞(3)分离。
[0059]
如果膜(21)被制成为对带正电荷的化合物(5)通透性的,但对精细胞不通透, 可看到带正电荷的化合物(5)会从室(10)迁移至室(20),并与截留在室(10)中的细 胞(3)分
离。
[0060]
如图2中所示和本文所述,阴极室(20)包含阴极,且阳极室(30)包含阳极。 然而,本发明的所有实施方案的范围还包括这样的结构,其中各个电极中的一 个或多个被提供在与各自的阴极室和阳极室电荷(例如离子)交流的位置(例如, 另外的室)。所需要的所有条件为阴极室(20)具有比样品输入室(10)更低的(更多 负电荷的)电势,且阳极室(30)具有比样品输入室(10)更高的(更多正电荷的)电势。
[0061]
分离膜
[0062]
对于将分离膜应用于电泳的其他指导可参见us 5039386、us 5650055、au 738361和wo 02/4314,其所有均通过引用并入本文。
[0063]
可选地,盒(15)包括通过各自的电极室(20、30)从电解质储库循环电解质的 装置。离子通透性膜以及事实上本发明使用的所有膜优选阻止相邻室内容物的 大量对流混合。
[0064]
膜可为如wo 2005/033295中所描述的,该申请通过引用并入本文。
[0065]
溶液
[0066]
根据本发明的方法,室在使用时填充有离子型缓冲液(“电解质”)。
[0067]
优选的缓冲液浓度为约1-100mm。可使用任何合适的缓冲液或电解质。合 适的缓冲液包括但不限于,精子相容性的生物缓冲液和组分如hepps、hepes、 bistris、氯化钠、磷酸盐缓冲液、蔗糖、葡萄糖和甘露醇。如下文所述,已发 现10mm hepes缓冲液、30mm nacl和0.2m蔗糖特别适用。然而,应当认 识到可使用任何其他合适的缓冲液。用于哺乳动物精子的合适缓冲液必须为“非 赋能性的(non-capacitating)”,以便它们不会造成精细胞过早获能。
[0068]
方法与精细胞富集技术的整合
[0069]
本发明方法至少涉及通过电泳使精细胞与化合物分离。然而,应当认识到 本发明的方法特别适合用于整合至wo 2005/033295所述的富集精细胞的
ꢀ“
aitken法”。
[0070]
aitken法是基于这样的认识:较高质量的精细胞在其表面携带更多的唾液 酸,并因此能够在电势的作用下展现较大的电泳迁移。不希望被理论束缚,这 被认为是由于较高水平的细胞表面唾液酸表达是精细胞恰当成熟的标志。
[0071]
图3示出了适于整合的方法的分离盒,其中精细胞样品不仅针对高质量精 细胞被富集,且“洗除了”化合物:
[0072]
室(20、30)、电极(1和2)、膜(31、21)、电解质操作装置(32、33、22、23) 可与上文参照图2描述的相同。阳极室(30)和阴极室(20)之间配置的为样品输入 室(10)和样品输出室(40)。这些室通过膜(41)隔开,膜(41)为离子(并因此电流)通 透性的,且为化合物(4、5)以及精细胞通透性的。优选地,膜(41)不允许大于精 细胞的细胞(例如白细胞)电泳通过,也不允许室(10)与(40)之间的大量对流混合。 合适的膜的其他细节可参见wo 05/033295,其通过引用并入本文。
[0073]
优选通过将精细胞样品放置在样品输入室(10)中来使用图3的装置。电势引 起健康精细胞穿过膜(41)迁移至样品输出室(40),可在此处回收精细胞供使用。 不健康的精细胞展现较小的电泳迁移,并因此更可能保留在样品输入室(10)中。
[0074]
具有正电荷的化合物(5)以与精细胞相反的方向迁移,并因此保留在室(10) 中或
穿过膜(21)迁移至阴极室(20),从而与样品输出室(40)中的健康精细胞分离。
[0075]
具有负电荷的化合物(4)以与健康精细胞相同的方向迁移,并因此从输入室 (10)进入样品输出室(40)。然后,它们可借助化合物通透性的但精细胞不能通过 的膜(31)与健康精细胞分离。这允许带负电荷的化合物(4)进入阳极室(30),从而 与样品输出室(40)中的健康精细胞分离。
[0076]
整合方法的优势
[0077]
wo 2005/033295中描述的aitken法提供的优势在于其为快速和简单地富集 具有低发的dna损伤和高水平的生活力以及在随后的授精过程中有用的细胞的 精细胞群的方式。
[0078]
本文描述的使用电泳分离化合物与精细胞的方法类似地提供了这样的优 势,其体现为快速和低干预并因此可能对精细胞功能具有很小损害的技术。
[0079]
根据本发明将两种方法整合带来了额外的优势,包括以下事实:可同时实 施两种方法从而减少总干预时间(优势在于精细胞功能损失的风险降低)和通过 仅需提供一个装置来提供成本节约。
[0080]
另外,为提供技术优势而在实施时进行的将精细胞暴露于化学试剂,在一 些情况下可能会带来损伤部分精细胞的潜在风险,例如诱导dna损伤,其可使 得细胞较不适合随后的应用。与aitken法整合允许将可能已被化学处理损伤的 精细胞从细胞样品去除,从而提高样品整体质量。
[0081]
电荷参数和其他运行参数
[0082]
可针对处理时间、室的尺寸、膜的性能以及精细胞和化合物及电解质缓冲 液的性质,优化本发明方法中使用的电势和电流强度以及其他相关参数。挑选 合适的参数的其他指导可参见上文引用的ainsworth&aitken的文章,其还描述 了可以如何评估分离之前和之后的精细胞质量。在一些情况下,条件可为以下 中的所有或一些条件的组合:
[0083]
缓冲液 可基于这样的细胞培养基,其具有200-400mosmol/kg的渗透 压,例如300-320mosmol/kg的渗透压,例如310mosm/kg的 渗透压。合适的缓冲液例如可包含10mm hedes、30mm氯 化钠和0.2m糖,例如果糖或蔗糖。ph优选为6-9,例如7-8, 例如ph7.4。
[0084]
电导率 可为1-10ms/cm,例如2-5,例如3.8-4.2ms/cm,例如4ms/cm。
[0085]
电流/电压 20-200ml ma的施加电流时可能是合适的。例如50-150ma, 例如60-100ma,例如70-80ma,例如75ma。电压可施加于 阴极与阳极之间来给出10-30v/cm的电场强度,例如15-20 v/cm的电场强度,例如16-18v/cm的电场强度,例如17v/cm 的电场强度。电压可为随时间脉冲式的,或者可被调节为任何 合适的波形,在这种情况下以上刚刚给出的值应被理解为在整 个电泳时段内得出的平均值。
[0086]
温度 优选针对良好精子存活来选择温度。对于人精子,其可为 15℃-40℃,例如20℃-30℃,例如20℃-25℃,例如23℃。
[0087]
时间 优选地,过程持续几秒或几分钟,例如10-1000秒。例如30-300、 50-500、10-100秒。
[0088]
膜
[0089]
样品输入室与相同的输出室之间的分离膜(41)在存在时应当为离子通透性 的,且在接受电泳力时还应为如本文所述的化合物通透性的和精细胞通透性的。 优选地,其针
对其他细胞类型如白细胞为不通透的。其可由任何合适的材料构 成,例如塑料材料,如聚碳酸酯、聚苯乙烯、聚丙烯或聚乙烯。聚碳酸酯可能 是特别合适的。5-50μm(例如5μm-10μm)的孔径可能是特别合适的。
[0090]
一个或两个样品室与各自的阴极室和阳极室之间的限制膜(21和31)应当为 离子通透性的,且还为化合物通透性的,但精细胞不能透过。已发现具有100kda 或更小(如80、50、40、20或10kda或更小)的分子阈值的膜特别合适。可使用 通过各种技术使用多种材料制备的膜。例如,聚丙烯酰胺膜,任选地,提供在 支撑结构上的聚丙烯酰胺膜可能是合适的。
[0091]
盒的构建
[0092]
可从任何合适的材料构建盒(15)。注射制模塑料(例如,聚碳酸酯)可能是特 别合适的,因为其易于生产和灭菌。本文的图中所示的室结构仅为图示,且可 使用其他的结构。室容积可为,例如0.5μl-5ml,例如50μl-1ml,例如100μl-800 μl,例如200μl-600μl,例如约400μl。盒可包括用于向室中导入和从室中回收 物质的输入和输出装置。
[0093]
精细胞的随后应用
[0094]
本发明的方法任选包括分离后步骤,即从样品输出室40移取精细胞、任选 地评估精子质量(例如使用生活力检测如曙红排斥检测、dna损伤检测如 tunel检测、活动性检测或简单的细胞计数)、任选地将细胞配制于合适的介质 中,然后将细胞“加载”至适于授精如子宫内授精的装置中。任选地,方法还包括 实施雌性动物或女性的授精步骤,例如通过子宫内授精实施。可将根据本发明 的第一个方面处理的精细胞加载至适用于ivf或icsi的装置。任选地,方法还 包括将精细胞用于ivf或icsi过程的步骤。
[0095]
因此,本发明还提供了根据本发明的第一方面的方法通过电泳与化合物分 离的精细胞在子宫内授精中的应用。
[0096]
精细胞的化学预处理方法
[0097]
本发明还提供了用化合物处理精细胞以增加精细胞的受精能力的方法,包 括使精细胞与化合物接触,然后通过电泳使精细胞与化合物分离,包括使精细 胞接受阴极和阳极之间的电势,使得精细胞与化合物分离。
[0098]
根据本发明的这一方面,精细胞、化合物可为上文参照本发明的其他方面 所描述的那样。化合物优选为用于提升精细胞活动性的化合物。分离方法和装 置可为上文参照本发明的第一方面所描述的那样。精细胞随后可用于子宫内授 精或被准备用于这类应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1