一种检测CYP2C19基因多态性的引物组及试剂盒的制作方法
一种检测cyp2c19基因多态性的引物组及试剂盒
技术领域
1.本发明涉及基因检测领域,特别是涉及一种检测cyp2c19基因多态性的引物组及试剂盒。
背景技术:
2.细胞色素p450(cyp450)同工酶是人体内主要的药物代谢酶之一。cyp2c19是cyp450同工酶家族的重要成员,代谢的临床药物主要包括抗血小板药物(如氯吡格雷)和质子泵抑制剂(如奥美拉唑)等。编码cyp2c19酶的基因是cyp2c19基因,该基因位于10号染色体的10q24.2上。cyp2c19基因含有多个等位基因,最常见的是cyp2c19*2(c.681g》a)、cyp2c19*3(c.636g》a)和cyp2c19*17(c.-806c》t)。cyp2c19*2和cyp2c19*3突变导致cyp2c19酶活性降低,而cyp2c19*17突变导致cyp2c19酶活性增强。cyp2c19*2、cyp2c19*3和cyp2c19*17在中国人群的发生频率分别约为23.1-35%、2-7%和0.5-4%。
3.从药物代谢方面来说,cyp2c19基因不同等位基因突变组合,使人群出现超快代谢者(um)、快代谢者(em)、中间代谢者(im)和慢代谢者(pm)4种表型。um个体的基因型可为cyp2c19*17/*17纯合型或cyp2c19*1/*17杂合型;em个体的基因型可为cyp2c19*1/*1纯合型;im个体的基因型可为cyp2c19*1/*2、cyp2c19*1/*3、cyp2c19*2/*17或cyp2c19*3/*17杂合型;pm个体的基因型可为cyp2c19*2/*3、cyp2c19*2/*2和cyp2c19*3/*3杂合型或纯合型。研究表明,cyp2c19不同代谢类型与奥美拉唑的临床疗效相关,pm患者的疗效优于em患者;而对氯吡格雷研究表明,im患者需更改剂量达到抗血小板的疗效,而pm患者患者需要增加药量或改用其他抗凝血药物如替格瑞洛等。因此,对cyp2c19基因型检测,可以判断个体对药物代谢能力及疗效的情况,从而指导临床用药,具有重要的临床意义。
4.目前,检测cyp2c19基因多态性的方法有很多种,主要的方法有限制性片段长度多态性聚合酶链反应技术(pcr-rflp)、sanger测序法、基因芯片法、荧光定量pcr法等。sanger测序法是检测基因多态性的金标准,但该方法由于检测成本较高、操作复杂以及检测周期长,不太适合临床推广使用。pcr-rflp法无需购买昂贵检测设备,但是其操作复杂,步骤繁多且容易污染。基因芯片法通过pcr产物与探针杂交,通过比较信号强度判断基因型,但是由于pcr产物需要进行后续分析,操作繁琐且容易出现假阳性。荧光定量pcr法由于操作简单,检测时间短,全程闭管检测,减少产物交叉污染,已经成为临床常用的检测方法。以上方法均需提取和纯化核酸,核酸提取纯化流程不仅增加实验检测步骤、检测成本和检测周期,而且存在因操作失误导致检测失败的可能。因此,难以满足临床对检测简单、快速、准确的需求。为解决以上问题,亟需建立一种操作简便、检测快速、成本低、灵敏度高且结果准确的cyp2c19多态性检测试剂盒,从而满足临床诊断需求。
技术实现要素:
5.鉴于以上所述现有技术的缺点,本发明的目的在于提供一种检测cyp2c19基因多态性的引物组及试剂盒,用于解决现有技术中的问题。
6.为实现上述目的及其他相关目的,本发明提供一种检测cyp2c19基因多态性的引物组,所述引物组包括以下中的一对或多对引物:
7.1)第一引物对:包括核苷酸序列如seq id no.1所示的cyp2c19*2 681g上游引物和核苷酸序列如seq id no.2所示的cyp2c19*2 681g下游引物;
8.2)第二引物对:包括核苷酸序列如seq id no.4所示的cyp2c19*2 681a上游引物和核苷酸序列如seq id no.5所示的cyp2c19*2 681a下游引物;
9.3)第三引物对:包括核苷酸序列如seq id no.7所示的cyp2c19*3 636g上游引物和核苷酸序列如seq id no.8所示的cyp2c19*3 636g下游引物;
10.4)第四引物对:包括核苷酸序列如seq id no.10所示的cyp2c19*3 636a上游引物和核苷酸序列如seq id no.11所示的cyp2c19*3 636a下游引物;
11.5)第五引物对:包括核苷酸序列如seq id no.13所示的cyp2c19*17-806c上游引物和核苷酸序列如seq id no.14所示的cyp2c19*17-806c下游引物;
12.6)第六引物对:包括核苷酸序列如seq id no.16所示的cyp2c19*17-806t上游引物和核苷酸序列如seq id no.17所示的cyp2c19*17-806t下游引物。
13.本发明提供一种检测cyp2c19基因多态性的试剂盒,所述试剂盒中包括pcr反应物和质控品,所述pcr反应物包括:
14.第一反应物,包括所述第一引物对;
15.第二反应物,包括所述第二引物对;
16.第三反应物,包括所述第三引物对;
17.第四反应物,包括所述第四引物对;
18.第五反应物,包括所述第五引物对;
19.第六反应物,包括所述第六引物对。
20.如上所述,本发明的检测cyp2c19基因多态性的引物组及试剂盒,具有以下有益效果:
21.1)本试剂盒不需要复杂的核酸提取纯化流程,减少提取纯化环节,缩短检测时间;可对血卡和全血样本进行荧光pcr扩增检测。
22.2)本试剂盒设计的arms引物和taqman探针针对cyp2c19基因型,可以特异性扩增识别基因型,确保结果准确性。
23.3)检测过程均为闭管检测,避免核酸扩增导致的气溶胶污染,确保结果真实可信;
24.4)检测反应体系加入ung酶防污染系统,显著降低污染可能;
25.5)增加阴性质控和阳性质控,监控假阳性和试剂及操作有效性。
26.6)具有灵敏性高、特异性强、操作简易、价格低廉等优点,可以快速、准确检测cyp2c19基因多态性,适合临床cyp2c19基因多态性分析检测和推广,满足临床诊断需求。
附图说明
27.图1显示为cyp2c19 c.681位点gg野生型检测结果。
28.图2显示为cyp2c19 c.681位点ga杂合突变型检测结果。
29.图3显示为cyp2c19 c.681位点aa纯合突变型检测结果。
30.图4显示为cyp2c19 c.636位点gg野生型检测结果。
31.图5显示为cyp2c19 c.636位点ga杂合突变型检测结果。
32.图6显示为cyp2c19 c.636位点aa纯合突变型检测结果。
33.图7显示为cyp2c19 c.-806位点cc野生型检测结果。
34.图8显示为cyp2c19 c.-806位点ct杂合突变型检测结果。
35.图9显示为cyp2c19 c.-806位点tt纯合突变型检测结果。
具体实施方式
36.本发明提供一种检测cyp2c19基因多态性的引物组,所述引物组包括以下中的一对或多对引物:
37.1)第一引物对:包括核苷酸序列如seq id no.1所示的cyp2c19*2 681g上游引物和核苷酸序列如seq id no.2所示的cyp2c19*2 681g下游引物;
38.2)第二引物对:包括核苷酸序列如seq id no.4所示的cyp2c19*2 681a上游引物和核苷酸序列如seq id no.5所示的cyp2c19*2 681a下游引物;
39.3)第三引物对:包括核苷酸序列如seq id no.7所示的cyp2c19*3 636g上游引物和核苷酸序列如seq id no.8所示的cyp2c19*3 636g下游引物;
40.4)第四引物对:包括核苷酸序列如seq id no.10所示的cyp2c19*3 636a上游引物和核苷酸序列如seq id no.11所示的cyp2c19*3 636a下游引物;
41.5)第五引物对:包括核苷酸序列如seq id no.13所示的cyp2c19*17-806c上游引物和核苷酸序列如seq id no.14所示的cyp2c19*17-806c下游引物;
42.6)第六引物对:包括核苷酸序列如seq id no.16所示的cyp2c19*17-806t上游引物和核苷酸序列如seq id no.17所示的cyp2c19*17-806t下游引物。
43.在一种实施方式中,所述引物组包括第一引物对、第二引物对、第三引物对、第四引物对、第五引物对和第六引物对。
44.所述引物组可用于检测cyp2c19基因的多态性。在一种实施方式中,所述cyp2c19基因为人cyp2c19基因。
45.对于上述的引物对具有的具体碱基序列而言,只要能够在pcr实施条件下特异性地识别各自的特异性识别区域(优选在单一的反应容器内使用的引物之间不发生退火及自退火),则可以使1个或多个碱基替换为其他碱基,也可在3’端或5’端添加1个或多个碱基。此处,所谓多个,例如为2~3个。向引物添加1个或多个碱基的情况下,优选向引物的5’端添加。
46.将上述的引物对具体的碱基序列中的1个或多个碱基取代为其他碱基而得到的碱基序列、与被取代前的碱基序列(即,序列号所示碱基序列)的同一性优选为70%以上,更优选为75%以上,更优选为80%以上,更优选为85%以上,更优选为90%以上,更优选为95%以上均可。
47.对于各引物的长度而言,只要能够特异性地识别对应的特异性识别区域、且引物之间不发生杂交即可,没有特别限制,优选为15个碱基以上且40个碱基以下。更优选的是,引物的长度的下限为16个碱基以上,进一步优选为17个碱基以上,进一步优选为18个碱基以上。更优选的是,引物的长度的上限为39个碱基以下,进一步优选为38个碱基以下,进一步优选为37个碱基以下。
48.本发明提供一种检测cyp2c19基因多态性的试剂盒,所述试剂盒中包括pcr反应物和质控品,所述pcr反应物包括:
49.第一反应物,包括所述第一引物对;
50.第二反应物,包括所述第二引物对;
51.第三反应物,包括所述第三引物对;
52.第四反应物,包括所述第四引物对;
53.第五反应物,包括所述第五引物对;
54.第六反应物,包括所述第六引物对。
55.在一种实施方式中,所述第一反应物还包括cyp2c19*2 681g探针、内参基因引物对和内参基因探针中的一种或多种。
56.在一种实施方式中,所述第二反应物还包括cyp2c19*2 681a探针、内参基因引物对和内参基因探针中的一种或多种。
57.在一种实施方式中,第三反应物还包括cyp2c19*3 636g探针、内参基因引物对和内参基因探针中的一种或多种。
58.在一种实施方式中,第四反应物还包括cyp2c19*3 636a探针、内参基因引物对和内参基因探针中的一种或多种。
59.在一种实施方式中,第五反应物还包括cyp2c19*17-806c探针、内参基因引物对和内参基因探针中的一种或多种。
60.在一种实施方式中,第六反应物还包括cyp2c19*17-806t探针、内参基因引物对和内参基因探针中的一种或多种。
61.所述第一反应物、第二反应物、第三反应物、第四反应物、第五反应物、第六反应物,可以是上述多个物质独立包装的试剂,也可以是上述物质的混合物。
62.在一较佳实施例中,所述第一反应物为所述第一引物对、cyp2c19*2 681g探针、内参基因引物对、内参基因探针形成的混合液。所述第二反应物为所述第二引物对、cyp2c19*2681a探针、内参基因引物对、内参基因探针形成的混合液。所述第三反应物为所述第三引物对、cyp2c19*3 636g探针、内参基因引物对、内参基因探针形成的混合液。所述第四反应物为所述第四引物对、cyp2c19*2 681a探针、内参基因引物对、内参基因探针形成的混合液。所述第五反应物为所述第五引物对、cyp2c19*17-806c探针、内参基因引物对、内参基因探针形成的混合液。所述第六反应物为所述第六引物对、cyp2c19*17-806t探针、内参基因引物对、内参基因探针形成的混合液。混合液中各引物浓度为100-400nm,各探针浓度为100-200nm。
63.在一种实施方式中,所述cyp2c19*2 681g探针的核苷酸序列如seq id no.3所示。
64.在一种实施方式中,所述cyp2c19*2 681a探针的核苷酸序列如seq id no.6所示。
65.在一种实施方式中,所述cyp2c19*3 636g探针的核苷酸序列如seq id no.9所示。
66.在一种实施方式中,所述cyp2c19*3 636a探针的核苷酸序列如seq id no.12所示。
67.在一种实施方式中,所述cyp2c19*17-806c探针的核苷酸序列如seq id no.15所示。
68.在一种实施方式中,所述cyp2c19*17-806t探针的核苷酸序列如seq id no.18所
示。
69.具体的,所述cyp2c19*2 681g探针、所述cyp2c19*2-c探针、所述cyp2c19*3 636g探针、cyp2c19*g-c探针、所述cyp2c19*17-806c探针和所述cyp2c19*17-806t探针的一端修饰有荧光基团,另一端修饰有淬灭基团。具体的,所述cyp2c19*2 681g探针、所述cyp2c19*2-c探针、所述cyp2c19*3 636g探针、cyp2c19*g-c探针、所述cyp2c19*17-806c探针和所述cyp2c19*17-806t探针的5’端修饰有荧光基团,3’端修饰有淬灭基团。
70.具体的,所述荧光基团选自以下中的一种:fam、hex、vic、cy3、rox、610、texas red、cy5。
71.具体的,所述荧光淬灭基团与荧光报告基团相对应,能够淬灭相应的荧光报告基团即可。例如,当荧光报告基团为fam时,所述荧光淬灭基团选自以下中的一种:nfq-mgb、bhq1、dabcyl、qys-7、bhq2。在一较佳实施方式中,所述荧光基团选自fam,所述淬灭基团选自nfq-mgb。
72.所述第一反应物、第二反应物、第三反应物、第四反应物、第五反应物和第六反应物中的内参基因引物对的序列相同或不同。
73.在一种实施方式中,所述第一反应物、第二反应物、第三反应物、第四反应物、第五反应物和第六反应物中的内参基因引物对的序列相同,所述内参基因引物对包括核苷酸序列如seq id no.19所示的上游引物和核苷酸序列如seq id no.20所示的下游引物。
74.所述第一反应物、第二反应物、第三反应物、第四反应物、第五反应物和第六反应物中的内参基因探针的序列相同或不同。
75.在一种实施方式中,所述第一反应物、第二反应物、第三反应物、第四反应物、第五反应物和第六反应物中的内参基因探针的序列相同,所述内参基因探针的核苷酸序列如seq id no.21所示。
76.内参基因探针的一端修饰有荧光基团,另一端修饰有淬灭基团。具体的,内参基因探针的5’端修饰有荧光基团,3’端修饰有淬灭基团。
77.所述内参基因探针与cyp2c19*2 681g探针、cyp2c19*2 681a探针、cyp2c19*3 636g探针、cyp2c19*3 636a探针、cyp2c19*17-806c探针和cyp2c19*17-806t探针的荧光基团不同。
78.在一种实施方式中,所述内参基因探针序列5’端修饰有vic,3’端修饰有nfq-mgb。
79.在一种实施方式中,所述第一反应物、第二反应物、第三反应物、第四反应物、第五反应物和第六反应物还均包括dna聚合酶,pcr缓冲液,dntp混合物和水性介质。
80.所述dna聚合酶例如为taq dna聚合酶。
81.所述缓冲液通常可以向pcr体系提供最合适的酶催反应的条件。所述缓冲液只要起到上述作用即可。
82.所述dntp混合物通常作为dna合成中的原料,具体可以包括datp、dgtp、dttp、dctp等。
83.所述水性介质通常可以用于调节pcr体系中各组分的浓度,通常可以作为稀释溶剂。
84.在一较佳实施方式中,所述dna聚合酶,pcr缓冲液,dntp混合物和水性介质可以为一种商品化试剂,所述商品化试剂中包括以上所有试剂。所述商品化试剂例如为英潍捷基
(上海)贸易有限公司的master mix。
85.具体的,所述质控品包括阳性质控品和阴性质控品。所述阳性质控品包括第一阳性质控品、第二阳性质控品、第三阳性质控品、第四阳性质控品、第五阳性质控品和第六阳性质控品。
86.所述第一阳性质控品包括cyp2c19*2 681g阳性质粒和内参基因阳性质粒。
87.所述第二阳性质控品包括cyp2c19*2 681a阳性质粒和内参基因阳性质粒。
88.所述第三阳性质控品包括cyp2c19*3 636g阳性质粒和内参基因阳性质粒。
89.所述第四阳性质控品包括cyp2c19*3 636a阳性质粒和内参基因阳性质粒。
90.所述第五阳性质控品包括cyp2c19*17-806c阳性质粒和内参基因阳性质粒。
91.所述第六阳性质控品包括cyp2c19*17-806t阳性质粒和内参基因阳性质粒。
92.所述cyp2c19*2 681g阳性质粒为包括cyp2c19*2 681g位点的质粒。
93.所述cyp2c19*2 681a阳性质粒为包括cyp2c19*2 681a位点的质粒。
94.所述cyp2c19*3 636g阳性质粒为包括cyp2c19*3 636g位点的质粒。
95.所述cyp2c19*3 636a阳性质粒为包括cyp2c19*3 636a位点的质粒。
96.所述cyp2c19*17-806c阳性质粒为包括cyp2c19*17-806c位点的质粒。
97.所述cyp2c19*17-806t阳性质粒为包括cyp2c19*17-806t位点的质粒。
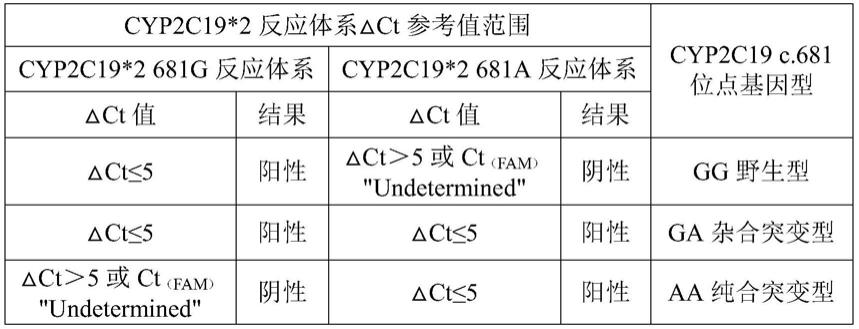
98.在一种实施方式中,所述第一阳性质控品、第二阳性质控品、第三阳性质控品、第四阳性质控品、第五阳性质控品和第六阳性质控品中的内参基因阳性质粒相同。内参基因阳性质粒为包括内参基因特异性序列的质粒。内参基因选自人β-actin、gapdh或18s-rrna基因。在一种实施方式中,所述内参基因选自gapdh,内参基因特异性序列的核苷酸序列如seq id no.22所示。
99.上述质粒的载体可以为本领域常用的克隆载体,例如puc57、pmd18-t、pmd19-t等。
100.在一种实施方式中,所述阴性质控品为无核酸酶水或te缓冲液。
101.在一种实施方式中,所述试剂盒中还包括核酸释放剂。所述核酸释放剂选自十二烷基硫酸钠、聚乙二醇辛基苯基醚或氢氧化钠中的一种或多种。在一较佳实施方式中,所述核酸释放剂包括十二烷基硫酸钠、聚乙二醇辛基苯基醚、氢氧化钠,以核酸释放剂的总体积为基准,所述十二烷基硫酸钠的终浓度为0.01%-1.5%(w/w,g/g),所述聚乙二醇辛基苯基醚的终浓度为0.1%-2%(v/v,ml/ml),所述氢氧化钠的终浓度为0.1m-1m。
102.本发明的核酸释放剂无需利用磁珠提取等复杂的核酸提取流程,也无需核酸纯化流程,可减少提取纯化环节、缩短检测时间。
103.本发明还提供一种检测cyp2c19基因多态性的方法,所述方法包括如下步骤:
104.1)预处理:用核酸释放剂预处理待测样本,释放待测样本中的核酸;
105.2)配制反应体系并进行pcr扩增反应,采集荧光信号;
106.3)质控及结果分析:按照下述规则进行判定:
107.(1)阴性对照组中各信号的ct值均应》35或为"undetermined",否则此次实验结果无效,重新检测;
108.(2)阳性对照组,fam和vic通道均应形成标准扩增曲线,且ct值均应≤32,否则此次实验结果无效,重新检测;
109.(3)对于待测样本,若fam、vic通道未形成标准扩增曲线或ct值》35或为"
undetermined",则该样本检测结果为阴性;fam、vic通道形成标准扩增曲线,34<ct
(vic)
≤35,则该样本此次检测结果无效,重新检测;ct
(vic)
≤34,计算目的信号扩增曲线ct值ct
(fam)
与ct
(vic)
的差值,即
△
ct=ct
(fam)-ct
(vic)
,按照如下规则判定基因型。
[0110][0111][0112][0113][0114]
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
[0115]
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
[0116]
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端
点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
[0117]
实施例1
[0118]
制备免核酸提取直接扩增检测cyp2c19基因多态性的试剂盒
[0119]
1、按下表所示利用现有技术或委托第三方公司分别合成针对cyp2c19*2 681g、cyp2c19*2 681a、cyp2c19*3 636g、cyp2c19*3 636a、cyp2c19*17-806c、cyp2c19*17-806t和内参基因的引物和探针组:
[0120]
[0121][0122]
2、按下表所示的组成成分和规格进行配制本试剂盒的试剂:
[0123]
[0124][0125]
master mix购于英潍捷基(上海)贸易有限公司,引物委托生工生物工程(上海)有限公司订购合成,探针委托英潍捷基(上海)贸易有限公司订购合成。第一反应物至第六反应物中,每条引物的浓度为150nm,各探针的浓度为150nm。第一阳性质控品为将包含有cyp2c19*2 681g位点的特异性序列(seq id no.23)和内参基因特异性序列分别连接到puc57载体的阳性质粒混合物。第二阳性质控品为将包含有cyp2c19*2 681a位点的特异性序列(seq id no.24)和内参基因特异性序列分别连接到puc57载体的阳性质粒混合物。第三阳性质控品为将包含有cyp2c19*3 636g位点的特异性序列(seq id no.25)和内参基因特异性序列分别连接到puc57载体的阳性质粒混合物。第四阳性质控品为将包含有cyp2c19*3 636a位点的特异性序列(seq id no.26)和内参基因特异性序列分别连接到puc57载体的阳性质粒混合物。第五阳性质控品为将包含有cyp2c19*17-806c位点的特异性序列(seq id no.27)和内参基因特异性序列分别连接到puc57载体的阳性质粒混合物。第六阳性质控品为将包含有cyp2c19*17-806t位点特异性序列(seq id no.28)和内参基因特异性序列分别连接到puc57载体的阳性质粒混合物。所用化学试剂采购自国药(上海)国际医药卫生有限公司。
[0126]
实施例2
[0127]
检测cyp2c19基因多态性的方法
[0128]
1、样本采集和处理
[0129]
(1)样本采集
[0130]
a、血卡样本:向fta卡上滴加约30μl非肝素钠或肝素锂抗凝的全血,血液应完全渗透fta卡,60℃烘箱干燥10分钟或室温自然干燥至少4小时。血卡样本采集时不要堆叠血斑,不与其他界面接触,待血斑充分干燥后应放入无菌袋中,避免样本之间的相互污染。
[0131]
b、全血样本:使用非肝素钠或肝素锂为抗凝剂的采血管,由专业人员抽取人外周血。抽血后,轻柔颠倒匀混5-10次,使抗凝剂与血液充分混匀。
[0132]
(2)样本处理
[0133]
a、血卡样本预处理:用75%酒精对取样器外部进行消毒,用取样器对血卡进行取样,共取3片,将所取血卡样本打入标记好的0.2ml的离心管中。分别取阴性质控品和阳性质控品3μl加入到2个0.2ml离心管中。每个0.2ml离心管中加入15μl的核酸释放剂,充分振荡混匀并离心,置于95℃金属浴孵育5分钟。离心至管盖和侧壁无液体,振荡混匀并离心,为待测样本,进行检测或2-8℃暂存备用,暂存时间不超过7天。
[0134]
b、外周血样本预处理:外周血样本,取0.5μl的以非肝素钠或肝素锂为抗凝剂的全血、分别取阴性质控品和阳性质控品3μl加入到3个0.2ml离心管中,分别加入15μl的核酸释放剂,充分振荡混匀并离心,置于95℃金属浴孵育5分钟。离心至管盖和侧壁无液体,振荡混匀并离心,为待测样本,进行检测或2-8℃暂存备用,暂存时间不超过7天。
[0135]
2、配制体系
[0136]
(1)将处理后的血卡样本和外周血样本分别作为待测样本按照下述方式配制体系。根据检测需求设置排版方式,根据排版将pcr反应物加入8联管中,每孔加22.5μl,并往反应孔中分别依次加入2.5μl的阴性质控品、待测样本和反应液对应的阳性质控品,加入后盖好8联管盖子,实验中各管中具体的组分见下表:
[0137]
[0138][0139]
(2)充分混匀并离心。
[0140]
3、荧光pcr检测
[0141]
将pcr反应管放入abi 7300plus荧光pcr扩增仪的样本槽,按对应顺序设置待测样本名称。设置荧光定量pcr反应条件,如下表所示:
[0142][0143]
同时收集fam和vic通道荧光信号。
[0144]
4、结果数据分析
[0145]
pcr程序运行结束后,导出实验数据,观察扩增曲线,分析ct值,进行结果判定。
[0146]
本实施例选用abi 7300plus用于扩增,但本发明不仅局限于abi 7300plus,它适用其他具有fam、vic荧光通道荧光定量pcr仪或根据不同荧光定量pcr仪选用不同荧光探针进行检测。
[0147]
5、结果判定
[0148]
(1)阴性对照组中各信号的ct值均应》35或为"undetermined"。否则,此次实验结
果无效,重新检测;
[0149]
(2)阳性对照组,fam和vic通道均应形成标准扩增曲线,且ct值均应≤32,否则此次实验结果无效,重新检测;
[0150]
(3)对于检测样本,若fam、vic通道未形成标准扩增曲线或ct值》35或为"undetermined",则该样本检测结果为阴性。fam、vic通道形成标准扩增曲线,34<ct
(vic)
≤35,则该样本此次检测结果无效,重新检测;ct
(vic)
≤34,计算目的信号扩增曲线ct值ct
(fam)
与ct
(vic)
的差值,即
△
ct=ct
(fam)-ct
(vic)
,按照如下规则判定基因型。
[0151][0152][0153][0154][0155]
获取cy2p2c19*2、cy2p2c19*3和cy2p2c19*17的野生型、杂合突变型、纯合突变型的血卡或全血样本,按照上述方法进行检测,检测结果分别如图1-9所示。
[0156]
实施例3:检测试剂盒检测体系检测血卡和全血样本的性能评估
[0157]
本实施例分别采集20例血卡和全血样本,按照本试剂盒描述的检测方法进行荧光pcr扩增检测cyp2c19基因型,检测结果直接对比“金标准”一代测序结果,从而验证本发明
检测试剂盒检测体系的准确性和重复性。
[0158]
具体实施方法如下:
[0159]
采用本试剂盒描述的检测方法按照步骤进行样本采集和处理、配置实验检测体系、荧光pcr扩增检测和检测结果数据分析。20例血卡和20例全血的样本cyp2c19基因分型结果如下表所示:
[0160]
[0161][0162]
通过与“金标准”一代测序的结果比对,本发明的荧光pcr基因分型检测方法的正确率为100%。因此,通过本实施例表明,本发明检测试剂盒检测体系检测血卡或全血样本进行cyp2c19基因多态性检测具有非常好的重复性和准确性。本发明检测试剂盒可以稳定用于免核酸提取直接扩增检测血卡或全血样本的cyp2c19基因多态性。
[0163]
本发明用于cyp2c19基因多态性检测,免去复杂的核酸提取纯化步骤,直接将血
卡/全血样本中释放核酸用于荧光pcr扩增,减少核酸提取纯化步骤所增加实验检测步骤、检测成本、检测周期和安全性等问题,满足临床对检测简单、快速和准确的需求。
[0164]
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1