一种基于铝盐混凝预处理的水中病毒含量的检测方法
1.本发明涉及一种促进胶体中病毒释放的方法,从而提高水中病毒检测效率,特别涉及污水中病毒的富集、释放及检测方法,属于生物分析测试和环境监测领域。
背景技术:
2.环境中存在的各种致病病毒可能对人类健康造成极大的危害。目前已经研究发现,污水中含有多种的病毒,如诺如病毒、脊髓灰质炎病毒、甲肝病毒、轮状病毒等等,这些病毒以水为媒介,经常引起传染病的爆发,因此有必要对其进行快速高效的检测,从而预防传染病大规模爆发。
3.但是,不同于生物样品,环境样品尤其是环境水体,由于水样体积巨大,其中杂质含量较多且较为复杂,病毒含量相对较少,现有的研究手段难以直接从水中检出病毒,因此十分有必要在病毒检测前先对水中的病毒进行富集预处理。
4.目前对病毒的富集浓缩主要有以下几种方法:吸附洗脱法、絮凝沉淀法、离心超滤法、超速离心法、正电膜/负电膜法等。尽管富集方法较多,但是却存在诸如操作复杂、价格昂贵、耗费时间较长、效果不稳定、易受到水质水量的影响、难以推广等许多问题。其中,铝盐混凝沉淀法由于其操作步骤简单、花费较少、对大型仪器的依赖程度低等优点,脱颖而出。但是多位研究者发现,在形成胶体的过程中,病毒大多被包裹在胶体内部,吸附在胶体表面的病毒占据很少的比例,仅通过对胶体表面病毒的洗脱不足以实现病毒的有效检测。由此需要寻找有效的病毒释放方法,从而有利于后续的核酸提取和定量pcr检测。本发明方法的原理是在污水中加入铝盐混凝剂,铝盐在ph=6条件下水解产生氢氧化铝胶体,带正电荷的氢氧化铝胶体通过吸附电中和与卷扫等作用包裹带负电荷的病毒颗粒,并使其随着氢氧化铝胶体的沉降从水中转移至沉淀中,通过过滤或离心的方式将含病毒的胶体与水溶液分开,收集的沉淀物通过化学溶解的方式释放包裹的病毒颗粒,进而利用核酸提取和实时荧光rt-pcr完成污水中病毒的检测。
5.本发明能够实现对胶体中病毒的释放,之后采用加热的方式将胶体完全溶解,将释放后的病毒进行核酸提取及荧光定量pcr检测,操作简单、方法检测限低、病毒回收率高。
技术实现要素:
6.本发明的目的是针对现有水中病毒浓度检测过程中,由于富集低浓度病毒存在的技术问题,提供一种提高基于铝盐混凝预处理水中病毒检测效率的方法、以及水中病毒含量检测方法,本发明病毒检测过程中,富集于胶体中病毒的释放不受待测水体水质水量的影响,富集于胶体中病毒释放效率高,效果稳定,病毒浓度检测结果准确,检测限低。
7.为实现本发明的目的,本发明一方面提供一种提高水中病毒检测效率的方法,包括向待测水样中加入絮凝剂,然后再向进行絮凝处理后的包裹病毒的胶体中加入释放剂,使得胶体溶解,病毒从胶体中释放。
8.其中,所述病毒为新冠病毒、猪流行性腹泻病毒(pedv)、猪传染性胃肠炎病毒
25℃,优选为4℃;离心力为1700-2500g;离心处理时间为5-15min。
31.尤其是,固液分离处理后,将上清液去除,获得病毒被浓缩后的所述包裹病毒的絮凝胶体或固体。
32.特别是,还包括测定絮凝胶体的体积,然后再加入释放剂。
33.特别是,获得包裹病毒的絮凝固体后,向絮凝固体中加入无核酸酶水,并测定体积后,再加入释放剂。
34.其中,步骤3)中所述的释放剂选择为氨基羧酸盐络合剂、醇胺类络合剂、羟基羧酸盐络合剂、有机膦酸盐络合剂或聚丙烯酸类络合剂中的一种或多种。
35.特别是,所述氨基羧酸盐络合剂为氨三乙酸钠、乙二胺四乙酸二钠二水合物、乙二胺四乙酸二钠、乙二胺四乙酸四钠或二乙烯三胺五乙酸五钠;所述醇胺类络合剂为单乙醇胺、二乙醇胺或三乙醇胺;所述羟基羧酸盐络合剂为葡萄糖酸钠、海藻酸钠或酒石酸钠;所述有机膦酸盐络合剂为乙二胺四甲叉磷酸钠、二乙烯三胺五甲叉膦酸五钠或氨基三甲叉膦酸五钠;所述聚丙烯酸类络合剂为水解聚马来酸酐或丙烯酸-马来酸酐共聚物。
36.其中,步骤3)中所述释放剂选择乙二胺四乙酸二钠、乙二胺四乙酸二钠二水合物、乙二胺四甲叉膦酸钠及其复配物,进一步优选为乙二胺四乙酸二钠或其二水合物。
37.特别是,所述释放剂的用量为每1毫升絮凝胶体中投加的乙二胺四乙酸二钠量至少为0.045g,优选为0.045-0.27g,优选为0.09-0.18g,进一步优选为0.18g;投加的乙二胺四乙酸二钠二水合物的投加量至少为0.05g,优选为为0.05-0.3g,进一步优选为0.1-0.2g(即乙二胺四乙酸二钠二水合物的投加量至少为0.05g/ml,优选为为0.05-0.3g/ml,优选为0.1-0.2g/ml,进一步优选为0.2g/ml)。
38.尤其是,还包括对加入释放剂后的胶体-释放剂混合体系进行加热处理,促使絮凝胶体与释放剂充分反应,胶体溶解,转变成液态,完全释放胶体包裹的病毒。
39.对加入释放剂后的胶体-释放剂混合液进行加热,促进释放剂与胶体的反应,释放被胶体包裹的病毒,制得释放液。
40.特别是,加热处理温度为40-60℃,优选为50-60℃;加热时间为5-30min,优选为5-15min。
41.其中,步骤4)中所述核酸提取方法为酚/氯仿抽提法、离心柱法或磁珠法,优选为磁珠法。
42.特别是,核酸提取过程按照核酸提取试剂盒的操作方法进行。
43.其中,步骤4)中所述核酸定量pcr测定选择逆转录定量pcr或数字pcr进行。
44.特别是,采用荧光定量pcr法、核酸依赖性扩增检测技术(nasba)或数字pcr(dpcr)法测定病毒核酸含量,优选为荧光定量pcr。
45.特别是,采用荧光定量pcr法测定过程中,获得病毒pcr扩增后的ct值,然后根据标准曲线(1)计算水样中病毒浓度,其中标准曲线(1)如下:
46.ct=k
×ꢀ
log10(n)+b
ꢀꢀꢀꢀꢀꢀꢀ
(1)
47.式(1)中:ct为待测水样的荧光定量pcr的ct值;n为待测水样中病毒浓度,copies/μl;log10(n)为待测水样中病毒浓度的对数值;k为标准曲线的斜率;b为标准曲线的截距。
48.其中,所述标准曲线按照如下方法绘制:
49.a)将已知病毒浓度的标准品用无核酸酶水稀释,配制成4-6个浓度梯度的病毒标
cov-2-aben新冠假病毒标准品(280μl)加入到450μl裂解液中,进行核酸提取,提取后的核酸即为sars-cov-2-aben新冠假病毒标准品阳性对照,共50μl。
68.利用数字pcr法(采用法国stilla technologies数字pcr(naica
tm crystal digital pcr system)仪器及相关试剂)测定sars-cov-2-aben新冠假病毒标准品阳性对照中的e基因浓度,测定结果为4.23*105copies/μl。换算测得sars-cov-2-aben新冠假病毒标准品中e基因的浓度为7.55*104copies/μl。
69.换算过程如下:提取后的核酸即为sars-cov-2-aben新冠假病毒标准品阳性对照,共50μl,阳性对照中e基因的浓度为4.23*105copies/μl,因此,阳性对照中e基因的总量为50*4.23*105=2.115*107copies;又因为取了280μl新冠假病毒标准品进行核酸提取,故新冠假病毒标准品中e基因浓度为2.115*107/280=7.55*104copies/μl。
70.本领域现有的病毒核酸提取试剂盒均适用于本发明的核酸提取,例如还可以是磁珠法核酸提取试剂盒(magmax
tm
core nucleic acid purification kit)。
71.2、配制含新冠假病毒水样
72.取假病毒标准品200μl与800μl无核酸酶水混合,得到将假病毒标准品稀释5倍后的新冠假病毒溶液,新冠假病毒溶液中e基因浓度为1.51*104copies/μl。
73.将新冠假病毒溶液(50μl)稀释到50ml自来水中,配制成新冠假病毒水样,备用,其中新冠假病毒水样中病毒浓度数量级为104copies/ml,水样中投加病毒拷贝数为投加的新冠假病毒溶液的浓度(1.51*104copies/μl)与投加体积(50μl)的乘积。
74.本实施例中的病毒以新冠假病毒为例,本领域中现有已知的其他病毒均适用于本发明,例如新冠病毒(sars-cov-2)、诺如病毒(norovirus)、脊髓灰质炎病毒(poliovirus)、猪流行性腹泻病毒(pedv)、猪传染性胃肠炎病毒(tgev)、轮状病毒(porv)、禽流感病毒(aiv)、猪伪狂犬病毒(prv)、猪细小病毒(ppv)或猪圆环病毒(pcv)等。
75.为了保证操作人员的安全,在富集、检测过程中,通常首先对水体、病毒进行灭活操作。本实施例中新冠假病毒对人无害,因此未进行病毒灭活处理。
76.3、絮凝处理
77.首先向步骤2)制备的新冠假病毒水样中加入ph调节剂,对水样进行第一次ph调节,调节水样ph值为6(ph通常为4-9,优选为5-7)后加入絮凝剂(alcl3),搅拌混合均匀,使得水样中絮凝剂铝离子的浓度为0.003m(通常为0.001-0.01m);
78.接着再加入ph调节剂,对新冠假病毒水样进行第二次ph调节,调节病毒水样ph值为6(通常为4-9,优选为5-7)后将水样置于摇床中,以150rpm(通常为100-200rpm)的转速混合均匀;第二次ph调节后,加入到水样中的絮凝剂alcl3形成氢氧化铝胶体,水体中的病毒与形成的胶体充分接触并吸附于胶体,絮凝、沉淀水体中的病毒。
79.本发明中絮凝剂除了氯化铝之外,其他硫酸铝、聚合氯化铝、聚合硫酸铝铁均适用于本发明;加入絮凝剂氯化铝后,水体中铝离子的浓度除了0.003m之外,其他浓度0.001-0.01m均适用于本发明;ph调节剂为1m盐酸溶液或氢氧化钠溶液。
80.4、离心处理
81.摇床混合15min(通常摇床混合时间至少15min,优选为15-20min)后,将水样转移至50ml离心管中,在4℃(通常为4-25℃,优选为4℃)条件下以1900g(通常为1700g-2500g)的离心力离心5min(通常离心时间为5-15min,优选为5min)。
82.5、络合处理
83.倒掉离心管中的上清液,获得离心胶体,并测定离心管内剩余胶体的体积(1ml),然后向离心管内剩余的胶体中加入乙二胺四乙酸二钠二水合物,其中乙二胺四乙酸二钠二水合物的加入量为每1ml离心管内剩余胶体中加入乙二胺四乙酸二钠二水合物0.2g(通常为0.05-0.3g/ml,优选为0.2g/ml),摇晃数十次至胶体变为液态;然后转移至10ml离心管,制得水样病毒胶体释放液,备用,其中所得水样病毒胶体释放液体积约1ml;
84.本实施例中离心后,离心管内剩余胶体为1ml,加入乙二胺四乙酸二钠二水合物0.2g。
85.本发明具体实施方式中加入的络合剂以乙二胺四乙酸二钠二水合物固体为例,其他络合剂如其他氨基羧酸盐络合剂(如氨三乙酸钠等)、醇胺类络合剂(如三乙醇胺等)、羟基羧酸盐络合剂(如葡萄糖酸钠等)、有机膦酸盐络合剂(如乙二胺四甲叉磷酸钠等)、聚丙烯酸类络合剂(如水解聚马来酸酐等)等均适用于本发明。
86.6、加热促溶
87.将10ml离心管放入水浴锅中,在60℃的条件下加热10min(通常为5-30min,优选为10min),促进乙二胺四乙酸二钠与氢氧化铝胶体的络合反应,氢氧化铝胶体与乙二胺四乙酸二钠反应,生成溶解性的络合物,反应完全后,氢氧化铝由胶体形式转变为液态,氢氧化铝包裹的病毒释放至液体中,制得热促溶水样病毒释放液。
88.由于乙二胺四乙酸二钠二水合物的投加量过量,因此未反应完的乙二胺四乙酸二钠以粉末的形式沉淀在管底。
89.7、病毒核酸提取
90.释放后的病毒存在于液体中,对热促溶水样病毒释放液按照核酸提取试剂盒(磁珠法:magmax
tm
core nucleic acid purification kit)进行核酸提取。
91.精确吸取热促溶病毒释放液(300μl)加入到450μl裂解液中,按照磁珠法核酸提取试剂盒(magmax
tm
core nucleic acid purification kit)的操作说明,取600μl进行核酸提取,提取后的核酸共90μl,制得水样病毒核酸提取液。
92.本领域现有的病毒核酸提取试剂盒均适用于本发明的核酸提取,例如还可以是qiaamp viral rna mini kit核酸提取试剂盒。
93.8、绘制标准曲线
94.8a、将步骤1中核酸提取得到的sars-cov-2-aben新冠假病毒标准品阳性对照进行10倍梯度稀释,获得从104到10-1
copies/μl共六个梯度的新冠假病毒标准品阳性对照稀释液,即浓度梯度分别为4.23*104、4.23*103、4.23*102、4.23*101、4.23*100、4.23*10-1
copies/μl。
95.8b、对六个阳性对照稀释液、步骤7提取得到的水样病毒核酸提取液进行新冠假病毒e基因进行荧光定量pcr(q-pcr)检测,在pcr反应体系中加入荧光定量pcr检测的mix(酶、四种三磷酸脱氧核苷酸(dntp)、mg
2+
、荧光基团、扩增缓冲液),ddh2o,与新冠假病毒e基因相对应的引物、模板样品;
96.按照程序进行pcr扩增,pcr反应程序为:45℃,10min;95℃,5min;95℃,15s及60℃,45s,对于95℃,15s及60℃,45s循环45次,并在最后一步收集荧光。每个实验3次重复(即3个平行样),获得3次重复的新冠假病毒ct值,并取平均值;其中,每个阳性对照稀释液的3
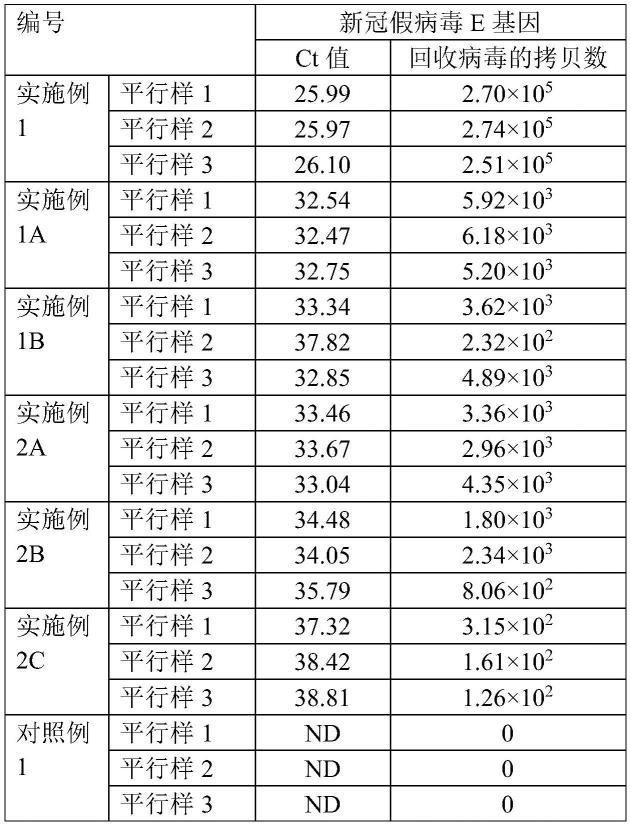
次重复q-pcr检测,获得3个ct值,取其平均值进行标准曲线绘制;水样病毒核酸提取液的3次荧光pcr检测的ct值:25.99、25.97、26.10。
97.8c、以六个梯度阳性对照稀释液中e基因浓度的对数为横轴,其对应的ct值为纵轴,绘制标准曲线,标准曲线如式(1)所示:
98.ct=k
ꢀ×ꢀ
log10(n) + b
ꢀꢀꢀꢀꢀꢀꢀ
(1)
99.式(1)中:ct为阳性对照稀释液的荧光定量pcr的ct值;n为阳性对照稀释液中病毒e基因浓度,copies/μl;log10(n)为阳性对照稀释液中病毒e基因浓度的对数值;k和b是根据标准曲线求得的常数,k为曲线斜率,k=-3.4745;b为曲线截距,b=35.92;
100.9、病毒定量测定
101.将测定水样病毒回收提取液的ct值代入标准曲线(1)中,计算得到待测样品浓度(n)。
102.根据水样中病毒富集、释放、核酸提取和荧光pcr检测的体积变化,计算回收病毒拷贝数;步骤6)中病毒释放后的热促溶水样病毒释放液为1ml,取其中300μl样品进行核酸提取,根据磁珠法核酸提取试剂盒的说明,核酸提取后待测样品提取核酸后共有90μl,核酸提取过程中,初始体积为300μl+450μl=750μl,根据操作说明,后续取600μl进行核酸提取,根据这一提取过程中的体积变化,计算得到回收病毒拷贝数(m,copies),m=n
×
90
×
(1000/300)
×
(750/600)
103.利用已知浓度的病毒及其ct值的结果,可以综合式(1),通过待测病毒的ct值计算待测样品中病毒的浓度,而后根据水样中病毒富集及病毒核酸提取过程中的水样的体积变化,计算得到水样富集后病毒的总拷贝数,根据荧光pcr测定得到的水样病毒核酸提取液的3个ct值,分别计算得到回收病毒的拷贝数,测定结果如表1。
104.10、测定病毒回收率
105.按照公式(1a)计算病毒回收率,
[0106][0107]
式(1a)中回收病毒拷贝数由定量pcr结果计算得到;投加病毒拷贝数根据步骤1中水样中病毒投加量确定,测定结果如表1a。
[0108]
本发明实施例以磁珠法提取核酸,本领域中现有的已知的核酸提取法,如酚/氯仿抽提法、离心柱法均适用于本发明,采用本领域现有已知的核酸提取试剂盒提取核酸。
[0109]
本发明采用荧光定量pcr检测病毒核酸含量,即根据测定的ct值,计算病毒回收率,本领域中其他定量检测方法如核酸依赖性扩增检测技术(nasba)或数字pcr(dpcr)法测定病毒核酸含量均适用于本发明。
[0110]
实施例1a:对富集前病毒浓度数量级为103copies/ml的水样进行富集、释放和检测
[0111]
除了步骤2)“配制含新冠假病毒水样”中将e基因浓度为1.51*104copies/μl的新冠假病毒溶液先稀释10倍,制成新冠假病毒稀释液后,再取新冠假病毒稀释液50ul稀释到50ml自来水中,制成新冠假病毒水样,使得水样中新冠假病毒e基因的初始浓度数量级为103copies/ml;步骤8)“绘制标准曲线”中的标准曲线的k=-3.7545,b=37.04;测定的水样病毒核酸提取液的3次荧光pcr检测的ct值如表1所示之外,其余与实施例1相同。
[0112]
荧光定量pcr检测结果如表1。按公式(1a)计算的病毒回收率如表1a。
[0113]
表1 实施例1-2c、对照例1中病毒的荧光定量pcr测定结果
[0114][0115]
实施例1b:对富集前病毒浓度数量级为102copies/ml的水样进行富集、释放和检测
[0116]
除了步骤2)“配制含新冠假病毒水样”中将e基因浓度为1.51*104copies/μl的新冠假病毒溶液先稀释100倍,制成新冠假病毒稀释液后,再取新冠假病毒稀释液50ul稀释到50ml自来水中,制成新冠假病毒水样,使得水样中新冠假病毒e基因的初始浓度数量级为102copies/ml;步骤8)“绘制标准曲线”中的标准曲线的k=-3.7545,b=37.04;测定的水样病毒核酸提取液的3次荧光pcr检测的ct值如表1所示之外,其余与实施例1相同。
[0117]
荧光定量pcr检测结果如表1。按公式(1a)计算的病毒回收率的结果如表1a。
[0118]
表1a 病毒的回收率
[0119]
编号新冠假病毒回收率实施例135.13%
±
1.61%实施例1a7.64%
±
0.67%实施例1b38.61%
±
31.90%实施例2a4.71%
±
0.95%
实施例2b21.85%
±
10.32%实施例2c26.60%
±
13.33%对照例10%
[0120]
实施例2a:乙二胺四乙酸二钠溶解方法对污水中病毒的富集和检测
[0121]
除了步骤2)中以北京某市政污水厂的进水为对象,将e基因浓度为1.51*104copies/μl的新冠假病毒溶液先稀释10倍,制成新冠假病毒稀释液后,再取新冠假病毒稀释液50μl加入到50ml污水中(即以北京某市政污水厂的进水替代实施例1中的自来水),制成新冠假病毒水样,使得水样中新冠假病毒e基因的初始浓度数量级为103copies/ml;步骤8)“绘制标准曲线”中的标准曲线的k=-3.7545,b=37.04之外,其余与实施例1相同。荧光定量pcr检测结果ct值、回收病毒拷贝数如表1;病毒回收率见表1a。
[0122]
实施例2b:对富集前病毒浓度数量级为102copies/ml污水水样进行富集、释放和检测
[0123]
除了步骤2)中将e基因浓度为1.51*104copies/μl的新冠假病毒溶液先稀释100倍,制成新冠假病毒稀释液后,再取新冠假病毒稀释液50μl加入到50ml污水中,制成新冠假病毒水样,使得水样中新冠假病毒e基因的初始浓度数量级为102copies/ml之外,其余与实施例2a相同。荧光定量pcr检测结果ct值、回收病毒拷贝数如表1;病毒回收率见表1a。
[0124]
实施例2c:对富集前病毒浓度数量级为101copies/ml污水水样的富集、释放和检测
[0125]
除了步骤2)中将e基因浓度为1.51*104copies/μl的新冠加病毒溶液先稀释1000倍,制成新冠假病毒稀释液后,再取新冠假病毒稀释液50μl加入到50ml污水中,制成新冠假病毒水样,使得水样中新冠假病毒e基因的初始浓度数量级为101copies/ml之外,其余与实施例2a相同。荧光定量pcr检测结果ct值、回收病毒拷贝数如表1;病毒回收率见表1a。
[0126]
对照例1:研磨释放胶体中的病毒
[0127]
1、配制含病毒水样
[0128]
取假病毒标准品200μl与800μl无核酸酶水混合,得到将假病毒标准品稀释5倍后的新冠假病毒溶液,新冠假病毒溶液中e基因浓度为1.51*104copies/μl。
[0129]
e基因浓度为1.51*104copies/μl的新冠加病毒溶液先稀释1000倍,制成新冠假病毒稀释液后,再取新冠假病毒稀释液(50μl)稀释到50ml实施例2c中使用的污水中,配制成新冠假病毒水样,备用,其中新冠假病毒水样中病毒浓度数量级为101copies/ml,水样中投加病毒拷贝数为投加的新冠假病毒溶液的浓度(1.51*101copies/μl)与投加体积(50μl)的乘积。
[0130]
2、絮凝处理
[0131]
首先向步骤2)制备的新冠假病毒水样中加入ph调节剂,对水样进行第一次ph调节,调节水样ph值为6(ph通常为4-9,优选为5-7)后加入絮凝剂(alcl3),搅拌混合均匀,使得水样中絮凝剂铝离子的浓度为0.003m(通常为0.001-0.01m);
[0132]
接着再加入ph调节剂,对新冠假病毒水样进行第二次ph调节,调节病毒水样ph值为6(通常为4-9,优选为5-7)后将水样置于摇床中,以150rpm(通常为100-200rpm)的转速混合均匀;第二次ph调节后,加入到水样中的絮凝剂alcl3形成氢氧化铝胶体,水体中的病毒与形成的胶体充分接触并吸附于胶体,絮凝、沉淀水体中的病毒。
[0133]
3、过滤、重悬处理
[0134]
摇床混合15min(通常摇床混合时间至少15min,优选为15-20min)后,将水样于室温静置15min(通常静置处理时间≥15min,优选为15-30min);然后将上清液缓慢倒掉,剩下的液体用滤纸过滤;
[0135]
将滤纸上的固体转移到已知重量的离心管中,称量离心管与其内部的固体的总质量,固体重量为0.7322g(过滤后滤纸上的固体质量小于1.5g,固体含水率为89.16%,通常为85-95%),接着加入3ml、浓度为0.01m、ph为7.3的缓冲液pbs(磷酸缓冲盐溶液),使得滤纸上的固体重新悬浮于缓冲液pbs中,即重悬处理,获得重悬混合液;
[0136]
4、研磨处理
[0137]
对全部的重悬混合液涡旋混匀2min,接着从中精确吸取300μl,放入研磨仪,以4m/s的线速度,进行研磨处理5min,获得研磨混合液;
[0138]
5、病毒核酸提取
[0139]
与实施例1的步骤7“病毒核酸提取”方法相同。
[0140]
6、绘制标准曲线
[0141]
与实施例1的步骤8“绘制标准曲线”的方法相同。
[0142]
7、病毒定量测定
[0143]
与实施例1的步骤9“病毒定量测定”的方法相同。
[0144]
实施例3:乙二胺四乙酸二钠溶解方法对自来水中病毒的富集和检测
[0145]
1、测定sars-cov-2-aben新冠假病毒标准品中e基因浓度
[0146]
按照磁珠法核酸提取试剂盒(magmax
tm
core nucleic acid purification kit)的操作说明精确吸取300μlsars-cov-2-aben新冠假病毒标准品加入到450μl裂解液中,取600μl进行核酸提取,提取后的核酸即为sars-cov-2-aben新冠假病毒标准品阳性对照(共90μl)。
[0147]
利用数字pcr法测定经过核酸提取后的sars-cov-2-aben新冠假病毒标准品阳性对照中e基因的浓度,测定结果为2.643*105copies/μl。换算测得sars-cov-2-aben新冠假病毒标准品中e基因的浓度为9.91*104copies/μl,即新冠假病毒标准品中e基因浓度为9.91*104copies/μl。
[0148]
换算过程如下:提取后的核酸即为sars-cov-2-aben新冠假病毒标准品阳性对照,共90μl,阳性对照中e基因的浓度为2.643*105copies/μl,因此,阳性对照中e基因的总量为90*2.643*105=2.379*107copies;又因为取了300μl新冠假病毒标准品进行核酸提取,初始体积为300μl+450μl=750μl,根据操作说明,后续取600μl进行核酸提取,根据这一提取过程中的体积变化,故新冠假病毒标准品中e基因浓度为2.379*107*750/600/300=9.91*104copies/μl
[0149]
2、配制含新冠假病毒水样
[0150]
取假病毒标准品100μl与900μl无核酸酶水混合,得到将假病毒标准品稀释10倍后的新冠假病毒溶液,新冠假病毒溶液中e基因浓度为9.91*103copies/μl。
[0151]
将新冠假病毒溶液50μl稀释到50ml自来水中,配制成新冠假病毒水样,备用,其中新冠假病毒水样中e病毒浓度数量级约为104copies/ml,;水样中投加病毒拷贝数为投加的新冠假病毒稀释液的浓度(9.91*103copies/μl)与投加体积(50μl)的乘积。
[0152]
荧光定量pcr检测结果如表2a。按照公式(1)计算病毒回收率的结果如表2。
[0153]
3、絮凝处理
[0154]
与实施例1步骤3“絮凝处理”相同。
[0155]
4、离心处理
[0156]
与实施例1的步骤4“离心处理”相同。
[0157]
5、络合处理
[0158]
除了倒掉离心管中的上清液后,离心管内剩余胶体的体积为0.9ml,向离心管内剩余胶体中加入乙二胺四乙酸二钠二水合物,乙二胺四乙酸二钠二水合物的添加量为每1ml胶体中添加0.2g,即乙二胺四乙酸二钠二水合物的添加量为0.2g/ml之外,其余与实施1相同。
[0159]
6、加热促溶处理
[0160]
与实施例1步骤6“加热促溶处理”相同。
[0161]
7、病毒核酸提取
[0162]
与实施例1步骤7“病毒核酸提取”相同。
[0163]
8、绘制标准曲线
[0164]
除了将步骤1中核酸提取得到的sars-cov-2-aben新冠假病毒标准品阳性对照进行10倍梯度稀释,获得从104到10-1
copies/μl共六个梯度的新冠假病毒标准品阳性对照稀释液,即浓度梯度分别为2.64*104、2.64*103、2.64*102、2.64*101、2.64*100、2.64*10-1
copies/μl;绘制的标准曲线的k=-3.3340,b=35.02之外,其余与实施例1相同。
[0165]
9、病毒定量测定
[0166]
与实施例1步骤9“病毒定量测定”相同。
[0167]
根据水样中病毒富集、释放、核酸提取和荧光pcr检测的体积变化,计算回收病毒拷贝数,荧光定量pcr检测结果、回收病毒拷贝数如表2。按照公式(1a)计算的病毒回收率如表2a。
[0168]
实施例3a、3b、3c:改变乙二胺四乙酸二钠二水合物的加入剂量
[0169]
除了步骤5“络合处理”中倒掉离心管中上清液,测定离心管内剩余胶体体积后,向离心管内剩余胶体中加入的乙二胺四乙酸二钠二水合物,其中每1ml剩余胶体中乙二胺四乙酸二钠二水合物的添加量分别为0.05g、0.1g、0.3g,即乙二胺四乙酸二钠二水合物的添加量为0.05g/ml、0.1g/ml、0.3g/ml之外,其余与实施例3相同。
[0170]
荧光定量pcr检测结果、回收病毒拷贝数如表2。按照公式(1a)计算的病毒回收率如表2a。
[0171]
对照例2:胶体中不加入乙二胺四乙酸二钠二水合物进行络合反应
[0172]
1、测定sars-cov-2-aben新冠假病毒标准品中e基因浓度
[0173]
与实施例3步骤1)相同。
[0174]
2、配制含新冠假病毒水样
[0175]
与实施例3步骤2)相同。
[0176]
3、絮凝处理
[0177]
与实施例3步骤3)相同。
[0178]
4、离心处理
[0179]
与实施例3步骤4相同。
[0180]
5、病毒核酸提取
[0181]
除了将离心处理后的上清液倒掉后,测定离心管内剩余胶体的体积(1ml),取离心管内剩余的胶体300μl进行核酸提取外,其余与实施例3的步骤7“病毒核酸提取”方法相同。
[0182]
6、绘制标准曲线
[0183]
与实施例3步骤8)相同。
[0184]
7、病毒定量测定
[0185]
与实施例3步骤9)相同。
[0186]
荧光定量pcr检测结果如表2。按照公式(1a)计算的病毒回收率如表2a。
[0187]
表2 实施例3-4b、对照例2病毒的荧光定量pcr测定结果
[0188][0189][0190]
表2a 实施例3-4b、对照例2病毒的回收率
[0191]
编号新冠假病毒回收率实施例37.79%
±
0.56%实施例3a10.38%
±
4.99%实施例3b13.81%
±
2.77%实施例3c6.76%
±
0.82%
实施例4a5.94%
±
0.61%实施例4b3.16%
±
0.44%对照例20
[0192]
实施例4a:过滤法进行固液分离并使用乙二胺四乙酸二钠释放病毒
[0193]
1、测定sars-cov-2-aben新冠假病毒标准品中e基因浓度
[0194]
与实施例1相同。
[0195]
2、配制含新冠假病毒水样
[0196]
取假病毒标准品200μl与800μl无核酸酶水混合,得到将假病毒标准品稀释5倍后的新冠假病毒溶液,新冠假病毒溶液中e基因浓度为1.51*104copies/μl;
[0197]
将e基因浓度为1.51*104copies/μl的新冠假病毒溶液先稀释10倍,制成新冠假病毒稀释液后,再取新冠假病毒稀释液50ul稀释到50ml自来水中,制成新冠假病毒水样,使得水样中新冠假病毒e基因的初始浓度数量级为103copies/ml;
[0198]
3、絮凝处理
[0199]
与实施例1相同。
[0200]
4、过滤处理
[0201]
摇床混合15min(通常摇床混合时间至少15min,优选为15-20min)后,用中速定型滤纸进行过滤处理(替换实施例1a中的离心处理),其他快速、慢速定性滤纸均适用于本发明。
[0202]
5、络合处理
[0203]
将过滤处理后的滤纸上过滤到的胶体刮入10ml离心管中,并测定离心管内胶体体积(1.2ml),向离心管内的胶体中加入乙二胺四乙酸二钠二水合物,其中乙二胺四乙酸二钠二水合物的加入量为每1ml离心管内剩余胶体中加入乙二胺四乙酸二钠二水合物0.2g(通常为0.05-0.3g/ml,优选为0.2g/ml),与实施例1相同。
[0204]
6、加热促溶
[0205]
与实施例1相同。
[0206]
7、病毒核酸提取
[0207]
与实施例1相同。
[0208]
8、绘制标准曲线
[0209]
与实施例1相同。
[0210]
9、病毒定量测定
[0211]
与实施例1步骤9)相同。
[0212]
荧光定量pcr检测结果、回收病毒拷贝数如表2。按照公式(1a)计算的病毒回收率如表2a。
[0213]
实施例4b:抽滤法进行固液分离并使用edta溶液释放病毒
[0214]
1、测定sars-cov-2-aben新冠假病毒标准品中e基因浓度
[0215]
与实施例4a相同。
[0216]
2、配制含新冠假病毒水样
[0217]
与实施例4a相同。
[0218]
3、絮凝处理
[0219]
与实施例4a相同。
[0220]
4、抽滤处理
[0221]
摇床混合15min(通常摇床混合时间至少15min,优选为15-20min)后,采用抽滤膜材质为pvdf(孔径为0.22μm)进行抽滤处理(替换实施例1a中的离心处理),其他孔径(0.45μm)及材质(mce)的滤膜均适用于本发明。
[0222]
5、络合溶解
[0223]
将抽滤处理后的滤膜上的固体刮入10ml离心管中,向离心管内加入无核酸酶水,溶解,并测定离心管内液体体积(1ml),向离心管内加入乙二胺四乙酸二钠二水合物,其中乙二胺四乙酸二钠二水合物的加入量为每1ml离心管内液体中加入乙二胺四乙酸二钠二水合物0.2g,与实施例1相同。
[0224]
向离心管内加入的乙二胺四乙酸二钠二水合物的加入量为每1ml离心管内液体中加入乙二胺四乙酸二钠二水合物0.05-0.3g,优选为0.2g(通常为0.05-0.3g/ml,优选为0.2g/ml),摇晃数十次使得滤膜上的固体溶解,所得体积约1ml。
[0225]
6、加热促溶
[0226]
与实施例1相同。
[0227]
7、病毒核酸提取
[0228]
与实施例1相同。
[0229]
8、绘制标准曲线
[0230]
与实施例1相同。
[0231]
9、病毒定量测定
[0232]
与实施例1步骤9)相同。
[0233]
荧光定量pcr检测结果如表2。按照公式(1a)计算的病毒回收率如表2。
[0234]
测定结果表明:
[0235]
1)由表1中实施例1-2c的测定结果可知:本发明的胶体中病毒的释放方法对污水及自来水中不同浓度的病毒均可行。
[0236]
2)由对照例1、实施例2c的测定结果可知,本发明的胶体中病毒的有效释放方法检出限可以低至10copies/ml,物理研磨的方式释放病毒在该浓度下无法有效检出病毒。
[0237]
3)由对照例2、实施例3a-3c的测定结果可知:本发明方法中添加不同质量的乙二胺四乙酸二钠二水合物(0.05g/ml-0.3g/ml)与氢氧化铝胶体络合,都能够有效释放病毒,不添加乙二胺四乙酸二钠二水合物无法有效释放被包裹在胶体中的病毒。
[0238]
试验例1:实际环境样品中新冠病毒的富集及检测
[0239]
检测尼泊尔某河流中新冠病毒的含量,连续3天采样,其中样品1-3取自河流a;样品4-6取自河流b。
[0240]
1、测定sars-cov-2-aben新冠假病毒标准品中e基因浓度
[0241]
按照核酸提取试剂盒(magmax
tm
core nucleic acid purification kit)的操作说明精确吸取sars-cov-2-aben新冠假病毒标准品(300μl)加入到450μl裂解液中,进行核酸提取,提取后的核酸即为sars-cov-2-aben新冠假病毒标准品阳性对照,共90μl;利用数字pcr法测定sars-cov-2-aben新冠假病毒标准品阳性对照中的e基因的浓度,测定结果为3.4*105copies/μl。
[0242]
2、絮凝处理
[0243]
与实施例1步骤3)相同。
[0244]
3、离心处理
[0245]
与实施例1步骤4)相同。
[0246]
4、络合溶解
[0247]
倒掉离心管中的上清液,获得离心胶体(1ml),然后向离心管内剩余的胶体中加入乙二胺四乙酸二钠二水合物0.2g,其中乙二胺四乙酸二钠二水合物的加入量为每1ml离心管内剩余胶体中加入乙二胺四乙酸二钠二水合物0.2g(通常为0.05-0.3g/ml),摇晃数十次至胶体变为液态;然后转移至10ml离心管,制得水样病毒胶体释放液,备用;
[0248]
5、加热促溶
[0249]
与实施例1步骤6)相同。
[0250]
6、病毒核酸提取
[0251]
与实施例1步骤7)相同
[0252]
7、绘制标准曲线
[0253]
7a、将步骤1)中核酸提取得到的sars-cov-2-aben新冠假病毒标准品阳性对照进行10倍梯度稀释,获得从104到10-1
copies/μl共六个梯度的新冠假病毒标准品阳性对照稀释液,即浓度分别为3.4*104、3.4*103、3.4*102、3.4*101、3.4*100、3.4*10-1
copies/μl。
[0254]
7b、对六个阳性对照稀释液、步骤6提取的水样病毒核酸提取液进行新冠假病毒e基因荧光定量pcr检测,pcr反应体系、pcr扩增反应程序与实施例1步骤8)相同。
[0255]
每个阳性对照稀释液3次重复,3个ct值,取其平均值进行标准曲线绘制;
[0256]
7c、除了标准曲线的k=-3.5821;b=36.40之外,其余与实施例1步骤8c)相同。
[0257]
8、病毒定量测定
[0258]
将测定的水样病毒回收提取液的ct值代入步骤7)的标准曲线中,计算得到待测样品中e基因浓度(n)
[0259]
根据水样中病毒富集、释放、核酸提取和荧光pcr检测的体积变化,计算回收病毒拷贝数;步骤5)中病毒释放后的热促溶水样病毒释放液为1ml,取300μl进行核酸提取,核酸提取后待测样品提取核酸后共有90μl,核酸提取过程中,初始体积为300μl+450μl=750μl,根据操作说明,后续取600μl进行核酸提取,根据这一提取过程中的体积变化,计算得到回收病毒拷贝数(m),m=n
×
90
×
(1000/300)
×
(750/600);
[0260]
利用已知浓度的病毒及其ct值的结果,得到标准曲线,通过待测病毒的ct值计算待测样品中病毒的浓度,而后根据水样中病毒富集及病毒核酸提取过程中的水样的体积变化,计算得到水样富集后病毒的总拷贝数,根据荧光pcr测定得到的水样病毒核酸提取液的3个ct值,分别计算得到回收病毒的拷贝数,测定结果如表3。
[0261]
本发明采用荧光定量pcr检测病毒核酸含量,根据测定的ct值,计算病毒回收率。
[0262]
表3 试验例1新冠病毒的荧光定量pcr测定结果
[0263][0264]
试验例2:实际养殖场污水检测
[0265]
检测上海市五家养殖场污水处理系统的进水中porv、pcv、ppv三种病毒的含量。
[0266]
1、絮凝处理
[0267]
向采集自上海市五家养殖场污水处理系统的进水水样(即待测水样)中加入ph调节剂,对水样进行第一次ph调节,调节水样ph值为6(ph通常为4-9);接着加入絮凝剂(alcl3),搅拌混合均匀,使得水样中絮凝剂铝离子的浓度为0.003m;
[0268]
接着再加入ph调节剂,对待测水样进行第二次ph调节,调节水样ph值为6(通常为4-9)后将水样置于摇床中,以150rpm(通常为100-200rpm)的转速混合均匀;第二次ph调节后,加入到水样中的絮凝剂alcl3形成氢氧化铝胶体,形成的胶体与水体中的病毒充分接触并吸附于胶体,絮凝、沉淀水体中的病毒;
[0269]
2、离心处理
[0270]
摇床混合15min(通常至少15min,优选为15-20min)后,将水样转移至50ml离心管中,在4℃(通常为4-25℃)条件下以1900g的离心力离心5min(通常为5-15min);
[0271]
3、络合处理
[0272]
倒掉离心管中的上清液,获得水样离心胶体(1.2ml),然后加入乙二胺四乙酸二钠二水合物,其中乙二胺四乙酸二钠二水合物的加入量为每1ml离心管内剩余胶体中加入乙二胺四乙酸二钠二水合物0.2g(通常为0.05-0.3g/ml,优选为0.2g/ml),摇晃数十次至胶体变为液态后转移至10ml离心管,制得待测水样病毒胶体释放液,备用,其中所得待测水样病毒胶体释放液体积1ml。
[0273]
4、加热促溶
[0274]
将10ml离心管放入水浴锅中,在60℃的条件下加热10min(通常为5-30min),促进乙二胺四乙酸二钠与氢氧化铝胶体的络合反应,氢氧化铝胶体与乙二胺四乙酸二钠反应,生成溶解性的络合物,反应完全后,氢氧化铝由胶体形式转变为液态,氢氧化铝包裹的病毒释放至液体中,制得热促溶待测水样病毒释放液。
[0275]
5、病毒核酸提取
[0276]
按照核酸提取试剂盒(磁珠法:magmax
tm
core nucleic acid purification kit)对热促溶待测水样病毒释放液进行核酸提取;
[0277]
精确吸取热促溶病毒释放液(300μl)加入到450μl裂解液中,按照磁珠法核酸提取
试剂盒的操作说明,取600μl进行核酸提取,提取后的核酸共90μl,制得水样病毒核酸提取液。
[0278]
本领域现有的病毒核酸提取试剂盒均适用于本发明的核酸提取,例如还可以是qiaamp viral rna mini kit核酸提取试剂盒。
[0279]
6、绘制porv、pcv、ppv三种病毒的标准曲线
[0280]
porv、pcv、ppv三种病毒的阳性对照购买自北京森康生物技术开发有限公司,初始浓度分别为1.0*103copies/μl,1.0*105copies/μl,5.0*104copies/μl。
[0281]
6-1、将3种阳性对照病毒分别进行10倍梯度稀释,获得从初始浓度到四次稀释后的五个梯度病毒阳性对照稀释液,即porv浓度梯度分别为1.0*103、1.0*102、1.0*101、1.0*10-1
、1.0*10-2
copies/μl;pcv浓度梯度分别为1.0*105、1.0*104、1.0*103、1.0*102、1.0*101copies/μl;ppv浓度梯度分别为5.0*104、5.0*103、5.0*102、5.0*101、5.0*10-1
copies/μl。
[0282]
6-2、对三种阳性对照病毒的稀释液、步骤5)提取得到的水样病毒核酸提取液分别做定量pcr检测,即对阳性对照病毒porv的5个稀释液进行porv病毒荧光定量pcr检测;pcv的5个稀释液进行pcv病毒荧光定量pcr检测;ppv的5个稀释液进行ppv病毒荧光定量pcr检测;其中在pcr反应体系中加入荧光定量pcr检测的mix(酶、四种三磷酸脱氧核苷酸(dntp)、mg
2+
、荧光基团、扩增缓冲液),ddh2o,与porv、pcv、ppv相对应的引物、模板样品(方法参见专利申请202011498998.4);
[0283]
porv的pcr扩增反应程序为:42℃,15min;94℃,3min;94℃,15s,53℃,10s,60℃,30s,对于94℃,15s,53℃,10s,60℃,30s,循环40次,并在最后一步收集荧光。每个实验3次重复(即3个平行样),获得3次重复的病毒ct值,并取平均值;
[0284]
pcv的pcr扩增反应程序为50℃,2min;94℃,3min;94℃,15s及60℃,40s,对于94℃,15s及60℃,40s,循环40次,并在最后一步收集荧光。每个实验3次重复(即3个平行样),获得3次重复的病毒ct值,并取平均值;
[0285]
ppv的pcr扩增反应程序为:94℃,3min;94℃,15s及60℃,40s,对于94℃,15s及60℃,40s循环40次,并在最后一步收集荧光。每个实验3次重复(即3个平行样),获得3次重复的新冠病毒ct值,并取平均值;
[0286]
其中,每个阳性对照稀释液的3次重复荧光pcr检测,获得3个ct值,取其平均值进行标准曲线绘制。
[0287]
6-3、以五个梯度阳性对照稀释液中病毒浓度的对数为横轴,其对应的ct值为纵轴,绘制标准曲线,标准曲线如式(1)所示:
[0288]
ct=k
ꢀ×ꢀ
log10(n) + b
ꢀꢀꢀꢀꢀꢀꢀ
(1)
[0289]
式(1)中:ct为阳性对照稀释液的荧光定量pcr的ct值;n为阳性对照稀释液中病毒浓度,copies/μl;log10(n)为阳性对照稀释液中病毒浓度的对数值;k和b是根据标准曲线求得的常数,k为标准曲线的斜率;b为标准曲线的截距;
[0290]
porv病毒的标准曲线:k=-3.2743,b=37.23;
[0291]
pcv病毒的标准曲线:k=-3.5240,b=35.93;
[0292]
ppv病毒的标准曲线:k=-3.2506,b=38.45。
[0293]
7、定量检测
[0294]
对步骤5)提取得到的水样病毒核酸提取液分别进行porv、pcv、ppv病毒进行荧光定量pcr检测,荧光定量pcr检测的反应体系、扩增反应程序与步骤6-2)中的病毒分别相对应,将测定的水样病毒核酸提取液的ct值分别代入对应的病毒标准曲线(1)中,分别计算得到待测样品中porv、pcv、ppv病毒的浓度(n);
[0295]
根据水样中病毒富集、释放、核酸提取和荧光pcr检测的体积变化,计算病毒拷贝数;步骤4)中病毒释放后的热促溶水样病毒释放液为1ml,取其中300μl样品进行核酸提取,根据磁珠法核酸提取试剂盒的说明,核酸提取后待测样品提取核酸后共有90μl,核酸提取过程中,初始体积为300μl+450μl=750μl,根据操作说明,后续取600μl进行核酸提取,根据这一提取过程中的体积变化,计算得到回收病毒拷贝数(m,copies),m=n
×
90
×
(1000/300)
×
(750/600);
[0296]
利用已知浓度的病毒及其ct值的结果,可以综合式(1),通过待测病毒的ct值计算待测样品中病毒的浓度,而后根据水样中病毒富集及病毒核酸提取过程中的水样的体积变化,计算得到水样富集后病毒的总拷贝数,根据荧光pcr测定得到的水样病毒核酸提取液的3个ct值,分别计算得到病毒的拷贝数,测定结果如表4。
[0297]
表4 三种病毒的荧光定量pcr测定结果
[0298][0299]
注:nd,未检出;porv,猪轮状病毒(porcine rotavirus);pcv,猪圆环病毒(porcine circovirus);ppv,猪细小病毒(porcine parvovirus)。
[0300]
本发明上述实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形
式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1