一种弯曲菌增菌培养液及其制备方法、应用与流程
1.本技术属于生物技术领域,尤其涉及一种弯曲菌增菌培养液及其制备方法、应用。
背景技术:
2.空肠弯曲菌和结肠弯曲菌是重要的食源性病原菌,在欧美等发达国家,空、结肠弯曲菌 的感染位居食源性病原菌感染的首位,也是导致食物中毒的重要病原。发展中国家,空、结 肠弯曲菌的感染通常是发达国家的100倍。
3.空、结肠弯曲菌感染导致的胃肠道疾病称为弯曲菌病。人弯曲菌病的主要 病原是空肠弯曲菌,占80%以上,结肠弯曲菌约占15%-20%,剩下的为空、结 肠弯曲菌以外的其它弯曲菌菌种。除胃肠炎外,空肠弯曲菌的感染可以导致格 林-巴利综合征(gbs)。针对空、结肠弯曲菌的检测和监测是防控感染和诊断 治疗的重点。细菌的分离培养是确定病原菌感染或则污染的金标准。
4.空、结肠弯曲菌属于革兰氏阴性菌,体外培养营养条件苛刻,属于苛养菌。目前空、结 肠弯曲菌分离培养的方法分为直接培养和增菌培养。由于体外生长条件苛刻,增菌培养是有 效的培养方法。目前常用的弯曲菌的增菌液主要有bolton增菌液和preston增菌液两大类。 这两类增菌液主要是在基础液体培养基(包括肉蛋白胨、白蛋白水解物、酵母提取物等)中 加入促生长的裂解的马血或者羊血和抗生素。两种增菌液的不同主要表现为抗生素种类的差 异:bolton增菌液的抗生素主要包括头孢哌酮钠、万古霉素、三甲氧苄氨嘧啶和两性霉素b 或者放线菌酮,4种;preston增菌液主要是将bolton增菌液中的两种抗生素头孢哌酮钠和万 古霉素更换为多粘菌素b和利福平。目前这两类增菌液都不能很好地促进弯曲菌的增殖同时 抑制弯曲菌外杂菌的生长。应用这两类增菌液增菌后,即使后期再使用选择性固体培养基的 培养,也很难从食品样品尤其是污染的禽肉、奶蛋以及腹泻患者中分离到弯曲菌。
技术实现要素:
5.本技术实施例的目的在于提供一种弯曲菌增菌培养液,旨在解决现有的增菌液存在不能 很好地促进弯曲菌的增殖同时抑制弯曲菌外杂菌的生长,检出的灵敏度和特异度较低的问题。
6.本技术实施例是这样实现的,一种弯曲菌增菌培养液,包括以下重量份数的原料:
7.脑浸液10-15份、牛脑心提取物6-7份、示蛋白胨8-12份、葡萄糖1-3份、金属盐6.5-12.5 份、血50份、烟酸0.001-0.002份、去氧胆酸钠0.5-1.5份、吐温0.0001-0.0005份以及抗生素 0.05-0.1份。
8.本技术实施例的另一目的在于一种弯曲菌增菌培养液的制备方法,包括:
9.按照所述的弯曲菌增菌培养液的配方称取各原料,备用;
10.将脑浸液、牛脑心提取物、示蛋白胨、葡萄糖、金属盐、烟酸、去氧胆酸钠以及吐温溶 于去离子水中,经高压处理后,得混合液体;
11.在所述混合物中加入血以及抗生素进行均匀混合,制成弯曲菌增菌培养液。
12.本技术实施例的另一目的在于一种所述的弯曲菌增菌培养液在弯曲菌检测中的应用。
13.本技术实施例提供的弯曲菌增菌培养液,通过科学优化培养液组成成分,得以显著提高 微需氧的弯曲菌的生长速度,在有弯曲菌和杂菌同时污染的样本的检测中,能够获得弯曲菌 的培养和单菌落;本技术提高了弯曲菌嗜营养的“活菌”的运动能力,大大提高了样本中空、 结肠弯曲菌的检出限,由原来的10
4-107cfu,到100cfu;同时,使用过程中仅需少量的增 菌培养液,用量远远少于现有增菌液。
附图说明
14.图1是本技术实施例提供的icdc-campy增菌液基础组合与bolton增菌液基础组合中 弯曲菌的生长差异曲线图;
15.图2是本技术实施例提供的增菌液不同组分对于弯曲菌的生长影响柱状图;
16.图3是本技术实施例提供的不同时间icdc-campy增菌液组合弯曲菌增殖特征曲线图;
17.图4是本技术实施例提供的弯曲菌(左)及杂菌(右)活菌打点计数示意图;
18.图5是本技术实施例提供的污染的禽肉样品bolton(preston)增菌液培养结果示意图;
19.图6是本技术实施例提供的污染的禽肉样品icdc-campy增菌培养结果示意图;
20.图7是本技术实施例提供的污染的牛奶样品bolton(preston)增菌液培养结果示意图;
21.图8是本技术实施例提供的污染的牛奶样品icdc-campy增菌培养结果示意图;
22.图9是本技术实施例提供的污染的蛋清bolton(preston)增菌液培养结果示意图;
23.图10是本技术实施例提供的污染的蛋清样品icdc-campy增菌培养结果示意图。
具体实施方式
24.为了使本技术的目的、技术方案及优点更加清楚明白,以下结合实施例,对本技术进行 进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本技术,并不用于限定 本技术。
25.目前已有的bolton和preston两类增菌液需要增菌后与同样含有选择性抗生素的固体培 养基结合使用,可以部分地分离到弯曲菌,但是检出的灵敏度和特异度显著低于本技术实施 例提供的弯曲菌增菌培养液。尤其是对于样品(或者标本)中杂菌的污染较高时,增菌液的 培养基营养成分不足以促进弯曲菌的生长,由于弯曲菌生长缓慢,杂菌增长快、抑制剂不能 很好抑制杂菌,导致培养检出率低或者不能检出弯曲菌。应用上述方法,我国弯曲菌的食品 安全的监测以及感染性腹泻的病原监测中,大部分地区食品样品以及腹泻患者的标本中检测 不到弯曲菌。
26.鉴于上述现状,本技术实施例提供了一种新的高效率的空、结肠弯曲菌增菌液以及增菌 培养方法,显著提高我国样品及标本中弯曲菌的检出率。
27.具体地,本技术实施例提供了一种弯曲菌增菌培养液(命名为icdc-campy),包括
以 下重量份数的原料:
28.脑浸液10-15份、牛脑心提取物6-7份、示蛋白胨8-12份、葡萄糖1-3份、金属盐6.5-12.5 份、血50份、烟酸0.001-0.002份、去氧胆酸钠0.5-1.5份、吐温0.0001-0.0005份以及抗生素 0.05-0.1份。
29.本技术icdc-campy优化了现有增菌液的组成,修改了基础培养基的组分,将通用的 以bloton增菌液为基础的基础培养基中肉蛋白胨、白蛋白及络蛋白的水解物和酵母提取物等 氮源和碳源去除,换成对于苛养菌有促进作用的固体牛脑心提取物、示蛋白胨、葡萄糖和烟 酸的配合,显著提高微需氧的弯曲菌的生长速度,在有弯曲菌和杂菌同时污染的样本的检测 中,能够获得弯曲菌的培养和单菌落。
30.经本技术研究确定上述原料的最少含量,如脑浸液不得少于10份、牛脑心提取物不得少 于6份、示蛋白胨不得少于8份、葡萄糖不得少于1份、金属盐不得少于6.5份、血不得少 于50份、烟酸不得少于0.001份、去氧胆酸钠不得少于0.5份、吐温不得少于0.0001份以及 抗生素不得少于0.05份;任一原料含量低于上述最低标准,均将导致检测的灵敏度或者检出 限降低。另外,本领域技术人员应当明了,得同等结果的时候,使用最小的或者合适的量是 适用的,在该含量范围内适量增加而获得相同技术效果的方案理应落入本技术保护范围内。
31.另外,本技术icdc-campy通过增加培养抑制剂和表面活性剂(去氧胆酸钠和吐温) 的使用,促进弯曲菌的生长同时抑制其它杂菌的污染,同时增菌液在静置的条件下与振动增 菌的效果没有显著差异。
32.在本技术实施例中,所述金属盐包括以下重量份数的原料:
33.氯化钠4-6份、磷酸氢二钠2-5份、丙酮酸钠0.25-0.5份、焦亚硫酸钠0.25-0.5份、硫酸 亚铁0.15-0.3份。
34.本技术icdc-campy相对于常用的增菌液增加了丙酮酸钠、焦亚硫酸钠和硫酸亚铁的 应用浓度,显著促进弯曲菌的生长同时抑制其它杂菌的生长;其中,磷酸氢二钠浓度升高到 2-5g/l,丙酮酸钠、焦亚硫酸钠浓度由原来的0.25g/l升高到0.5-0.75g/l,硫酸亚铁的浓度升 高到0.15-0.3g/l;另外,当磷酸氢二钠浓度调整为3.5g/l、丙酮酸钠、焦亚硫酸钠浓度调整 为0.625g/l、硫酸亚铁的浓度调整为0.225g/l、磷酸氢二钠的浓度调整为3.5g/l对应促进弯 曲菌的生长同时抑制其它杂菌的生长效果最佳。
35.在本技术实施例中,所述血为去纤维羊血、兔血、胎牛血清中的一种。
36.在本技术实施例中,所述抗生素包括以下重量份数的原料:
37.万古霉素0.01-0.02份、两性霉素b 0.01-0.015份,利福平0.01-0.012份、三甲氧苄氨嘧 啶(tmp)0.01-0.015份以及头孢哌酮钠0.02-0.032份。
38.针对中国样品的污染特征,经本技术验证获得应用浓度较小的万古霉素、两性霉素b、 利福平、tmp和头孢哌酮钠五种抗生素的组合能够发挥杂菌抑制作用,在提高弯曲菌生长速 度的基础上,提高弯曲菌增菌培养液的选择性和特异性。
39.本技术实施例还提供了一种弯曲菌增菌培养液的制备方法,包括以下步骤:
40.步骤s1:按照上述的弯曲菌增菌培养液的配方称取各原料,备用。
41.步骤s2:将脑浸液、牛脑心提取物、示蛋白胨、葡萄糖、金属盐、烟酸、去氧胆酸钠以 及吐温溶于去离子水中,经高压处理后,得混合液体。
42.可选地,所述步骤s2,包括:
43.将脑浸液、牛脑心提取物、示蛋白胨、葡萄糖、金属盐、烟酸、去氧胆酸钠以及吐温溶 于1000份的去离子水中,121℃高压15min,得混合液体。
44.步骤s3:在所述混合物中加入血以及抗生素进行均匀混合,制成弯曲菌增菌培养液。
45.可选地,所述步骤s3,包括:
46.待混合液体冷却至45-55℃时,加入血以及抗生素进行均匀混合,制成弯曲菌增菌培养液。
47.本技术实施例还提供了一种上述的弯曲菌增菌培养液在弯曲菌检测中的应用。
48.值得注意的是,应用上述本技术icdc-camp增菌液,每份样本仅需要4ml增菌液进行 增菌就能获得良好的培养结果(具体见以下针对样本的实施例研究),但按照之前国标以及 其它通用的方法,对于25g禽肉需要的bolton或者preston增菌液至少225ml,且结果较差。 本技术的弯曲菌增菌培养液的组合,在禽肉中的检出限为100cfu,样本中有极低量的弯曲菌 的污染都能检测到;另外,在污染的奶,蛋中的检出限都低于101cfu,而其它增菌液的检 出限大于104cfu甚至需要107cfu才能检测到。
49.以下给出本技术某些实施方式的实施例,其目的不在于对本技术的范围进行限定。
50.另外,需要说明的是,以下实施例中所给出的数值是尽可能精确,但是本领域技术人员 理解由于不可能避免的测量误差和实验操作问题,每一个数字都应该被理解为约数,而不是 绝对准确的数值。
51.实施例1(与传统弯曲菌增菌液相比,icdc-campy增菌液的基础培养组分的改变对于 弯曲菌生长作用差异分析)
52.icdc-campy增菌液基础组合:固体脑浸液12.5份、牛脑心提取物6.5份、示蛋白胨 10份、葡萄糖2份、烟酸0.001份。
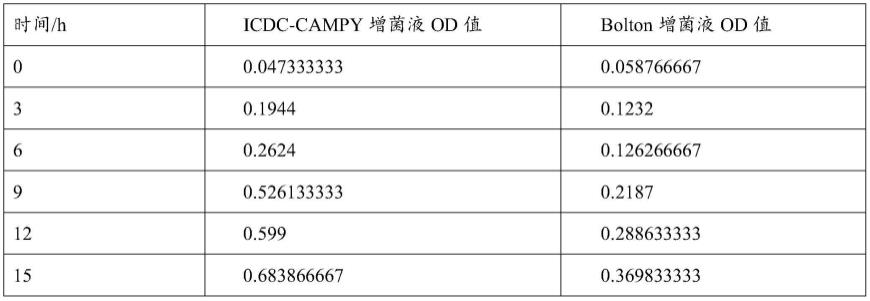
53.bolton增菌液基础组合:肉蛋白胨10份、络蛋白水解物5份、酵母提取物5份。
54.生长曲线测定:
55.(1)将弯曲菌标准菌株nctc11168于karmali培养基进行传代,37℃,微需氧培养24h;
56.(2)收集生长旺盛的细菌,将细菌重悬于5ml生理盐水,调菌液od
600
为1.0;
57.(3)分别使用icdc-campy增菌液、bolton增菌液培养基将菌液稀释20倍,od
600
为 0.05进行180rpm/min微需氧,摇菌培养;
58.(4)每隔3h测一次菌液od(每个时间点取3次样品的平均值),并设纯icdc-campy 增菌液、bolton增菌液为阴性对照。
59.icdc-campy增菌液和bolton增菌液两种增菌液基础组合对于弯曲菌生长od值差异 影响结果见表1以及图1所示。
60.表1.不同增菌液基础于弯曲菌生长od值差异
于样品检测时杂菌的污染的选择性),其它组分可显著促进弯曲菌的生长。
71.实施例3(icdc-campy增菌液中优化的盐离子与生长因子协同增殖作用分析)
72.在实施例2的基础上,针对icdc-campy中优化的盐离子浓度与生长因子添加,进行 协同作用分析如下:
73.(1)将弯曲菌标准菌株atcc33560在karmali固体培养基上培养16-20h,收集对数生 长期的菌株于生理盐水中,反复冲洗菌株;
74.(2)使用生理盐水稀释菌株,调整菌液使菌液浓度达到od
600
=1;
75.(3)将od
600
=1的菌液应用生理盐水进行50倍稀释,将稀释后的菌液分别加到以下不 同组分的icdc-campy增菌液中,顺序如下:
[0076] 不同的icdc-campy增菌液组分a1基础培养基组分+培养抑制剂和表面活性剂a2基础培养基组分+培养抑制剂和表面活性剂+优化的盐离子a3基础培养基组分+培养抑制剂和表面活性剂+促生长因子a4基础培养基组分+培养抑制剂和表面活性剂+优化的盐离子+促生长因子
[0077]
其中,培养抑制剂为去氧胆酸钠1份;表面活性剂为吐温80 0.2ml;优化金属盐浓度为 氯化钠4g/l、磷酸氢二钠2g/l、丙酮酸钠0.5g/l、焦亚硫酸钠0.5g/l、硫酸亚铁0.25g/l, 未优化金属盐浓度为氯化钠4g/l、丙酮酸钠0.25g/l、焦亚硫酸钠0.25g/l;促生长因子为去 纤维兔血50份、烟酸0.001份。
[0078]
(4)将不同组合的培养菌液放置42℃微需氧环境下培养30h,每隔3h测一次od
600
值, 以确定菌株增殖特征,每个组合样本重复三次取均值。
[0079]
不同时间点不同组合增菌液菌株的增殖结果见表3以及图3所示。
[0080]
表3.不同时间点不同组合增菌液菌株的增殖结果(平均od值)
[0081] a1a2a3a43h0.05720.05460.04660.08516h0.1570.17240.19870.30159h0.31140.39410.43440.609412h0.55990.6790.68570.877315h0.81930.96710.93411.102418h1.02741.11561.13361.244421h1.2121.25291.29941.364424h1.33311.40411.44771.535427h1.46151.43341.38611.2955
[0082]
由表3以及图3可知,icdc-campy增菌液的基础培养基组分+培养抑制剂和表面活性 剂+优化的盐离子+促生长因子(a4)可显著促进弯曲菌的增殖。
[0083]
实施例4-6(不同污染样本icdc-campy增菌液培养与通用的bolton(preston)增菌液培 养的差异验证)
[0084]
由于食品样品的复杂性,食品样品中进行弯曲菌的分离培养比较困难。本技术从最容易 污染的零售鸡肉样品以及国际上可导致暴发的污染的奶、蛋等3种重要的食品样品,首先进 行样品本底无弯曲菌污染的确定后,进行样品目的菌种和其它杂菌的模拟污染
样品的制备(杂 菌污染浓度为目的菌种的10倍),对污染的样本,通过应用bolton、preston两类增菌液和 icdc-campy增菌液组合同时进行检测的实施例验证。具体步骤如下:
[0085]
1.模拟污染菌株的准备:
[0086]
(1)目标菌株为空肠弯曲菌和结肠弯曲菌,验证菌株信息见表4:
[0087]
表4.验证目的菌株的背景信息
[0088]
序号菌种菌株编号菌株来源1空肠弯曲菌sz112鸡肉2空肠弯曲菌sz113鸭肉3空肠弯曲菌sz114鸡肉4空肠弯曲菌sz115鸭肉5空肠弯曲菌sz116鸡肉6结肠弯曲菌atcc33559标准菌株7空肠弯曲菌atcc33560标准菌株8空肠弯曲菌atcc700297标准菌株9空肠弯曲菌sz-c064鸡肛拭10空肠弯曲菌sz-c065鸡肛拭11空肠弯曲菌sz-c066牛粪12空肠弯曲菌bdyy-07267病人13空肠弯曲菌bdyy-07270病人14结肠弯曲菌sh15ce11鸡粪便15结肠弯曲菌sh15ce12鸡粪便16结肠弯曲菌sh15ce13鸡粪便17结肠弯曲菌sh-ccd11c353腹泻病人18结肠弯曲菌sh-ccd11c361腹泻病人19结肠弯曲菌sh-ccd11c377腹泻病人20结肠弯曲菌szc102鸡肝
[0089]
(2)杂菌菌种主要包括变形杆菌、沙门氏菌、弧菌、大肠杆菌、弓形杆菌等,菌株信息 见表5:
[0090]
表5.验证杂菌菌株的背景信息
[0091]
[0092][0093]
实施例4:生禽肉污染样品弯曲菌培养检测验证
[0094]
(1)icdc-campy增菌液的制备:称取固体脑浸液10份、牛脑心提取物6份、示蛋白 胨12份、葡萄糖3份组成的氮源和碳源;氯化钠4份、磷酸氢二钠3份、丙酮酸钠0.25份、 焦亚硫酸钠0.25份、硫酸亚铁0.25份;烟酸0.001份;去氧胆酸钠0.5份和吐温80 0.1ml; 上述组分溶于1l无菌去离子水中,121℃高压15分钟后,冷却到50℃左右,加入50份无菌 去纤维绵羊血,同时加入万古霉素20mg、两性霉素b15mg,利福平10mg、三甲氧苄氨嘧啶 10mg、头孢哌酮钠增加为20mg,配置成icdc-campy增菌液,将上述增菌液充分混匀后 以4ml/管分装,4℃冷藏避光保存。
[0095]
(2)模拟生禽肉样本的制备:分别复苏培养目标菌株和杂菌(杂菌以不同菌种1:1等量 混匀成菌液池),收集生长旺盛的菌株于生理盐水中,调整弯曲菌菌液浓度为1.0麦氏浊度, 10倍稀释后取10ul打点计数(从1:10开始打点)(图4.左),确定1.0麦氏浊度弯曲菌菌液 浓度为:2*108cfu/ml,将原弯曲菌菌液进行10倍稀释,稀释后浓度为:2*105,2*104,2*103, 2*102,2*101、2*100cfu/ml共6个污染浓度梯度;调整杂菌菌液池浓度为2.5麦氏浊度, 10倍稀释后取10ul打点计数(图4.右),确定2.5麦氏浊度杂菌菌液浓度为1*109cfu/ml, 将上述杂菌菌液进行10倍稀释,稀释后浓度为:1*106,1*105,1*104,1*103,1*102, 1*101cfu/ml,6个污染浓度梯度。
[0096]
(3)不同增菌液增菌培养对模拟生禽肉样品空、结肠弯曲菌的培养验证:
[0097]
1)bolton(preston)增菌:按照国标的方法直接进行bolton(preston)增菌液微需氧增 菌培养:分别称取25g克鸡肉放入带有滤膜的均质袋中,在质袋中分别加入225ml的bolton 增菌液和225ml的preston(preston)增菌液,充分盥洗;分别在盥洗液中加入不同浓度的弯 曲菌菌液和杂菌菌液(保持杂菌菌液与目标菌弯曲菌菌液浓度一致或者是目标菌液浓度的10 倍),充分混匀;
[0098]
2)icdc-campy增菌:在质袋中加入100ml的蛋白胨水盥洗液充分盥洗、加入污染的 弯曲菌和杂菌后充分混匀,对蛋盥洗液进行2000g离心,富集沉淀。取0.4ml的沉淀悬浮液 加到4ml的icdc-campy增菌液中,与bolton增菌液和的preston增菌液一起进行微需氧 增菌培养;
[0099]
3)bolton(preston)增菌液培养结果(图5,1-6分别对应6个弯曲菌及杂菌的污染浓度 中bolton(preston)增菌液结果):挑取2*106浓度,skirrow平板(24h,1:50)上3个疑
似 单克隆,后经过镜检鉴定,确定1个阳性单克隆。确定bolton增菌液和preston增菌液对于 污染的生禽肉样品最低检出限的浓度为105cfu/25g。但目的菌的菌落与杂菌菌落形态相似, 需要有经验的操作者才能完成。
[0100]
4)icdc-campy增菌后过滤培养的结果(图6,1-6分别为6个模拟的弯曲菌及杂菌污 染浓度样品的增菌培养结果):从最低污染浓度挑取菌落,进行弯曲菌的鉴定,菌落鉴定皆 为弯曲菌,确定浓度为2*100cfu/25g是icdc-campy增菌培养的最小检测浓度(即本次实 验的检出限)。不同增菌液的增菌培养比较结果确定,对于污染的生禽肉,icdc-campy为 高效的弯曲菌增菌液。
[0101]
综上,经本实施例验证确定,对于污染的生禽肉,icdc-campy增菌液的最小检出浓度 为2*100cfu/25g。
[0102]
实施例5:牛奶污染样品弯曲菌培养检测验证
[0103]
(1)icdc-campy增菌液的制备:称取固体脑浸液12份、牛脑心提取物6.5份、示 蛋白胨10份、葡萄糖2份组成的氮源和碳源;氯化钠4份、磷酸氢二钠2份、丙酮酸钠0.5 份、焦亚硫酸钠0.5份、硫酸亚铁0.25份;烟酸0.001份;去氧胆酸钠0.5份和吐温80为0.2ml; 上述成分溶于1l无菌去离子水中,121℃高压15分钟后,冷却到50℃左右,加入50份无菌 去纤维兔血,同时加入万古霉素15mg、两性霉素b15mg,利福平10mg、三甲氧苄氨嘧啶 10mg、头孢哌酮钠增加为25mg,配置成icdc-campy增菌液,将上述增菌液充分混匀后以 4ml/管分装,4℃冷藏避光保存。
[0104]
(2)模拟污染样品的制备:
[0105]
弯曲菌与杂菌活菌的制备方法与上述一致,50ml牛奶中弯曲菌和杂菌的污染浓度依次 为:3*104cfu、3*103cfu、3*102cfu、3*101cfu、3*100cfu、3*10-1
cfu;杂菌:3*105cfu、 3*104cfu、3*103cfu、3*102cfu、3*101cfu、3*100cfu。分别为6个浓度。
[0106]
(3)不同增菌液的培养:
[0107]
1)分别取50ml液体牛奶,每份样品分别加入上述制备的弯曲菌和杂菌菌液菌液,充分 混匀;
[0108]
2)bolton(preston)增菌:按照国标方法,20000g离心上述污染的样品30min后弃去 上清,分别用10ml bolton(preston)增菌液悬浮沉淀(尽量避免带入油层),再转移至装有 90ml的bolton(preston)增菌液中,进行微需氧培养;
[0109]
3)icdc-campy增菌:另用1ml生理盐水悬浮,取400ul加入盛有4ml的 icdc-campy增菌液的螺口管中微需氧增菌培养;
[0110]
4)bolton(preston)增菌后结果如图7,从1-6分别为6个污染浓度,挑取平皿菌落, 鉴定后没有发现弯曲菌,因此判定应用bolton(preston)增菌培养污染牛奶中弯曲菌,检出 限大于3*104cfu/50ml。
[0111]
5)icdc-campy的增菌培养结果见图8,从1-6分别为6个污染浓度,挑取平皿菌落, 鉴定发现最低浓度平皿上单菌落为弯曲菌(第4个浓度),确定浓度为3*101cfu/50ml是污 染的牛奶样品,icdc-campy增菌培养的最小检测浓度(即本次实验的检出限)。
[0112]
实施例6:蛋清污染样品弯曲菌的培养检测验证
[0113]
(1)icdc-campy增菌液的制备:称取固体脑浸液13份、牛脑心提取物6份、示蛋 白胨10份、葡萄糖2份组成的氮源和碳源;氯化钠4份、磷酸氢二钠2.5份、丙酮酸钠0.3 份、焦
亚硫酸钠0.3份、硫酸亚铁0.25份;烟酸0.001份;去氧胆酸钠1.0份和吐温80为0.1ml; 上述成分溶于1l无菌去离子水中,121℃高压15分钟后,冷却到50℃左右,加入50份无菌 胎牛血清,同时加入万古霉素20mg、两性霉素b15mg,利福平10mg、三甲氧苄氨嘧啶20mg、 头孢哌酮钠增加为30mg,配置成icdc-campy增菌液,将上述增菌液充分混匀后以4ml/ 管分装,4℃冷藏避光保存。
[0114]
(2)蛋清污染样品制备:弯曲菌与杂菌活菌的制备方法与上述一致;取25ml蛋清样品 于125ml bolton(preston)增菌液中(1:6稀释),分别加入稀释好的弯曲菌以及杂菌菌液, 制成弯曲菌1.5*107cfu、1.5*106cfu、1.5*105cfu、1.5*104cfu、1.5*103cfu、1.5*102cfu6 个稀释度以及1.5*108cfu、1.5*107cfu、1.5*106cfu、1.5*105cfu、1.5*104cfu、1.5*103cfu 杂菌6个稀释度的混合液。
[0115]
(3)不同增菌液对污染样品的培养:
[0116]
1)bolton(preston)增菌:加入到bolton(preston)的增菌液混匀后,转移25ml于100ml bolton(preston)增菌液中并混匀,将增菌后bolton肉汤进行微需氧增菌培养;
[0117]
2)icdc-campy增菌:取25ml蛋清于75ml的0.1%的无菌蛋白胨水盥洗液中稀释混 匀,每份样品分别加入稀释好的弯曲菌菌液和杂菌菌液各6个稀释度;2000g 4℃离心污染 的蛋白胨水盥洗液15min后弃去上清,用1ml生理盐水悬浮沉淀,取0.4ml的沉淀悬浮液 到4ml的icdc-camp增菌液中微需氧增菌培养;
[0118]
3)bolton(preston)增菌后培养结果见图9,从1-6分别为6个污染浓度,挑取平皿菌落, 鉴定后没有发现弯曲菌,因此判定应用bolton(preston)增菌培养污染蛋清中弯曲菌,检出 限大于1.5*107cfu/25ml。
[0119]
4)icdc-campy增菌液增菌后培养结果见图10,从1-6分别为6个污染浓度,挑取平 皿菌落,鉴定发现最低浓度平皿上单菌落为弯曲菌,确定浓度为2*101cfu/25ml是污染蛋清 样品icdc-campy增菌培养的最小检测浓度(即本次实验的检出限)。
[0120]
综上所述,本技术实施例通过优化了增菌液的组成,修改了基础培养基的组分,将通用 的以bloton增菌液为基础的基础培养基中肉蛋白胨、白蛋白及络蛋白的水解物和酵母提取物 等氮源和碳源去除,换成对于苛养菌有促进作用的固体牛脑心提取物、示蛋白胨、葡萄糖和 烟酸,显著提高微需氧的弯曲菌的生长速度,在有弯曲菌和杂菌同时污染的样本的检测中, 能够获得弯曲菌的培养和单菌落。
[0121]
其次,本技术实施例通过增加表面活性剂去氧胆酸钠和吐温的使用,促进弯曲菌的生长 同时抑制其它杂菌,同时增菌液在静置的条件下与振动增菌的效果没有显著差异;以及通过 改变增菌液中金属离子的组分和浓度,增加了增菌液中丙酮酸钠、焦亚硫酸钠和硫酸亚铁的 使用并提高部分离子浓度,促进弯曲菌的生长。
[0122]
再者,本技术实施例提供的icdc-campy组分组合利于弯曲菌的增殖,提高了弯曲菌 嗜营养的“活菌”的运动能力,大大提高了样本中空、结肠弯曲菌的检出限,由原来的 104cfu-107cfu,到100cfu;另外,本技术实现在使用过程中降低了增菌液的使用:应用 蛋白胨水盥洗样品或者直接离心液体样本,富集后应用icdc-camp增菌液,在样本分离培 养中中仅需要少量的富集样本,按照国标的方法,对于25g禽肉需要的bolton或者preston 增菌液至少225ml,但只需要icdc-camp增菌液4ml。
[0123]
值得注意的是,当前只有分子检测的灵敏度可以与本技术增菌培养方法相比,但
是,由 于分子检测不能获得“活”菌,因此本技术增菌培养方法目前无其它能与其相同灵敏度、特 异度的方法可替代。
[0124]
以上所述实施例仅表达了本技术的几种实施方式,其描述较为具体和详细,但并不能因 此而理解为对本技术专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在 不脱离本技术构思的前提下,还可以做出若干变形和改进,这些都属于本技术的保护范围。 因此,本技术专利的保护范围应以所附权利要求为准。
[0125]
以上所述仅为本技术的较佳实施例而已,并不用以限制本技术,凡在本技术的精神和原 则之内所作的任何修改、等同替换和改进等,均应包含在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1