组氨酰-TRNA合成酶-FC缀合物的制作方法
组氨酰-trna合成酶-fc缀合物
1.相关申请的交叉引用
2.本技术是申请号为201480026024.2的分案申请,并且本技术基于35u.s.c.
§
119(e)要求于2013年3月15日递交的美国临时申请第61/789,011 号的优先权,其据此通过引用整体并入本文。
3.关于序列表的声明
4.与本技术相关的序列表以文本格式提供代替纸件副本,其通过引用 并入本说明书中。含有该序列表的文本文件的名称为 atyr_116_01wo_st25.txt。该文本文件大小为约399kb,创建于2014 年3月14日,其通过efs-web电子递交。
5.发明背景
技术领域
6.本发明一般地涉及一个或多个组氨酰-trna合成酶(hrs)多肽和免 疫球蛋白fc区的缀合物如融合多肽、包含它们的组合物,以及使用该多 肽和组合物治疗或诊断多种病症的方法。
7.相关领域的描述
8.physiocrine通常为在高等生物的氨酰-trna合成酶(aars)基因家族 中发现的小的、天然存在的蛋白质结构域,其对氨酰-trna合成酶在蛋白 质合成中已确立的作用不是必需的。在发现physiocrine范例以前,仅已知 氨酰-trna合成酶(约20个酶的家族)在所有活细胞中普遍表达,以及其在 蛋白质合成过程中的必要作用。然而,最近的科学发现现在表明氨酰
ꢀ‑
trna合成酶具有除蛋白质合成之外的另外的作用,事实上,其在多细胞 生物中已进化为在组织生理学和疾病中起重要的稳态作用。
9.aars存在非经典功能的证据包括在从简单的单细胞生物进化至较 复杂的生命形式期间建立的明确的序列比较;在未丧失促进蛋白质合成 的能力的情况下,aars已通过添加附加结构域而进化成结构上较复杂 的。
10.与该假设一致的是,在高等真核生物中已发现aars的一系列丰富和 多样化的扩展功能,特别是对于人trna合成酶。基于单独结构域的直接 分析以及trna合成酶基因突变发现的该数据表明这些新的附加结构域 或physiocrine对于aars新获得的非经典功能极为重要,所述基因突变与 疾病有因果联系,但不影响氨酰化或蛋白质合成活性。
11.另外,对以下存在渐增的认可:特异性trna合成酶,如组氨酰-trna合成酶(hrs)能够由活细胞释放或分泌且能够为免疫调节、趋化性和血管 生成特性提供重要的局部作用信号。已经通过以下获得aars作为细胞外 信号传导分子的作用的直接确认:显示特异性trna合成酶的分泌和细胞 外释放的研究,以及添加包含新的附加结构域(physiocrine)的trna合成酶 的片段但不添加没有这些结构域的其他片段在一系列细胞外信号传导通 路中是活跃的直接证明。诸如hrs的这些physiocrine代表开发新的首创治 疗蛋白质以治疗人类疾病的新的且先前未开发的机遇。
12.为了最好地开发治疗或诊断环境中的这些和其他活性,本领域需要 具有改善的
药代动力学特性的hrs多肽。这些改善的hrs多肽治疗形式 使得能够开发出治疗多种疾病和病症的更有效的治疗方案,并比未修饰 蛋白需要明显更少的给药频率。
附图说明
13.图1显示了示例性免疫球蛋白的结构组成,并提供了抗体类型和亚 类的概述。
14.图2显示了来自人iga1(seq id no:156)、iga2(seq id no:157)、igm(seq id no:158)、igg1(seq id no:159)、igg2(seq id no:160)、 igg3(seq id no:161)、igg4(seq id no:162)和ige(seq id no:163) 的fc区的比对。序列上方显示了fcα的二级结构。脱字符(^)和星号(*) 显示了分别占结合表面的0-4%和5-12%的残基。
15.图3显示了在全长hrs和hrs(1-506)的还原性和非还原性条件下 sds-page分析的结果。结果显示与全长蛋白质相比,hrs(1-506)显著降 低二硫化物介导的链间键形成的形成。使用mops-sds电泳缓冲液,将 样品(10μg)上样至4-12%bis-tris凝胶中。
16.图4显示了在tnbs-诱导的小鼠结肠炎模型中示例性hrs-衍生的多 肽的抗炎性质。在雄性bdf-1小鼠中进行研究,每组12只小鼠。将tnbs 和布地奈德以5mg/kg加入至水中。在tnbs处理之前3天开始以1mg/kg 或5mg/kg的浓度通过iv注射每天施用hrs(1-60)(resokine,(hisrs
n4
))。 该图显示了经约80小时治疗的小鼠和未治疗的小鼠的存活百分比(%)。
17.图5a显示了在他汀类药物肌病模型中用于评价hrs(1-506)的治疗 效用的给药方案。治疗给药组包括媒介物(n=11),0.3mpk hrs(1-506) (n=8),1.0mpk hrs(1-506)(n=8),3.0mpk hrs(1-506)(n=8);图5b显示 了在用他汀类药物+/-0.3mg/kg、1.0mg/kg和3.0mg/kg hrs(1-506)治 疗15天之后肌钙蛋白c测量的结果。该图显示了hrs(1-506)在降低他汀 类药物肌钙蛋白c诱导中的积极效果。
18.图6a显示了在用他汀类药物+/-0.3mg/kg、1.0mg/kg和3.0mg/kghrs(1-506)治疗12天之后ck测量的结果;图6b显示了在治疗15天之 后的相同数据。该图显示了hrs(1-506)在降低他汀类药物诱导的ck水 平中的积极效果。
19.图7显示了与媒介物对照相比,在用他汀类药物治疗15天之后循环 的hars水平。该图显示了他汀类药物诱导细胞外hars的释放。
20.图8显示了在用他汀类药物+/-0.3mg/kg、1.0mg/kg和3.0mg/kghrs(1-506)治疗15天之后在10x放大率下腘绳肌(hamstring)切片的代表 性h&e图像。
21.图9显示了他汀类药物治疗的大鼠腘绳肌的基因表达分析的结果。 该数据描述了被选择跟踪以下标志物的137个基因的表达的变化:肌肉 和免疫细胞功能、炎症、代谢状态、组织修复、肌肉生长和萎缩。将基 因表达值对于参照基因标准化并表示为相对于媒介物治疗组的倍数变 化。
22.图10a显示了他汀类药物治疗的大鼠腘绳肌的基因表达分析的结 果。该数据描述了比较他汀类药物治疗的动物相对于媒介物治疗的动物 基因表达相对变化的137个基因(如在图7中)表达的变化。图10b显示了 与单独用他汀类药物治疗的动物相比,也用hrs(1-506)治疗的他汀类药 物治疗的动物的基因表达的相对变化。
23.图11显示了在用他汀类药物+/-0.3mg/kg、1.0mg/kg和3.0mg/kghrs(1-506)治疗15天之后,10种糖尿病/代谢综合征相关的基因在他汀 类药物治疗的大鼠腘绳肌中的基因
表达分析结果。
24.图12显示了在用他汀类药物+/-0.3mg/kg、1.0mg/kg和3.0mg/kghrs(1-506)治疗15天之后,26种免疫细胞标志物基因在他汀类药物治疗 的大鼠腘绳肌中的基因表达分析结果。
25.图13a-d显示了在用他汀类药物+/-0.3mg/kg、1.0mg/kg和3.0 mg/kg hrs(1-506)治疗15天之后,cd11a、cd11b、cd8a和cd8b基因 在他汀类药物治疗的大鼠腘绳肌中的基因表达分析结果。
26.图14a-c显示了在用他汀类药物+/-0.3mg/kg、1.0mg/kg和3.0 mg/kg hrs(1-506)治疗15天之后,cd18、ccr5和cd45r基因在他汀 类药物治疗的大鼠腘绳肌中的基因表达分析结果。
27.图15显示了在用他汀类药物+/-0.3mg/kg、1.0mg/kg和3.0mg/kghrs(1-506)治疗15天之后,17种炎症标志物基因在他汀类药物治疗的大 鼠腘绳肌中的基因表达分析结果。
28.图16a-d显示了在用他汀类药物+/-0.3mg/kg、1.0mg/kg和3.0 mg/kg hrs(1-506)治疗15天之后,炎症细胞因子il-6、mcp1、il-10和 干扰素-γ(ifn-γ)在他汀类药物治疗的大鼠腘绳肌中的基因表达分析结 果。
29.图17显示了在用他汀类药物+/-0.3mg/kg、1.0mg/kg和3.0mg/kghrs(1-506)治疗15天之后,14种粘附、发育和纤维化相关的基因在他汀 类药物治疗的大鼠腘绳肌中的基因表达分析结果。
30.图18显示了在用他汀类药物+/-0.3mg/kg、1.0mg/kg和3.0mg/kghrs(1-506)治疗15天之后,14种肌肉消耗/萎缩(wasting/atrophy)相关的 基因在他汀类药物治疗的大鼠腘绳肌中的基因表达分析结果。
31.图19a显示了在用他汀类药物+/-0.3mg/kg、1.0mg/kg和3.0mg/kghrs(1-506)治疗15天之后,14种肌肉消耗/萎缩相关的基因在他汀类药 物治疗的大鼠腘绳肌中的基因表达分析结果。图19b显示了mmp-3的特 定变化,以及图19c显示了在相同条件下mmp-9基因表达的特定变化。
32.图20显示了在用他汀类药物+/-0.3mg/kg、1.0mg/kg和3.0mg/kghrs(1-506)治疗15天之后,29种肌细胞生成相关的基因在他汀类药物治 疗的大鼠腘绳肌中的基因表达分析结果。
33.图21显示了纯化的fc融合蛋白的sds-page分析结果。泳道1:参 见blue plus2蛋白梯带(life technologies)。泳道2和6:fc-hrs(2-60)批 次#472。泳道3和7:hrs(1-60)-fc批次#473。泳道4和8:fc-hrs(2-60) 批次#480。泳道5和9:hrs(1-60)-fc批次#482。在非还原性条件下运行 泳道2-5,并在还原性条件下运行泳道6-9。
34.图22显示了在蛋白a、阳离子交换和羟磷灰石色谱之后代表性纯化 的fc-hrs(2-60)融合物的分析性尺寸排阻hplc分析(重复注射的重叠)。 纯度为99.2%的主峰,和0.8%的高分子量(hmw)物质。
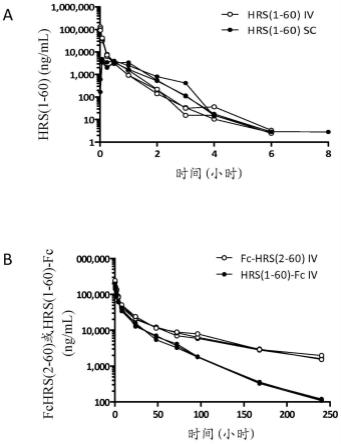
35.图23a显示了在静脉内或皮下注射小鼠之后时间相对于hrs(1-60) 的浓度。图23b显示了在静脉内注射小鼠之后时间相对于fc-hrs(2-60) 和hrs(1-60)-fc的浓度。图23c显示了在皮下注射小鼠之后时间相对于 fc-hrs(2-60)和hrs(1-60)-fc的浓度。
36.图24a显示了在终止时在用不同的hrs-fc融合蛋白治疗的小鼠中 疾病活动指数
(dai)分数。条形柱代表每个治疗组的平均dai(+sem)。 dai包含了出血和腹泻以及体重减轻分数相关的信息。图24b显示了在 终止时在用化合物治疗的小鼠中的大肠重量:长度比率。条形柱代表每 个治疗组的平均比率(+sem)。
37.图25显示了tnbs研究中转录变化的概观。显示了在相对于未处理 动物( animals)(第1组)标准化之后,tnbs处理的动物(第2组)、用 tnbs和布地奈德(第3组)、tnbs和测试物a(hrs(1-60);第4组)以及 tnbs和测试物b(fc-hrs(2-60);第5组和第6组)处理的动物中的相对 转录变化。散布图中的每个点表示测量的基因。在第2组中的7种基因 上调超过10倍(il6、il1b、mcp-1、mmp3、mmp9、cd11b和il10)。
38.图26a-26f和26h显示了tnbs上调的免疫和炎症相关的基因。显 示了在相对于未处理动物(第1组)标准化之后,tnbs处理的动物(第2 组)、用tnbs和布地奈德(第3组)、tnbs和测试物a(hrs(1-60);第4 组)以及tnbs和测试物b(fc-hrs(2-60);第5组和第6组)处理的动物的 单个基因的相对转录变化。散布图中的每个点表示组内每只动物的目标 基因的丰度。使用学生t检验计算显著性,其中*=p-值《0.05,**=p-值 《0.01。
39.图27a-27d显示了不同的t细胞群体在未处理小鼠或用tnbs结肠 内处理以诱导实验性结肠炎的小鼠、用tnbs+0.5mg/kg fc-hrs(2-60) 治疗的小鼠的脾中的相对百分比。显示了针对(27a)cd3、(27b)cd8、 (27c)cd4和(27d)cd25以及foxp3染色的活淋巴细胞的百分比。treg 细胞另外地以cd4
+
细胞设门。
40.发明概述
41.本发明的实施方案一般地涉及具有一个或多个与其共价结合的免疫 球蛋白fc区的组氨酰-trna合成酶(hrs)多肽缀合物、包含这类分子的 药物组合物、生产方法及其治疗应用方法。除其他优势外,相对于相应 的未修饰的hrs多肽,本发明的hrs-fc缀合物可具有改善的药代动力 学特性和/或改善的治疗相关的生物学活性。
42.因此,某些实施方案包括hrs融合多肽,其包含含有与seq idno:1-106、170-181或185-191中任一个或者与表d1、d3-d6或d8任一 个中的序列具有至少80%同一性的氨基酸序列的hrs多肽,以及至少一 个融合至所述hrs多肽的c-末端、n-末端或两端的fc区。在一些实施 方案中,所述hrs多肽包含以下、由以下组成或基本上由以下组成:与 seq id no:1-106、170-181或185-191中任一个或者与表d1、d3-d6或 d8任一中的序列至少90%同一的氨基酸序列。在具体实施方案中,所述 hrs多肽包含以下、由以下组成或基本上由以下组成:seq id no:1-106、 170-181或185-191中任一个的氨基酸序列或表d1、d3-d6或d8任一中 的序列。
43.在具体实施方案中,hrs多肽包含seq id no:1的氨基酸残基2-40、 2-45、2-50、2-55、2-60、2-66或1-506,或者包含与seq id no:1的残 基2-40、2-45、2-50、2-55、2-60、2-66或1-506具有至少90%同一性的 氨基酸序列。在一些实施方案中,所述hrs多肽在长度上至多约40-80 个氨基酸且包含seq id no:1的残基2-45。在特定实施方案中,所述hrs 多肽由或基本上由seq id no:1的氨基酸残基2-40、2-45、2-50、2-55、 2-60、2-66或1-506组成。
44.在一些实施方案中,hrs多肽的至少一个内源性半胱氨酸残基已被 另一氨基酸取代或缺失。在某些实施方案中,所述至少一个内源性半胱 氨酸残基选自cys174、cys191、cys224、cys235、cys507和cys509。 在具体实施方案中,所述至少一个内源性半胱氨酸残基选自cys224、 cys235、cys507和cys509。在特定实施方案中,所述内源性半胱氨酸残 基为
no:385)、或hrs(1-66)-fc(seq id no:390)、或fc-hrs(2-60) hrs(2-60)(seq id no:396)具有至少90%同一性的氨基酸序列。
52.在某些情况下,相对于相应的hrs多肽,hrs融合多肽具有改变的 药代动力学。所述改变的药代动力学的实例包括增加的血清半衰期、增 加的生物利用度、增加的暴露和/或降低的清除率。在某些情况下,暴露 增加至少100倍。在一些情况下,hrs融合多肽在小鼠中具有至少30小 时的半衰期。在某些情况下,所述生物利用度为增加至少约30%的皮下 生物利用度。在一些情况下,相对于相应的hrs多肽,所述hrs融合 多肽具有改变的免疫效应器活性。这类免疫效应器活性的实例包括以下 一种或多种:补体活化、补体依赖性细胞毒作用(cdc)、抗体依赖性细胞 介导的细胞毒作用(adcc)或抗体依赖性细胞介导的吞噬作用(adcp)。
53.在某些实施方案中,相对于野生型fc区,所述fc区包含变异的fc 区。在一些实施方案中,所述变异的fc区包含与seq id no:128-163或 341中任一序列或所述序列的组合具有至少90%同一性的序列。在某些实 施方案中,所述变异的fc区包含来自不同物种、不同ig类型或不同ig 亚类的一个或多个fc区的杂合体。在具体实施方案中,所述变异的fc 区包含来自不同物种、不同ig类型和/或不同ig亚类的fc区的一个或多 个铰链、ch2、ch3和/或ch4结构域的杂合体。
54.在某些实施方案中,相对于相应的野生型fc区,变异的fc区为修 饰的糖型。在具体实施方案中,相对于相应的野生型fc区,变异的fc 区具有改变的药代动力学。这类改变的药代动力学的实例包括血清半衰 期、生物利用度和/或清除率。在一些实施方案中,相对于相应的野生型 fc区,所述变异的fc区具有改变的效应器活性。这类效应器活性的实例 包括以下一种或多种:补体活化、补体依赖性细胞毒作用(cdc)、抗体依 赖性细胞介导的细胞毒作用(adcc)或抗体依赖性细胞介导的吞噬作用 (adcp)。
55.在某些实施方案中,相对于相应的野生型fc区,变异的fc区具有 对一种或多种fcγ受体的改变的结合。示例性fcγ受体描述于本文中且 为本领域已知。
56.在某些实施方案中,相对于相应的野生型fc区,所述变异的fc区 具有对一种或多种fcrn受体的改变的结合。示例性fcrn受体描述于本 文中且为本领域已知的。
57.在一些实施方案中,相对于相应的野生型fc区,所述变异的fc区 具有改变的(例如,增加的)溶解度;且相对于相应的未修饰hrs多肽, hrs-fc融合多肽具有改变的溶解度。
58.在特定实施方案中,hrs-fc融合多肽在生理溶液中或在其他生理条 件如体内条件下基本上为二聚体形式。在特定实施方案中,如通过uv 圆二色谱分析所测定的,所述hrs-fc融合多肽具有与相应未修饰的或不 同修饰的hrs多肽基本上相同的二级结构。
59.在一些实施方案中,当施用于哺乳动物时,所述hrs-fc融合多肽具 有的血浆或血清药代动力学auc谱比相应的未修饰hrs多肽大至少5 倍。
60.在某些实施方案中,在抗炎活性分析中,所述hrs-fc融合多肽具有 与相应未修饰的或不同修饰的hrs多肽基本上相同的活性。
61.在某些实施方案中,在抗炎活性分析中,所述hrs-fc融合多肽具有 的活性比相应未修饰的或不同修饰的hrs多肽的活性大2倍。
62.在某些实施方案中,当在室温类似条件下,在ph 7.4的pbs中进行 7天的比较时,所述hrs-fc融合多肽具有比相应未修饰的或不同修饰的 hrs多肽大至少30%的稳定性。
63.hrs-fc融合多肽的具体实例可以包含seq id no:107-110或 337-338或349-350或381-390或396中的至少一者,或与seq idno:107-110或337-338或349-350或381-390或396具有至少80%、90%、 95%、98%同一性的氨基酸序列。seq id no:107和338为融合至seq idno:1的残基1-60的示例性c-末端fc融合多肽(hrs(1-60)_fc)的氨基酸 序列;seq id no:108和337为融合至seq id no:1的残基1-60的示例 性n-末端fc融合多肽(fc_hrs(1-60))的氨基酸序列;seq id no:109为 融合至seq id no:1的残基1-506的示例性c-末端fc融合多肽 (hrs(1-506)_fc)的氨基酸序列;以及seq id no:110为融合至seq idno:1的残基1-506的示例性n-末端fc融合多肽(fc_hrs(1-506))的氨基 酸序列。
64.在一些实施方案中,hrs-fc融合多肽具有抗炎活性,例如在基于细 胞的测定中或施用于对象之后。
65.还包括,例如药物组合物或治疗组合物的组合物,其包含本文所述 的hrs-fc融合多肽以及药学上可接受的或药用级载体或赋形剂。在一些 组合物中,所述多肽的纯度为至少约95%,小于约5%的多肽发生聚集。 在一些实施方案中,所述组合物被配制成经由口服施用、皮下施用、鼻 内施用、肺部施用或胃肠外施用来递送。在某些实施方案中,所述组合 物包含选自以下的递送媒介物:脂质体、胶粒、乳剂和细胞。
66.在一些实施方案中,所述组合物用于a)治疗炎症或自身免疫疾病, b)减少任选地与自身免疫或炎性疾病相关的肌肉或肺部炎症,c)诱导对组 氨酰-trna合成酶(hrs)自身抗原的耐受性,d)消除参与针对hrs自身抗 原的自身免疫应答的t细胞组或亚组,e)减少对象中的组织炎症,任选 为肌肉、肺和/或皮肤组织,f)治疗肌营养不良,g)治疗横纹肌溶解、肌肉 消耗、恶病质、肌肉炎症或肌肉损伤,和/或h)治疗与自身抗体相关的疾 病。
67.还包括给药方案,当使用3天或更长的给药间隔时,所述给药方案 将对象血浆中的组氨酰-trna合成酶(hrs)-fc融合多肽的平均稳态浓度 维持在约300pm至约1000nm,所述给药方案包括向对象施用本文所述 的治疗组合物或hrs-fc融合多肽。
68.一些实施方案包括在有需要的对象中维持组氨酰-trna合成酶 (hrs)-fc融合多肽水平高于最低有效治疗水平的方法,其包括向对象施 用本文所述的治疗组合物或hrs-fc融合多肽。
69.还包括在有需要的对象中治疗炎症或自身免疫疾病或病况的方法, 其包括向对象施用本文所述的治疗组合物或hrs-fc融合多肽。
70.一些实施方案包括在有需要的对象中减少与自身免疫或炎性疾病相 关的肌肉或肺部炎症的方法,其包括向对象施用本文所述的治疗组合物 或hrs-fc融合多肽。
71.某些实施方案包括在有需要的对象中诱导对组氨酰-trna合成酶 (hrs)自身抗原的耐受性的方法,其包括向对象施用本文所述的治疗组合 物或hrs-fc融合多肽。
72.一些实施方案包括在有需要的对象中消除参与针对组氨酰-trna合 成酶(hrs)自身抗原的自身免疫应答的t细胞组或亚组的方法,其包括向 对象施用本文所述的治疗组合物或hrs-fc融合多肽。
73.还包括在有需要的对象中减少组织炎症的方法,其包括向对象施用 本文所述的治疗组合物或hrs-fc融合多肽。在某些实施方案中,所述组 织选自肌肉、肠、脑、肺和皮肤。
74.一些实施方案包括在有需要的对象中治疗肌营养不良的方法,其包 括向对象施用本文所述的治疗组合物或hrs-fc融合多肽。在具体实施方 案中,所述肌营养不良选自:
杜氏肌营养不良、贝克肌营养不良(beckermuscular dystrophy)、emery-dreifuss肌营养不良、肢带型肌营养不良、 面肩肱型肌营养不良、肌强直性营养不良、眼咽肌营养不良、远端肌营 养不良和先天性肌营养不良。
75.某些实施方案包括在有需要的对象中治疗横纹肌溶解、肌肉消耗、 恶病质、肌肉炎症或肌肉损伤的方法,其包括向对象施用本文所述的治 疗组合物或hrs-fc融合多肽。
76.一些实施方案包括治疗与自身抗体相关的疾病的方法,其包括向有 需要的对象施用本文所述的组合物或aars/hrs多肽。在一些实施方案 中,所述疾病选自炎性肌病,包括炎性肌病、多肌炎、皮肌炎和相关病 症、多肌炎-硬皮病重叠、包涵体肌炎(ibm)、抗合成酶综合征、间质性 肺病、关节炎和雷诺现象(reynaud’s phenomenon)。在一些实施方案中, 在出现疾病症状之前,将所述组合物施用于对象。在一些实施方案中, 所述自身抗体对组氨酰-trna合成酶为特异的。在一些实施方案中,所 述hrs多肽包含被疾病特异性自身抗体识别的组氨酰-trna合成酶的至 少一种表位。在一些实施方案中,所述表位为被来自对象血清的抗体识 别的免疫显性表位。在一些实施方案中,所述hrs多肽阻断自身抗体与 天然组氨酰-trna合成酶的结合。在一些实施方案中,所述hrs多肽导 致自身反应性t-细胞的克隆缺失。在一些实施方案中,所述hrs多肽导 致参与自身免疫应答的t细胞的功能失活。在一些实施方案中,施用hrs 多肽引起减轻的肌肉或肺部炎症。在一些实施方案中,所述hrs多肽诱 导对自身抗原的耐受性。
77.在某些实施方案中,组合物被配制成经由口服施用、鼻内施用、肺 部施用、肌内施用或胃肠外施用来递送。
78.还包括分离的多核苷酸,其包含编码本文所述的hrs-fc缀合物或融 合多肽的核苷酸序列,包括包含这类多核苷酸的载体,以及包含所述多 核苷酸和/或载体的宿主细胞。
79.一些实施方案包括制备本文所述的hrs-fc融合多肽的方法,其包括 a)培养宿主细胞(例如,大肠杆菌k-12宿主细胞)以表达hrs-fc融合多肽, 其中所述宿主细胞包含编码本文所述的hrs-fc融合多肽的多核苷酸,其 可操作地连接至调控元件;以及b)从所述宿主细胞中分离hrs-fc融合多 肽。在特定实施方案中,大肠杆菌k-12菌株选自w3110和ut5600。
80.发明详述
81.除非另有相反的说明,本发明的实施可利用本技术领域的分子生物 学和重组dna技术的常规方法,出于示例的目的,这些中的许多在下文 被描述。这类技术在文献中有充分的解释。参见,例如,sambrook等, molecular cloning:a laboratory manual(第3版,2000);dna cloning:apractical approach,vol.i&ii(d.glover编);oligonucleotide synthesis(n. gait编,1984);oligonucleotide synthesis:methods and applications(p. herdewijn编,2004);nucleic acid hybridization(b.hames&s.higgins编, 1985);nucleic acid hybridization:modern applications(buzdin和lukyanov 编,2009);transcription and translation(b.hames&s.higgins编,1984); animal cell culture(r.freshney编,1986);freshney,r.i.(2005)culture ofanimal cells,a manual of basic technique,第5版.hoboken nj,john wiley &sons;b.perbal,a practical guide to molecular cloning(第3版,2010); farrell,r.,rna methodologies:a laboratory guide for isolation andcharacterization(第3版,2005).poly(ethylene glycol),chemistry andbiological applications,acs,washington,1997;veronese,f.和
j.m.harris 编,peptide and protein pegylation,advanced drug delivery reviews,54(4) 453-609(2002);zalipsky,s et al.,“use of functionalized poly(ethyleneglycols)for modification of polypeptides”in polyethylene glycolchemistry:biotechnical and biomedical applications。
82.本文引用的所有出版物、专利和专利申请均通过引用方式整体并入 本文。
83.定义
84.除非另有定义,本文所用的所有技术和科学术语具有本发明所属领 域技术人员通常所理解的相同的含义。尽管任何与本文所述的类似或等 同的方法和材料均可用于实施或测试本发明,本文描述了优选的方法和 材料。出于本发明的目的,对以下术语定义如下。
85.本文所用冠词(“a/an”)是指一个或多于一个(即至少一个)该冠词的语 法上的宾语。举例来说,“元件”是指一个元件或多于一个元件。
[0086]“约”是指相对于参考数量、水平、数值、数目、频率、百分比、 容积、尺寸、量、重量或长度,变化多达30%、25%、20%、15%、10%、 9%、8%、7%、6%、5%、4%、3%、2%或1%的数量、水平、数值、数 目、频率、百分比、容积、尺寸、量、重量或长度。
[0087]
如本文所用,术语“氨基酸”是指天然存在的和非天然存在的氨基 酸以及氨基酸类似物和模拟物。天然存在的氨基酸包括蛋白质生物合成 中所用的20种(l)-氨基酸和其他氨基酸如4-羟脯氨酸、羟赖氨酸、锁链 素、异锁链素、同型半胱氨酸、瓜氨酸和鸟氨酸。非天然存在的氨基酸 包括,例如,(d)-氨基酸、正亮氨酸、正缬氨酸、对氟苯丙氨酸、乙硫氨 酸等,其为本领域技术人员所熟知。氨基酸类似物包括天然和非天然存 在的氨基酸的修饰形式。这类修饰可包括,例如,氨基酸上的化学基团 和部分的取代或替换,或者通过氨基酸的衍生化。氨基酸模拟物包括例 如,表现出与参照氨基酸功能上类似的特性如电荷和电荷间距(chargespacing)特性的有机结构。例如,模拟精氨酸(arg或r)的有机结构具有的 正电荷部分以类似的分子间距布置,并具有与天然存在的arg氨基酸侧 链的e-氨基相同的迁移率。模拟物还包括受约束的结构,从而维持氨基 酸或氨基酸功能基团的最佳间距和电荷相互作用。本领域技术人员知道 或能够确定什么结构构成了功能上等同的氨基酸类似物和氨基酸模拟 物。
[0088]
如本文所用,“处于发生疾病或不良反应的风险”的对象在本文所述 的治疗方法之前可以具有或可以不具有可检测的疾病、或疾病症状,且 可以已显示或可以未显示出可检测的疾病或疾病症状。“处于
……
风险
”ꢀ
表示对象具有一种或多种风险因素,其为如本文所述且本领域已知的与 疾病发生相关的可测量参数。具有这些风险因素的一种或多种的对象发 生疾病、或不良反应的概率高于没有一种或多种这些风险因素的对象。
[0089]
本文使用的“自身免疫性疾病”为由个体自身组织引起且针对个体自 身组织的疾病或病症。自身免疫疾病或病症的实例包括但不限于炎性反 应,如炎症性皮肤疾病,包括银屑病和皮炎(例如,异位性皮炎);系统性 硬皮病和硬化症;与炎性肠病相关的反应(如克罗恩病和溃疡性结肠炎); 呼吸窘迫综合征(包括成人呼吸窘迫综合征;ards);皮炎;脑膜炎;脑 炎;葡萄膜炎;结肠炎;肾小球肾炎;过敏性病况,如湿疹和哮喘以及 涉及t细胞浸润和慢性炎症反应的其他病况;动脉粥样硬化;白细胞粘 附缺陷;类风湿性关节炎;系统性红斑狼疮(sle);糖尿病(例如,i型糖 尿病或胰岛素依赖性糖尿病);多发性硬化;雷诺综合征
(reynaud’ssyndrome);自身免疫性甲状腺炎;变应性脑脊髓炎;斯耶格伦综合征 (sjorgen’s syndrome);青少年型糖尿病;以及通常在结核病、结节病、多 肌炎、炎性肌病、间质性肺病、肉芽肿病和血管炎中发现的由细胞因子 和t-淋巴细胞介导的急性和迟发型超敏反应相关的免疫反应;恶性贫血 (艾迪生病(addison’s disease));涉及白血球渗出的疾病;中枢神经系统 (cns)炎性病症;多器官损伤综合征;溶血性贫血(包括但不限于冷球蛋 白血症(cryoglobinemia)或库姆斯阳性贫血(coombs positive anemia));重症 肌无力;抗原-抗体复合物介导的疾病;抗肾小球基底膜疾病;抗磷脂综 合征;变应性神经炎;格雷夫斯病(graves’disease);朗-爱二氏肌无力综 合征(lambert-eaton myasthenic syndrome);大疱性类天疱疮;天疱疮;自 身免疫性多内分泌腺疾病;reiter病;僵人综合征;贝切特病(behcetdisease);巨细胞动脉炎;免疫复合物肾炎;iga肾病;igm多发性神经 病;免疫性血小板减少性紫癜(itp)或自身免疫性血小板减少症等。
[0090]
在整个本技术文件中,除非上下文另有要求,词语“包含 (comprise/comprises/comprising)”应理解为是指包括所陈述的步骤或成 分或者步骤或成分的组,但不排除任何其他步骤或成分或者步骤或成分 的组。“由...组成(consisting of)”是指包括且限于词组“由...组成”后所列举 的内容。因此,词组“由...组成”表示所列举的成分为必需的或必要的,且 不可以存在其他成分。“基本上由...组成(consisting essentially of)”是指 包括该词组后所列举的任何成分,并限于不干扰或促进本公开中指明的 所列举成分的活性或作用的其他成分。因此,词组“基本上由...组成”表 示所列举的成分为必需的或必要的,但其他成分是任选的,且根据其是 否实质上影响所列举成分的活性或作用而可以存在或不可以存在。
[0091]
术语“克隆缺失”是指自身反应性t-细胞的缺失(例如,丧失或死亡)。 克隆缺失可在胸腺中心实现,或在外周实现或在两者实现。
[0092]
术语“缀合物”意指由于将分子例如生物活性分子(如,hrs多肽) 共价连接至免疫球蛋白fc区而形成的实体。缀合物多肽的一个实例为“融 合蛋白”或“融合多肽”,即通过将最初编码单独多肽的两个或更多个编 码序列连接起来而生成的多肽;连接的编码序列翻译后产生单一的融合 多肽,其通常具有源自各单独多肽的功能特性。
[0093]
词语“无内毒素”或“基本上无内毒素”通常是指组合物、溶剂和/ 或容器,其包含至多微量(例如对于对象没有临床不良生理作用的量)的内 毒素,优选为无法检测到的内毒素量。内毒素是与某些细菌,通常为革 兰氏阴性菌相关的毒素,尽管内毒素也可以发现于革兰氏阳性菌,如单 核细胞增生李斯特菌(listeria monocytogenes)。最常见的内毒素为各种革 兰氏阴性菌外膜中发现的脂多糖(lps)或脂寡糖(los),且其代表了这些 细菌致病能力的重要致病特征。人体中少量的内毒素可以引起发热、血 压降低以及炎症激活和凝血以及其他不良生理作用。
[0094]
因此,在药物生产中,通常理想的是从药物产品和/或药物容器中去 除大多数的或所有微量的内毒素,因为即使少量也可在人体中引起不良 作用。除热原烘箱可以用于该目的,因为通常需要超过300℃的温度来 破坏大多数的内毒素。例如,基于初级包装材料如注射器或小瓶,结合 250℃的玻璃温度和30分钟的保持时间通常足以获得3个对数级的内毒 素水平减少。本文包括其他去除内毒素的方法,包括例如,如本文所述 和本领域已知的色谱法和过滤法。还包括在真核细胞如哺乳动物细胞中 产生hrs-fc缀合物并从其中分离
出hrs-fc缀合物的方法,以降低(如 果没有消除的话)本发明的组合物中存在内毒素的风险。优选在无血清的 细胞中产生hrs-fc缀合物并从其中分离出hrs-fc缀合物的方法。
[0095]
可使用本领域已知的常规技术检测内毒素。例如,利用来自鲎的血 液的鲎试剂测定(limulus amoebocyte lysate assay),是用于检测内毒素存 在的非常灵敏的测定。在该检测中,由于强有力的酶级联放大了该反应, 极低水平的lps可导致鲎试剂的可检测的凝聚。内毒素也可通过酶联免 疫吸附测定(elisa)来定量。为了基本上无内毒素,内毒素水平可小于约 0.001、0.005、0.01、0.02、0.03、0.04、0.05、0.06、0.08、0.09、0.1、0.5、 1.0、1.5、2、2.5、3、4、5、6、7、8、9或10eu/ml。通常,1ng脂多 糖(lps)对应于约1-10eu。
[0096]
如本文所用,术语“功能”和“功能的(functional)”等是指生物学、 酶学或治疗功能。
[0097]“同源性”是指相同的或构成保守取代的氨基酸的百分数。可以使 用诸如gap的序列比较程序确定同源性(deveraux等,nucleic acidsresearch.12,387-395,1984),其通过引用并入本文。以这种方式,与本文 所列举的序列长度类似或实质上不同的序列,可通过将空位插入至比对 中来进行比较,例如通过使用gap的比较算法来确定这类空位。
[0098]“生理上稳定的”连接子是指在水中或在生理条件下(例如在体内、 体外培养条件下,例如在一种或多种蛋白酶存在下)基本上稳定的连接子, 也就是说,在生理条件下它在较长时期内不会经历任何可评估程度的降 解反应(例如,可酶促降解的反应)。通常,生理上稳定的连接子是在生理 条件下表现的降解率小于每天约0.5%、约1%、约2%、约3%、约4%或 约5%的连接子。
[0099]
所用“分离的”是指材料基本上或实质上没有在其天然状态下通常 伴随它的组分。如本文所用,例如,“分离的肽”或“分离的多肽”等, 包括肽或多肽分子从其天然的细胞环境中以及从与细胞其他组分的结合 中的体外分离和/或纯化;即它不再显著结合有体内物质。
[0100]
术语“半数最大有效浓度”或“ec
50”是指本文所述的hrs-fc缀合 物的浓度,在该浓度下它在某一指定的暴露时间后诱导基线和最大值间 一半的反应;因此,剂量-量反应曲线的ec
50
表示观察到其最大效果的 50%时的化合物浓度。在某些实施方案中,本文提供的试剂的ec
50
相对 于上文所述的“非经典的”活性表示。ec
50
还表示获得50%的体内最大效 应所需的血浆浓度。同样地,“ec
90”是指观察到其最大效应的90%时的 试剂或组合物浓度。“ec
90”可从“ec
50”和hill斜率计算,或者使用本 领域常规知识从数据直接确定。在一些实施方案中,hrs-fc缀合物的 ec
50
小于约0.01、0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、 2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、 20、25、30、40、50、60、70、80、90或100nm。优选地,生物治疗性 组合物具有的ec
50
值为约1nm或更小。
[0101]
hrs-fc缀合物的“半衰期”可指相对于施用至生物体的血清或组织 中之时的活性,或者相对于任何其他定义的时间点,该缀合物失去其一 半的药理学、生理学或其他活性所用的时间。“半衰期”也可指相对于施 用至生物体的血清或组织中之时的量或浓度,或者相对于任何其他定义 的时间点,hrs-fc缀合物的量或浓度减少为施用至生物体的血清或组织 中的最初量的一半所用的时间。半衰期可在血清和/或任何一种或多种选 定的组织中测量。
[0102]
本文所用术语“连接(linkage)”、“连接子(linker)”、“连接子部分(linker
moiety)”或“l”是指可用于将hrs多肽与另一hrs多肽和/或与一个 或多个fc区隔开的连接子。所述连接子可以为生理上稳定的或者可以包 括可释放的连接子如可酶促降解的连接子(例如可蛋白水解切割的连接 子)。在某些方面,所述连接子可以为肽连接子,例如作为hrs-fc融合 蛋白的一部分。在一些方面,所述连接子可以为非肽连接子。
[0103]
术语“调节”和“改变”包括通常以相对于对照的统计上显著的或 生理学显著的量或程度的“增加”、“提高”或“刺激”,以及“减少”或
ꢀ“
降低”。“增加”、“刺激”或“提高”的量通常为“统计学上显著的
”ꢀ
量,且可以包括为没有组合物时(例如,不存在本发明的任何hrs-fc缀 合物)或对照组合物、样品或测试对象所产生的量的1.1、1.2、2、3、4、 5、6、7、8、9、10、15、20、30或更多倍(例如,500倍、1000倍)(包括 其间的的所有整数和小数点,且大于1,例如,1.5、1.6、1.7、1.8等)的 增加。“减少”或“降低”的量通常为“统计上显著的”量,且可以包括 没有组合物(无试剂或化合物)时或对照组合物所产生的量的1%、2%、3%、 4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、 55%、60%、65%、70%、75%、80%、85%、90%、95%或100%(包括其 间的所有整数)的减少。作为一个非限制性实例,比较经典和非经典活性 中的对照可包括相比相应的(按序列)未修饰的、或不同地修饰的hrs多 肽的目标hrs-fc缀合物。本文描述了比较和“统计上显著的”量的其他 实例。
[0104]
如本文所用,“非经典的”活性通常指:i)本发明的hrs多肽具有的 新的、非氨酰化活性,其不在任何明显的程度上为完整的天然全长亲本 蛋白所具有,或者ii)完整的天然全长亲本蛋白所具有的活性,其中相比 完整的天然全长亲本蛋白,,所述hrs多肽在非经典的活性方面表现出 显著更高(例如至少大20%)的特定活性,或者在新环境中表现出该活性; 例如,通过将该活性与完整的天然全长亲本蛋白具有的其他活性分开。 在hrs多肽的情况下,非经典活性的非限制性实例包括细胞外信号传导, 包括调节细胞增殖、调节细胞迁移、调节细胞分化(例如,血细胞生成、 神经形成、肌细胞生成、骨生成和脂肪生成)、调节基因转录、调节细胞 凋亡或其他形式的细胞死亡、调节细胞信号传导、调节细胞摄取或分泌、 调节血管生成、调节细胞结合、调节细胞代谢、调节细胞因子产生或活 性、调节细胞因子受体活性、调节炎症和免疫原性等。
[0105]
在某些实施方案中,组合物中任何给定试剂(例如,hrs-fc缀合物如 融合蛋白)的“纯度”可具体限定。例如,某些组合物包含的试剂的纯度 可为至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、 98%、99%或100%,包括其间的所有小数,如通过例如但不限于高压液 相色谱(hplc)(其为生物化学和分析化学中经常使用的用于分离、鉴定和 定量化合物的柱层析的一种熟知的形式)所测定的。
[0106]
不希望受限于任何具体理论,“可酶促降解的连接子”是指可被一种 或多种酶如肽酶或蛋白酶降解的连接子,例如氨基酸序列。
[0107]
术语“多肽”和“蛋白”在本文中可互换使用,指氨基酸残基的聚 合物及其变体和合成的类似物。因此,这些术语适用于其中一个或多个 氨基酸残基为合成的非天然存在的氨基酸的氨基酸聚合物如相应的天然 存在的氨基酸的化学类似物,以及天然存在的氨基酸聚合物。
[0108]“可释放的连接子”包括但不限于,生理上可切割的连接子和可酶 促降解的连接子。因此,“可释放的连接子”是在生理条件下可以经历自 发水解或通过一些其他机制切割
(例如,酶催化的切割、酸催化的切割、 碱催化的切割等)的连接子。例如,“可释放的连接子”可涉及碱性提取质 子(例如,可电离的氢原子,hα)作为驱动力的消除反应。出于本文的目 的,“可释放的连接子”与“可降解的连接子”同义。在具体实施方案中,可 释放的连接子于ph 7.4、25℃,例如生理ph、人体温度(例如在体内)下 的半衰期为约30分钟、约1小时、约2小时、约3小时、约4小时、约 5小时、约6小时、约12小时、约18小时、约24小时、约36小时、约 48小时、约72小时、或约96小时或更多。
[0109]“统计上显著的”是指该结果不可能偶然出现。可通过本领域已知 的任何方法测定统计显著性。常用显著性测量方法包括p-值,p-值是如 果无效假设为真,观察事件发生的频率或可能性。如果获得的p-值小于 该显著性水平,那么拒绝该无效假设。在简单的情况下,该显著性水平 限定在p-值为0.05或更小。
[0110]
术语“溶解度”是指本文提供的hrs-fc缀合多肽溶解于液体溶剂中 形成均质溶液的特性。溶解度通常表示为浓度,通过每单位体积的溶剂 中的溶质质量(g溶质/kg溶剂、g/dl(100ml)、mg/ml等)、摩尔浓度、质 量摩尔浓度、摩尔分数或浓度的其他类似描述。每量的溶剂能够溶解的 溶质的最大平衡量,是特定条件(包括温度、压力、ph和溶剂的特性)下 该溶质在该溶剂中的溶解度。在某些实施方案中,在生理ph或其他ph 下测量溶解度,例如ph 5.0、ph 6.0、ph 7.0或ph 7.4。在某些实施方案 中,在水或生理缓冲液如pbs或nacl(有或没有nap)中测量溶解度。在 特定实施方案中,在相对较低的ph(例如,ph 6.0)和相对较高的盐(例如, 500mm nacl和10mm nap)下测量溶解度。在某些实施方案中,在生物 流体(溶剂)如血液或血清中测量溶解度。在某些实施方案中,所述温度可 为约室温(例如,约20℃、21℃、22℃、23℃、24℃、25℃)或约体温(37℃)。 在某些实施方案中,hrs-fc缀合多肽在室温或37℃具有的溶解度为至 少约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、 7、8、9、10、11、12、13、14、15、16、17、18、19、20、25或30mg/ml。
[0111]
如本文所用,“对象”包括任何呈现症状或有呈现症状风险的动物, 该症状可用本发明的hrs-fc缀合多肽治疗或诊断。合适的对象(患者)包 括实验动物(如小鼠、大鼠、兔或豚鼠)、农场动物和家养动物或宠物(如 猫或犬)。包括非人的灵长类以及优选地,人类患者。
[0112]“基本上”或“实质上”是指几乎整个或全部地,例如,95%、96%、 97%、98%、99%或更大的某给定量。
[0113]
如本文所用,“治疗(treatment/treating)”包括对疾病或病况的症状 或病理的任何合意的作用,且可以包括接受治疗的疾病或病症的一种或 多种可测量标志物的甚至最小的变化或改善。“治疗(treatment/treating)
”ꢀ
不一定表示完全根除或治愈疾病或病况或其相关症状。接受该治疗的对 象是任何有需要的对象。临床改善的示例性标志物对本领域技术人员来 说是显而易见的。
[0114]
组氨酰-trna合成酶衍生的多肽
[0115]
本发明的实施方案涉及组氨酰-trna合成酶多肽(“hrs或hisrs多 肽”)-fc缀合物,其包括包含野生型hrs序列、天然存在的序列、非天然 存在的序列和/或其变体和片段的hrs-fc缀合物。hrs衍生的多肽的特 定实例包括具有改变的半胱氨酸含量的那些。组氨酰-trna合成酶属于 ii型trna合成酶家族,其具有三种高度保守的序列基序。i型trna合 成酶和ii型trna合成酶普遍被认为在以下两步反应中负责氨基酸特异 性结合至其同源
trna:首先由atp活化氨基酸(aa)以形成aa-amp, 然后转移至trna的受体末端。全长组氨酰-trna合成酶通常以胞质同源 二聚体或选择性剪接的线粒体形式存在。
[0116]
最近已证明,真核生物的组氨酰-trna合成酶的某些生物片段或者 选择性剪接的亚型(physiocrines,或hrs多肽),或在某些情况下完整的 合成酶调节某些信号传导通路,或具有抗炎特性。这些不同于trna合 成酶在蛋白合成中的经典作用的活性,在本文总称为“非经典活性”。这 些physiocrines可以通过选择性剪接或蛋白水解而天然产生,且能够以细 胞自主性方式(即在宿主细胞内)或者非细胞自主性方式(即在宿主细胞外) 发挥作用,以调节多种稳态平衡机制。例如,如在本发明中所提供的, hrs多肽,如组氨酰-trna合成酶的n-末端片段(例如,hrs 1-48、hrs 1-60)尤其能够通过阻断与体内活动性炎症部位相关的炎性细胞的迁移、 活化或分化(例如,单核细胞、巨噬细胞、t细胞、b细胞)来发挥抗炎信 号。此外,相对于全长hrs多肽序列,某些突变或缺失体(例如,hrs1-506、hrs 1-60)赋予增加的活性和/或改善的药理性质。表d1中提供了 某些示例性hrs多肽的序列。
[0117]
[0118]
[0119]
[0120]
[0121][0122]
许多天然存在的组氨酰-trna合成酶单核苷酸多态性(snp)和人基因 的天然存在的变体都已经进行了测序,且在本领域已知为至少部分地在 功能上可互换。表d2中显示了组氨酰-trna合成酶的若干这类变体(即 代表性组氨酰-trna合成酶snp)。
[0123]
[0124]
[0125]
[0126][0127]
另外,人基因的同源物和直系同源物存在于如表d3中所列出的其他 物种中,因此选择天然存在的氨基酸、或snp中存在的核苷酸变体、或 其他天然存在的同源物代替表d1、d4-d6或d8中列出的任何人hrs多 肽序列将是常规的操作。
[0128][0129][0130]
因此,在本发明的任何方法治疗组合物和试剂盒中,术语“hrs多 肽”、“hrs蛋白质”或“hrs蛋白质片段”包括组氨酰-trna合成酶的 所有天然存在形式和合成形式,所述组
氨酰-trna合成酶具有非经典活性, 如抗炎活性和/或保留与来自患有与组氨酰-trna合成酶的自身抗体相关 疾病的对象的自身抗体或自身反应性t-细胞特异性交叉反应的至少一种 表位。这类hrs多肽包括全长人蛋白质以及衍生自表d1、d3-d6或d8 中列出的全长蛋白质的hrs肽。在一些实施方案中,术语hrs多肽是 指衍生自约45或50至约250个氨基酸长的人组氨酰-trna合成酶(的多 肽序列(表d1中的seq id no:1)。应理解在本文所述的任何hrs-fc缀 合物中,当产生融合蛋白或缀合物时,可以从表d1、d3-d6或d8中列 出的任何序列删除hrs多肽的n-末端酸(例如,n-末端met)。
[0131]
在一些实施方案中,hrs多肽在长度上为约20-509、20-508、20-507、 50-506、20-505、50-504、20-503、20-502、20-501、20-500、20-400、20-300、 20-250、20-200或20-100个氨基酸。例如,在特定实施方案中,多肽在 长度上为约20-25、20-35、20-40、20-45、20-55、20-60、20-65、20-70、 20-75、20-80、20-85、20-90、20-95或20-100个氨基酸,或约30-35、30-40、 30-45、30-55、30-60、30-65、30-70、30-75、30-80、30-85、30-90、30-95 或30-100个氨基酸,或约40-45、40-55、40-60、40-65、40-70、40-75、 40-80、40-85、40-90、40-95或40-100个氨基酸,或约45-50、45-55、 50-55、50-60、50-65、50-70、50-75、50-80、50-85、50-90、50-95或50-100 个氨基酸,或约60-65、60-70、60-75、60-80、60-85、60-90、60-95或 60-100个氨基酸,或约70-75、70-80、70-85、70-90、70-95或70-100 个氨基酸,或约80-85、80-90、80-95或80-100个氨基酸。在某些实施方 案中,hrs多肽在长度上为约20、21、22、23、24、25、26、27、28、 29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、 45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、 61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、 77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、 93、94、95、96、97、98、99、100、150、200、250、300、350、400、 450、500、501、502、503、504、505、506、507、508或509个氨基酸。
[0132]
在一些实施方案中,hrs多肽在高达约1至5x 10-7
m或更高浓度下 不会在竞争性elisa中显著竞争与野生型组氨酰-trna合成酶结合的疾 病相关的自身抗体(例如,jo-1抗体)。因此,在一些实施方案中,hrs 多肽对疾病相关的自身抗体的亲和力低于野生型组氨酰-trna合成酶 (seq id no:1),如在竞争性elisa中测量的。在一些实施方案中,hrs 多肽对疾病相关的自身抗体(例如,jo-1抗体)的表观亲和力比疾病相关的 自身抗体对野生型人(seq id no:1)的亲和力低至少约10倍、或至少约 20倍、或至少约50倍、或至少约100倍。
[0133]
因此,组氨酰-trna合成酶的所有这类同源物、直系同源物和天然 存在的或合成的亚型(例如,表d1、d3-d6或d8中列出的任何蛋白质) 都被包括在本发明的任何方法、hrs-fc缀合物、试剂盒和组合物中,只 要它们保留与来自患有与组氨酰trna合成酶的自身抗体相关疾病的对 象的自身抗体或自身反应性t-细胞特异性交叉反应的至少一种表位,或 具有非经典活性。hrs多肽可以为其天然形式,即作为其天然下出现于 不同物种中时的不同变体,其可以被看做是人组氨酰-trna合成酶的功 能等效变体,或可以为功能上等效的其天然衍生物,其氨基酸序列可能 不同,例如通过截短(例如,从n-或c-末端或者两端)或其他氨基酸缺失、 添加、插入、取代或翻译后修饰。天然存在的化学衍生物,包括任何hrs 多肽的翻译后修饰和降解产物,也特别地被包括于本发明的任何方法和 组合物中,包括例如,hrs多肽或hrs-fc缀合物的焦谷氨酰、异天冬 氨酰、蛋白水解的、磷酸化的、糖基化的、氧化的、异构化的和脱氨基 的变体。如本文所述,hrs多肽和hrs-fc缀合物也可由天然存在
的氨 基酸和/或非天然存在的氨基酸组成。
[0134]
如上所述,本发明的实施方案包括组氨酰-trna合成酶的所有同源 物、直系同源物和天然存在的亚型(例如,表或序列表中所列的或衍生的 任何蛋白质,或在表或序列表中列出的其对应的核酸)以及这些hrs参照 多肽的“变体”。所述多肽“变体”是指通过添加、缺失和/或取代至少一个 氨基酸残基而不同于参照hrs多肽的多肽,其通常保留(例如,模拟)或 调节(例如,拮抗)参照hrs多肽的一种或多种非经典活性。变体还包括 已经通过添加、缺失和/或取代至少一个氨基酸残基而修饰从而具有改善 的稳定性或其他药学特性的多肽。
[0135]
在某些实施方案中,多肽变体通过一个或多个可为保守的或非保守 的取代而不同于参照多肽,如本文所述和本领域所知的。在某些实施方 案中,所述多肽变体包含保守取代,就此而言,本领域理解,一些氨基 酸可以改变为具有广泛相似特性的其他氨基酸而不改变该多肽的活性性 质。在一些实施方案中,所述变体包含一个或多个保守残基,包括leu7、 gln14、gly15、val18、arg19、leu21、lys22、lys25、ala26、val35、 leu38、leu39、leu41和lys 42(基于seq id no:1的编号)中的一个或多 个。
[0136]
可用于本发明的任何方法和组合物的hrs多肽变体的特定实例包括 全长hrs多肽,或其截短或剪接变体(例如,表或序列表中所列的或衍生 的任何蛋白质),其i)保留可检测的非经典活性和/或保留与来自患有与组 氨酰trna合成酶的自身抗体相关疾病的对象的自身抗体或自身反应性 t-细胞特异性交叉反应的至少一种表位,以及ii)具有一种或多种另外的 氨基酸插入、取代、缺失和/或截短。在某些实施方案中,变体多肽包括 与hrs参照多肽的相应序列具有至少约50%、55%、60%、65%、70%、 75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、 98%或更多序列同一性或相似性的氨基酸序列,如本文所述(例如,表或 序列表中所列的或衍生的任何蛋白),并基本上保留了该参照多肽的非经 典活性。还包括通过添加、缺失或取代1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、30、40、50、60、70、80、 90、100、110、120、130、140、150个或更多个氨基酸而不同于参照hrs 序列,但保留了参照hrs多肽特性的序列。在某些实施方案中,所述氨 基酸添加或缺失出现在hrs参照多肽的c-末端和/或n-末端。在某些实 施方案中,所述氨基酸添加包括1、2、3、4、5、6、7、8、9、10、11、 12、13、14、15、16、17、18、19、20、30、40、50个或更多个邻近hrs 参照多肽的c-末端和/或n-末端的野生型残基(即,来自相应的全长hrs 多肽)。
[0137]
在一些实施方案中,所述hrs多肽包含约45至250个或约50至250 个氨基酸的全长组氨酰trna合成酶的多肽片段,其包含、由或基本上 由在seq id no:1-106、170-181或185-191一个或多个中示出的hrs多 肽序列的氨基酸组成。在一些实施方案中,所述hrs多肽包含、由或基 本上由seq id no:1的残基1-141、1-408、1-113或1-60组成。在一些 方面,所述hrs多肽为包含、由或基本上由seq id no:1的残基 1-60+175-509、1-60+211-509或1-60+101-509组成的剪接变体。在具体 方面,所述hrs多肽包含、由或基本上由seq id no:1的残基1-48或 1-506组成。
[0138]
在某些实施方案中,本发明的hrs多肽包含、由或基本上由能够调 节体内抗炎活性,或者具有抗体或自身反应性t-细胞阻断活性的全长 hrs多肽的最小活性片段组成。在一方面,这类最小活性片段包含、由 或基本上由whep结构域(即,seq id no:1的约氨基酸1-43)组成。在 一些方面,该最小活性片段包含、由或基本上由氨酰化结构域(即,seq id
no:1的约氨基酸54-398)组成。在一些方面,该最小活性片段包含、由 或基本上由反密码子结合结构域(即如,seq id no:1的约氨基酸406-501) 组成。在下表d4中显示其他示例性活性片段。
[0139]
[0140]
[0141]
[0142]
[0143][0144]
对于一些hrs多肽,hrs多肽的约或至少约20-40、20-45、20-50、 20-55或20-60、20-65或20-67个连续或非连续的氨基酸来自seq id no:1 的氨基酸1-67。在具体实施方案中,hrs多肽的约20、21、22、23、24、 25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、 41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、 57、58、59、60、61、62、63、64、65、66或67个连续或非连续的氨基 酸来自seq id no:1的氨基酸1-67。hrs多肽可以包含whep结构域、 氨酰化结构域、反密码子结合结构域的一个或多个或其任何组合。在具 体实施方案中,hrs多肽没有功能性氨酰化结构域。在一些实施方案中, 多肽基本上由来自人hrs的whep结构域组成。不希望受任何理论的束 缚,某些hrs多肽中的whep结构域的独特方向或构象可以有助于提高 这些蛋白中观察到的非经典、和/或抗体阻断活性。
[0145]
因此,在某些实施方案中,hrs多肽包含、由或基本上由人hrswhep结构域序列组成。在一些实施方案中,人hrs whep结构域序列 通过某些保守残基限定。例如,在一些方面,hrs多肽包含、由或基本 上由下表d5中的人hrs whep结构域共有序列组成。
[0146]
在某些实施方案中,hrs多肽可以包含将最小结构域连接至异源蛋 白(如,fc结构域)或剪接变体的柔性连接子的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、 25、26、27、28个或所有29个氨基酸。
[0147]
如本文所用,术语“序列同一性”或例如,包含“与...50%同一的序 列”是指比较窗口上基于核苷酸与核苷酸或氨基酸与氨基酸的序列相同 的程度。因此,“序列同一性百分比”可以通过如下方式计算:在比较窗 口上比较两个最佳比对的序列,确定在两个序列中出现的相同核酸碱基 (例如,a、t、c、g、i)或相同氨基酸残基(例如,ala、pro、ser、thr、 gly、val、leu、ile、phe、tyr、trp、lys、arg、his、asp、glu、asn、 gln、cys和met)的位置数目以得到匹配的位置数目,用匹配的位置数目 除以比较窗口的总位置数(即窗口大小),该结果再乘以100以获得序列同 一性百分比。
[0148]
用于描述两个或更多个多肽之间的序列关系的术语包括,“参照序 列”、“比较窗口”、“序列同一性”、“序列同一性百分比”和“基本上的 同一性”。“参照序列”在长度上为至少12个,但经常为15-18个,且通 常为至少25个单体单元,包括核苷酸和氨基酸残基。因为
两个多肽可以 各自包含:(1)在这两个多肽之间类似的序列(即,仅为完整多肽序列的一 部分),以及(2)在这两个多肽之间不同的序列,两个(或更多个)多肽之间 的序列比较通常是通过在“比较窗口”上对这两个多肽序列进行比较, 以确定和比较局部区域的序列相似性。“比较窗口”是指至少6个,通常 约50至约100个,更通常约100至约150个连续位置的概念节段 (conceptual segment),其中在将序列与具有相同数目的连续位置的参照序 列进行最佳对齐后,将这两个序列进行比较。相比用于这两个序列最佳 对齐的参照序列(其不包含添加或缺失),比较窗口可以包含约20%或更少 的添加或缺失(即空位)。用于比对比较窗口的序列最佳对齐,可以通过计 算机执行的算法(wisconsin geneticssoftware package release 7.0中的 gap、bestfit、fasta和tfasta,genetics computer group,575 sciencedrive madison,wi,usa)来实施,或者通过目测和所选的任何不同方法产 生的最佳比对(即,产生在比较窗口上的最高同源性百分比)来实施。也可 以参见,例如altschul等,1997,nucl.acids res.25:3389公开的blast程 序族。序列分析的详细讨论可参见ausubel等,“current protocols inmolecular biology,”john wiley&sons inc,1994-1998,第15章的第19.3 单元。
[0149]
序列之间的序列相似性或序列同一性(上述术语在本文可互换使用) 的计算可按如下进行。为了确定两个氨基酸序列或两个核酸序列的同一 性百分比,可将所述序列进行比对用于最佳比较目的(例如,为了最佳对 齐,可将空位引入至第一和第二氨基酸或核酸序列中的一个或两者中; 而对于比较目的,可忽视非同源的序列)。在某些实施方案中,用于比较 目的而进行比对的参照序列的长度为参照序列长度的至少30%,优选至 少40%,更优选至少50%、60%,甚至更优选至少70%、80%、90%、100%。 然后比较在相应氨基酸位置或核苷酸位置的氨基酸残基或核苷酸。当在 第一序列中的位置被与在第二序列的相应位置的相同氨基酸残基或核苷 酸占据时,则分子在该位置是相同的。
[0150]
两个序列之间的同一性百分比是序列共有的相同位置数目(将为了两 个序列的最佳对齐而必须引入的空位的数目和每个空位的长度考虑在内) 的函数。
[0151]
可使用数学算法来比较序列和确定两个序列之间的同一性百分比。 在优选的实施方案中,两个氨基酸序列间的同一性百分比使用needleman 和wunsch算法(1970,j.mol.biol.48:444-453)确定,其已整合至gcg软件 包中的gap程序,使用了blossum 62矩阵或pam250矩阵,且空位权重 为16、14、12、10、8、6或4,长度权重为1、2、3、4、5或6。在又 一个优选的实施方案中,使用gcg软件包中的gap程序来确定两个核 苷酸序列之间的同一性百分比,采用了nwsgapdna.cmp矩阵,且空位 权重为40、50、60、70或80,长度权重为1、2、3、4、5或6。尤其优 选的参数组(除非另有说明,应使用该组参数)为blossum 62计分矩阵, 空位罚分为12,空位延伸罚分为4,以及移码空位罚分为5。两个氨基酸 或核苷酸序列之间的同一性百分比也可使用e.meyers和w.miller算法 (1989,cabios,4:11-17)确定,其已整合至align程序(2.0版),使用了 pam120权重残基表,空位长度罚分为12,空位罚分为4。
[0152]
可将本文所述的核酸和蛋白质序列用作“查询序列”来对公共数据 进行搜索,例如,以鉴定其他家族成员或相关序列。该搜索可使用altschul 等,(1990,j.mol.biol,215:403-10)的nblast和xblast程序(2.0版)进 行。可采用nblast程序进行blast核苷酸搜索,分数=100,字长= 12,以获得本发明的核酸分子同源的核苷酸序列。可采用xblast程序 进行blast蛋白搜索,分数=50,字长=3,以获得本发明的蛋白分子 同源的氨基酸序列。为
获得空位比对以便比较,可使用altschul等.(nucleicacids res.25:3389-3402,1997)中描述的gapped blast。当采用blast 和gapped blast程序时,可使用各个程序(例如,xblast和nblast) 的默认参数。
[0153]
在某些实施方案中,变异的多肽与相应的hrs参照序列相差至少1% 但少于20%、15%、10%或5%的残基。如果该比较需要对齐,应将序列 进行最大相似性比对。来自缺失或插入或错配的“环”突的序列被认为 是差异的。合适地,所述差异为在非关键残基或保守取代处的差异或改 变。在某些实施方案中,变异的hrs多肽的分子量与hrs参照多肽的 分子量相差约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、 12%、13%、14%、15%、16%、17%、18%、19%、20%或更多。
[0154]
还包括hrs参照多肽的生物活性“片段”,即hrs蛋白片段的生物 活性片段。代表性生物活性片段通常参与相互作用,例如,分子内或分 子间相互作用。分子间相互作用可为特异性结合相互作用或酶促相互作 用。分子间相互作用可发生于hrs多肽和细胞的结合伴侣之间,如细胞 受体或参与hrs多肽的非经典活性的其他宿主分子。
[0155]
hrs参照多肽的生物活性片段可为这样的多肽片段,其为例如,本 文所述的hrs参照多肽中任一个所示的氨基酸序列的10、11、12、13、 14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、 30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、110、 120、130、140、150、160、170、180、190、200、220、240、260、280、 300、320、321、322、323、324、325、326、327、328、329、330、331、 332、333、334、335、336、337、338、339,340,341,342,343,344,345,346, 347,348,349,350,351,352,353,354,355,356,357,38,359,360,361,362, 363,364,365,380,400,450,500,505或更多个连续或非连续的氨基酸,包 括其间的所有整数(例如,101、102、103)和范围(例如,50-100、50-150、50-200)。在某些实施方案中,生物活性片段包含非经典活性相关的序列、 结构域或基序。在某些实施方案中,任何hrs参照多肽的c-末端或n
‑ꢀ
末端区可以被截短约1、2、3、4、5、6、7、8、9、10、11、12、13、14、 15、16、17、18、19、20、25、30、35、40、45、50、60、70、80、90、 100、110、120、130、140、150、160、170、180、190、200、250、300、 350、400、450、500或更多个氨基酸,或者被截短约10-50、20-50、50-100、 100-150、150-200、200-250、250-300、300-350、350-400、400-450、450-500 或更多个氨基酸,包括其间的所有整数和范围(例如,101、102、103、104、 105),只要该截短的hrs多肽保留了参照多肽的非经典活性。下表5中 显示了某些示例性截短的hrs多肽和人hrs whep结构域共有序列。
[0156]
[0157]
[0158][0159]
应理解在本发明的任何hrs-fc缀合物中,hrs多肽的n-末端酸(例 如,n-末端met)可以从本文所述的任何示例性截短的hrs多肽或其他 hrs序列另外地缺失。
[0160]
通常,生物活性片段具有不小于其源自的生物活性(即非经典活 性)hrs参照多肽的活性的约1%、10%、25%或50%。测量这类非经典活 性的示例性方法描述于实施例中。
[0161]
在一些实施方案中,hrs蛋白、其变体和生物活性片段结合至一个 或多个细胞结合伴侣的亲和力为至少约0.01、0.05、0.1、0.2、0.3、0.4、 0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、11、12、13、 14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、 30、
40、50、100或150nm。在一些实施方案中,hrs蛋白片段对于选 定的细胞结合伴侣,尤其是参与非经典活性的结合伴侣的结合亲和力比 相应的全长hrs多肽或特定的选择性剪接的hrs多肽变体的结合亲和 力强至少约1.5x、2x、2.5x、3x、3.5x、4x、4.5x、5x、6x、7x、8x、9x、 10x、15x、20x、25x、30x、40x、50x、60x、70x、80x、90x、100x、200x、 300x、400x、500x、600x、700x、800x、900x、1000x或更多(包括其间 的所有整数)。
[0162]
如上所述,可以用不同的方式改变hrs多肽,包括氨基酸取代、缺 失、截短和插入。这类操作的方法通常为本领域所已知。例如,hrs参 照多肽的氨基酸序列变体可通过dna突变制备。诱变和核苷酸序列改变 的方法为本领域熟知的。参见,例如kunkel(1985, proc.natl.acad.sci.usa.82:488-492),kunkel等,(1987,methods in enzymol, 154:367-382),美国专利第4,873,192号,watson,j.d等,(“molecularbiology of the gene”,第四版,benjamin/cummings,menlo park,calif., 1987))以及其中引用的参照文献。对不影响目标蛋白的生物活性的适当氨 基酸取代的指导,可以参见dayhoff等,(1978)atlas of protein sequenceand structure(natl.biomed.res.found.,washington,d.c.)的模型。
[0163]
相比参照hrs氨基酸残基,具有生物活性的截短的hrs多肽和/或 变异的hrs多肽可以在沿着其序列的多个位置含有保守的氨基酸取代, 且这类另外的取代可以改变的半胱氨酸含量进一步提高hrs多肽的活性 或稳定性。“保守的氨基酸取代”是其中的氨基酸残基被具有类似侧链的 氨基酸残基替换。具有类似侧链的氨基酸残基的家族已经在本领域进行 了定义,其通常可归为以下亚类:
[0164]
酸性:由于在生理ph下其失去了h离子,该残基带有负电荷,且 该残基被水溶液吸引,从而在包含其的肽于生理ph的水性介质中时,寻 找肽构象中的表面位置。具有酸性侧链的氨基酸包括谷氨酸和天冬氨酸。
[0165]
碱性:由于在生理ph或在其一个或两个ph单位之内(例如,组氨酸) 其与h离子结合,该残基带有正电荷,且该残基被水溶液吸引,从而在 包含其的肽于在生理ph的水性介质中时,寻找肽构象中的表面位置。具 有碱性侧链的氨基酸包括精氨酸、赖氨酸和组氨酸。
[0166]
带电荷的:在生理ph下该残基带有电荷,因此,包括具有酸性或碱 性侧链的氨基酸(即,谷氨酸、天冬氨酸、精氨酸、赖氨酸和组氨酸)。
[0167]
疏水的:在生理ph下该残基不带有电荷,且该残基被水溶液排斥, 从而在包含其的肽于水性介质中时,寻找肽构象中的内部位置。具有疏 水性侧链的氨基酸包括酪氨酸、缬氨酸、异亮氨酸、亮氨酸、甲硫氨酸、 苯丙氨酸和色氨酸。
[0168]
中性的/极性的:在生理ph下该残基不带有电荷,且该残基没有被 水溶液充分排斥,从而在包含其的肽于水性介质中时,其会寻找肽构象 中的内部位置。具有中性/极性侧链的氨基酸包括天冬酰胺、谷氨酰胺、 半胱氨酸、组氨酸、丝氨酸和苏氨酸。
[0169]
该描述还将某些氨基酸定征为“小”氨基酸,因为其侧链不够大(甚至 缺乏极性基团)来赋予其疏水性。除了脯氨酸以外,“小”氨基酸是至少一 个极性基团在侧链上,且3个或更少的碳不在侧链上的具有4个或更少 碳的氨基酸。具有小侧链的氨基酸包括甘氨酸、丝氨酸、丙氨酸和苏氨 酸。由于其对肽链的二级构象的已知影响,基因编码的二级氨基酸脯氨 酸是特殊情况。脯氨酸与所有其他天然存在的氨基酸的结构不同之处在 于,其侧链连接至α-氨基的氮以及α-碳。几个氨基酸相似性矩阵是本领 域已知的(参见例如,pam120
矩阵和pam250矩阵,其公开于例如dayhoff 等,1978,a model of evolutionary change in proteins)。然而,在m.o. dayhoff,(编),atlas of protein sequence and structure,vol.5,pp.345-358, national biomedical research foundation,washington dc;以及gonnet等 (science,256:14430-1445,1992)中用于确定距离关系的矩阵将脯氨酸包括 在与甘氨酸、丝氨酸、丙氨酸和苏氨酸相同的组中。因此,出于本发明 的目的,脯氨酸被归类为“小”氨基酸。
[0170]
分类为极性或非极性所要求的吸引或排斥程度是随意的,因此,本 发明具体包括的氨基酸被归类为一者或另一者。大多数没有具体指定的 氨基酸可基于已知的行为进行归类。
[0171]
氨基酸残基可进一步归为以下亚类:环状的或非环状的,以及芳香 族的或非芳香族的、针对残基的侧链取代基自解释的分类,以及小的或 大的。如果其含有总计4个或更少的碳原子(包括羧基碳,只要存在另外 的极性取代基);3个或更少(如果不是),则该残基被认为是小的。当然, 小残基总是非芳香族的。根据其结构特性,氨基酸残基可分为两个或更 多类别。对于天然存在的蛋白氨基酸,根据该方案所分的亚类如表a所 示。
[0172]
表a:氨基酸亚类.
[0173][0174]
保守的氨基酸取代还包括基于侧链的分组。例如,具有脂肪族侧链 的氨基酸组为:甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸;具有脂 肪族-羟基侧链的氨基酸组为:丝氨酸和苏氨酸;具有包含酰胺的侧链的 氨基酸组为:天冬酰胺和谷氨酰胺;具有芳香族侧链的氨基酸组为:苯 丙氨酸、酪氨酸和色氨酸;具有碱性侧链的氨基酸组为:赖氨酸、精氨 酸和组氨酸;具有含硫的侧链的氨基酸组为:半胱氨酸和甲硫氨酸。例 如,可合理地预期,用异亮氨酸或缬氨酸替换亮氨酸、用谷氨酸替换天 冬氨酸、用丝氨酸替换苏氨酸、或者用结构相关的氨基酸进行类似的氨 基酸替换将不会对所得变体多肽的特性产生大的影响。是否氨基酸改变 会产生具有功能的截短的hrs多肽和/或变异的hrs多肽,可通过分析 如本文所述的其非经典活性容易地确定。保守性取代如标题为示例性取 代的表b中所示。落在本发明范围内的氨基酸取代,通常通过选择在它 们对维持以下的作用中没有明显区别的取代来实现:(a)取代区域中的肽 骨架结构,(b)靶标位点处分子的电荷或疏水性,(c)侧链的体积,或(d)生 物功能。引入取代后,针对生物活性来筛选变体。
[0175]
表b:示例性氨基酸取代.
[0176][0177]
可选择地,基于侧链的特性,进行保守取代的类似氨基酸可分为3 类。第一组包括谷氨酸、天冬氨酸、精氨酸、赖氨酸、组氨酸,其均具 有带电荷的侧链;第二组包括甘氨酸、丝氨酸、苏氨酸、半胱氨酸、酪 氨酸、谷氨酰胺、天冬酰胺;而第三组包括亮氨酸、异亮氨酸、缬氨酸、 丙氨酸、脯氨酸、苯丙氨酸、色氨酸、蛋氨酸,其描述于zubay,g., biochemistry,第三版,wm.c.brown publishers(1993)。
[0178]
已确定人hrs whep结构域的nmr结构(参见nameki等,accession1x59_a)。另外,也已确定全长人hrs的晶体结构以及hrs的内部催化 结构域缺失突变体(hrsδcd)(参见xu等,structure.20:1470-7,2012;以及 美国专利申请第61/674,639号)。结合hrs的一级氨基酸序列,蛋白质的 这些详细的物理描述提供了对该蛋白中特定氨基酸所起作用的精确了 解。因此,本领域技术人员可使用该信息以鉴定结构上保守的结构域、 连接区域、二级结构如α-螺旋、表面或溶剂-暴露的氨基酸、未暴露的或 内部区域、催化位点和配体相互作用表面以及其他结构特征。然后,这 类技术人员可使用该信息和其他信息以容易地改造保留或改善感兴趣的 非经典活性的hrs变体,例如,通过保存或改变这些和其他结构特征内 或与这些和其他结构特征相邻的氨基酸残基的特性,如通过相对于野生 型残基保存或改变所选择的氨基酸侧链的极性、亲疏水性指数、电荷、 尺寸和/或定位(向内、向外)(参见,例如,zaiwara等,molbiotechnol.51:67-102,2012;perona和hadd,biochemistry.51:8705-29, 2012;morin等,trends biotechol.29:159-66,2011;collins等,annu.rev. biophys.40:81-98,2011;和美国申请第61/674,639号)。
[0179]
因此,在截短的hrs多肽和/或变异的hrs多肽中预测的非必需氨 基酸残基通常是用来自相同侧链家族的另一氨基酸残基替换的。可选择 地,可沿着hrs编码序列的全部或部分如通过饱和诱变来随机引入突变, 可针对亲本多肽的活性来筛选所得突变体,以鉴定保留了该活性的突变 体。将编码序列诱变后,可重组表达该编码的肽,并可确定该肽的活性。
ꢀ“
非必需的”氨基酸残基是可从实施方案多肽的参照序列中改变的而不会 消除或实质
上改变一种或多种其非经典活性的残基。合适地,该改变没 有实质上消除这些活性中的一种,例如,所述活性是参照hrs序列的至 少20%、40%、60%、70%或80%100%、500%、1000%或更多。“必需的
”ꢀ
氨基酸残基是这样的残基,当其从hrs多肽的参照序列中改变时,导致 亲本分子的活性被消除从而存在小于20%的参照活性。例如,这类必需 的氨基酸残基包括在遍及不同物种的hrs多肽中是保守的那些残基,包 括在不同来源的hrs多肽的一个或多个活性结合位点或基序中是保守的 那些序列。
[0180]
确定抗炎活性的测定,包括来自体外基于细胞的细胞因子释放的常 规测量以及动物研究为本领域中充分确定的(参见,例如wittmann等,jvis exp.(65):e4203.doi:10.3791/4203,2012;feldman等,mol cell.47:585-95, 2012;clutterbuck等,j proteomics.74:704-15,2011,giddings和maitra,jbiomol screen.15:1204-10,2010;wijnhoven等,glycoconj j.25:177-85, 2008;以及frow等,med res rev.24:276-98,2004)且可容易地用于描述 和优化抗炎活性。在所附实施例中也描述了示例性体内实验系统。
[0181]
在一些实施方案中,hrs多肽可以具有一个或多个半胱氨酸取代, 其中一个或多个天然存在的(非-半胱氨酸)残基被半胱氨酸取代(例如,以 改变稳定性、以促进fc片段基于硫醇的缀合、以促进peg或其他分子 基于硫醇的结合)。在一些实施方案中,半胱氨酸取代靠近hrs多肽的 n-末端和/或c-末端(例如,seq id no:1-106、170-181或185-191)或hrs 多肽的其他表面暴露的区域。具体的实施方案包括,相对于seq idno:1-106、170-181或185-191中任一序列的n-末端和/或c-末端,其中0、 1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、 19、20、21、22、23、24或25个氨基酸中的一个或多个残基用半胱氨酸 残基取代。在一些实施方案中,可以通过产生n-末端或c-末端融合蛋白 来将半胱氨酸残基添加至hrs多肽。这类融合蛋白可以为任何长度,但 通常的长度为约1-5或约5-10、约10-20或约20-30个氨基酸。在一些实 施方案中,优选融合至c-末端。
[0182]
表d6中显示了基于hrs多肽hrs(1-60)这类半胱氨酸修饰的蛋白质 的具体的示例性实施方案。该方法直接可应用于表d5的hrs多肽以及 本文所述的其他hrs多肽。
[0183]
[0184][0185]
在一些实施方案中,hrs多肽可包括这样的突变体,其中内源性或 天然存在的半胱氨酸残基已突变成替代氨基酸或缺失。在一些实施方案 中,hrs多肽中半胱氨酸残基的插入或取代可以与其他表面暴露的反应 性半胱氨酸残基的消除相组合。因此,在一些实施方案中,hrs多肽可 以包含例如在cys83、cys174、cys191、cys196、cys224、cys235、cys379、 cys455、cys507和/或cys509处的一个或多个取代和/或缺失(如seq idno:1所定义的),以去除天然存在的半胱氨酸残基。
[0186]
特定实施方案包括具有cys83、cys174、cys191、cys196、cys224、 cys235、cys379、cys455的任何一个或多个的突变或缺失或例如通过缺 失c-末端3个氨基酸(δ507-509)缺失cys507和cys509的seq idno:1-106、170-181或185-191中的任何一种或其变体或片段。在这些位 置的示例性突变包括,例如半胱氨酸至丝氨酸、丙氨酸、亮氨酸、缬氨 酸或甘氨酸的突变。在某些实施方案中,用于特定半胱氨酸取代的氨基 酸残基可选自在其他物种或生物体的hrs直系同源物中发现的天然存在 的取代。表d7中呈现了该类型的示例性取代。
[0187][0188][0189]
在一些实施方案中,被选择来诱变的天然存在的半胱氨酸基于其表 面暴露而选择。因此,在一方面,被选择来取代的半胱氨酸残基选自 cys224、cys235、cys507和cys509。在一些实施方案中,缺失seq id no:1 的最后三个(c-末端)残基以便缺失残基507至509。在一些实施方案中, 半胱氨酸被选择突变或缺失以便消除分子内半胱氨酸对,例如cys174和 cys191。
[0190]
减少表面暴露的半胱氨酸残基的所需半胱氨酸突变/取代(以粗体下 划线所示)的特定另外的实例包括在下表d8中列出的那些。
[0191]
[0192]
[0193]
[0194]
[0195]
[0196]
[0197]
[0198][0199]
在一些实施方案中,这类半胱氨酸取代的突变体被修饰以在限定的 表面暴露位置处改造、插入或以其他方式引入新的表面暴露的半胱氨酸 残基,其中所述引入的残基基本上不会干扰hrs多肽的非经典活性。特 定实例包括例如在以上所述的任何还原的半胱氨酸hrs多肽的n-或c
‑ꢀ
末端处插入(或重新插入回)另外的半胱氨酸残基。在一些实施方案中,这 类n-或c-末端表面暴露的半胱氨酸的插入涉及将全长人hrs的最后1 个、最后2个或最后3个天然存在的c-末端氨基酸重新插入至hrs多肽 的还原的半胱氨酸变体,例如,重新插入序列cic(cys ile cys)的全部或 部分。示例性还原的半胱氨酸突变体包括例如在seq id no:1-106、 170-181或185-191或表d1、d3-d6或d8的任何hrs多肽中在残基 cys174、cys191、cys224和cys235处突变(或缺失)的任何组合和/或 cys507和cys509的缺失或取代(基于全长人hrs(seq id no:1)的编号)。
[0200]
对于一些类型的与异源分子如fc区或peg或其他异源分子的位点
‑ꢀ
特异性缀合或结合,hrs多肽可以具有一个或多个谷氨酰胺取代,其中 一个或多个天然存在的(非-谷氨酰胺)残基被谷氨酰胺取代以例如促进分 子与谷氨酰胺的酰胺基的转谷氨酰胺酶-催化的结合。在一些实施方案中, 在hrs多肽(例如,seq id no:1-106、170-181或185-191或表d1、d3-d6 或d8的hrs多肽)的n-末端和/或c-末端附近引入谷氨酰胺取代。具体 的实施方案包括,相对于seq id1-106、170-181或185-191中任一序列 的n-末端和/或c-末端,其中0、1、2、3、4、5、6、7、8、9、10、11、 12、13、14、15、16、17、18、19、20、21、22、23、24或25个氨基酸 中的一个或多个残基被谷氨酰胺残基取代。这些和相关的hrs多肽也可 包括去除任何天然存在的谷氨酰胺残基(如果需要的话)的取代(例如,保 守取代),从而调节位点-特异性缀合或结合的程度。
[0201]
对于某些类型的与异源分子如fc区或peg或其他异源分子的位点
‑ꢀ
特异性缀合或
结合,hrs多肽可以具有一个或多个赖氨酸取代,其中一 个或多个天然存在的(非-赖氨酸)残基被赖氨酸取代以促进例如分子与赖 氨酸的氨基的基于酰化或烷化的结合。这些方法通常也导致分子结合至 n-末端残基。在一些实施方案中,赖氨酸取代在hrs多肽的n-末端和/ 或c-末端附近(例如,seq id no:1-106、170-181或185-191或者表d1、 d3-d6或d8的hrs多肽)。具体的实施方案包括其中相对于seqid1-106、170-181或185-191中任一序列(或表d1、d3-d6或d8的hrs 多肽)的n-末端和/或c-末端的0、1、2、3、4、5、6、7、8、9、10、11、 12、13、14、15、16、17、18、19、20、21、22、23、24或25个氨基酸 中的一个或多个残基被赖氨酸残基取代。这些和相关的hrs多肽也可包 括去除任何天然存在的赖氨酸残基(如果需要的话)的取代(例如,保守取 代),从而调节位点-特异性缀合或结合的程度。
[0202]
与hrs多肽的位点-特异性缀合也可以通过取代hrs多肽的一种或 多种溶剂可及的表面氨基酸进行。可以基于预测的溶剂可及性,使用 sppider服务器(http://sppider.cchmc.org/),采用公布的示例性hrs多肽 的晶体结构(参见xu等,structure.20:1470-7,2012;和美国申请第 61/674,639号),来确定合适的溶剂可及的氨基酸。基于该分析,表面上 的几个氨基酸可能用作突变位点以引入适用于缀合或结合的官能团。基 于晶体结构可计算氨基酸的表面可及性分数,其中较高的分数表示较好 的可及性。在具体实施方案中,较高的分数(例如,》40)为优选的。因此, 在一些实施方案中,表面可及性分数大于40的氨基酸位置可以用于引入 半胱氨酸、赖氨酸、谷氨酰胺或其他非天然存在的氨基酸。
[0203]
在具体实施方案中,溶剂可及的表面氨基酸选自:丙氨酸、甘氨酸 和丝氨酸,以及能够用包括但不限于半胱氨酸、谷氨酰胺或赖氨酸的天 然存在的氨基酸或者被优化用于位点特异性缀合或结合的非天然存在的 氨基酸来取代。
[0204]
在多种实施方案中,本发明涵盖在hrs多肽的任何氨基酸位置处凭 借取代非天然存在的氨基酸而进行的位点-特异性缀合或结合,所述非天 然存在的氨基酸包含与连接至异源分子如fc区或peg或其他异源分子 的官能团形成共价键的官能团。非天然氨基酸能够在,例如相对于seq idno:1-106、170-181或185-191中任一序列(或表d1、d3-d6或d8的hrs 多肽)的n-末端和/或c-末端的0、1、2、3、4、5、6、7、8、9、10、11、 12、13、14、15、16、17、18、19、20、21、22、23、24或25个氨基酸 中的一个或多个残基处插入或取代;在seq id no:1-106、170-181或 185-191中任一序列(或表d1、d3-d6或d8的hrs多肽)的n-末端和/或 c-末端处插入或取代,或者如本文所述的溶剂可及的表面氨基酸。
[0205]
在具体实施方案中,非天然存在的氨基酸包括但不限于除硒代半胱 氨酸和以下20个遗传编码的α-氨基酸外的任何氨基酸、修饰的氨基酸或 氨基酸类似物:丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷 氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、蛋氨 酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸、缬氨酸。α
‑ꢀ
氨基酸的一般结构用以下通式表示:
[0206][0207]
非天然氨基酸通常为具有上述通式的任何结构,其中r基团为除了 20个天然氨基酸所用基团以外的任何取代基。参见,例如生物化学教科 书,如对于20个天然氨基酸的结
构,参见biochemistry,l.stryer,第3 版.1988,freeman and company,new york。注意:本文公开的非天然氨 基酸可为除了上述20个α-氨基酸以外的天然存在的化合物。由于本文公 开的非天然氨基酸通常仅在侧链上不同于天然氨基酸,非天然氨基酸与 其他氨基酸例如天然的或非天然氨基酸形成酰胺键,其方式与天然存在 的蛋白中形成酰胺键的方式一样。然而,非天然氨基酸具有不同于天然 氨基酸的侧链。例如,上述通式中的r任选地包括:烷基-、芳基-、芳基 卤化物、乙烯基卤化物、烷基卤化物、乙酰基、酮、氮丙啶、腈、硝基、 卤化物、酰基-、酮基-、叠氮基-、羟基-、肼、氰基-、卤代-、酰肼、烯 基、炔基、醚、硫醚、环氧化物、砜、硼酸、硼酸酯、甲硼烷、苯基硼 酸、巯基、硒基-、磺酰基-、硼酸酯(borate)、硼酸酯(boronate)、磷基、 膦酰基、膦、杂环基、吡啶基、萘基、二苯甲酮、受限环(constrained ring) 如环辛炔、硫酯、烯酮(enone)、亚胺、醛、酯、硫代酸、羟胺、氨基、 羧酸、α-酮基羧酸、α-或β-不饱和酸和酰胺、乙醛酰胺或有机硅烷基等或 它们的任何组合。
[0208]
非天然氨基酸的特定实例,包括但不限于,p-乙酰基-l-苯丙氨酸、 o-甲基-l-酪氨酸、l-3-(2-萘基)丙氨酸、3-甲基-苯丙氨酸、o-4-烯丙基-l
‑ꢀ
酪氨酸、4-丙基-l-酪氨酸、三o-乙酰基-glcnacβ-丝氨酸、β-o-glcnac-l
‑ꢀ
丝氨酸、三o-乙酰基-galnac-α-苏氨酸、α-galnac-l-苏氨酸、l-多巴、 氟化苯丙氨酸、异丙基-l-苯丙氨酸、p-叠氮基-l-苯丙氨酸、p-酰基-l-苯 丙氨酸、p-苯甲酰-l-苯丙氨酸、l-磷酸丝氨酸、磷酰丝氨酸、磷酰酪氨 酸、p-碘代-苯丙氨酸、p-溴代苯丙氨酸、p-氨基-l-苯丙氨酸、异丙基-l
‑ꢀ
苯丙氨酸、下文或本文其他地方所列举的那些等。
[0209]
因此,可以选择这样的非天然存在的氨基酸,其包含与所需分子(例 如,fc区,peg)的任何优选的官能团形成共价键的官能团。一旦选定, 非天然氨基酸可购自供货商或化学合成。任何数目的非天然氨基酸可以 被掺入靶分子中且可以根据待被结合的所需分子的数目而改变。分子可 以与所有或仅一些非天然氨基酸结合。另外,根据所需结果,相同或不 同的非天然氨基酸可以掺入hrs多肽中。在某些实施方案中,约1、2、 3、4、5、6、7、8、9、10或更多个非天然氨基酸掺入hrs多肽中,这 些非天然氨基酸的任一个或全部可以缀合至包含所需官能团的分子。
[0210]
在某些方面,可利用非天然氨基酸的用途以修饰(例如,增加)选定的 hrs多肽的非经典活性,或改变蛋白质的体内或体外半衰期。非天然氨 基酸也可用于促进hrs蛋白的(选择性)化学修饰(例如,聚乙二醇化),如 本文他处所述。例如,某些非天然氨基酸允许诸如fc区或peg的聚合 物与给定蛋白的选择性结合,以此改善其药代动力学特性。
[0211]
氨基酸类似物和模拟物的特定实例的描述可参见,例如roberts和 vellaccio,the peptides:analysis,synthesis,biology,gross和meinhofer编, 第5卷,p.341,academic press,inc.,new york,n.y.(1983),其整卷通过引 用并入本文。其他实例包括全烷基化的氨基酸,尤其是全甲基化的氨基 酸。参见,例如,combinatorial chemistry,wilson和czarnik编,ch.11,p. 235,john wiley&sons inc.,new york,n.y.(1997),其整本书通过引用并 入本文。其他实例包括酰胺部分(以及,因此,所得肽的酰胺骨架)被取代 的氨基酸,例如,通过糖环、类固醇、苯二氮卓或碳环。参见,例如burger’smedicinal chemistry and drug discovery,manfred e.wolff编,ch.15,pp. 619-620,john wiley&sons inc.,new york,n.y.(1995),其整本书通过引 用并入本文。合成肽、多肽、模拟肽和蛋白质的方法为本领域熟知的(参 见,例如,美国专利第5,420,109号;m.bodanzsky,
principles of peptidesynthesis(第1版&第2修订版),springer-verlag,new york,n.y.(1984& 1993),参见第7章;stewart和young,solid phase peptide synthesis,(第2 版),pierce chemical co.,rockford,ill.(1984),其各自通过引用并入本文)。 因此,本发明的hrs多肽可以由天然存在的和非天然存在的氨基酸以及 氨基酸类似物和模拟物组成。
[0212]
多核苷酸
[0213]
某些实施方案涉及编码hrs多肽或hrs-fc融合蛋白的多核苷酸。 还包括单独地或与hrs编码序列一起编码本文所述的fc区中的任何一 个或多个的多核苷酸。除了其他应用,这些实施方案可以用于重组产生 所需的hrs、fc区或hrs-fc多肽或者其变体,或在选定的细胞或对象 中表达所述hrs、fc区或hrs-fc多肽。本领域技术人员应理解,由于 遗传密码的简并性,有许多核苷酸序列编码如本文所述的hrs多肽 hrs-fc融合蛋白。这些多核苷酸中的一些可能与任何天然基因的核苷酸 序列具有最小的同源性。然而,本发明特别地包括由于密码子使用差异 而不同的多核苷酸,例如针对人、酵母或细菌密码子选择而优化的多核 苷酸。
[0214]
本领域技术人员应理解,多核苷酸可以为单链的(编码的或反义的) 或双链的,可以为dna(基因组的、cdna或合成的)或rna分子。本发 明的多核苷酸内可存在但不必需存在其他编码或非编码序列;且多核苷 酸可以但不必需连接至其他分子和/或支持材料(support material)。
[0215]
多核苷酸可以包含天然序列(即,编码hrs-fc融合多肽或其部分的 内源序列)或可以包含此种序列的变体或生物功能等同物。多核苷酸变体 可以含有一种或多种取代、添加、缺失和/或插入,如下文进一步描述, 优选为使得编码的多肽活性相对于未修饰的多肽基本上没有降低。
[0216]
在另外的实施方案中,本发明提供了分离的多核苷酸,其包含与hrs 多肽或hrs-fc融合蛋白相同或互补的不同长度的连续序列伸展,其中所 述分离的多核苷酸编码如本文所述截短的hrs多肽。
[0217]
因此,多个多核苷酸能够编码本发明的hrs多肽、fc区和融合蛋白。 而且,所述多核苷酸序列可由于不同理由而被操作。实例包括但不限于, 整合优选的密码子以促进所述多核苷酸在多种生物体中的表达(通常参见 nakamura等,nuc.acid.res.28:292,2000)。此外,可掺入沉默突变以便引 入、或消除限制性位点,降低cpg二核苷酸基序的密度(参见,例如 kameda等,biochem.biophys.res.commun.349:1269-1277,2006)或降低单 链序列形成茎环结构的能力:(参见,例如,zuker m.,nucl.acidres.31:3406-3415,2003)。此外,可通过在起始密码子处包含入kozak共 有序列(即(a/g)cc(a/g)ccatgg(seq id no:199)进一步优化哺乳动物表 达。可用于该目的的kozak共有序列是本领域已知的(mantyh等,pnas 92:2662-2666,1995;mantyh等,prot.exp.&purif.6:124,1995)。下表d9 中提供了多种hrs多肽的示例性野生型和密码子优化的形式。
[0218]
[0219]
[0220]
[0221]
[0222]
[0223]
[0224]
[0225]
[0226]
198;也参见实施例) 具有至少约30%、40%50%、55%、60%、65%、70%,通常至少约75%、 80%、85%,理想地约90%-95%或更多,且更适宜地约98%或更多的序 列同一性,所述同一性通过本文其他地方描述的序列比对程序使用默认 参数测得。在某些实施方案中,变体与参照序列可以相差约1、2、3、4、 5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、 22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、 38、39、40、41、41、43、44、45、46、47、48、49、50、60、70、80、 90、100(包括其间的所有整数)个或更多个碱基。在某些实施方案中,如 当所述多核苷酸变体编码具有非经典活性的hrs多肽时,相对于未修饰 的多肽,编码的hrs多肽的所需活性基本上没有降低。对编码的多肽的 活性的影响通常可以根据本文所述进行评估。在一些实施方案中,变体 可改变hrs多肽的聚集状态,例如以提供在不同实施方案中主要以单体、 二聚体或多聚体存在的hrs多肽。
[0231]
某些实施方案包括在下文所述的严格条件下与参照hrs多核苷酸序 列(例如,seq id no:111-127、182-184、192-198;也参见实施例)或其 互补物杂交的多核苷酸。如本文所用,术语“在低严格条件、中等严格条 件、高严格条件或极高严格条件下杂交”描述了用于杂交和洗涤的条件。 进行杂交反应的指导可参见ausubel等,(1998,同上),第6.3.1-6.3.6部分。 水性和非水性方法描述于该参考文献,以及这两种方法任一种都能够被 使用。
[0232]
本文提及的低严格条件包括和涵盖至少约1%v/v到至少约15%v/v 的甲酰胺,和至少约1m到至少约2m盐用于在42℃杂交,以及至少约 1m到至少约2m盐用于在42℃洗涤。低严格条件还可以包括1%牛血 清白蛋白(bsa)、1mm edta、0.5m nahpo4(ph 7.2)、7%sds用于在 65℃杂交,以及(i)2
×
ssc、0.1%sds;或(ii)0.5%bsa、1mm edta、 40mm nahpo4(ph 7.2)、5%sds用于在室温洗涤。低严格条件的一个 实施方案包括在6
×
氯化钠/柠檬酸钠(ssc)中于约45℃杂交,然后在0.2
ꢀ×
ssc、0.1%sds中于至少50℃洗涤两次(对于低严格条件,洗涤的温 度可升高至55℃)。
[0233]
中等严格条件包括和涵盖至少约16%v/v到至少约30%v/v的甲酰 胺,和至少约0.5m到至少约0.9m盐用于在42℃杂交,以及至少约0.1 m到至少约0.2m盐用于在55℃洗涤。中等严格条件还可以包括1%的 牛血清白蛋白(bsa)、1mm edta、0.5m nahpo4(ph 7.2)、7%sds用 于在65℃杂交,以及(i)2
×
ssc、0.1%sds;或(ii)0.5%bsa、1mmedta、40mm nahpo4(ph 7.2)、5%sds用于在60-65℃洗涤。中等严 格条件的一个实施方案包括在6
×
ssc中于约45℃杂交,然后在0.2
×ꢀ
ssc、0.1%sds中于60℃洗涤一次或多次。高严格条件包括和涵盖至少 约31%v/v到至少约50%v/v的甲酰胺,和约0.01m到约0.15m盐用于 在42℃杂交,以及约0.01m到约0.02m盐用于在55℃洗涤。
[0234]
高严格条件也可以包括1%bsa、1mm edta、0.5m nahpo4(ph7.2)、7%sds用于在65℃杂交,以及(i)0.2
×
ssc、0.1%sds;或(ii)0.5% bsa、1mm edta、40mm nahpo4(ph 7.2)、1%sds用于在大于65℃ 的温度洗涤。高严格条件的一个实施方案包括在6
×
ssc中于约45℃杂 交,然后在0.2
×
ssc、0.1%sds中于65℃洗涤一次或多次。极高严格 条件的一个实施方案包括在0.5m磷酸钠、7%sds中于65℃杂交,然 后在0.2
×
ssc、1%sds中于65℃洗涤一次或多次。
[0235]
其他严格条件为本领域所熟知,且本领域技术人员应理解,可操作 多种因素以优化杂交的特异性。优化最终洗涤的严格性可用于确保高程 度的杂交。详细的实例,可参见ausubel等,同上,第2.10.1至2.10.16 页,和sambrook等.(1989,同上),第1.101至1.104部
分。尽管严格的洗 涤通常在约42℃至68℃的温度进行,本领域技术人员应理解,其他温 度也可适用于严格条件。最大的杂交率通常发生在低于dna-dna杂合 体形成的tm约20℃至25℃。本领域公知,tm为解链温度,或两条互补 多核苷酸序列解离的温度。用于估算tm的方法是本领域熟知的(参见 ausubel等,同上,第2.10.8页)。
[0236]
通常,完美匹配的双链dna的tm可以通过下式近似预测:tm=81.5 +16.6(log
10
m)+0.41(%g+c)-0.63(%甲酰胺)
–
(600/长度),其中:m 为na+浓度,优选为0.01摩尔至0.4摩尔的范围;%g+c为鸟嘌呤和胞 嘧啶碱基之和占总碱基数目的百分比,其在30%至75%g+c的范围内;% 甲酰胺是甲酰胺浓度的体积百分比;长度为dna双链体中碱基对的数 目。每增加1%的随机错配碱基对数目,双链dna的tm降低约1℃。对 于高严格条件通常在tm–
15℃进行洗涤,或对于中等严格条件在tm–ꢀ
30℃进行洗涤。
[0237]
在杂交程序的一个实例中,包含固定的dna的膜(例如,硝酸纤维 素膜或尼龙膜)于42℃在含有标记探针的杂交缓冲液(50%去离子甲酰 胺、5
×
ssc、5
×
丹哈德溶液(denhardt’s solution)(0.1%聚蔗糖、0.1%聚 乙烯吡咯烷酮和0.1%牛血清白蛋白)、0.1%sds和200mg/ml变性的鲑 鱼精细胞dna)中杂交过夜。然后将所述膜进行两次连续的中等严格条件 洗涤(即,在2
×
ssc、0.1%sds中于45℃洗涤15min,然后在2
×
ssc、 0.1%sds中于50℃洗涤15min),然后进行两次连续的更高的严格条件 洗涤(即,在0.2
×
ssc、0.1%sds中于55℃洗涤12min,然后在0.2
×
ssc 和0.1%sds溶液中于65-68℃洗涤12min)。
[0238]
hrs多肽和hrs-fc缀合物的产生
[0239]
hrs-fc缀合多肽可以通过本领域技术人员已知的任何合适程序制 备,例如通过使用标准的固相肽合成(merrifield,j.am. chem.soc.85:2149-2154(1963)),或通过使用遗传修饰的宿主的重组技术。 蛋白合成可采用人工技术或通过自动化技术进行。例如可采用appliedbiosystems 431a肽合成仪(perkin elmer)实现自动化合成。可选择地,可 分别化学合成各种片段,并采用化学方法进行组合以制备所需的分子。
[0240]
也可通过熟知的技术在合适的宿主细胞中表达编码考虑中的hrs多 肽或hrs-fc缀合物的dna或rna序列来制备hrs-fc缀合物。可以通 过已建立的标准方法来合成制备编码所述hrs-fc缀合物或hrs多肽的 多核苷酸序列,例如亚磷酸胺法,其描述于beaucage等,tetrahedronletters 22:1859-1869,1981;或matthes等,embo journal 3:801-805,1984 描述的方法。根据亚磷酸胺法,例如在自动化dna合成仪中合成了寡核 苷酸,进行纯化、双链化并连接以形成合成的dna构建体。可选地,所 述dna或rna构建体可采用标准重组分子生物技术进行构建,包括限 制酶介导的克隆和基于pcr的基因扩增。在一些实施方案中,对于直接 mrna介导的表达,多核苷酸可以被封装在纳米颗粒或脂质体中以能够 被有效递送且摄取入细胞,所述多核苷酸任选地包含修饰的帽或尾部结 构以增强稳定性和翻译。
[0241]
多核苷酸序列也可以为混合的基因组、cdna、rna和合成来源的 那些。例如,可以将编码前导肽的基因组或cdna序列连接至编码所述 hrs多肽或hrs-fc缀合物的基因组或cdna序列,此后可以通过在某 个位点根据熟知程序插入编码所需氨基酸序列的合成寡核苷酸来修饰所 述dna或rna序列,以用于进行同源重组,或优选地采用合适的寡核 苷酸通过pcr来产生所需的序列。在一些实施方案中,可将信号序列包 含在编码序列前面。该序列编码位于编码序列n-末端的信号肽,其与宿 主细胞交流从而引导所述多肽至细胞表面或将所述多肽分泌至培养基 中。通常所述信号肽在蛋白离开宿主细胞之前被该细胞切割下
来。信号 肽可发现于原核生物和真核生物的多种蛋白中。
[0242]
多种表达载体/宿主系统是已知的且可用于容纳和表达多核苷酸序 列。这些包括但不限于,微生物如用重组噬菌体、质粒或粘粒dna表达 载体转化的细菌;用酵母表达载体转化的酵母;用病毒表达载体(例如, 杆状病毒)感染的昆虫细胞系统;用病毒表达载体(例如,花椰菜花叶病毒 camv;烟草花叶病毒tmv)或用细菌表达载体(例如,ti或pbr322质粒) 转化的植物细胞系统;或者动物细胞系统,包括用病毒、质粒、附加体 或整合的表达载体转化的哺乳动物细胞,且更特别地人细胞系统。
[0243]
出现在表达载体中的“控制元件”或“调控序列”为载体的非翻译区— 增强子、启动子、5
′
和3
′
非翻译区
‑‑
其与宿主细胞蛋白相互作用以进行转 录和翻译。这类元件在其强度和特异性上可能不同。根据所用的载体系 统和宿主,可以使用任何数目的合适转录和翻译元件,包括组成型和诱 导型启动子。例如,当在细菌系统中克隆时,可以使用诱导型启动子如 pbluescript噬菌粒(stratagene,la jolla,calif.)或psport1质粒(gibcobrl,gaithersburg,md.)的杂合lacz启动子等。在哺乳动物细胞系统中, 通常优选来自哺乳动物基因或来自哺乳动物病毒的启动子。如果需要生 成包含编码多肽的序列的多个拷贝的细胞系,基于sv40或ebv的载体 可有利地与适当的可选择标记一起使用。
[0244]
某些实施方案可以使用基于大肠杆菌的表达系统(参见,例如, structural genomics consortium等,nature methods.5:135-146,2008)。这些 和相关的实施方案可以部分地或完全地基于不依赖连接反应的克隆方法 (lic),以产生合适的表达载体。在特定实施方案中,蛋白质表达可以通 过t7 rna聚合酶(例如,pet载体系列),或具有替代启动子(包括例如 tac启动子)的修饰的pet载体来控制。这些和相关的实施方案可以利用 表达宿主菌株bl21(de3)(bl21的λde3溶原菌),其支持t7-介导的表 达,且为了改善的目标蛋白稳定性,其缺乏lon和ompt蛋白酶。还包括 携带很少用于大肠杆菌中的编码trna的质粒的表达宿主菌株,如 rosetta
tm
(de3)和rosetta 2(de3)菌株。在一些实施方案中,可以利用 其他大肠杆菌菌株,包括其他大肠杆菌k-12菌株,如w3110(f-λ
‑ in(rrnd-rrne)1rph-1)和ut5600(f、arac14、leub6(am)、seca206(azir)、 lacy1、proc14、tsx67、δ(omptfepc)266、enta403、glnx44(as)、λ-、 trpe38、rfbc1、rpsl109(strr)、xyla5、mtl-1、thie1),这可导致发酵期 间翻译后修饰的水平降低。可通过使用以商标核酸酶和 蛋白提取试剂出售的试剂,改善细胞溶解和样品处理。对 于细胞培养,自诱导培养基可改善许多表达系统的效率,包括高通量表 达系统。这种类型的培养基(例如,overnight express
tm
自诱导系统) 通过代谢转换逐步引发蛋白表达,而无需加入人工诱导剂如iptg。
[0245]
具体的实施方案使用六组氨酸标签(如以商标融合物出售 的那些),然后是固定化金属亲和层析(imac)纯化或相关技术。然而,在 某些方面,临床级别的蛋白可分离自大肠杆菌包涵体,使用或没有使用 亲和标签(参见,例如,shimp等,protein expr purif.50:58-67,2006)。作 为进一步实例,某些实施方案可以使用冷休克诱导的大肠杆菌高收率生 产系统,因为大肠杆菌中过表达的蛋白在低温下提高了其溶解度和稳定 性(参见,例如,qing等,nature biotechnology.22:877-882,2004)。
[0246]
还包括高密度的细菌发酵系统。例如,高细胞密度培养真氧罗尔斯 通氏菌(ralstonia eutropha)允许以大于150g/l的细胞密度进行蛋白生产, 且以大于10g/l的滴
76,atcccrl-1587);人宫颈癌细胞(hela,atcc ccl 2);犬肾细胞(mdck, atcc ccl 34);布法罗大鼠肝细胞(brl 3a,atcc crl 1442);人肺细 胞(w138,atcc ccl 75);人肝细胞(hep g2,hb 8065);小鼠乳腺瘤(mmt 060562,atcc ccl51);tr1细胞(mather等,annalsn.y.acad.sci.383:44-68,1982);mrc 5细胞;fs4细胞;和人肝癌系(hepg2)。其他可用的哺乳动物宿主细胞系包括中国仓鼠卵巢(cho)细胞,包 括dhfr-cho细胞(urlaub等,pnas usa.77:4216,1980);和骨髓瘤细胞 系如nso和sp2/0。对于某些适于抗体制备的哺乳动物宿主细胞系的综 述,参见,例如yazaki和wu,methods in molecular biology,第248卷(b. k.c lo编,humana press,totowa,n.j.,2003),pp.255-268。某些优选的哺 乳动物细胞表达系统包括基于cho和hek293细胞的表达系统。哺乳动 物表达系统可利用在例如方瓶(t-flask)、滚瓶或细胞工厂(cell factories)中 贴附的细胞系,或者在例如1l和5l转瓶(spinner)、5l、14l、40l、100l 和200l搅拌的罐式生物反应器或20/50l和100/200l wave生物反应器 中的悬浮培养物,以及本领域已知的其他物质。
[0251]
还包括无细胞的蛋白表达方法。这些和相关的实施方案通常利用纯 化的rna聚合酶、核糖体、trna和核糖核苷酸。这些试剂可通过例如 从细胞或基于细胞的表达系统中提取来制备。
[0252]
此外,宿主细胞株可以针对其调节插入的序列的表达或以所需方式 处理表达的蛋白的能力进行选择。多肽的这类修饰包括但不限于,翻译 后修饰如乙酰化、羧化、糖基化、磷酸化、脂化、酰化、或插入非天然 存在的氨基酸(通常参见美国专利第7,939,496、7,816,320、7,947,473、 7,883,866、7,838,265、7,829,310、7,820,766、7,820,766、7,7737,226, 7,736,872、7,638,299、7,632,924和7,230,068号)。在一些实施方案中, 这类非天然存在的氨基酸可插入到cys130位置。切割该蛋白的“前原”形 式的翻译后加工也可以用于促进正确的插入、折叠和/或功能。除了细菌 细胞以外,可选择具有或甚至缺乏针对这类翻译后活性的特定细胞机构 和特性机制的不同宿主细胞,如酵母、cho、hela、mdck、hek293 和w138,以确保正确地修饰和加工外源蛋白。
[0253]
重组细胞产生的hrs多肽或hrs-fc缀合物可根据本领域已知的各 种技术来纯化和表征。用于进行蛋白纯化和分析蛋白纯度的示例性系统 包括快速蛋白液相色谱(fplc)(例如,akta和bio-rad fplc系统)、高 压液相色谱(hplc)(例如,beckman和waters hplc)。用于纯化的示例 性化学方法包括离子交换色谱(例如,q、s)、尺寸排阻色谱、盐梯度、 亲和纯化(例如,ni、co、flag、麦芽糖、谷胱甘肽、蛋白a/g)、凝胶 过滤、反相、陶瓷离子交换色谱和疏水作用柱(hic)以及本领 域已知的其他方法。在本文实施例部分也公开了几种示例性方法。
[0254]
hrs-fc缀合物
[0255]
如上所述,本发明的实施方案涉及hrs-fc缀合物,其包含共价连接 至一个或多个hrs多肽的至少一个fc区。hrs-fc缀合物的实例包括融 合蛋白和多种形式的化学交联的蛋白。众多的fc区序列可以用于本发明 的hrs-fc缀合物,包括来自多个物种的野生型序列及其变体、片段、杂 合体和化学修饰形式。所述hrs-fc多肽也可以(任选地)包含一个或多个 连接子,其通常把一个或多个fc区与所述一个或多个hrs多肽隔开, 所述连接子包括肽连接子和化学连接子,如本文所述和本领域所知的。 应理解,在任何这些hrs-fc缀合物中,hrs多肽的天然n或c末端氨 基酸,或fc结构域的天然n或c-氨基酸可以缺失和/或被例如非
天然氨 基酸替换以促进表达和/或克隆或用作两个蛋白之间的连接子序列。
[0256]
相对于未缀合的或未修饰的hrs多肽,例如没有与其连接的fc区 的相同或相似序列的相应hrs多肽,hrs-fc缀合多肽可提供多种优势。 仅以说明的方式,相对于具有相同或相似序列的未修饰的hrs多肽,一 个或多个fc区的共价连接可改变(例如,增加、降低)所述hrs多肽的溶 解度、半衰期(例如,在血清中、在选定的组织中、在储藏条件如室温或 冷冻下的测试管中)、二聚化或多聚化特性、一种或多种生物活性,例如 通过提供fc区相关的效应器功能(例如,经典补体级联激活、通过fc受 体(fcr)与免疫效应细胞相互作用、免疫球蛋白的区室化)、细胞吸收、胞 内运输、组织分布和/或生物利用度。在某些方面,fc区可赋予与补体依 赖性细胞毒性(cdc)、抗体依赖性细胞介导的细胞毒性(adcc)和/或抗体 依赖性细胞介导的吞噬作用(adcp)相关的效应器功能,这些被认为在清 除特定靶细胞如肿瘤细胞和被感染的细胞中起作用。
[0257]
某些实施方案使用hrs-fc融合蛋白。“融合蛋白”在本文其他地方有 定义且为本领域熟知的,以及制备融合蛋白的方法(对于fc融合蛋白相关 的一般公开和方法,参见,例如美国专利第5,116,964、5,428,130、 5,455,165、5,514,582、6,406,697、6,291,212和6,300,099号)。在hrs-fc 融合蛋白中,所述fc区可融合至所述hrs多肽的n-末端、c-末端或两 者。在一些实施方案中,一个或多个fc区可在相对于hrs序列内部进 行融合,例如,通过将fc区放置于第一hrs序列(例如结构域)和第二 hrs序列(例如结构域)之间,其中第一hrs序列融合至该fc区的n-末 端,而第二hrs序列融合至该fc区的c-末端。在特定实施方案中,所 述第一和第二hrs序列是相同的。在其他实施方案中,所述第一和第二 hrs序列是不同的(例如,它们包括所述hrs多肽的不同功能结构域)。 某些hrs-fc融合蛋白也可包括另外的异源蛋白质序列,即非-fc区和非
ꢀ‑
hrs多肽序列。
[0258]
术语“hrs-fc”可表示,但不一定表示,所述fc区与hrs多肽的n
‑ꢀ
末端或c-末端结合。例如,在某些情况下,术语“fc-hrs”表示fc区融 合至hrs多肽的n-末端,而术语“hrs-fc”表示fc区融合至hrs多肽的 c-末端。然而,每个术语均可更一般地用于指fc区和hrs多肽的任何 融合蛋白或缀合物。
[0259]
在一些实施方案中,hrs-fc融合蛋白可以包含偶联至单个fc结构 域的hrs多肽的串联重复拷贝,其任选地通过连接肽隔开。表d10中提 供了示例性串联重复的hrs-fc融合蛋白。实例中说明了特定串联重复的 hrs-fc缀合物的制备和序列。
[0260]
基化位点,从而赋予铰链区多肽对肠蛋白酶显著的抗性。ch2结构域的铰 链近侧区的残基也能影响免疫球蛋白和其各自fc受体之间相互作用的特 异性(参见,例如shin等,intern.rev.immunol.10:177-186,1993)。
[0266]
因此,如本文所用,术语“fc区”或“fc片段”或“fc”是指含有来自一 个或多个选定的免疫球蛋白(包括其片段和变体及其组合)的ch2区、ch3区和/或ch4区中的一个或多个的蛋白。“fc区”也可以包含免疫球蛋白重 链恒定区的一个或多个铰链区。在某些实施方案中,fc区不包含免疫球 蛋白的ch1、c
l
、v
l
和/或vh区中的一个或多个。
[0267]
fc区可源自任何一个或多个免疫球蛋白类型的ch2区、ch2区、ch4区和/或铰链区,所述免疫球蛋白类型包括但不限于iga、igd、ige、igg、 igm,包括其亚类及其组合。在一些实施方案中,所述fc区源自iga免 疫球蛋白,包括iga1和/或iga2亚类。在某些实施方案中,所述fc区 源自igd免疫球蛋白。在具体实施方案中,所述fc区源自ige免疫球蛋 白。在一些实施方案中,所述fc区源自igg免疫球蛋白,包括igg1、igg2、 igg2、igg3和/或igg4亚类。在某些实施方案中,所述fc区源自igm免 疫球蛋白。图2显示了来自人iga1(seq id no:156)、iga2(seq idno:157)、igm(seq id no:158)、igg1(seq id no:159)、igg2(seq idno:160)、igg3(seq id no:161)、igg4(seq id no:162)和ige(seq idno:163)的fc区比对。
[0268]
某些fc区显示了对一种或多种fc-受体(fcr)的特异性结合。fc受体 类型的实例包括,fcγ受体(fcγr)、fcα受体(fcαr)、fcε受体(fcεr)和新 生儿fc受体(fcrn)。例如,相对于fcαr、fcεr和/或fcrn,某些fc区 具有增加的对一个或多个fcγr的结合(或亲和力)。在一些实施方案中, 相对于一个或多个fcγr、fcεr和/或fcrn,fc区具有增加的对fcαr的 结合。在其他实施方案中,相对于一个或多个fcγr、fcαr和/或fcrn, fc区具有增加的对fcεr(例如,fcαri)的结合。在具体实施方案中,相 对于一个或多个fcγr、fcαr和/或fcεr,fc区具有增加的对fcrn的结 合。在某些实施方案中,fc区对一个或多个选定的fcr的结合(或亲和力) 相对于其对一个或多个不同fcr的结合(或亲和力)通常增加约1.5x、2x、 2.5x、3x、3.5x、4x、4.5x、5x、6x、7x、8x、9x、10x、15x、20x、25x、 30x、40x、50x、60x、70x、80x、90x、100x、200x、300x、400x、500x、 600x、700x、800x、900x、1000x或更多倍(包括其间的所有整数)。
[0269]
fcγr的实例包括fcγri、fcγriia、fcγriib、fcγriic、fcγriiia和 fcγriiib。fcγri(cd64)表达于巨噬细胞和树突状细胞,且在吞噬作用、 呼吸爆发、细胞因子刺激和树突状细胞内吞运输中起作用。fcγri的表达 被gm-csf和γ-干扰素(γ-ifn)上调,且被白介素-4(il-4)下调。fcγriia 表达于多形核白细胞(pmn)、巨噬细胞、树突状细胞和肥大细胞。fcγriia 在吞噬作用、呼吸爆发、细胞因子刺激中起作用。fcγriia的表达被 gm-csf和γ-ifn上调,而被il-4降低。fcγiib表达于b细胞、pmn、 巨噬细胞和肥大细胞。fcγiib抑制免疫受体酪氨酸活化基序(itam)介导 的反应,因此其为抑制性受体。fcγriic的表达被静脉内免疫球蛋白(ivig) 和il-4上调,而被γ-ifn降低。fcγriic表达于nk细胞。fcγriiia表达 于自然杀伤(nk)细胞、巨噬细胞、肥大细胞和血小板。该受体参与吞噬 作用、呼吸爆发、细胞因子刺激、血小板聚集和细胞脱颗粒以及nk-介 导的adcc中。fcγriii的表达被c5a、tgf-β和γ-ifn上调,且被il-4 下调。fcγriiib是表达于pmn上的与gpi连接的受体。
[0270]
相对于fcγriia、fcγriib、fcγriic、fcγriiia和/或fcγriiib,某些 fc区具
有增加的对fcγri的结合。相对于fcγri、fcγriib、fcγriic、 fcγriiia和/或fcγriiib,一些实施方案具有增加的对fcγriia的结合。相 对于fcγri、fcγriia、fcγriic、fcγriiia和/或fcγriiib,特别的fc区具 有增加的对fcγriib的结合。相对于fcγri、fcγriia、fcγriib、fcγriiia 和/或fcγriiib,某些fc区具有增加的对fcγriic的结合。相对于fcγri、 fcγriia、fcγriib、fcγriic和/或fcγriiib,一些fc区具有增加的对fcγriiia 的结合。相对于fcγri、fcγriia、fcγriib、fcγriic和/或fcγriiia,特定 的fc区具有增加的对fcγriiib的结合。
[0271]
fcαr包括fcαri(cd89)。fcαri存在于中性粒细胞、嗜酸性粒细胞、 单核细胞、某些巨噬细胞(例如,库普弗(kupffer)细胞)和某些树突状细胞 表面上。fcαri由两个胞外ig-样结构域组成,是免疫球蛋白超家族和多 链免疫识别受体(mirr)家族的成员,并通过与两条fcrγ信号传导链结合 来传导信号。
[0272]
fcεr包括fcεri和fcεrii。高亲合力受体fcεri是免疫球蛋白超家 族的成员,表达于上皮的朗格汉斯细胞、嗜酸性粒细胞、肥大细胞和嗜 碱性粒细胞,且在控制过敏反应中起主要作用。fcεri还表达于抗原呈递 细胞,并调节促炎症细胞因子的产生。低亲和力受体fcεrii(cd23)是作 为膜结合的或可溶性受体起作用的c型凝集素。fcεrii调节b细胞生长 和分化,并阻止嗜酸性粒细胞、单核细胞和嗜碱性粒细胞与ige结合。 相对于fcεrii,某些fc区具有增加的对fcεri的结合。相对于fcεri, 其他fc区具有增加的对fcεrii的结合。
[0273]
下表f1概括了某些fcr的特性。
[0274]
[0275][0276]
fc区可源自任何动物的免疫球蛋白分子,包括脊椎动物如哺乳动物 例如牛、山羊、猪、犬、小鼠、兔、仓鼠、大鼠、豚鼠、非-人灵长类和 人。来自示例性野生型人iga1、iga2、
igd、ige、igg1、igg2、igg3、 igg4和igm免疫球蛋白的ch2、ch3、ch4和铰链区的氨基酸序列显示 如下(seq id no:128-154)。
[0277]
seq id no:128为人iga1铰链区的氨基酸序列 (vpstpptpspstpptpsps)。
[0278]
seq id no:129为人iga1 ch2区的氨基酸序列 (cchprlslhrpaledlllgseanltctltglrdasgvtftwtpssgks avqgpperdlcgcysvssvlpgcaepwnhgktftctaaypesktplta tlsks)。
[0279]
seq id no:130为人iga1 ch3区的氨基酸序列 (gntfrpevhllpppseelalnelvtltclargfspkdvlvrwlqgsqe lprekyltwasrqepsqgtttfavtsilrvaaedwkkgdtfscmvghe alplaftqktidrlagkpthvnvsvvmaevdgtcy)。
[0280]
seq id no:131为人iga2铰链区的氨基酸序列(vppppp)。
[0281]
seq id no:132为人iga2 ch2区的氨基酸序列 (cchprlslhrpaledlllgseanltctltglrdasgatftwtpssgks avqgpperdlcgcysvssvlpgcaqpwnhgetftctaahpelktplta nitks)。
[0282]
seq id no:133为人iga2 ch3区的氨基酸序列 (gntfrpevhllpppseelalnelvtltclargfspkdvlvrwlqgsqe lprekyltwasrqepsqgtttfavtsilrvaaedwkkgdtfscmvghe alplaftqktidrlagkpthvnvsvvmaevdgtcy)。
[0283]
seq id no:134为人igd铰链区的氨基酸序列 (espkaqassvptaqpqaegslakattapattrntgrggeekkkekek eeqeeretktp)。
[0284]
seq id no:135为人igd ch2区的氨基酸序列 (ecpshtqplgvylltpavqdlwlrdkatftcfvvgsdlkdahltwev agkvptggveegllerhsngsqsqhsrltlprslwnagtsvtctlnh pslppqrlmalrep)。
[0285]
seq id no:136为人igd ch3区的氨基酸序列 (aaqapvklslnllassdppeaaswllcevsgfsppnillmwledqre vntsgfaparpppqprsttfwawsvlrvpappspqpatytcvvshedsr tllnasrslevsyvtdhgpmk)。
[0286]
seq id no:137为人ige ch2区的氨基酸序列 (vcsrdftpptvkilqsscdggghfpptiqllclvsgytpgtinitwled gqvmdvdlstasttqegelastqseltlsqkhwlsdrtytcqvtyqg htfedstkkca)。
[0287]
seq id no:138为人ige ch3区的氨基酸序列 (dsnprgvsaylsrpspfdlfirksptitclvvdlapskgtvnltwsras gkpvnhstrkeekqrngtltvtstlpvgtrdwiegetyqcrvthphl pralmrsttkts)。
[0288]
seq id no:139为人ige ch4区的氨基酸序列 (gpraapevyafatpewpgsrdkrtlacliqnfmpedisvqwlhnevq lpdarhsttqprktkgsgffvfsrlevtraeweqkdeficravheaas psqtvqravsvnpgk)。
[0289]
seq id no:140为人igg1铰链区的氨基酸序列 (epkscdkthtcppcp)。
[0290]
seq id no:341为修饰的人igg1铰链区衍生的序列的氨基酸序列 (sdkthtcppcp)。
[0291]
seq id no:141为人igg1 ch2区的氨基酸序列 (apellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnw yvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykck vsnkalpapiektiskak)。
[0292]
seq id no:142为人igg1 ch3区的氨基酸序列 (gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpe nnykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnh ytqkslslspgk)。
[0293]
seq id no:342为人igg1重链序列的氨基酸序列 (msdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdv shedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqd wlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtk nqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflys kltvdksrwqqgnvfscsvmhealhnhytqkslslspgk)。应理解, 在该人igg1重链序列中的met残基可以缺失,例如在与hrs多肽n-末 端融合时(参见seq id no:340)。
[0294]
seq id no:143为人igg2铰链区的氨基酸序列(erkccvecppcp)。
[0295]
seq id no:144为人igg2 ch2区的氨基酸序列 (appvagpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwy vdgvevhnaktkpreeqfnstfrvvsvltvvhqdwlngkeykckvs nkglpapiektisktk)。
[0296]
seq id no:145为人igg2 ch3区的氨基酸序列 (gqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpe nnykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealhn hytqkslslspgk)。
[0297]
seq id no:146为人igg3铰链区的氨基酸序列 (elktplgdtthtcprcpepkscdtpppcprcpepkscdtpppcprcpep kscdtpppcprcp)。
[0298]
seq id no:147为人igg3 ch2区的氨基酸序列 (apellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfkw yvdgvevhnaktkpreeqynstfrvvsvltvlhqdwlngkeykckv snkalpapiektisktk)。
[0299]
seq id no:148为人igg3 ch3区的氨基酸序列 (gqprepqvytlppsreemtknqvsltclvkgfypsdiavewessgqpe nnynttppmldsdgsfflyskltvdksrwqqgnifscsvmhealhnr ftqkslslspgk)。
[0300]
seq id no:149为人igg4铰链区的氨基酸序列(eskygppcpscp)。
[0301]
seq id no:150为人igg4 ch2区的氨基酸序列(apeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnw yvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckv snkglpssiektiskak)。
[0302]
seq id no:151为人igg4 ch3区的氨基酸序列 (gqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqp ennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhn hytqkslslslgk)。
[0303]
seq id no:152为人igm ch2区的氨基酸序列 (viaelppkvsvfvpprdgffgnprksklicqatgfsprqiqvswlreg kqvgsgvttdqvqaeakesgpttykvtstltikesdwlgqsmftcrv dhrgltfqqnassmcvp)。
[0304]
seq id no:153为人igm ch3区的氨基酸序列 (dqdtairvfaippsfasifltkstkltclvtdlttydsvtiswtrqngea vkthtniseshpnatfsavgeasiceddwnsgerftctvthtdlpsplk qtisrpk)。
[0305]
seq id no:154为人igm ch4区的氨基酸序列 (gvalhrpdvyllppareqlnlresatitclvtgfspadvfvqwmqrg qplspekyvtsapmpepqapgryfahsiltvseeewntgetytcvvah ealpnrvtertvdkstgkptlynvslvmsdtagtcy)。
[0306]
因此本发明的hrs-fc缀合物可以包含以下、由以下组成或基本上由 以下组成:seq id no:128-163或339-342的人fc区氨基酸序列中的一 个或多个,包括其变体、片段、同源物、直系同源物、旁系同源物及其 组合。某些示例性实施方案包括长度大小范围如下的fc区:约20-50、 20-100、20-150、20-200、20-250、20-300、20-400、50-100、50-150、50-200、 50-250、50-300、50-400、100-150、100-200、100-250、100-300、100-350、 100-400、200-250、200-300、200-350或200-400个氨基酸,其任选地包 含、由或基本上由seq id no:128-154或341-342的任何一个或多个组 成。某些实施方案包括至多约50、60、70、80、90、100、110、120、130、 140、150、160、170、180、190、200、210、220、230、240、250、300、 350、400或更多个氨基酸的fc区,其任选地包含、由或基本上由seq idno:128-154或339-342的任何一个或多个组成。
[0307]
某些fc区包含、由或基本上由以下序列组成:seq id no:128-130 或156所示的人iga1序列,其以任何顺序从n-末端至c-末端读取,包 括其组合(例如,seq id no:128和129和130;seq id no:128和129; seq id no:128和130;seq id no:129和130)及其变体和片段。某些 fc区包含、由或基本上由seq id no:128所示的人iga1序列组成。某 些fc区包含、由或基本上由seq id no:129所示的人iga1序列组成。 某些fc区包含、由或基本上由seq id no:130所示的人iga1序列组成。
[0308]
某些fc区包含、由或基本上由以下序列组成:seq id no:131-133 或157所示的人iga2序列,其以任何顺序从n-末端至c-末端读取,包 括其组合(例如,seq id no:131和132和133;seq id no:131和132; seq id no:131和133;seq id no:132和133)及其变体和片段。某些 fc区包含、由或基本上由seq id no:131所示的人iga2序列组成。某 些fc区包含、由或基本上由seq id no:132所示的人iga2序列组成。 某些fc区包含、由或基本上由seq id no:133所示的人iga2序列组成。
[0309]
某些fc区包含、由或基本上由以下序列组成:seq id no:134-136 所示的人igd序列,其以任何顺序从n-末端至c-末端读取,包括其组合 (例如,seq id no:134和135和136;seq id no:134和135;seq idno:134和136;seq id no:135和136)及这些序列的变体和片段以及组 合。某些fc区包含、由或基本上由seq id no:134所示的人igd序列组 成。某些fc区包含、由或基本上由seq id no:135所示的人igd序列组 成。某些fc区包含、由或基本上由seq id no:136所示的人igd序列组 成。
[0310]
某些fc区包含、由或基本上由以下序列组成:seq id no:137-139 或163所示的人ige序列,其以任何顺序从n-末端至c-末端读取,包括 其组合(例如,seq id no:137和138和139;seq id no:137和138;seqid no:137和139;seq id no:138和139)及这些序列的变体和片段以及 组合。某些fc区包含、由或基本上由seq id no:137所示的人ige序列 组成。某些fc区包含、由或基本上由seq id no:138所示的人ige序列 组成。某些fc区包含、由或基本上由seq id no:139所示的人ige序列 组成。
[0311]
某些fc区包含、由或基本上由以下序列组成:seq id no:140-142 或159或339-342所示的人igg1序列,其以任何顺序从n-末端至c-末 端读取,包括其组合(例如,seq id no:140和141和142;seq id no:140 和141;seq id no:140和142;seq id no:141和142)及这些序列的变 体和片段以及组合。某些fc区包含、由或基本上由seq id no:140所示 的人igg1序列组成。某些fc区包含、由或基本上由seq id no:141所 示的人igg1序列组成。某些
fc区包含、由或基本上由seq id no:142 所示的人igg1序列组成。某些fc区包含、由或基本上由seq id no:339 所示的人igg1序列组成。某些fc区包含、由或基本上由seq id no:340 所示的人igg1序列组成。某些fc区包含、由或基本上由seq id no:341 所示的人igg1序列组成。某些fc区包含、由或基本上由seq id no:342 所示的人igg1序列组成。
[0312]
某些fc区包含、由或基本上由以下序列组成:seq id no:143-145 或160所示的人igg2序列,其以任何顺序从n-末端至c-末端读取,包 括其组合(例如,seq id no:143和144和145;seq id no:143和144; seq id no:143和145;seq id no:144和145),以及及这些序列的变体 和片段及组合。某些fc区包含、由或基本上由seq id no:143所示的人 igg2序列组成。某些fc区包含、由或基本上由seq id no:144所示的 人igg2序列组成。某些fc区包含、由或基本上由seq id no:145所示 的人igg2序列组成。
[0313]
某些fc区包含、由或基本上由以下序列组成:seq id no:146-148 或161所示的人igg3序列,其以任何顺序从n-末端至c-末端读取,包 括其组合(例如,seq id no:146和147和148;seq id no:146和147; seq id no:146和148;seq id no:147和148)及这些序列的变体和片段 以及组合。某些fc区包含、由或基本上由seq id no:146所示的人igg3 序列组成。某些fc区包含、由或基本上由seq id no:147所示的人igg3 序列组成。某些fc区包含、由或基本上由seq id no:148所示的人igg3 序列组成。
[0314]
某些fc区包含、由或基本上由以下序列组成:seq id no:149-151 或162所示的人igg4序列,其以任何顺序从n-末端至c-末端读取,包 括其组合(例如,seq id no:149和150和151;seq id no:149和150; seq id no:149和151;seq id no:150和151)及这些序列的变体和片段 以及组合。某些fc区包含、由或基本上由seq id no:149所示的人igg4 序列组成。某些fc区包含、由或基本上由seq id no:150所示的人igg4 序列组成。某些fc区包含、由或基本上由seq id no:151所示的人igg4 序列组成。
[0315]
某些fc区包含、由或基本上由以下序列组成:seq id no:152-154 或158所示的的人igm序列,其以任何顺序从n-末端至c-末端读取,包 括其组合(例如,seq id no:152和153和154;seq id no:152和153; seq id no:152和154;seq id no:153和154)及这些序列的变体和片段 以及组合。某些fc区包含、由或基本上由seq id no:152所示的人igm 序列组成。某些fc区包含、由或基本上由seq id no:153所示的人igm 序列组成。某些fc区包含、由或基本上由seq id no:154所示的人igm 序列组成。
[0316]
如上所述,某些实施方案使用本文所述的和本领域已知的fc区的变 体、片段、杂合体和/或以其他方式修饰的形式(例如,seq id no:128-163 的人ig序列)。
[0317]
变体被包括在内,所述变体相对于参照序列如seq id no:128-163 所示的参照序列中任何一个或多个序列,具有一个或多个氨基酸取代、 插入、缺失和/或截短。在某些实施方案中,变异的fc区包括与seq idno:128-163中任何一个或多个具有至少约50%、55%、60%、65%、70%、 75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、 98%或更多序列同一性或相似性或同源性的氨基酸序列。还包括如下的 fc区:其通过添加、缺失、插入或取代1、2、3、4、5、6、7、8、9、 10、11、12、13、14、15、16、17、18、19、20、30、40、50、60,70、 80、90、100、110、120、130、140、150个或更多氨基酸而与seq idno:128-163中一个或多个不同。在某些实施方案中,所述氨基酸添加或 缺失发生在fc参照序列的c-末端和/或n-末端。
[0318]
在具体实施方案中,变异的fc区包含能够与seq id no:128-163中 任何一个或多个进行最佳比对而产生以下的blast比特分数或序列相 似性分数的氨基酸序列:至少约50、60、70、80、90、100、100、110、 120、130、140、150、160、170、180、190、200、210、220、230、240、 250、260、270、280、290、300、310、320、330、340、350、360、370、 380、390、400、410、420、430、440、450、460、470、480、490、500、 510、520、530、540、550、560、570、580、590、600、610、620、630、 640、650、660、670、680、690、700、710、720、730、740、750、760、 770、780、790、800、810、820、830、840、850、860、870、880、890、 900、910、920、930、940、950、960、970、980、990、1000或更多, 包括其间的所有整数和范围,其中blast比对采用blosum62矩阵, 空位存在罚分为11,且空位延伸罚分为1。
[0319]
还包括杂合的fc区,例如,包含来自不同物种、不同ig类型和/或 不同ig亚类的免疫球蛋白的fc结构域(例如,铰链、ch2、ch3、ch4) 的组合的fc区。一般性实例包括杂合的fc区,其包含、由或基本上由 ch2/ch3结构域的以下组合组成:iga1/iga1、iga1/iga2、iga1/igd、 iga1/ige、iga1/igg1、iga1/igg2、iga1/igg3、iga1/igg4、iga1/igm、 iga2/iga1、iga2/iga2、iga2/igd、iga2/ige、iga2/igg1、iga2/igg2、 iga2/igg3、iga2/igg4、iga2/igm、igd/iga1、igd/iga2、igd/igd、igd/ige、 igd/igg1、igd/igg2、igd/igg3、igd/igg4、igd/igm、ige/iga1、ige/iga2、 ige/igd、ige/ige、ige/igg1、ige/igg2、ige/igg3、ige/igg4、ige/igm、 igg1/iga1、igg1/iga2、igg1/igd、igg1/ige、igg1/igg1、igg1/igg2、 igg1/igg3、igg1/igg4、igg1/igm、igg2/iga1、igg2/iga2、igg2/igd、 igg2/ige、igg2/igg1、igg2/igg2、igg2/igg3、igg2/igg4、igg2/igm、 igg3/iga1、igg3/iga2、igg3/igd、igg3/ige、igg3/igg1、igg3/igg2、 igg3/igg3、igg3/igg4、igg3/igm、igg4/iga1、igg4/iga2、igg4/igd、 igg4/ige、igg4/igg1、igg4/igg2、igg4/igg3、igg4/igg4、igg4/igm、 igm/iga1、igm/iga2、igm/igd、igm/ige、igm/igg1、igm/igg2、igm/igg3、 igm/igg4、igm/igm(或其片段或变体),且任选地包含来自iga1、iga2、 igd、igg1、igg2、igg3或igg4中一个或多个的铰链,和/或来自ige和 /或igm的ch4结构域。在特定实施方案中,铰链、ch2、ch3和ch4结 构域来自人ig。
[0320]
另外的实例包括杂合的fc区,其包含、由或基本上由ch2/ch4结构 域的以下组合组成:iga1/ige、iga2/ige、igd/ige、ige/ige、igg1/ige、 igg2/ige、igg3/ige、igg4/ige、igm/ige、iga1/igm、iga2/igm、igd/igm、 ige/igm、igg1/igm、igg2/igm、igg3/igm、igg4/igm、igm/igm(或其 片段或变体),且任选地包含来自iga1、iga2、igd、igg1、igg2、igg3、 igg4中一个或多个的铰链,和/或来自iga1、iga2、igd、ige、igg1、igg2、 igg3、igg4或igm中一个或多个的ch3结构域。在特定实施方案中, 铰链、ch2、ch3和ch4结构域来自人ig。
[0321]
某些实例包括杂合的fc区,其包含、由或基本上由ch3/ch4结构域 的以下组合组成:iga1/ige、iga2/ige、igd/ige、ige/ige、igg1/ige、 igg2/ige、igg3/ige、igg4/ige、igm/ige、iga1/igm、iga2/igm、igd/igm、 ige/igm、igg1/igm、igg2/igm、igg3/igm、igg4/igm、igm/igm(或其片 段或变体),且任选地包括来自iga1、iga2、igd、igg1、igg2、igg3、 igg4中一个或多个的铰链,和/或来自iga1、iga2、igd、ige、igg1、 igg2、igg3、igg4或igm中一个或多个的ch2结构域。在特定实施方案 中,铰链、ch2、ch3和ch4结构域来自人ig。
[0322]
具体实例包括杂合的fc区,其包含、由或基本上由铰链/ch2结构域 的以下组合组成:iga1/iga1、iga1/iga2、iga1/igd、iga1/ige、iga1/igg1、 iga1/igg2、iga1/igg3、iga1/
igg4、iga1/igm、iga2/iga1、iga2/iga2、 iga2/igd、iga2/ige、iga2/igg1、iga2/igg2、iga2/igg3、iga2/igg4、 iga2/igm、igd/iga1、igd/iga2、igd/igd、igd/ige、igd/igg1、igd/igg2、 igd/igg3、igd/igg4、igd/igm、igg1/iga1、igg1/iga2、igg1/igd、igg1/ige、 igg1/igg1、igg1/igg2、igg1/igg3、igg1/igg4、igg1/igm、igg2/iga1、 igg2/iga2、igg2/igd、igg2/ige、igg2/igg1、igg2/igg2、igg2/igg3、 igg2/igg4、igg2/igm、igg3/iga1、igg3/iga2、igg3/igd、igg3/ige、 igg3/igg1、igg3/igg2、igg3/igg3、igg3/igg4、igg3/igm、igg4/iga1、 igg4/iga2、igg4/igd、igg4/ige、igg4/igg1、igg4/igg2、igg4/igg3、 igg4/igg4、igg4/igm(或其片段或变体),且任选地包含来自iga1、iga2、 igd、ige、igg1、igg2、igg3、igg4或igm中一个或多个的ch3结构 域,和/或来自ige和/或igm的ch4结构域。在特定实施方案中,铰链、 ch2、ch3和ch4结构域来自人ig。
[0323]
某些实例包括杂合的fc区,其包含、由或基本上由铰链/ch3结构域 的以下组合组成:iga1/iga1、iga1/iga2、iga1/igd、iga1/ige、iga1/igg1、 iga1/igg2、iga1/igg3、iga1/igg4、iga1/igm、iga2/iga1、iga2/iga2、 iga2/igd、iga2/ige、iga2/igg1、iga2/igg2、iga2/igg3、iga2/igg4、 iga2/igm、igd/iga1、igd/iga2、igd/igd、igd/ige、igd/igg1、igd/igg2、 igd/igg3、igd/igg4、igd/igm、igg1/iga1、igg1/iga2、igg1/igd、igg1/ige、 igg1/igg1、igg1/igg2、igg1/igg3、igg1/igg4、igg1/igm、igg2/iga1、 igg2/iga2、igg2/igd、igg2/ige、igg2/igg1、igg2/igg2、igg2/igg3、 igg2/igg4、igg2/igm、igg3/iga1、igg3/iga2、igg3/igd、igg3/ige、 igg3/igg1、igg3/igg2、igg3/igg3、igg3/igg4、igg3/igm、igg4/iga1、 igg4/iga2、igg4/igd、igg4/ige、igg4/igg1、igg4/igg2、igg4/igg3、 igg4/igg4、igg4/igm(或其片段或变体),且任选地包含来自iga1、iga2、 igd、ige、igg1、igg2、igg3、igg4或igm中一个或多个的ch2结构 域和/或来自ige和/或igm的ch4结构域。在特定实施方案中,铰链、 ch2、ch3和ch4结构域来自人ig。
[0324]
一些实例包括杂合的fc区,其包含、由或基本上由铰链/ch4结构域 的以下组合组成:iga1/ige、iga1/igm、iga2/ige、iga2/igm、igd/ige、 igd/igm、igg1/ige、igg1/igm、igg2/ige、igg2/igm、igg3/ige、igg3/igm、 igg4/ige、igg4/igm(或其片段或变体),且任选地包含来自iga1、iga2、 igd、ige、igg1、igg2、igg3、igg4或igm中一个或多个的ch2结构 域,和/或来自iga1、iga2、igd、ige、igg1、igg2、igg3、igg4或igm 中一个或多个的ch3结构域。
[0325]
杂合的fc区的特定实例可参见,例如wo 2008/147143,其源自igg 亚类的组合或人igd和igg的组合。
[0326]
还包括衍生的或以其他方式修饰的fc区。在某些方面,相对于野生 型或天然存在的fc区,所述fc区可以通过例如,磷酸化、硫酸化、丙 烯酰化(acrylation)、糖基化、甲基化、法尼基化、乙酰化、酰胺化等进行 修饰。在某些实施方案中,所述fc区可以包含野生型或天然糖基化模式, 或者可选择地,它可以包含相对于天然形式增加的糖基化、相对于天然 形式减少的糖基化,或它可以为完全去糖基化的。作为修饰的fc糖型的 一个实例,fc区减少的糖基化减少了对第一补体组分c1的c1q区的结 合、adcc-相关的活性降低和/或cdc-相关的活性降低。因此,某些实 施方案使用去糖基化的或未糖基化的(aglycosylated)fc区。参见,例如关 于示例性未糖基化fc区的产生的wo 2005/047337。fc区糖型的另一实 例可根据kabat等的编号系统通过用半胱氨酸残基取代q295位置来产生 (参见,例如美国申
请第2010/0080794号)。某些实施方案可以包括这样 的fc区,其中fc区中约80-100%的糖蛋白包含无果糖的成熟核心碳水 化合物结构(参见,例如美国申请第2010/0255013号)。一些实施方案可 以包括这样的fc区,其通过取代或缺失进行优化,以减少岩藻糖基化水 平,例如,增加对fcγri、fcγria或fcγriiia的亲和力,和/或提高表达 fcγriia的细胞的吞噬作用(参见美国申请第2010/0249382和 2007/0148170号)。
[0327]
作为修饰的fc糖型的另一实例,fc区可以包含寡甘露糖型n-聚糖, 且任选地具有一种或多种以下特性:相对于含有复合型n-聚糖的相应fc 区或hrs-fc缀合物,具有增加的adcc活性、增加的对fcγriiia(和某 些其他fcr)的结合亲和力、对hrs多肽的靶标具有类似的或增加的结合 特异性、对hrs多肽的靶标具有类似的或更高的结合亲和力,和/或对甘 露糖受体具有类似的或更低的结合亲和力(参见,例如美国申请第 2007/0092521号和美国专利第7,700,321号)。作为另一实例,使用通过在 改造的或变体细胞系中表达抗体而产生的改造的糖型,实现了fc区对 fcγr的增强的亲和力(参见,例如umana等,nat biotechnol.17:176-180, 1999;davies等,biotechnol bioeng.74:288-294,2001;shields等,j biolchem.277:26733-26740,2002;shinkawa等,2003,j biolchem.278:3466-3473,2003;和美国申请第2007/0111281号)。某些fc区 糖型包含增加的n-糖苷键型复合糖链比例,所述复合糖链在糖链的还原 端不具有岩藻糖1-位与n-乙酰葡糖胺6-位的连接(参见,例如美国申请第 2010/0092997号)。具体实施方案可以包括igg fc区,其用通过α-2,6键 合而连接至各自末端唾液酸部分的至少一个半乳糖部分进行糖基化,任 选地其中所述fc区具有比相应的野生型fc区更高的抗炎活性(参见美国 申请第2008/0206246号)。这些和相关改变的糖基化方法中的某些方法已 经产生了显著提高的fc区选择性结合fcr如fcγriii以介导adcc以及 改变fc区其他特性的能力,如本文所述。
[0328]
相对于相应的野生型fc序列(例如,相同物种、相同ig类型、相同 ig亚类),某些变体、片段、杂合体或以其他方式修饰的fc区可以具有 对一种或多种fcr的改变的结合。例如,相对于相应的野生型fc序列, 这类fc区可以具有增加的对fcγ受体、fcα受体、fcε受体和/或新生儿 fc受体中一种或多种的结合。在其他实施方案中,相对于相应的野生型 fc序列,变体、片段、杂合体或修饰的fc区可以具有减少的对fcγ受体、 fcα受体、fcε受体和/或新生儿fc受体中一种或多种的结合。具体fcr 描述于本文其他地方。
[0329]
具有改变的(例如,增加的、减少的)fcr结合的fc变体的具体实例, 可参见例如,美国专利第5,624,821和7,425,619号;美国申请第 2009/0017023、2009/0010921和2010/0203046号;以及wo 2000/42072 和wo 2004/016750。某些实例包括在298、333和/或334位置具有一个 或多个取代例如s298a、e333a和/或k334a(基于kabat等的eu索引编 号)的人fc区,其已经显示增加了对激活性受体fcγriiia的结合,并降 低了对抑制性受体fcγriib的结合。可组合这些突变以获得在对fcr的 结合中具有进一步改善的双或三突变变体。某些实施方案包括 s298a/e333a/k334a三突变体,其具有对fcγriiia增加的结合、对 fcγriib降低的结合,以及增加的adcc(参见,例如shields等,j biolchem.276:6591-6604,2001;和presta等,biochem soc trans.30:487-490, 2002)。还可参见改造的fc糖型,其具有对fcr增加的结合,如umana 等(同上);和美国专利第7,662,925号中所公开的。一些实施方案包括含 有一个或多个选自以下取代的fc区:434s、252y/428l、252y/434s和 428l/434s(参见美国申请第2009/0163699和20060173170),基于kabat 等的eu索引。
430p、430q、430r、430s、430t、430v、430w、430y、431h、431k、 431p、432r、432s、438g、438k、438l、438t、438w、439e、439h、 439q、440d、440e、440f、440g、440h、440i、440k、440l、440m、 440q、440t、440v或442k。如上,重链中的残基编号为eu索引中的 编号(参见kabat等,同上)。这类fc区变体通常赋予与其可操作连接的 hrs多肽改变的效应器功能或改变的血清半衰期。优选地,相比没有这 类氨基酸取代的相应fc区,所述改变的效应器功能为adcc的增加、 adcc的降低、cdc的增加、cdc的降低、clq结合亲和力的增加、clq 结合亲和力的降低、fcr(优选fcrn)结合亲和力的增加,或fcr(优选 fcrn)结合亲和力的降低。
[0336]
另外的实例包括这样的fc区变体,其包含在以下位置中的一个或多 个位置处的氨基酸取代:221、222、224、227、228、230、231、223、 233、234、235、236、237、238、239、240、241、243、244、245、246、 247、249、250、258、262、263、264、265、266、267、268、269、270、 271、272、273、274、275、276、278、280、281、283、285、286、288、 290、291、293、294、295、296、297、298、299、300、302、313、317、 318、320、322、323、324、325、326、327、328、329、330、331、332、 333、334、335、336和/或428(参见,例如美国专利第7,662,925号)。在 特定实施方案中,fc区变体包含选自以下的至少一个氨基酸取代: p230a、e233d、l234e、l234y、l234i、l235d、l235s、l235y、l235i、 s239d、s239e、s239n、s239q、s239t、v240i、v240m、f243l、v264i、v264t、v264y、v266i、e272y、k274t、k274e、k274r、k274l、k274y、 f275w、n276l、y278t、v302i、e318r、s324d、s324i、s324v、n325t、 k326i、k326t、l328m、l328i、l328q、l328d、l328v、l328t、a330y、 a330l、a330i、i332d、i332e、i332n、i332q、t335d、t335r和t335y。 在其他特定实施方案中,fc区变体包含选自以下的至少一个氨基酸取代: v264i、f243l/v264i、l328m、i332e、l328m/i332e、v264i/i332e、 s298a/i332e、s239e/i332e、s239q/i332e、s239e、a330y、i332d、 l328i/i332e、l328q/i332e、v264t、v240i、v266i、s239d、s239d/i332d、 s239d/i332e、s239d/i332n、s239d/i332q、s239e/i332d、s239e/i332n、 s239e/i332q、s239n/i332d、s239n/i332e、s239q/i332d、a330y/i332e、 v264i/a330y/i332e、a330l/i332e、v264i/a330l/i332e、l234e、l234y、 l234i、l235d、l235s、l235y、l235i、s239t、v240m、v264y、a330i、 n325t、l328d/i332e、l328v/i332e、l328t/i332e、l328i/i332e、 s239e/v264i/i332e、s239q/v264i/i332e、s239e/v264i/a330y/i332e、 s239d/a330y/i332e、s239n/a330y/i332e、s239d/a330l/i332e、 s239n/a330l/i332e、v264i/s298a/i332e、s239d/s298a/i332e、 s239n/s298a/i332e、s239d/v264i/i332e、s239d/v264i/s298a/i332e、 s239d/v264i/a330l/i332e、s239d/i332e/a330i、p230a、 p230a/e233d/i332e、e272y、k274t、k274e、k274r、k274l、k274y、 f275w、n276l、y278t、v302i、e318r、s324d、s324i、s324v、k326i、 k326t、t335d、t335r、t335y、v240i/v266i、s239d/a330y/i332e/l234i、 s239d/a330y/i332e/l235d、s239d/a330y/i332e/v240i、 s239d/a330y/i332e/v264t、s239d/a330y/i332e/k326e和 s239d/a330y/i332e/k326t,在更特定实施方案中,fc区变体包含选自 以下的一系列取代:n297d/i332e、 f241y/f243y/v262t/v264t/n297d/i332e、s239d/n297d/i332e、 s239e/n297d/i332e、s239d/d265y/n297d/i332e、 s239d/d265h/n297d/i332e、v264e/n297d/i332e、y296n/n297d/i332e、 n297d/a330y/i332e、s239d/d265v/n297d/i332e、 s239d/d265i/n297d/i332e和n297d/s298a/a330y/i332e。在特定实施 方案中,fc区变体包含在332位置处的氨基酸取代(使用eu索引的编号, kabat等,同上)。取代的实例包括:332a、332d、332e、332f、
332g、 332h、332k、332l、332m、332n、332p、332q、332r、332s、332t、 332v、332w和332y。fc区中的残基编号为kabat等的eu索引中的编 号。除了本文所述的其他特性外,相对于相应的野生型fc区,这类fc 区变体可以具有增加的对fcγr的亲和力、具有增加的稳定性和/或增加 的溶解度。
[0337]
其他实例包括这样的fc区变体,其包含以下氨基酸取代中的一个或 多个:224n/y、225a、228l、230s、239p、240a、241l、243s/l/g/h/i、 244l、246e、247l/a、252t、254t/p、258k、261y、265v、266a、267g/n、 268n、269k/g、273a、276d、278h、279m、280n、283g、285r、288r、 289a、290e、291l、292q、297d、299a、300h、301c、304g、305a、 306i/f、311r、312n、315d/k/s、320r、322e、323a、324t、325s、326e/r、 332t、333d/g、335i、338r、339t、340q、341e、342r、344q、347r、 351s、352a、354a、355w、356g、358t、361d/y、362l、364c、365q/p、 370r、372l、377v、378t、383n、389s、390d、391c、393a、394a、 399g、404s、408g、409r、411i、412a、414m、421s、422i、426f/p、 428t、430k、431s、432p、433p、438l、439e/r、440g、441f、442t、 445r、446a、447e,任选地,其中相比亲本fc多肽,所述变体具有改 变的fc配体识别和/或改变的效应器功能,且其中残基编号为kabat等的 eu索引中的编号。这些和相关的实施方案的具体实例包括这样的fc区 变体,其包含或由以下的取代组组成:(1)n276d、r292q、v305a、i377v、 t394a、v412a和k439e;(2)p244l、k246e、d399g和k409r;(3)s304g、 k320r、s324t、k326e和m358t;(4)f243s、p247l、d265v、v266a、 s383n和t411i;(5)h224n、f243l、t393a和h433p;(6)v240a、s267g、 g341e和e356g;(7)m252t、p291l、p352a、r355w、n390d、s408g、 s426f和a431s;(8)p228l、t289a、l365q、n389s和5440g;(9)f241l、 v273a、k340q和l441f;(10)f241l、t299a、i332t和m428t;(11) e269k、y300h、q342r、v422i和g446a;(12)t225a、r301c、s304g、 d312n、n315d、l351s和n421s;(13)s254t、l306i、k326r和q362l;(14)h224y、p230s、v323a、e333d、k338r和s364c;(15)t335i、 k414m和p445r;(16)t335i和k414m;(17)p247a、e258k、d280n、 k288r、n297d、t299a、k322e、q342r、s354a和l365p;(18)h268n、 v279m、a339t、n361d和s426p;(19)c261y、k290e、l306f、q311r、 e333g和q438l;(20)e283g、n315k、e333g、r344q、l365p和s442t; (21)q347r、n361y和k439r;(22)s239p、s254p、s267n、h285r、 n315s、f372l、a378t、n390d、y391c、f404s、e430k、l432p和 k447e;以及(23)e269g、y278h、n325s和k370r,其中残基编号为kabat 等的eu索引中的编号(参见,例如美国申请第2010/0184959号)。
[0338]
fc变体的另一个特定实例包含seq id no:155的序列,其中在位置 1的xaa为ala或不存在;在位置16的xaa为pro或glu;在位置17的 xaa为phe、val或ala;在位置18的xaa为leu、glu或ala;在位置 80的xaa为asn或ala;和/或在位置230的xaa为lys或不存在(参见, 例如美国申请第2007/0253966号)。相比野生型fc序列,这些fc区和相 关的hrs-fc缀合物中的某些具有增加的半衰期、降低的效应器活性,和 /或明显更少的免疫原性。
[0339]
fc区变体也可具有一个或多个突变的铰链区,如美国申请第 2003/0118592号所述。例如,铰链区的一个或多个半胱氨酸可缺失或被 不同的氨基酸取代。所述突变的铰链区可不包含半胱氨酸残基,或者它 可包含比相应的野生型铰链区少1、2或3个的半胱氨酸残基。在一些实 施方案中,相对于野生型ig铰链区,具有这类突变的铰链区的fc区显示 了降低的二聚化能力。
[0340]
如上所述,相对于相应的hrs多肽,hrs-fc缀合物如hrs-fc融合 蛋白通常具有改
变的(例如,改善的、增加的、降低的)药代动力学特性。 药代动力学特性的实例包括稳定性或半衰期、生物利用度(药物被吸收的 部分)、组织分布、分布容积(在药物通过静脉注射后立即分布于其中并在 血浆和周围组织之间形成平衡的表观容积)、浓度(药物在血浆中的初始或 稳态浓度)、消除率常数(药物从身体中去除的速率)、消除率(为抵消消除 所需的输注速率)、曲线下面积(auc或暴露;单次剂量后或稳态时浓度
‑ꢀ
时间曲线的积分)、清除率(每单位时间排除药物的血浆容积)、c
max
(经口 服施用后的药物血浆浓度峰值)、t
max
(到达c
max
的时间)、c
min
(施用下一剂 量前药物达到的最低浓度)和波动(稳态时一个给药间隔内的峰谷波动)。 在一些方面,实现了这些改善的特性而没有明显改变所述hrs多肽的二 级结构和/或降低其非经典生物活性。事实上,一些hrs-fc缀合物具有 增加的非经典生物活性。
[0341]
因此,在一些实施方案中,当在相同或可比较条件下施用至哺乳动 物时,所述hrs-fc缀合物或hrs-fc融合多肽的血浆或血清药代动力学 auc谱比相应未修饰的或不同修饰的hrs多肽的血浆或血清药代动力 学auc谱大至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、 16、17、18、19、20、50、100、200、300、400或500倍。在某些实施 方案中,当于室温下在类似条件下比较时,例如于ph 7.4在pbs中为期 约1、2、3、4、5、6、7、8、9、10、11、12、13、14天或1、2、3、4 周左右时,所述hrs-fc缀合物或hrs-fc融合多肽的稳定性(例如通过 半衰期测量的),比相应未修饰的或不同修饰的hrs多肽大至少10%、 20%、30%、40%、50%、60%、70%、80%、90%、100%、200%、300%、 400%或500%。
[0342]
在具体实施方案中,hrs-fc缀合物或hrs-fc融合多肽在ph 7.4、 25℃下,例如生理ph、人体温(例如,体内;在血清中;在给定组织中; 在诸如大鼠、小鼠、猴或人的给定物种中)中的生物半衰期为:约或至少 约30分钟、约1小时、约2小时、约3小时、约4小时、约5小时、约 6小时、约12小时、约18小时、约20小时、约24小时、约30小时、 约36小时、约40小时、约48小时、约50小时、约60小时、约70小 时、约72小时、约80小时、约84小时、约90小时、约96小时、约120 小时、或约144小时或更长时间或任何介于它们中间的半衰期。
[0343]
在某些实施方案中,在皮下(sc)施用之后,hrs-fc缀合物或hrs-fc 融合多肽与相应未修饰的hrs-多肽相比具有较大的生物利用度。在某些 实施方案中,与相应未修饰的hrs-多肽相比,hrs-fc缀合物或hrs-fc 融合多肽具有至少约20%、至少约30%、至少约40%,、至少约50%,至少 约60%、至少约70%,至少约80%、至少约90%或至少约100%或更高的 生物利用度。
[0344]
在某些实施方案中,如通过uv圆二色谱分析所测定的,所述hrs-fc 融合多肽具有与相应未修饰的或不同修饰的hrs多肽基本上相同的二级 结构。在某些实施方案中,在抗炎活性测定中,所述hrs-fc融合多肽具 有与相应未修饰的或不同修饰的hrs多肽基本上相同的活性。在其他实 施方案中,在抗炎活性测定中,hrs-fc融合多肽具有比相应未修饰的或 不同修饰的hrs多肽大2、3、4、5、6、7、8、9、10、11、12、13、14、 15、16、17、18、19或20倍的活性。
[0345]
肽连接子
[0346]
在某些实施方案中,可以使用肽连接子序列以足够确保每个多肽折 叠为其所需二级和三级结构的距离来隔开所述hrs多肽和fc区。可使 用本领域熟知的标准技术,将这类肽连接子序列整合至融合蛋白中。
[0347]
某些肽连接子序列可以基于以下示例性因素来挑选:(1)其采用柔性 延伸构象的能力;(2)其不能采用能与第一和第二多肽上的功能表位相互 作用的二级结构;(3)其生理稳定性;和(4)没有可能与多肽的功能表位反 应的疏水或带电荷的残基,或其他特征。参见,例如,george和heringa, j protein eng.15:871-879,2002。
[0348]
连接子序列在长度上通常可以为1至约200个氨基酸。具体的连接 子可具有如下的总氨基酸长度:约1-200个氨基酸、1-150个氨基酸、1-100 个氨基酸、1-90个氨基酸、1-80个氨基酸、1-70个氨基酸、1-60个氨基 酸、1-50个氨基酸、1-40个氨基酸、1-30个氨基酸、1-20个氨基酸、1-10 个氨基酸、1-5个氨基酸、1-4个氨基酸、1-3个氨基酸,或者约1、2、3、 4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、 21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、 37、38、39、40、41、42、43、44、45、46、47、48、49、50、60、70、 80、90、100个或更多氨基酸。
[0349]
肽连接子可以使用任何一种或多种天然存在的氨基酸、非天然存在 的氨基酸、氨基酸类似物和/或氨基酸模拟物,如本文其他地方所述且本 领域已知的。可以有用地用作连接子的某些氨基酸序列包括在maratea 等,gene 40:39-46,1985;murphy等,pnas usa.83:8258-8262,1986;美国 专利第4,935,233号和美国专利第4,751,180号中公开的那些。具体的肽 连接子序列包含gly、ser和/或asn残基。如需要,其他接近中性的氨基 酸如thr和ala也可以用于肽连接子序列中。
[0350]
某些示例性连接子包括如下含有gly、ser和/或asn的连接子:[g]
x
、 [s]
x
、[n]
x
、[gs]
x
、[ggs]
x
、[gss]
x
、[gsgs]
x
(seq id no:200)、[ggsg]
x (seq id no:201)、[gggs]
x
(seq id no:202)、[ggggs]
x
(seq idno:203)、[gn]
x
、[ggn]
x
、[gnn]
x
、[gngn]
x
(seq id no:204)、[ggng]
x (seq id no:205)、[gggn]
x
(seq id no:206)、[ggggn]
x
(seq idno:207)连接子,其中
x
为1、2、3、4、5、6、7、8、9、10、11、12、 13、14、15、16、17、18、19或20或更多。这些或相关氨基酸的其他组 合对本领域技术人员来说是显而易见的。
[0351]
连接肽的另外的实例包括但不限于以下氨基酸序列: gly-gly-gly-gly-ser-gly-gly-gly-gly-ser-gly-gly-gly-gly-ser-(seq idno:208); gly-ser-gly-gly-gly-gly-ser-gly-gly-gly-gly-ser-gly-gly-gly-gly-ser-gly-gly-gly-gly-ser-(seq id no:209); gly-gly-gly-gly-ser-gly-gly-gly-gly-ser-gly-gly-gly-gly-ser-gly-gly-gly-gly-ser-gly-gly-gly-gly-ser-gly-gly-gly-gly-ser-(seq id no:210); asp-ala-ala-ala-lys-glu-ala-ala-ala-lys-asp-ala-ala-ala-arg-glu-ala
‑ꢀ
ala-ala-arg-asp-ala-ala-ala-lys-(seq id no:211);和 asn-val-asp-his-lys-pro-ser-asn-thr-lys-val-asp-lys-arg-(seq idno:212)。
[0352]
连接肽的其他非限制性实例包括dgggs(seq id no:213);tgekp (seq id no:214)(参见,例如,liu等,pnas.94:5525-5530,1997);ggrr (seq id no:215)(pomerantz等1995);(ggggs)n(seq id no:203)(kim 等,pnas.93:1156-1160,1996);egkssgsgseskvd(seq id no:216) (chaudhary等,pnas.87:1066-1070,1990);kesgsvsseqlaqfrsld (seq id no:217)(bird等,science.242:423-426,1988);ggrrgggs(seqid no:218);lrqrdgerp(seq id no:219);lrqkdgggserp(seq idno:220);lrqkd(gggs)2erp(seq id no:221)。在特定实施方案中, 所述连接子序列包含gly3连接子序列,其包含三个甘氨酸残基。在具体 实施方案中,可使用能够建模dna-结合位点和肽本身的计算机程序 (desjarlais&berg,
pnas.90:2256-2260,1993;和pnas.91:11099-11103, 1994)或通过噬菌体展示方法来合理地设计柔性连接子。
[0353]
肽连接子可以为生理上稳定的,或者可以包括可释放的连接子如生 理上可降解的或可酶切的连接子(例如,可蛋白水解切割的连接子)。在某 些实施方案中,一个或多个可释放的连接子可导致所述缀合物更短的半 衰期和更快的清除率。这些和相关的实施方案可用于,例如提高hrs多 肽在血流中的溶解度和血液循环寿命,同时还将hrs多肽递送至血流中, 其在连接子降解后基本上无fc区。这些方面尤其可用于那些情况,即当 永久缀合至fc区时其中hrs多肽显示降低的活性。通过使用本文提供 的连接子,,这类hrs多肽当处于缀合形式时能够维持其治疗活性。作 为另一实例,可以施用大且相对惰性的hrs-fc缀合多肽,其随后在体内 降解(通过可降解的连接子)而产生具有部分fc区或完全没有fc区的生物 活性的hrs多肽。以这些和其他方式,可更有效地调整所述hrs-fc缀 合多肽的特性以达到hrs多肽随时间的生物活性和循环半衰期的平衡。
[0354]
在具体实施方案中,所述连接肽包含自催化的或自切割的肽切割位 点。在具体实施方案中,自切割肽包含获自以下的那些多肽序列:马铃 薯y病毒(potyvirus)和心脏病毒2a肽、fmdv(口蹄疫病毒)、马鼻炎a 病毒、明脉扁刺蛾病毒(thosea asigna virus)和猪捷申病毒。在某些实施方 案中,所述自切割多肽位点包含2a或2a-样位点、序列或结构域(donnellyet al.,j.gen.virol.82:1027-1041,2001)。示例性2a位点包括以下序列: llnfdllklagdvesnpgp(seq id no:222); tlnfdllklagdvesnpgp(seq id no:223);llklagdvesnpgp (seq id no:224);nfdllklagdvesnpgp(seq id no:225); qllnfdllklagdvesnpgp(seq id no:226); apvkqtlnfdllklagdvesnpgp(seq id no:227); vtellyrmkraetycprpllaihptearhkqkivapvkqt(seq idno:228);lnfdllklagdvesnpgp(seq id no:229); llaihptearhkqkivapvkqtlnfdllklagdvesnpgp(seq idno:230);和earhkqkivapvkqtlnfdllklagdvesnpgp(seq idno:231)。在一个实施方案中,自催化肽切割位点包含翻译的2a信号序 列,例如,口蹄疫病毒(fmdv)聚蛋白的2a区,其为18个氨基酸序列。 可以使用的2a-样序列的其他实例包括昆虫病毒聚蛋白、c型轮状病毒的 ns34蛋白和锥虫(trypanosoma spp.)中的重复序列,其描述于例如 donnelly et al.,journal of general virology.82:1027-1041,2001中。
[0355]
合适的蛋白酶切割位点和自切割肽为本领域技术人员所知(参见,例 如ryan等,j.gener.virol.78:699-722,1997;和scymczak等,naturebiotech.5:589-594,2004)。示例性蛋白酶切割位点包括但不限于以下蛋白 酶的切割位点:马铃薯y病毒nia蛋白酶(例如,烟草蚀纹病毒蛋白酶)、 马铃薯y病毒hc蛋白酶、马铃薯y病毒p1(p35)蛋白酶、byovirus nia 蛋白酶、byovirus rna-2-编码的蛋白酶、口蹄疫病毒l蛋白酶、肠病毒 2a蛋白酶、鼻病毒2a蛋白酶、小核糖核酸3c蛋白酶(picorna 3cproteases)、豇豆花叶病毒24k蛋白酶、线虫传多面体病毒24k蛋白酶、 rtsv(水稻东格鲁病球状病毒)3c-样蛋白酶、pyvf(欧防风黄点病毒) 3c-样蛋白酶、肝素、凝血酶、xa因子和肠激酶。由于其高的切割严紧 度,tev(烟草蚀纹病毒)蛋白酶切割位点被包括在一些实施方案中,例如, exxyxq(g/s)(seq id no:232),例如,enlyfqg(seq id no:233)和 enlyfqs(seq id no:234),其中x表示任何氨基酸(由tev进行的切 割发生于q和g或者q和s之间)。
[0356]
适用于本发明具体实施方案的可酶促降解的连接子的其他实例包括 但不限于:
由丝氨酸蛋白酶如凝血酶、胰凝乳蛋白酶、胰蛋白酶、弹性 蛋白酶、激肽释放酶或枯草杆菌蛋白酶切割的氨基酸序列。凝血酶可切 割的氨基酸序列的示例性实例包括但不限于:-gly-arg-gly-asp-(seq idno:235)、-gly-gly-arg-、-gly-arg-gly-asp-asn-pro-(seq id no:236)、
ꢀ‑
gly-arg-gly-asp-ser-(seq id no:237)、
ꢀ‑
gly-arg-gly-asp-ser-pro-lys-(seq id no:238)、-gly-pro-arg-、
ꢀ‑
val-pro-arg-和-phe-val-arg-。弹性蛋白酶可切割的氨基酸序列的示例性 实例包括但不限于:-ala-ala-ala-、-ala-ala-pro-val-(seq id no:239)、
ꢀ‑
ala-ala-pro-leu-(seq id no:240)、-ala-ala-pro-phe-(seq id no:241)、-ala-ala-pro-ala-(seq id no:242)和-ala-tyr-leu-val-(seq id no:243)。
[0357]
可酶促降解的连接子还包括可由基质金属蛋白酶如胶原酶、溶基质 素和明胶酶切割的氨基酸序列。基质金属蛋白酶可切割的氨基酸序列的 示例性实例包括但不限于:-gly-pro-y-gly-pro-z-(seq id no:244)、
ꢀ‑
gly-pro-、leu-gly-pro-z-(seq id no:245)、-gly-pro-ile-gly-pro-z-(seqid no:246)和-ala-pro-gly-leu-z-(seq id no:247),其中y和z为氨基 酸。胶原酶可切割的氨基酸序列的示例性实例包括但不限于:
ꢀ‑
pro-leu-gly-pro-d-arg-z-(seq id no:248),-pro
‑ꢀ
leu-gly-leu-leu-gly-z-(seq id no:249),
ꢀ‑
pro-gln-gly-ile-ala-gly-trp-(seq id no:250),
ꢀ‑
pro-leu-gly-cys(me)-his-(seq id no:251),
ꢀ‑
pro-leu-gly-leu-tyr-ala-(seq id no:252),
ꢀ‑
pro-leu-ala-leu-trp-ala-arg-(seq id no:253),和
ꢀ‑
pro-leu-ala-tyr-trp-ala-arg-(seq id no:254),其中z为氨基酸。溶基 质素可切割的氨基酸序列的示例性实例为:
ꢀ‑
pro-tyr-ala-tyr-tyr-met-arg-(seq id no:255);且明胶酶可切割的氨基 酸序列的实例为:-pro-leu-gly-met-tyr-ser-arg-(seq id no:256)。
[0358]
适用于本发明的具体实施方案中的可酶促降解的连接子还包括可被 血管紧张素转化酶切割的氨基酸序列,诸如例如,-asp-lys-pro-、
ꢀ‑
gly-asp-lys-pro-(seq id no:257)和-gly-ser-asp-lys-pro-(seq idno:258)。
[0359]
适用于本发明的具体实施方案的可酶促降解的连接子还包括可通过 组织蛋白酶b降解的氨基酸序列,诸如例如,val-cit、 ala-leu-ala-leu-(seq id no:259)、gly-phe-leu-gly-(seq id no:260)和 phe-lys。
[0360]
在具体实施方案中,可释放的连接子在ph 7.4、25℃,例如生理ph、 人体温(例如,在体内、在血清中、在给定组织中)中的半衰期为:约30min、 约1小时、约2小时、约3小时、约4小时、约5小时、约6小时、约 12小时、约18小时、约24小时、约36小时、约48小时、约72小时或 约96小时或更长时间或者任何介于它们中间的半衰期。本领域技术人员 应理解,可通过使用特定可释放的连接子来精细地调整hrs-fc缀合多肽 的半衰期。
[0361]
然而,在某些实施方案中,任何一个或多个肽连接子为任选的。例 如,当第一和第二多肽具有可用于分隔功能结构域并防止空间位阻的非 必需n-末端和/或c-末端氨基酸区时,可能不需要连接子序列。
[0362]
应用方法
[0363]
本发明的实施方案涉及这样的发现:fc区-组氨酰-trna合成酶 (hrs-fc)缀合多肽及其片段和变体以多种有用的方式提供了在体外和体 内调节炎症反应的改善的方法。因此,本发明的组合物通过调节直接或 间接介导炎症和/或自身免疫疾病、病况和病症的细胞,可以用作用于治 疗包括炎症反应、慢性炎症、急性炎症和免疫疾病在内的广泛的促
炎、 炎症和/或自身免疫适应症的免疫调节剂。可使用众多本领域已知且可利 用的技术中的任何一种来监测本发明组合物作为免疫调节剂的效用,包 括例如,迁移测定(例如,使用白细胞或淋巴细胞)、细胞因子生成测定、 或细胞活力或细胞分化测定(例如,使用b-细胞、t-细胞、单核细胞或 nk细胞)。
[0364]“炎症”通常是指组织对有害刺激如病原体、受损细胞(例如,伤口) 和刺激物的生物学反应。术语“炎症反应”是指实现和调节炎症的具体机 制,包括(仅以示例的方式)免疫细胞活化或迁移、迁移、自身免疫性和自 身免疫疾病、细胞因子产生、血管舒张,包括激肽释放、纤维蛋白溶解 和凝结,以及本文所述的和本领域已知的其他方式。理想地,炎症是身 体的保护性尝试以便去除有害刺激物并启动受感染的一种或多种组织的 愈合过程。在没有炎症的情况下,伤口和感染将不会愈合,而产生组织 的持续破坏会危及存活的情况。另一方面,过度的或慢性炎症可能与多 种疾病相关,如花粉热、动脉粥样硬化和类风湿性关节炎,以及本文所 述的和本领域已知的其他疾病。
[0365]
慢性炎症的临床征象取决于疾病持续时间、炎症病灶、病因和受影 响的解剖学区域,(参见,例如kumar等,robbins basic pathology-8ft ed., 2009elsevier,london;miller,lm,pathology lecture notes,atlanticveterinary college,charlottetown,pei,canada)。慢性炎症与多种病理性病 况或疾病相关,包括例如,过敏症、阿尔茨海默氏症、贫血症、主动脉 瓣狭窄、关节炎如类风湿性关节炎和骨关节炎、癌症、充血性心脏衰竭、 纤维肌痛、纤维化、心脏病发作、肾功能衰竭、红斑狼疮、胰腺炎、中 风、外科并发症、炎性肺病、炎症性肠病包括克罗恩氏病(cd)和溃疡性 结肠炎(uc)、动脉粥样硬化、神经性疾病、糖尿病、代谢紊乱、肥胖症 和银屑病,以及本文所述的和本领域已知的其他疾病。许多其他的慢性 疾病还可以包括炎性组分,因此可以用本发明的hrs-fc缀合物治疗,包 括,例如肌营养不良和横纹肌溶解。因此,hrs-fc缀合物可以用于治疗 或控制慢性炎症、调节个体慢性炎症反应中任何一种或多种,或者治疗 与慢性炎症相关的任何一种或多种疾病或病况。
[0366]
某些具体的炎症反应包括细胞因子的产生和活性以及相关的通路。 例如,某些示例性实施方案涉及通过核因子-kb(nf-kb)调节细胞信号传 导,如通过增加该转录因子的下游活性。在某些情况下,nf-kb活性的 增加会导致细胞因子信号传导或活性的增加,如促炎细胞因子(例如, tnf-α或β)和抗炎细胞因子(例如,il-10)。
[0367]
评估炎症和其他病况的征象和症状的标准,包括为了进行不同的诊 断和为了监测治疗的目的,如确定在治疗过程中是否施用了治疗有效的 剂量,例如,通过按照接受的临床标准测定改善,对本领域技术人员来 说是显而易见的,且通过以下文献的教导进行示例:例如berkow等(编), the merck manual,第16版,merck and co.,rahway,n.j.,1992;goodman 等(编),goodman and gilman's the pharmacological basis of therapeutics, 第10版,pergamon press,inc.,elmsford,n.y.,(2001);avery's drugtreatment:principles and practice of clinical pharmacology and therapeutics, 第3版,adis press,ltd.,williams and wilkins,baltimore,md.(1987); ebadi,pharmacology,little,brown and co.,boston,(1985);osolci al.(编), remington's pharmaceutical sciences,第18版,mack publishing co.,easton, pa(1990);katzung,basic and clinical pharmacology,appleton and lange, norwalk,ct(1992)。
[0368]
还包括通过使用本文所述的任何hrs-fc缀合物来调节免疫反应的 方法,所述免
疫反应如先天性免疫反应或适应性免疫反应。如本文所用, 术语“免疫反应”包括针对抗原、疫苗组合物或由免疫系统的一种或多种 细胞介导的免疫调节分子的可测量或可观察的反应。免疫反应通常开始 于抗原或免疫调节分子结合至免疫系统细胞。针对抗原或免疫调节分子 的反应可以由很多细胞类型来介导,包括初始结合至抗原或免疫调节分 子的细胞,和参与介导先天性的、体液、细胞介导的免疫反应的细胞。
[0369]
还包括治疗免疫疾病的方法。可以根据本发明治疗的示例性免疫系 统疾病、病症或病况包括但不限于:原发性免疫缺陷、免疫介导的血小 板减少症、川崎综合征、骨髓移植(例如、成人或儿童中最近的骨髓移植)、 慢性b细胞性淋巴细胞白血病、hiv感染(例如成人或儿童的hiv感染)、 慢性炎症性脱髓鞘性多发性神经病、输血后紫癜等。
[0370]
此外,可以用本文所述的任何hrs-fc缀合物治疗的其他疾病、病症 和病况包括:格林-巴利(guillain-barre)综合征、贫血(例如,与细小病毒 b19相关的贫血、存在高感染风险(例如,复发性感染)的具有稳定的多发 性骨髓瘤的患者、自身免疫性溶血性贫血(例如,温型自身免疫性溶血性 贫血)、血小板减少症(例如,新生儿血小板减少症)和免疫介导的中性粒 细胞减少症)、移植(例如,巨细胞病毒(cmv)阳性器官的巨细胞病毒的阴 性受体)、低丙种球蛋白血症(例如,具有感染或发病危险因素的低丙种球 蛋白血症新生儿)、癫痫(例如,难治性癫痫)、全身性血管炎综合征、重 症肌无力(例如重症肌无力的失代偿)、皮肌炎和多发性肌炎。
[0371]
可以用本文所述的任何hrs-fc缀合物治疗的其他自身免疫疾病、病 症和病况包括但不限于:自身免疫性溶血性贫血、自身免疫性新生儿血 小板减少症、特发性血小板减少性紫癜、自身免疫性血细胞减少、溶血 性贫血、抗磷脂综合征、皮炎、过敏性脑脊髓炎、心肌炎、复发性多发 性软骨炎、风湿性心脏病、肾小球肾炎(例如、iga肾病)、多发性硬化、 神经炎、葡萄膜炎眼炎、多发性内分泌病、紫癜(例如henloch-scoenlein 紫癜)、reiter病、僵人综合征、自身免疫性肺炎、格林-巴利综合征、胰 岛素依赖型糖尿病和自身免疫性炎症性眼病。
[0372]
可以用本文所述的任何hrs-fc缀合物治疗的另外的自体免疫疾病、 病症或病况包括但不限于:自身免疫性甲状腺炎;甲状腺功能减退症, 包括桥本氏甲状腺炎和特征为例如细胞介导的和体液甲状腺细胞毒的甲 状腺炎;sle(其特征通常为例如循环和局部产生的免疫复合物); goodpasture综合征(其特征通常为例如抗基底膜抗体);天疱疮(其特征通 常为例如表皮棘层松解的抗体);受体自体免疫病,诸如例如graves病(其 特征通常在于,例如,促甲状腺激素受体的抗体);重症肌无力(其特征通 常为例如乙酰胆碱受体抗体);胰岛素抵抗(其特征通常为例如胰岛素受体 抗体);自身免疫性溶血性贫血(其特征通常为例如抗体致敏的红细胞的吞 噬作用);和自身免疫性血小板减少性紫癜(其特征通常为例如抗体致敏的 血小板的吞噬作用)。
[0373]
可以用本文所述的任何hrs-fc缀合物治疗的其他自身免疫疾病、病 症或病况包括但不限于:类风湿性关节炎(其特征通常为例如关节中的免 疫复合物);具有抗胶原抗体的硬皮病(其特征通常为例如核仁型和其他核 抗体);混合性结缔组织疾病(其特征通常为例如可提取核抗原如核糖核蛋 白的抗体);多发性肌炎/皮肌炎(其特征通常为例如非组蛋白抗核抗体); 恶性贫血(其特征通常为例如,抗壁细胞、抗微粒体和抗内因子抗体);特 发性艾迪生病(其特征通常为例如,体液和细胞介导的肾上腺细胞毒性); 不孕症(其特征通
常为例如,抗精子抗体);肾小球肾炎(其特征通常为例 如,肾小球基底膜抗体或免疫复合物)、原发性肾小球肾炎、iga肾病; 大疱性类天疱疮(其特征通常为例如,igg和基底膜中的补体);干燥综合 征(其特征通常为例如,多发性组织抗体和/或特定非组蛋白抗核抗体 (ss-b));糖尿病(其特征通常为例如,细胞介导的和体液胰岛细胞抗体); 和肾上腺素性药物耐药性,包括具有哮喘或囊性纤维化的肾上腺素性药 物耐药性(其特征通常为例如,β-肾上腺素受体抗体)。
[0374]
可以用本文所述的任何hrs-fc缀合物治疗的其他自身免疫疾病、病 症或病况包括但不限于:慢性活动性肝炎(其特征通常为例如,平滑肌抗 体);原发性胆汁性肝硬化(其特征通常为例如,抗-线粒体抗体);其他内 分泌腺障碍(其特征为例如,在某些情况下的特定组织抗体);白癜风(其 特征通常为例如,抗-黑素细胞抗体);血管炎(其特征通常为例如,血管 壁中的免疫球蛋白和补体和/或低血清补体);心肌梗塞后病症(其特征通 常为例如,抗-心肌抗体);心切开术综合征(其特征通常为例如,抗-心肌 抗体);荨麻疹(其特征通常为例如,ige的igg和igm抗体);异位性皮 炎(其特征通常为例如,ige的igg和igm抗体);哮喘(其特征通常为例 如,ige的igg和igm抗体);炎性肌病;和其他炎症性、肉芽肿的、退 行性和萎缩性病症。
[0375]
可以用本文所述的任何hrs-fc缀合物治疗的另外的疾病和病症包 括起因于或者与th17或其他th细胞亚型失衡相关的那些。实例包括银 屑病、银屑病关节炎、异位性皮炎(湿疹)、巴洛同心性硬化、谢耳德氏弥 漫性硬化(schilder's diffuse sclerosis)、马尔堡ms、ibd、克罗恩病、溃 疡性结肠炎、胶原性结肠炎、淋巴细胞性结肠炎、缺血性结肠炎、改道 性结肠炎、贝赛特氏疾病(disease)、未定型结肠炎、哮喘、自身 免疫心肌炎、子宫内膜异位症、成人斯蒂尔病(adult onset still'sdisorder,aosd)、henoch-schonlein紫癜(hsp)、伏格特-小柳-原田三氏综 合征(vogt-koyanagi-harada,vkh)、牙周病、器官移植失败、移植物抗宿 主病和德维克病(devic's disease(视神经脊髓炎))。
[0376]
在一些方面,本发明包括降低与自身免疫疾病相关的肌肉或肺部炎症 的方法,其包括向有需要的对象施用包含本文所述的任何hrs-fc缀合物 的组合物。示例性肌肉炎性疾病和病症包括肌营养不良、运动诱发的肌 肉炎症、与肌损伤或手术相关的炎症、横纹肌溶解以及本文所述的相关 疾病和病症。
[0377]
还包括治疗与自身抗体相关的疾病的方法,其包括向有需要的对象 施用包含本文所述的任何hrs-fc缀合物的治疗组合物,其中所述hrs 多肽包含由自身抗体特异性识别的至少一种表位。
[0378]
某些实施方案包括诱导对组氨酰-trna合成酶(hisrs)抗原耐受性的 方法,所述方法包括向对象施用包含本文所述的任何hrs-fc缀合物的组 合物,其中所述hrs多肽包含由自身抗体特异性识别的至少一种表位, 并且其中所述组合物的施用引起对自身抗原的耐受作用。
[0379]
还包括消除参与针对组氨酰trna合成酶(hisrs)自身抗原的自身免 疫反应的t细胞组或亚组的方法,所述方法包括向对象施用包含本文所 述的任何hrs-fc缀合物的组合物,其中所述hrs多肽包含由自身抗体 或自身反应性t细胞特异性识别的至少一种表位,并且其中所述组合物 的施用引起自身反应性t细胞的克隆缺失。
[0380]
在另一实施方案中,本发明包括在参与针对组氨酰trna合成酶 (hrs)自身抗原的
自身免疫反应的t细胞中诱导无变应性的方法,所述方 法包括向对象施用包含本文所述的任何hrs-fc缀合物的组合物,其中所 述hrs多肽包含由自身抗体或t细胞特异性识别的至少一种表位,并且 其中所述组合物的施用引起自身免疫反应中涉及的t细胞功能失活。
[0381]
在另一实施方案中,本发明包括治疗与组氨酰trna合成酶功能不 全相关的疾病的替代疗法,其包括向有需要的对象施用包含本文所述的 任何hrs-fc缀合物的治疗组合物,其中所述hrs多肽功能上补偿组氨 酰trna合成酶功能不全。
[0382]
在该替代疗法的一方面,组氨酰trna合成酶功能不全由抗-jo-1抗 体的存在导致。在该替代疗法的一方面,组氨酰trna合成酶功能不全 由内源性组氨酰trna合成酶突变引起,所述突变调节内源性组氨酰 trna合成酶的活性、表达或细胞分布。在一方面,组氨酰trna合成酶 功能不全与波瑞特综合征(perrault syndrome)或尤塞氏综合征(ushersyndrome)相关。
[0383]
在任何这些方法中,术语“耐受性”是指对哺乳动物,特别是人中 的特定抗原的免疫反应持续降低或不存在。耐受性不同于广义的免疫抑 制,其中免疫反应的所有免疫细胞或所有特定类别的免疫细胞,如b细 胞介导的免疫反应,被降低或消除。耐受性的形成可以通过在以单剂量 或连续剂量施用治疗性hrs-fc缀合物之后,宿主对象的血清中没有hrs 多肽的抗体浓度或hrs多肽的抗体浓度降低来进行常规监测。耐受性的 形成通常将足以减少患者中自身免疫疾病的症状,例如患者可以得到充 分地改善从而在不存在、或在存在减少量的普通免疫抑制剂,如皮质类 固醇的情况下维持正常活性。
[0384]
在任何这些方法中,组合物耐受性通常将被维持,意指其具有约1 个月、约2个月、约3个月、约4个月、约5个月、或约6个月或更长 的持续时间。耐受性可能导致选择性b-细胞无变应性、或t-细胞无变应 性或两者。
[0385]
在任何这些方法、治疗和治疗组合物中,术语“与组氨酰trna合成 酶特异性的自身抗体相关的疾病”是指任何这样的疾病或病症,其中检测 到或可检测到组氨酰trna合成酶的抗体,不考虑其他自身抗体是否也 被检测到,或被认为在疾病进展或成因中起作用。检测患者样品中抗体 的方法可以通过任何标准程序进行,包括例如ria、elisa、免疫沉淀、 组织或细胞(包括转染细胞)染色、抗原微阵列、质谱分析、特异性中和测 定或用于鉴定所需抗原特异性的本领域已知的许多其他方法中的一种。 在一些方面,抗体特异性可进一步通过确定抗体选择性结合组氨酰trna 合成酶的不同剪接变体和截短的或蛋白水解形式的能力来表征。相对熟 知的针对组氨酰trna合成酶的人自身抗体包括例如jo-1的抗体。
[0386]
在任何要求保护的方法和组合物的一些实施方案中,hrs多肽或 hrs-fc缀合物包含来自组氨酰trna合成酶的表位,其与针对组氨酰
ꢀ‑
trna合成酶的疾病相关的自身抗体特异性交叉反应。在任何要求保护 的方法和组合物的一些实施方案中,hrs多肽或hrs-fc缀合物包含来 自组氨酰trna合成酶的表位,其与针对组氨酰-trna合成酶的疾病相关 的自身反应性t细胞特异性交叉反应。在任何要求保护的方法和组合物 的一些实施方案中,hrs多肽或hrs-fc缀合物包含这样的表位,其与 针对另一trna合成酶或非trna合成酶自身抗体的疾病相关的自身抗体 特异性交叉反应。
[0387]
在任何要求保护的方法的一些实施方案中,hrs多肽或hrs-fc缀 合物包含免疫显性表位,其被来自具有与组氨酰-trna合成酶的自身抗 体相关疾病的患者血清的大多数抗体特异性识别。在任何要求保护的方 法的一些实施方案中,hrs多肽或hrs-fc缀合物包含
免疫显性表位, 其被来自具有与组氨酰-trna合成酶的自身抗体相关疾病的患者血清的 大多数自身反应性t细胞特异性识别。
[0388]
在一些实施方案中,表位被包含在hrs多肽的whep结构域内(约 为seq id no:1的氨基酸1-43);氨酰化结构域(约为seq id no:1的氨 基酸54-398);或反密码子结合结构域(约为seq id no:1的氨基酸 406-501)或它们的任何组合。
[0389]
在一些实施方案中,hrs多肽不包含与针对组氨酰-trna合成酶的 疾病相关的自身抗体特异性交叉反应的表位。在一些实施方案中,hrs 多肽在高达约1x 10-7
m浓度下不会在竞争性elisa中显著竞争结合于组 氨酰-trna合成酶的疾病相关的自身抗体。在一些实施方案中,hrs多 肽在高达约5x 10-7
m浓度下不会在竞争性elisa中显著竞争结合于组氨 酰-trna合成酶的疾病相关的自身抗体。在一些实施方案中,hrs多肽 在高达约1x 10-6
m浓度下不会在竞争性elisa中显著竞争结合于组氨酰
ꢀ‑
trna合成酶的疾病相关的自身抗体。
[0390]
因此,在一些实施方案中,hrs多肽对疾病相关的自身抗体的亲和 力低于野生型组氨酰-trna合成酶(seq id no:1),如在竞争性elisa中 测量。在一些实施方案中,hrs多肽对疾病相关的自身抗体的表观亲和 力比疾病相关的自身抗体对野生型人(seq id no:1)的亲和力低至少约 10倍、或至少约20倍、或至少约50倍、或至少约100倍。在一方面, 组氨酰-trna合成酶的自身抗体针对jo-1抗原。
[0391]
与对组氨酰-trna合成酶特异的自身抗体相关的疾病(以及与组氨酰
ꢀ‑
trna合成酶的功能不全相关的疾病)的实例包括但不限于自身免疫疾 病、炎性疾病和炎性肌病,其包括特发性炎性肌病、多肌炎、他汀类药 物诱导的肌病、皮肌炎、间质性肺病(和其他肺纤维化病况)以及诸如多肌 炎-硬皮病重叠和包涵体肌炎(ibm)的相关病症及诸如在抗合成酶综合征 中存在的那些病况,其包括例如间质性肺病、关节炎、食管蠕动障碍、心 血管疾病和诸如雷诺现象的其他血管表现;与组氨酰-trna合成酶的功 能不全相关的疾病的其他实例包括导致活性组氨酰-trna合成酶功能不 全的遗传病症,包括尤塞氏综合征和波瑞特综合征。
[0392]
多肌炎影响身体两侧的骨骼肌(涉及进行运动)。在18岁以下的人群 中很少见到;大多数病例为31至60岁的人群。除了上文列出的症状之 外,进行性肌无力导致难于吞咽、说话,从坐位起立、爬楼梯、抬物体 或够高处。患有多肌炎的人也可能经历关节炎、呼吸短促和心律失常。 多肌炎经常与合成酶(包括hisrs)的抗体相关,从而导致免疫细胞侵入受 损的肌细胞。因此,hrs-fc缀合物可以用于降低免疫细胞活化和侵袭以 及治疗多肌炎。
[0393]
皮肌炎的特征在于先于或伴随进行性肌无力的皮疹。该皮疹看起来 不完整,具有紫色或红色变色,并在眼睑和用于伸展或伸直包括指关节、 肘、膝和脚趾的关节的肌肉上特征性地形成。红疹也可以出现于面部、 颈、肩、上胸、背部和其他部位,在受感染区域也可能有肿胀。有时在 没有明显肌受累时出现皮疹。患有皮肌炎的成人可能经历体重减轻或低 热、肺发炎以及对光敏感。不像多肌炎,成人皮肌炎可以伴随乳腺肿瘤、 肺肿瘤、女性生殖器肿瘤或肠肿瘤。患有皮肌炎的儿童和成人可形成钙 沉着,其在皮肤下或肌肉中看起来呈硬肿块(被称为钙质沉着)。钙质沉着 通常在疾病发作之后1-3年出现,但可以在多年后出现。相比开始于成年 的皮肌炎,这些沉着物更常见于儿童皮肌炎中。皮肌炎可能与胶原-血管 或自身免疫疾病相关。
[0394]
在多肌炎和皮肌炎的一些病例中,随着疾病进展,远端肌肉(远离身 体的躯干,如
在前臂以及脚踝和手腕周围的那些)可受累。多肌炎和皮肌 炎可以与胶原-血管或自身免疫疾病相关,从而导致免疫细胞侵入受损的 肌细胞。因此,hrs-fc缀合物可以用于降低免疫细胞活化和侵袭以及治 疗皮肌炎。
[0395]
包涵体肌炎(ibm)的特征在于进行性肌无力和损耗。肌无力的发作通 常为逐渐的(经数月或数年)并影响近端和远端肌肉。肌无力可以仅影响身 体一侧。有时在受累肌纤维的细胞中见到被称为空泡的小孔。跌倒和绊 跌通常为imb的首个引起注意的症状。对于一些个体,病症开始为手腕 和手指的无力,其导致捏、钉和握物体困难。手腕和手指肌肉可能存在 无力,前臂肌肉和腿部股四头肌可能存在萎缩(肌肉体积变小或减少)。在 约一半ibm病例中出现吞咽困难。虽然早期可出现疾病,但疾病的症状 通常在50岁之后开始。不像多肌炎和皮肌炎,ibm在男性中的出现频率 大于女性。与其他肌营养不良一样,ibm也导致进行性免疫细胞侵入受 损的肌细胞。因此,hrs-fc缀合物可以用于降低免疫细胞活化和侵袭以 及治疗ibm。
[0396]
幼年肌炎与成人皮肌炎和多肌炎具有一些相似性。其通常影响2至 15岁儿童,症状包括近端肌无力和炎症、水肿(引起肿胀的身体组织内液 体的异常聚集)、肌肉痛、疲劳、皮疹、腹痛、发热和挛缩(由肌腱的炎症 引起的关节周围的肌或腱的慢性缩短,这阻止了关节自由移动)。患有幼 年肌炎的儿童也可以具有吞咽和呼吸困难,并且心脏可能受累。患有幼 年皮肌炎的约20%至30%的儿童形成钙质沉着。受累儿童可以在其血液 中不会显示高于正常水平的肌酶肌酸激酶,但具有高于正常水平的其他 肌酶。幼年肌炎也导致进行性的免疫细胞侵入受损的肌细胞。因此, hrs-fc缀合物可以用于降低免疫细胞活化和侵袭以及治疗幼年肌炎。
[0397]
他汀类药物诱导的肌病与长期使用他汀类药物相关,所述他汀类药 物通过抑制3-羟基-3-甲基戊二酰辅酶a还原酶(hmgcr)起作用。通常, 良好耐受的这些药物已经被描述为肌肉毒性的诱导剂。最近,已存在甚 至在药物停止之后他汀类药物肌病在患者中持续的报道,这被假设为具 有自身免疫病因。他汀类药物在降低冠心病和冠状动脉硬化进展的风险 中的益处毫无异议。然而,相关的并发症可危及生命。据估计,目前美 国超过3800万人在服用他汀类药物,预测这些中高达7%(》260万)会形 成肌肉症状,这些肌肉症状中高达0.5%(》190,000)可能继续形成威胁生命 的肌病。
[0398]
所有他汀类药物均可引起肌肉问题,并且风险随着其亲脂性、降胆 固醇的效力和剂量的增加而增加。具体地,西立伐他汀(cerivastatin)已被指 出与较高风险相关,并已撤出美国市场。在剩余的他汀类药物中,阿托 伐他汀(atorvastatin)和辛伐他汀(simvastatin)具有较高的肌肉毒性比率。其 他非他汀类药物降脂药剂,如烟酸和贝特类(fibrates)也携带肌肉问题的风 险,特别是当与他汀类药物组合时。虽然不可能预测什么样的患者将具 有他汀类药物-诱导的肌肉问题,但先前的肌肉问题可能是风险因素且当 开始他汀类药物治疗时应考虑在内。如果患者可能为遗传性肌病的携带 者,则肌病的家族史为有关的,因为它可通过他汀类药物治疗的额外应 激而显露出来。其他风险因素可以包括年龄超过80岁、低体重、女性性 别、甲状腺功能减退、某些遗传缺陷和亚裔以及某些药物的伴随使用, 包括钙通道阻断剂、大环内酯抗生素、奥美拉唑、胺碘酮、唑类抗真菌 药(azole antifungals)、组胺h2受体拮抗剂、奈法唑酮、环孢素、hiv蛋 白酶抑制剂、华法林和西柚汁。
[0399]
他汀类药物引起的最常见肌肉症状为肌肉痛或肌痛,且其在约7%的 他汀类药物用者中出现。肌痛可为从轻至重的任何地方的肌痛且经常因 肌肉活动而严重。如果症状为可忍耐的且他汀类药物治疗适应症例如在 患有高胆固醇血症和近期发生的心肌梗塞的患者中为强的,则继续的他 汀类药物治疗可以为适当的。
[0400]
在开始他汀类药物治疗之前,基线肌酸激酶(ck)水平并未得到指导 他汀类药物治疗的组织机构的一致推荐,但如果肌肉症状随后形成,则 ck水平可提供非常有用的信息。也可出现肌无力,其特征通常为易疲劳 的且与疼痛和升高的ck相组合。与大多数肌病一样,无力为近端最显 著的。他汀类药物治疗也出现罕见的横纹肌溶解发作;虽然发生频率低 得多,但可能为致命的。在他汀类药物肌病的最典型肌肉组织中可观察 到的变化为细胞色素氧化酶阴性纤维、脂质含量增加以及破碎红纤维。 自身免疫性坏死性肌病为他汀肌病的罕见形式。在这些患者中,他汀药 物的中断不会使其恢复,甚至在停药几个月之后也不会。患者具有主要 为近端的、通常为无痛的无力。
[0401]
诊断基于个体的病史、体检结果和肌肉强度测试以及显示升高水平 的各种肌肉酶和自身抗体的血样。诊断工具包括肌电图,其记录收缩和 静止期间控制肌肉的电活性;超声,其用于寻找肌肉炎症;以及磁共振 成像,其显示异常肌肉并评价肌肉疾病。可通过显微镜检查慢性炎症、 肌纤维死亡、血管变形或对ibm的诊断特异的变化的体征来检查肌活检。 因此,hrs-fc缀合物可以用于降低免疫细胞活化和侵袭至受损肌肉,以 及治疗他汀类药物诱导的肌病和横纹肌溶解。
[0402]
间质性肺病(ild)为广义的肺疾病类别,其包括特征为肺的瘢痕形成 (即,“纤维化”)和/或炎症的130多种病症。ild占胸肺科医生所见病例的 15%。间质性肺病(ild)可由多种来源形成,所述来源范围为其他疾病至 环境因素。ild的一些已知病因包括:结缔组织或自身免疫疾病,包括 例如,硬皮病/进行性系统性硬化、狼疮(系统性红斑狼疮)、类风湿性关 节炎和多肌炎/皮肌炎;以及职业的和环境暴露,包括例如,暴露于灰尘 和某些气体、毒物、化学疗法和辐射疗法。
[0403]
在ild中,肺中的组织变为发炎的和/或瘢痕的。肺的间质包括小血 管和肺泡(气囊)中及附近区域,在那发生氧气和二氧化碳的交换。间质的 炎症和瘢痕形成破坏该组织并导致肺从空气吸取氧的能力降低。因此, hrs-fc缀合物可以用于降低免疫细胞活化和侵袭至受损肺以及治疗ild。
[0404]
ild的进展在疾病间和个体方面有差异。因为间质性肺病破坏肺中 氧气和二氧化碳的转移,所以其症状通常表现为呼吸问题。ild的两种 最常见症状为锻炼时呼吸短促和无痰干咳。
[0405]
尤塞氏综合征(usher syndrome)为影响听觉和视觉的最常见病况。尤 塞氏综合征的主要症状为听觉损失和色素性视网膜炎(rp)。rp通过视网 膜的进行性变性引起夜盲症和周边视觉(侧视)丧失。随着rp进展,视野 变窄直至仅保留中心视觉。许多患有尤塞氏综合征的人也具有严重的平 衡问题。约3-6%的所有耳聋儿童以及另一3-6%的耳背儿童具有尤塞氏综 合征。在诸如美国的发达国家中,每100,000个出生中约四名婴儿具有尤 塞氏综合征。尤塞氏综合征以常染色体隐性遗传特性遗传。几个基因座 已与尤塞氏综合征相关,所述基因座包括组氨酰t-rna合成酶 (puffenberger等,(2012)plos one 7(1)e28936 doi:10.1371/journal. pone.0028936)。
[0406]
尤塞氏综合征存在三种临床类型:1型、2型和3型。在美国,1型 和2型为最常见类型。总之,它们在患有尤塞氏综合征的所有儿童病例 中占约90-95%。
[0407]
患有1型尤塞氏综合征的儿童在出生时深度耳聋并且具有严重平衡 问题。由于与1型尤塞氏综合征相关的平衡问题,患有该病症的儿童在 没有支撑时坐立迟缓,且在18个月大之前通常不会独立行走。这些儿童 通常在幼童时期形成视觉问题,几乎一直到他们10岁时。视觉问题最经 常开始于在晚上具有视觉困难,但趋向进展迅速直至该人完全失明。
[0408]
患有2型尤塞氏综合征的儿童在出生时具有中度至严重的听觉损失 和正常平衡。虽然听觉损失的严重度不同,但大多数儿童能获益于助听 器并能进行口头交流。在2型尤塞氏综合征中的视觉问题趋向比1型中 的视觉问题进展缓慢,其中直至青少年时才会发作rp。
[0409]
患有3型尤塞氏综合征的儿童在出生时具有正常的听觉。虽然患有 该病症的大多数儿童具有正常至接近正常的平衡,但一些可能在以后形 成平衡问题。随着时间的推移,听觉和视力恶化,但其衰退率可在人之 间(甚至在相同家族内)有差异。患有3型尤塞氏综合征的人可能到青少年 时形成听觉损伤,他或她通常到成年中期或成年晚期需要助听器。夜盲 症通常在青春期某时开始。盲点到青春晚期至成年早期出现,到成年中 期,该人为法定失明。
[0410]
波瑞特综合征(ps)的特征在于:与患有感觉神经听力损害的女性卵巢 发育不全相关,在一些对象中为神经系统异常,包括进行性小脑共济失 调和智力低下。波瑞特综合征的确切患病率为未知的,可能未被充分诊 断,特别是在男性中,其中性腺功能减退症不是特征且这一症状保持未 被检测到的。按照患有感觉神经性聋的女性中青春期延迟的呈现,诊断 的平均年龄为22岁。听觉缺陷在所有病例中为显著的,除了其中一名报 道的病例(诊断时的平均年龄为8岁)。听觉丧失一直是感觉神经性的且双 侧的,但严重度为可变的(轻微的至显著的),甚至在来自相同家族的受累 患者中。已在所有女性病例中报道了卵巢发育不全,但在男性中未检测 到性腺缺陷。闭经通常为原发性的,但也已报道了继发性闭经。在半数 记录的病例中报道了发育迟缓(身高低于第三百分位数)。神经学异常的 确切频率为未知的,但已报道没有神经学异常的九名女性和两名男性 (16-37岁)。神经学体征为进行性的,通常在生命后期出现,然而在年轻 ps患者中已注意到走路延迟或早期频繁摔倒。常见的神经学体征为共济 失调、运动障碍、有限的眼外运动和多神经病。也已报道了患有脊柱侧 凸的一些病例。ps的传递为常染色体隐性的,最近已确定线粒体组氨酰 trna合成酶的突变引起与波瑞特综合征相关的卵巢发育不全和感觉神 经性听觉丧失。(pierce等,pnas usa.108(16)6543-6548,2011)。
[0411]
肌营养不良是指一组这样的遗传病症,其中强度和肌肉体积逐渐降 低。所有肌营养不良的标志为肌无力,所述肌无力由一种或多种肌肉特 异性基因中的原发遗传缺陷驱动。另外,肌营养不良通常具有多变的炎 性组分,所述炎性组分驱使肌肉炎症并最终促进肌肉组织的变性。因此, hrs-fc缀合物可以用于降低免疫细胞活化和侵袭至受损肌肉以及治疗 肌营养不良。至少九种类型的肌营养不良通常为公知的。在一些方面, 所述肌营养不良选自:杜氏肌营养不良、贝克肌营养不良、emery-dreifuss 肌营养不良、肢带型肌营养不良、面肩肱型肌营养不良、肌强直性营养 不良、眼咽肌营养不良、远端肌营养不良和先天性肌营养不良。
[0412]
杜氏肌营养不良(dmd):dmd影响年轻男孩,引起通常开始于腿部 的进行性肌无力。其为肌营养不良的最严重形式。在出生3,500名男孩中 出现约1例dmd,在美国其影响大约8,000名男孩和年轻男性。在非常 少的女性携带者中出现轻度形式。
[0413]
dmd由编码肌营养不良蛋白的基因突变引起,所述肌营养不良蛋白 为在防止功能性蛋白质产生的肌营养不良蛋白相关的糖蛋白复合体 (dgc)内发挥作用的肌膜下蛋白。肌营养不良蛋白的量与疾病的严重度相 关(即,存在的肌营养不良蛋白越少,表型越严重)。dgc复合体将细胞 内细胞骨架连接至细胞外基质。dgc在肌节的z-线聚集,并赋予穿过肌 纤维的力的传递。该连接的破坏导致膜不稳定,这最终导致肌膜破裂。 细胞外钙的流入改变如肌肉收缩的分子过程并激活蛋白水解活性。受累 肌纤维变为坏死的或凋亡的,并释放促有丝分裂化学引诱物,其引发炎 性过程。变性和再生的循环最终导致不可逆的肌肉萎缩以及被纤维化和 脂肪组织取代。
[0414]
患有杜氏肌营养不良的男孩通常在学龄前儿童时开始显示症状。首 先腿部受累,从而使得行走困难并引起平衡问题。多数患者比预期晚三 至六个月才会行走,并在跑动中存在困难。挛缩(永久的肌肉紧缩)通常在 五岁或六岁开始,最严重的为腓肠肌。在该年龄,频繁的摔倒和骨折为 常见的开始。到九岁或十岁时,爬楼梯和独立的起身可能变为不可能的, 并且到十二岁时,多数男孩使用轮椅移动。大约在该年龄躯干肌的无力 经常导致脊柱侧弯(侧向脊柱弯曲)和脊柱后凸(前后弯曲)。
[0415]
dmd的最严重的无力之一为膈无力,所述膈是位于腹部上端执行主 要的呼吸和咳嗽工作的肌肉层。膈无力导致精力和活力下降,并由于不 能有效地咳嗽而使肺部感染增加。患有dmd的年轻男性可活至其二十几 岁及以上,条件是他们具有机械通气辅助和优良的呼吸卫生。
[0416]
在一些实施方案中,患有dmd的对象的特征在于以下的一种或多 种:反映下肢肌肉病损的阳性高尔斯氏征(positive gower’s sign);血液中 高水平的肌酸激酶(cpk-mm);xp21基因的基因错误;或例如通过肌活 检所测量的肌营养不良蛋白的水平降低或不存在。
[0417]
可以单独地或与其他疗法组合使用hrs-fc缀合物治疗dmd,所述 疗法如反义寡核苷酸类(例如,外显子跳跃疗法,如eteplirsen)、皮质甾 类、β2-激动剂、物理疗法、呼吸支持、干细胞疗法和基因替代疗法。在 一些实施方案中,hrs-fc缀合物的施用在6-分钟行走测试中产生统计上 显著的改善。
[0418]
贝克肌营养不良(bmd):bmd按照比dmd轻度的病程影响年长男 孩和年轻男性。在出生30,000名男性中出现约1例bmd。贝克肌营养不 良为不如杜氏肌营养不良严重的变型,其由产生的截短的、但具有部分 功能形式的肌营养不良蛋白导致。
[0419]
bmd的症状通常在童年晚期至成年早期出现。虽然症状的进展可能 平行于dmd的进展,但症状通常为轻度的且病程更易变的。可出现脊柱 侧凸,但其通常为轻度的并进展更缓慢。在bmd中更常出现心肌疾病(心 肌病)。问题可以包括心跳不规则(心率失常)和充血性心力衰竭。症状可 以包括疲劳、呼吸短促、胸痛和眩晕。也出现呼吸无力,并且可能导致 需要机械通气。可以单独地或与其他疗法组合使用hrs-fc缀合物来治疗 bmd。
[0420]
emery-dreifuss肌营养不良(edmd):edmd影响年轻男孩,引起 小腿挛缩和无力、肩膀和上臂无力以及电脉冲经过心脏使其跳动的方式 的问题(心脏传导缺陷)。存在三种
亚型的emery-dreifuss肌营养不良,可 通过其遗传模式进行区别:x-连锁的、常染色体显性和常染色体隐性。 x-连锁形式为最常见的。每种类型在患病率和症状方面有差异。疾病由 lmna基因,或更常见的emd基因的突变引起。两种基因编码核被膜 的蛋白质组分。
[0421]
edmd通常开始于幼童时期,在肌无力之前通常患有挛缩。无力最 初影响肩膀和上臂连同腓肠肌群,从而导致足下垂(foot-drop)。患有 edmd的多数男性存活至中年,虽然如果不用起搏器治疗,心律的缺陷 (心脏传导阻滞)可为致命的。hrs-fc缀合物可以单独地或与其他疗法组 合用于治疗edmd。
[0422]
肢带型肌营养不良(lgmd):lgmd开始于童年晚期至成年早期并 影响男性和女性,引起臀部和肩膀周围的肌肉无力。它为肌营养不良中 最可变的,并且存在现在公认的几种不同形式的疾病。患有疑似lgmd 的许多人在过去可能被误诊,并且因此难于估计疾病的患病率。在美国 受影响的人数可能为小几千。
[0423]
虽然存在至少六种基因能引起不同类型的lgmd,lgmd的两种主 要临床形式是通常公认的。严重的童年期形式看起来类似于dmd,但以 常染色体隐性特质遗传。
[0424]
肢带型肌营养不良2b型(lgmd2b)由dysferlin基因的功能丧失突变 引起。dysferlin主要在骨骼肌和心肌中表达,而且也在单核细胞、巨噬 细胞以及其中它被定位于胞质小泡和细胞膜的其他组织中表达。dysferlin 似乎参与膜融合和运输以及修复过程。lgmd2b为迟发(青少年/青壮年) 肌病,其特征在于:进行性对称的肌无力,尤其为侵入性免疫/炎性病变。 肌活检通常显示显著的炎症细胞浸润,以及肌纤维变性/再生,炎症细胞 浸润主要由巨噬细胞/巨噬细胞活化标志物(hla-dr、hla-abc、cd86)、 cd8
+
细胞毒性t细胞和cd4
+
t细胞组成。因此,hrs-fc缀合物可以用 于降低免疫细胞活化和侵入至受损肌肉,以及治疗肢带型肌营养不良。
[0425]
成年发作的lgmd的症状通常出现在人的青少年或二十几岁,且以 躯干附近肌肉的进行性无力和萎缩为标志。可出现挛缩,且行走的能力 通常在发作后约20年丧失。患有lgmd的一些人发展为需要使用呼吸 机的呼吸无力。寿命可能稍微缩短。(常染色体显性形式通常出现在生命 后期,且进展相对缓慢。)
[0426]
面肩肱型肌营养不良(fsh):fsh,也称为landouzy-dejerine疾病, 开始于童年晚期至成年早期并影响男性和女性,引起面部、肩膀和上臂 的肌无力。臀部和腿部也可受到影响。在每20,000人中发生约1例fsh, 并在美国影响大约13,000人。
[0427]
fsh在其严重度和发作年龄方面有差异,甚至在相同家族的成员之 间。虽然婴儿或童年发作是可能的,症状最常开始于青少年或二十岁出 头。在早期发作的人群中症状趋向更严重。疾病被指定为受疾病影响最 严重的身体区域:面部(面-)肌肉、肩膀(肩胛-)肌肉和上臂(肱骨的)肌肉。 臀部和腿部也可受到影响。患有fsh的儿童经常患有部分或全聋。
[0428]
fshd需要两个缺陷,第一为d4z4重复序列的缺失,第二为dux4 基因的“毒性功能的获得”。注意到的第一症状为经常难于将物体举过肩 膀。在一侧的无力可能大于另一侧。肩膀无力也引起肩胛骨向后突出, 被称为翼状肩胛(scapular winging)。fshd与特定肌肉群的炎性侵袭相关, 因此hrs-fc缀合物可以用于降低免疫细胞活化和侵袭至受损肌肉以及 治疗fshd。
[0429]
肌强直性肌营养不良:肌强直性肌营养不良(也称为steinert病)影响 男性和女性,引起首先在面部、足和手观察到的全身无力。它伴随有不 能放松受累肌肉(肌强直)。症
状可开始于出生至成年期。肌强直性肌营养 不良1型1(dm1)为肌营养不良的最常见形式,影响美国30,000多人。它 起因于dmpk(肌强直性营养不良蛋白激酶)基因的dna序列中短(ctg) 重复序列的扩增。肌强直性肌营养不良2型(dm2)非常罕见,并且为 znf9(锌指蛋白9)基因中cctg重复序列扩增的结果。
[0430]
肌强直性肌营养不良的症状包括面部无力和下巴松弛、睑下垂(下垂 症)以及前臂和小腿肌肉萎缩。患有该营养不良的人难于放松其握力,尤 其是如果对象为冷的。肌强直性肌营养不良影响心肌,从而引起心率失 常和心脏传导阻滞;影响消化系统的肌肉,从而引起动力障碍和便秘。 也影响其他身体系统:肌强直性营养不良可以引起白内障、视网膜变性、 低的iq、额头变秃、皮肤病症、睾丸萎缩、睡眠呼吸暂停和胰岛素抗药 性。因为积极性下降,增加睡眠的需求或期望睡眠为常见的。虽然多数 甚至在生命晚期不需要轮椅,但在发作的20年内严重残疾影响患有该类 型营养不良的多数人。因此,hrs-fc缀合物能够通过例如减少与肌肉组 织相关的炎症而用于治疗肌强直性营养不良,所述肌肉组织包括骨骼肌 (例如,四头肌)和/或心脏组织以及其他组织。
[0431]
眼咽肌营养不良(opmd):opmd影响两种性别的成年人,引起眼 部肌肉和咽喉的无力。它在魁北克的法裔加拿大家族以及在美国西南部 的西班牙裔美国家族中最常见。
[0432]
opmd通常开始于人的三十多岁或四十多岁,其中控制眼部或咽喉 的肌肉无力。症状包括睑下垂、难于吞咽(吞咽困难)并且无力会发展至面 部、颈以及偶尔上肢的其他肌肉。吞咽困难可以引起误吸,或将食物或 唾液引入气道。肺炎可能会随后发生。因此,hrs-fc缀合物能够通过例 如降低与肌肉组织相关的炎症而用于治疗opmd。
[0433]
远端肌营养不良(dd):dd开始于中年或更晚,引起足和手的肌肉无 力。它在瑞典最为常见,而在世界的其他地方罕见。dd通常开始于二十 多岁或三十多岁,其中手、前臂和小腿无力。诸如打字或系扣的精细运 动困难可为第一症状。症状进展缓慢,并且该疾病通常不会影响寿命。 因此,hrs-fc缀合物可通过降低与肌肉组织炎症相关的炎症而用于治疗 dd。
[0434]
先天性肌营养不良(cmd):cmd从出生时便存在,导致全身无力并 通常进展缓慢。被称为福山cmd(fukuyama cmd)的亚型也涉及精神发 育迟滞。两种均为罕见的;福山cmd在日本更常见。
[0435]
cmd的标志为从出生起严重的肌无力,婴儿时显示“松软”和极少的 随意运动。虽然如此,但患有cmd的儿童可在具有或没有一些辅助装置 时学会走路,并活至成年早期或更久。相比之下,患有福山cmd的儿童 很少能够走路,并具有严重的精神发育迟滞。具有该类型的cmd的多数 儿童死于童年。与其他肌营养不良一样,hrs-fc缀合物因此可例如通过 降低与肌肉组织炎症相关的炎症而用于治疗cmd。
[0436]
恶病质:恶病质(或消耗综合征)通常以体重减轻、肌肉萎缩、疲劳、 无力以及在未主动地试图减肥的某人中显著的食欲缺乏为特征。恶病质 的正式定义为营养上不可逆转的体重丧失。即使受累患者饮食更多卡路 里,去脂体重也丧失,这表明存在原发性病变。
[0437]
患有癌症、aids、慢性阻塞性肺疾病、多发性硬化、充血性心力衰 竭、肺结核、家族性淀粉样多神经病、汞中毒(肢痛症)和激素缺乏症以及 其他疾病的患者经历恶病质。
[0438]
恶病质也可为多种潜在病症的迹象,所述病症包括:癌症、代谢性 酸中毒(即,蛋白质合成降低并且蛋白质分解代谢增加)、某些感染性疾病 (例如,肺结核、aids)、慢性胰
腺炎、自身免疫病症或苯丙胺类成瘾。 恶病质使患者身体变弱至不能动的状态,这源于食欲缺乏、无力和贫血, 并且恶病质对标准治疗的反应通常为差的。
[0439]
约50%的所有癌症患者遭受恶病质。患有上胃肠道和胰腺癌的那些 患者具有形成恶病质症状的最高频率。除了渐增的发病率和死亡率、加 重的化疗副作用和下降的生活质量之外,恶病质被认为是大比例的癌症 患者(范围为22%至40%的患者)死亡的直接原因。癌症恶病质的症状包括 渐进性体重减轻以及宿主储备的脂肪组织和骨骼肌的消耗。传统的治疗 方法包括使用食欲刺激药、5-ht3拮抗剂、营养补充和cox-2抑制剂。
[0440]
虽然对恶病质的发病机制了解很少,预期涉及多个生物途径,包括 促炎细胞因子如tnf-α、神经内分泌激素、igf-1和肿瘤特异性因子,如 蛋白质水解诱导因子。
[0441]
因此,hrs-fc缀合物可以用于治疗恶病质以及其任何相关的、潜在 的或继发性病症或并发症。hrs-fc缀合物可单独使用或与其他疗法组合 使用,所述其他疗法如高蛋白、亮氨酸和鱼油组合的膳食补充、抗氧化 剂、孕激素(醋酸甲地孕酮、醋酸甲羟孕酮)和抗环氧化酶-2药物、食欲刺 激药和5-ht3拮抗剂等。
[0442]
横纹肌溶解:横纹肌溶解为骨骼肌组织中肌纤维的分解。分解产物 被释放至血流,这些产物中的某些,如肌红蛋白对肾有害并且可导致肾 衰竭。
[0443]
症状包括肌肉痛、呕吐、意识错乱、昏迷或异常的心率和节律并且 其严重度通常取决于肌肉受损程度以及是否发展为肾衰竭。肾的损伤可 导致尿产生减少或无尿,这通常在初始肌肉受损之后约12至24小时发 生。受损肌肉的肿胀可引起隔室综合征或外围组织,如神经和血管,在 相同筋膜隔室中的挤压,并导致失血和受累身体部位的损伤(例如,功能 的丧失)。该并发症的症状包括患肢疼痛或感觉减少。其他并发症包括弥 漫性血管内凝血(dic),即可导致不受控出血的严重凝血障碍。
[0444]
初始肌肉损伤可以通过以下引起:例如,物理因素(例如挤压伤、剧 烈运动)、改变的血供(例如,动脉血栓形成、栓塞)、改变的新陈代谢(例 如,高血糖高渗性状态、高-和低钠血症、低钾血症、低钙血症、低磷血 症、酮酸中毒、甲状腺功能减退症)、改变的体温(过高热、低体温)、药 物和毒素(例如,他汀类药物、抗精神病药物、神经肌肉阻滞药、利尿药、 重金属、铁杉、昆虫或蛇毒液类)、药物滥用(例如,醇、苯丙胺、可卡因、 海洛因、氯胺酮、lds、mdma)、感染(例如,柯萨奇病毒、流感病毒a 型、流感病毒b型、爱泼斯坦-巴尔病毒、原发性hiv感染、恶性疟原虫 (plasmodium falciparum)、疱疹病毒、嗜肺军团病杆菌(legionellapneumophila)、沙门氏菌)和自身免疫肌肉损伤(例如,多肌炎、皮肌炎)。 另外,某些遗传病况增加横纹肌溶解的风险,包括醣酵解和糖原分解缺 陷(例如,麦卡德尔疾病(mcardle’s disease)、磷酸果糖激酶缺乏症、糖原 沉积病viii、ix、x和xi)、脂类代谢缺陷(例如,肉碱棕榈酰转移酶i 和ii缺乏症、酰基辅酶a脱氢酶的亚型缺乏症(例如,lcad、scad、 mcad、vlcad、3-羟酰基-辅酶a脱氢酶缺乏症)、硫解酶缺乏症)、线 粒体肌病(例如,琥珀酸脱氢酶缺乏症、细胞色素c氧化酶缺乏症和辅酶 q10缺乏症)以及其他,如葡萄糖-6-磷酸脱氢酶缺乏症、肌腺苷酸脱氨酶 缺乏症和肌营养不良。
[0445]
横纹肌溶解通常用验血和尿分析诊断,并且可通过异常升高或增加 的肌酸酐和尿素水平、下降的尿排出量或尿的红褐色变色来指示。主要 的治疗包括静脉内液、透析和血液滤过。
[0446]
因此,hrs-fc缀合物可以用于治疗横纹肌溶解及其任何相关的、继 发的或潜在的
病症或并发症。hrs-fc缀合物可单独使用或与其他疗法组 合使用,所述疗法包括意图治疗休克和保护肾功能的那些。示例性疗法 包括静脉内液体供给,通常为等渗盐水(每体积氯化钠溶液为0.9重量%) 以及诸如血液透析、连续血液滤过和腹膜透析的肾替代疗法(rrt)。
[0447]
更普遍地,本文所述的hrs-fc缀合物可诸如通过减少免疫细胞的活 化、分化、迁移或浸润至所选组织,增加抗炎细胞因子的产生或降低促 炎细胞因子的产生或活性及其他机制来减少炎症应答。而且,通过阻断 抗组氨酰-trna合成酶抗体或自身反应性t细胞的结合、作用或产生, 本发明方法中的某些可用于治疗与抗组氨酰-trna合成酶抗体、其他自 身抗体以及组氨酰-trna合成酶功能不全的其他原因相关的广泛的自身 免疫和炎性疾病和病症。
[0448]
药物制剂、施用和试剂盒
[0449]
本发明的实施方案包括包含hrs-fc缀合多肽的组合物,其配制为药 学上可接受的或生理上可接受的溶液,用于单独地或与一种或多种其他 治疗形式组合施用至细胞、对象或动物。还应理解,如需要,本发明的 组合物还可以与其他制剂例如,其他蛋白或多肽或多种药物活性制剂组 合施用。实际上对于也可以包含在所述组合物中的其他组分没有限制, 只要所述另外的制剂对所要实现的调节或其他效果没有不利影响。
[0450]
对于药物生产,hrs-fc缀合物治疗组合物通常基本上无内毒素。内 毒素是与某些细菌,通常为革兰氏阴性菌相关的毒素,尽管内毒素也可 以发现于革兰氏阳性菌,如单核细胞增生李斯特菌中。最常见的内毒素 为各种革兰氏阴性菌外膜中发现的脂多糖(lps)或脂寡糖(los),且其代 表了这些细菌致病能力的重要致病特征。人体中少量的内毒素可以引起 发热、血压降低以及炎症激活和凝血以及其他不良生理作用。
[0451]
可使用本领域已知的常规技术检测内毒素。例如,利用来自鲎的血 液的鲎试剂测定(limulus amoebocyte lysate assay),是检测内毒素存在的 非常灵敏的测定。在该检测中,由于强有力的酶级联放大了该反应,很 低水平的lps可导致鲎试剂的可检测凝聚。内毒素也可通过酶联免疫吸 附测定(elisa)来定量。
[0452]
基本上无内毒素时,内毒素水平可以为:小于约0.001、0.005、0.01、 0.02、0.03、0.04、0.05、0.06、0.08、0.09、0.1、0.5、1.0、1.5、2、2.5、 3、4、5、6、7、8、9或10eu/mg蛋白。通常,1ng脂多糖(lps)对应于 约1-10eu。
[0453]
在某些实施方案中,如本文所述,所述hrs-fc缀合物组合物具有的 内毒素含量为:小于约10eu/mg hrs-fc缀合物、或小于约5eu/mghrs-fc缀合物、小于约3eu/mg hrs-fc缀合物、或小于约1eu/mghrs-fc缀合物、或小于约0.1eu/mg hrs-fc缀合物、或小于约0.01eu/mghrs-fc缀合物。在某些实施方案中,如上所述,基于蛋白重量百分比, 所述hrs-fc缀合药物组合物为约95%无内毒素,优选约99%无内毒素, 且更优选约99.99%无内毒素。
[0454]
包含治疗剂量的hrs-fc缀合多肽的药物组合物包括组氨酰-trna合 成酶的所有同源物、直系同源物和天然存在的亚型。
[0455]
在一些实施方案中,这类药物组合物可以包含组氨酸缓冲液,其在 任何所述药物组合物中可以存在的范围为约1mm至约100mm。在一些 实施方案中,所述组氨酸缓冲液可以存在的浓度为:约1mm、约2mm、 约3mm、约4mm、约5mm、约6mm、约7mm、约8mm、约9mm、 约10mm、
约11mm、约12mm、约13mm、约14mm、约15mm、 约16mm、约17mm、约18mm、约19mm、约20mm、约25mm、 约30mm、约40mm、约50mm、约60mm、约70mm、约80mm、 约90mm或约100mm,包括所述浓度之间的所有整数和范围。
[0456]
在一方面,这类组合物可以包含基本上单分散的hrs-fc缀合多肽, 意指当例如通过尺寸排阻色谱、动态光散射或分析超离心来评估时,所 述hrs-fc缀合组合物主要(即至少约90%或更多)以一种表观分子量形式 存在。
[0457]
在另一方面,这类组合物具有的纯度(基于蛋白)为至少约90%;或者 在一些方面,至少约95%纯度;或者在一些实施方案中,至少98%纯度。 可以通过本领域已知的任何常规分析方法来测定纯度。
[0458]
在另一方面,相比存在的蛋白总量,这类组合物具有的高分子量聚 集物含量小于约10%;或者在一些实施方案中,这类组合物具有的高分 子量聚集物含量小于约5%;或者在一些方面,这类组合物具有的高分子 量聚集物含量小于约3%;或者在一些实施方案中,高分子量聚集物含量 小于约1%。高分子量聚集物含量可以通过多种分析技术来测定,包括例 如,尺寸排阻色谱、动态光散射或分析超离心。
[0459]
药物组合物可以包括hrs-fc缀合多肽的药学上可接受的盐。关于合 适的盐的综述,参见stahl和wermuth的handbook of pharmaceuticalsalts:properties,selection,and use(wiley-vch,2002)。合适的碱盐由形成 无毒性盐的碱形成。代表性实例包括铝盐、精氨酸盐、苄星青霉素盐、 钙盐、胆碱盐、二乙胺盐、二乙醇胺盐、甘氨酸盐、赖氨酸盐、镁盐、 匍甲胺盐、乙醇胺盐、钾盐、钠盐、氨丁三醇盐和锌盐。也可以形成酸 和碱的半盐,例如,半硫酸盐和半钙盐。适于肠胃外施用的用于本发明 的组合物可以包含药物活性成分的无菌水溶液和/或悬浮液,优选与受体 的血液等渗,通常使用氯化钠、甘油、葡萄糖、甘露醇、山梨醇等。以 示例而非限制的方式,适于形成药学上可接受的酸加成盐的有机酸包括 乙酸、三氟乙酸、丙酸、己酸、环戊烷丙酸、乙醇酸、草酸、丙酮酸、 乳酸、丙二酸、琥珀酸、苹果酸、马来酸、富马酸、酒石酸、柠檬酸、 棕榈酸、苯甲酸、3-(4-羟基苯甲酰)苯甲酸、肉桂酸、扁桃酸、烷基磺酸(例 如、甲磺酸、乙磺酸、1,2-乙烷-二磺酸、2-羟基乙烷磺酸)、芳基磺酸(例 如苯磺酸、4-氯苯磺酸、2-萘磺酸、4-甲苯磺酸、樟脑磺酸)、4-甲基二环 (2.2.2)-辛-2-烯-1-羧酸、葡庚糖酸、3-苯基丙酸、三甲基乙酸、叔丁基乙 酸、十二烷基硫酸、葡糖酸、谷氨酸、羟萘甲酸、水杨酸、硬脂酸、粘 康酸等。
[0460]
在具体实施方案中,载体可以包括水。在一些实施方案中,所述载 体可以为盐的水溶液,例如,在生理ph下含有生理浓度的钠、钾、钙、 镁和氯化物的水。在一些实施方案中,所述载体可以为水且所述制剂还 可以包含nacl。在一些实施方案中,所述制剂可以为等渗的。在一些实 施方案中,所述制剂可以为低渗的。在其他实施方案中,所述制剂可以 为高渗的。在一些实施方案中,所述制剂可以为等渗压的(isomostic)。在 一些实施方案中,所述制剂基本上无聚合物(例如,形成凝胶的聚合物、 聚合物粘性增强剂)。在一些实施方案中,所述制剂基本上无粘性增强剂 (例如,羧甲基纤维素、聚阴离子聚合物)。在一些实施方案中,所述制剂 基本上无形成凝胶的聚合物。在一些实施方案中,所述制剂的粘度约与 含有相同浓度的hrs-fc缀合物(或其药学上可接受的盐)的盐溶液的粘度 相同。
[0461]
在本发明的药物组合物中,药学上可接受的赋形剂和载体溶液的制 剂为本领域技术人员熟知的,其为将本文所述的具体组合物开发用于各 种治疗方案的合适的给药和
选包含等渗剂,例如糖或氯化钠。可通过在该组合物中使用延迟吸收剂, 例如单硬脂酸铝和明胶,使得该可注射组合物延长吸收。
[0470]
对于在水溶液中进行的肠胃外施用,例如,如需要,应将溶液适当 地进行缓冲,且应首先用足够的盐或葡萄糖使液体稀释剂等渗。这些特 定的水溶液尤其适于经静脉内、肌肉内、皮下和腹膜内施用。在这方面, 鉴于本公开,可使用的无菌水介质应是本领域技术人员已知的。例如, 可以将一个剂量溶解于1ml等渗的nacl溶液中,并加入至1000ml皮下 输注流体中或在建议的输注部位注射(参见,例如remington’spharmaceutical sciences,第15版,pp.1035-1038和1570-1580)。根据受治 疗对象的状况,必然存在剂量的一些变化。在任何情况下,负责施用的 人将确定用于个体对象的适当剂量。此外,对于人施用,制剂应符合fda 生物制剂标准办公室(office of biologics standards)所要求的无菌、产热原 性以及一般安全和纯度标准。
[0471]
无菌可注射溶液可通过如下来制备:以所需量将活性化合物掺入至 具有以上所列的各种其他成分的适当溶剂中,根据需要,接着进行过滤 灭菌。通常,分散体按如下制备:将各种无菌活性成分掺入至含有碱性 分散介质和所需的上述所列的其他成分的无菌媒介物中。在用于制备无 菌可注射溶液的无菌粉末的情况下,优选的制备方法为真空干燥和冷冻 干燥技术,其从其此前无菌过滤的溶液产生活性成分加任何其他所需成 分的粉末。
[0472]
本文公开的组合物可以制备为中性或盐形式。药学上可接受的盐, 包括酸加成盐(与蛋白的游离氨基形成的),且其是与无机酸如盐酸或磷 酸,或者有机酸如乙酸、草酸、酒石酸、扁桃酸等形成的。与游离羧基 形成的盐也可衍生自无机碱如氢氧化钠、氢氧化钾、氢氧化铵、氢氧化 钙或氢氧化铁,以及有机碱如异丙胺、三甲胺、组氨酸、普鲁卡因等。 配制制剂时,溶液应以与剂量制剂相容的方式且以治疗有效的量施用。 所述制剂可以以多种剂型容易地施用,如可注射溶液、药物释放胶囊等。
[0473]
如本文所用,“载体”包括任何和所有溶剂、分散介质、媒介物、包 衣、稀释剂、抗细菌和抗真菌剂、等渗和吸收延迟剂、缓冲剂、载体溶 液、悬浮液、胶体等。将这类介质和试剂用于药物活性物质的应用为本 领域技术人员熟知的。除了任何常规介质或试剂与活性成分不相容时, 本文包括其在治疗组合物中的应用。补充的活性成分也可掺入至组合物 中。
[0474]
短语“药学上可接受的”是指当被施用至人时不产生过敏或类似不良 反应的分子实体和组合物。含有蛋白质作为活性成分的水性组合物的制 剂为本领域熟知的。通常,这类组合物以作为液体溶液或悬浮液的注射 剂制备;也可制备适于在注射前为液体形式的溶液或悬浮液的固体形式。 所述制剂也可被乳化。
[0475]
用于本发明的hrs-fc缀合多肽也可以单独地或与以下物质联用而 局部地、经皮(内)或透皮施用至皮肤、粘膜或眼睛表面:一种或多种抗组 胺药、一种或多种抗生素、一种或多种抗真菌剂、一种或多种β-阻滞剂、 一种或多种抗炎剂、一种或多种抗肿瘤剂、一种或多种免疫抑制剂、一 种或多种抗病毒剂、一种或多种抗氧化剂或其他活性剂。用于局部和经 眼施用的制剂可以配制为速释和/或调节的释放。调节的释放制剂包括延 迟的、缓释的、脉冲的、受控的、定向的和程序化释放。
[0476]
用于该目的的典型制剂包括:凝胶、水凝胶、洗剂、溶液、滴眼剂、 乳膏、软膏、扑粉(dusting powder)、敷料剂、泡沫剂、膜剂、皮肤贴剂、 薄片(wafer)、植入物、海绵、纤维、绷
带和微乳液。也可以使用脂质体。 典型的载体包括乙醇、水、矿物油、液态石蜡、白石蜡、甘油、聚乙二 醇和丙二醇。可以掺入渗透增强剂—参见,例如,finnin和morgan:j. pharm.sci.88(10):955-958,(1999)。其他局部施用的方式包括通过以下方 法递送:电穿孔法、电离子透入疗法、声透疗法、超声促渗和微针法或 无针注射(例如,以商标名powderject
tm
、bioject
tm
出售的系统)。
[0477]
抗组胺药的实例包括但不限于:氯雷他定(loradatine)、羟嗪、苯海拉 明、氯苯那敏、溴苯那敏、赛庚啶、特非那定、氯马斯汀、曲普利啶、 卡比沙明、二苯拉林、苯茚胺、阿扎他定、曲吡那敏、右旋氯苯那敏、 右旋溴苯那敏、甲吡吩嗪和三甲丙咪嗪抗敏安(trimprazine doxylamine)、 抗感明、嘧啶胺、氯环嗪、松齐拉敏和它们的衍生物。
[0478]
抗生素的实例包括但不限于:氨基糖苷类(例如,丁胺卡那霉素、安 普霉素、阿贝卡星、黄霉素、布替罗星、地贝卡星、双氢链霉素、一种 或多种福提霉素、庆大霉素、异帕米星、卡那霉素、小诺霉素、新霉素、 十一烯酸新霉素、奈替米星、巴龙霉素、核糖霉素、西索米星、大观霉 素、链霉素、妥布霉素、丙大观霉素);氯霉素类(例如叠氮氯霉素、氯霉 素、氟苯尼考、甲砜霉素)、安沙霉素类(例如利福酰胺、利福平、利福霉 素sv、利福喷汀、利福昔明)、内酰胺例如碳头孢烯类(例如氯碳头孢); 碳青霉烯类(例如比阿培南、亚胺培南、美罗培南、帕尼培南);头孢菌素 类(例如,头孢克洛、头孢羟氨苄、头孢羟唑、头孢曲嗪、头孢西酮、头 孢唑啉、头孢卡品酯、头孢克定、头孢地尼、头孢妥仑、头孢吡肟、头 孢他美、头孢克肟、头孢甲肟、头孢地嗪、头孢尼西、头孢哌酮、头孢 雷特、头孢噻肟、头孢替安、头孢唑兰、头孢咪唑、头孢匹胺、头孢匹 罗、头孢泊肟酯、头孢丙烯、头孢沙定、头孢磺啶、头孢他啶、头孢特 仑、头孢替唑、头孢布烯、头孢唑肟、头孢曲松、头孢呋辛、头孢唑南、 头孢乙腈钠、头孢氨苄、头孢来星、头孢噻啶、头孢菌素、头孢噻吩、 头孢匹林钠、头孢拉啶、pivcefalexin);头霉素类(例如,头孢拉宗、头孢 美唑、头孢米诺、头孢替坦、头孢西丁);单菌胺类(例如,氨曲南、卡卢 莫南、替吉莫南);氧头孢烯类(氟氧头孢、拉氧头孢);青霉素类(例如, 美西林、匹美西林、阿莫西林、氨苄西林、阿帕西林、阿扑西林、叠氮 西林、阿洛西林、巴氨西林、苄基青霉酸、苄基青霉素钠、羧苄青霉素、 卡茚西林、氯甲西林、氯唑西林、环己西林、双氯西林、依匹西林、芬 贝西林、氟氯西林、海他西林、仑氨西林、美坦西林、甲氧西林钠、美 洛西林、萘夫西林钠、苯唑西林、培那西林、氢碘酸喷沙西林、苯明青 霉素g、苄星青霉素g、二苯甲胺青霉素g、青霉素g钙、海巴明青霉 素g、青霉素g钾、普鲁卡因青霉素g、青霉素n、青霉素o、青霉素 v、苄星青霉素v、海巴明青霉素v、青哌环素、苯氧乙基青霉素钾、哌 拉西林、匹氨西林、丙匹西林、喹那西林、磺苄西林、舒他西林、酞氨 西林、替莫西林、替卡西林);其他(例如,利替培南);林可酰胺类(例如, 克林霉素、林可霉素);大环内酯类(例如,阿奇霉素、卡波霉素、克拉霉 素、地红霉素、红霉素、醋硬脂红霉素、依托红霉素、葡庚糖酸红霉素、 乳糖酸红霉素、红霉素丙酸酯、硬脂酸红霉素、交沙霉素、乙酰吉他霉 素、麦迪霉素、米奥卡霉素(miokamycin)、竹桃霉素、普利霉素、罗他霉 素、罗沙米星、罗红霉素、螺旋霉素、醋竹桃霉素);多肽类(例如,安福 霉素、杆菌肽、卷曲霉素、粘菌素、恩拉霉素、恩维霉素、夫沙芬净、 短杆菌肽s、一种或多种短杆菌肽、蜜柑霉素、多粘菌素、普那霉素、瑞 斯西丁素、替考拉宁、硫链丝菌素、结核放线菌素、短杆菌酪肽、短杆 菌素、万古霉素、紫霉素、维吉霉素、杆菌肽锌);四环素类(例如,阿哌 环素、金霉素、氯莫环素、地美环素、多西环素、胍甲环素、赖甲环素、 甲氯环素、甲烯土霉素、米诺环素、氧四环素、青哌环素、匹哌环素、 罗利环素、山环素、
四环素);和其他(例如,环丝氨酸、莫匹罗星、马铃 薯球蛋白)。2,4-二氨基嘧啶类(例如,溴莫普林、四氧普林、甲氧苄啶); 硝基呋喃类(例如,呋喃他酮、呋唑氯胺、硝呋拉定、硝呋太尔、硝呋复 林、硝呋吡醇、硝呋拉嗪、硝呋妥因醇、呋喃妥因);喹诺酮类及类似物(例 如,西诺沙星、环丙沙星、克林沙星、二氟沙星、依诺沙星、氟罗沙星、 氟甲喹、格帕沙星、洛美沙星、米洛沙星、那氟沙星、萘啶酸、诺氟沙 星、氧氟沙星、噁喹酸、帕珠沙星、培氟沙星、吡哌酸,吡咯米酸、罗 索沙星、芦氟沙星、司帕沙星、替马沙星、托氟沙星、曲伐沙星);磺胺 类(例如,磺胺乙酰甲氧吡嗪、苄磺胺、氯胺-b、氯胺-t、二氯胺t、n
2-磺 胺二甲异嘧啶、磺胺米隆、4
’‑
(甲基氨磺酰基)磺酰基苯胺 (4
’‑
(methylsulfamoyl)sulfanilanilide)、诺丙磺胺、酞磺醋胺、酞磺胺噻唑、 柳氮磺嘧啶、琥珀磺胺噻唑、磺胺苯酰、磺胺醋酰、磺胺氯哒嗪、磺胺 柯定、磺胺西汀(sulfacytine)、磺胺嘧啶、磺胺戊烯、磺胺地索辛、磺胺 多辛、磺胺乙二唑、磺胺胍、磺胺二甲噁唑脒(sulfaguanol)、磺胺林、磺 胺洛西酸、磺胺甲嘧啶、磺胺对甲氧嘧啶、磺胺甲嘧啶、磺胺甲二唑、 磺胺甲氧甲嘧啶(sulfamethomidine)、磺胺甲噁唑、磺胺甲氧哒嗪、磺胺 美曲、磺胺米柯定、磺胺噁唑、磺胺、4-磺胺水杨酸、n
4-双磺胺、磺胺 酰脲、正磺胺酰-3,4-丙谷胺(n-sulfanilyl-3,4-xylamide)、磺胺硝苯、磺胺培 林(sulfaperine)、磺胺苯吡唑、磺胺普罗林、磺胺吡嗪、磺胺吡啶、磺胺 异噻唑、磺胺均三嗪、磺胺噻唑、磺胺硫脲、磺胺托拉米、磺胺索嘧啶、 磺胺异噁唑);砜类(例如,醋氨苯砜、醋地砜(acediasulfone)、醋地砜钠、 氨苯砜、地百里砜、葡糖砜钠、苯丙砜、琥珀氨苯砜、磺胺酸、对磺胺 酰苄胺、阿地砜钠、噻唑砜);及其他(例如,氯福克酚、海克西定、乌洛 托品、脱水亚甲柠檬酸乌洛托品、马尿酸乌洛托品、扁桃酸乌洛托品、 磺基水杨酸乌洛托品、硝羟喹啉、牛磺罗定、希波酚)。
[0479]
抗真菌剂的实例包括但不限于:多烯类(例如,两性霉素b、克念菌 素、制皮菌素(dermostatin)、非律平、制霉色基素、曲古霉素、哈霉素、 鲁斯霉素、美帕曲星、那他霉素、制霉菌素、培西洛星、真菌霉素);其 他(例如,偶氮丝氨酸、灰黄霉素、寡霉素、十一烯酸新霉素、吡咯尼群、 西卡宁、杀结核菌素、绿胶霉素(viridin));烯丙胺类(例如,布替萘芬、 萘替芬、特比萘芬);咪唑类(例如,联苯苄唑、布康唑、氯登妥因、氯米 达唑、氯康唑、克霉唑、益康唑、恩康唑、芬替康唑、氟曲马唑、异康 唑、酮康唑、拉诺康唑、咪康唑、奥莫康唑、硝酸奥昔康唑、舍他康唑、 硫康唑、噻康唑);硫代氨基甲酸酯类(例如,托西拉酯、托林达酯、托萘 酯);三唑类(例如,氟康唑、伊曲康唑、沙康唑、特康唑);其他(例如, 吖啶琐辛、阿莫罗芬、苯柳胺酯(biphenamine)、溴柳氯苯胺、丁氯柳胺、 丙酸钙、氯苯甘醚、环吡酮、氯羟喹、艾索帕尔(coparaffinate)、双胺噻 唑二盐酸盐、依沙酰胺、氟胞嘧啶、哈利他唑(halethazole)、海克替啶、 氯氟卡班、硝呋太尔、碘化钾、丙酸、吡硫翁、水杨苯胺、丙酸钠、舒 苯汀、替诺尼唑、三醋汀、苄硫噻二嗪乙酸(ujothion)、十一烯酸、丙酸 锌)。
[0480]
β-阻滞剂的实例包括但不限于:醋丁洛尔、阿替洛尔、拉贝洛尔、美 托洛尔、普萘洛尔、噻吗洛尔及其衍生物。
[0481]
抗肿瘤剂的实例包括但不限于:抗生素及其类似物(例如,阿克拉霉 素、放线菌素f1、氨茴霉素、偶氮丝氨酸、博来霉素、放线菌素c、卡柔 比星、嗜癌霉素(carzinophilin)、色霉素、更生霉素、柔红霉素、6-重氮-5
‑ꢀ
氧代-l-正亮氨酸、多柔比星、表柔比星、伊达比星、美诺立尔、丝裂霉 素、霉酚酸、诺加霉素、橄榄霉素、培洛霉素、吡柔比星、普卡霉素、 泊非霉素、嘌呤霉素、链黑菌素、链脲菌素、杀结核菌素、净司他丁、 佐柔比星);抗代谢药(例
如,叶酸类似物类(例如,二甲叶酸(denopterin)、 依达曲沙、甲氨蝶呤、吡曲克辛、蝶罗呤,三甲曲沙);嘌呤 类似物(例如,克拉屈滨、氟达拉滨、6-巯基嘌呤、硫咪嘌呤(thiamiprine)、 硫鸟嘌呤);嘧啶类似物(例如,安西他滨、阿扎胞苷、6-阿扎尿苷、卡莫 氟、阿糖胞苷、去氧氟尿苷、乙嘧替氟、依诺他滨、氟尿苷、氟尿嘧啶、 吉西他滨、替加氟(tagafur))。
[0482]
抗炎剂的实例包括但不限于:甾体抗炎剂和非甾体抗炎剂。示例性 甾体抗炎剂包括:乙酰氧孕烯醇酮、阿氯米松、阿尔孕酮、安西奈德、 倍氯米松、倍他米松、布地奈德、氯泼尼松、氯倍他索、氯倍他松、氯 可托龙、氯泼尼醇、皮质酮、可的松、可的伐唑、地夫可特、地奈德、 去羟米松、地塞米松、二氟拉松、二氟可龙、二氟泼尼酯、甘草次酸、 氟扎可特、氟氯奈德(flucloronide)、氟米松、氟尼缩松、氟轻松醋酸酯、 醋酸氟轻松、氟考丁酯、氟可龙、氟米龙、醋酸氟培龙、醋酸氟泼尼定、 氟泼尼龙、氟氢缩松、丙酸氟替卡松、福莫可他、氯氟舒松、丙酸氯倍 他索、卤米松、醋酸卤泼尼松、氢可他酯、氢化可的松、依碳酸氯替泼 诺(loteprednol etabonate)、马泼尼酮、甲羟松、甲泼尼松、甲基泼尼松龙、 糠酸莫米松、帕拉米松、泼尼卡酯、泼尼松龙、泼尼松龙25-二乙基氨基 乙酸酯、泼尼松龙磷酸钠、泼尼松、泼尼松龙戊酸酯(prednival)、泼尼立 定、利美索龙、替可的松、曲安西龙、曲安奈德、苯曲安奈德和己曲安 奈德。
[0483]
示例性非甾体抗炎剂包括:氨基芳基羧酸衍生物(例如,恩芬那酸 (enfenamic acid)、依托芬那酯、氟芬那酸、异尼辛、甲氯芬那酸 (meclofenamic acid)、甲芬那酸、尼氟灭酸、他尼氟酯、特罗芬那酯、托 芬那酸);芳基乙酸衍生物(例如,醋氯芬酸、阿西美辛、阿氯芬酸、氨芬 酸、呱氨托美丁、溴芬酸、丁苯羟酸、桂美辛、氯吡酸、双氯芬酸钠、 依托度酸、联苯乙酸、芬克洛酸、芬替酸、葡美辛、异丁芬酸、吲哚美 辛、三苯唑酸、伊索克酸、氯那唑酸、甲嗪酸、莫苯唑酸、奥沙美辛 (oxametacine)、吡拉唑酸、丙谷美辛、舒林酸、噻拉米特、托美丁、吲哚 美辛托品(tropesin)、佐美酸);芳基丁酸衍生物(例如,丁丙二苯肼、布替 布芬、苯布芬、联苯丁酸);芳基羧酸衍生物(例如,环氯茚酸、酮咯酸、 替诺立定);芳基丙酸衍生物(例如,阿明洛芬、苯噁洛芬、柏莫洛芬、布 氯酸、卡洛芬、非诺洛芬、氟诺洛芬、氟比洛芬、布洛芬、异丁普生、 吲哚洛芬、酮洛芬、洛索洛芬、萘普生、奥沙普秦、piketoprolen、吡洛 芬、普拉洛芬、丙替嗪酸、舒洛芬、噻洛芬酸、希莫洛芬、扎托洛芬); 吡唑类(例如,二苯咪唑(difenamizole)、依匹唑);吡唑啉酮类(例如,阿 扎丙宗、苄哌立隆、非普拉宗、莫非布宗、吗拉宗、羟布宗、苯基丁氮 酮、哌布宗、异丙安替比林、雷米那酮、琥布宗、噻唑丁炎酮 (thiazolinobutazone));水杨酸衍生物(例如,醋氨沙洛、阿司匹林、贝诺 酯、溴水杨醇(bromosaligenin)、乙酰水杨酸钙、二氟尼柳、依特柳酯、 芬度柳、龙胆酸、水杨酸乙二醇酯、水杨酸咪唑、赖氨酸乙酰水杨酸、 美沙拉秦(mesalamine)、水杨吗啉、1-水杨酸萘酯、奥沙拉秦、帕沙米特、 乙酰基水杨酸苯酯、水杨酸苯酯、醋水杨胺、水杨酰胺邻醋酸、水杨酰 硫酸、双水杨酯、柳氮磺胺吡啶);噻嗪甲酰胺类(例如,安吡昔康、屈噁 昔康、伊索昔康、氯诺昔康、吡罗昔康、替诺昔康);ε-乙酰氨基己酸、 s-腺苷甲硫氨酸、3-氨基-4-羟基丁酸、阿米西群、苄达酸、苄达明、布可 隆、联苯吡胺、地他唑、依莫法宗、非普地醇、愈创薁(guaiazulene)、萘 丁美酮、尼美舒利、奥沙西罗、瑞尼托林(paranyline)、哌立索唑、普罗 喹宗、超氧化物歧化酶、替尼达普和齐留通。
[0484]
抗病毒剂的实例包括:干扰素γ、齐多夫定、盐酸金刚烷胺、利巴韦 林、阿昔洛韦、
伐昔洛韦(valciclovir)、双脱氧胞苷、膦酰甲酸、更昔洛 韦及它们的衍生物。
[0485]
抗氧化剂的实例包括:抗坏血酸盐、α-生育酚、甘露醇、还原型谷胱 甘肽、各种类胡萝卜素、半胱氨酸、尿酸、牛磺酸、酪氨酸、超氧化物 歧化酶、叶黄素、玉米黄质、隐黄素(cryotpxanthin)、虾青素、番茄红素、 n-乙酰基-半胱氨酸、肌肽、γ-谷氨酰半胱氨酸、槲皮素、乳铁蛋白、二 氢硫辛酸、柠檬酸盐、银杏叶提取物、茶叶儿茶素、越桔提取物、维生 素e或维生素e的酯、棕榈酸视黄酯及它们的衍生物。其他治疗剂包括 角鲨胺、碳酸酐酶抑制剂、α-2肾上腺素受体激动剂、抗寄生物药、抗真 菌剂及它们的衍生物。
[0486]
当然,每种组分的具体施用剂量将根据处方中的具体组分、接受治 疗的对象、疾病严重性的不同而不同,例如,根据炎症反应的严重性、 施用方式和处方医师的判断。因此,由于病人之间的差异,以上给出的 剂量为指导性的,医师可以调节所述化合物的剂量以实现医师所认为的 恰当治疗。
[0487]
本领域技术人员应理解,对于其中载体包含形成凝胶的聚合物的 hrs-fc缀合物制剂,在某些制剂中包含盐尤其是盐溶液是禁忌的,因为 包含盐会导致溶液在局部施用前成胶,其与某些原位形成凝胶的聚合物 (例如,结冷胶)一样,或者包含盐会抑制形成凝胶聚合物的凝胶化特性。 本领域技术人员能够基于所需的制剂性能以及本领域已知的形成凝胶聚 合物的特性来选择适当的组合。
[0488]
合适的水性盐溶液为本领域技术人员所了解,且可以包括例如,ph 为约ph 4.5至约ph 8.0的溶液。在水性溶液的其他变化中(其中水包含在 载体中),所述制剂的ph为以下范围中的任何值:约6至约8.0、约6至 约7.5、约6至约7.0、约6.2至约8、约6.2至约7.5、约7至约8、约6.2 至约7.2、约5.0至约8.0、约5至约7.5、约5.5至约8.0、约6.1至约7.7、 约6.2至约7.6、约7.3至约7.4、约6.0、约7.1、约6.2、约7.3、约6.4、 约6.5、约6.6、约6.7、约6.8、约6.9、约7.0、约7.1、约7.2、约7.3、 约7.4、约7.5、约7.6或约8.0。在一些变型中,所述hrs-fc缀合物制 剂的ph为约6.0至约7.0。在一些变型中,所述制剂的ph为约7.4。在 具体的变型中,所述制剂的ph为约6.2至约7.5。
[0489]
在某些实施方案中,盐(例如,nacl)的浓度为例如约0%至约 0.9%(w/v)。例如,所述盐的浓度可以为:约0.01至约0.9%、约0.02%至 约0.9%、约0.03%至约9%、约0.05%至约0.9%、约0.07%至约0.9%、 约0.09%至约0.9%、约0.1%至约0.9%、约0.2%至约0.9%、约0.3%至约 0.9%、约0.4%至约0.9%、约0.5%至约0.9%、约0.6%至约0.9%、约0.7% 至约0.9%、约0.8%至约0.9%、约0.9%、约0%、约0.05%、约0.01%、 约0.09%、约0.1%、约0.2%、约0.3%、约0.4%、约0.5%、约0.6%、约 0.7%或约0.8%。在某些实施方案中,所述水性盐溶液可为等渗的(例如, nacl浓度为约0.9%nacl(w/v))。在某些实施方案中,所述水性溶液可包 含的nacl浓度为约0.5%、约0.7%、约0.8%、约0.85或约0.75%。本领 域技术人员应理解,根据其他组分的浓度,例如所述hrs-fc缀合物以盐 存在时,获得适于施用的制剂所需的nacl或其他盐的浓度可以改变。
[0490]
在一些实施方案中,制剂基本上没有增加粘性的试剂时,所述制剂 可以基本上没有增加粘性的试剂,诸如但不限于多阴离子聚合物、水溶 性纤维素衍生物(例如,羟丙甲纤维素(也称hpmc、羟丙基甲基纤维素和 羟丙基纤维素)、羟乙基纤维素、羧甲基纤维素等)、聚乙烯醇、聚乙烯吡 咯烷酮、硫酸软骨素、透明质酸、可溶性淀粉等。在一些变型中,所述 制剂不包含水凝胶或其他保持剂(诸如例如,美国专利公开第 2005/0255144号中公开的那
些(通过引用整体并入本文)),例如,其中所 述水凝胶可以包括掺入了以下物质的水凝胶:均聚物;共聚物(例如,羟 甲基甲基丙烯酸酯、乙二醇、二甲基甲基丙烯酸酯和甲基丙烯酸的四聚 物)、三亚甲基碳酸酯和聚乙醇酸的共聚物、polyglactin 910、葡糖酸盐、 聚对二氧环己酮、聚乙醇酸、聚乙醇酸毡、聚4-羟基丁酸酯、聚(l-丙交 酯)和聚(l-丙交酯乙交酯共聚物)的组合、乙二醇甲基丙烯酸酯、聚-dl
‑ꢀ
丙交酯或primacryl);氧化再生的纤维素、聚丙烯和聚二氧环己酮的复合 物,或聚丙烯和波丽胶羊油酮(poligelcaprone)的复合物等。在一些变型中, 所述制剂不包含以下物质中的一种或多种:聚乙烯醇、羟丙基甲基纤维 素、聚乙二醇400蓖麻油乳化液、羧甲基纤维素钠、丙二醇、羟丙基瓜 尔胶、羧甲基纤维素钠、白凡士林、矿物油、右旋糖酐70、甘油、羟丙 甲纤维素、亚麻籽油、鱼油、ω-3和ω-6脂肪酸、叶黄素或月见草油。在 一些变型中,所述制剂不包含描述于美国专利第4,888,354号(通过引用整 体并入本文)中的载体中的一种或多种,诸如例如油酸、乙醇、异丙醇、 单油酸甘油酯、二油酸甘油酯、月桂酸甲酯、丙二醇、丙醇或二甲基亚 砜。在一些变型中,所述制剂基本上无二油酸甘油酯和异丙醇。
[0491]
在具体实施方案中,形成凝胶的聚合物可为例如多糖。在某些实施 方案中,所述多糖为结冷胶。结冷胶是指由细菌伊乐假单胞菌 (pseudomonas elodea)产生的杂多糖,尽管名称“结冷胶”更通常地用于本 领域。结冷胶,尤其是制剂详细描述于美国专利第4,861,760 号(据此通过引用整体并入)中,尤其是其在噻吗洛尔制剂中的应用。低乙 酰澄清度的结冷胶购自merck&co(rahway,n.j.),结冷胶可 购自cpkelco(atlanta,ga.)等。多糖如结冷胶的制备描述于例如,美国专 利第4,326,053和4,326,052号,其据此通过引用整体并入。
[0492]
在某些实施方案中,形成凝胶的聚合物存在的浓度为:约0.03%至约 2%(w/v)。在一些实施方案中,所述形成凝胶的聚合物存在的浓度为:约 0.03%至约1.75%、约0.03%至约1.5%、约0.03%至约1.25%、约0.03% 至约1%、约0.03%至约0.9%、约0.03%至约0.8%、约0.03%至约0.7%、 约0.03%至约0.6%、约0.03%至约0.5%、约0.05%至约2%、约0.05%至 约1.75%;约0.05%至约1.5%、约0.05%至约1.25%、约0.05%至约1%、 约0.05%至约0.9%、约0.05%至约0.8%、约0.05%至约0.7%、约0.05% 至约0.6%、约0.05%至约0.5%、约0.1%至约2%、约0.1%至约1.75%、 约0.1%至约1.5%、约0.1%至约1.25%、约0.1%至约1%、约0.1%至约 0.9%、约0.1%至约0.8%、约0.1%至约0.7%、约0.1%至约0.6%、约0.1% 至约0.5%、约0.2%至约2%、约0.2%至约1.75%、约0.2%至约1.5%、 约0.2%至约1.25%、约0.2%至约1%、约0.2%至约0.9%、约0.2%至约 0.8%、约0.2%至约0.7%、约0.2%至约0.6%、约0.2%至约0.5%或约0.5% 至约1.5%。在一些实施方案中,所述形成凝胶的聚合物的浓度为:约 0.1%、约0.2%、约0.4%、约0.6%、约0.8%、约1%。
[0493]
在具体实施方案中,所述形成凝胶的聚合物为以下浓度的结冷胶: 约0.05%至约2%(w/v)、约0.1%至约2%(w/v)、约0.1%至约1%(w/v)、 约0.05%至约1%(w/v)或约0.1%至约0.6%(w/v)。在一些实施方案中, 所述结冷胶的浓度为约0.1%、约0.2%、约0.4%、约0.6%、约0.8%、约 1%。
[0494]
在制剂的一些实施方案中,所述制剂可以包含另外的组分,如一种 或多种防腐剂、一种或多种表面活性剂或一种或多种药物试剂。在具体 实施方案中,所述制剂可以包
含另外的组分,如一种或多种防腐剂、一 种或多种表面活性剂、一种或多种张度剂、一种或多种缓冲剂、一种或 多种螯合剂、一种或多种增粘剂、一种或多种盐或一种或多种药物试剂。 在这些实施方案的某些中,所述制剂可以包含(除了hrs-fc缀合物(或其 药学上可接受的盐)和载体外):一种或多种防腐剂、一种或多种缓冲剂(例 如,1、2、3种等)、一种或多种螯合剂和一种或多种盐。在一些实施方 案中,所述制剂可以包含(除了hrs-fc缀合物(或其药学上可接受的盐) 和载体外):一种或多种防腐剂、一种或多种张度剂、一种或多种缓冲剂、 一种或多种螯合剂和一种或多种增粘剂。
[0495]
在一些实施方案中,所述制剂的粘度约与含有相同浓度的hrs-fc 缀合物(或其药学上可接受的盐)的盐溶液的粘度相同。在一些实施方案 中,所述制剂基本上不含形成凝胶的聚合物。在某些实施方案中,若载 体为水,所述制剂可以另外包含一种或多种螯合剂(例如,edta二钠 (edta)、一种或多种防腐剂(例如,苯扎氯铵、苄索氯铵、氯己定、氯丁 醇、对羟基苯甲酸甲酯、苯乙醇、对羟基苯甲酸丙酯、硫柳汞、硝酸苯 汞、硼酸苯汞、乙酸苯汞,或者以上中两种或更多种的组合)、盐(例如, nacl)和一种或多种缓冲剂(例如,一种或多种磷酸盐缓冲剂(例如,磷酸 氢二钠、磷酸二氢钠及其组合等)、柠檬酸盐缓冲液、马来酸盐缓冲液、 硼酸盐缓冲液和以上中两种或更多种的组合)。
[0496]
在具体实施方案中,螯合剂为edta二钠,防腐剂为苯扎氯铵,盐 为nacl,以及缓冲剂为磷酸氢二钠和磷酸二氢钠。在这些实施方案的某 些中,所述制剂基本上无聚合物。在一些实施方案中,所述制剂基本上 无增粘剂(例如,羧甲基纤维素、多阴离子聚合物等)。在一些实施方案中, 所述制剂的粘度约与含有相同浓度的hrs-fc缀合物(或其药学上可接受 的盐)的盐溶液的粘度相同。在这些实施方案的一些中,hrs-fc缀合物(或 其药学上可接受的盐)的浓度为:约0.02%至约3%、约0.02%至约2%、 约0.02%至约1%(w/v)。在某些实施方案中,所述hrs-fc缀合物(或其 药学上可接受的盐)的浓度为:约0.01%、约0.02%、约0.03%、约0.05%、 约0.07%、约0.1%、约0.3%、约0.4%、约0.5%、约0.6%、约0.8%或约 1%(w/v)。
[0497]
在某些实施方案中,若载体包括水,增粘剂也可以包含在该制剂中。 本领域技术人员熟悉合适的增粘剂,例如,水溶性纤维素衍生物(例如, 羟丙甲纤维素(也称hpmc、羟丙基甲基纤维素和羟丙基纤维素)、羟乙基 纤维素、羧甲基纤维素等)、聚乙烯醇、聚乙烯吡咯烷酮、硫酸软骨素、 透明质酸和可溶性淀粉。预期当使用增粘剂时,所包含的增粘剂浓度不 应高至使得所述制剂会在施用前或施用后形成凝胶(例如,其中增粘剂浓 度不足以诱导凝胶形成)。
[0498]
尽管增粘剂的精确浓度取决于制剂中其他组分的选择和浓度以及所 选的具体增粘剂,通常,增粘剂可存在的浓度使得所得溶液的粘度小于 约1000厘泊。在某些实施方案中,所述制剂的粘度为:小于约900、小 于约800、小于约700、小于约600、小于约500、小于约400、小于约 300、小于约200、小于约150、小于约100、小于约50厘泊。在一些实 施方案中,所述制剂的粘度为:约200、约150、约100、约50厘泊。在 具体实施方案中,所述粘度小于约200厘泊。在其他实施方案中,小于 约120厘泊或小于约100厘泊。在一些实施方案中,所述粘度为约100 厘泊。在其他实施方案中为约50厘泊。在其他实施方案中,所述粘度为 约200厘泊。测量粘度的方法为本领域技术人员熟知的。例如,其描述 于美国药典29(第911章)viscosity,第2785页(其通过引用整体并入本 文)。本领域技术人员熟知,通常被视为“凝
胶”的制剂所具有的粘度明 显大于1000厘泊,例如,大于约2000厘泊,大于约5000厘泊。
[0499]
在一些实施方案中,包括(但不限于)如上所述当盐的使用为禁忌时, 所述制剂还可以包含一种或多种张度剂。如本文所用,术语“张度剂”及 其同源词是指可调节制剂的张度但不是盐(例如,不是nacl)的试剂,如 本领域技术人员基于本文提供的教导应理解的,由于某些形成凝胶的聚 合物或增粘剂的存在,盐对于某些制剂为禁忌。这些试剂可以用于制备 等渗的或近乎等渗的制剂(例如,稍微超过或低于等渗;例如,在等渗的 约
±
20%、约
±
15%、约
±
10%、约
±
5%范围)。张度剂也可以使用于其中盐 的使用不是禁忌的制剂。
[0500]
张度剂可以用于调节本文所述的制剂的张度,其为本领域技术人员 所知且可基于本文提供的教导进行选择。例如,张度剂包括多元醇(例如, 糖醇(例如,甘露醇等)、三羟基醇(例如,甘油等)、丙二醇或聚乙二醇等), 或者两种或更多种多元醇的组合。同样,张度剂的浓度取决于制剂中其 他组分的特性和浓度,且可基于本文提供的教导由本领域技术人员容易 地确定。
[0501]
在某些实施方案中,张度剂为甘油或甘露醇。在一些实施方案中, 所述张度剂为甘油。在其他实施方案中,其为甘露醇。在其他实施方案 中,可以使用甘露醇和甘油的组合。张度剂的示例性浓度包括,例如, 约0.001%至约3%。在一些实施方案中,所述张度剂(例如,甘露醇或甘 油)的浓度为,例如约0.001%至约2.7%、约0.001%至约2.5%、约0.001% 至约2%、约0.001%至约1.5%、约0.001%至约1%、约0.01%至约3%、 约0.01%至约2.7%、约0.01%至约2.5%、约0.01%至约2%、约0.01%至 约1.5%、约0.01%至约1%、约0.1%至约3%、约0.1%至约2.7%、约0.1% 至约2.5%、约0.1%至约2%、约0.1%至约1.5%、约0.1%至约1%、约 0.01%约1%至约3%、约1%至约2.5%、约1%至约2%、约1%至约1.8%、 约1%至约1.5%,或者约0.001%、约0.01%、约0.05%、约0.08%、约 0.1%、约0.2%、约0.5%、约0.8%、约1%、约1.5%、约1.8%、约2%、 约2.2%、约2.5%、约2.8%或约3%(w/v)。在某些实施方案中,所述张度 剂为甘露醇。在这些实施方案的一些中,载体包括形成凝胶的试剂(例如, 结冷胶)。
[0502]
在一些实施方案中,张度剂为甘露醇。在这些实施方案的某些中, 所述载体包括增粘剂(例如,水溶性纤维素衍生物(例如,羟丙甲纤维素)、 聚乙烯醇、聚乙烯吡咯烷酮、硫酸软骨素、透明质酸和可溶性淀粉)。
[0503]
在一些实施方案中,制剂还可以包含防腐剂(例如,苯扎氯铵、苄索 氯铵、氯己定、氯丁醇、对羟基苯甲酸甲酯、苯乙醇、对羟基苯甲酸丙 酯、硫柳汞、硝酸苯汞、硼酸苯汞或乙酸苯汞、过氧化物),或者上述防 腐剂中两种或更多种的组合。在某些实施方案中,所述防腐剂为苯扎氯 铵。
[0504]
本领域技术人员应理解,防腐剂存在的浓度可以为:约0.001%至约 0.7%(w/v)。在具体实施方案中,所述防腐剂存在的浓度可以为:约0.001% 至约0.5%(w/v)、约0.001%至约0.05%(w/v)、约0.001%至约0.02%(w/v)、 约0.001%至约0.015%(w/v)、约0.001%至约0.005%(w/v)、约0.01%至 约0.02%、约0.002%至约0.01%、约0.015%至约0.05%、小于约《0.5%、 约0.005%至约0.01%、约0.001%至约0.15%、约0.002%至约0.004%、 约0.001%至约0.002%。在一些实施方案中,所述防腐剂的浓度可以为: 例如,约0.001%、约0.005%、约0.01%、约0.02%、约0.03%、约0.05%、 约0.1%、约0.2%、约0.5%或约0.7%(w/v)。各种常用防腐剂的典型浓度 (w/v)列举于以下的表c中。
[0505][0506]
在某些实施方案中,所述制剂还可以包含表面活性剂或者两种或更 多种表面活性剂的组合。在具体实施方案中,所述制剂基本上无表面活 性剂。如本文所用,术语“基本上无”是指特定组分的水平为使用常规检 测方法和本领域技术人员所知的方案无法检测的。例如,hplc(包括手 性hplc、手性hplc/ms、lc/ms/ms等)、薄层色谱、质谱、偏振测量、 气相色谱和质谱联用等。
[0507]
在具体实施方案中,所述制剂还可以包含螯合剂(例如,edta二钠 (edta)(例如,柠檬酸edta二钠(二水合物))等)。在一些实施方案中, 可以存在螯合剂的组合。本领域技术人员应理解,螯合剂可用于阻止制 剂组分的降解,从而增加制剂的保存期限。本领域技术人员应理解,将 edta与结冷胶制剂联用可能是禁忌的,因为edta会导致结冷胶制剂 在施用前形成凝胶。
[0508]
螯合剂的典型浓度为约0.005%至0.1%(w/v)。例如,约0.005%至约0.09%、约0.005%至约0.08%、约0.005%至约07%、约0.005%,至约0.06%、 约0.005%至约0.05%、约0.005至约0.04%、约0.005%至约0.03%、约 0.01%至约0.1%、约0.01%至约0.09%、约0.01%至约0.08%、约0.01% 至约0.07%、约0.01%至约0.06%、约0.01%至约0.05%、约0.01%至约 0.04%等。在某些实施方案中,螯合剂的浓度为约0.005%、约0.01%、约 0.02%、约0.03%、约0.05%、约0.06%、约0.07%、约0.08%、约0.09%、 或约0.1%。
[0509]
在具体实施方案中,所述螯合剂为edta二钠。在某些实施方案中, 所述螯合剂为edta二钠(二水合物)。在这些实施方案的一些中,所述 edta二钠二水合物存在的浓度为约0.01%(w/v)。
[0510]
在一些实施方案中,所述制剂还可以包含一种或多种缓冲剂(例如, 磷酸盐缓冲剂(例如,磷酸钠缓冲剂(例如,磷酸氢二钠、磷酸二氢钠等)、 柠檬酸盐缓冲剂、马来酸盐缓冲剂、硼酸盐缓冲剂等)。本领域技术人员 应理解,所述一种或多种缓冲剂应结合给定制剂的其他组分来选择,以 得到适于使用的ph(例如,ph为约4.5至约8)。
[0511]
在某些实施方案中,所述缓冲剂为磷酸盐缓冲剂或者两种或更多种 磷酸盐缓冲剂的组合。在某些实施方案中,所述缓冲剂为磷酸氢二钠和 磷酸二氢钠。
[0512]
缓冲剂例如磷酸盐缓冲剂的典型浓度可以为:约0.005摩尔至0.1摩 尔。在一些实
施方案中,所述缓冲剂的浓度可以为:约0.01至约0.1、约 0.01至约0.08、约0.01至约0.05、约0.01至约0.04、约0.02至约0.1、 约0.02至约0.08、约0.02至约0.06、约0.02至约0.05、约0.02至约0.04 摩尔等。在具体实施方案中,存在两种缓冲剂。示例性缓冲剂包括磷酸 氢二钠(例如,磷酸氢二钠
·
7h2o)和磷酸二氢钠(例如,无水磷酸二氢钠) 的组合。在一些实施方案中,所述缓冲剂的浓度为:约0.005摩尔、约 0.01摩尔、约0.02摩尔、约0.03摩尔、约0.04摩尔、约0.05摩尔、约 0.06摩尔、约0.07摩尔或约0.1摩尔。
[0513]
本发明的又一个方面包括如本文所述的制剂在制备药物中的应用。 具体地,在制备用于治疗和/或预防如本文所述的病况的药物中的应用。 而且,本文不同描述的制剂也预期用于制备根据本文所述的方法来治疗 和/或预防所述病况的药物,除非另有说明。
[0514]
制剂配制方法是本领域熟知的,且其公开于例如,remington:thescience and practice of pharmacy,mack publishing company,easton,pa.,第 19版(1995)。本文提供的组合物和试剂可以根据本发明方法以任何治疗 有效的给药方案来施用。对给药量和频率进行选择以产生有效水平的试 剂而不产生有害作用。本发明化合物的有效量取决于施用途径、接受治 疗的温血动物的种类以及考虑中的具体温血动物的身体特征。这些因素 和它们与决定上述有效量的关系为医药领域的熟练从业人员熟知的。可 对该量和施用方法进行调整以获得最佳效力,但应基于以下因素,诸如 体重、饮食、同时用药和医学领域的技术人员了解的其他因素。
[0515]
在某些实施方案中,所述药物组合物可以通过鼻内喷剂、吸入和/或 其他气溶胶递送媒介物来递送。通过鼻用气溶胶喷剂将基因、多核苷酸 和肽组合物直接递送至肺部的方法已描述于例如,美国专利第5,756,353 号和美国专利第5,804,212号(各自明确地通过引用整体并入本文)。同样, 使用鼻内微粒树脂(takenaga等,1998)和溶血磷脂酰甘油化合物(美国专 利第5,725,871号,其明确地通过引用整体并入本文)递送药物也为药物领 域熟知的。同样,以聚四氟乙烯支持基质的形式递送透粘膜药物描述于 美国专利第5,780,045号(其明确地通过引用整体并入本文)。
[0516]
在某些实施方案中,可以通过使用脂质体、纳米胶囊、微粒、微球、 脂质颗粒、囊泡等来进行递送,以将本发明的组合物引入至合适的宿主 细胞中。具体地,本发明的组合物可以配制为包封于脂质颗粒、脂质体、 囊泡、纳米球、纳米颗粒等中进行递送。可使用已知和常规技术来配制 和使用这类递送媒介物。
[0517]
在某些实施方案中,本文提供的试剂可以结合至药学上可接受的固 体基质,包括生物相容的和生物可降解的基质如聚合物和基质。这类固 体基质的实例包括但不限于:聚酯、水凝胶(例如,聚(2-羟乙基-甲基丙烯 酸酯)或聚(乙烯醇))、聚交酯(美国专利第3,773,919号)、l-谷氨酸和γ-乙 基-l-谷氨酸酯的共聚物、非降解性的乙烯-醋酸乙烯酯、可降解的乳酸
‑ꢀ
乙醇酸共聚物如聚(乳酸-乙醇酸共聚物)(plga)和lupron depot
tm (由乳酸-乙醇酸共聚物和醋酸亮丙瑞林组成的可注射微球)、聚-d-(-)-3
‑ꢀ
羟基丁酸、胶原、金属、羟磷灰石、生物玻璃、铝酸盐、生物陶瓷材料 和纯化的蛋白。
[0518]
在一个具体实施方案中,所述固体基质包含atrigel
tm
(qlt,inc., vancouver,b.c.)。药物递送系统由溶解于生物相容性载体中的生 物可降解聚合物组成。可以在生产期间将药物混合至该液体递送系统中, 或者根据产品,可以在随后由医师于使用时加入。当液体产品通过小规 格针注射至皮下空间或者通过插管置于可进入的组织部位
时,组织流体 中的水会引起聚合物沉淀并将药物捕获在固体植入物中。然后,包封于 该植入物中的药物在聚合物基质随时间生物降解时以受控的方式释放。
[0519]
在具体实施方案中,当口服、皮下或静脉内施用时,施用的hrs-fc 缀合物组合物的量的范围通常为约0.1mg/kg至约100mg/kg,且通常为约 0.1mg/kg至10mg/kg或20mg/kg的剂量。在具体实施方案中,剂量为约 1mg/kg、约3mg/kg、约5mg/kg、约7.5mg/kg或约10mg/kg。在某些 实施方案中,以0.1mg/kg至10mg/kg或0.5mg/kg至5mg/kg的单剂量施 用组合物。在一些实施方案中,以0.1mg/kg至50mg/kg、0.5mg/kg至 20mg/kg或5g/kg至20mg/kg的剂量施用组合物。
[0520]
对于人,所用的每日剂量范围可以为:约0.1mg/kg至0.5mg/kg、约 1mg/kg至5mg/kg、约5mg/kg至10mg/kg、约10mg/kg至20mg/kg、 约20mg/kg至30mg/kg、约30mg/kg至50mg/kg,和约50mg/kg至100 mg/kg/24小时。
[0521]
对于具有较长半衰期的hrs-fc缀合物,人使用的剂量范围可以为, 例如,约0.1mg/kg/周至0.5mg/kg/周、约1mg/kg/周至5mg/kg/周、约5 mg/kg/周至10mg/kg/周、约10mg/kg/周至20mg/kg/周、约20mg/kg/ 周至30mg/kg/周、约30mg/kg/周至50mg/kg/周或约50mg/kg/周至100 mg/kg/周。
[0522]
可以将具有较长半衰期的hrs-fc缀合物在人中以约0.1mg/kg/月至 0.5mg/kg/月、约1mg/kg/月至5mg/kg/月、约5mg/kg/月至10mg/kg/月、 约10mg/kg/月至20mg/kg/月、约20mg/kg/月至30mg/kg/月、约30mg/kg/ 月至50mg/kg/月、或约50mg/kg/月至100mg/kg/月给药。
[0523]
在不同实施方案中,所述剂量为约50-2500mg/天、100-2500mg/天、300-1800mg/天或500-1800mg/天、或500-2500mg/周、1000-2500mg/ 周、300-1800mg/周、或500-1800mg/周、或500-2500mg/月、1000-2500 mg/月、300-1800mg/月或500-1800mg/月。在一些实施方案中,所述剂 量为约100至600mg/天、100至600mg/周、或100至600mg/月。在一 些实施方案中,所述剂量为约300至1200mg/天、300至1200mg/周或 300至1200mg/月。在具体实施方案中,所述组合物或药剂以100mg/周、 2.4mg/周、300mg/周、600mg/周、1000mg/周、1200mg/周或1800mg/ 周的剂量,每周或每月一剂或多剂量进行施用(即,其中组合的剂量实现 所需的每周或每月剂量)。在一些实施方案中,剂量为100mg bid、150mgbid、240mg bid、300mg bid、500mg bid或600mg bid。在不同实施方 案中,所述组合物或药剂以单次给药或重复给药施用。初始剂量和随后 剂量可以相同或不同。
[0524]
在一些实施方案中,总的日剂量可以为:约0.001mg、约0.005mg、 约0.01mg、约0.05mg、约0.1mg、0.5mg、1mg、约2mg、约3mg、 约4mg、约5mg、约6mg、约7mg、约8mg、约9mg、约10mg、约 20mg、约30mg、约40mg、约50mg、约60mg、约70mg、约80mg、 约90mg或约100mg/24小时。
[0525]
在一些实施方案中,总的周剂量可以为:约0.001mg、约0.005mg、 约0.01mg、约0.05mg、约0.1mg、0.5mg、1mg、约2mg、约3mg、 约4mg、约5mg、约6mg、约7mg、约8mg、约9mg、约10mg、约 20mg、约30mg、约40mg、约50mg、约60mg、约70mg、约80mg、 约90mg或约100mg/周。
[0526]
在一些实施方案中,总的月剂量可以为:约0.001mg、约0.005mg、 约0.01mg、约0.05mg、约0.1mg、0.5mg、1mg、约2mg、约3mg、 约4mg、约5mg、约6mg、约7mg、约8mg、约9mg、约10mg、约 20mg、约30mg、约40mg、约50mg、约60mg、约70mg、约80mg、 约90mg或约100mg/月。
[0527]
对于在几天或更长时间内重复施用,根据情况维持治疗直到出现了 对疾病症状所期望的抑制作用。这些和其他疗法(例如,离体疗法)的进展 可通过常规方法和测定并基于医师或本领域其他技术人员已知的标准来 容易地监测。
[0528]
还应理解,对于缓释递送装置和组合物,根据缓释系统的释放特性, 在该递送系统中含有的hrs的总剂量将相应地为更大。因此,旨在5天 的时长内递送hrs-fc缀合物的缓释组合物或装置通常包含至少约5至 10倍的日剂量的hrs-fc缀合物;旨在365天的时长内递送hrs-fc缀合 物的缓释组合物或装置通常包含至少约400至800倍的日剂量的hrs-fc 缀合物(当使用缓释系统给药时,取决于所述hrs-fc缀合物的稳定性和 生物利用度)。
[0529]
在某些实施方案中,组合物或药剂经静脉内给药,例如,通过在例 如约10min至90min的时长内输注。在其他相关的实施方案中,组合物 或药剂例如,在一段时间内的剂量为约0.1至约10mg/kg/hr通过连续输 注给药。尽管时长可以变化,在某些实施方案中,时长可以为约10min 至约24hr或约10min至约3天。
[0530]
在具体实施方案中,有效量或治疗有效量是足以把受试者血浆中的 hrs-fc缀合物浓度维持大于约300pm、大于约1nm、大于约10nm、 大于约100nm或大于约1000nm的量。
[0531]
在某些实施方案中,iv或sc剂量是足以使血浆浓度(c
max
)达到约 1,000nm至约5,000nm或约200nm至约1,000nm、或约20nm至约 200nm的量。
[0532]
在具体实施方案中,以足以在哺乳动物实现这样的血浆浓度的量和 频率施用hrs-fc缀合物,所述血浆浓度具有约300pm至约1nm的平 均波谷浓度和/或约300pm至约1nm的稳态浓度。在一些实施方案中, 哺乳动物血浆中hrs-fc缀合物的c
min
维持在大于约1nm和/或稳态浓度 维持在约1nm至约10nm。在某些实施方案中,哺乳动物血浆中hrs-fc 缀合物的c
min
维持在大于约10nm和/或稳态浓度维持在约10nm至约 100nm。在某些实施方案中,哺乳动物血浆中hrs-fc缀合物的c
min
维 持在大于约100nm和/或稳态浓度维持在约100nm至约1000nm。
[0533]
在本发明的具体实施方案中,单次施用时,hrs-fc缀合物的有效量 或hrs-fc缀合物的血浆浓度被实现或维持了例如,至少15分钟、至少 30分钟、至少45分钟、至少60分钟、至少90分钟、至少2小时、至少3小时、至少4小时、至少8小时、至少12小时、至少24小时、至少 48小时、至少3天、至少4天、至少5天、至少6天、至少1周、至少 2周、至少1个月、至少2个月、至少3个月、至少4个月或至少6个月。
[0534]
在具体实施方案中,所述有效剂量实现了本文所述的组合物或药剂 的血浆水平或平均波谷浓度。这些可以使用常规方法容易地测定。
[0535]
在其他方面,本发明的实施方案提供了试剂盒,其包括装有本发明 的一种或多种hrs-fc缀合物、多肽、多核苷酸、抗体、多单元复合物及 其组合物等的一个或多个容器,如本文所述。所述试剂盒可包括针对如 何使用这类组合物的书面说明(例如,调节细胞信号传导、血管生成、癌 症、炎症病况、诊断等)。
[0536]
本文的试剂盒也可以包括被治疗的适应症适合的或所需的或者用于 所需的诊断应用的一种或多种另外的治疗剂或其他组分。如需要,另外 的治疗剂可以包含于第二容器中。另外的治疗剂的实例包括但不限于, 抗肿瘤剂、抗炎剂、抗菌剂、抗病毒剂、血管生成剂等。
[0537]
本文的试剂盒也可包括一个或多个注射器,或其他需要的或期望的 促进所需递
送模式的组件(例如,支架、可植入的储库等)。
[0538]
现在将通过以下实施例来说明本发明的某些实施方案。然而,本发 明可以用很多不同方式实施,而不应解释为其受限于本文示出的实施方 案;相反,提供这些实施方案是为了使得本公开充分而完整,并向本领 域技术人员充分传递本发明的范围。
实施例
[0539]
实施例1
[0540]
his标记的resokine(包含氨基酸1-60的hrs)的制备
[0541]
密码子优化和基因合成。使用dna2.0(menlo park,ca)形成的算法, 将编码resokine的dna(hrs(1-60))针对大肠杆菌表达进行密码子优化。
[0542]
密码子优化的dna序列如下:
[0543]
atggcagaacgtgcggcattggaagaattggttaaactgcaaggtg aacgtgttcgtggtctgaagcagcagaaggctagcgcggagctga tcgaagaagaggtggccaaactgctgaagctgaaggcgcagctgg gcccggacgagagcaaacaaaagttcgtcctgaaaaccccgaaac accaccatcaccatcac(seq id no:261)
[0544]
翻译的蛋白质序列如下:
[0545]
maeraaleelvklqgervrglkqqkasaelieeevakllklkaqlgp deskqkfvlktpkhhhhhh(seq id no:262)
[0546]
另外,用接近n-末端(包含另外的n-末端met和cys残基)、c-末端 (包含第61位处另外的c-末端半胱氨酸)以及在连接分子的2α螺旋截面 的连接子结构域中(包含ala 26
→
cys的突变)插入的半胱氨酸残基来制备 该构建体的工程化形式。下文列出这些构建体的密码子优化的dna序列 以及相应的氨基酸序列。
[0547]
h-n4:1-h(密码子-hrs(1-60)-m1mc-6xhis): atgtgtgcagaaagagccgccctggaagagttagttaagttgcaa ggtgaacgtgtccgtggtctgaagcagcagaaggctagcgcggag ctgatcgaagaagaggtggccaaactgctgaagctgaaggcgcag ctgggcccggacgagagcaaacaaaagttcgtcctgaaaaccccg aaacaccaccatcaccatcac(seq id no:263)
[0548]
翻译的蛋白质序列如下:
[0549]
mcaeraaleelvklqgervrglkqqkasaelieeevakllklkaqlg pdeskqkfvlktpkhhhhhh(seq id no:264)
[0550]
h-n4:2-h(密码子-hrs(1-60)-a26c-6xhis):
[0551]
atggcagaacgtgcggcattggaagaattggttaaactgcaaggtg aacgtgttcgtggtctgaagcagcagaagtgcagcgcggagctga tcgaagaagaggtggccaaactgctgaagctgaaggcgcagctgg gcccggacgagagcaaacaaaagttcgtcctgaaaaccccgaaac accaccatcaccatcac(seq id no:265)
[0552]
翻译的蛋白质序列如下:
[0553]
maeraaleelvklqgervrglkqqkcsaelieeevakllklkaqlgp deskqkfvlktpkhhhhhh(seq id no:266)
[0554]
h-n4:3-h(密码子-hrs(1-60)-c61-6xhis):
[0555]
atggcagaacgtgcggcattggaagaattggttaaactgcaaggtg aacgtgttcgtggtctgaagcagcagaaggctagcgcggagctga tcgaagaagaggtggccaaactgctgaagctgaaggcgcagctgg gcccggacgagagcaaacaaaagttcgtcctgaaaaccccgaaat gccaccaccatcaccatcac(seq id no:267)
[0556]
翻译的蛋白质序列如下:
[0557]
maeraaleelvklqgervrglkqqkasaelieeevakllklkaqlgp deskqkfvlktpkchhhhhh(seq id no:268)
[0558]
用c-末端6xhis标签合成相应基因(dna 2.0),并将其亚克隆至 pjexpress411表达载体中,其中使用t7启动子驱动转录,且将卡那霉素 抗性用于抗生素筛选。
[0559]
表达菌株。用所述的相关密码子优化的表达构建体转化bl21(de3) 感受态细胞(novagen,目录号69450)。简而言之,将质粒(1μl)加入至50μl 感受态细胞中。将反应物混合并于冰上孵育30分钟。将反应物在42℃ 热激30秒,然后在冰上冷激2分钟。然后加入soc培养基(500μl),并 将该管于37℃,250rpm孵育1小时。最后,将等份的培养物(50μl)涂布 于卡那霉素平板(teknova s9641)并于37℃孵育过夜。挑出单个克隆,并 用于扩大表达。
[0560]
培养基。通过将200ml无菌的m9最低限度盐5x(bd248510)、无 菌纯净水中的778ml 30g/l酵母提取物(bd212750)、20ml无菌20%葡 萄糖(sigma g7021)和2ml无菌1.0m mgso4(sigma m7506)混合来制备 m9ye培养基。进料溶液含有5%酵母提取物、50%葡萄糖、微量元素和 2g/l硫酸镁。将硫酸卡那霉素(invitrogen 15160)加入m9ye和进料溶液 两者中至最终浓度为100μg/ml。
[0561]
补料分批发酵。使用配备mfcs/da软件的4l发酵罐(sartoriusbiostat b plus)进行补料分批发酵。搅拌速度设为1000rpm。通过加入30% 氢氧化铵(sigma 221228)和30%磷酸(sigma p5811)将ph值自动控制在 7.0。用无油隔膜式空气压缩机(cole-parmer)以4l/min的流速提供空气。 使空气通过0.2μm midisart 2000过滤器(sartorius 17805)。自动化提供纯 氧(west air)以将溶氧水平控制在70%。用neslab rte7循环仪(thermoscientific)将温度控制在30℃。通过加入消泡剂204(sigma a8311)来控制 泡沫。发酵罐中m9ye培养基的初始体积为3l。用在30℃和250rpm 下过夜生长的150ml种子培养物接种发酵罐。当该容器中的葡萄糖被耗 尽时,用蠕动泵以0.9ml/min将浓缩的进料溶液引入至该容器中。当细胞 在600nm处的光学密度达到约30时,用0.5mm iptg(fisher scientificbp1755)诱导该培养物。将培养物培养过夜(约18小时分批进料时相)并通 过6,000x g离心1小时进行收获。将细胞团块保存于-20℃直至纯化。 在sds-page上确定resokine的表达。
[0562]
蛋白的纯化。通过细胞裂解和澄清、固定化金属亲和色谱和阳离子 交换色谱法从大肠杆菌细胞团纯化resokine及其cys变体。将称重10g 并含有resokine或cys变体的冷冻细胞解冻以4:1ml/g细胞团的比率重 新悬浮于1x ninta缓冲液(50mm tris,0.3m nacl,25mm咪唑,ph 8), 连同5mmβ-巯基乙醇(sigma cat#m7154-25ml)和1个蛋白酶抑制剂混 合物片剂(roche cat#05 056 489 001)一起。在所有细胞重新悬浮后,将细 胞在微流化器m-110y中于冰上裂解,在冰上以15000psi经过2次以释 放可溶的resokine或cys变体。在第二次通过之后加入ninta缓冲液以 冲洗经过微流化器剩余的裂解物(裂解后的终体积为100-120ml)。将裂解 物以15000x g@4c离心30min。用acropak 200(pall cat#12094)以 0.45/0.2um过滤上清液。滤过的上清液为澄清的裂解物。
[0563]
固定化金属亲和色谱(imac)纯化。将来自10g细胞团的澄清裂解物 上样至含有3ml ninta树脂(qiagen#30210)并在ninta缓冲液中预平 衡的重力-流动柱中。用50倍柱体积(cv)的含0.1%triton x-114的1xninta缓冲液洗涤树脂以去除内毒素,然后用30倍cv的1x ninta缓 冲液,随后用5倍cv的ninta洗脱缓冲液(50mm tris,0.3m nacl,0.3 m咪唑,
ph 8@4c)洗脱。
[0564]
阳离子交换(cex)色谱纯化。cex载荷通过在cex a缓冲液(10mm 磷酸钠,ph 7.0,2mm dtt)中稀释ninta洗出液1/20x来制备,然后上 样至在cex a中平衡的sp琼脂糖高效柱。用0-100%b的线性梯度经20 个cv洗脱蛋白质,其中a=10mm磷酸钠,ph 7.0,2mm dtt,以及b=10 mm磷酸钠,1m氯化钠,2mm dtt,ph 7.0,在214nm监测吸光度。 合并对应于214nm处吸光度的洗脱梯度中主峰的级分。使用amiconultra-15 3kd mwco超离心装置将cex合并物缓冲液交换至1x pbs ph 7.4(gibco#10010)。
[0565]
实施例2
[0566]
his标记的全长组氨酰-trna合成酶(hrs)的制备
[0567]
密码子优化和基因合成。将全长hisrs基因针对大肠杆菌表达进行 密码子优化并将其亚克隆至pet21a载体,其中t7启动子被用于驱动转 录。另外,将5个氨基酸连接子和6xhis标签连接于c-末端。
[0568]
dna序列如下:
[0569]
atggcggaacgtgccgcactggaagaattggttaaattacaggga gaacgcgtacgtggtcttaaacaacaaaaagcctctgcggaattga ttgaagaagaagttgccaaattactgaaactgaaagctcaacttg gacccgatgaaagtaaacaaaaatttgtgttgaaaacgcccaaag gaacccgtgattatagtccacgtcaaatggccgttcgtgaaaaagt gttcgacgttattattcgctgttttaaacgtcacggtgctgaagtaa tcgatacccccgtatttgaattgaaagagactctgatgggcaaatat ggtgaagattctaaactgatttatgatttgaaagaccaaggaggtg aactgctgagcctgcgctacgacttaactgtgccttttgcccgttac ttagccatgaataaattaaccaacatcaaacgttaccatattgcaaaa gtatatcgccgcgacaaccctgcaatgactcgtggacgctatcgcg aattctatcagtgtgattttgatattgccggaaatttcgacccgatga tcccggatgccgagtgtttgaaaattatgtgtgaaattctgagttcg ttgcagatcggagactttcttgtaaaagttaatgaccgccgtattct ggatggtatgtttgctatttgcggtgtttctgattccaaattccgtac aatctgctcaagcgtggacaaattggataaagtgtcttgggaagaa gtaaaaaatgaaatggtgggagaaaaaggcctggctccagaagta gcagaccgtattggtgactatgttcaacaacatggcggtgtgtcctt agtcgaacagttattacaggatcctaaactgagccaaaataaacaa gcacttgaaggactgggagatctgaaattactctttgaatatctgac cttatttgggattgatgataaaattagctttgatctgagcttggcccg cggtcttgattattataccggcgtgatttacgaagctgttctcttgca aaccccagcccaggcgggcgaagagcctttgggagtcggcagtgt ggcagccggtggtcgttatgatggtttggtaggaatgtttgacccta aaggccgtaaagtaccatgtgtggggctttctatcggtgtcgaacg tatcttttctattgttgaacaacgtcttgaagctttggaggaaaaga tccgtaccacggaaacccaagtcttagttgcaagtgcccaaaaaaa actgttagaagaacgcctgaaactcgtatcagaactttgggacgcc ggcatcaaggccgaactgctgtataaaaagaacccgaaattgttaa accaactccagtattgtgaagaagctgggatcccactcgtagctatt attggtgagcaagaattaaaagatggcgtgattaaactgcgttcag taacaagccgtgaagaggtagatgtacgtcgcgaagacttagtgg aagaaattaaacgccgcaccggtcaaccgttatgtatttgcgcggc cgcactcgagcaccaccaccaccaccactga(seq id no:269)
[0570]
翻译的蛋白质序列如下:
[0571]
maeraaleelvklqgervrglkqqkasaelieeevakllklkaqlgp deskqkfvlktpkgtrdysprqmavrekvfdviircfkrhgaevidtp vfelketlmgkygedskliydlkdqggellslrydltvpfarylamn kltnikryhiakvyrrdnpamtrgryrefyqcdfdiagnfdpmipdae clkimceilsslqigdflvkvndrril
dgmfaicgvsdskfrticssvdk ldkvsweevknemvgekglapevadrigdyvqqhggvslveqllqd pklsqnkqaleglgdlkllfeyltlfgiddkisfdlslargldyytgvi yeavllqtpaqageeplgvgsvaaggrydglvgmfdpkgrkvpcvg lsigverifsiveqrlealeekirttetqvlvasaqkklleerlklvsel wdagikaellykknpkllnqlqyceeagiplvaiigeqelkdgviklrs vtsreevdvrredlveeikrrtgqplcicaaalehhhhhh(seq id no:270)
[0572]
表达菌株。用密码子优化的表达构建体转化bl21(de3)感受态细胞 (novagen,目录号69450)。简而言之,将质粒(1l)加入至50μl感受态细 胞中。将反应物混合并于冰上孵育30分钟。将反应物在42℃热激30秒, 然后在冰上冷激2分钟。然后加入soc培养基(500l),并将该管于37℃,250rpm孵育1小时。最后,将等份的培养物(50l)涂布于氨苄西林平板 (teknova s9641)并于37℃孵育过夜。挑出单个克隆,并用于扩大表达。
[0573]
培养基。通过将200ml无菌的m9最低限度盐5x(bd248510)、无 菌纯净水中的778ml 30g/l酵母提取物(bd212750)、20ml无菌20%葡 萄糖(sigma g7021)和2ml无菌1.0m mgso4(sigma m7506)混合来制备 m9ye培养基。进料溶液含有5%酵母提取物、50%葡萄糖、微量元素和 2g/l硫酸镁。将氨苄西林加入m9ye和进料溶液两者中至最终浓度为100 μg/ml。
[0574]
补料分批发酵。使用配备mfcs/da软件的4l发酵罐(sartoriusbiostat b plus)进行补料分批发酵。搅拌速度设为1000rpm。通过加入30% 氢氧化铵(sigma 221228)和30%磷酸(sigma p5811)将ph值自动控制在 7.0。用无油隔膜式空气压缩机(cole-parmer)以4l/min的流速提供空气。 使空气通过0.2μm midisart 2000过滤器(sartorius 17805)。自动化提供纯 氧(west air)以将溶氧水平控制在70%。用neslab rte7循环仪(thermoscientific)将温度控制在30℃。通过加入消泡剂204(sigma a8311)来控制 泡沫。发酵罐中m9ye培养基的初始体积为3l。用在30℃和250rpm 下过夜生长的150ml种子培养物接种发酵罐。当该容器中的葡萄糖被耗 尽时,通过蠕动泵以0.9ml/min将浓缩的进料溶液引入至该容器中。当细 胞在600nm处的光密度达到约30时,用0.5mm iptg(fisher scientificbp1755)诱导该培养物。将培养物培养过夜(约18小时分批进料时相)并通 过6,000x g离心1小时进行收获。将细胞团块保存于-20℃直至纯化。 在sds-page上确定hisrs的表达。
[0575]
hisrs的纯化。将冷冻的细胞团(40g)重新悬浮于160ml(即4ml/g 细胞团)裂解缓冲液中(20mm tris,400mm nacl,20mm咪唑,14mm β-me,ph 8.0,4℃)。将完全的无edta的蛋白酶抑制剂片剂(roche)以1 片/50ml的比率加入至悬浮液中。随着通过冰冷却,使悬浮液以15,000psi 通过微流化器(microfluidics)两次。将裂解物在4℃下以35,000x g离心 45min。将上清液通过0.22μm acropak 200囊式过滤器(pall)过滤。
[0576]
将澄清的裂解物结合至用ni-nta结合缓冲液(20mm tris,400mmnacl,20mm咪唑,5mmβ-me,ph 8.0,4℃)预平衡的ni-nta树脂(qiagen)。用500倍柱体积的ni-nta结合缓冲液+0.1%triton x-114洗 柱,随后用50倍柱体积的ni-nta结合缓冲液洗柱。用5倍柱体积的 ni-nta洗脱缓冲液(20mm tris,400mm nacl,500mm咪唑,5mm β-me,ph 8.0,4℃)洗脱结合的蛋白hisrs。
[0577]
ni-nta洗出液通过阴离子交换柱进一步纯化。具体地说,ni-nta 洗出液用q结合缓冲液(20mm tris,50mm nacl,1mm dtt,ph 7.4)透 析,然后上样至用q结合缓冲液预平衡的5ml q-琼脂糖柱。将期望产物 用线性梯度的0-1m nacl于q结合缓冲液中经10倍柱体积从柱上洗脱。 将纯化的hisrs浓缩,缓冲液交换至pbs(invitrogen产品#10010)+1mmdtt,
并通过0.22μm无菌过滤器过滤。
[0578]
实施例3
[0579]
全长hars中半胱氨酸残基的活性位点滴定
[0580]
为确定全长hars中表面暴露的半胱氨酸残基的位置和特性,将纯 化的重组蛋白质与碘乙酰胺在天然和变性条件下孵育以使任何表面暴露 的半胱氨酸残基烷基化。然后,将样品通过限制性蛋白水解,随后lc
‑ꢀ
质量分析进行分析以确定修饰的半胱氨酸残基的位置和特性。
[0581]
为进行烷基化研究,将全长、多组氨酸标记的hars(6.65mg/ml于 pbs、10%甘油、2mm dtt、ph7.4中,(实施例2))首先通过与10mm dtt 在室温孵育45分钟而充分还原。与碘乙酰胺的孵育以30mm(“低的”)或 100mm(“高的”)碘乙酰胺浓度在暗处进行30分钟,并在hars的天然和 变性样品上进行以确定反应是成功的。通过将蛋白质与4m胍在50℃预 孵育45min来制备变性的hars。在与碘乙酰胺孵育之后,使用10kda 分子量筛截透析膜将样品在4℃于pbs(ph 7.4)中透析,并进行3次缓 冲液交换,然后用于如下文所述的质谱分析。
[0582]
简而言之,通过将蛋白质稀释入0.1%甲酸至1m/ml的最终浓度来制 备样品,注射5μg蛋白样品并通过反相hplc,以及随后使用agilent tof 质谱仪通过质谱分析进行分析。在c3 hplc柱(agilent zorbax300sb-c3,5μm,2.1x150mm柱)上使用(2-60%的流动相b)的线性梯度经 18min(流动相a:0.1%甲酸;流动相b:含0.1%甲酸的乙腈)首先分离样 品。样品的质谱分析为谱图模式。通过masshunter(agilent)获得并分析数 据。通过masshunter bioconfirm(agilent)计算测量的分子量。
[0583]
结果(数据未示出)显示在天然条件下,仅3或4个半胱氨酸残基被容 易地修饰,而相比之下,当蛋白质首次变性以破坏其天然构象时,所有 10个半胱氨酸被容易地变性。
[0584]
为了鉴定修饰的半胱氨酸残基的特性,在与碘乙酰胺孵育之前和之 后,将样品在37℃于4m盐酸胍中经历30min变性,随后在室温下使用 10:1比率(w/w)用lysc蛋白水解裂解20h。使用dionex hplc和thermoltq xl质谱仪通过lc/ms/ms分析蛋白消化物。在c18 hplc柱(agilentzorbax 300sb-c18,5μm,2.1x150mm)上使用流动相b(流动相a:0.1% 甲酸;流动相b:含0.1%甲酸的乙腈)的梯度首先分离样品。10min内梯 度开始为1-3%b,然后在76min内梯度为40%b。将分离的蛋白消化物 通过谱图模式的全ms或全ms扫描进行分析,通过对前三个鉴定的离 子进行串联ms/ms扫描进行分析。通过xcalibur(thermo)获得并分析数 据。肽测序基于每个肽的ms/ms光谱,其中b-和y-离子峰与其理论离子 相匹配。肽的鉴定定和修饰位点的定位基于分子量,使用ms/ms光谱通 过肽测序来确认,并列于表e1中。
[0585][0586][0587]
结果揭示(数据未示出),cys235、cys507和cys509被容易地通过碘 乙酰胺处理进行修饰,并且因此可能为容易地被进行化学修饰的表面暴 露的残基。
[0588]
实施例4
[0589]
产生具有改变的半胱氨酸含量的修饰的hrs多肽
[0590]
为了确定全长hrs中10个天然存在的半胱氨酸残基中任一个是否 能突变成可选的天然存在的氨基酸残基或缺失,设计引物以选择性突变 每个半胱氨酸残基。为了实现这一点,可以使用基于以下的引物(参见表 e2)。
[0591]
[0592][0593]
为了确认活性位点滴定数据,使用程序getarea1.1分析全长hrs的 晶体结构以评估10个半胱氨酸残基的相对位置。结果(数据未示出)表明 除了c235、c507和c509之外,在seq id no:1的c174、c191和c224 位置处的半胱氨酸至少部分暴露于表面并可能经由标准试剂进行修饰。 另外,hrs的晶体结构的分析表明c174和c191能够形成内部二硫键, 而c507和c509能够在hrs二聚体内形成链间二硫键,两者可能有助于 微观不均一性,其能够被有益地消除。
[0594]
为了直接评估两个c-末端半胱氨酸残基在有助于链间二硫键形成中 的显著性,在还原之前和之后通过sds page分析来比较hrs的全长和 c-末端缺失形式(hrs(1-506))的his-标记形式。图3中显示的结果表明全 长hrs为非共价和ss-连接的二聚体的~50:50混合物,而hrs(1-506)显 著减少了ss-连接的二聚体。通过下文所述的竞争性elisa进行的两种 蛋白质的比较揭示,对于jo-1抗体结合,两种蛋白质具有相当的ic50值 (数据未示出)。与hrs(1-506)相关的显著减少的链间二硫键形成表明该变 体为形成改善的下一代产物形式的合适的起点。
[0595]
为确定全长hrs中剩余的四个部分暴露的半胱氨酸残基中任一个能 否突变为可选的天然存在的氨基酸残基,设计引物以选择性突变c174、 c191、c224和c235残基。为实现这一点,使用表e3中列出的以下引 物:
[0596][0597]
使用quikchange快速定点诱变试剂盒(agilent,目录号210518),按 照生产商的说明书,通过诱变引入突变。诱变后,用dpn i酶于37℃下 处理样品,并用常规方法将其转化至xl10 gold感受态细胞。将多个克隆 在tb培养基(terrific broth)中于37℃下生长过夜,并用qiaprep spin小 量制备试剂盒(qiagen目录号27106)纯化所得质粒。对质粒进行测序以确 认每个克隆的氨基酸取代的同一性。将代表性克隆转化至novablue感受 态细胞(novagen目录号70181),并在250ml m9ye培养基中于37℃下 生长过夜。使用hispeed plasmid maxi试剂盒(qiagen目录号12663)进行 大量质粒制备,以产生突变体的质粒储库用于进一步的分析。通过测量 a260、a280和a230测定浓度和纯度。所纯化的质粒在按照标准方案转 染至大肠杆菌或哺乳动物细胞之前保存于-20℃。
[0598]
为了评估每个残基突变的突变影响,将代表性克隆转化至大肠杆菌或 哺乳动物细胞并评估产物产率、内毒素含量、稳定性和在下文所述的确 定jo-1抗体结合的elisa测定中的相对活性。
[0599]
蛋白产生。用上文所述的编码还原的半胱氨酸构建体的密码子优化 的表达构建体转化bl21(de3)感受态细胞(novagen,目录号69450)或 w3110细胞(attc)。在调整生产规模和所使用的细胞团的量后,用于产 生重组蛋白的表达系统、发酵培养基、发酵条件和纯
化步骤基本上与以 下实施例4中所述的那些相同。下表e4显示制得的蛋白的纯化产量和内 毒素水平。
[0600][0601][0602]
结果显示所有还原变体为相对良好表达的,并且成功地纯化为具有 低的内毒素水平。具体地说,基于cys191和cys235突变的还原的半胱 氨酸变体显示出有利的表达水平;虽然所有克隆显示出合理的表达水平 和低的内毒素水平。
[0603]
为了评估半胱氨酸突变对纯化蛋白质的电荷异质性的影响,将每个 克隆样品通过等电点聚焦分析。使用life technologies novex ph 3-10 ief 凝胶1.0mm(目录号p/n ec6645box)、novex ief标志物3-10(目录号 p/n 391201)、novex ph 3-10ief缓冲液试剂盒(目录号p/n lc5317),将 样品(10μg)上样至等电点聚焦凝胶(ph 3-10),用1x阴极缓冲液(上室)和 1x阳极缓冲液(下室)在100v运行1小时,在200v运行1小时以及在500v 运行30分钟。将凝胶用12%tca和3.5%磺基水杨酸固定30分钟并用 expedeon instantblue(目录号p/n isb1l)染色。数据(结果未显示)表明第 174位处半胱氨酸的突变显著降低等电点异质性,这与该半胱氨酸残基经 历与半胱氨酸191的分子内二硫键形成的可能性一致。
[0604]
为评估半胱氨酸修饰对所得蛋白的热稳定性、聚集的倾向性、结构 和trna合成酶活性的影响,通过差示扫描荧光测定法、尺寸排阻 hplc(se-hplc)、竞争性elisa和活性位点滴定对该蛋白进行评估。该 结果显示于下表e5中。
[0605]
通过监测热变性期间荧光随亲脂性染料的荧光强度的变化而在蛋白 样品上进行差示扫描荧光测定法。在将样品于100μl终体积的pbs ph7.0(150mm nacl,20mm磷酸盐)中稀释至0.5mg/ml并与热转移染料溶 液混合后对样品进行研究,所述热转移染料溶液通过将储备液(appliedbiosystems/life technologies,p/n 4461146)在超纯蒸馏水(gibco,p/n10977)中稀释20倍来制备。将5μl稀释的染料加入至100μl样品。将 混合物以每孔20μl和每样品重复4个孔接种至384孔透明光反应板 (applied biosystems/life technologies p/n 4309849)。通过viia 7实时 pcr仪器(applied biosystems/life technologies,p/n 4453552)进行读板。 获得了以下热变性方案:开始变化速率为1.6℃/s,直至温度为25℃,在 该点时,仪器在该温度保持2分钟,然后以0.5℃/s的速率使温度进一步 增加至99℃,在该点,将该温度保持另外2分钟。
[0606]
用配备有真空除气器、二元/四元泵、恒温自动进样器、恒温柱室、 二极管阵列检测器(dad)和chemstation色谱分析软件的agilent 1260hplc系统,使用流速为0.3ml/min的200mm磷酸钠,150mm nacl ph7.0的流动相,利用tskgel super sw3000,4.6mm id x 30cm,4μm粒度, 柱(tosoh,18675)在纯化的蛋白样品上完成尺寸排阻hplc分析。在 短暂的离心后,注入每种蛋白的未稀释样品(40μg)。将系统适用性样品(牛 血清白蛋白,bsa,thermo scientific,p/n:23209)和内部对照(野生型hrs) 用于包括在样品内以确保测试的有效性。
[0607]
在96孔板(immulon 4hbx)中进行竞争性elisa,所述板已涂覆有用 pbs把浓度调节至2μg/ml的50μl全长his-标记的hars溶液。将板 密封并在4℃孵育过夜。在使用前,将板用pbst洗涤五次,随后在室温 用100μl含1%bsa的pbs封闭1小时。当elisa板封闭时,将还原的 半胱氨酸竞争分子(浓度范围为1x 10-6
m至1x 10-13
m)与在含1%bsa的 pbs中以1:10,000稀释的α-jo-1抗体(genway gwb-fb7a3d或 immunovision hjo-0100)在单独的孵育板(costar 3357 96孔)中于4℃下孵 育1小时。在封闭完成后,将elisa板用pbst洗涤三次,将含有抗体 和竞争剂的50μl溶液加入至elisa板并将样品在室温孵育1.5小时。 在初始结合孵育后,将板用pbst洗涤五次。然后,以1:5,000的稀释度 加入50μl检测抗体(abd serotec山羊抗人igg f(ab’)2:hrp 0500-0099) 并在室温孵育一小时。在第二结合孵育后,将板用pbst洗涤五次,并 加入50μl tmb底物(thermo scientific pierce tmb substrate pi-34021)。 反应进行8分钟,此时加入50μl 2m硫酸终止溶液。使用spectramax 读板仪在450nm进行比色定量。
[0608]
为测定每个hars506半胱氨酸变体中催化活性位点的数目,使用 了活性位点滴定测定(如fersht等,(1975)biochemistry中所述)。简而言之, 在室温下用5μm hars、10mm mgcl2、50μm atp、20mm l-组氨酸、 2ug/ml无机焦磷酸酶、1.65μm[γ-32p]atp于标准缓冲液(100mmhepes ph 7.5,20mm kcl)中进行测定。在低轮廓pcr板中用酶引发反 应,在含有hclo4/炭浆(1:4 7%hclo4:10%炭浆)的96-孔pvdfmultiscreen滤板微孔中在30s、1min、2min、4min、6min和10min的 时间点猝灭反应。在通过移液器上下吹打混合后,用supermix闪烁体使 样品旋转至收集板并在microbetae读板仪中计数。
[0609][0610]
来自这些研究的结果证实所有半胱氨酸突变体为有活性的,其中活 性、稳定性或构象丧失很少或没有丧失,如通过活性位点滴定法、elisa 结合以及热变性的tm测定所测量。trna合成酶活性的活性位点滴定揭 示,所有还原的半胱氨酸突变体为有活性的,因此
适合用于本发明的任 何组合物、方法和试剂盒中。通常,cys191取代显示出总体较低的热稳 定性,而cys174突变体显示出显著较少的异质性,如通过等电点聚焦所 测定的。
[0611]
实施例5
[0612]
具有c-末端截断的修饰的(无标签)hrs多肽(hisrs
n8
)或(hrs(1-506) 的产生
[0613]
为了缺失最后三个氨基酸以及野生型hisrs与his-标签之间的连接 子,设计引物与quikchange快速定点诱变试剂盒(agilent,目录号210519) 一起使用。为实现这一点,使用表e6中列出的以下引物:
[0614][0615][0616]
按照quikchange快速定点诱变试剂盒生产商的说明书进行缺失。诱 变后,用dpn i酶于37℃下处理样品,并用常规方法将其转化至xl10 gold 感受态细胞。将多个克隆在lb肉汤(luria-bertani broth)中于37℃生长过 夜,并用qiaprep spin小量制备试剂盒(qiagen目录号27106)纯化所得的 质粒。对所述质粒测序以确认每个克隆的氨基酸取代的同一性。为了缺 失his标签,设计引物与quikchange快速定点诱变试剂盒(agilent,目录 号210519)一起使用。为实现这一点,使用表e7中列出的以下引物。
[0617][0618]
按照quikchange快速定点诱变试剂盒生产商的说明书进行缺失,如 上所述。
[0619]
蛋白产生。如实施例2中所述,用编码hisrs
n8
(hrs(1-506))的密码 子优化的表达构建体转化bl21(de3)感受态细胞(novagen,目录号69450) 或w3110细胞(attc)。用于产生重组蛋白的表达系统、发酵培养基和发 酵条件基本上与实施例2中所述的那些相同。
[0620]
无标签hisrs
n8
(hisrs(1-506))的纯化。将冷冻的细胞团(400g)重新 悬浮在4倍体积(1600ml)的裂解缓冲液(50mm tris,50mm nacl,5mmmgcl2,2mm l-半胱氨酸,ph7.4)中。将完全的无edta的蛋白酶抑制剂 片剂(roche,cat#05 056 489 001)以1片/50ml的比率加入至该悬浮液 中。随着通过冰的冷却,将悬浮液以18,000psi两次通过微流化器 (microfluidics)。将裂解物在4℃下以15,000x g离心45min。将上清液 通过2-3acropak 1500囊式过滤器(0.8/0.2μm,pall,pn12675)过滤。
[0621]
将澄清的裂解物加样至用q缓冲液a(50mm tris,50mm nacl,ph7.4)预平衡的382ml q hp柱(5x19.5 cm)。将产物用线性梯度的0-30%q 缓冲液b(50mm tris,1m nacl,ph 7.4)经10倍柱体积(cv)洗脱。在1/2 cv/级分处收集级分并通过sds-page分析。基于凝
胶分析合并。
[0622]
将3.5m硫酸铵溶液加入至以上q hp混合物中至1.2m的最终浓度。 将混合物通过acropak 200(0.2um)过滤并加样至用20mm tris,1.2m硫 酸铵,ph 7.0预平衡的481ml苯基hp柱(5x24.5 cm)。将产物用在20mmtris/ph 7.0中的线性梯度的1.2-0m硫酸铵经10倍cv洗脱。基于 sds-page分析将含有产物的级分(1/2cv/级分)合并。
[0623]
将来自以上的phenyl pool经由tff系统浓缩至0.5l,所述tff系 统由pellicon mini盒座(millipore cat#xx42pmini)、masterflex i/p泵和2 x 0.1m2盒(30kd mwco,novasep cat#pp030m01l)组成。然后将浓缩的 溶液与6倍透析体积(3l)的cht缓冲液a(10mm磷酸钠,150mm nacl, ph 7.0)缓冲交换。在进行下一步骤之前,将保留物通过0.2μm millexgp-50过滤器(millipore部件#slgp 05010)过滤。
[0624]
将上述溶液加样至用cht缓冲液a预平衡的380ml陶瓷羟磷灰石 (cht)柱(5x19.4 cm)。用缓冲液a,随后用6%的缓冲液b(500mm磷酸 钠,150mm nacl,ph 7.0)洗涤柱。用线性梯度的6-56%缓冲液b经10倍 cv洗脱产物。基于sds-page分析将含有产物的级分(1/2cv/级分)合并。
[0625]
使用相同的tff系统,将cht混合物浓缩至~0.2l,与6倍渗透体 积的当前制剂缓冲液(20mm磷酸钠,150mm nacl,ph 7.0)缓冲交换,并 浓缩至~10mg/ml的靶浓度。将产物溶液通过0.2μm millex gp-50过滤 器(millipore部件#slgp 05010)过滤,并保存在-80℃冰箱中。
[0626]
实施例6
[0627]
hrs(1-60)(resokine)作为抗炎剂的评价
[0628]
为评价hrs来源的多肽的潜在抗炎性质,在tnbs诱导的结肠炎模 型中测试包含hrs的氨基酸1-60(“resokine”)的n-末端、天然存在的剪 接变体。在雄性bdf-1小鼠中进行研究,其中12只小鼠/组;以5mg/kg 口服施用布地奈德。
[0629]
在本研究中,在tnbs处理前3天开始,通过iv注射以1或5mg/kg 的浓度每天施用resokine。图4中显示的数据表明用任一浓度的resokine 治疗引起存活率的显著增加。因此,resokine看起来具有有效的抗炎作 用,这与以下假设一致:hrs多肽参与炎性过程的局部控制。
[0630]
实施例7
[0631]
hrs多肽用于治疗他汀类药物诱导的肌炎和横纹肌溶解的评价
[0632]
他汀类药物为hmg coa还原酶抑制剂,其抑制胆固醇合成中的限 速步骤-甲羟戊酸的合成。已证明他汀类药物治疗在降低患者的胆固醇水 平中是有益的。然而,他汀类药物治疗的副作用和并发症包括肌无力、 肌炎和横纹肌溶解。肌肉肌病为市售的几个他汀类药物的并发症,如果 患者显示出任何这些症状,则通常将患者从他汀类药物-治疗中剔除。类 似于许多其他肌病、肌营养不良和肌肉的炎性病症,他汀类药物诱导的 肌病的疾病进展的出现看起来是由于初始的化学、遗传或物理损伤的结 果,由于免疫细胞侵入受损肌细胞,所述损伤发炎逐渐加重。
[0633]
因此,他汀类药物诱导的肌病代表研究药物诱导的肌炎的广泛可适 用的模型系统,其直接适用于其他肌病和肌营养不良,所有这些疾病共 享常见的炎性组分,其通过促进免疫细胞侵入受损肌肉组织来介导疾病 进展。
[0634]
本研究的目的为评价hrs(1-506)在逆转他汀类药物-诱导的肌肉肌 炎作用中的功效,这通过响应于用hrs(1-506)的治疗而改变的循环酶水 平、肌肉功能和炎症标志物的基因表达的改变所指示。
[0635]
为实现这一点,每天用1mg/kg西立伐他汀给药大鼠,然后转变为每 隔一天(qod)用西立伐他汀给药。该给药方案的目标为维持动物的持续疾 病状态,但不具有极大影响大鼠存活率的这类严重疾病。在他汀类药物
‑ꢀ
给药已引发肌炎的循环标志物的可测量变化之后,然后在大鼠中评价 hrs(1-506)的剂量范围的功效。
[0636]
方案和方法。在本研究中,在第1天开始,将10周龄的雌性 sprague-dawley大鼠用在0.5%甲基纤维素中的1mg/kg西立伐他汀 ((sigma,目录号sml0005)经由灌胃口服治疗。在7天的每天给药后,将 大鼠转变为在第9、11和13天每隔一天的给药策略(qod)。在第6天通过 静脉注射开始hrs(1-506)和媒介物给药并每天给药大鼠至第14天(在图 5a中示意性地示出)。在第15天、在最后测试品给药后24小时和在最后 他汀类药物施用后48小时处死所有大鼠。以在20mm napo4,0.15m nacl, ph 7.0中的3个剂量(0.3、1.0和3.0mg/kg)每天施用hrs(1-506)。
[0637]
为解决本研究的主要目标,进行了以下研究测量和端值:大鼠存活 率、重量、在第12天和15天时循环的血清ck水平、第15天腘绳肌样 品的h&e染色、肌钙蛋白-i elisa、在第15天血液中的cbc、腿筋样 品的qpcr以及血清内源性hars水平。
[0638]
qpcr方法。将小鼠腘绳肌从动物中切除并保存在-80℃直至分析。 使用qiagen的rneasy纤维组织中量试剂盒(目录#75742)在10个腿筋的 组中准备组织。一旦rna从qiagen柱中洗脱,将其在agilent生物分析 仪2100上运行以检测rna完整性并用nanodrop测定rna浓度和纯度。 然后,将rna保存在-80℃。
[0639]
rna至cdna的逆转录(rt)在eppendorf的mastercycler pcr机器 中于96孔pcr板规格中进行,程序如下:37℃保持60分钟,95℃保 持5分钟。未使用96孔板的边缘孔,并用50mcl水填充边缘孔以防止内 部孔的蒸发。每个样品rt使用20mcl rna和30mcl逆转录预混合物 (ambion的taqman preamp cells to ct试剂盒,目录#4387299)。一旦完 成rt,下一步为预扩增样品cdna中的目标基因。将目标基因的引物 (fluidigm设计的deltagene引物)组合至200nm的终浓度。使用这些引 物,在每个样品中预扩增目标基因。使用applied biosystems viia7 pcr 机器在384孔规格中于10mcl反应物(2.5mcl cdna,7.5mcl pre-amp预 混合物)中进行预扩增,程序如下:95℃保持10分钟;14个循环(95℃ 保持15秒,60℃保持4分钟)。在预扩增步骤后,加入核酸外切酶(newengland biolabs目录#m0293l)以去除每个样品的未掺入引物。在 viia7 pcr机器中也完成该核酸外切酶反应,程序如下:37℃保持30 分钟,80℃保持15分钟。在核酸外切酶后,将rt样品以1:5(7mcl核 酸外切酶样品+18mcl低的edta缓冲液)进一步稀释。
[0640]
在fluidigm的biomark系统上用于运行qpcr的芯片为用于基因表 达的96.96动态阵列ifc。在加载样品和测定前根据制造商的推荐首先用 ifc控制器hx准备芯片。为准备待装填于芯片的测定,在96孔板中制 备每个目标基因的3.6mcl 20mcm正向和反向引物的4.4mcl测定预混合 物(fluidigm的2x测定上样试剂,目录#8500736和低的edta te)。为准 备样品,将4.5mcl样品预混合物(ambion的2x taqman基因表达预混合 物,fluidigm的20x dna结合染料样品上样试剂目录号100-0388和 biotium的20x evagreen目录#31000)加入
至96孔板中的3mcl稀释的 预扩增的/核酸外切酶样品。一旦已经准备好芯片,将以上准备的5mcl 样品或测定加载至芯片。将芯片返至ifc控制器,用于将样品加载入芯 片。在芯片已完成加载后,然后可在biomark上使用带有熔点曲线的用 于基因表达的96.96动态阵列的预设程序运行qpcr以测定引物特异性。 通过δδct方法测定相对基因表达。
[0641]
细胞外hars的定量。使用2种小鼠抗-hars单克隆抗体m03(sigma #sab1403905和abnova#h00003035-m03)和m01(abgent#at2317a)以 三明治夹心形式内部形成基于96孔的elisa以检测大鼠血清中的 hars。使用七点标准曲线在96孔costar板(costar 96-孔板#3369)中运行 测定,使用hrs(1-506)的储备液(7.5mg/ml于20mm napo4,0.15m naclph 7.0中,使用1x pbst(0.05%吐温-20)作为稀释液)以范围为75至0.1 ng/ml生成所述标准曲线。将m01小鼠单克隆的克隆1c8(abgent #at2317a)内部生物素化并用作检测抗体,m03小鼠单克隆抗体(sigma #sab1403905,批次#11238,0.5mg/ml和abnova#h00003035-m03,批 次#11238,0.5mg/ml)用作捕获抗体。将酪蛋白(thermo scientific#37528) 用作封闭剂,将1x pbst(0.05%吐温-20)用作洗涤缓冲液。使用链霉亲 和素-hrp(invitrogen cat#434323,批次#816755a)使用tmb底物(thermo #34021)定量抗体结合并将2m硫酸作为停止液。
[0642]
通过用在1x pbs中的0.6至2μg/ml m03抗体包被平板过夜来运行 elisa测定,然后将其通过与酪蛋白孵育1小时来封闭并用3xpbst洗 涤。然后将板与标准物和样品孵育1小时,用3xpbst洗涤;然后与在 pbst中稀释的500ng/ml生物素化-m01孵育1小时,用3xpbst洗涤; 与200ng/ml链霉亲和素-hrp孵育1小时,用3xpbst洗涤;然后加入tmb底物保持4分钟。用停止液停止反应并在450nm处读取吸光度。
[0643]
在没有背景扣除时基于平均原始吸光度值基于标准曲线来对结果进 行定量。prism被用于标准曲线拟合。模型:log(激动剂)相对于反应拟合 [4-参数逻辑回归]每个单独浓度点(未平均的)的回收百分比通过以下计 算:
[0644]
(测量的
–
实际的)x 100%
[0645]
(实际的)
[0646]
其他读数。每天称重大鼠。在第1天、第8天、第12天(经由尾静脉) 和第15天(终止)取血清样品用于循环酶分析(idexx),并使用商业elisa 试剂盒测量血清骨骼肌肌钙蛋白-i测量。在第3、5、8、10、12和15天 当天给药前进行尿分析。在第15天使大鼠安乐死之前对分离的血液进行 cbc分析。在第15天,对大鼠进行安乐死并将腘绳肌和肺(未膨胀)的一 部分置于10%nbf中用于切片的石蜡包埋和h&e染色(premierlaboratory)。将腘绳肌和肺的另一部分置于-80c用于rna提取和分析。 在第15天还分离肝、肾和心并置于锌-福尔马林中进行石蜡包埋(tsri组 织学)用于长期组织保存。
[0647]
结果。在本研究中存在100%的存活率,所有大鼠存活至第15天的 预定处死时间。他汀类药物-给药的大鼠的平均重量低于未用他汀类药物 给药的对照大鼠的平均重量。在第15天,他汀类药物+媒介物组在所有 组中具有最低的大鼠平均重量,而他汀类药物+3mg/kg hrs(1-506)-给药 组在所有他汀类药物-治疗的动物中具有最高的平均重量(数据未示出)。 cbc分析显示不同动物治疗组之间总体相似的变化模式(数据未示出)。
[0648]
在第12天和15天,观察到他汀类药物治疗的大鼠中的血清ck比 未治疗的对照组的血清ck出现小幅增加。在第12天,与他汀类药物+ 媒介物处理的动物相比,用1mg/kg和
3mg/kg hrs(1-506)给药的大鼠具 有较小、较紧凑的ck平均值(图6a-b),这与hrs(1-506)治疗对他汀类 药物诱导的肌炎具有积极影响相一致,也与hrs(1-506)对肌肉功能具有 积极作用相一致,在hrs(1-506)治疗的动物中肌肉肌钙蛋白c水平也降 低(图5b)。而且,与未接受他汀类药物的大鼠相比,他汀类药物治疗的 大鼠中的内源性血清hrs水平升高(图7),这表明hrs的释放可能作为 肌肉炎症的内源性调节剂起作用。对腘绳肌的h&e染色显示:与媒介物
ꢀ‑
给药的和0.3mg/kg hrs(1-506)-给药的大鼠相比,在用1mg/kg和3mg/kghrs(1-506)给药的他汀类药物-治疗的大鼠中中肌肉变性/坏死和炎症分 数降低(图8)。
[0649]
为进一步研究hrs对他汀类药物诱导的肌病的影响的机理基础,在 完成研究后检测治疗动物的腘绳肌中基因表达的变化。如上所述在第15 天时对分离自大鼠的腘绳肌进行rna分析。来自这些研究的结果显示响 应于他汀类药物治疗而升高超过5倍的所有13种基因通过用hrs(1-506) 治疗而降低(参见表e8;和图9-10)。
[0650][0651]
他汀类药物治疗的大鼠腘绳肌的转录分析揭示:10个糖尿病/代谢综 合征相关基因(图11)和几个管家基因(数据未示出)并未显著受到hrs治 疗的影响。相比之下,他汀类药物治疗的大鼠腘绳肌的26个免疫细胞标 志物基因的转录分析揭示大量的基因存在显著变化(参见图12-14),包括 itgal(cd11a)、cd11b、cd8a、cd8b、cd18、ccr5、ptppc和(cd45r) 表达的剂量依赖性抑制。另外,hrs(1-506)在降低许多炎症标志物基因 的表达中是有效的,所述炎症标志物基因包括il6、mcp1、il10和ifnγ(参 见图15-16)。也在14种粘附、发育和纤维化相关基因(参见图17-18)、肌 肉收缩性基因neb(数据未示出)以及与肌肉消耗、萎缩和肌生成相关的基 因中观察到转录变化(参见图19-20)。
[0652]
结论。与接受媒介物或低剂量0.3mg/kg hrs(1-506)的动物相比,在 接受较高剂量hrs(1-506)(1.0mg/kg或3.0mg/kg)的动物中均观察到降低 的ck、血清肌钙蛋白-i和肌细胞变性/坏死以及肌肉炎症。rna分析数 据通过证明在用较高剂量的hrs(1-506)给药的他汀类药物-处理的大鼠 的腘绳肌中cd8a、il-6、mcp-1和mmp-9表达的降低来支持这些结果。 这些基因的上调最可能是由于增加的免疫细胞浸润受损的肌肉组织。基 于表达的基因的特性,浸润免疫细胞可能由以下细胞类型中的一种或多 种组成:t细胞、树突细胞、nk细胞和巨噬细胞/单核细胞。所有这些细 胞类型已经与肌肉炎症相关,hrs多肽(包括hrs(1-506))介导显著抑制 这一免疫细胞流入的能力表明诸如hrs(1-506)的hrs多肽代表有效的免 疫调节剂,其能够在多种炎性和自身免疫性疾病和病症中充当有效的免疫 调节剂。
[0653]
实施例8
[0654]
hrs-fc多肽的制备
[0655]
如下制备、纯化并分析n-末端和c-末端fc-组氨酰trna合成酶 (hrs-fc)融合蛋
白。
[0656]
质粒构建。通过聚合酶链式反应(pcr)扩增人igg1 fc结构域,然后 使用以下引物经由顺序pcr反应将其插入hrs多肽hrs(1-60)的c-末端 或n-末端,并将所得扩增的dna片段插入位于pet28表达载体(novagen 69864)的hrs(1-60)的c-末端或n-末端。应理解n-末端fc融合蛋白的 产生导致hrs(1-60)中n-末端甲硫氨酸的缺失/取代为fc结构域的c-末 端氨基酸,并且在适当的情况下反之亦然。
[0657]
以下引物用于产生n-末端融合的hrs(1-60)fc融合蛋白 (fc-hrs(2-60))(表e9):
[0658][0659]
以下引物用于产生c-末端融合的hrs(1-60)fc融合蛋白 (hrs(1-60)-fc)(表e10)。
[0660][0661]
使用推荐的热循环参数进行pcr反应,并通过凝胶电泳验证pcr
‑ꢀ
扩增的片段。使用emboss成对比对算法,通过与理论序列进行比对而 确认序列。以下显示fc-hrs(2-60)和hrs(1-60)-fc的克隆的dna和蛋 白质序列。
[0662]
fc-hrs(2-60)(n-末端fc融合)的dna序列: atgtctgacaaaactcacacatgcccaccgtgcccagcacctgaac tcctggggggaccgtcagtcttcctcttccccccaaaacccaagga caccctcatgatctcccggacccctgaggtcacatgcgtggtggtg gacgtgagccacgaagaccctgaggtcaagttcaactggtacgtg gacggcgtggaggtgcataatgccaagacaaagccgcgggaggag cagtacaacagcacgtaccgtgtggt
cagcgtcctcaccgtcctgc accaggactggctgaatggcaaggagtacaagtgcaaggtctcca acaaagccctcccagcccccatcgagaaaaccatctccaaagcca aagggcagccccgagaaccacaggtgtacaccctgcccccatccc gggaggagatgaccaagaaccaggtcagcctgacctgcctggtca aaggcttctatcccagcgacatcgccgtggagtgggagagcaatgg gcagccggagaacaactacaagaccacgcctcccgtgctggactc cgacggctccttcttcctctacagcaagctcaccgtggacaagagc aggtggcagcaggggaacgtcttctcatgctccgtgatgcacgag gctctgcacaaccactacacgcagaagagcctctccctgtctccgg gtaaagcagagcgtgcggcgctggaggagctggtgaaacttcagg gagagcgcgtgcgaggcctcaagcagcagaaggccagcgccgag ctgatcgaggaggaggtggcgaaactcctgaaactgaaggcacag ctgggtcctgatgaaagcaaacagaaatttgtgctcaaaaccccca ag tga(seq id no:335)
[0663]
hrs(1-60)-fc(c-末端fc融合)的dna序列 atggcagagcgtgcggcgctggaggagctggtgaaacttcaggga gagcgcgtgcgaggcctcaagcagcagaaggccagcgccgagct gatcgaggaggaggtggcgaaactcctgaaactgaaggcacagct gggtcctgatgaagcaaacagaaatttgtgctcaaaacccccaag tctgacaaaactcacacatgcccaccgtgcccagcacctgaactcc tggggggaccgtcagtcttcctcttccccccaaaacccaaggacac cctcatgatctcccggacccctgaggtcacatgcgtggtggtggac gtgagccacgaagaccctgaggtcaagttcaactggtacgtggac ggcgtggaggtgcataatgccaagacaaagccgcgggaggagcag tacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcacc aggactggctgaatggcaaggagtacaagtgcaaggtctccaaca aagccctcccagcccccatcgagaaaaccatctccaaagccaaag ggcagccccgagaaccacaggtgtacaccctgcccccatcccggg aggagatgaccaagaaccaggtcagcctgacctgcctggtcaaag gcttctatcccagcgacatcgccgtggagtgggagagcaatgggca gccggagaacaactacaagaccacgcctcccgtgctggactccga cggctccttcttcctctacagcaagctcaccgtggacaagagcagg tggcagcaggggaacgtcttctcatgctccgtgatgcacgaggctc tgcacaaccactacacgcagaagagc ctc tcc ctg tct ccg ggtaaatga(seq id no:336)
[0664]
fc-hrs(2-60)(n-末端fc融合)的蛋白质序列
[0665]
msdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdv shedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqd wlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemt knqvsltclvkgfypsdiavewesngqpennykttppvldsdgsffly skltvdksrwqqgnvfscsvmhealhnhytqkslslspgkaeraal eelvklqgervrglkqqkasaelieeevakllklkaqlgpdeskqkf vlktpk(seq id no:337)
[0666]
hrs(1-60)-fc(c-末端fc融合)的蛋白质序列
[0667]
maeraaleelvklqgervrglkqqkasaelieeevakllklkaqlgp deskqkfvlktpksdkthtcppcpapellggpsvflfppkpkdtlmisr tpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyr vvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqv ytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttpp vldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqksls lspgk(seq id no:338)
[0668]
如下制备另外的n-末端和c-末端fc-组氨酰trna合成酶(hrs-fc) dna构建体。
[0669]
质粒构建。将具有n-末端fc的hrs(2-60)或具有c-末端fc的hrs (1-60)(实施例8)亚克隆至含有tac启动子代替t7的修饰的pet24b载体 (emd,gibbstown,nj)(“pet24b_tac”)。使用含有5’ndei位点和 3’xhoi位点的以下引物通过聚合酶链式反应(pcr)扩增fc-hrs(2-60)和 hrs(1-60)-fc,并使用ndei和xhoi限制性位点将所得扩增的dna亚克 隆至
pet24b_tac。
[0670]
以下引物用于扩增fc-hrs(2-60)(n-末端fc融合)(表e11):
[0671][0672][0673]
以下引物用于扩增hrs(1-60)-fc(c-末端fc融合)(表e12)。
[0674][0675]
使用推荐的热循环参数进行pcr反应,并通过凝胶电泳验证pcr
‑ꢀ
扩增的片段。使用dnastar lasergene seqman pro通过与理论序列比对 来确认序列。以下显示fc-hrs(2-60)和hrs(1-60)-fc的克隆的dna和 蛋白质序列。
[0676]
fc-hrs(2-60)(n-末端fc融合)的dna序列: atgtctgacaaaactcacacatgcccaccgtgcccagcacctgaac tcctggggggaccgtcagtcttcctcttccccccaaaacccaagga caccctcatgatctcccggacccctgaggtcacatgcgtggtggtg gacgtgagccacgaagaccctgaggtcaagttcaactggtacgtg gacggcgtggaggtgcataatgccaagacaaagccgcgggaggag cagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgc accaggactggctgaatggcaaggagtacaagtgcaaggtctcca acaaagccctcccagcccccatcgagaaaaccatctccaaagcca aagggcagccccgagaaccacaggtgtacaccctgcccccatccc gggaggagatgaccaagaaccaggtcagcctgacctgcctggtca aaggcttctatcccagcgacatcgccgtggagtgggagagcaatgg gcagccggagaacaactacaagaccacgcctcccgtgctggactc cgacggctccttcttcctctacagcaagctcaccgtggacaagagc aggtggcagcaggggaacgtcttctcatgctccgtgatgcacgag gctctgcacaaccactacacgcagaagagcctctccctgtctccgg gtaaagcagagcgtgcggcgctggaggagctggtgaaacttcagg gagagcgcgtgcgaggcctcaagcagcagaaggccagcgccgag ctgatcgaggaggaggtggcgaaactcctgaaactgaaggcacag ctgggtcctgatgaaagcaaacagaaatttgtgctcaaaaccccca ag tga(seq id no:347)
[0677]
hrs(1-60)-fc(c-末端fc融合)的dna序列: atggcagagcgtgcggcgctggaggagctggtgaaacttcaggga gagcgcgtgcgaggcctcaagcagcagaaggccagcgccgagct gatcgaggaggaggtggcgaaactcctgaaactgaaggcacagct gggtcctgatgaaagcaaacagaaatttgtgctcaaaacccccaa gtctgacaaaactcacacatgcccaccgtgcccagcacctgaactc ctggggggaccgtcagtcttcctcttccccccaaaacccaaggaca ccctcatgatctcccggacccctgaggtcacatgcgtggtggtgga cgtgagccacgaagaccctgaggtcaagttcaactggtacgtgga cggcgtggaggtgcataatgccaagacaaagccgcgggagg
agca gtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcac caggactggctgaatggcaaggagtacaagtgcaaggtctccaac aaagccctcccagcccccatcgagaaaaccatctccaaagccaaa gggcagccccgagaaccacaggtgtacaccctgcccccatcccgg gaggagatgaccaagaaccaggtcagcctgacctgcctggtcaaa ggcttctatcccagcgacatcgccgtggagtgggagagcaatgggc agccggagaacaactacaagaccacgcctcccgtgctggactccg acggctccttcttcctctacagcaagctcaccgtggacaagagcag gtggcagcaggggaacgtcttctcatgctccgtgatgcacgaggct ctgcacaaccactacacgcagaagagcctctccctgtctccgggta aa tga(seq id no:348)
[0678]
fc-hrs(2-60)(n-末端fc融合)的蛋白质序列:msdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdv shedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqd wlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemt knqvsltclvkgfypsdiavewesngqpennykttppvldsdgsffly skltvdksrwqqgnvfscsvmhealhnhytqkslslspgkaeraal eelvklqgervrglkqqkasaelieeevakllklkaqlgpdeskqkf vlktpk.(seq id no:349)
[0679]
hrs(1-60)-fc(c-末端fc融合)的蛋白质序列: maeraaleelvklqgervrglkqqkasaelieeevakllklkaqlgp deskqkfvlktpksdkthtcppcpapellggpsvflfppkpkdtlmisr tpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyr vvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqv ytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttpp vldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslsl spgk(seq id no:350)
[0680]
如下制备另外的n-末端和c-末端fc-组氨酰trna合成酶(hrs-fc) dna构建体。
[0681]
质粒构建。使用quikchange诱变(agilent,santa clara,ca)生成具有 n-末端fc的hrs(2-40)、(2-45)、(2-50)、(2-55)、(2-66)或具有c-末端 fc的hrs(1-40)、(1-45)、(1-50)、(1-55)、(1-66)。将先前生成的含有 fc-hrs(2-60)和hrs(1-60)-fc的pet24b_tac构建体与以下列出的引物 组合用于quikchange反应以生成hrs-fc构建体。
[0682]
将以下引物用于扩增fc-hrs(2-40)、(2-45)、(2-50)、(2-55)、(2-66) 多肽(n-末端fc融合)(表e13):
[0683]
agtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaatga(seqidno:371)
[0689]
fc-hrs(2-45)(n-末端fc融合)的dna序列:atgtctgacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaagcagagcgtgcggcgctggaggagctggtgaaacttcagggagagcgcgtgcgaggcctcaagcagcagaaggccagcgccgagctgatcgaggaggaggtggcgaaactcctgaaactgaaggcacagctgtga(seqidno:372)
[0690]
fc-hrs(2-50)(n-末端fc融合)的dna序列:atgtctgacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaagcagagcgtgcggcgctggaggagctggtgaaacttcagggagagcgcgtgcgaggcctcaagcagcagaaggccagcgccgagctgatcgaggaggaggtggcgaaactcctgaaactgaaggcacagctgggtcctgatgaaagctga(seqidno:373)
[0691]
fc-hrs(2-55)(n-末端fc融合)的dna序列:atgtctgacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccc
tcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaagcagagcgtgcggcgctggaggagctggtgaaacttcagggagagcgcgtgcgaggcctcaagcagcagaaggccagcgccgagctgatcgaggaggaggtggcgaaactcctgaaactgaaggcacagctgggtcctgatgaaagcaaacagaaatttgtgtga(seqidno:374)
[0692]
fc-hrs(2-66)(n-末端fc融合)的dna序列:atgtctgacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaagcagagcgtgcggcgctggaggagctggtgaaacttcagggagagcgcgtgcgaggcctcaagcagcagaaggccagcgccgagctgatcgaggaggaggtggcgaaactcctgaaactgaaggcacagctgggtcctgatgaaagcaaacagaaatttgtgctcaaaacccccaagggaacccgtgattatagttga(seqidno:375)
[0693]
hrs(1-40)-fc(c-末端fc融合)的dna序列:atggcagagcgtgcggcgctggaggagctggtgaaacttcagggagagcgcgtgcgaggcctcaagcagcagaaggccagcgccgagctgatcgaggaggaggtggcgaaactcctgaaatctgacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaatga(seqidno:376)
[0694]
hrs(1-45)-fc(c-末端fc融合)的dna序列:atggcagagcgtgcggcgctggaggagctggtgaaacttcagggagagcgcgtgcgaggcctcaagcagcagaaggccagcgccgagctgatcgaggaggaggtggcgaaactcctgaaactgaaggcacagctgtctgacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcct
gcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaatga(seqidno:377)
[0695]
hrs(1-50)-fc(c-末端fc融合)的dna序列:atggcagagcgtgcggcgctggaggagctggtgaaacttcagggagagcgcgtgcgaggcctcaagcagcagaaggccagcgccgagctgatcgaggaggaggtggcgaaactcctgaaactgaaggcacagctgggtcctgatgaaagctctgacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaatga(seqidno:378)
[0696]
hrs(1-55)-fc(c-末端fc融合)的dna序列:atggcagagcgtgcggcgctggaggagctggtgaaacttcagggagagcgcgtgcgaggcctcaagcagcagaaggccagcgccgagctgatcgaggaggaggtggcgaaactcctgaaactgaaggcacagctgggtcctgatgaaagcaaacagaaatttgtgtctgacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaatga(seqidno:379)
[0697]
hrs(1-66)-fc(c-末端fc融合)的dna序列:atggcagagcgtgcggcgctggaggagctggtgaaacttcagggagagcgcgtgcgaggcctcaagcagcagaaggccagcgccgagctgatcgaggaggaggtggcgaaactcctgaaactgaaggcacagctgggtcctgatgaaagcaaacagaaatttgtgctcaaaacccccaagggaacccgtgattatagttctgacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggac
tggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcacgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaatga(seqidno:380)
[0698]
fc-hrs(2-40)(n-末端fc融合)的蛋白质序列:msdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkaeraaleelvklqgervrglkqqkasaelieeevakllk(seqidno:381)
[0699]
fc-hrs(2-45)(n-末端fc融合)的蛋白质序列:msdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkaeraaleelvklqgervrglkqqkasaelieeevakllklkaql(seqidno:382)
[0700]
fc-hrs(2-50)(n-末端fc融合)的蛋白质序列:msdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkaeraaleelvklqgervrglkqqkasaelieeevakllklkaqlgpdes(seqidno:383)
[0701]
fc-hrs(2-55)(n-末端fc融合)的蛋白质序列:msdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkaeraaleelvklqgervrglkqqkasaelieeevakllklkaqlgpdeskqkfv(seqidno:384)
[0702]
fc-hrs(2-66)(n-末端fc融合)的蛋白质序列:msdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkaeraaleelvklqgervrglkqqkasaelieeevakllklkaqlgpdeskqkfvlktpkgtrdys(seqidno:385)
[0703]
hrs(1-40)-fc(c-末端fc融合)的蛋白质序列:maeraaleelvklqgervrglkqqkasaelieeevakllksdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seqidno:386)
[0704]
hrs(1-45)-fc(c-末端fc融合)的蛋白质序列:maeraaleelvklqgervrglkqqkasaelieeevakllklkaqlsdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytl
ppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seqidno:387)
[0705]
hrs(1-50)-fc(c-末端fc融合)的蛋白质序列:maeraaleelvklqgervrglkqqkasaelieeevakllklkaqlgpdessdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seqidno:388)
[0706]
hrs(1-55)-fc(c-末端fc融合)的蛋白质序列:maeraaleelvklqgervrglkqqkasaelieeevakllklkaqlgpdeskqkfvsdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seqidno:389)
[0707]
hrs(1-66)-fc(c-末端fc融合)的蛋白质序列:maeraaleelvklqgervrglkqqkasaelieeevakllklkaqlgpdeskqkfvlktpkgtrdyssdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seqidno:390)
[0708]
如下制备n-末端fc-组氨酰trna合成酶(hrs-fc)串联融合dna构建体。
[0709]
质粒构建。使用pet24b_tac_fc-hrs(2-60)构建体生成具有n-末端fc的hrs(2-60)_hrs(2-60)。将hrs(2-60)基因用以下列出的含有5’和3’xhoi位点的引物进行pcr扩增。使用推荐的热循环参数进行pcr反应。pet24b_tac_fc-hrs(2-60)构建体用xhoi消化,去磷酸化以及凝胶纯化。pcr生成的片段也用xhoi消化以及凝胶纯化。将凝胶纯化的hrs(2-60)亚克隆至pet24b_tac_fc-hrs(2-60)的xhoi位点。为生成最终构建体,使用以下列出的引物,quikchange诱变用于去除串联hrs(2-60)片段之间的终止密码子和xhoi位点。使用dnastarlasergeneseqmanpro通过与理论序列进行比对来确认序列。
[0710]
以下引物用于扩增fc-hrs(2-60)(表e15):
[0711]
iptg(fisher scientificbp1755)诱导该培养物。使培养物过夜生长(约17-小时诱导),且使最终 od
600
达到约120。以8,000g离心30min收获细胞。弃去上清液,并将该 细胞团保存于-20℃直至纯化。
[0718]
使用转化至ut5600感受态细胞的含有tac启动子而不是t7(“pet24b_tac”)的修饰的pet24b载体来制备另外的hrs-fc融合蛋 白。由获自coli遗传库存中心(coli genetic stock center(cgsc,yale))的 细菌储库制备ut5600感受态细胞。ut5600为大肠杆菌的k12衍生菌株 并被命名为以下基因型:f、arac14、leub6(am)、seca206(azir)、lacy1、 proc14、tsx-67、δ(ompt-fepc)266、enta403、glnx44(as)、λ-、trpe38、 rfbc1、rpsl109(strr)、xyla5、mtl-1、thie1。
[0719]
使用标准程序将包含这些构建体的表达载体转化至ut5600细胞,并 制备甘油储液。
[0720]
发酵培养基。对于分批培养基,通过将16克/l酵母提取物(difco212750)、8g/l甘油(sigma g2025)、11.28g/l m9盐(difco 248510)和 100μl/l消泡剂204(sigma ag6426)混合至去离子水并经由高压釜灭菌来 制备ut5600_m9_ye培养基。高压灭菌后添加物为0.64ml/l痕量金属 溶液、2.3ml/l 100x硫酸镁和45.83g/l l-亮氨酸。通过将250g/l酵母 提取物、225g/l甘油和100μl/l消泡剂204混合至去离子水并经由高压 釜灭菌来制备进料培养基。灭菌后添加物为10ml/l痕量金属溶液、2.3 ml/l 100x硫酸镁、45.83ml/l l-亮氨酸。
[0721]
补料分批发酵。使用配备mfcs/da软件的0.5l发酵罐(infors)进行 补料分批发酵。将搅拌速度设定为关联控制在500-1200rpm。通过加入 30%氢氧化铵(sigma 221228)和30%磷酸(sigma p5811)将ph值自动控制 在7.0
±
0.1。用无油隔膜式空气压缩机(cole-parmer)以0.5l/min的流速提 供空气。使空气通过0.2μm midisart 2000过滤器(sartorius 17805)。自动 化提供纯氧(west air)以将溶氧水平控制在30%。用neslab rte7循环仪 (thermo scientific)将温度控制在30℃。在需要时,通过加入消泡剂 204(sigma a8311)来控制泡沫。发酵罐中ut5600_m9_ye培养基的初始 体积为0.24l。用在37℃和250rpm下生长6小时的≈10od单位(在od5-10时约1-2ml的种子)的种子培养物接种发酵罐。当该容器中的分批甘 油被耗尽时(~4小时),通过指数补料程序中设置的蠕动泵将浓缩的进料 溶液引入至该容器中。当细胞在600nm处的光密度达到~150时,用0.5 mm iptg(fisher scientific bp1755)诱导培养物。在诱导后将培养物孵育4 小时并通过在10,000x g离心30分钟收获。最终细胞团产量近似为150-200克/升湿细胞重量(wcw)。将细胞团保存于-80℃直至纯化。经由 sds-page和山羊抗人igg,hrp缀合的抗体(thermo p/n 31413)的蛋白质 印迹来确认靶蛋白的表达。
[0722]
fc融合蛋白的纯化。将冷冻细胞团重新悬浮于4倍体积(即4ml/g 细胞团)的裂解缓冲液(50mm tris、500mm nacl、14mmβ-me,ph 7.5) 中。将完全的无edta的蛋白酶抑制剂片剂(roche)以1片/50ml的比率 加入至该悬浮液中。随着通过冰的冷却,使悬浮液以14,000psi两次通过 微流化器(microfluidics)。将裂解物以≥10,000x g于4℃离心45min。使 上清液通过0.45+0.22μm sartobran囊式过滤器(sartorius)过滤。
[0723]
将澄清的裂解物以1ml树脂/10g细胞团的比率结合至用结合缓冲液 (50mm tris,500mm nacl,ph 7.5)预平衡的mabselect树脂(gehealthcare)。用500倍柱体积的结合缓
冲液+0.1%triton x-114洗柱,随 后用100倍柱体积的结合缓冲液洗柱。用3.75倍柱体积的洗脱缓冲液(0.1 m甘氨酸、0.5m精氨酸,ph 3.0)洗脱结合蛋白、融合蛋白至含有1.25倍 柱体积的中和缓冲液(1m tris,ph 8.0)的收集管。
[0724]
任选地,为进一步去除高分子量种类,将物质在amicon 30kda超 离心浓缩装置(millipore)中浓缩并上样至hiload superdex 200pg 16/600 尺寸排阻色谱柱(ge healthcare)。将物质在1.1倍柱体积的1x pbs ph 7.4 (gibco#10010)中洗脱,并基于280nm处色谱吸光度过程合并对应于主 峰的级分。
[0725]
如果不进行尺寸排阻色谱,则将纯化的fc融合蛋白缓冲液交换至含 有pbs,ph 7.4的缓冲液。使透析的蛋白通过q膜过滤器(来自sartorius 的sartobind-q或来自pall的mustang-q)或q-琼脂糖柱(ge healthcare)以 进一步去除内毒素,并使其通过0.22μm无菌过滤器过滤。
[0726]
fc融合蛋白可调比例的纯化过程。使用最低纯化发展有效的稳健过 程,将使用mabselect随后通过尺寸排阻色谱法的纯化过程用于纯化多个 fc融合蛋白。然而,在蛋白a(mabselect)和尺寸排阻色谱步骤期间洗涤 剂清洗的使用限制了按比例放大纯化的能力。使用裂解物絮凝、蛋白a 色谱法、阳离子交换(cex)和陶瓷羟磷灰石(cht)色谱法也形成fc融合蛋 白的按比例放大的纯化过程。
[0727]
如上所述进行重新悬浮和裂解,其中省略蛋白酶抑制剂片剂和来自 裂解缓冲液的β-me。在裂解后,加入聚乙烯亚胺,mw 1300(sigma aldrich) 至0.04%(v/v)使裂解物絮凝并在4℃下孵育30min。如上所述进行离心 和澄清。使用mabselect树脂在以1ml树脂/4g细胞团的装填比率填充的 色谱柱中对澄清的裂解物进行蛋白a色谱法,其中在50mm tris,500mmnacl ph 7.5中进行5倍柱体积的洗涤步骤,随后在3倍柱体积的0.1m 甘氨酸,ph 3.0中洗脱并在0.3倍柱体积的1m tris ph 8.0中中和。在蛋 白a后,cex载荷通过将蛋白a后洗脱液在cex平衡缓冲液(20mm磷 酸钠,ph 6.0)中稀释5x来制备,上样至sp琼脂糖高效柱,用5倍柱体 积的平衡缓冲液洗涤并用0至300mm nacl的线性氯化钠梯度经10倍柱 体积洗脱。基于洗脱峰级分的sds-page分析合并cex级分。通过装填 至在cht平衡缓冲液(5mm磷酸钠,150mm氯化钠,1μm氯化钙,ph 6.5) 中平衡的cht i型40μm柱(bio-rad)来对cex混合物进行陶瓷羟磷灰 石色谱,用5倍柱的平衡缓冲液洗涤,用150mm至1.5m氯化钠的线性 氯化钠梯度经10倍柱体积洗脱,以及1.5m nacl保持高达20倍柱体积 以完成洗脱。在cht后,使用amicon 30kda离心浓缩装置(millipore) 将蛋白缓冲液交换至1x pbs ph 7.4。
[0728]
通过bradford蛋白测定(thermo scientific)或通过280nm处的uv吸 光度确定融合蛋白浓度。通过bradford蛋白测定(thermo scientific)确定 融合蛋白浓度。通过endosafe pts lal测定(charles river)测得的内毒素 水平低于4eu/mg。
[0729]
hrs-fc融合蛋白的分析。如图21中所显示的,通过sds-page分 析纯化的hrs-fc融合蛋白。将10μg蛋白上样量的样品在mops-sds 缓冲液中的nupage 4-12%bis-tris凝胶上于150v下运行60分钟并用 instant blue染色。还原的样品具有25mm dtt,在上样前将还原的样品 在95℃于1x lds缓冲液中加热10分钟。
[0730]
还通过尺寸排阻色谱法(sec)来分析纯化的hrs-fc融合蛋白。将样 品上样至agilent 1260hplc系统上的tsk-gel super sw3000柱(tosoh, 4.6mm id x 30cm,4μm)。用含有0.1m nacl,0.2m磷酸钠和5%2-丙醇 的流动相(ph7)以0.3ml/min进行30分钟等度
(isocratic)运行。在280nm 处进行uv检测。色谱图如图22所示。
[0731]
在蛋白a后且尺寸排阻色谱法纯化之前,大约83%的蛋白质呈期望 的二聚体形式,其中剩余量以高分子量种类存在。在尺寸排阻色谱法后, 二聚体的比例增至95至99%。使用蛋白a、阳离子交换和羟磷灰石色谱 法纯化过程,二聚体的比例超过99%。大多数二聚体蛋白含有位于fc铰 链区中的链内二硫键,但也存在一些非共价的二聚体。
[0732]
使用lc/esi-ms获得的完整质谱数据的分析表明在非还原条件下 fc融合蛋白的分子大小与大约64,520道尔顿的预期分子质量一致(数据 未示出)。在远和近uv区内fc融合蛋白的cd谱揭示,融合蛋白的结构 与预期结构域结构一致。另外,从hrs-fc融合蛋白获得的去卷积差示扫 描热量法(deconvoluted differential scanning calorimetry)数据表明fc融合 蛋白与fc组分的ch1和ch2结构域的两个主要热转化特性折叠(数据未 示出),这与预测结构一致。
[0733]
为评估与未修饰的hrs蛋白质相比hrs-fc融合蛋白构建体的药代 动力学特性,将蛋白质以8mg/kg的剂量经由单次静脉内或皮下大剂量施 用于正常的c57bl/6小鼠。用分布在九只动物/产物形式的取样时间连续 抽取血样。对于每个时间点,抽取来自三只独立小鼠的血清。通过elisa 测量测试物浓度,并使用phoenix软件的非隔室模型分析得到动力学参 数。
[0734]
在图23a、23b和23c中显示的结果表明fc融合蛋白的产生导致半 衰期、暴露和sc生物利用度显著增强。
[0735][0736][0737]
在表e16中显示的药代动力学分析表明,与未修饰的蛋白相比, hrs-fc融合构建体显示出显著改善的全身性暴露、清除率和半衰期。与 未修饰的蛋白相比,fc融合蛋白的产生还改善了蛋白的皮下生物利用度。 具体地说,与未修饰的蛋白相比,fc-hrs(1-60)将暴露增加200至300 倍,这取决于给药途径;另外,sc生物利用度和半衰期均显著增强。
[0738]
实施例9
[0739]
在tnbs诱导的结肠炎中fc融合蛋白的测试
[0740]
大肠由内陷至瓶状结构-隐窝的上皮粘膜作为内衬。不像小肠,在该 区域不存在小肠绒毛,其中隐窝上部开口在扁平的桌状区域。通过位于 隐窝基部的干细胞生成隐窝的细胞,其子细胞迅速分裂并分化成主要的 结肠细胞以及产生粘蛋白的杯状细胞(较小数目的内分泌细胞并且也产生 m细胞)。隐窝的大小以及每个隐窝中杯状细胞的数目沿盲肠至直肠的大 肠增加,当从粪便中吸收水时,这大概有助于粪便的传递并提供充分的 粘膜和干细胞保护。
[0741]
通常,肠隐窝中细胞产生的速率与细胞损失速率精确匹配-非常灵敏 的稳态机制操作。粘膜屏障的破坏使细菌进入身体,对将患疾病产生影 响。相反,增生可生成息肉,并最终生成肿瘤。肠屏障的破坏可由暴露 于非细胞类型特异性(经常为增生特异性)细胞毒性剂-通常由抗癌治疗引 起。然而,干扰上皮细胞更新也为炎性疾病的常见特征。
[0742]
目前的炎性肠病(ibd)啮齿动物模型包括例如通过操作t-细胞群体而 引发自身免疫疾病,通过在大肠中积聚特定物质而刺激肠的粘膜衬里(如 用dss、硫酸葡聚糖钠)或化学破坏上皮细胞(如用三硝基苯磺酸盐,tnbs) 而生成的模型。
[0743]
在任何这些模型中,疾病严重度可以通过观察到的病理分级的多种 主观评价以及损伤的更为客观和定量性测量来评估,从而为基础生物学 提供更多有意义的见解。通过使用计算机辅助的长度/区域测量方法来扩 展分析以对粘膜/粘膜下层中的变化作图并获得损伤的更多定量测量并且 因此获得治疗功效是可能的。虽然这些模型中的每一个存在不同的赞成 和反对,但tnbs结肠炎模型为人体中多种炎性肠病的确定模型,其已被 成功地用于验证和优化人类疗法的功效。
[0744]
tnbs小鼠模型。在该结肠炎模型中,通过在结肠内施用在乙醇中的 tnbs来诱导结肠刺激。这引发了具有th1-型细胞因子特性的急性结肠 炎,其特征为编码tnf-α、ifn-γ和il-12等的基因的表达(fichtner-feigl 等,j.clin.invest.2005.115:3057-3071)。结肠炎可能会很严重,且位于引入 tnbs的结肠区域。炎症反应导致局部肿胀、炎性细胞浸润和上皮细胞损 失。
[0745]
在该研究中,将未修饰的hrs多肽(hrs(1-60)的功效与fc融合蛋白 fc-hrs(2-60)和hrs(1-60)-fc进行比较以评估其在缓解小鼠中tnbs-诱 导的急性结肠炎的功效。评价了使用i.v.或s.c.施用测试物质的三种不同的 给药方案。布地奈德(p.o.)被用作研究中的参照物质。
[0746]
动物和笼具:在本研究中使用总计100只bdf-1(无幽门螺杆菌,无小 鼠诺瓦克病毒(murine norovirus-free))雄性小鼠(harlan laboratories,uk)。 供应时动物为8-10周龄并在10-12周龄时使用。将所有小鼠保持在spf(无 特定病原)屏障装置的独立通风笼(ivc)中。通过笼子编号和耳穿孔来识别 动物。
[0747]
饮食和动物福利:向动物饲喂来自b&k的大鼠和小鼠扩充饮食(ratand mouse expanded diet)。以hydropac
tm
水袋(过滤的ro水; hydropac/实验室产品,delaware,usa)供应水。自由进食和饮水。存在21
ꢀ±
2℃的恒定室温和55
±
10%的平均相对湿度。昼夜循环为恒定的,其中 光期和暗期各自为12小时(07:00hr/19:00hr转换)。每天监测动物健康并以 定期间隔清洁笼子。所有程序都是根据英国1986年动物(科学程序)法案被 核准的。
[0748]
分组、剂量、给药和制剂:将总计100只小鼠随机分成10个研究组(表 e17)。在任一笼子中的所有小鼠接受相同治疗并出于识别目的对所有小 鼠进行耳穿孔。将每日体重测量用于计算施用于可适用组的测试物或媒 介物的体积。
[0749][0750]
tnbs和测试物质的制备和施用。tnbs:在盐水/50%乙醇中以 15mg/ml溶液制备tnbs(sigma;批次#slbd6811v)。在研究第0天11:00hr 时,使用置于痔环近端4cm的塑料导管将单剂量的200μl(3mg tnbs)滴入 结肠。在将tnbs引入结肠后,将动物维持在倒垂位置1分钟以便使化合 物的渗漏最小化。
[0751]
hrs(1-60):测试物质以17.1mg/ml容纳在四小瓶冷冻储备液(每个为 0.033ml体积)中,将所述测试物质保存在-80℃直至使用。在每天测试物 质施用时,取出单个等分试样并在湿冰上解冻。在解冻后,将小瓶的内 容物通过上下吸打十次混合。随后,将测试物质用冷的媒介物(无菌,1xpbs,ph 7.4)稀释以得到0.2mg/ml的溶液;将溶液通过上下吸打十次混合。 通过静脉注射每天以5ml/kg施用该溶液(从研究第0天直至研究第3天)以 便得到1mg/kg的剂量。
[0752]
fc-hrs(2-60):测试物质以4.7mg/ml容纳在四小瓶冷冻储备液(一个 小瓶为2.51ml,其余三瓶为2.01ml)中,将所述测试物质保存在-80℃直至 使用。在每天测试物质施用时,取出单个等分试样并在湿冰上解冻。在 解冻后,将小瓶的内容物通过上下吸打十
次混合。随后,将测试物质用 冷的媒介物(无菌,1x pbs,ph 7.4)稀释以得到3mg/ml和1mg/ml的溶液; 将溶液通过上下吸打十次混合。根据3种不同的方案施用fc-hrs(2-60): i)通过静脉注射每天(从研究第0天直至研究第3天)以5ml/kg施用1mg/ml的 溶液以便得到5mg/kg的剂量;ii)通过静脉注射每天(仅在研究的第0天施用 一次)以5ml/kg施用1mg/ml的溶液以便得到mg/kg的剂量;iii)通过皮下注 射每天(从研究第0天直至研究第3天)以5ml/kg施用3mg/ml的溶液以便得 到15mg/kg的剂量。
[0753]
hrs(1-60)-fc:测试物质以4.99mg/ml容纳在四小瓶冷冻储备液(一 个小瓶为2.37ml,其余三瓶为1.89ml)中,将所述测试物质保存在-80℃ 直至使用。在每天测试物质施用时,取出单个等分试样并在湿冰上解冻。 在解冻后,将小瓶的内容物通过上下吸打十次混合。随后,将测试物质 用冷的媒介物(无菌,1x pbs,ph 7.4)稀释以得到3mg/ml和1mg/ml的溶 液;将溶液通过上下吸打十次混合。根据3种不同的方案施用 hrs(1-60)-fc:i)通过静脉注射每天(从研究第0天直至研究第3天)以 5ml/kg施用1mg/ml的溶液以便得到5mg/kg的剂量;ii)通过静脉注射每天 (仅在研究的第0天施用一次)以5ml/kg施用1mg/ml的溶液以便得到5mg/kg 的剂量;iii)通过皮下注射每天(从研究第0天直至研究第3天)以5ml/kg施用 3mg/ml的溶液以便得到15mg/kg的剂量。
[0754]
布地奈德:从tocris(tocris 1101,批次#1a/128902)获得布地奈德并 将其保存在环境温度的暗处直至使用。在每天施用时,将布地奈德配制 为于花生油中的1mg/ml溶液(sigma)。通过灌胃口服每天以5ml/kg施用布 地奈德(从研究第0天直至研究第3天)以便产生5mg/kg的剂量。
[0755]
临床检查和止痛。显示大于15%体重减轻的任何动物被认为是有病 的,并且治疗可能已经被抑制。如果体重减轻大于20%,则淘汰该动物。 每天监测动物健康。从研究的第1天直至研究结束,每日称重一次所有小 鼠,并根据表e18中的标准每日评估一次粪便硬度以及在粪便中和肛门周 围存在的明显血液。
[0756][0757]
止痛剂的使用:在赞助商的指导下,在本研究中未使用止痛剂,因 为它可能干扰测试物质的作用。
[0758]
收获并准备组织以用于组织学检测:在处死时,用4%异氟烷,2l/mino2和2l/min n2o使小鼠麻醉。当完全麻醉后,通过直接的心脏穿刺取血 并通过颈椎脱臼法确认死亡。
[0759]
全血和血浆样品的制备。通过心脏穿刺将来自所有小鼠的血液收集 至1.5ml微离心管中。将血液样品立即置于冰上并保持60分钟使其凝结成 块。然后,将样品在4℃下以3000g离心7分钟。在离心之后将血清通过无 菌移液管立即转移至预标记的小瓶中并立即在干冰上冷冻。
[0760]
肠样品的制备。将大肠取出,用pbs冲洗,并记录其长度和净重,然 后分切为近端、中端和远侧区,并固定于carnoy溶液中。另外,将结肠 的小样品速冻于液氮中。使用leica tp1020组织处理器和eg1140h工作 站,将固定的组织通过系列的酒精和二甲苯进行脱水,并包埋于石蜡中。 使用leica rm2125rtf切片机切割切片(5μm厚),并在37℃下于显微镜载 玻片中风干过夜。随后,将载玻片在二甲苯中脱蜡并通过梯度酒精至pbs 进行复水。然后将所有切片用苏木精和伊红(h&e)染色,并封片。
[0761]
组织学分析:以盲方式评估组织学切片。用显微镜观察切片,并根 据表e19中所概述的标准,将所述切片指定为范围为0至5的主观严重性评 分。评估了从中端至远侧大肠的高达十二个横截面。
[0762][0763]
统计分析:在提及的情况下,使用graph pad prism利用anova与事 后检验组合进行分组数据的统计比较。
[0764]
qpcr分析:将小鼠结肠从动物中切除并保存在-80℃直至分析。使 用qiagen’s rneasy小试剂盒(目录#74106)由结肠制备rna。一旦rna从 qiagen柱中洗脱,将其在agilent生物分析仪2100上运行以检测rna完整 性并用nanodrop测定rna浓度和纯度。然后,将rna保存在-80℃。
[0765]
rna至cdna的逆转录(rt)在eppendorf的mastercycler pcr机器 中于96孔pcr板规格中进行,程序如下:37℃保持60分钟,95℃保 持5分钟。未使用96孔板的边缘孔,并用50mcl水填充边缘孔以防止内 部孔的蒸发。每个样品rt使用在25mcl逆转录预混合物(reversetranscription master mix,life technologies#4387406)中的100ng的rna。 一旦完成rt,下一步为预扩增样品cdna中的目标基因。将目标基因的 引物(fluidigm设计的deltagene引物)组合至200nm的终浓度。使用这 些引物,在每个样品中预扩增目标基因。使用applied biosystems viia7pcr机器在384孔规格中于10mcl反应物(2.5mcl cdna,7.5mclpre-amp预混合物)中进行预扩增,程序如下:95℃保持10分钟;14个 循环(95℃保持15秒,60℃保持4分钟)。在预扩增步骤后,加入核酸 外切酶(new england biolabs目录#
m0293l)以从每个样品去除未掺入 的引物。在viia7 pcr机器中也完成该核酸外切酶反应,程序如下:37℃ 保持30分钟,80℃保持15分钟。在核酸外切酶后,将rt样品以1:5(7mcl 核酸外切酶样品+18mcl低的edta缓冲液)进一步稀释。
[0766]
在fluidigm的biomark系统上用于运行qpcr的芯片为用于基因表 达的96.96动态阵列ifc。在装载样品和测定前根据制造商的推荐首先用 ifc控制器hx准备芯片。为准备待装填于芯片的测定,在96孔板中制 备每个目标基因的3.6mcl 20mcm正向和反向引物的4.4mcl测定预混合 物(fluidigm的2x测定上样试剂,目录#8500736和低的edta te)。为准 备样品,将4.5mcl样品预混合物(ambion的2x taqman基因表达预混合 物,fluidigm的20x dna结合染料样品上样试剂目录号100-0388和 biotium的20x evagreen目录#31000)加入至96孔板中的3mcl稀释的 预扩增的/核酸外切酶样品。一旦已经准备好芯片,将以上准备的5mcl 样品或测定加载至芯片。将芯片返至ifc控制器,用于将样品加载入芯 片。。在芯片已完成加载后,然后可在biomark上使用带有熔点曲线的 用于基因表达的96.96动态阵列的预设程序运行qpcr以测定引物特异 性。使用多个管家基因通过δδct方法测定相对基因表达。
[0767]
结果:
[0768]
生存期参数-所有接受tnbs的组显示在施用结肠炎试剂后的前24 个小时内平均体重急速下降起始体重的8-10%;随后,平均体重存在较 缓的减少,其中到研究结束时所有组显示平均体重显著下降至起始体重 的80-90%(p≤0.0158)。仅用媒介物处理的小鼠的体重在研究期间显示出最 小的变化,其中到研究的第4天时,最终平均体重为起始体重的99.6
±ꢀ
1.7%(平均值
±
标准差)。tnbs/媒介物组具有最低的平均终体重79.8
±ꢀ
1.8%。一些组(即tnbs/fc-hrs(2-60)-s.c.组和tnbs/布地奈德组)的最终 平均体重则人为地高,由于在这些组中早期发病率的较高发生率。在显 示最少早期发病率的组中,tnbs/fc-hrs(2-60)-qd-i.v.组具有最高的 85.6
±
7.1%的平均终体重,虽然这并未显著不同于tnbs/媒介物组(p》0.05)(数据未示出)。
[0769]
虽然粘膜出血的观察结果不太常见,但大多数接受tnbs-的小鼠在 研究期间某阶段显示出腹泻。响应于某些测试物质治疗,腹泻的发生率 降低。在第4天研究结束时,tnbs/媒介物组具有累积的(标准化的)腹泻 分数31;其中tnbs/fc-hrs(2-60)-qd-i.v.和tnbs/hrs(1-60)-fc-qd-i.v. 组具有最低分数26(数据未示出)。
[0770]
小鼠的临床状况可最好通过将出血和腹泻相关信息连同体重减轻的 分数组合来获得,以便产生疾病活动指数(dai)分数。这可在使小鼠安乐 死当天最精确地测定,因为缺失的粪便硬度观察数据可由直肠中粪便的 观察结果来补充。对于在第4天存活的小鼠,与未治疗的对照组相比, 所有接受tnbs的组的平均dai分数存在显著增加(p≤0.0062),除了 tnbs/fc-hrs(2-60)-s.c.组,虽然在研究中,该组在预定终点时仅剩下三 只小鼠。在第4天时tnbs/媒介物组中存活小鼠的平均dai为7.13
±ꢀ
0.64;相比之下,tnbs/布地奈德和tnbs/hrs(1-60)-fc-一次-i.v.组具有 显著较低的平均dai,分别为4.33
±
1.97和4.20
±
3.03(p≤0.0304)。将在 第1天存活至至少07:00hr的所有小鼠包括在dai的计算中产生了类似 结果(参见图24a),虽然在tnbs/布地奈德和tnbs/hrs(1-60)-fc-一次
ꢀ‑
i.v.组中观察到的效果不再显著(p》0.05)。
[0771]
死后观察结果-对于仅媒介物处理的小鼠,平均大肠重量和长度分别 为200.4
±
21.7mg和108.3
±
7.8mm;平均大肠重量:长度比率为1.85
±
0.12 (mg/mm)。相对于未处理的对照小鼠,所有tnbs-处理组显示大肠重量显 著增加(p≤0.0215),其中tnbs/媒介物组的平均大肠重量为368.4
±ꢀ
70.1mg。tnbs/布地奈德组在所有接受tnbs的组中具有最低的平均大肠 重量298.0
±
62.0mg。tnbs施用也与所有接受tnbs的组中大肠长度的显 著减少相关(p≤0.0285),其中tnbs/媒介物组的平均大肠长度为75.6
±ꢀ
9.3mm;相比之下,tnbs/hrs(1-60)-fc-qd-i.v.组显示出显著减轻的大 肠缩短,其中平均大肠长度为94.9
±
11.8mm(p=0.0019)。大肠重量和长度 的变化导致所有接受tnbs的组中大肠重量:长度比率的显著增加 (p≤0.0116)。tnbs/媒介物组在所有组中具有最高的平均大肠重量:长度比 率4.92
±
0.99(mg/mm)。相对于tnbs/媒介物对照组,tnbs/布地奈德组、tnbs/fc-hrs(2-60)-s.c.组、tnbs/hrs(1-60)-fc-qd-i.v.组和tnbs/ hrs(1-60)-fc-一次-i.v.组均显示显著降低的大肠重量:长度比率,虽然 tnbs/hrs(1-60)-fc-qd-i.v.组的平均比率受研究早期安乐死的小鼠的数 目的影响。tnbs/布地奈德和tnbs/hrs(1-60)-fc-qd-i.v.组的平均大肠重 量:长度比率分别为3.57
±
1.01和3.56
±
0.80(p=0.0143和p=0.0456)(参见 图24b)。
[0772]
组织病理学
–
根据epistem的标准组织学评分程序评估与tnbs-诱导 的结肠炎相关的组织病理学变化。所有接受tnbs的组显示组织病理学分 数的显著增加(p≤0.0036)。t细胞/媒介物组的平均组织病理学分数为2.32
ꢀ±
0.65,其中tnbs/hrs(1-60)-fc-s.c.组具有最高的平均组织病理学分数 2.41
±
0.68。其他处理组具有比tnbs/媒介物组低的平均组织病理学分 数,其中tnbs/布地奈德和tnbs/fc-hrs(2-60)-qd-i.v.组分别具有最低的 分数1.66
±
1.08和1.68
±
1.03,虽然这些降低并非统计上显著的。基于部 位基础,这些处理的效应在大肠的远端三分之一更明显,虽然仍并不是 统计学显著的。
[0773]
发病率-仅一组,即tnbs/hrs(1-60)-fc-qd-i.v.组显示所有(合格的) 小鼠存活(由于tnbs施用期间大肠穿孔排除小鼠75;由于缺乏疾病诱导 排除小鼠78)。在其他组中存活率范围为80%(tnbs/fc-hrs(2-60)-qd-i.v. 组)至33.3%(tnbs/fc-hrs(2-60)-s.c.组);tnbs/布地奈德组中的存活率 为60%。当小鼠呈现不良状况(孤僻的/不能显示正常行为)时,使小鼠安乐 死;虽然每六小时检查一次,但发现两只小鼠(40和50)在研究第3天 19:00hr时死亡(数据未示出)。
[0774]
qpcr结果。为进一步研究hrs(1-60)和fc-hrs(2-60)对tnbs诱导 的结肠炎的影响的机理基础,在完成研究后检测动物结肠中基因表达的 变化。如上所述对当天分离自小鼠的结肠进行rna分析。来自这些研究 的结果显示,响应于tnbs处理,七种基因升高超过10倍,并通过用 fc-hrs(2-60)治疗显著降低,(参见表e20;和图25)。
[0775][0776]
[0777]
tnbs处理的小鼠结肠的转录分析揭示:许多基因,包括几个管家基 因(数据未示出)未受到fc-hrs(2-60)治疗的显著影响。相比之下,tnbs 处理的小鼠结肠的转录分析揭示tnbs调节的免疫和炎症相关基因通过 fc-hrs(2-60)显著降低。该结果通过以下发现被强化:hrs(1-60)也显著 降低tnbs诱导的mcp1、mmp3、cd11b和il10水平(参见图26a-26f 和26h)。
[0778]
结论:将tnbs施用至bdf-1小鼠的结肠内导致形成结肠炎,特征 为急剧的体重减轻,中等增加的腹泻和粘膜出血的发生率。死后检测显 示大肠重量:长度比率的显著变化以及大肠的溃疡性病损,同时肠内狭 窄和随附的粪便积聚。用布地奈德治疗也与生存期和死后疾病参数的改 善相关,虽然在所有接受tnbs的组中具有最低的平均组织病理学分数, 但该疾病中参数的减少未实现显著性。用fc-hrs(2-60)-qd-i.v.治疗在降 低组织病理学分数中具有与布地奈德类似的效果并与更优的存活率相 关。tnbs/hrs(1-60)-fc-qd-i.v.组显示最高水平的存活率以及在大肠重 量:长度比率中显示显著改善,虽然其在降低组织病理学分数中不如布 地奈德或fc-hrs(2-60)有效。关于组织病理学分数,所有这三种测试物 质似乎对大肠远侧三分之一具有最大的效果。观察到tnbs/ fc-hrs(2-60)-s.c.组和tnbs/hrs(1-60)-fc-一次-i.v.组的疾病参数的改善 (例如体重和大肠重量:长度比率)。另外,tnbs处理的小鼠结肠的转录 分析揭示tnbs调节的免疫和炎症相关基因通过fc-hrs(2-60)显著降低。 该结果通过以下发现强化:hrs(1-60)也显著降低tnbs诱导的mcp1、 mmp3、cd11b和il10水平,这表明hrs-fc融合蛋白在免疫调节该系 统的基因表达中是有效的。
[0779]
总体上,数据表明fc-hrs(2-60)和hrs(1-60)-fc在治疗肠内炎症以 及其他炎性病况中具有显著潜能。
[0780]
实施例10
[0781]
hrs-fc融合蛋白对t细胞群体的影响
[0782]
为体内评价hrs-fc缀合物对t细胞群体的潜在影响,在tnbs诱 导的结肠炎模型中测试fc-hrs(2-60),类似于上文所述。在雄性bdf-1 小鼠中进行研究。简而言之,在实验前,使雄性bdf-1小鼠(jacksonlaboratories)适应最少1周,在tnbs施用前16小时和在给药前13小时 开始禁食。以单剂量0.5mg/kg,iv施用fc-hrs(2-60),同时开始tnbs 处理。分析来自每组三只动物的脾细胞的免疫群体。为选择用于分析的 动物,排除具有最严重和最少严重疾病分数的小鼠(基于临床观察结果、 粪便硬度和体重)。从剩余动物中,基于代表其各个组的平均值挑选来自 每个治疗组的三只动物。
[0783]
程序。从bdf-1小鼠收获脾脏并直接置于在冰上的10ml冷的细胞染 色缓冲液(biolegend,目录#420201,批次#b166478)中。在组织培养皿 中两个磨砂高压灭菌的载玻片之间使脾脏机械地分离。使细胞悬浮液通 过70μm过滤器过滤,并通过在4℃下于300g离心5分钟使细胞沉淀。 将细胞在10ml细胞染色缓冲液中洗涤一次并使用nexcelom cellometerauto 2000细胞生存计数器计数。将脾细胞以5x 105个细胞/ml复溶于细 胞染色缓冲液中并用抗体立即染色用于流式细胞术。
[0784]
根据制造商的说明书使用one step staining mouse treg flow试剂盒 (biolegend目录#13680,批号#b177852、b177853、b174309、b176365) 对总计1x 106个细胞进行t调节标志物(cd4、cd25和foxp3)染色。
[0785]
对于免疫细胞的表型,用针对cd3(目录#100334,批次#162956)、 cd4(目录#100529,批次#b152907)和cd8(目录#100714,批次#b165226) 的荧光-标记的抗体对总计1x 106个细胞进行染色(抗体购自biolegend)。 将细胞用在制造商推荐的浓度下于细胞染色缓冲液中稀释的抗体染色并 在4℃孵育30分钟。将细胞用细胞染色缓冲液充分洗涤并使用稳定固定 缓冲液(bd biosciences目录#338036,批次#2291614)固定。
[0786]
在va流式细胞术研究核心设施(va san diego,la jolla,ca)进行流 式细胞术。在3激光bd canto仪器(488氩,633hene,405violet)上分析 样品。使用flowjo软件分析原始facs文件(treestar)。
[0787]
结果。将细胞外染色的脾细胞以活的淋巴细胞群体和cd3
+
细胞设门 以测定总的t细胞百分比。为生成cd4
+
和cd8
+
的群体百分比,将细胞 从活的淋巴细胞门中设门分为cd3
+
cd4
+
t细胞和cd3
+
cd8
+
t双-阳性 细胞。t调节细胞(treg)设门于活的淋巴细胞门,然后设门于cd4
+
细胞。 基于cd25和foxp3的表达测定treg细胞。在这些数据中(参见图 27a-27d),每个点代表一只动物,线代表平均值。
[0788]
与未处理动物相比,在tnbs-处理的动物中,cd3
+
t细胞存在增加 (图27a)。相比之下,三只fc-hrs(2-60)治疗的小鼠中有两只显示出与 tnbs处理的动物相比降低的cd3
+
t细胞。为测定哪个cd3
+
群体负责 该变化,进一步研究cd8
+
、cd4
+
和treg细胞群体。图27b和图27c显 示cd8
+
t和cd4
+
细胞在tnbs-处理的动物中升高,而用fc-hrs(2-60) 治疗降低了cd8
+
t和cd4
+
细胞的水平。而且,与未处理的动物相比, treg细胞在tnbs-处理的动物中被耗尽,但相比于tnbs处理的动物, treg细胞在fc-hrs(2-60)治疗组中增多(图27d)。此外,用fc-hrs(2-60) 治疗的一只小鼠显示与未治疗动物类似的treg水平。总之,这些结果表 明,tnbs通过增加cd8
+
t细胞和降低treg细胞而将脾脏中的t细胞群 体改变为更多炎性表型,以及用fc-hrs(2-60)治疗将这些群体恢复为体 内平衡水平。
[0789]
基于上述详细描述,可对实施方案做出这些和其他改变。通常,在 所附的权利要求书中,所用术语不应解释为将权利要求书限制于本说明 书和权利要求书公开的具体实施方案,而应解释为包括所有可能的实施 方案以及该权利要求书所享有的等同物的全部范围。因此,权利要求书 并不受限于本公开。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1