一种含CCL1的融合蛋白、制备方法及应用与流程
一种含ccl1的融合蛋白、制备方法及应用
技术领域
1.本发明涉及生物医药技术领域,具体来说,涉及一种含ccl1的融合蛋白、制备方法及应用。
背景技术:
2.树突状细胞(dendritic cells,dc)是机体功能最强的专职抗原递呈细胞(antigen presenting cells,apc),它能高效地摄取、加工处理和递呈抗原,未成熟dc具有较强的迁移能力,成熟的dc细胞可以以多种细胞表面蛋白与t细胞结合,并使之激活,将dc细胞本身捕获到的抗原蛋白表位肽最终交叉呈递给t细胞并促使其分化为抗原特异性细胞毒性t淋巴细胞。最终发挥细胞免疫过程对抗原物质进行识别和降解。
3.肿瘤疫苗通过免疫增强已有的抗肿瘤反应或启动初始t细胞来诱导患者的效应t细胞功能,抗原特异性cd8+细胞毒性t淋巴细胞(ctl)在抗肿瘤过程中发挥重要作用。dc细胞是唯一能激活初始cd8+t细胞的专职抗原呈递细胞,对细胞外肿瘤抗原通过mhc-i进行摄取、加工和交叉提呈,对产生有效的ctl至关重要。因此,通过偶联dc细胞表面分子将肿瘤抗原递送至dc细胞是有效诱导cd8+t细胞免疫应答的肿瘤治疗策略。
4.目前,已经探明的能够对dc细胞的递呈起到曾强作用的分子包括xcl-1,但仍亟待探明更多的能够起到促进递呈作用的dc细胞表面分子。
技术实现要素:
5.针对相关技术中的上述技术问题,本发明提出一种含ccl1的融合蛋白、制备方法及应用,能够克服现有技术的上述不足。
6.为实现上述技术目的,本发明的技术方案是这样实现的:一种融合蛋白,自n端至c端依次包括:ige信号肽、ccl1、linker和抗原。
7.本发明还提供了另外一种融合蛋白,自n端至c端依次包括:ige信号肽、ccl1、linker、抗原和t2片段,所述t2片段的氨基酸序列如seq id no:4所示。
8.优选地,所述抗原来自病毒、病原菌和/或肿瘤;所述病毒包括hpv、ebv、hcv、hiv、hbv、vzv或冠状病毒中的至少一种;所述肿瘤包括肝癌、宫颈癌、卵巢癌、肺癌、头颈癌、前列腺癌、乳腺癌、血癌、卵巢癌、结直肠癌中的至少一种。
9.优选地,所述ige信号肽的氨基酸序列如seq id no:5所示,所述ccl1的氨基酸序列如seq id no:3所示,所述linker为(g5s)n,其中n为1~10;所述抗原为hpv16的e6蛋白和/或hpv16的e7蛋白,所述hpv16的e6蛋白的氨基酸序列如seq id no:1所示,所述hpv16的e7蛋白的氨基酸序列如seq id no:2所示。
10.本发明还提供了编码所述融合蛋白的核酸。
11.所述核酸的核苷酸序列如seq id no:9所示。
12.本发明还提供了含有所述核酸的表达载体,其包括骨架载体和编码所述融合蛋白的核酸。
13.本发明还提供了转化或转染所述载体的宿主。
14.本发明还提供了一种所述融合蛋白的制备方法,包括:培养含有编码所述融合蛋白的基因表达载体的宿主,获得含有所述融合蛋白的培养物。
15.本发明还提供了所述的融合蛋白、所述的基因、所述的表达载体或所述的宿主在制备防治疾病的产品中的应用,所述防治包括预防和/或治疗,具体包括提高血清中抗体水平、预防肿瘤的形成、抑制肿瘤生长,提高机体对肿瘤的免疫反应能力。所述疾病包括由病毒和/或病原菌引起的疾病。或者所述疾病为肿瘤。所述防治疾病的产品包括药物和/或疫苗,给予的方式包括口服、注射和/或电转。
16.本发明的有益效果:本发明利用ccl1与dc细胞等免疫细胞表面受体的趋化结合能力将不同的抗原蛋白转运交叉呈递到dc细胞表面,提高了各种抗原蛋白被dc细胞吞噬、加工、呈递的效率,改善了其防治相关疾病的效果。本发明中的t2序列经实验测定其具有非常强的免疫增强效果,可以在促进抗原呈递的过程中进一步激发体液和细胞免疫反应,最终达到抑制相关肿瘤生长的效果。
附图说明
17.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
18.图1为ccl1趋化各类专职抗原提呈细胞能力分析图;图2a为pvr-ccl1-e6e7-t2的质粒图谱;图2b为pvr-ccl1-e6e7的质粒图谱;图2c为pvr-e6e7的质粒图谱;图3为检测pvr-ccl1-e6e7-t2、pvr-ccl1-e6e7和pvr-e6e7的三种质粒目的基因的表达情况,利用蛋白免疫印迹技术(westernblot)检测c端带有flag标签的融合蛋白编码核苷酸的表达情况;图4为不同融合基因对小鼠进行预防型免疫用于后期测试特异性t细胞反应的时间轴;图5为不同融合基因对小鼠进行免疫后特异性t细胞反应的流式检测结果;图6为不同融合基因、mrna和蛋白疫苗分别对小鼠进行预防型免疫和接瘤时间轴;图7为上述预防型免疫的量瘤检测结果图;图8为不同融合基因、mrna和蛋白疫苗分别对小鼠进行治疗型免疫和接瘤时间轴;图9为上述治疗型免疫的量瘤检测结果图。
具体实施方式
19.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员所获得的所有其他实施例,都属于本发明保护的范围。
20.除非另有定义,本文使用的所有科技术语具有本领域普通技术人员所理解的相同含义。关于本领域的定义及术语,专业人员具体可参考current protocols in molecular biology(ausubel)。氨基酸残基的缩写是本领域中所用的指代20个常用l-氨基酸之一的标准3字母和/或1字母代码。
21.本发明所述ccl1是一种人体内重要的趋化因子,它属于cc趋化因子家族(cc chemokines)中的一员,其可以特异性的在人体t细胞中高水平表达,ccr8为其唯一受体。ccl1
→
ccr8 信号对于免疫细胞的迁移和活化有重要作用。本发明研究表明ccl1能够用于递送物质到专职抗原提呈细胞,特别是dc细胞,从而增强dc细胞的递呈效果。
22.本发明中,所述ccl1可为人源片段,也可为其他动物来源的片段,例如鼠源、兔源、猴源、猪源等,其可为完整的ccl1,也可为其中具有ccl1活性的片段或突变体,本发明对此不做限定。本发明实施例中,以人源ccl1为实验对象,验证ccl1对抗原的递呈效果的提高。所述人源ccl1的氨基酸序列为:ksmqvpfsrccfsfaeqeiplrailcyrntssicsneglifklkrgkeacaldtvgwvqrhrkmlrhcpskrk(如seq id no:3所示)。
23.本发明所述融合蛋白中,所述t2序列是由t4噬菌体纤维蛋白c末端的一段短肽(t4 phageheadfibritin)改造而来,种属来源属于外源序列,该序列在人体内完全没有,不会出现增强免疫后对人体其他蛋白造成杀伤的问题。有报道认为该序列可以在某些情况下促进某些蛋白的三聚体化。本发明中发现t2这段作为经过人工改造后的多肽序列具有人体内的免疫增强效果。本发明中,t2片段由31个氨基酸组成,其序列为pgsgyipeaprdgqayvrk dgewvllstflg(如seq id no:4所示)。
24.本发明所述融合蛋白中的抗原的个数至少为1个。例如,可为1个、2个、3个、4个、5个、6个、7个、8个、9个或10个及以上。在本发明的研究中,对1个或2个抗原的融合效果进行实验,都表现出良好的效果。
25.本发明所述抗原来自病毒、病原菌和/或肿瘤。在本发明中,所述抗原可为来自病毒、病原菌和/或肿瘤的蛋白。一些实施例中,所述抗原来自病毒的衣壳蛋白或非结构蛋白、病原菌的膜蛋白、鞭毛蛋白或肿瘤的表面抗原。其可为的完整片段,也可为其抗原决定簇。其可仅含有一个抗原决定簇,也可以由多个抗原决定簇串联而成,也可以为一个抗原决定簇重复串联两次或以上。
26.本发明中,所述病毒包括但不限于hpv、ebv、hcv、hiv、hbv、vzv或冠状病毒中至少一种;本发明中,所述肿瘤包括但不限于肝癌、宫颈癌、卵巢癌、肺癌、头颈癌、前列腺癌、乳腺癌、血液肿瘤、卵巢癌、结直肠癌中至少一种。
27.一些实施例中,所述抗原为hpv病毒的e2、e5、e6和/或e7蛋白或其突变表位。所述hpv病毒包括各种亚型的hpv病毒,例如, hpv6、hpv11、hpv16、hpv18、hpv31、hpv33、hpv35、hpv39、hpv45、hpv51、hpv52、hpv56和/或hpv58型。
28.一些实施例中,所述抗原为eb病毒的lmp1、lmp2、ebna1、或其突变表位。
29.一些实施例中,所述抗原为冠状病毒的s蛋白、n蛋白、e蛋白、m蛋白或其表位。所述冠状病毒为sars病毒、mers病毒和/或covid_19。
30.一些实施例中,所述抗原为肝癌的gpc3蛋白和/或afp蛋白。
31.一些实施例中,所述抗原为前列腺癌的psa,psma,psca,pap和/或steap1。
32.一些实施例中,所述抗原为乳腺癌的her2/neu和/或bcar3的优势表位。
33.一些实施例中,所述抗原为黑色素瘤的mage-a3,isr2,ny-eso-1,melan a,gp100,tyrosinase,trp1和/或trp2。
34.一些实施例中,所述抗原为血癌的immunoglobulin idiotype,immunoglobulinκ-chain和/或immunoglobulin λ-chain。
35.一些实施例中,所述抗原为结直肠癌的aim2,ht001,taf1b,micoryx和/或tgfβrii。
36.一些实施例中,所述抗原为卵巢癌的folate receptor-α。
37.一些实施例中,所述抗原为多种原癌基因、抑癌基因和/或肿瘤特异性抗原的p53,idh1/ idh2, bage,gage1,gage2,cag3,rage,cea,cdk4,casp-8,ras,bcr/abl和/或muc-1。
38.本发明利用ccl1与dc细胞等免疫细胞表面受体的趋化结合能力将上述的抗原蛋白转运交叉呈递到dc细胞表面,从而提高了各种抗原蛋白被dc细胞吞噬、加工、呈递的效率,改善了其防治相关疾病的效果。在此前的预实验中,上述蛋白中包括hpv16的e6或e7的蛋白在内的多个抗原的递呈效率已经被验证能够被ccl1提高。本发明实施例中,以hpv16的e6和e7蛋白为案例,证明ccl1对抗原蛋白递呈效率的提高效果,其他蛋白与ccl1融合后也会起到良好的效果。
39.本发明中为了保证融合蛋白中各功能片段不受空间位阻影响而顺利地折叠,在片段间添加linker,其中,ccl1与hpv病毒抗原蛋白之间的linker为gggggsggggg。不同抗原之间可以通过(g5s)n和/或aga相连。
40.在本发明中,为了提高融合蛋白的表达效果,在ccl1的n端添加促使融合蛋白分泌到胞外的信号肽。一些实施例中,所述信号肽为ige信号肽。具体的,其氨基酸序列为mdwtwilflvaaatrvhs(如seq id no:5所示)在本发明中,为了方便融合蛋白的纯化,在融合蛋白的c端添加标签。所述标签选自本领域熟知的重组蛋白纯化标签。一些实施例中,所述标签的氨基酸序列为dykddddk,但该序列只为鉴定蛋白表达的标签不影响序列的免疫效果。
41.一些具体实施例中,所述融合蛋白的结构为自n端
→
c端依次包括:ige信号肽、人源ccl1蛋白序列、linker序列(gggggsggggg)、e6e7蛋白序列、t2蛋白序列、flag标签序列。具体的,其氨基酸序列如seq id no:15所示。
42.本发明所述的编码蛋白的核酸可以是dna、rna、cdna或pna。在本发明实施例中,所述核酸为dna或rna形式。所述dna形式包括cdna、基因组dna或人工合成的dna。所述dna可以是单链的或是双链的。核酸可以包括具有不同功能的核苷酸序列,如编码区和非编码区如调控序列(例如启动子或转录终止子)。核酸在拓扑学上可以是线性或环状的。核酸可以是例如载体(如表达或克隆载体)的一部分,或一个片段。所述核酸可直接从天然来源获得,或者可由重组、酶法或化学技术辅助制备。所述rna形式为由基因转录获得的mrna等。
43.在本发明中,对表达融合蛋白的dna序列进行了优化,这些优化包括但不限于:密码子使用偏好性,消除不利于表达的二级结构(如发夹结构),改变gc含量,cpg二核苷酸含量,mrna的二级结构,隐蔽剪接位点,早期多聚腺苷化位点,内部核糖体进入位点和结合位点,负cpg岛,rna不稳定区,重复序列(直接重复、反向重复等)和可能影响克隆的限制性位点。
44.本发明所述的预防是指在肿瘤发生前给予本发明所述的药物能够起到降低肿瘤发生风险的作用。本发明所述的治疗是指在肿瘤发生之后给予本发明所述的药物,能够抑制肿瘤生长,降低肿瘤体积或延缓肿瘤的生长速度。本发明实施例中,以小鼠移植瘤细胞tc-1为实验对象,验证融合蛋白疫苗的效果。
45.本发明中还提供了融合蛋白的转录单元,所述转录单元是指启动子开始至终止子结束的 dna序列。启动子和终止子两侧或之间还可包括调控片段,所述调控片段可以包括与核酸序列可操作地连接的启动子、增强子、转录终止信号、多腺苷酸化序列、复制起点、核酸限制性位点、和同源重组位点,例如启动子的增强子,poly(a)信号等。本发明提供的转录单元中,包括cmv或cmv/r启动子、cmv增强子和编码融合蛋白的核酸片段。
46.本发明所述重组载体,是指重组的核酸载体,是一种重组dna分子,其包含期望的编码序列和对可操作连接的编码基因在具体宿主生物内的表达所必不可少的合适的核酸序列。对原核细胞中的表达必需的核酸序列包括启动子,任选包括操纵基因序列,核糖体结合位点及可能的其它序列。已知原核细胞利用启动子,增强子以及终止和多腺苷酸化信号。一经转化进入合适的宿主,载体可以独立于宿主基因组进行复制和发挥作用,或者,在一些情况下,自己整合进入基因组。在本说明书中,“质粒”和“载体”有时可以交换通用,因为质粒是当前最普遍使用的载体形式。然而,本发明意图包括表达载体的这样的其它形式,其发挥等价作用,其在本领域是已知的或将变为已知的,包括但不限于:质粒,噬菌体颗粒,病毒载体和/或仅为潜在的基因组插入物。具体实施例中,编码本发明提供的融合蛋白的核酸可构建于各种真核表达载体中。例如,其骨架载体可以是pvax1系列载体、或pvr系列载体。
47.本发明所述的宿主细胞,为含有核酸载体和/或目标基因的原核或真核宿主。用使用重组dna技术构建的载体转化或转染宿主细胞。这样的转化宿主细胞有能力复制编码蛋白质的载体或表达期望蛋白质。
48.本发明实施例中,所述融合蛋白的制备方法采用诱导重组宿主表达的方式,所述培养物可以为培养获得的菌体、细胞体、培养液、或者有上述培养物中经提取和/或纯化获得的物质。
49.本发明提供的防治疾病的产品包括:所述的融合蛋白、核酸、表达载体、宿主、所述制备方法制得的融合蛋白,和/或所述制备方法制得的含有所述融合蛋白的培养物。本发明中,所述防治疾病的产品包括药物和/或疫苗。所述疫苗中还包括药学上可接受的运载体、赋形剂和/或佐剂。所述药物中还包括药学上可接受的辅料。
50.本发明所述的预防是指在疾病发生前给予本发明所述的防治疾病的产品,从而能够起到降低疾病发生风险的作用。本发明所述的治疗是指在疾病发生之后给予本发明所述的防治疾病的产品,能够改善病症,抑制疾病发展,使患者恢复健康。例如,将本发明所述的产品用于防治肿瘤,能够提高血清中抗体水平、抑制肿瘤生长,降低肿瘤体积或延缓肿瘤的生长速度。本发明实施例中,以小鼠移植瘤细胞tc-1为实验对象,验证融合蛋白疫苗的效果并获得良好的效果。
51.本发明实施例中,涉及的片段的氨基酸序列和编码的核酸片段如表1所示:表1 片段的氨基酸序列和编码的核酸片段seqidno:1hpv16的e6蛋白的氨基酸序列seqidno:2hpv16的e7蛋白的氨基酸序列
seqidno:3ccl1的氨基酸序列seqidno:4t2多肽氨基酸序列seqidno:5ige信号肽seqidno:6质粒pvr-ccl1-e6e7-t2的核苷酸序列seqidno:7质粒pvr-ccl1-e6e7的核苷酸序列seqidno:8质粒pvr-e6e7的核苷酸序列seqidno:9质粒pvr-ccl1-e6e7-t2中编码融合蛋白的dna序列seqidno:10质粒pvr-ccl1-e6e7中编码融合蛋白的dna序列seqidno:11质粒pvr-e6e7中编码融合蛋白的dna序列seqidno:12质粒pvr-ccl1-e6e7-t2中编码融合蛋白的mrna序列seqidno:13质粒pvr-ccl1-e6e7中编码融合蛋白的mrna序列seqidno:14质粒pvr-e6e7中编码融合蛋白的mrna序列seqidno:15质粒pvr-ccl1-e6e7-t2中融合蛋白的氨基酸序列seqidno:16质粒pvr-ccl1-e6e7中融合蛋白的氨基酸序列seqidno:17质粒pvr-e6e7中融合蛋白的氨基酸序列本发明采用的试剂耗材皆为普通市售品,皆可于市场购得。下面结合实施例,进一步阐述本发明。
52.实施例1从小鼠骨髓以及外周血分别分离单核和单核细胞、t 细胞亚群、嗜酸性粒细胞、嗜碱性粒细胞。其中骨髓单核细胞分别加入m-csf和gm-csf、il4诱导分化为巨噬细胞和dc细胞后进行趋化实验。趋化小室(碳酸脂膜transwell小室:5μm;costar,cat:3422)的上室中放入上述分离或这诱导分化的细胞,根据实验室前期工作基础加入细胞数量为1
×ꢀ
106/100μl/孔。同时设置自发迁移对照组以及ccl1细胞因子组,所加入的细胞数目相同。ccl1因子采用e.coli纯化重组鼠ccl1蛋白,根据实验室前期已有的工作基础,100ng/ml为最佳趋化效率剂量。4小时后收集趋化下室中的细胞,并进行流式分析ccl1对各类免疫细胞的趋化能力。如图1所示,结果显示ccl1能有效的从上室中募集各类免疫细胞细胞到下室中(p<0 .001)。
53.实施例2融合基因或蛋白疫苗的抗原设计方案及哺乳动物表达质粒的构建与制备构建pvr-ccl1-e6e7-t2质粒:根据人乳头瘤病毒亚型hpv16的e6和e7蛋白,人源ccl1蛋白及t2多肽序列构建融合蛋白ccl1-e6e7-t2。在融合蛋白ccl1-e6e7-t2的n末端连接一个氨基酸序列为mdwtwilflvaaatrvhs的ige信号肽;在融合蛋白ccl1-e6e7-t2的c末端连接一个dykddddk的8个氨基酸组成的flag标签。
54.最终得到的融合蛋白,自n端
→
c端依次包括:ige信号肽、人源ccl1蛋白序列、linker序列(gggggsggggg)、e6蛋白序列、e7蛋白序列、t2蛋白序列、flag标签序列。
55.将融合蛋白的氨基酸序列进行哺乳动物细胞表达偏好的密码子优化,确定其融合基因序列为seq id no:8将该融合基因序列进行基因合成,之后将其整体构建到pvr质粒载体的对应多克隆位点区域,使其能够以正确的密码子翻译顺序表达融合蛋白。最终构建形成的质粒命名为pvr-ccl1-e6e7-t2质粒,如图2 a所示。
56.构建pvr-e6e7质粒:在人乳头瘤病毒亚型hpv16的e6和e7蛋白序列之前在连接一个氨基酸序列为mdwtwilflvaaatrvhs的ige信号肽,之后连接dykddddk的8个氨基酸组成的flag标签。
57.使得最终得到的融合蛋白自n端
→
c端依次包括:ige信号肽、e6e7蛋白序列、flag标签序列,如图2 c所示。
58.将融合蛋白的氨基酸序列进行哺乳动物细胞表达偏好的密码子优化,确定其融合基因序列为seq id no:11该融合基因序列进行基因合成,之后将其整体构建到pvr质粒载体的对应多克隆位点区域,使其能够以正确的密码子翻译顺序表达融合蛋白。最终构建形成的质粒命名为pvr-e6e7质粒。
59.构建质粒pvr-ccl1-e6e7:同样的令最终构建的融合基因自n端
→
c端依次包括:ige信号肽、人源ccl1蛋白序列、linker序列(gggggsggggg)、e6e7蛋白序列、flag标签序列。
60.将融合蛋白的氨基酸序列进行哺乳动物细胞表达偏好的密码子优化,确定其融合基因序列为seq id no:10将该融合基因序列进行基因合成,之后将其整体构建到pvr质粒载体的对应多克隆位点区域,使其能够以正确的密码子翻译顺序表达融合蛋白。最终构建形成的质粒命名为pvr-ccl1-e6e7质粒。如图2 b所示。
61.具体的,在本实施例所阐述的实验中构建的质粒模式实际上为:pvr-ccl1-抗原-t2、pvr-ccl1-抗原及其对照质粒pvr-抗原。在本实施例的实验中抗原使用的是hpv16亚型的e6e7融合蛋白。
62.实施例3构建质粒的体外细胞转染实验(以实施例2构建的antigenm为hpv16 e6和e7蛋白的载体为例,对含有其他抗原的载体转染的方式与此相同):转染前24小时,在6孔细胞培养板内接种2.5
×
105个hek293t细胞,待细胞密度长到60%-70%时开始转染试验。转染时提前在37℃水浴锅中预热细胞培养基、无血清的opti-mem 培养基。转染时将 5 微克空载体(vector),pvr-ccl1-e6e7-t2表达载体,pvr-ccl1-e6e7表达载体,pvr-e6e7表达载体和20μl pei 转染试剂先后加入到 200 μl无血清的opti-mem 中,混合均匀后,室温下静置20分钟。将需要转染的细胞更换新鲜培养基,轻柔加入上述转染体系,轻轻摇匀。将细胞放回细胞培养箱中培养 6 小时后换液。转 48小时后收取细胞用western blot检测e6e7融合基因质粒hek293t细胞中的表达效果。
63.将收集细胞,加入60μl的含有 pmsf 或 cocktail 蛋白酶抑制剂的 0.5% np40 裂解缓冲液。充分重悬细胞, 4℃旋转裂解细胞 30 分钟。12000 rpm, 4℃离心裂解液 10 分钟,收集上清至新的 1.5 ml ep 管中,弃掉沉淀。根据样品实际体积加入 5
×
sds-page 蛋白上样缓冲液,混合均匀后将样品放在 100℃空气浴中加热 10分钟,立即进行 western blot,利用flag标签抗体(sigma, f3165)进行检测,结果如图3显示空载体(vector)无蛋白表达,pvr-ccl1-e6e7-t2和pvr-ccl1-e6e7表达蛋白大小位置明显高于pvr-e6e7,说明实验组质粒pvr-ccl1-e6e7-t2、 pvr-ccl1-e6e7和对照组质粒pvr-e6e7都能够顺利正常在哺乳动物细胞中表达。
64.实施例4探索ccl1趋化因子和t2多肽分别对于融合基因疫苗诱导细胞特异性t细胞反应的影响(以抗原为hpv16 e6和e7蛋白的疫苗为例,对含有其他抗原的疫苗诱导t细胞反应的步
骤与此相同):鉴于融合基因在哺乳动物细胞可以正常表达。我们提取单独pvr-ccl1-e6e7-t2、pvr-ccl1-e6e7、pvr-e6e7质粒,利用teresa活体基因导入仪对小鼠进行免疫质粒电转,质粒剂量25ug,加上阴性对照pbs组共4组,每组5只。按照图4的时间轴标注的免疫策略对小鼠进行免疫,之后在d14对各组小鼠进行采血并加入加了肝素的pbs溶液中。将样品整体进行3000rpm离心5min。弃上清,剩余沉淀采用震荡法打散后加入1ml裂红液于室温裂解1min。后将全部样品进行1200rpm离心6min。弃去上清,使用700μl的pbs溶液洗涤一次。第二次1200rpm离心6min。弃去上清后加入300μl灭活过的10%fbs的1640培养基,重悬沉淀后,加入5μl e7蛋白tetramer(e7-tetramer)染色1h。流式染色:cd8-pe;e7-tetramer-fitc。流式结果如图5所示。结果显示,在相同剂量组别的比较中所有ccl1-e6e7-t2组的e7特异性t细胞数量都远远多于e6e7组。在相同剂量组别的比较中所有ccl1-e6e7-t2组的e7特异性t细胞数量都多于ccl1-e6e7组。在相同剂量组别的比较中所有ccl1-e6e7组的e7特异性t细胞数量都多于e6e7组。这说明,ccl1趋化因子在抗原蛋白的n端可以有效诱导抗原分子与特异性免疫细胞的结合,从而大大加强了抗原分子交叉呈递的效果,使得ccl1最终能够诱导出抗原分子更强的特异性免疫反应。另外,t2多肽在抗原蛋白c端可以有效加强抗原分子在细胞免疫过程中的免疫强度,大大增加了特异性t细胞产生的数量,起到了免疫增强因子的决定性作用。
65.实施例5融合基因dna和mrna以及蛋白形式疫苗对小鼠移植瘤细胞tc-1同种移植瘤发生的干预效果(以抗原为hpv16 e6和e7蛋白的蛋白形式疫苗为例,对含有其他抗原的疫苗对肿瘤干预效果的验证步骤与此相同):鉴于融合基因在哺乳动物细胞可以正常表达。我们提取单独pvr-ccl1-e6e7-t2和pvr-e6e7质粒,利用teresa活体基因导入仪对小鼠进行免疫质粒电转,并体外转录制备表达pvr-ccl1-e6e7-t2的mrna疫苗与体内转染试剂in vivo-jetpei包裹成脂质纳米颗粒作为mrna形式疫苗(记做ccl1-e6e7-t2-mrna)。
66.另纯化融合蛋白作为蛋白疫苗,其中pvr-ccl1-e6e7-t2质粒对应的融合蛋白记做ccl1-e6e7-t2。
67.同种移植tc-1细胞后观察融合基因免疫对tc-1移植瘤细胞生长的抑制情况。
68.确定tc-1细胞成瘤后,我们按照图6时间轴标注的免疫策略对小鼠进行质粒电转和mrna肌肉注射以及蛋白皮下注射。将c57b6(购自为通利华)周龄雌性小鼠和雄性小鼠分为a、b两组,每组分别注射pbs、pvr-e6e7质粒、pvr-ccl1-e6e7-t2质粒、ccl1-e6e7-t2-mrna以及ccl1-e6e7-t2蛋白的五小组,每小组五只,利用脱毛膏进行小鼠右侧靠近腹股沟淋巴结处脱毛处理。之后直接注射mrna,蛋白或利用电转仪在脱毛处注射质粒,每只25μg,每两周一次,共注射两次,在最后一次注射后一周接种之前摸索好成瘤条件的tc-1瘤细胞,观察肿瘤形成时间并每两天测量肿瘤的长径a和短径b,按照a
×b×
b/2进行肿瘤体积计算,绘制肿瘤生长曲线。结果如图7所示,免疫pvr-ccl1-e6e7-t2质粒、pvr-e6e7质粒、ccl1-e6e7-t2-mrna以及ccl1-e6e7-t2蛋白的组别均能使得小鼠体内移植瘤无法成瘤,疫苗效果显著。而且在d30天对所有小鼠进行二次接瘤挑战,结果显示移植瘤仍然无法成瘤。这说明四组疫苗均有非常明显的预防肿瘤的效果。
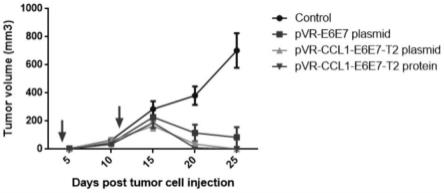
69.实施例6融合基因疫苗对小鼠移植瘤细胞tc-1同种移植瘤的治疗效果(以抗原为hpv16 e6和e7蛋白的融合基因疫苗为例,对含有其他抗原的疫苗对肿瘤干预效果的验证步骤与此相同):鉴于在预防免疫实验中ccl1-e6e7-t2等疫苗的效果优良。我们又对融合基因免疫的tc-1同种移植瘤的治疗效果进行实验探索。采用如图8中的时间轴对小鼠进行接瘤和质粒治疗性免疫。每次免疫接种量为25μg。在接瘤后开始对小鼠进行免疫两次分别为d4和d11。之后按照相同方法进行量瘤,统计肿瘤体积。绘制肿瘤生长曲线如图9所示。结果显示,pvr-ccl1-e6e7-t2质粒、ccl1-e6e7-t2-mrna以及ccl1-e6e7-t2蛋白的三组相较pvr-e6e7质粒组更早发生肿瘤生长抑制,且pvr-ccl1-e6e7-t2质粒、ccl1-e6e7-t2-mrna以及ccl1-e6e7-t2蛋白的三组在接瘤第17天前后移植瘤完全消失,达到了完全的肿瘤治疗效果。
70.综上所述,借助于本发明的上述技术方案,本发明利用ccl1与dc细胞等免疫细胞表面受体的趋化结合能力将不同的抗原蛋白转运交叉呈递到dc细胞表面,提高了各种抗原蛋白被dc细胞吞噬、加工、呈递的效率,改善了其防治相关疾病的效果。本发明中的t2序列经实验测定其具有非常强的免疫增强效果,可以在促进抗原呈递的过程中进一步激发体液和细胞免疫反应,最终达到抑制相关肿瘤生长的效果。
71.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1