磷酸吡哆醇合酶PdxJ突变体及其在制备维生素B6中的应用
磷酸吡哆醇合酶pdxj突变体及其在制备维生素b6中的应用
技术领域
1.本发明属于生物技术领域,具体涉及磷酸吡哆醇合酶pdxj突变体及其在制备维生素b6中的应用。
背景技术:
2.维生素 b6在药物、食品和饲料工业中具有广泛的应用,是人类或其他动物不可缺少的维生素,其包括三种天然形式:吡哆醇、吡哆醛和吡哆胺,在体内以磷酸酯衍生物存在。维生素b6主要以活性形式磷酸吡哆醛参与近百种酶反应,其中多数与氨基酸代谢有关,例如转氨基、脱羧、脱水及转硫化反应等。
3.目前维生素b6的产品形式是吡哆醇盐酸盐,主要采用4-甲基-5-乙氧基噁唑路线以化学法人工合成,中间体噁唑合成过程中用到强腐蚀性的三氯氧磷和有毒溶剂苯,反应控制难,潜在安全隐患大;制备工艺繁琐,能耗高,废水量大,废盐含量高,不利于环境保护,原子经济性差,产品成本高;另外,所得产品着色较重,精制工艺较为复杂等。生物制造过程具有原料无毒、反应过程温和、安全隐患小和环境友好等优点,因此维生素 b6的生物合成研究具有重大的科学意义和应用需求,是维生素 b6绿色工业化生产的一个必然趋势,经济效益和社会效益显著。
4.维生素b6的生物合成最初是tazoe等人筛选了1590株菌株后发现,根瘤菌具有天然高产吡哆醇的能力,但产量较低(tazoe m et al., production of vitamin b
6 in rhizobium. biosci biotechnol and biochem, 1999; 63(8):1378-1382.)。根瘤菌生长慢,生长周期较长,自身的遗传操作复杂,难以进行大规模的遗传研究,严重制约了根瘤菌作为底盘细胞进行维生素b6生产的研究。大肠杆菌,其遗传背景清晰,分子手段多样,是一种被广泛用作表达重要化学品的生产宿主。
5.本发明人前期对野生型大肠杆菌菌株mg1655进行了途径改造(zl202110059483.2),以此为底盘细胞进一步探究其发酵生产维生素b6的能力。在大肠杆菌中,磷酸吡哆醇合酶(pyridoxine 5-phosphate synthase =pdxj)催化3-磷酸羟基-1-氨基丙酮(pha)和5-磷酸脱氧核糖(dxp)生成5-磷酸吡哆醇(pnp),其kcat为= 0.07 s-1
,km=26.9 μm,kcat/km=0.002s-1
μm-1
,其催化常数远低于合成途径中的其它酶,因此磷酸吡哆醇合酶pdxj的活性严重限制了维生素b6生物合成途径的催化效率,是维生素b6合成途径的限速酶,这大大限制了维生素b6发酵产量的提高。因此,急需提供一种具有较高活性的磷酸吡哆醇合酶用于提高维生素b6的生产。
技术实现要素:
6.针对现有技术的需求,本发明提供一种能够显著提高维生素b6的发酵产量的磷酸吡哆醇合酶pdxj突变体。
7.本发明提供一种磷酸吡哆醇合酶pdxj突变体,其氨基酸序列是以seqidno:1所示的氨基酸序列为参考序列,在对应于seq id no:1的g7,i10,d11,i13,a19,g21,t22,a23,
v44,e100,v101,t103,e104,g194,t196,l212,n213,a217v,i218,i219位中的至少一个位置的氨基酸残基发生突变;或者所述磷酸吡哆醇合酶突变体的氨基酸序列具有所述发生突变的氨基酸序列中的所述突变位点,且与所述发生突变的氨基酸序列具有80%以上同源性、具有磷酸吡哆醇合酶活性的功能性片段,优选具有90%以上、95%以上或98%以上的同源性。
8.在本发明公开的一个实施方案中,所述磷酸吡哆醇合酶pdxj突变体包括对应于seqidno:1,发生如下位点的取代:g7l,i10l,d11n,i13v,a19q,g21d,t22v,a23t,v44i,e100i,v101l,t103l,e104t,g194c,g194q,t196c,t196v,t196m,a217v,l212i,n213i,i218l,i219g中的任一种或二种或三种或四种以上的组合:(1)所述的酶突变体是将seqidno.1中的第11位的d置换为n,得到的蛋白质。
9.(2)所述的酶突变体是将seqidno.1中的第13位的i置换为v,得到的蛋白质。
10.(3)所述的酶突变体是将seqidno.1中的第103位的t置换为l,得到的蛋白质。
11.(4)所述的酶突变体是将seqidno.1中的第196位的t置换为c,得到的蛋白质。
12.(5)所述的酶突变体是将seqidno.1中的第212位的l置换为i,得到的蛋白质。
13.(6)所述的酶突变体是将seqidno.1中的第217位的a置换为v,得到的蛋白质。
14.(7)所述的酶突变体是将seqidno.1中的第103位的t置换为l,且第212位的l置换为i,得到的蛋白质。
15.(8)所述的酶突变体是将seqidno.1中的第13位的i置换为v,且第196位的t置换为c,得到的蛋白质。
16.(9)所述的酶突变体是将seqidno.1中的第104位的e置换为t,且第219位的i置换为g,得到的蛋白质。
17.(10)所述的酶突变体是将seqidno.1中的第10位的i置换为l,且第212位的l置换为i,得到的蛋白质。
18.(11)所述的酶突变体是将seqidno.1中的第10位的i置换为l,且第22位的t置换为v,得到的蛋白质。
19.(12)所述的酶突变体是将seqidno.1中的第23位的a置换为t,第104位的e置换为t,且第212位的l置换为i,得到的蛋白质。
20.(13)所述的酶突变体是将seqidno.1中的第13位的i置换为v,第104位的e置换为t,且第212位的l置换为i,得到的蛋白质。
21.(14)所述的酶突变体是将seqidno.1中的第10位的i置换为l,第22位的t置换为v,且第23位的a置换为t,得到的蛋白质。
22.(15)所述的酶突变体是将seqidno.1中的第104位的e置换为t,第196位的t置换为v,且第218位的i置换为l,得到的蛋白质。
23.(16)所述的酶突变体是将seqidno.1中的第10位的i置换为l,第13位的i置换为v,且第212位的l置换为i,得到的蛋白质。
24.(17)所述的酶突变体是将seqidno.1中的第13位的i置换为v,第100位的e置换为i,且第212位的l置换为i,得到的蛋白质。
25.(18)所述的酶突变体是将seqidno.1中的第23位的a置换为t,第194位的g置换为c,且第219位的i置换为g,得到的蛋白质。
26.(19)所述的酶突变体是将seqidno .1中的第104位的e置换为t,第194位的g置换为c,且第218位的i置换为l,得到的蛋白质。
27.(20)所述的酶突变体是将seqidno .1中的第7位的g置换为l,第196位的t置换为c,且第217位的a置换为v,得到的蛋白质。
28.(21)所述的酶突变体是将seqidno .1中的第23位的a置换为t,第44位的v置换为l,且第212位的l置换为i,得到的蛋白质。
29.(22)所述的酶突变体是将seqidno .1中的第10位的i置换为l,第23位的a置换为t,且第104位的e置换为t,得到的蛋白质。
30.(23)所述的酶突变体是将seqidno .1中的第10位的i置换为l,第101位的v置换为l,且第104位的e置换为t,得到的蛋白质。
31.(24)所述的酶突变体是将seqidno .1中的第13位的i置换为v,第104位的e置换为t,且第196位的t置换为c,得到的蛋白质。
32.(25)所述的酶突变体是将seqidno .1中的第23位的a置换为t,第218位的i置换为l,且第219位的i置换为g,得到的蛋白质。
33.(26)所述的酶突变体是将seqidno .1中的第194位的g置换为c,第213位的n置换为i,且第218位的i置换为l,得到的蛋白质。
34.(27)所述的酶突变体是将seqidno .1中的第23位的a置换为t,第100位的e置换为i,且第219位的i置换为g,得到的蛋白质。
35.(28)所述的酶突变体是将seqidno .1中的第104位的e置换为t,第194位的g置换为c,第196位的t置换为v,且第218位的i置换为l,得到的蛋白质。
36.(29)所述的酶突变体是将seqidno .1中的第10位的i置换为l,第44位的v置换为i,第101位的v置换为l,且第104位的e置换为t,得到的蛋白质。
37.(30)所述的酶突变体是将seqidno .1中的第23位的a置换为t,第44位的v置换为i,第104位的e置换为t,且第194位的g置换为q,得到的蛋白质。
38.(31)所述的酶突变体是将seqidno .1中的第10位的i置换为l,第101位的v置换为l,第104位的e置换为t,且第196位的t置换为v,得到的蛋白质。
39.(32)所述的酶突变体是将seqidno .1中的第10位的i置换为l,第21位的g置换为d,第22位的t置换为v,且第104位的e置换为t,得到的蛋白质。
40.(33)所述的酶突变体是将seqidno .1中的第10位的i置换为l,第101位的v置换为l,第104位的e置换为t,且第194位的g置换为q,得到的蛋白质。
41.(34)所述的酶突变体是将seqidno .1中的第194位的g置换为c,第196位的t置换为m,第23位的a置换为t,且第219位的i置换为g,得到的蛋白质。
42.本发明还涉及含所述重组磷酸吡哆醇合酶pdxj突变体编码基因的重组载体。所述重组载体包含与适合指导在宿主细胞中表达的控制序列可操作地连接的多核苷酸。优选该表达载体为prsfduet-1。
43.本发明在一个具体实施方式中:将重组磷酸吡哆醇合酶pdxj突变体编码基因同表达载体prsfduet-1连接,构建了含有磷酸吡哆醇合酶pdxj突变体编码基因的表达重组质粒。将表达重组质粒转化至宿主菌中,获得含有重组质粒的重组微生物(基因工程菌)。
44.本发明尤其提供重组磷酸吡哆醇合酶pdxj突变体、重组载体、重组微生物在制备
维生素b6中的应用。
45.具体地,包括培养所述重组微生物后,收集所产生的维生素b6。优选地,采用分泌型重组表达载体转化的重组微生物,在培养后的发酵液中收集维生素b6。
46.本发明通过研究同源性比对、晶体结构分析以及催化机理的理解,模拟底物与酶的对接方式,筛选可设计的残基,再通过酶设计突变体的氨基酸序列,最终实验验证获得了一系列的磷酸吡哆醇合酶pdxj突变体。经对比研究证实,本发明重组磷酸吡哆醇合酶pdxj基因和突变基因的工程菌生物安全,对发酵培养的生物量几乎没有任何影响,尤其可以有效的提高大肠杆菌生产维生素b6的能力。实验数据表明其中对于野生型基因在大肠杆菌中过表达,维生素b6的能力并没有明显提高,而磷酸吡哆醇合酶pdxj突变体在大肠杆菌中过表达能显著提高产维生素b6的能力。
附图说明
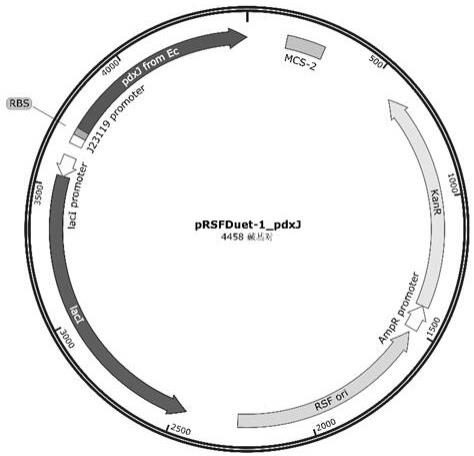
47.图1为载体prsfduet-1_pdxj的图谱。
48.图2为维生素b6的标准曲线图。
49.图3为不同pdxj突变的工程菌株发酵70h后的生物量。
具体实施方式
50.本发明的以下实施例和附图仅说明实现本发明的具体实施方案,这些方案和附图不可以理解为对本发明的限制,任何在不脱离本发明的原理和实质的情况下所做的任何改变,均落在本发明的保护范围之内。
51.本实施例中所用到的实验技术与实验方法,如无特殊说明均为常规技术方法。本实施例中所使用的材料、试剂等,如无特殊说明,均可通过正规商业渠道获得。
52.实施例1:磷酸吡哆醇合酶pdxj原始基因的构建1、从野生型mg1655基因组为模板扩增得到编码氨基酸序列如seqidno:1所示的磷酸吡哆醇合酶pdxj原始基因,其核苷酸序列如seq id no: 2所示,所用引物为liulx-1/liulx-2,以野生型prsfduet-1质粒为模板扩增骨架(引物liulx-3/liulx-4),通过gibson组装将pdxj基因与质粒骨架连接,转化dh5α大肠杆菌,涂布于lb平板(含50 μg/ml卡那霉素),筛选阳性克隆并验证(引物duetup1/duetdown1)条带正确后测序确认,得到验证正确的重组质粒prsfduet-1_pdxj原始基因载体(图谱见图1),提质粒备用。
53.表1 pdxj原始基因载体构建的引物实施例2:磷酸吡哆醇合酶pdxj突变位点的设计首先,将大肠杆菌来源的磷酸吡哆醇合酶pdxj与genbank数据库中已报道的磷酸
吡哆醇合酶氨基酸序列进行同源性比对分析,通过对大肠杆菌来源的pdxj的晶体结构(pdb: 1m5w)分析以及催化机理的理解,模拟底物与酶的对接方式,根据对接的结果,选取和催化结合机理类似的结合模式,6埃范围内的残基去掉部分保守残基,被定为可设计的残基,利用rosetta进行酶设计,设计突变体的氨基酸序列。
54.实施例3:磷酸吡哆醇合酶pdxj突变体的构建1、通过一步pcr法引入定点突变位点,以实施例1获得的重组质粒prsfduet-1_pdxj原始为模板进行单定点突变,在进行2或3或4组合突变时则以相应获得的单或双或三位点突变体为质粒模板。基本流程为首先设计突变引物(引物见表2),在引物上引入突变位点,进行overlap pcr,然后用dpnl酶识别甲基化位点并将其酶切消化模板,dpnl酶处理过的pcr产物转化,最后进行挑菌测序验证,验证正确者提质粒备用。
55.表2实施例3中用到的引物
2、共获得34个pdxj突变体,分别命名为pdxj1-pdxj34。与prsfduet-1_pdxj原始基因相比,pdxj1-pdxj34的氨基酸差异见表3中第2列。
56.表3 突变体及其相对于原始基因的氨基酸差异
实施例4:含突变载体的大肠杆菌工程菌株的构建将上述方法所获得的prsf-duet1系列质粒载体,通过电穿孔法按照图下步骤转化至大肠杆菌工程菌ll05(该菌株来自于本发明人此前授权专利:zl202110059483.2)中,在lb平板(含50 μg/ml卡那霉素)上分别筛选得到重组大肠杆菌菌株。
57.1.感受态细胞的制备(1)从-80度冰箱活化大肠杆菌 mg1655衍生菌株ll05,37℃,200rpm/min的恒温培养箱中振荡培养12小时左右,次日无菌条件下,按照初始od为0.1的接种量接入50mllb液体培养基中,培养od约至0.6,即可制备感受态细胞。
58.(2)在超净工作台的无菌条件下将50ml的 ll05菌液转移至50ml无菌离心管中,冰浴30min后4000rpm/min、4℃ 离心10min。
59.(3)弃上清,加入30 ml预冷的去离子水,吹吸悬浮菌体,4000 rpm/min,4℃离心10 min。
60.(4)重复步骤(3)。
a,每一样品总时长30 min。荧光检测器设置激发波长293nm,发射波长395 nm,柱温为35℃,流速0.8 ml/min,进样体积20
ꢀµ
l。
74.(4)维生素b6标准曲线的绘制将不同浓度的标准品按上述条件进行hplc检测,绘制峰面积a-vb6浓度标准曲线。以测得的峰面积a为纵坐标,维生素b6质量浓度c(mg/l)记为横坐标,绘制维生素b6标准曲线。见图2,得回归方程y = 132317x + 6899.2,r2=1,吸收度与质量浓度呈良好的线性关系。液相结束后根据维生素b6标准曲线计算样品产量。
75.发酵产量及产量增长结果如表3第4列,第5列,生物量如图3所示。
76.由图3和表3的数据可以看出,磷酸吡哆醇合酶pdxj经过理性改在后,生物量几乎维持不变,但显著提高了维生素b6的发酵产量,具有较大的应用推广价值。
77.以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1