一株高产麦角甾醇的酿酒酵母工程菌株、构建方法及应用
1.本发明属于生物技术领域,尤其是一株高产麦角甾醇的酿酒酵母工程菌株、构建方法及应用。
背景技术:
2.麦角甾醇,又称麦角固醇,是一种28碳甾族化合物,广泛存在于酵母中,是真菌细胞膜的重要组成成分,对确保细胞活力、膜的流动性、膜结合酶的活性、膜的完整性以及细胞物质运输等起着重要作用。麦角甾醇是一种重要的医药化工原料,用于生产“可的松”、“激素黄体酮”等甾醇类药物。麦角甾醇也是维生素d2的前体,经紫外线照射后可得到维生素d2。在医药工业上,维生素d2是预防和治疗佝偻病、龋齿及老年骨质疏松症的重要药品。维生素d2还可以作为饲料添加剂添加在饲料中,增加畜禽的产蛋率和孵化率。
3.目前,国内外用于生产麦角甾醇的酵母菌种主要采用以下四种选育方法获得:自然选育、常规选育、杂交法、原生质体融合法。上述四种技术均存在明显的不足之处。自然选育是从不同酵母菌种进行筛选。研究发现,对不同种、属的酵母菌的麦角甾醇的含量进行分析,不同种、属间差异很多,该方法工作量大且耗时长。常规选育是用诱变剂对菌株进行处理。这种方法可以直接获得高产麦角甾醇的菌株,但诱变选育的随机性大,结果具有不确定性。采用杂交法和原生质体融合法可以将不同菌株的优良性状结合起来,能获得生物量和麦角甾醇含量都较高的菌株。但研究发现,在这些酵母细胞中还含有2wt%左右的麦角甾醇前体物24(28)-脱氢麦角甾醇存在。若24(28)-脱氢麦角甾醇不能进一步转化为麦角甾醇,则酵母细胞内的麦角甾醇含量将不能被有效提升。
4.我国麦角甾醇年产量不能满足消费者的需求,需要从国外进口,但从总体来看,我国对麦角甾醇的需求量呈逐年上升的趋势。因此,本领域迫切需要开发一种有效提升细胞内麦角甾醇含量的菌株。
5.通过检索,发现如下两篇与本发明专利申请相关的专利公开文献:
6.1、一种可动态调控7-脱氧胆固醇及维生素d3的酿酒酵母菌的构建方法及应用(cn113025512a),所述构建方法包括以下步骤:s1、使用启动子gal7控制酿酒酵母工程菌种mot3基因的表达,转化入原始酵母菌中构建第一酿酒酵母菌;s2、构建麦角甾醇动态调控的dcas9系统并提取构建的质粒;s3、人工合成融合基因片段gal80f-loxt-ptef1-dhcr24-tcyc1-pgap-dic-tadh1-gal80r,将其转化进入第一酿酒酵母菌,pcr验证后获得第二酿酒酵母菌;s4、将步骤s3中构建的质粒转化进入第二酿酒酵母菌中,经筛选后获得可动态调控生产7-dhc的酿酒酵母菌。本发明所提供的构建方法构建的酿酒酵母菌,通过在不影响菌株生长状态的同时,利用酿酒酵母内源的甾醇调控系统,结合dcas9系统实现副产物的减少,7-dhc的产量提升。
7.2、一种产生菜籽甾醇的酿酒酵母工程菌及其构建方法和应用(cn110903993a),所述酿酒酵母工程菌含有甾醇δ7-还原酶基因和葡萄糖脱氢酶基因。本发明提供的酿酒酵母工程菌能够将麦角甾醇还原成菜籽甾醇。在本发明中,所述酿酒酵母工程菌中共表达甾醇
δ7-还原酶和葡萄糖脱氢酶,就可以葡萄糖脱氢酶形成的nadph作为辅因子,利用甾醇δ7-还原酶将酿酒酵母固有的麦角甾醇还原成菜籽甾醇,从而达到生物制备菜籽甾醇的目的。
8.通过对比,本发明专利申请与上述专利公开文献存在本质的不同。
技术实现要素:
9.本发明目的在于克服现有技术中的不足之处,提供一株高产麦角甾醇的酿酒酵母工程菌株、构建方法及应用。
10.本发明解决其技术问题所采用的技术方案是:
11.一株高效产麦角甾醇的酿酒酵母工程菌株,所述酿酒酵母工程菌株是在酿酒酵母宿主中过表达seq id no.1所示的脂质转运蛋白基因sec14基因构建得到的,脂质转运蛋白基因sec14的核苷酸序列为seq id no.1,其所编码的的氨基酸序列为seq id no.2。
12.进一步地,所述工程菌株在构建时所采用的表达载体为prs426,所采用的宿主菌为酿酒酵母菌株(saccharomyces cerevisiae)by4741。
13.进一步地,所述工程菌株在构建时构建了包含ha-tag的sec14融合基因。
14.如上所述的酿酒酵母工程菌株的构建方法,包括以下步骤:
15.(1)将seq id no.1所示的sec14基因与ha-tag构建融合基因至表达载体prs426中;
16.(2)对构建的表达载体采用醋酸锂转化法转入酿酒酵母by4741进行表达;
17.(3)通过尿嘧啶营养缺陷型(-ura)固体酵母培养基筛选,能够在尿嘧啶营养缺陷型(-ura)固体培养基上生长出的单菌落,即得到单克隆重组菌株。
18.如上所述的酿酒酵母工程菌株的构建方法,包括以下步骤:
19.(1)将seq id no.1所示的sec14基因与3ha即ha
×
3构建融合基因;
20.(2)以质粒pyx212为模板,进行pcr扩增,得到p
tpi1
启动子;
21.(3)将融合基因和p
tpi1
启动子与载体prs426连接,构建含有sec14基因的重组质粒;
22.(4)对构建的重组质粒采用醋酸锂转化法导入酿酒酵母by4741中进行表达;
23.(5)在尿嘧啶营养缺陷型(-ura)固体培养基上得到高表达sec14的by4741/prs426-p
tpi1-sec14-3ha菌株,即得。
24.如上所述的酿酒酵母工程菌株在生产麦角甾醇中的应用。
25.利用如上所述的酿酒酵母工程菌株发酵生产麦角甾醇的方法,步骤如下:
26.将酿酒酵母工程菌划线于尿嘧啶营养缺陷型(-ura)固体培养基平板上,28~30℃培养48-72h,将活化后的菌种,接1-2环于装有3-5ml尿嘧啶营养缺陷型(-ura)液体培养基的试管中,28~30℃,180-220rpm条件下培养12-16h即为种子培养液,将种子培养液按2-10%接种量接入到尿嘧啶营养缺陷型(-ura)的发酵培养基中,28~30℃,180-220rpm条件下发酵24-36h,即得。
27.进一步地,所述尿嘧啶营养缺陷型(-ura)固体培养基为:酵母氮源基础(yeastnitrogen base)6.5-7g/l,灭菌结束后加入尿嘧啶缺陷型氨基酸混合物(do supplement(-ura)powder)0.72-0.84g/l和葡萄糖1.7-2.3%,琼脂2-3%,用ddh2o定容至1l;
28.所述尿嘧啶营养缺陷型(-ura)液体培养基为:酵母氮源基础(yeastnitrogen base)6.5-7g/l,灭菌结束后加入尿嘧啶缺陷型氨基酸混合物(do supplement(-ura)powder)0.72-0.84g/l和葡萄糖1.7-2.3%,用ddh2o定容至1l;
29.所述尿嘧啶营养缺陷型(-ura)发酵培养基为:酵母氮源基础(yeastnitrogen base)6.5-7g/l,灭菌结束后加入尿嘧啶缺陷型氨基酸混合物(do supplement(-ura)powder)0.72-0.84g/l和葡萄糖1.7-2.3%,用ddh2o定容至1l;
30.其中,上述百分数均为质量浓度百分数。
31.一种如上所述的酿酒酵母工程菌株细胞内的麦角甾醇含量测定的方法,具体步骤如下:
32.(1)酿酒酵母工程菌株发酵结束后,收集全部菌体;
33.(2)将收集到的菌体进行冷冻干燥;
34.(3)干菌体回流皂化;
35.(4)使用有机溶剂萃取多次,合并溶剂层;
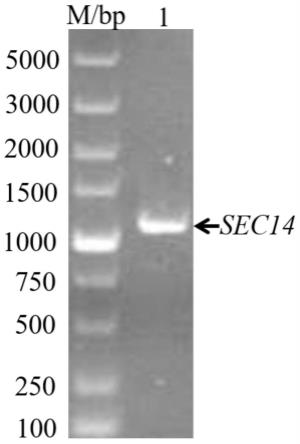
36.(5)蒸干有机溶剂层,复溶已提取物质;
37.(6)使用高效液相色谱法测量283nm处的紫外吸收峰;
38.(7)计算细胞内麦角甾醇含量。
39.一种如上所述的酿酒酵母工程菌株的生长曲线的测定方法,具体步骤如下:
40.(1)将产麦角甾醇的酿酒酵母工程菌株和对照菌株分别接种于尿嘧啶营养缺陷型(-ura)液体培养基的试管中,28~30℃、180-220r/min的条件下培养12-16h;
41.(2)分别取20μl、30μl、40μl菌液依次加入含有1ml尿嘧啶营养缺陷型(-ura)液体培养基的ep管中,混匀,取300μl加入100孔板中,同时取300μl尿嘧啶营养缺陷型(-ura)液体培养基做空白对照;将100孔板放置于全自动生长曲线测定仪中,28~30℃培养,每隔1h测定波长600nm处的吸光度值;
42.(3)以培养时间x为横坐标,od
600
值y为纵坐标,绘制生长曲线。
43.本发明取得的优点和积极效果为:
44.1、本发明酿酒酵母工程菌株是在酿酒酵母宿主菌中表达seq id no.1所示的sec14基因所得。所述构建方法通过构建过表达sec14基因的重组质粒,化转至酿酒酵母宿主菌中,获得高产麦角甾醇的酿酒酵母工程菌株。本发明所构建的酿酒酵母工程菌株所含麦角甾醇为酵母菌干重的0.95%-1.20%,比野生型酵母菌株提高了26%-31%。本发明提供的工程菌不但具有产量高的优点,并且可以通过相对简单的方法条件进行发酵,在工业上易于实现并控制,投资成本低,具有广阔的应用前景。
45.2、本发明酿酒酵母工程菌株发酵24h后麦角甾醇含量达到干重的1.07%,相比野生菌株的麦角甾醇含量提高了28%。
附图说明
46.图1为本发明中sec14基因扩增验证图;其中,m:dna分子量标准;泳道1-sec14扩增片段;
47.图2为本发明中启动子p
tpi1
扩增验证图;其中,m:dna分子量标准;泳道1-p
tpi1
扩增片段;
nitrogen base)6.5-7g/l,灭菌结束后加入尿嘧啶缺陷型氨基酸混合物(do supplement(-ura)powder)0.72-0.84g/l和葡萄糖1.7-2.3%,琼脂2-3%,用ddh2o定容至1l;
70.所述尿嘧啶营养缺陷型(-ura)液体培养基为:酵母氮源基础(yeastnitrogen base)6.5-7g/l,灭菌结束后加入尿嘧啶缺陷型氨基酸混合物(do supplement(-ura)powder)0.72-0.84g/l和葡萄糖1.7-2.3%,用ddh2o定容至1l;
71.所述尿嘧啶营养缺陷型(-ura)发酵培养基为:酵母氮源基础(yeastnitrogen base)6.5-7g/l,灭菌结束后加入尿嘧啶缺陷型氨基酸混合物(do supplement(-ura)powder)0.72-0.84g/l和葡萄糖1.7-2.3%,用ddh2o定容至1l;
72.其中,上述百分数均为质量浓度百分数。
73.一种如上所述的酿酒酵母工程菌株细胞内的麦角甾醇含量测定的方法,具体步骤如下:
74.(1)酿酒酵母工程菌株发酵结束后,收集全部菌体;
75.(2)将收集到的菌体进行冷冻干燥;
76.(3)干菌体回流皂化;
77.(4)使用有机溶剂萃取多次,合并溶剂层;
78.(5)蒸干有机溶剂层,复溶已提取物质;
79.(6)使用高效液相色谱法测量283nm处的紫外吸收峰;
80.(7)计算细胞内麦角甾醇含量。
81.一种如上所述的酿酒酵母工程菌株的生长曲线的测定方法,具体步骤如下:
82.(1)将产麦角甾醇的酿酒酵母工程菌株和对照菌株分别接种于尿嘧啶营养缺陷型(-ura)液体培养基的试管中,28~30℃、180-220r/min的条件下培养12-16h;
83.(2)分别取20μl、30μl、40μl菌液依次加入含有1ml尿嘧啶营养缺陷型(-ura)液体培养基的ep管中,混匀,取300μl加入100孔板中,同时取300μl尿嘧啶营养缺陷型(-ura)液体培养基做空白对照;将100孔板放置于全自动生长曲线测定仪中,28~30℃培养,每隔1h测定波长600nm处的吸光度值;
84.(3)以培养时间x为横坐标,od
600
值y为纵坐标,绘制生长曲线。
85.具体地,相关制备及检测实施例如下:
86.实施例1sec14基因表达载体构建
87.根据sec14的核苷酸序列设计以下扩增引物:
88.prs426-p
tpi1-sec14-3ha-f:
[0089]5’‑
tctataactacaaaaaaacacatacaatggttacagtatgttgttgc-3’;
[0090]
prs426-p
tpi1-sec14-3ha-r:
[0091]5’‑
tttcatcgaaaaggcttccggacatagtcaggaacatcgtatgggta-3’;
[0092]
pcr反应体系:fastpfu buffer 10μl,2.5mm dntps 4μl,模板dna 1μl,上下游引物各0.5μl,fastpfu dnapolymerase 1μl,ddh2o补齐至总体积50μl;
[0093]
以by4741基因组dna为模板,进行pcr扩增获得sec14片段。pcr反应条件为:95℃5min,95℃30s,56℃30s,72℃1min,循环35次,72℃5min,4℃保温。pcr产物进行琼脂糖凝胶电泳分析后,切胶回收目的片段(图1)。
[0094]
根据质粒pyx212的核苷酸序列设计以下扩增引物:
[0095]
p
tpi1-f:5
’‑
ggtaccgggccccccctagaggatctacgtatggtcattcttcttc-3’[0096]
p
tpi1-r:5
’‑
aaaagcaacaacatactgtaaccattgtatgtattttttgtagttataga-3’[0097]
pcr反应体系:fastpfu buffer 10μl,2.5mm dntps 4μl,模板dna 1μl,上下游引物各0.5μl,fastpfu dnapolymerase 1μl,ddh2o补齐至总体积50μl;
[0098]
以质粒pyx212为模板,进行pcr扩增获得p
tpi1
启动子。pcr反应条件为:95℃5min,95℃30s,55℃30s,72℃1min,循环35次,72℃5min,4℃保温。pcr产物进行琼脂糖凝胶电泳分析后,切胶回收目的片段(图2)。
[0099]
实施例2sec14基因过表达酿酒酵母工程菌株的构建
[0100]
利用基因工程的方法,使用限制性内切酶xho i及not i对sec14-3ha融合基因、p
tpi1
启动子及prs426载体进行双酶切连接,获得重组质粒进行双酶切验证(图3),送金唯智公司测序,测序正确的重组质粒命名为prs426-p
tpi1-sec14-3ha。将获得的重组质粒转化至saccharomyces cerevisiae by4741菌株中,之后通过尿嘧啶营养缺陷型(-ura)固体酵母培养基筛选得到单克隆重组菌株。
[0101]
实施例3sec14基因过表达酿酒酵母工程菌株的生长曲线
[0102]
(1)将产麦角甾醇的酿酒酵母工程菌株和对照菌株分别接种于装有5ml尿嘧啶营养缺陷型(-ura)液体培养基的试管中,30℃、220r/min的条件下培养12-16h;
[0103]
(2)分别取20μl、30μl、40μl菌液依次加入含有1ml尿嘧啶营养缺陷型(-ura)液体培养基的1.5ml ep管中,混匀,取300μl加入100孔板中,同时取300μl尿嘧啶营养缺陷型(-ura)液体培养基做空白对照。将100孔板放置于全自动生长曲线测定仪中,30℃培养,每隔1h测定波长600nm处的吸光度值。
[0104]
(3)以培养时间(x)为横坐标,od
600
值(y)为纵坐标,绘制生长曲线。
[0105]
结果如图4所示,所构建酿酒酵母工程菌株在指数期生长速度略快于野生型对照菌,进入平台期后,其生长速度略慢于野生型对照菌。但总体来说,所构建酿酒酵母工程菌株与野生型对照菌在生长趋势上基本保持一致。
[0106]
实施例4酿酒酵母工程菌株发酵生产麦角甾醇
[0107]
(1)活化菌种
[0108]
将产麦角甾醇的酿酒酵母工程菌株划线于尿嘧啶营养缺陷型(-ura)固体培养基平板,30℃培养48h;
[0109]
(2)种子培养
[0110]
将活化后的菌种,接1环于装有5ml尿嘧啶营养缺陷型(-ura)液体培养基的试管中,30℃,220rpm条件下培养12h即为种子培养液;
[0111]
种子培养基为:酵母氮源基础(yeast nitrogen base)6.7g/l,灭菌结束后加入尿嘧啶缺陷型氨基酸混合物(do supplement(-ura)powder)0.77g/l和葡萄糖2%;
[0112]
(3)发酵培养
[0113]
将种子培养液按2%接种量接入装有200ml尿嘧啶营养缺陷型(-ura)液体培养基的三角瓶中,30℃,220rpm条件下发酵24h;
[0114]
发酵培养基为:酵母氮源基础(yeast nitrogen base)6.7g/l,灭菌结束后加入尿
嘧啶缺陷型氨基酸混合物(do supplement(-ura)powder)0.77g/l和葡萄糖2%。
[0115]
实施例5麦角甾醇酿酒酵母菌株中麦角甾醇含量测定
[0116]
(1)发酵培养(如实施例4所述)结束后,收集全部菌体,并将菌体进行冷冻干燥;
[0117]
(2)称取0.2g干酵母,加入1ml 90%无水乙醇,2ml 30%氢氧化钠,85℃皂化回流2.5h;
[0118]
(3)待溶液冷却至室温,加入适量乙酸乙酯萃取2-3次,合并有机层;
[0119]
(4)旋转蒸发仪蒸干有机溶剂,得到麦角甾醇干物质;
[0120]
(5)加入5ml甲醇复溶提取到的麦角甾醇,超声溶解;
[0121]
(6)使用高效液相色谱法测量283nm处的紫外吸收峰;
[0122]
麦角甾醇产率使用以下公式计算:
[0123]
每克干酵母中麦角甾醇百分比(%)=[(c*5)/m]*100%
[0124]
c:麦角甾醇浓度;
[0125]
m:菌体干重;
[0126]
发酵至24h后,经测定麦角甾醇产量结果如图5所示,从图中可以看出,所构建酿酒酵母工程菌株中麦角甾醇的产量达到1.07%,较野生型菌株提高了28%。
[0127]
本发明所涉及的sec14基因如下(序列表seq id no.1):
[0128]
atggttacagtatgttgttgcttttatttactttttctttttttgacattcattgtgacaatattcacattcttcagatagttctgtctatatgaagcaaaaatgatatatcaataagtttactaacaaacacaagtggtattactatgacttcactttaaatagcaacaagaaaaggaatttttagaatcctaccctcaaaactgtcctccagatgccttgcctggtactccaggaaatttagacagcgctcaagagaaggcattggcagaactaagaaaacttttggaagacgctggtttcattgaacgtttagacgattcaactttactacgttttttgagagccagaaaatttgatgttcaattggctaaagaaatgtttgaaaactgcgaaaaatggaggaaggattatggtaccgacactatcttgcaagattttcattatgatgaaaaaccattgattgccaaattctacccacaatattatcataaaaccgataaagatggccgcccagtatattttgaagaattaggtgctgttaacttacatgaaatgaacaaggttacctctgaagagaggatgttgaaaaacttggtttgggaatacgaatctgtcgttcaatacagattacctgcctgttcaagagctgctggtcacctagtggaaacttcatgtacaattatggatttgaaaggtatctccatatctagtgcatacagtgttatgtcatatgttagggaagcctcctacataagtcaaaactattaccccgaacgtatgggtaaattttacatcatcaacgcgccattcggtttctctaccgcatttaggctatttaaacctttcttggatccagtcactgtttcaaagatttttatcttgggttcttcttaccagaaggaattattaaagcaaattccagctgaaaacttaccagtcaaatttggcggtaagtctgaagttgatgaatccaagggtgggttatacctatccgatatcggtccatggagggatccaaagtatattggaccggaaggtgaagctccggaagccttttcgatgaaatga
[0129]
seq id no.1所编码的sec14的氨基酸序列如seq id no.2所示:mvtqqekeflesypqncppdalpgtpgnldsaqekalaelrklledagfierlddstllrflrarkfdvqlakemfencekwrkdygtdtilqdfhydekpliakfypqyyhktdkdgrpvyfeelgavnlhemnkvtseermlknlvweyesvvqyrlpacsraaghlvetsctimdlkgisissaysvmsyvreasyisqnyypermgkfyiinapfgfstafrlfkpfldpvtvskifilgssyqkelikqipaenlpvkfggksevdeskgglylsdigpwrdpkyigpegeapeafsm。
[0130]
尽管为说明目的公开了本发明的实施例,但是本领域的技术人员可以理解:在不脱离本发明及所附权利要求的精神和范围内,各种替换、变化和修改都是可能的,因此,本发明的范围不局限于实施例所公开的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1