一种鉴定人肠道脆弱拟杆菌的引物对及其应用的制作方法
1.本发明属于荧光定量pcr检测领域,具体涉及一种鉴定人肠道脆弱拟杆菌的引物对,用于鉴定人肠道脆弱拟杆菌的荧光定量pcr反应体系及其应用。
背景技术:
2.脆弱拟杆菌(bacteroides fragilis)是临床上最常见的一种厌氧菌。能分解糖,对胆汁耐受,为类杆菌属的代表株。革兰氏阴性杆菌,两端钝圆而浓染,中间有不着色部份。在正常情况下,它能维持人体消化系统平衡和机体抵抗力,是免疫系统的驱动力,已被应用于健康领域。
3.脆弱拟杆菌对人体既有利,又有害,具有双重作用。它可以释放消炎物质,帮助免疫系统保持平衡。很多时候,它对我们的免疫系统发号施令,进行操纵。这种操纵并不会抑制或减弱我们免疫系统的性能,相反,还有助于免疫系统发挥功能。另一方面,脆弱拟杆菌常寄生于人的口腔、肠道和女性生殖道,是一种条件致病菌,主要为内源性感染,可引起女性生殖系统、胸腔和颅内感染。
4.现有鉴定脆弱拟杆菌的方法有基于形态学观察、生化试验、分子生物学实验等。脆弱拟杆菌的触酶试验阳性,发酵葡萄糖、麦芽糖和蔗糖,不发酵阿拉伯糖、鼠李糖、山梨醇和海藻糖,胆汁七叶苷试验阳性,吲哚试验阴性,耐20%胆盐。脆弱拟杆菌是革兰阴性杆菌,大小为(0.8~1.3)μm
×
(1.6~8)μm,染色不均,两端圆而深染,中间不着色或染色较浅,似为空泡。培养物呈明显的多形性,在液体培养基尤其在含糖的培养基中,为长丝状或其他形状。
5.目前,已经公开报道基于分子生物学实验鉴定脆弱拟杆菌的方法有2个。谢湘峰等(巢式pcr结合微孔板杂交技术鉴定脆弱拟杆菌.中国实验诊断学,2002,(02):75)报道的方法,技术相对繁琐,涉及实验仪器和设备较多。张煜坤等(选择性培养基结合特异引物法分离鉴定家兔肠道脆弱拟杆菌.家畜生态学报,2015,36(03):58)报道的方法仅限于家兔肠道脆弱拟杆菌的鉴定。
6.人类粪便的主要成分包括水和固体成分,其中水约占总质量的四分之三,其余四分之一是固体。固体物质大多是蛋白质、无机物、脂肪、未消化的食物纤维、从肠道脱落的细胞和死掉的细菌、以及大量金属离子等。由于粪便成分的复杂性,且各组分含量不恒定,对于肠道特定菌种的生化或分子生物学鉴定带来了极大难度和不确定性。
7.目前,已有的检测脆弱拟杆菌的方法已经不能进一步满足对于人肠道中脆弱拟杆菌的直接检测和定量分析的要求。
技术实现要素:
8.本发明公开了一种基于pcr技术的人肠道脆弱拟杆菌鉴定的方法,本发明可直接以人类粪便为模板,直接检测其是否含有脆弱拟杆菌以及含有脆弱拟杆菌的相对丰度。
9.本发明公开了一种鉴定人肠道脆弱拟杆菌的引物对,包括正向引物和反向引物,
所述正向引物和反向引物的序列分别如seq id no:1和2所示。
10.本发明公开了一种荧光定量pcr反应体系,包括:10
×
pcr buffer、sybr green i、dntp、模板、正向引物和反向引物,所述正向引物和反向引物的序列分别如seq id no:1和2所示。
11.优选的,所述10
×
pcr buffer的配方为:500mmol/l kcl,100mmol/l ph 8.3tris-hcl,5-50mmol/l mgcl2。
12.优选的,所述mgcl2浓度为5mmol/l。
13.优选的,所述10
×
pcr buffer的溶剂为dd水或超纯水。
14.本发明公开了一种鉴定人肠道脆弱拟杆菌的试剂盒,所述试剂盒包括所述的引物对和/或所述的反应体系。
15.优选的,所述试剂盒还包括脆弱拟杆菌标准品溶液。
16.优选的,所述标准品溶液为不同浓度的脆弱拟杆菌。
17.本发明公开了一种鉴定人肠道脆弱拟杆菌的方法,包括如下步骤:
18.1)将受试者粪便样本稀释制备成粪便稀释物;
19.2)将步骤(1)中的粪便稀释物作为模板建立pcr反应体系,所述反应体系包括:10
×
pcr buffer、sybr green i、dntp、模板、正向引物和反向引物,所述正向引物和反向引物的序列分别如seq id no:1和2所示;
20.3)pcr扩增;
21.4)根据扩增结果判断样本中的脆弱拟杆菌是否存在。
22.优选的,所述方法为非疾病诊断目的。
23.优选的,所述10
×
pcr buffer的配方为:500mmol/l kcl,100mmol/l ph 8.3tris-hcl,5-50mmol/l mgcl2。
24.优选的,所述mgcl2浓度为5mmol/l。
25.优选的,所述步骤1)中的粪便样本稀释步骤为:取受试者粪便0.5g置于灭菌的1.5ml离心管,4℃存放,将所取样品溶于50ml生理盐水,从中吸取1ml悬浮液,用生理盐水稀释100倍,备用。
26.优选的,所述步骤3)中的pcr扩增条件为:(1)预变性,98℃,10min;(2)变性,96℃,30s;(3)退火,60℃,30s;(4)延伸,72℃,40s;(5)重复步骤(2)~(4)1次;(6)变性,96℃,30s;(7)退火,58℃,30s;(8)延伸,72℃,40s;(9)重复步骤(6)~(8)1次;(10)变性,96℃,30s;(11)退火,56℃,30s;(12)延伸,72℃,40s;(13)重复步骤(10)~(12)35次;(14)继续延伸,72℃,7min。
27.本发明公开了所述的引物对和/或所述的扩增体系在制备检测人肠道脆弱拟杆菌试剂盒中的用途。
28.本发明通过降低pcr缓冲液中mgcl2浓度,与配对脆弱拟杆菌16s rrna的多对pcr引物组合试验,在调整pcr反应步骤的基础上,以获得最佳的实时定量pcr效果,并实现了对粪便稀释物的直接pcr鉴定。运用本技术,可一次性、快速鉴定人类肠道中是否含有脆弱拟杆菌,无需对受试人粪便中肠道菌群的分离后再行鉴定。本发明无需分离粪便中的肠道菌种后再行pcr,减少试验步骤,节约检测时间,达到了一步法快速鉴定肠道中是否含有脆弱拟杆菌的试验目的。
附图说明
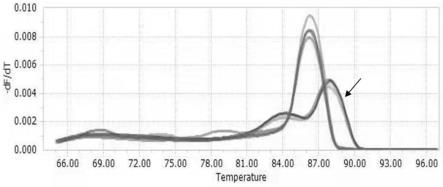
29.图1为引物对1和引物对2对粪便样品的稀释液的实时定量pcr的溶解曲线,其中,箭头所指的溶解曲线是引物对2的扩增曲线,出现杂峰,且荧光信号较弱,说明扩增的特异性较差,而引物对1的溶解度曲线是单一特征峰,说明其扩增特异性好。
30.图2为引物对1对人粪便混合样品的稀释液和脆弱拟杆菌标准品实时定量pcr的溶解曲线,可见两组样品的溶解曲线完全重合。运用引物对3-引物对10没有检测数值,无溶解曲线。
31.图3为脆弱拟杆菌标准样品的扩增的标准曲线,该标准曲线的回归方程为y=-1.1132x+33.598,y为ct值,2
(2+x)
为受试样品中脆弱拟杆菌的数据。
具体实施方式
32.以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
33.若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
34.实施例1人肠道脆弱拟杆菌荧光定量pcr反应体系的建立
35.1.粪便样本的获取
36.取受试者粪便0.5g置于灭菌的1.5ml离心管,4℃存放。所取样品溶于50ml生理盐水,从中吸取1ml悬浮液,用生理盐水稀释100倍,以此作为pcr反应的模板。
37.2.配置pcr反应体系
38.冰上配置pcr反应体系,进行pcr扩增,反应体系如下表1。
39.表1:人肠道脆弱拟杆菌荧光定量pcr反应体系
40.试剂体积10
×
pcr buffer5μlsybr green i(50
×
)1μl2.5mmol/l dntp2μl10μmol/l primer-f1μl10μmol/l primer-r1μldnapolymerase0.5μl模板(人粪便稀释物)1μlddh2o补齐至总体积50μl总体系50μl
41.其中,10
×
pcr buffer为自制缓冲液,配方为:500mmol/l kcl,100mmol/l tris-hcl(ph 8.3),5mmol/l mgcl2。mgcl2浓度显著低于常规商品化pcr试剂中mgcl2浓度。5mmol/l mgcl2有助于更准确地扩增混合样品(人粪便稀释物)中的目标模板(人肠道中的脆弱拟杆菌)。
42.实施例2人肠道脆弱拟杆菌荧光定量pcr扩增引物的设计
43.根据人脆弱拟杆菌16s rrna的序列,设计不同的针对人肠道脆弱拟杆菌的扩增引物,引物设计的原则包括:引物与目标模板的序列要紧密互补;引物与引物之间避免形成稳
定的二聚体或发夹结构;引物不能和目标模板的非目的位点发生错配;避免引物中联系ggg或ccc等。初步设计获得的扩增引物组序列如下表2。
44.表2:配对脆弱拟杆菌的pcr引物序列
[0045][0046]
实施例3人肠道脆弱拟杆菌荧光定量pcr扩增引物的筛选
[0047]
对于表2中设计获得的扩增脆弱拟杆菌的引物对,进行筛选鉴定,具体操作如下。
[0048]
为了研究配对脆弱拟杆菌的pcr引物对(表2)能否有效地扩增脆弱拟杆菌的目标基因,我们将5例健康受试者的粪便稀释物混合后加入脆弱拟杆菌的标准样品,以此作为阳性模板;将5例健康受试者的粪便稀释物混合后,离心法去除混合稀释物中的肠道菌群,以此作为阴性模板,按照实施例1建立pcr反应体系。
[0049]
pcr反应条件如下:
[0050]
(1)预变性,98℃,10min;
[0051]
(2)变性,96℃,30s;
[0052]
(3)退火,60℃,30s;
[0053]
(4)延伸,72℃,40sec;
[0054]
(5)重复步骤(2)~(4)1次;
[0055]
(6)变性,96℃,30s;
[0056]
(7)退火,58℃,30s;
[0057]
(8)延伸,72℃,40sec;
[0058]
(9)重复步骤(6)~(8)1次;
[0059]
(10)变性,96℃,30s;
[0060]
(11)退火,56℃,30s;
[0061]
(12)延伸,72℃,40sec;
[0062]
(13)重复步骤(10)~(12)35次;
[0063]
(14)继续延伸,72℃,7min;
[0064]
按上述实时定量pcr步骤行pcr。结果显示(表3),其中引物对1和引物对2可扩增混合粪便阳性模板中的目标基因(ct值分别为22.84
±
0.16、29.43
±
0.51),引物对3~引物对10均无法扩增混合粪便中的目标基因。
[0065]
表3.配对脆弱拟杆菌的pcr引物的筛选结果
[0066][0067][0068]
注:ct值是指每个实时定量pcr反应管内的荧光信号到达设定的域值时所经历的循环数。实时定量pcr设定的循环数为40,因此ct值≤40。ct值越小,表示目标基因的表达量越高。
[0069]
为了进一步分析引物对1和引物对2对脆弱拟杆菌16s rrna目标基因扩增的特异性,我们分析了引物对1和引物对2实时定量pcr的溶解曲线(图1)。其中引物对2的溶解曲线,出现杂峰,且荧光信号较弱,说明其pcr扩增的特异性较差。相比较,引物对1的溶解曲线是单一特征峰(图1),说明其扩增特异性佳。
[0070]
为了进一步分析运用引物对1对人粪便稀释物样品(阳性模板)和脆弱拟杆菌标准样品的pcr鉴定的特异性,我们分析了其溶解曲线(图2)。结果显示,运用引物对1对粪便稀释物样品(阳性模板)和脆弱拟杆菌标准样品的实时定量pcr的溶解曲线完全一致,特征峰单一,且荧光信号较强(图2)。由此说明,本技术从人粪便混合样品中直接鉴定是否含有脆弱拟杆菌的方法切实可行、且特异性较高。
[0071]
实施例4人肠道脆弱拟杆菌荧光定量pcr反应体系的镁离子的优化
[0072]
在初步的实验中,我们采用了商品化的pcr缓冲液来建立反应扩增体系,但是,在实际扩增中,扩增靶标较为困难,难以建立扩增曲线。根据已有的报道,反应体系中镁离子的浓度对于荧光定量pcr的反应至关重要。
[0073]
因此,我们在实际操作中调整了不同的镁离子的浓度来建立不同的pcr反应体系,采用引物对1进行扩增验证。
[0074]
pcr缓冲液中的低浓度mgcl2(pcr反应终浓度0.5mmol/l)。mgcl2浓度显著低于常规商品化pcr试剂中mgcl2浓度(pcr反应终浓度1~2mmol/l)。为了研究高浓度mgcl2是否能有效扩增人粪便稀释物样品(阳性模板),我们设置mgcl2浓度梯度,并行实时定量pcr鉴定。结果显示(表4),mgcl2浓度≥1mmol/l均不能在人粪便稀释物样品中有效扩增脆弱拟杆菌的目标基因。
[0075]
表4.不同浓度mgcl2对人粪便稀释物样品扩增脆弱拟杆菌目标基因的效果分析
[0076]
mgcl2终浓度ct0.5mmol/l23.01
±
0.241mmol/ln/a1.5mmol/ln/a2mmol/ln/a2.5mmol/ln/a5mmol/ln/a
[0077]
实施例5对临床样本中的肠道脆弱拟杆菌荧光定量pcr检测
[0078]
收集33例健康体检者或不同症状的临床患者粪便样本,按照实施例1的方法建立pcr反应体系,使用引物对1作为扩增引物,同时配制脆弱拟杆菌标本标准品,并建立样品的标准曲线(参见图3),可精确测定受试样品中脆弱拟杆菌的数量。由该标准曲线可知,ct=-1.1132x+33.598(2
(2+x)
为受试样品中脆弱拟杆菌的数据),并且检测的线性较好。33例临床受试者的肠道脆弱拟杆菌的检测结果参见表5。
[0079]
表5受试者基本信息及脆弱拟杆菌的表达(ct值)
[0080]
[0081][0082]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1