茚虫威半抗原、抗原、抗体、检测装置及其制备和应用的制作方法
1.本发明涉及农药安全检测的技术领域,特别是涉及茚虫威半抗原、抗原、抗体、检测装置及其制备和应用。
背景技术:
2.茚虫威(indoxacarb),化学名称为7-氯-2,3,4a,5-四氢-2-[甲氧基羰基(4-三氟甲氧基苯基)氨基甲酰基]茚并[1,2-e][1,3,4-]噁二嗪-a-羧酸甲酯。茚虫威是由美国杜邦公司发现、开发和生产的兼具噁二嗪结构的氨基甲酸酯类杀虫剂,具有独特的作用机理,其在昆虫体内被迅速转化为n-去甲氧羰基代谢物,由 n-去甲氧羰基代谢物作用于昆虫神经细胞失活态电压门控钠离子通道,不可逆地阻断和破坏昆虫体内的神经冲动传递,导致害虫运动失调,不能进食,麻痹并最终死亡。
3.作为一种低毒、高效杀虫剂,茚虫威应用广泛,可有效防治粮、棉、果、蔬等作物上的多种害虫。茚虫威虽然属于低毒杀虫剂,但是使用不当,也会造成作物中残留量过高,从而对人体健康造成危害,研究证实,茚虫威在单一高剂量口服情况下,可导致人体出现痉挛、颤抖和动作不协调等诸多症状。
4.新型低毒高效农药茚虫威等可有效防治多种害虫, 在农业种植中已经被广泛使用。国内外已报道了茚虫威在水稻、甘蓝、豇豆和棉花等作物上的残留分析和安全性评价研究,前处理大多采用丙酮、甲醇、石油醚等试剂提取,液液萃取或固相萃取柱净化,相对来说前处理比较繁琐,主要由气相色谱仪(ecd检测器)或液相色谱仪(pda检测器)进行检测,但过程较复杂,成本较高。很难达到快速检测的目的,不适用于现场快速检测,不能满足监管部门、检测机构现场监督执法的需要。
技术实现要素:
5.本发明的目的在于提供了茚虫威半抗原、抗原、抗体、检测装置及其制备和应用。
6.根据本发明的一个方面,提供了茚虫威半抗原,其结构如下所示:(ⅰ),其中,n为3、4、5或6。
7.根据本发明的另一个方面,制备茚虫威半抗原的方法,其特征在于,包括以下步骤:s1. 茚虫威原药与还原剂反应,反应完毕后,萃取、纯化,得到中间体,还原剂为硼氢化钠、硼氢化钾、硼氢化锂中的任意一种,中间体的结构式如式(ⅱ)所示:(ⅱ);s2. 中间体被反应溶剂溶解后,与酸酐类化合物发生酰化反应,反应完毕后,萃取、纯化,得到茚虫威半抗原,茚虫威半抗原的结构式如式(ⅰ)所示,反应溶剂为无水吡啶、二氯甲烷-三乙胺或甲苯中的任意一种。
8.在一些实施方式中,步骤s1中茚虫威原药与还原剂的摩尔比为1:(1.1-5)。
9.在一些实施方式中,步骤s2中间体与酸酐类化合物的摩尔比为1:(1.2-8),酸酐类化合物为丁二酸酐、戊二酸酐、己二酸酐中的任意一种。
10.根据本发明的再一个方面,提供了茚虫威抗原,包含茚虫威半抗原以及与茚虫威半抗原偶联的载体蛋白,载体蛋白为牛血清白蛋白、牛乳铁蛋白、鸡卵清白蛋白或血蓝蛋白中的一种。
11.根据本发明的第四个方面,提供了茚虫威抗体,是由茚虫威抗原经动物免疫制备得到,茚虫威抗体为茚虫威单克隆抗体。
12.根据本发明的第五个方面,提供了茚虫威半抗原、茚虫威抗原或茚虫威抗体在茚虫威的免疫学检测中的应用。
13.根据本发明的第六个方面,提供了茚虫威胶体金层析检测装置,为一步法卡扣式检测卡,包括样品垫、胶体金垫、反应膜和吸水纸,反应膜上设有检测线和质控线,胶体金垫中含有胶体金标记的茚虫威抗体,检测线包被有茚虫威抗原。
14.根据本发明的第七个方面,提供了一种检测样品中茚虫威残留的方法,该方法为使用茚虫威胶体金层析检测装置对样品中含有的茚虫威进行检测。
15.在一些实施方式中,样品为茶叶、果蔬、水体或者土壤中的一种。
16.本发明的有益效果:本发明提供的茚虫威半抗原的制备方法,使用的化学试剂容易得到、操作过程简单、合成步骤简洁有效、反应产率较高、并且检测成本较低。本发明利用层析式免疫胶体金原理,通过检测卡中检测线与质控线之间的比色来定性检测样本中是否残留有茚虫威,应用时不需要使用液相色谱或质谱等大型仪器,达到快速检测的目的。本发明应用免疫学检测方法,对样品中残留的茚虫威进行专属检测,具有特异性好、灵敏度高、操作简便、可实现现场快速检测等优点,能更好的满足监管部门、检测机构现场监督执法的需要,为相关执法部门快速检测茶叶、果蔬、水体或者土壤中是否残留茚虫威提供技术支
持。
附图说明
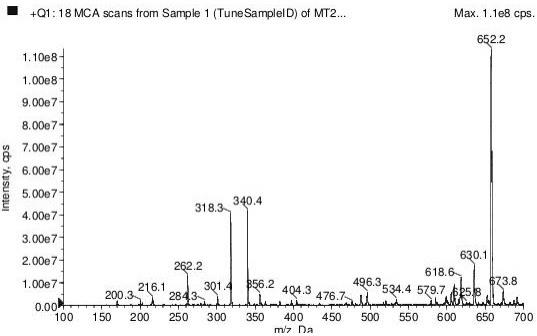
17.图1为本发明的一种实施方案的茚虫威半抗原的质谱图。
18.图2为本发明的一种实施方案的茚虫威半抗原的合成流程图。
19.图3为本发明的一种实施方案的茚虫威胶体金层析检测装置的结构示意图。
具体实施方式
20.以下通过具体的实施案例对本发明作进一步详细的描述,应理解这些实施例仅用于说明本发明而不用于限制本发明的保护范围,在阅读了本发明之后,本领域技术人员对本发明的各种等价形式的修改均落于本技术所附权利要求所限定。若无特殊说明,本发明的所有原料和试剂均为常规市场可购买的原料、试剂。
21.实施例1本实施例中茚虫威原药选择京博农化科技有限公司供应的95%的茚虫威原药,硼氢化钠选择国药集团化学试剂有限公司供应的分析纯硼氢化钠,乙酸乙酯选择国药集团化学试剂有限公司供应的分析纯乙酸乙酯,无水硫酸钠选择国药集团化学试剂有限公司供应的99%无水硫酸钠,无水吡啶选择国药集团化学试剂有限公司供应的99.5%无水吡啶,丁二酸酐选择国药集团化学试剂有限公司供应的分析纯丁二酸酐,n,n-二甲基甲酰胺选择国药集团化学试剂有限公司供应的99.8% n,n-二甲基甲酰胺,三正丁胺选择国药集团化学试剂有限公司供应的分析纯三正丁胺,氯甲酸异丁酯选择国药集团化学试剂有限公司供应的98%氯甲酸异丁酯,以下实施例2-10均采用本实施例1中的试剂。
22.实施例2
ꢀꢀ
茚虫威半抗原的合成与鉴定茚虫威半抗原的制备方法,包括以下步骤:s1. 取一单口瓶,称取茚虫威原药1.0g加入单口瓶中,用20ml无水甲醇溶解后,在冰浴条件下分批加入硼氢化钠0.21g,室温搅拌,tlc监控至反应完全,蒸干溶剂后加入100ml蒸馏水,加入乙酸乙酯萃取、分液,得到有机相,将有机相用无水硫酸钠干燥后,柱层析纯化,得到中间体0.8g,中间体的结构式如式(ⅱ)所示:(ⅱ);s2. 取中间体400mg,用无水吡啶溶解后加入丁二酸酐0.2g,升温至80℃反应过夜,反应结束后蒸干溶剂,加入水与乙酸乙酯洗涤、萃取、分液,保留有机相,用无水硫酸钠干燥,柱层析纯化,得到茚虫威半抗原200mg,经质谱鉴定,ei-ms(positive)m/z:652.2[m+na]+ 。茚虫威半抗原的结构式如式(ⅰ)所示,其中n为3。
[0023]
实施例3
ꢀꢀꢀ
茚虫威免疫用抗原的合成采用活泼酯法制备茚虫威免疫用抗原,称量茚虫威半抗原70mg,溶于3ml dmf中,加入36mg nhs、41mg edc.hcl,室温反应6h,制备得到活化液;称取64mg bsa溶于3.2ml0.1m ph9.0的硼酸缓冲液,加入1ml dmf,0.9ml上述活化液,室温反应4小时后用pbs( 0.01 mol/l,ph= 7.4的磷酸盐缓冲液)透析,每4 h换液1次,换液7~ 8次,透析后4000转/min离心5min,取上清液,得到茚虫威半抗原-bsa偶联物,即为茚虫威免疫用抗原,于-20℃保存。
[0024]
实施例4
ꢀꢀꢀ
茚虫威包被用抗原的制备称取54 mg茚虫威半抗原溶于200μl无水dmf中,然后按顺序依次加入42.7μl三正丁胺和23.4μl氯甲酸异丁酯,室温下搅拌反应1 h,制备得到反应液;将300 mg ova溶于2 ml碳酸盐缓冲溶液中,搅拌下缓慢滴加200μl上述反应液,室温下搅拌反应3h,然后透析,离心,得到茚虫威半抗原
‑‑
ova偶联物,即为茚虫威包被用抗原,于-20℃保存。
[0025]
实施例5
ꢀꢀꢀ
茚虫威单克隆抗体的制备及纯化5.1动物免疫取8~9周龄balb/c雌性小鼠,将实施例3中制备得到的茚虫威免疫用抗原与弗氏完全佐剂等量混合,完全乳化后,腹部皮下注射,剂量为茚虫威免疫用抗原100μg/只,以后每隔三周以同剂量取人工抗原与弗氏不完全佐剂混合乳化后皮下多点注射,免疫四次后测定其效价和抑制率,选取效价和抑制率都较高的小鼠进行细胞融合,融合前5d加倍剂量强化免疫一次;5.2细胞融合将小鼠骨髓瘤sp2/0细胞与脾细胞以5: 1的比例混合,在50% peg下融合,洗涤、离心后,以hat培养基悬浮,接种于含饲养细胞的96孔培养板中,在37℃条件下,5%的co2培养箱中培养;5.3单克隆抗体的制备和纯化提前一周注射0.5ml液体石蜡至balb/c小鼠腹腔,将细胞培养液(每只小鼠注射量为1ml,含约(1~2)
×
108个细胞)以腹腔注射的方式注射入小鼠腹部10-15d后,待小鼠腹部明显膨大时采集腹水,采用饱和硫酸铵沉淀法除去杂蛋白,再过protein a柱子纯化出igg,即为茚虫威单克隆抗体,-20℃保存。
[0026]
实施例6
ꢀꢀꢀ
茚虫威胶体金层析检测装置的制备6.1 胶体金的制备取1%氯金酸溶液1ml,加入99ml超纯水配成终浓度0.01%的氯金酸溶液,加热沸腾后,取1%柠檬酸三钠1.6ml一次性迅速加入煮沸的氯金酸溶液中,继续加热至溶液由淡黄色转为蓝黑色最终变为亮红色,颜色稳定后继续加热5min,室温冷却,补充失水至原体积,得到胶体金溶液;5.2抗体的制备调节胶体金溶液ph值至8.0,用恒速搅拌器均匀搅拌,同时逐滴加入茚虫威单克隆抗体,1h后加入与茚虫威单克隆抗体量相当的peg,充分反应30min后加入与茚虫威单克隆抗体量相当的bsa,加完后,继续搅拌30min。在9000rpm 转速下离心30min,获得均一性金标抗体沉淀,即茚虫威单克隆抗体-胶体金标记物,再加入pnpb重悬备用;5.3胶体金检测装置的组装
在底板上,沿同一方向依次将样品垫、喷涂有茚虫威单克隆抗体-胶体金标记物的胶体金垫、设置有检测线和质控线的硝酸纤维素膜和吸水纸依次搭接粘连,切成适当宽度的条状物后放入卡槽中,最后盖上面盖,检测线包被有茚虫威包被用抗原,质控线包被有羊抗鼠igg,其中羊抗鼠igg以羊作为免疫动物,以鼠源抗体为免疫原对无病原体羊进行免疫,得到羊抗鼠抗体。
[0027]
实施例7
ꢀꢀ
一种检测样品中茚虫威残留的方法7.1 样品的预处理:取5 g搅碎的样品加至内有5ml ph=7.4的磷酸盐缓冲液(缓冲液中含有10%的乙醇)的提取瓶中,拧紧瓶盖大力摇匀约30秒,混匀后即为待测液,样品为茶叶、果蔬、水体或者土壤中的一种;7.2 检测:拧开试剂瓶上盖,用吸管吸取0.5ml上层清液,滴加3-4滴到茚虫威胶体金检测装置的样品槽中3min后,并进行结果判读;7.3 结果判读:参照下表1进行结果判读;表 1
ꢀꢀꢀ
结果判读表7.4与验证方法结果对比:将采用本实施例的检测方法的结果,与采用液相色谱-质谱/质谱法测定的结果进行比较,结果为:本发明的检测方法与液相色谱-质谱/质谱法的结果一致,说明本发明对样品中茚虫威残留的检测方法具有较高的准确度。
[0028]
实施例8
ꢀꢀꢀ
茚虫威胶体金层析检测装置的灵敏度向阴性蔬菜样品中,分别以10μg/kg、20μg/kg、25μg/kg、30μg/kg的添加量加入茚虫威,得到多个添加不同茚虫威含量的待测蔬菜样品,采用实施例6制备的氟硅唑胶体金层析检测装置和本实施7中的检测方法,对待测蔬菜样品进行检测。
[0029]
检测结果发现,茚虫威添加量为25μg/kg、30μg/kg的待测蔬菜样品检出为阳性,而添加量为10μg/kg、20μg/kg的待测蔬菜样品检出为阴性。通过上述添加实验,本发明中茚虫威胶体金层析检测装置对茚虫威的检出限位25μg/kg,说明本发明的茚虫威胶体层析金检测装置对茚虫威灵敏度高。
[0030]
实施例9
ꢀꢀ
茚虫威胶体金检测装置的特异性实验向阴性土壤样品中,分别以25μg/kg的添加量加入茚虫威、以5mg/kg的添加量加入
甲萘威、以5mg/kg的添加量加入灭多威、以5mg/kg的添加量加入克百威、以5mg/kg的添加量加入苯醚甲环唑、以5mg/kg的添加量加入涕灭威,得到多个含有不同农药成分的待测土壤样品,采用实施例6制备的茚虫威胶体金层析检测装置与实施例7中的检测方法,对待测土壤样品进行检测。
[0031]
检测结果发现,只有加入茚虫威的待测土壤样品中检出阳性,而加入甲萘威、灭多威、克百威、苯醚甲环唑、涕灭威的待测土壤样品无法检出,说明本发明的检测装置对茚虫威的特异性较好。
[0032]
实施例10
ꢀꢀ
茚虫威胶体金层析检测装置的保质期测定用三批常规生产的产品分别做保质期实验,放置于室内室温环境保持,每隔1个月取12个装置,用质控样本检测,分别做阴性和25μg/kg、50μg/kg、100μg/kg、200μg/kg加标实验,重复三次,观察数据变化,考察保质期时间。阴性显色从13个月开始下降,在1年时间内产品品质无明显变化,因此确定保质期为1年。
[0033]
以上所述的仅是本发明的一些实施方式,对于本领域的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1