用于测定子宫内膜癌预后的组合物和方法与流程
用于测定子宫内膜癌预后的组合物和方法
1.本技术是申请日为2016年2月5日、中国申请号为201680020371.3、发明名称为“用于测定子宫内膜癌预后的组合物和方法”的发明申请的分案申请。
技术领域
2.本发明一般涉及用于在特定亚群的患者中测定子宫内膜癌预后的组合物和方法。
背景技术:
3.提供以下对本发明的背景的探讨仅为帮助阅读者理解本发明,不能视为描述或构成本发明的现有技术。
4.子宫内膜癌(ec)涵盖具有可变的临床结果的常见的子宫内膜样组织学亚型,及具有一致的不良预后的较不常见的乳头状浆液/透明细胞癌(psc)。ec来自子宫的内膜,是美国女性中第四常见的恶性肿瘤。在2013年,有预计49,500例的新病例被诊断,并有8,200人由ec致死。大多数患者患有低级别、早期的疾病。然而,大多数具有更高侵袭性、高级别的肿瘤的患者将在1年内发展,这些患者的疾病扩散超出子宫。
5.子宫内膜癌大体分成两组。i型子宫内膜样肿瘤与雌激素过量、肥胖和性激素受体(hormone-receptor)阳性相关,与ii型相比,患有i型肿瘤的个体通常具有有利的预后。ii型主要表现为浆液性肿瘤,其在老年人、非肥胖妇女中更常见,并具有相对较差的结果。早期子宫内膜样癌通常用辅助放射疗法治疗,而浆液性肿瘤用化疗治疗。因此,适当的亚型分类对于选择适当的辅助治疗至关重要,但用于解决这一需要的诊断解决对策有限。
6.在ec中的主要未满足的诊断需要是,识别具有子宫内膜样组织学和较低分期的病例,所述较低分期具有复发风险并且将从辅助化疗中受益。
7.多中心子宫内膜癌(multicenter uterine corpus endometrial carcinoma,ucec)研究近年来采用了表达和基因组微阵列、甲基化谱(methylation profiling)和下一代测序(ngs)来满足这一需求。研究主要基于测序和微阵列数据,鉴定了ec的四个不同的分子簇(molecular cluster)。(the cancer genome atlas research network,integrated genomic characterization of endometrial carcinoma,00 nature,1-8(2013)).这些簇包括1)与极高突变率和有利的预后相关的pole突变病例组,以及2)与tp53突变、常见基因组拷贝数(cn)变化、预后差相关的大多数(但不专有)psc病例组。然而,病例中最多(155/232,66.8%)为3)具有未突变的tp53和少量cn变化的子宫内膜样ec,或4)表现微卫星不稳定性(microsatellite,msi)的病例。最后两组具有更多可变的结果。
8.尽管进行了这样的综合研究,但是所述确定的分子簇或亚组特异性突变并没有用于测定预后。本文公开的组合物和方法通过检查突变模式、msi状态、cn变化总数和突变负荷(mutation load)如何相互作用来阐明。本公开提供了基于大型临床数据集(clinical data set)开发的聚类预测模型,以及与较低分期子宫内膜样肿瘤的复发的新预后性指标相关的附加发现。另外,所公开的模型和方法可以为了鉴定和验证预后的分子标记而应用于其它病情。
技术实现要素:
9.本发明提供用于测定患有子宫内膜癌(ec)和其它类似病症的个体的预后的方法和组合物。特别地,本发明提供在患有ec的受试者亚组中基于esr1的突变状态,预测生存、预测复发和指导治疗的方法。本发明可以单独使用或与其它临床症状、诊断或指标组合使用,用于测定患有ec或其它类似病症的个体的预后。
10.另外,本发明提供了基于分子簇数据在多种病情中开发预后性模型的方法。
11.因此,一方面,本发明提供了测定受试者的子宫内膜癌的复发风险的方法,所述方法包括:从受试者获得样品;测试样品的esr1基因中的突变;并且如果esr1基因未突变则指示受试者不处于复发风险,或如果esr1基因突变则指示受试者处于复发风险。
12.在一些实施方案中,子宫内膜癌是i/ii期,而在一些实施方案中,i/ii期子宫内膜癌可进一步包含低拷贝数变化和微卫星不稳定性。
13.在一些实施方案中,esr1基因中的突变是y537取代,而在其它实施方案中,esr1基因中的突变是框内缺失。
14.在一些实施方案中,测定受试者的子宫内膜癌的复发风险的方法进一步包括:当esr1基因突变时向受试者施用用于治疗子宫内膜癌的化合物。在一些实施方案中,受试者可以事先经过手术去除子宫内膜肿瘤,而在一些实施方案中,受试者可以为无症状或受试者可以在缓解中。
15.另一方面,本发明提供一种预测患有子宫内膜癌的受试者复发的方法,所述方法包括:从受试者获得样品;测试样品的esr1基因中的突变;并且如果esr1基因突变,则表明受试者将经历癌症复发,并且如果esr1基因未突变,则表明受试者将不会经历癌症复发。
16.在一些实施方案中,子宫内膜癌是i/ii期,而在一些实施方案中,i/ii期子宫内膜癌可进一步包含低拷贝数变化和微卫星不稳定性。
17.在一些实施方案中,esr1基因中的突变是y537取代,而在其它实施方案中,esr1基因中的突变是框内缺失。
18.在一些实施方案中,预测患有子宫内膜癌的受试者复发的方法可进一步包括:当esr1基因突变时向受试者施用用于治疗子宫内膜癌的化合物。在一些实施方案中,受试者可以事先经过手术去除子宫内膜肿瘤,而在一些实施方案中,受试者可以为无症状或受试者可以在缓解中。
19.另一方面,本发明提供了一种用于指导患有子宫内膜癌的受试者的治疗的方法,所述方法包括:从受试者获得样品;测试样品的esr1基因中的突变;并且如果esr1基因突变,则表明受试者应接受化疗。
20.在一些实施方案中,子宫内膜癌是i/ii期,而在一些实施方案中,i/ii期子宫内膜癌可进一步包含低拷贝数变化和微卫星不稳定性。
21.在一些实施方案中,esr1基因中的突变是y537取代,而在其它实施方案中,esr1基因中的突变是框内缺失。
22.在一些实施方案中,指导患有子宫内膜癌的受试者的治疗的方法,可以涉及已经事先经过手术去除子宫内膜肿瘤的受试者,并且在一些实施方案中,受试者可以为无症状或受试者可以在缓解中。
23.一方面,本发明提供了测定受试者的子宫内膜癌的复发风险的方法,所述方法包
括:从受试者获得样品;测试样品的csde1基因中的突变;并且如果csde1基因未突变,则表明受试者不处于复发风险,或如果csde1基因突变,则表明受试者处于复发风险。
24.在一些实施方案中,子宫内膜癌是i/ii期,而在一些实施方案中,i/ii期子宫内膜癌可进一步包含低拷贝数变化和微卫星不稳定性。
25.在一些实施方案中,测定受试者的子宫内膜癌的复发风险的方法进一步包括:当csde1基因突变时向受试者施用用于治疗子宫内膜癌的化合物。在一些实施方案中,受试者可以事先经过手术去除子宫内膜肿瘤,而在一些实施方案中,受试者可以为无症状或受试者可以在缓解中。
26.另一方面,本发明提供了预测患有子宫内膜癌的受试者复发的方法,所述方法包括:从受试者获得样品;测试样品的csde1基因中的突变;并且如果csde1基因突变,则表明受试者将将经历癌症复发,而如果csde1基因未突变,则表明受试者不会经历癌症复发。
27.在一些实施方案中,子宫内膜癌是i/ii期,而在一些实施方案中,i/ii期子宫内膜癌可进一步包含低拷贝数变化和微卫星不稳定性。
28.在一些实施方案中,预测患有子宫内膜癌的受试者复发的方法可进一步包括:当csde1基因突变时向受试者施用用于治疗子宫内膜癌的化合物。在一些实施方案中,受试者可以事先经过手术去除子宫内膜肿瘤,而在一些实施方案中,受试者可以为无症状或受试者可以在缓解中。
29.另一方面,本发明提供了一种用于指导患有子宫内膜癌的受试者的治疗的方法,所述方法包括:从受试者获得样品;测试样品的csde1基因中的突变;并且如果csde1基因突变,则表明受试者应接受化疗。
30.在一些实施方案中,子宫内膜癌是i/ii期,而在一些实施方案中,i/ii期子宫内膜癌可进一步包含低拷贝数变化和微卫星不稳定性。
31.在一些实施方案中,指导患有子宫内膜癌的受试者的治疗的方法,可以涉及已经事先经过手术去除子宫内膜肿瘤的受试者,并且在一些实施方案中,受试者可以为无症状或受试者可以在缓解中。
32.一方面,本发明提供了测定受试者的子宫内膜癌的复发风险的方法,所述方法包括:从受试者获得样品;测试样品的sgk1基因中的突变;并且如果sgk1基因未突变,则表明受试者不处于复发风险,或如果sgk1基因突变,则表明受试者处于复发风险。
33.在一些实施方案中,子宫内膜癌是i/ii期,而在一些实施方案中,i/ii期子宫内膜癌可进一步包含低拷贝数变化和微卫星不稳定性。
34.在一些实施方案中,测定受试者的子宫内膜癌的复发风险的方法进一步包括:当sgk1基因突变时向受试者施用用于治疗子宫内膜癌的化合物。在一些实施方案中,受试者可以事先经过手术去除子宫内膜肿瘤,而在一些实施方案中,受试者可以为无症状或受试者可以在缓解中。
35.另一方面,本发明提供了预测患有子宫内膜癌的受试者复发的方法,所述方法包括:从受试者获得样品;测试样品的sgk1基因中的突变;并且如果sgk1基因突变,则表明受试者将经历癌症复发,而如果sgk1基因未突变,则表明受试者将不会经历癌症复发。
36.在一些实施方案中,子宫内膜癌是i/ii期,而在一些实施方案中,i/ii期子宫内膜癌可进一步包含低拷贝数变化和微卫星不稳定性。
37.在一些实施方案中,预测患有子宫内膜癌的受试者复发的方法可进一步包括:当sgk1基因突变时向受试者施用用于治疗子宫内膜癌的化合物。在一些实施方案中,受试者可以事先经过手术去除子宫内膜肿瘤,而在一些实施方案中,受试者可以为无症状或受试者可以在缓解中。
38.另一方面,本发明提供了一种用于指导患有子宫内膜癌的受试者的治疗的方法,所述方法包括:从受试者获得样品;测试样品的sgk1基因中的突变;并且如果sgk1基因突变,则表明受试者应接受化疗。
39.在一些实施方案中,子宫内膜癌是i/ii期,而在一些实施方案中,i/ii期子宫内膜癌可进一步包含低拷贝数变化和微卫星不稳定性。
40.在一些实施方案中,指导患有子宫内膜癌的受试者的治疗的方法,可以涉及已经事先经过手术去除子宫内膜肿瘤的受试者,并且在一些实施方案中,受试者可以为无症状或受试者可以在缓解中。
41.一方面,本发明提供使用下一代测序检测微卫星不稳定性的方法,包括:获得肿瘤样品和正常样品;使用下一代测序对肿瘤样品和正常样品的微卫星定位进行测序;识别序列中的串联重复序列;从包括串联重复序列的序列中提取覆盖度和总读取值;计算正常样品和肿瘤样品的散度(divergence);计算每个核苷酸位置的δ散度;计算所有δ散度值的和;其中从所有δ散度值的和获得的值表示在正常样品和肿瘤样品之间,测序的微卫星定位的序列散度的量化。在一些实施方案中,一次测序多于一个的微卫星定位。在一些实施方案中,检测微卫星不稳定性的方法可以在历史数据集而不是单个样品上进行。在一些实施方案中,可以进行检测微卫星不稳定性的方法,以便鉴定先前未知的微卫星位点。
42.一方面,本发明提供了一种测定癌症亚型的方法,所述方法包括:包含特定癌症中的已知突变和遗传改变的数据集;根据-bayes模型将已知突变和改变转化为可量化特征;根据特征的卡方值选择最具预测性的特征;根据选择的预测性特征鉴定癌症亚型。
43.在一些实施方案中,所述已知突变和遗传改变包括基因突变和微卫星状态。
44.在一些实施方案中,鉴定的亚型可以表明复发风险增加、无进展生存的可能性降低。另外,鉴定癌症的亚型可以用于指导患有鉴别的癌症亚型的受试者的治疗。在一些实施方案中,根据特定亚型的鉴定对受试者在手术后施用化疗来去除原发性肿瘤。
45.本发明还涉及如下项:
46.1.一种测定受试者中子宫内膜癌的复发风险的方法,所述方法包括:
47.a)从所述受试者获取样品;
48.b)测试所述样品的esr1基因中的突变;和
49.c)如果esr1基因未突变,则表明所述受试者不处于复发风险,或如果esr1基因突变,则表明所述受试者处于复发风险。
50.2.根据项1的方法,其中所述子宫内膜癌是i/ii期。
51.3.根据项2的方法,其中所述i/ii期子宫内膜癌还包括低拷贝数变化和微卫星不稳定性。
52.4.根据项1的方法,其中所述esr1基因中的突变是y537取代。
53.5.根据项1的方法,其中所述esr1基因中的突变是框内缺失(in-frame deletion)。
54.6.根据项1的方法,还包括当所述esr1基因突变时向所述受试者施用用于治疗子宫内膜癌的化合物。
55.7.根据项1的方法,其中所述受试者先前已经进行手术以去除子宫内膜肿瘤。
56.8.根据项1的方法,其中所述受试者是无症状的。
57.9.根据项1的方法,其中所述受试者在缓解中。
58.10.一种预测患有子宫内膜癌的受试者复发的方法,所述方法包括:
59.a)从所述受试者获取样品;
60.b)测试所述样品的esr1基因中的突变;和
61.c)如果esr1基因突变,则表明所述受试者将经历癌症复发,如果esr1基因未突变,则表明所述受试者将不会经历癌症复发。
62.11.根据项10的方法,其中所述子宫内膜癌是i/ii期。
63.12.根据项11的方法,其中所述i/ii期子宫内膜癌还包括低拷贝数变化和微卫星不稳定性。
64.13.根据项10的方法,其中所述esr1基因中的突变是y537取代。
65.14.根据项10的方法,其中所述esr1基因中的突变是框内缺失。
66.15.根据项10的方法,还包括当所述esr1基因突变时向所述受试者施用用于治疗子宫内膜癌的化合物。
67.16.根据项10的方法,其中所述受试者先前已经进行手术以去除子宫内膜肿瘤。
68.17.根据项10的方法,其中所述受试者是无症状的。
69.18.根据项10的方法,其中所述受试者在缓解中。
70.19.一种用于指导患有子宫内膜癌的受试者的治疗的方法,所述方法包括:
71.a)从所述受试者获取样品;
72.b)测试所述样品的esr1基因中的突变;和
73.c)如果esr1基因突变,则表明所述受试者应接受化疗。
74.20.根据项19的方法,其中所述子宫内膜癌是i/ii期。
75.21.根据项20的方法,其中所述i/ii期子宫内膜癌还包括低拷贝数变化和微卫星不稳定性。
76.22.根据项19的方法,其中所述esr1基因中的突变是y537取代。
77.23.根据项19的方法,其中所述esr1基因中的突变是框内缺失。
78.24.根据项19的方法,其中所述受试者先前已经进行手术以去除子宫内膜肿瘤。
79.25.根据项19的方法,其中所述受试者是无症状的。
80.26.根据项19的方法,其中所述受试者在缓解中。
81.27.一种测定受试者的子宫内膜癌的复发风险的方法,所述方法包括:
82.a)从所述受试者获取样品;
83.b)测试所述样品的csde1基因中的突变;和
84.c)如果csde1基因未突变,则表明所述受试者不处于复发风险,如果csde1基因突变,则表明所述受试者处于复发风险。
85.28.根据项27的方法,其中所述子宫内膜癌是i/ii期。
86.29.根据项28的方法,其中所述i/ii期子宫内膜癌还包括低拷贝数变化和微卫星
不稳定性。
87.30.根据项27的方法,还包括当所述csde1基因突变时向所述受试者施用用于治疗子宫内膜癌的化合物。
88.31.根据项27的方法,其中所述受试者先前已经进行手术以去除子宫内膜肿瘤。
89.32.根据项27的方法,其中所述受试者是无症状的。
90.33.根据项27的方法,其中所述受试者在缓解中。
91.34.一种预测患有子宫内膜癌的受试者复发的方法,所述方法包括:
92.a)从所述受试者获取样品;
93.b)测试所述样品的csde1基因中的突变;和
94.c)如果csde1基因突变,则表明所述受试者将经历癌症复发,并且如果csde1基因未突变,则表明所述受试者将不会经历癌症复发。
95.35.根据项34的方法,其中所述子宫内膜癌是i/ii期。
96.36.根据项35的方法,其中所述i/ii期子宫内膜癌还包括低拷贝数变化和微卫星不稳定性。
97.37.根据项34的方法,还包括当所述csde1基因突变时向所述受试者施用用于治疗子宫内膜癌的化合物。
98.38.根据项34的方法,其中所述受试者先前已经进行手术以去除子宫内膜肿瘤。
99.39.根据项34的方法,其中所述受试者是无症状的。
100.40.根据项34的方法,其中所述受试者在缓解中。
101.41.一种用于指导患有子宫内膜癌的受试者的治疗的方法,所述方法包括:
102.a)从所述受试者获取样品;
103.b)测试所述样品的csde1基因中的突变;和
104.c)如果csde1基因突变,则表明所述受试者应接受化疗。
105.42.根据项41的方法,其中所述子宫内膜癌是i/ii期。
106.43.根据项42的方法,其中所述i/ii期子宫内膜癌还包括低拷贝数变化和微卫星不稳定性。
107.44.根据项41的方法,其中所述受试者先前已经进行手术以去除子宫内膜肿瘤。
108.45.根据项41的方法,其中所述受试者是无症状的。
109.46.根据项41的方法,其中所述受试者在缓解中。
110.47.一种测定受试者的子宫内膜癌的复发风险的方法,所述方法包括:
111.a)从所述受试者获取样品;
112.b)测试所述样品的sgk1基因中的突变;和
113.c)如果sgk1基因未突变,则表明所述受试者不处于复发风险,或如果sgk1基因突变,则表明所述受试者处于复发风险。
114.48.根据项47的方法,其中所述子宫内膜癌是i/ii期。
115.49.根据项48所述的方法,其中所述i/ii期子宫内膜癌还包括低拷贝数变化和微卫星不稳定性。
116.50.根据项47的方法,还包括当所述sgk1基因突变时,向所述受试者施用用于治疗子宫内膜癌的化合物。
117.51.根据项47的方法,其中所述受试者先前已经进行手术以去除子宫内膜肿瘤。
118.52.根据项47的方法,其中所述受试者是无症状的。
119.53.根据项47的方法,其中所述受试者在缓解中。
120.54.一种预测患有子宫内膜癌的受试者复发的方法,所述方法包括:
121.a)从所述受试者获取样品;
122.b)测试所述样品的sgk1基因中的突变;和
123.c)如果sgk1基因突变,则表明所述受试者将经历癌症复发,并且如果sgk1基因未突变,则表明所述受试者将不会经历癌症复发。
124.55.根据项54的方法,其中所述子宫内膜癌是i/ii期。
125.56.根据项55所述的方法,其中所述i/ii期子宫内膜癌还包括低拷贝数变化和微卫星不稳定性。
126.57.根据项54的方法,其进一步包括:当所述sgk1基因突变时向所述受试者施用用于治疗子宫内膜癌的化合物。
127.58.根据项54的方法,其中所述受试者先前已经进行手术以去除子宫内膜肿瘤。
128.59.根据项54的方法,其中所述受试者是无症状的。
129.60.根据项54的方法,其中所述受试者在缓解中。
130.61.一种用于指导患有子宫内膜癌的受试者的治疗的方法,所述方法包括:
131.a)从所述受试者获取样品;
132.b)测试所述样品的sgk1基因中的突变;和
133.c)如果sgk1基因突变,则表明所述受试者应接受化疗。
134.62.根据项61所述的方法,其中所述子宫内膜癌是i/ii期。
135.63.根据项62所述的方法,其中所述i/ii期子宫内膜癌还包括低拷贝数变化和微卫星不稳定性。
136.64.根据项61所述的方法,其中所述受试者先前已经进行手术以去除子宫内膜肿瘤。
137.65.根据项61的方法,其中所述受试者是无症状的。
138.66.根据项61所述的方法,其中所述受试者在缓解中。
139.67.一种使用下一代测序检测微卫星不稳定性的方法,所述方法包括:
140.a)获得肿瘤样品和正常样品;
141.b)使用下一代测序对肿瘤样品和正常样品的微卫星定位进行测序;
142.c)识别所述序列中的串联重复序列;
143.d)从包括串联重复序列的序列中提取覆盖度和总读取值;
144.e)计算正常样品和肿瘤样品的散度;
145.f)计算每个核苷酸位置的δ散度;
146.g)计算所有δ散度值的和;
147.其中从所有δ散度值的和获得的值表示在测序的微卫星定位处的正常样品与肿瘤样品之间的序列散度的量化。
148.68.根据项67的方法,其中一次对一个以上的微卫星定位进行测序。
149.69.一种测定癌症亚型的方法,所述方法包括:
150.a)包含特定癌症中的已知突变和遗传改变的数据集;
151.b)根据-bayes模型将已知突变和改变转化为可量化特征;
152.c)根据特征的卡方值选择最具预测性的特征;
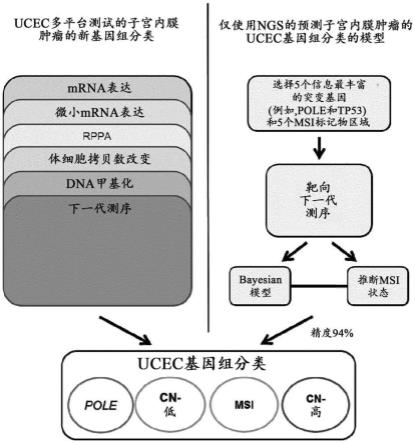
153.d)根据所选择的预测性特征识别癌症亚型。
154.70.根据项69的方法,其中所述已知突变和遗传改变包括基因突变和微卫星状态。
155.71.根据项69的方法,其中所述鉴定的亚型表明复发风险增加。
156.72.根据项69的方法,其中所述鉴定的亚型表明无进展生存的可能性降低。
157.73.根据项69的方法,其中所述癌症的亚型鉴别用于指导患有所述鉴别的癌症亚型的受试者的治疗。
158.74.根据项73的方法,其中所述受试者在手术后施用化疗以除去原发性肿瘤。
附图说明
159.图1显示基于多平台测试和聚类算法(左)的子宫内膜肿瘤的基因组分类,以及具有94%准确度的预测相同基因组分类的模型(右),所述模型使用五个突变基因的二元制(binary)突变状态和微卫星不稳定状态。
160.图2显示突出了在子宫内膜癌中的基因组分类的分布的视觉表现。i/ii期病例大多数(74%)分为cn-低或msi。在这个不确定的子集(subset)中,发现了在已复发病例中以较高速率突变的基因(例如esr1)。iii期/iv期病例以cn-高分类占主导地位,且预后通常较差。
161.图3示出显示子宫内膜癌的无病生存率的kaplan-meier曲线。图3a显示全部病例,而图3b仅绘出由i/ii期病例组成的子集。较浅、较低的线描绘了具有突变esr1的病例,而较深、较高的线描绘了具有野生型esr1的病例。
162.图4说明了用于从ngs读数来量化微卫星不稳定性的示例性方法。
163.图5显示来自jsi-seqnext软件(a)的直方图图像,其显示正常样品的测序覆盖度,黑色箭头指出两个微卫星区域。还示出了由msi检测方法(b)产生的图像。扩增子/感兴趣区域的核苷酸位置(i)位于x轴上。黑色箭头作为覆盖度直方图的精确表现的参照。以核苷酸数(y1轴)测量正常样品覆盖度(红色,较高线)和肿瘤样品覆盖度(绿色,中间的线)。由y2轴上的整数值指出δ散度(蓝色,较低线)(公式3)。
164.图6显示了显示微卫星稳定的感兴趣区域(roi)的样品的示例。利用毛细管电泳移动肿瘤(t)和正常(n)样品以测定5个msi标记(上)。在肿瘤和正常样品中,均在高功率(左下)可见单峰,表明稳定的微卫星(mss)模式。msi检测方法(右下)检测到低散度(蓝色,较低线),确认了结果。
165.图7示出了显示微卫星不稳定的感兴趣区域(roi)的样品的示例。利用毛细管电泳移动肿瘤(t)和正常(n)样品以测定5个msi标记(上)。在肿瘤和正常样品中,均在高功率(左下)可见轻微的双峰(bimodal peak),表明在该区域中有msi。msi检测方法(右下方)检测到高散度(蓝色,较低线),确认了结果。
166.图8显示了三个基因中每一个基因的fisher精确检验结果,在所述三个基因中突变与在i/ii期、cn-低/msi亚组中的复发显著相关。
具体实施方式
167.本文提供了用于检测i/ii期子宫内膜癌中的esr1突变并根据突变状态预测个体预后的方法。另外,提供用于患有esr1突变子宫内膜癌或类似病症的患者的诊断、预后、管理和治疗决定的方法。更一般而言,本发明提供用于诊断和预测癌症患者,特别是那些患有子宫内膜癌的患者的方法和模型。所公开的方法可以基于个体的具体的分子或遗传图谱来改善个体的预后。确定个体的疾病预后或复发的可能性,可以改善治疗结果并增加生存。
168.本文还提供了开发一种模型来鉴定可用于疾病的诊断或预后的分子簇的方法。开发这样的模型可以包括将与mrna表达相关的数据、microrna表达、体细胞拷贝数改变、dna甲基化、测序(包括sanger和下一代测序)以及反相蛋白质阵列与其它分子诊断技术相结合。通过利用本文公开的数据分析步骤,本领域技术人员可以基于分子簇谱(molecular cluster profiles)开发用于预测各种疾病的预后有用的模型。
169.应当理解,所述方法不限于所描述的特定实施例,并且可以变化。还应当理解,本文使用的专业术语仅用于描述特定实施例的目的,而不是限制性的。本技术的范围将仅由所附的权利要求限制。
170.如本文所使用的,“约”表示加或减10%。
171.如本文所使用的,“可选”或“可选地”是指随后描述的事件或状况可以发生或可以不发生,并且该描述包括所述事件或状况发生的情况及其不发生的情况。
172.如本文中所使用的,术语“样品”、“试验样品”或“生物样品”是指源自认为具有子宫内膜癌的个体的任何液体或固体材料。在优选的实施方案中,试验样品获取自生物来源,如来自动物(最优选人)的培养中的细胞或组织或液体样品。本发明的优选样品包括但不限于:活检、抽吸物(aspirates)、血浆、血清、全血、血细胞、淋巴液、脑脊液、滑液、尿液、唾液和皮肤或其它器官(例如活检材料)。本文所用的术语“患者样品”也可以指获取自寻求诊断或治疗子宫内膜癌或相关病症或疾病的人的组织样品。这些术语中的每一个可以互换使用。
173.如本文中所使用的,“具有增加的风险”是指与一般群体相比,被鉴别为具有高于正常的癌症发展可能性的受试者。此外,曾患有癌症或目前患有癌症的受试者,为具有增加的癌症发展风险的受试者,因为这样的受试者可能会继续发展癌症。目前患有或曾患有肿瘤的受试者也具有增加的肿瘤转移风险。
174.如本文所使用的,“测定预后”是指在该过程中预测患者的病症的过程或结果。术语“预后”并不是指以100%的准确度来预测病症的过程或结果的能力。相反,该术语是指,鉴定与未显示该病症的个体相比,在呈现给定病症/标记物的患者中发生特定的过程或结果的概率的增加或减少。预后的性质取决于具体的疾病和被评估的病症/标志物。例如,可以将预后表示为:可以预期患者存活的时间量、疾病进入缓解或经历复发的可能性、或可以预期疾病在复发前保持缓解的时间量。
175.在整个本技术中引用了各种出版物。这些出版物的全部内容的公开内容通过引用并入本技术中,以更充分地描述相关的本领域的技术状态。通过引用,公开的参考文献也将其中包含的在该参考文献依据的语句中所讨论的材料单独和专门地并入本文中。
176.本文公开了用于癌症的诊断和预后评估的方法。还公开了治疗癌症的方法。一方面,在需要诊断或预后信息的不同受试者中,确定基因(和/或微卫星的稳定性)或蛋白质的
表达以便提供癌症谱。
177.在癌组织内,不同的表达谱可以指示不同的预后状态(例如良好的长期生存前景或较差的长期生存前景)。通过比较不同状态下癌组织的谱,可以获得关于以下的信息:在这些状态中的每一种中,哪些基因是重要的(包括基因的上调和下调两者和/或突变)。鉴定在癌组织中差异表达的序列以及导致不同预后性结果的差异表达,对确定患者治疗有临床价值。
178.具体治疗方案可以根据是否改善给定的患者的结果(指能降低复发风险或增加无进展生存的可能性)来评估。例如,一般用辅助放疗治疗早期子宫内膜样癌,而用化疗治疗通常更具攻击性的浆液性肿瘤。然而,具有早期子宫内膜样肿瘤的个体的某些子集即使在用辅助放疗治疗后,也将经历疾病复发和可能死亡。能够鉴定敏感亚群的诊断和预后方法对于确定用于这些个体的适当治疗过程至关重要。
179.癌症的遗传谱(genetic profile):
180.在一些实施方案中,本公开提供了用于根据特定分子谱确定患有癌症的个体的预后的方法。谱可以包括但不限于:特异性致癌基因例如pole、pten、tp53、fbxw7、rpl22、fgfr2、pik3ca、和/或esr1、csde1和/或sgk1的突变状态、微卫星状态、拷贝数(cn)状态。可以基于这些因素的组合将个体分成亚组或子集。举例来说,在子宫内膜癌中,亚组可以定义为有pole突变并具有高突变率。该组可能具有有利的预后,而体现为tp53突变和高cn变化的另一亚组可能具有不良的预后。
181.微卫星稳定性
182.微卫星位点(microsatellite locus)是具有长度为1至5个碱基对的重复单元的简单串联重复序列的基因组dna的区域。数十万个这样的微卫星位点分散于整个人类基因组。微卫星位点基于最小重复单元的长度分类。例如,具有长度为1~5个碱基对的重复单元的位点分别被称为“单核苷酸”、“二核苷酸”、“三核苷酸”、“四核苷酸”和“五核苷酸”重复位点。
183.微卫星不稳定性(msi)是一种遗传缺陷,其中的基因组的局部重复延伸(称为“微卫星”)由于聚合酶在dna复制期间的滑脱而大小不同。msi是人类癌症的子集的特征,其具有诊断性、预后性和治疗性的后果。与其它亚型相比,msi阳性结直肠癌(crc)具有有利的预后,并能对辅助化疗有较差反应。
184.对于大多数二倍体物种的正常基因组dna(例如来自哺乳动物物种的基因组dna)的每个微卫星位点,在每个位点包括两个等位基因。两个等位基因的长度可以彼此相同或不同,并且从一个个体到另一个个体之间可以不同。在给定个体及其后代中,微卫星等位基因通常保持恒定长度;但在某些肿瘤类型中已观察到微卫星的长度的不稳定性。这种肿瘤中的基因组不稳定性的形式称为微卫星不稳定性。
185.msi的分子基础是错配修复(mmr)蛋白包括mlh1、msh2、msh6和pms2中的一种或多种的突变、基因缺失或表观遗传沉默。这些mmr遗传改变可以以种系突变形式(如在lynch综合征/遗传性非息肉性结肠直肠癌中)发生,或以在肿瘤发展期间发生的散在的变化形式发生。
186.现在推荐对患有结肠癌的患者进行林奇综合征的通用筛选;然而这种筛选可能也适用于子宫内膜癌。lynch筛选策略包括通过pcr和/或免疫组织化学(ihc)的msi检测,来检
测组织切片中的错配修复蛋白的表达损失。用msi pcr和ihc两者的平行试验可提供最稳健的结果(yield)。
187.用于检测msi pcr的主要方法是,对宏观解剖(macrodissected)的正常/非肿瘤组织与肿瘤组织的配对样品中的5个微卫星位点的扩增模式进行比较。用于pcr分析的5个微卫星最经常的是nci指定小组(nci-designated panel),其包括两个单核苷酸位点big adenine tract:bat-25和bat-26,以及三个二核苷酸位点(d2s123、d5s346和d17s250)。
188.其它的msi的检测方法为本领域已知,本领域技术人员可以确定与本文公开的那些方法一起使用何种方法。举例来说,dna测序表示一种通过直接评估正常肿瘤配对样品中的微卫星的长度来检测msi的替代方法。通过利用dna测序对微卫星进行归类,可以设计一个单独的分析来同时检测msi和突变状态。然而,将原始序列读段转换为msi状态的方法尚未得到充分验证。与本文报导方法不同的已经报导用于检测测序数据中的微卫星的其它方法,包括beifant等人,2013和kim,laird&park,2013,其通过引用并入本文。
189.与非肿瘤组织相比,当在肿瘤样品中5个基因座中至少有2个显示出大小变化时诊断为msi。其通常利用毛细管凝胶电泳电泳图的视觉解释来评估。因此,利用pcr的msi调用(call)偶尔可以是主观的,特别是当5个测试的位点中仅有1个观察到明确的异常pcr扩增时,该发现称为msi-低。
190.已经鉴定并推荐了许多信息丰富的微卫星位点用于msi测试,因此本领域技术人员将能确定在特定情况下(即,与特定类型的癌症相关联的那些微卫星),怎样的微卫星的组合适合进行测试。可以使用多种标记来增加检测的力度,且多种标记可以与所公开的方法结合使用。为了增加任何给定类型的癌症的msi测定的特异性,推荐有至少五个信息非常丰富的微卫星位点的组。通过放大和分析更多数量的位点产生的增加的信息,通常导致对解释测试结果的置信度和准确性增加。
191.在对肿瘤进行下一代测序(ngs)研究中,已经确定具有msi的肿瘤病例在序列比对过程期间产生读取丢弃(dropout)的模式,其为特征性并且有别于可观察到的其它的序列改变。本文公开的是新设计并验证的检测这种比对模式的过程,其允许使用ngs数据精确测定msi状态。
192.拷贝数变化
193.拷贝数变化(cn)是一种基因组的结构变化的形式,其导致细胞具有dna的一个或多个部分的异常数量的拷贝。在给定的染色体上dna区域可能被删除或复制。
194.cn通常稳定并可遗传,但在发展期间也可能从头产生。像其它类型的遗传变异一样,已经将一些cn与易感性或对疾病的抗性相联系,且在癌症例如子宫内膜癌中通常使基因拷贝数升高。
195.pole
196.pole(hgnc:9177,gene id:5426,ng_033840.1)编码dna聚合酶ε的催化亚基该酶参与dna修复和染色体dna复制。已经将该基因的突变与大肠癌、子宫内膜癌、面部畸形、免疫缺陷、青斑和矮小症相联系。
197.pten
198.pten(hgnc:9588,gene id:5728,ng_000305.3)被鉴定为在大量癌症中以高频突变的肿瘤抑制因子。编码该基因的蛋白质为磷脂酰肌醇-3,4,5-三磷酸3-磷酸酶。其包含张
力蛋白样结构域和与双特异性蛋白酪氨酸磷酸酶的催化结构域相似的催化结构域。与大多数蛋白酪氨酸磷酸酶不同,该蛋白质优先使磷酸肌醇底物去磷酸化。它在细胞中负调节磷脂酰肌醇-3,4,5-三磷酸的细胞内水平,并通过负调节akt/pkb信号通路作为肿瘤抑制因子发挥作用。
199.tp53
200.tp53(hgnc:11998,gene id:7157,ng_017013.2)编码含有转录激活域、dna结合域和寡聚化结构域的肿瘤抑制蛋白。编码的蛋白质响应多种多样的细胞应激来调节靶基因的表达,从而诱导细胞周期阻滞、凋亡、衰老、dna修复或代谢的变化。该基因的突变与多种人类癌症相关,包括遗传性癌症如li-fraumeni综合征。该基因的可变剪接(alternative splicing)和选择性启动子(alternate promoter)的使用导致多种转录变异和同种型。额外的同种型也已经证明是由使用选择性翻译起始密码子而产生的。
201.fgfr2
202.fgfr2(hgnc:3689,gene id:2263,ng_012449.1)编码成纤维细胞生长因子受体2,成纤维细胞生长因子受体家族的成员,其具有在成员之间和整个进化中高度保守的氨基酸序列。fgfr家族成员彼此不同在于它们的配体亲和力和组织分布。全长代表性蛋白质包括由三个免疫球蛋白样结构域、单个疏水跨膜片段和细胞质酪氨酸激酶结构域组成的细胞外区域。蛋白质的细胞外部分与成纤维细胞生长因子相互作用,启动(setting in motion)下游信号的级联,最终影响有丝分裂和分化。取决于同种型,这个特定的家族成员是对于酸性、碱性和/或角质形成细胞生长因子的高亲和受体。在其它病理病症之中,该基因的突变与crouzon综合征、pfeiffer综合征、颅缝早闭症(craniosynostosis)、apert综合征、jackson-weiss综合征、beare-stevenson cutis gyrata综合征、saethre-chotzen综合征、综合征型颅缝早闭和子宫内膜癌相关。关于该基因已经注意到编码不同同种型的多个可变剪接的转录剪接体。
203.pik3ca
204.pik3ca基因(hgnc:8975,gene id:5290,ng_0121113.2)编码p110α蛋白或磷脂酰肌醇-4,5-二磷酸3-激酶、催化亚基α。最近的证据表明pik3ca基因在一系列人类癌症包括但不限于:宫颈癌和子宫内膜癌中突变。磷脂酰肌醇3-激酶包含85kda的调节亚基和110kda的催化亚基。由该基因编码的蛋白质代表使用atp来磷酸化ptdins、ptdins4p和ptdins(4,5)p2的催化亚基。
205.fbxw7
206.fbxw&基因(hgnc:16712,gene id:55294,ng_029466.1)编码f-box蛋白家族的成员,该成员特征在于约40个氨基酸的基序即所述f-box。f-box蛋白构成称为scf(skp1-cullin-f-box)的泛素蛋白连接酶复合物的四个亚基之一,该亚基在磷酸化依赖性泛素化中发挥作用。f-box蛋白分为3类:含有wd-40结构域的fbws、含有富亮氨酸重复序列的fbs、和含有不同蛋白质-蛋白质相互作用模块或没有可识别的基序的fbx。该基因编码的蛋白质以前称为fbx30,属于fbws类;该蛋白质除了f-box之外还包含7个串联wd40重复序列。该蛋白直接与细胞周期蛋白(cyclin)e结合,并且可能靶向细胞周期蛋白e用于泛素介导的降解。在卵巢和乳腺癌细胞系中检测到该基因的突变,意味该基因在人类癌症的发病机理中发挥潜在作用。关于该基因已经发现了编码不同同种型的多个转录剪接体。
207.rpl22
208.rpl22基因(hgnc:10315,gene id:6146,nc_000001.11)编码作为60s亚基的组分的细胞质核糖体蛋白。该蛋白属于核糖体蛋白l22e家族。其起始甲硫氨酸残基在翻译后去除。该蛋白质可以特异性结合epstein-barr病毒编码的rna(eber)1和2。已显示小鼠蛋白能够结合肝素。存在利用选择性polya信号的转录剪接体。如编码核糖体蛋白的基因常见的,该基因的多个加工假基因(processed pseudogenes)分散于整个基因组中。先前认为该基因映射到3q26,且其在一些具有3;21易位的治疗相关性骨髓增生异常综合征(myelodysplastic syndrome)患者中与位于21q22的急性骨髓性白血病1(acute myeloid leukemia 1)(aml1)基因融合;然而,这些融合实际上涉及位于3q26的核糖体蛋白l22假基因,且该基因实际上映射到1p36.3-p36.2。
209.雌激素受体-α(esr1)
210.esr1基因(hgnc:3467,gene id:2099,genbank:x03635.1,ng_008493.1)编码雌激素受体,一种由数个对激素结合、dna结合和激活转录重要的结构域组成的配体激活转录因子。蛋白质定位于细胞核,在细胞核中它可以与雌激素受体2形成同二聚体或杂二聚体。雌激素及其受体对于性发育和生殖功能至关重要,且也在其它组织如骨骼中发挥作用。雌激素受体也参与包括以下的病理过程:乳腺癌、子宫内膜癌和骨质疏松症。选择性启动子使用和可变剪接导致数十种转录剪接体,但是许多这些变体的全长特性尚未确定。esr1基因位于染色体6上。
211.csde1
212.csde1基因(hgnc:29905,gene id:7812,nc_000001.11)编码含有e1的称为冷休克域的rna结合蛋白。这种蛋白质是内部启动人鼻病毒rna翻译必需的,且其可能参与翻译耦合的mrna周转。在细胞质脱腺苷化/由不稳定性(mcrd)域的主要编码区决定簇介导的fos mrna的翻译和衰变相互作用(decay interplay)中,也已经将csde1与其它rna结合蛋白相关联。
213.sgk1
214.sgk1基因(hgnc:10810,gene id:6446,nc_000006.12)编码在细胞应激反应中起重要作用的丝氨酸/苏氨酸蛋白激酶。该激酶激活特定的钾、钠和氯通道,启示其参与如细胞生存、神经元兴奋性和肾脏排钠(renal sodium excretion)的调节过程。该基因的高水平表达可能有助于如高血压和糖尿病肾病的病症。关于该基因已经注意到编码不同同种型的数个可变剪接的转录剪接体。
215.微卫星不稳定性的下一代测序:
216.从具有msi的肿瘤中读段的ngs在比对过程中产生丢弃的模式,其为特征性并且有别于其它的序列改变。如本文所公开的,该发现已经被用于设计一种msi状态分型的方法,并将结果与基于金标准pcr的毛细管电泳分级方法进行比较。
217.对于msi的目前的金标准方法依赖于通过目视检查毛细管电泳产生的pcr峰。在一个方面,本公开发明提供了一种基于来自ngs读段的比对模式定义msi的方法。在正常/非肿瘤样品与源于来自具有癌症的患者的组织样品的测序读段中的覆盖度差异,可以基于ngs数据数学性计算。
218.在分析之前,处理测序数据以识别测序读段中的短串联重复序列(str)核苷酸区
域的开始和末端索引。用于识别str的各种工具和程序为本领域已知,并且可以在线获得。编程脚本可用于从分析创建包含全部感兴趣区域(roi)的文件。该脚本然后可以识别串联重复序列,并报告str域的列表和这些域的索引。
219.在一个实施方案中,该方法包括从仅对于在通过串联重复序列查找器报告的索引中的核苷酸序列的读取文件中,提取覆盖度和总读取值。在一些实施方案中,对正常样品(n)实施了一次、并对肿瘤样品(t)实施了一次以下算法(公式1),开始于索引的核苷酸重复序列(例如在图4中,“共有序列”行的突出显示区域)。
220.(公式1)dni=
│
(ci–
tri)/tri│
*100
221.公式1(eq1)可以通过从感兴趣区域(roi)中检测到的总读数(tr)中,减去测序读段中的核苷酸位置(i)的覆盖度来计算正常样品的散度(d),然后除以tr并取绝对值。将结果乘以100,给出1-100之间的正整数值。然后公式2(eq2)可以对肿瘤样品(t)实行相同的计算。
222.(公式2)dti=
│
(c
i-tri)/tri│
*100
223.(公式3)δdi=
│
dti–
dni│
224.(公式3)∑δd
i(str)
225.公式3(eq3)可以通过从正常散度(dn)减去肿瘤散度(dt)并取绝对值来计算每个核苷酸位置(i)的δ散度(δd)。公式4(eq4)计算所有δd值的和(reimann和(riemann sum))。获得的值表示在微卫星上的正常样品和肿瘤样品之间的序列散度的定量,因此表示在该位点的msi水平。
226.在一些实施方案中,用于检测msi的公开方法在msi的已知位点上进行。在一些实施方案中,用于检测msi的公开方法可用于在任何给定肿瘤样品中鉴定新微卫星位点。
227.在一些实施方案中,与传统的基于pcr的方法相比,本文提供的用于msi测定的ngs方法,可以精确定量正常肿瘤配对样品中的微卫星不稳定性。
228.在一些实施方案中,本文提供的用于msi测定的ngs方法检测基因组中的微卫星不稳定性的新区域。
229.在一些实施方案中,本文提供的用于msi测定的ngs方法可以在单次分析中同时检测突变和msi状态。在一些实施方案中,在结肠直肠癌(crc)或子宫内膜癌(ec)中为了治疗选择的目的,本文提供的用于msi测定的ngs方法确定msi状态。
230.用于确定癌症中的有限(limited)基因集亚型的方法:
231.本文公开了用于鉴定和研发癌症的有限基因集亚型的新方法,所述方法可能有助于确定患者预后的各种方面(包括复发和/或缓解的可能性及无进展生存的可能性),且关于对给定患者的最佳治疗过程和/或治疗的时机这些方法可能有指导性。
232.在一些实施方案中,可以并入来自各种数据库的msi状态和突变数据。在一些实施方案中,突变状态或遗传/分子改变被转化为可量化特征。举例来说,可以将任何基因的突变状态考虑为二元特征:突变或非突变,而可以将msi状态认为是0=mss,1=msi-低,2=msi-高。
233.可以使用数据挖掘软件来构建-bayes模型来预测来自给定数据集的分子亚组,且特征选择可以使用本领域已知的卡方特征选择方法或其它适当的统计方法在数据集上进行。特征选择方法将表明具有最佳模型准确性的模型,并可以基于多个特征来划分
子组。举例来说,数据分析可能揭示:包含5个基因和msi状态(总共6个特征)的模型具有最佳模型准确性。模型可以包括1-50个之间的特征。举例来说,模型可以包括约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个特征。
234.在一个示例性实施方案中,ec中五个对亚型分类最信息丰富的基因(按有意义的顺序)可以为tp53、pole、pten、fbxw7和rpl22。在一些实施方案中,可以将这5个基因和msi状态用作在-bayes分类实验中预测亚簇的特征。
235.亚型预测的平均准确度不需要为100%,以便提供临床益处。举例来说,亚型预测可以为80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100%准确。在一些实施方案中,亚型预测模型优选》90%准确。举例来说,在一个示例性实施例中,用于分类ec的6特征模型在测定ec的亚型中为94%准确,具备的平均精度和检索率(recall)分别为0.971
±
0.07和0.970
±
0.04。最大假阳性率为0.11。
236.在一些实施方案中,本文提供的用于msi测定的ngs方法可以在单次分析中同时检测突变和msi状态。在其它实施方案中,这些方法可基于由公开的方法确定的分子谱,用于鉴定具有相似的预后性结果的癌症患者亚组。在一些实施方案中,这些方法可以用于指导结肠直肠癌(crc)或子宫内膜癌(ec)中的治疗选择(包括治疗的选择和治疗时机)的目的。
237.在一些实施方案中,使用将ngs推导的msi状态与突变特征组合的方法来推导新的癌症分子分型和预后模型。例如,本文提供用于子宫内膜癌的分子亚型分型的5基因+msi状态模型。
238.子宫内膜癌分期和分子簇:
239.子宫内膜癌(ec)涵盖具有可变的临床结果的常见的子宫内膜样组织学亚型,及具有一致的不良预后的较不常见的乳头状浆液/透明细胞癌(psc)。ec的主要未满足的诊断需要是:确定具有复发风险并可从辅助化疗获益的较低分期子宫内膜样组织学的病例,或在比在本发明前应事先施用的阶段更早期的阶段进行治疗。举例来说,通过在手术切除肿瘤后接受化疗(即使受试者似乎在缓解中),具有i/ii期子宫内膜癌的个体(例如具有esr1突变的那些)的一些子集可以受益。
240.已经鉴定了四种不同的ec分子簇。这些分子簇包括一组具有极高突变率和有利的预后的pole突变病例,以及一组具有tp53突变、频繁的基因组拷贝数(cn)变化和预后不良的最有可能但不排他的psc病例。然而,大多数病例(66.8%)呈现具有更多可变的结果。这些病例包括:具有未突变的tp53和少量cn变化的子宫内膜样ec的组,或具有微卫星不稳定性(msi)的组。本文公开的是突变模式、msi状态、cn变化的总数和突变负荷如何相互作用,来预测临床相关i/ii期子宫内膜样病例的结果和复发的细节。
241.分期是在该过程中医生将根据观察性信息和癌症可能扩散了多少来分类肿瘤的过程。在分期中考虑的因素包括:肿瘤的程度、癌症是否已经扩散到淋巴结以及癌症是否已经扩散到远隔部位。在选择治疗方案中,子宫内膜癌的阶段是最重要的因素,并且通常基于在手术期间移除的组织的检查来对癌症分期。也可以将这种类型的手术分期与其它诊断技术例如超声、mri或ct扫描进行配对,以寻找扩散的迹象。然而,这种类型的分期未能考虑到特定个体的癌症的分子谱。
242.举例来说,虽然具有i/ii期子宫内膜癌的许多个体仅基于分期可以给予积极预期,但是这些个体中的一些将最终疾病复发,且有一些可能死于疾病发展。本文提供了基于
个体的癌症的分子谱来创建用于预测预后、复发和/或生存的模型的方法。在一个实施方案中,这样的预后的方法可以包括:测定具有i/ii期子宫内膜癌的个体是否在esr1基因中具有突变。
243.ec中的预测性预后分子簇:
244.可以对一组肿瘤样品进行数据分析,以确定是否存在预后分子簇。例如,检测了来自232例具有ec的患者的样品,包括子宫内膜样亚型155例,且这些病例中有127例为i/ii期。在给定数据集中可以检测的预后信息可以包括但不限于:复发和结果。对于子宫内膜癌,总体复发率为19%(45/232),报告有23例死亡(10%)。在整个数据集中,在cn-高组中复发更常见(22/60;37%),且在pole突变组中未发生复发。
245.一旦已经确定了预后信息,就可以基于具有相似结果的患者的分子谱开发模型来鉴定他们的特定子集。
246.对于子宫内膜癌,为用于过滤5个最显著突变(卡方检验的)的基因和msi状态的模型。该模型可以以96%的准确度预测四种先前报告的结果簇。然而,当将分析限制于i/ii期子宫内膜样亚组(p=0.41)时,kaplan-meier分析对二元制msi状态和cn类没有显示显著的结果预测能力。这是一个感兴趣的患者亚组,因为他们中的大多数将不会接受侵袭性化疗来预防手术治疗后复发;因此,仅鉴定那些可从化疗受益的个体将是有临床价值的。
247.在较低分期病例中,每例病例的突变数明显更低(p《0.01),但与复发不相关。在子宫内膜样病例中,根据临床分期或复发状态不同,在ec中的常见突变致癌基因包括pten和pik3ca没有显著的差异突变。
248.然而,在i/ii期子宫内膜样亚组中,在ec中以前未充分研究的几种其它基因发生了差异突变。这些基因包括雌激素受体-α基因(esr1),在该基因中突变与复发为差异相关(p《0.01,费舍尔精确检验(fisher's exact))。在该亚组中,微阵列分析上更高的cn改变分数也与复发显著相关(p《0.01,student’s t检验)。较低分期子宫内膜样病例中的基因组复杂性与tp53突变(124/127未突变)或tp53丢失(126/127无缺失)不相关,意味其它的基因组维持改变(genome maintenance alteration)。
249.在较低分期子宫内膜样肿瘤中,包括esr1、csde1和sgk1在内的一小组基因的基因组复杂性和突变状态是有前景的复发风险预测因子。esr1突变先前已被鉴定为转移性乳腺癌中侵袭性疾病的标志物,但在ec中未鉴定。因此,esr1、csde1和sgk1可用于预测患有i/ii期子宫内膜癌的患者的预后,包括复发的可能性和无进展生存。
250.因此,在一些实施方案中,本公开提供了预测患有子宫内膜癌的受试者的方法,所述方法包括:从受试者获得样品;测试样品的esr1、csde1和/或sgk1基因中的突变;如果esr1、csde1和/或sgk1基因不突变,则表明受试者将经历无进展生存,或者如果esr1、csde1和/或sgk1基因突变,则表明受试者将具有降低的无进展生存的机会。
251.在其它实施方案中,本公开提供预测患有子宫内膜癌的受试者复发的方法,所述方法包括:从受试者获得样品;测试样品的esr1、csde1和/或sgk1基因中的突变;并且如果esr1、csde1和/或sgk1基因突变,则表明受试者将经历癌症复发,而如果esr1、csde1和/或sgk1基因未突变,则表明受试者将不会经历癌症复发。
252.在一个实施方案中,基于esr1、csde1和/或sgk1突变的存在,对传统上将不施用化疗的i/ii期子宫内膜癌的受试者施用化疗。在另一个实施方案中,基于esr1、csde1和/或
sgk1突变的存在,可以对无症状的受试者施用适当的治疗剂,如化疗。在另一个实施方案中,基于esr1、csde1和/或sgk1突变的存在,可以对在缓解中的受试者施用适当的治疗剂,如化疗。
253.在一个实施方案中,基于受试者的分子谱对受试者施用适当的治疗剂以:消除受试者的癌症或降低肿瘤的大小或肿瘤数量;阻止或减缓受试者的肿瘤的生长;抑制或减缓受试者的新肿瘤或肿瘤转移的发展;和/或降低目前患有或以前患有癌症的受试者的症状和/或复发的频率或严重程度。在一些实施方案中,受试者的分子谱可以包括在esr1、csde1和/或sgk1基因中的突变。
254.在一些实施方案中,可以一起分析esr1、csde1和sgk1,以在单个测试中确定每个基因的突变状态。这样的组合测试可用于确定患者预后、复发风险、总体生存、无进展生存,和/或用于指导对患者的治疗。在其它实施方案中,可以分别分析esr1、csde1和sgk1,以在分别的测试中确定每个基因的突变状态。
255.在一个实施方案中,基于受试者的分子谱对受试者施用适当的治疗剂,以最小化受试者将患癌症的机会或延缓癌症的发展。例如,处于如上所述的增加的癌症风险的人将是预防癌症的治疗的候选者。在一些实施方案中,受试者的分子谱可以包括esr1中的突变。
256.实施例
257.实施例1.簇预测模型
258.对ec的全部232例病例进行具有非缺失复发状态的病例的数据分析,包括cn-低/msi子集(155例)和i/ii期子集(127例)。预测信息在包括复发和结果的数据集中提供。总复发率为20%(45/232),报告死亡23例(10%)。与cn-低/msi组合的簇相比,cn-高簇的复发显著更常见(p《0.01,fisher's exact)。在pole突变组中没有复发。
259.将对于任何基因的突变状态看作二元制特征,而msi状态是名义性的。基于相对于结果簇(类)的卡方属性选择(chi-square attribute selection)方法,选择了msi状态和5个基因用于进一步检查。所得模型能够以94%的精确度预测在之前的ucec研究(the cancer genome atlas research network,integrated genomic characterization of endometrial carcinoma,00nature,1-8(2013))中报告的四个结果簇(图1)。
260.在十倍交叉验证(10-fold cross validation)实验中,随机接种模型用于100次迭代,并记录了性能指标。平均精度和回归率为0.971
±
0.07和0.970
±
0.04,而最大假阳性率为0.11;这些数据表明了令人满意的性能。
261.实施例2.i/ii期cn-低/msi复发预测程序
262.当将分析限制于i/ii期cn-低/msi亚组时,基于突变状态、msi状态和cn种类并无结果预测能力(kaplan-meier,p=0.41)。
263.微阵列分析中的较高的cn改变得分,与i/ii期cn-低/msi亚组中的复发显著相关(p《0.01,student’s t检验)。较低分期cn-低/msi病例的基因组复杂性,与tp53突变(124/127例未突变)或tp53丢失(126/127例无缺失)不相关,这意味着在该子集中其它的基因组维持改变。
264.i/ii期中的突变负荷(mutation load)(每例病例的突变总数)显著低于(p《0.01)iii/iv期。然而,每例病例的突变数与较低分期cn-低/msi队列中的复发没有显著相关。在i/ii期cn低/msi病例中,以前表征的一般在ec中突变的致癌基因包括pten、fgfr2和pik3ca
的突变率,无基于临床分期或复发状态的差异(p分别=0.70、0.22、0.29))。
265.鉴定了数种在ec中以前未知的基因,且在具有i/ii期cn-低/msi亚组(图2,左下)中已复发的病例组中,所述基因以显著更高的速率突变。这些基因之一是雌激素受体-α基因(esr1)(p《0.01,fisher's exact)。在复发组中的三个esr1突变中有两个是y537取代,有一个是框内缺失,gkc415del;两种突变均位于配体结合域(lbd)中。y537取代先前已报导为乳腺癌中的激活突变,且在来自tcga研究的390例er阳性乳腺癌中未发现。当观察整个ucec数据集时,esr1突变是无进展生存的适度指标(图3a)。然而,在i/ii期cn低/msi子集中,在野生型和突变体esr1之间存在显著差异(kaplan-meier,p《0.01)(图3b)。
266.实施例3.用于在癌症样品中的预后和诊断治疗学建模的单次测序分析中,进行精确msi分型和突变特征分析的方法
267.基于ngs读段的比对模式确定msi。对源于来自具有癌症的患者的组织样品的正常/非肿瘤性肿瘤样品之间的测序读段中的覆盖度差异,进行了数学性计算。
268.在分析之前,使用工具“tandem repeats finder”(trf)(http://tandem.bu.edu/trf/trf.html)处理测序数据以识别测序读段中的短串联重复序列(str)核苷酸区域的开始和末端索引。编程脚本从分析创建了一个包含全部感兴趣区域(roi)的.fasta文件。脚本然后执行trf并返回str区域的列表和这些区域的索引。
269.从仅对于在由trf返回的索引中的核苷酸的序列的读取文件中,提取覆盖度和总读取值。
270.从索引的核苷酸重复序列(在图4的“共有序列”行中突出显示)开始实施发散算法,对正常样品(n)实施一次并对肿瘤样品(t)实施一次。(图4)
271.公式1(eq.1)通过从感兴趣区域(roi)中检测的总读数(tr)中,减去测序读段中的核苷酸位置(i)的覆盖度,然后除以tr并取绝对值来计算正常样品的散度(d)。将结果乘以100,给出了1-100之间的正整数值。然后使用公式2(eq.2)对肿瘤样品(t)实行相同的计算。
272.公式3(eq.3)通过从正常散度(dn)减去肿瘤散度(dt)然后取绝对值来计算每个核苷酸位置(i)的δ散度(δd)。公式4(eq.4)计算了所有δd值的reimann和。获得的该值表示微卫星上的正常和肿瘤之间的序列散度的定量,因此表示在该位点的msi水平。
273.为了通过对具有已知msi状态的肿瘤细胞系实行测序来验证该方法,确定了雷曼和相关性(riemann sum correlation)。已知具有高水平msi的结肠癌细胞hct-116,被该方法分类为roi微卫星中有msi。相比之下,微卫星稳定的结肠癌细胞系sw480被这种方法证实无msi。表1显示微卫星bat-25的验证结果,而表2显示微卫星bat-26的细胞系验证结果。利用pcr-ce方法的这些细胞系的平行分析证实了测试的系的已知状态(未示出)。
274.表1:对hct-116(msi-高)和sw480(mss)细胞系的稀释研究(dilutionstudies)中的bat-25微卫星的reimann和。
[0275][0276][0277]
表2:对hct-116(msi-高)和sw480(mss)细胞系的稀释研究中的bat-26微卫星的reimann和。
[0278]
bat26
ꢀꢀꢀ
reimann和hct-116ulsw480 ul稀释比755150 75814.850.1599%-1%725.6514.250.7595%-5%772.213.51.590%-10%802.111.253.7575%-25%780.77.57.550%-50%671.63.7511.2525%-75%658.31.513.510%-90%721.50.7514.255%-95%452.740.1514.851%-99%
[0279]
在稀释研究中,bat-25研究证实了每个样品的覆盖度几乎相等。更高的reimann和得分与bat-25的更高浓度的hct-116dna密切相关(r2=0.95)。然而,bat-26的一些稀释样品显示了更多可变的覆盖度(roi丢弃),这影响了bat-26的reimann和相关性(r2=0.44)。
[0280]
因为对于每个微卫星,扩展/收缩模式(expansion/contraction pattern)是不同的,所以需要用于为每个roi调用msi的reimann和阈值,且通过对具有已知msi状态的多个样本进行平均而获得所述reimann和阈值。
[0281]
在测序运行中包括的所有微卫星roi上实行reimann和得分方法。使用了与pcr-ce方法相同的准则,合并所有微卫星/roi的结果来提供每种病例的最终msi调用。
[0282]
验证结果表明,该方法也可用于在任何给定肿瘤样品中鉴定新微卫星位点。
[0283]
图5示出来自jsi-seqnext软件的显示正常样品的测序覆盖度的直方图图像(a),黑色箭头表明两个微卫星区域。还示出了由msi检测方法产生的图像(b)。将扩增子/感兴趣区域的核苷酸位置(i)定位在x轴上。黑色箭头用作覆盖度直方图的精确表示的参考。以核苷酸数(y1轴)测量了正常样品覆盖度(较高线)和肿瘤样品覆盖度(中间线)。δ散度(较低
线)(eq.3)由y2轴上的整数值表明。
[0284]
图6示出了显示微卫星稳定的感兴趣区域(roi)的样品的实例。利用毛细管电泳移动肿瘤(t)和正常(n)样品以测定5个msi标记(上)。在肿瘤和正常样品中,均在高功率可见单峰(左下),表明稳定的微卫星(mss)模式。msi检测方法(右下)检测到较低散度(较低线),确认了结果。
[0285]
图7示出了显示微卫星不稳定的感兴趣区域(roi)的样品的实例。利用毛细管电泳移动肿瘤(t)和正常(n)样品以测定5个msi标记(上)。在肿瘤和正常样品中,均在高功率(左下)可见轻微的双峰(bimodal peak),表明在该区域中有msi。msi检测方法(右下)检测到高散度(较低线),确认结果。
[0286]
实施例4.在子宫内膜癌中对使用ngs用于msi状态测定和突变检测方法的技术验证
[0287]
为了证明在ngs测序运行中测定msi状态和突变状态的实用性,为子宫内膜癌(ec)设计了illumina测序小组(panel)。
[0288]
ec涵盖具有可变的临床结果的常见的子宫内膜样组织学亚型,及具有一致的不良预后的较不常见的乳头状浆液/透明细胞癌(psc)。微卫星不稳定性(msi)在子宫内膜样ec的子集中可见,并已被推荐为检测由遗传性lynch综合征引起的ec的诊断试验。许多ec的分子分析已经鉴定了与组织学类型和高风险临床特征相关的突变模式,并已被并入专门设计的ngs分析中。
[0289]
特别地,多中心子宫内膜性子宫内膜癌(uterine corpus endometrial carcinoma,ucec)研究鉴定了ec的4种不同分子簇。这些簇包括1)与极高突变率和有利的预后相关的pole突变病例组,以及2)与tp53突变、常见基因组拷贝数(cn)变化、预后差相关的大多数(但不专有)psc病例组。然而,大多数的病例(155/232,66.8%)为3)具有未突变的tp53和少量cn变化的子宫内膜样ec,或4)表现微卫星不稳定性(microsatellite,msi)的病例。最后两组具有更多可变的结果。
[0290]
设计了小组来同时确定msi状态并检测突变,所述突变可将ec分类至已知的分子亚组包括:pole突变的、具有在pik3/ras途径中的突变的cn-低、cn-高变体和msi病例。
[0291]
为了确定这些亚组,进行了以下研究:
[0292]
(1)设计了一个定制ngs小组以用于illumina truseq方法,其包括在实体瘤中的19个常见突变基因以及跨越5个nci微卫星位点的扩增子。根据基因的频率和与ec的种类相关性,选择了基因用于突变分析;
[0293]
(2)使用突变/微卫星定制小组,对来自原发性大肠癌和子宫内膜癌样品的配对的正常和肿瘤样品、以及已知的msi+和msi-crc细胞系进行dna测序;
[0294]
(3)使用模拟序列读段生物信息学地验证了上述近似,来检测ngs数据中的msi;和
[0295]
(4)比较了所公开的ngs方法与传统的毛细管凝胶电泳方法之间的msi状态测定。
[0296]
表3列出了在定制基于illumina dna的子宫内膜癌的ngs分析中测序到的基因、覆盖的区域和碱基对的量。
[0297]
表3:ngs分析基因和区域
[0298][0299][0300]
实施例5.使用组合的msi分型突变分析方法来构建用于子宫内膜癌分型的有限基因集模型。
[0301]
除了设计和验证msi/突变ngs ec分析之外,还评估了所公开的方法寻找由the cancer genome atlas research network定义的ec的4种分子亚型的能力。
[0302]
为了实现该操作,将来自ucec研究的数据用作训练集。在该研究中,突变数据用ngs获得,且msi状态用标准pcr-ce方法确定。一旦从ucec数据确定了编码精确亚型需要的最小基因集,就针对使用定制设计的illumina分析获得的原发性ec肿瘤测序数据测试了该模型。
[0303]
方法:
[0304]
从cbioportal.org下载了在来自ucec数据集的定制小组中的基因的msi状态和突
变数据(表3)。将任何基因的突变状态看作二元制特征:突变或非突变,而将msi状态考虑成0=mss、或1=msi-低、而2=msi-高。这些结果与ucec衍生的分子ec亚组:pole、cn-低、cn-高和msi进行了比较。
[0305]
使用数据挖掘软件weka构建-bayes模型,以从ucec数据集预测分子亚组。使用卡方特征选择方法对数据集进行特征选择。具有最佳模型精度的特征选择方法是5基因和msi状态模型(共6个特征)。用于在ucec数据中的亚型分类的五个最信息丰富的基因(按重要性的顺序)为tp53、pole、pten、fbxw7和rpl22。
[0306]
这5个基因和msi状态被用作在-bayes分类试验中预测子簇的特征。将病例的顺序随机化,在设置了100次随机种子的10折交叉验证实验中,对数据集应用-bayes分类程序。
[0307]
亚型预测的平均精度为94%;平均精度和回归分别为0.971
±
0.07和0.970
±
0.04。最大假阳性率为0.11。
[0308]
然后针对从定制小组获得的30个原发性ec病例的测序数据测试了该模型。
[0309]
实施例6.在esr1、csde1和sgk1中的突变作为较低分期子宫内膜癌结果差的预测因子
[0310]
子宫内膜癌(ec)涵盖具有可变的临床结果的常见的子宫内膜样组织学亚型,及具有一致的不良预后的较不常见的乳头状浆液/透明细胞癌(psc)。在ec中的主要未满足的诊断需要是,鉴定具有子宫内膜样组织学和较低分期的病例,所述较低分期具有复发风险并且将从辅助化疗或放射疗法中受益。微卫星不稳定性(msi)在子宫内膜样ec的子集中可见,并已被推荐为检测由遗传性lynch综合征引起的诊断试验。许多ec的分子分析已经鉴定了与组织学类型和高风险临床特征相关的突变模式,但是现在仍没有出现对于子宫内膜样亚型的公认的预测性生物标记物。
[0311]
多中心子宫内膜癌(ucec)研究近年来采用了表达和基因组微阵列、甲基化谱和下一代测序(ngs)。该研究主要基于测序和微阵列数据鉴定了ec的4个不同的分子簇。这些簇包括1)与极高突变率和有利的预后相关的pole突变病例组,以及2)与tp53突变、常见基因组拷贝数(cn)变化、预后差相关的大多数(但不专有)psc病例组。然而,大多数的病例(155/232,66.8%)为3)具有未突变的tp53和少量cn变化的子宫内膜样ec,或4)表现微卫星不稳定性(msi)的病例。最后两组具有更多可变的结果,限制了它们在常规结果预测中的实用性。
[0312]
对ucec数据的初步分析没有清楚鉴定用于分层i/ii期子宫内膜样ec的遗传、表达或表观遗传学特征。在单因素分析中分析了ucec数据,并鉴定了三个可以在较低分期ec中分层结果的突变基因。这些基因之一的esr1/雌激素受体潜在可靶向于一系列目前可获得的治疗。
[0313]
方法:
[0314]
ucec数据集中的结果分析
[0315]
ucec数据中的晚期(iii/iv)期子宫内膜癌不论分子亚型均显示了较差结果。因此,分析仅限制于i/ii期病例。在这些病例中的pole突变的亚组显示具有高度有利的结果,而cn-高亚组被表征为具有较劣结果。这两个亚组仅占总病例的95/232(41%)。因此,这项研究进一步只致力于i/ii期、cn-低/msi亚组,该亚组包括大多数的ucec案病例并具有更多
可变的结果。
[0316]
结果数据包括总体存活(os)和复发,所述复发被编码为二进制特征如已复发或无进展。表1-3示出了用于分析的类别。
[0317]
统计分析
[0318]
由于上述原因,仅选择了有复发数据(127)的i/ii期、cn低/msi病例进行进一步分析。
[0319]
将来自82个最经常突变的基因的突变、和全部232例ucec病例的临床数据组织成表格形式。将突变翻译成二元制值:突变或非突变。
[0320]
在该组中,大多数病例(111)无进展,有16例复发。在复发和无进展组之间,cn-低和msi ec亚型的分布相似。对每个基因实行了fisher精确检验(2x2列联表)。
[0321]
结果:
[0322]
对于i/ii期cn-低/msi病例中的任何基因,os没有显著差异,这可能是由于报道的少数死亡例。
[0323]
对于进展,与无进展组相比,在具有复发的患者中有三个基因有显著差异突变。它们是esr1、csde1和sgk1。
[0324]
图8显示了三个基因中每一个基因的fisher精确检验的结果,在所述三个基因中,突变与在i/ii期、cn-低/msi亚组中的复发显著相关。
[0325]
虽然已充分地详细描述和示例了本发明以使得本领域技术人员进行制造和使用,但在不脱离本发明的精神和范围的情况下,各种替代、修改和改进应当是显而易见的。
[0326]
本领域技术人员能够理解,本发明良好地适用于实现发明目的并获得提及的及其中内含的结果和优点。本领域技术人员能够预料到对其的修改和其它用途。这些修改均包括在本发明的精神内并由权利要求的范围限定。
[0327]
对于本领域技术人员显而易见的是,在不脱离本发明的范围和精神的情况下,可以对本文公开的本发明进行种种替换和修改。
[0328]
在本说明书中提到的所有专利和出版物都表明本发明所属领域的普通技术人员的水平。如同每个单独的出版物被具体和单独通过引用并入的相同程度,所有专利和出版物通过引用并入本文。
[0329]
本文说明性地描述的本发明可以在不存在本文未具体公开的任何要素或要件,限制或局限的情况下实施。因此,例如在本文中,本文中的任何术语“包括”、“基本上由...组成”和“由...组成”可以用其它两个术语中的任一个代替。已使用的术语和表达用作描述性的术语而非限制性,并且不意味着这些术语和表达的使用排除了所示和描述的特征或其部分的任何等同物,但应该认识到,在所要求保护的本发明的范围内能够进行各种修改。因此,应当理解尽管通过优选实施例和可选特征具体公开了本发明,但是本领域技术人员可以采取本文公开的概念的修改和变化,且这些修改和变化视为包括在所附权利要求限定的本发明的范围内。
[0330]
在所附权利要求中阐述了非限制性实施例。
[0331]
参考文献
[0332]
arabi h et al._impact of microsatellite instability(msi)on survival in high grade endometrial carcinoma.gynecol oncol_2009 may;113(2):153-8.
[0333]
benson g,et al,tandem repeats finder:a program to analyze dna sequences.nuc acids res1999;27(2):573-580.
[0334]
cirisano,f.d,et al.(2000).the outcome of stage i
–
ii clinically and surgically staged papillary serous and clear cell endometrial cancers when compared with endometrioid carcinoma.gynecologic oncology,77(1),55-65.
[0335]
creutzberg cl,et al.nomograms for prediction of outcome with or without adjuvant radiation therapy for patients with endometrial cancer:a pooled analysis of portec-1 and portec-2 trials.international journal of radiation oncology*biology*physics 91.3(2015):530-539.
[0336]
diaz-padilla i,et al.mismatch repair status and clinical outcome in endometrial cancer:a systematic review and meta-analysis.crit rev oncol hematol 2013 oct;88(1):154-67.
[0337]
deschoolmeester v,et al.comparison of three commonly used pcr-based techniques to analyze msi status in sporadic colorectal cancer j clin lab anal 2006;20(2),52-61.
[0338]
giardiello fm,et al.guidelines on genetic evaluation and management of lynch syndrome:a consensus statement by the us multi-society task force on colorectal cancer.am j gastroenterol_2014 aug;109(8):1159-79.
[0339]
gould-suarez m,et al._cost-effectiveness and diagnostic effectiveness analyses of multiple algorithms for the diagnosis of lynch syndrome.dig dis sci 2014 dec;59(12):2913-26.
[0340]
hogberg t.adjuvant chemotherapy in endometrial carcinoma:overview of randomised trials.clinical oncol.2008;20(6):463
–
469.
[0341]
kim,tm,laird,pw,&park,pj.the landscape of microsatellite instability in colorectal and endometrial cancer genomes.cell 2013;155(4):858-868.
[0342]
mills am,et al.lynch syndrome screening should be considered for all patients with newly diagnosed endometrial cancer.am j surg pathol 2014 nov;38(11):1501-9.
[0343]
missiaglia e,et al.distal and proximal colon cancers differ in terms of molecular,pathological,and clinical features.ann oncol.2014 oct;25(10):1995-2001
[0344]
modica i,et al.utility of immunohistochemistry in predicting microsatellite instability in endometrial carcinoma.am j surg pathol_2007 may;31(5):744-51.
[0345]
nardon e,et al.a multicenter study to validate the reproducibility of msi testing with a panel of 5 quasimonomorphic mononucleotide repeats.diag molec pathol.2010;19(4):236-242.
[0346]
niu,b,et al.msisensor:microsatellite instability detection using paired tumor-normal sequence data.bioinformatics 2014;30(7):1015-1016.
[0347]
popat s,hubner r and houlston rs.systematic review of microsatellite instability and colorectal cancer prognosis.j clin oncol 2005 jan 20;23(3)609-618.
[0348]
the cancer genome atlas research network.integrated genomic characterization of endometrial carcinoma.nature 2013 may 02;497:67-73.may 02,2013.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1