具有延长的保存期的过氧化物酶化学发光底物的制作方法
本发明涉及一种用于在测定样品中的分析物的分析中测定过氧化物酶的化学发光底物,其中该化学发光底物具有延长的保存期。
背景技术:
辣根过氧化物酶(hrp)催化的鲁米诺化学发光氧化广泛应用于抗原、抗体和核酸的分析测试,尤其是印迹测试,例如斑点印迹和蛋白质印迹(蛋白质)、dna印迹和rna印迹(核酸)以及酶联免疫分析(eia,用于蛋白质或核酸)。
已知通过添加电子介体或增强剂,可以使得hrp催化的鲁米诺的化学发光氧化变得更快和更高效,如例如krickalj(1991),clinicalchemistry,37:1472-1481或krickalj,voytajc和bronsteini在"chemiluminescentmethodsfordetectingandquantitatingenzymeactivity"(2000),methodsenzymol;305:370-390中所述的。
其中鲁米诺和增强剂同时氧化的增强化学发光反应(ecl)的机理已描述如下[lindj,merenyig和eriksente(1983),jamchemsoc,105:7655-7661]。在ecl的第一步骤中,增强剂(e)(其是比鲁米诺具有更高活性的hrp的底物)根据“乒乓”机制在hrp的存在下被过氧化氢氧化:
hrp+h2o2→hrp-i(1)
hrp-i+e→hrp-ii+e●(2)
hrp-ii+e→hrp+e●(3)
其中e是增强剂,e●是增强剂的单电子氧化的自由基产物,hrp是处于fe(iii)静息状态的辣根过氧化物酶,hrp-i和hrp-ii是过氧化物酶的氧化中间体,其分别比静息状态高两个和一个氧化当量。然后,增强剂的自由基产物(e●)与鲁米诺分子(lh-)可逆地反应[eastonpm,simmondsac,rakisheva,egorovam和candeiaslp(1996),jamchemsoc;118:6619-6624]:
在热力学上,氧化还原平衡(4)的位置由实验条件下增强剂和鲁米诺自由基的还原电位之间的差异决定。一旦形成,两个鲁米诺自由基(l●-)歧化成鲁米诺阴离子(lh-)和二杂氮醌(diazaquinone)中间体(l):
2l●-→lh-+l(5)
二氮杂醌中间体(l)与过氧化氢反应而生成过氧化鲁米诺(lo22-),其随着分子氮的排出而折叠(collapse)成激发态的3-氨基邻苯二甲酸([ap2-]*);[ap2-]*然后返回到基态(ap2-)而发射425nm的光子(hν):
l+h2o2→lo22-→[ap2-]*+n2→ap2-+hν(6)
发射光的强度与鲁米诺自由基(l●-)的生成速率的平方成比例。该二次关系是受激物质生成机制的结果,其涉及两个鲁米诺自由基的歧化(反应式5)。反过来,鲁米诺自由基的生成速率由酶转换率给出,其通过氧化还原平衡(4)后得到鲁米诺自由基(l●-)的所生成自由基的分数来衡量。酶转换率受限速步骤(hrp-ii还原为正铁酶,反应式(3))控制。总之,通过考虑(a)通过增强剂与hrp-ii的反应的酶转换加速和(b)增强剂自由基与鲁米诺之间的可逆电子转移反应,可以近似地描述化学发光的增强。
许多化合物被成功用于增强hrp诱导的化学发光,包括荧光素、6-羟基苯并三唑类、对碘苯酚类、对香豆酸和其他酚类增强剂(thorpeghg和krickalj(1986)methodsenzymol133:331);芳族胺(美国专利no.4,279,950);乙酰苯胺类(欧洲专利申请no.603953);n-取代的吩噻嗪类(美国专利no.5,171,688和美国专利no.6,432,662);硼酸类(美国专利no.5,629,168)。
此外,如美国专利no.7,803,573中所述,化学发光光发射的进一步更大的提高用某些4-二烷基氨基吡啶类,例如4-吗啉代-吡啶(morp)、4-二甲氨基吡啶(dmap)和4-吡咯烷基吡啶(ppy)获得。属于4-氨基吡啶类的这些化合物仅在与初级电子转移型增强剂结合使用时才提供光输出的进一步增强。因此,它们可被描述为次级增强剂或共增强剂,如vdovenkomm,dellacianal和sakharoviy(2009)analbiochem392:54中所述。向含有sptz增强剂的底物溶液中加入4-二烷基氨基吡啶类显著提高了sptz阳离子自由基的产生速率,反应式(2)和(3),从而提高了hrp转换率,如sakharoviy和vdovenkomm(2013)analbiochem434:12所述。us9,040,252中描述了用作共增强剂的另一组化合物。这些共增强剂属于n-唑类,最有用的是咪唑、1-甲基-咪唑、1,2,3-三唑和1,2,4-三唑。
在实际操作中,使用者混合两种单独的、先前制备的缓冲溶液,一者包含鲁米诺和增强剂,另一者包含过氧化物氧化剂。虽然这两种单独的溶液可以长时间储存,但通过混合两种部分溶液获得的最终“工作溶液”的稳定性有限,其范围从几小时到最多几天。
因此,希望的是无需在进行测试程序时混合单独的组分,而不会降低或损害底物的性能。
先前提供具有延长的储存稳定性的完整过氧化物酶底物的尝试获得的成功非常有限。例如,giri在美国专利no.6,602,679中公开了具有延长的稳定性的制剂,其包含增强剂和过氧化物稳定剂。但是,未报告稳定性数据。类似地,woerner在美国专利申请2007/0264647中描述了在碱性条件下使用卤化亚锡作为过氧化氢的稳定剂以用于过氧化物酶类分析的化学发光、荧光和比色检测。尽管声称“通过在缓冲体系中稳定和/或增强过氧化氢,用于该类分析的组合物可具有更高的保存期”,但其未提供实验证据。
因此,尽管有先前报道的那些,仍需要用于过氧化物酶的增强化学发光检测的改进的底物制剂,其中所有组分混合在缓冲溶液中,并具有延长的保存期。
技术实现要素:
本发明的目的是提供一种用于在检测样品中分析物的分析中定量测定过氧化物酶的新的化学发光底物,其中该化学发光底物具有延长的保存期。
根据本发明,上述目的通过在随后的权利要求中指定的试剂盒得以实现,该权利要求被理解为形成本说明书的组成部分。
根据一个实施方案,本公开涉及一种用于进行测定样品中分析物的分析的试剂盒,其中该试剂盒包含化学发光的环状二酰肼(diacylhydrazide)、过氧化物氧化剂、增强剂和共增强剂,其中该增强剂为阴离子n-烷基吩噁嗪,并且该共增强剂选自4-二烷基氨基吡啶和n-唑(n-azole)。
根据另一实施方案,本公开涉及一种用于进行检测样品中分析物的化学发光分析的方法,其中该方法采用了本文公开的试剂盒。
附图说明
现在参考附图仅以举例的方式描述本发明,其中:
-图1显示了本发明的环状二酰肼的结构。
-图2显示了本发明的阴离子n-烷基吩噁嗪增强剂的结构。
-图3显示了sptz的氧化动力学的图。
-图4显示了spox的氧化动力学的图。
-图5显示了化学发光信号与鲁米诺/过硼酸盐/spox底物中spox浓度的相关性。
-图6显示了鲁米诺/过硼酸盐/spox底物中化学发光信号的ph相关性。
-图7显示了化学发光信号与鲁米诺/过硼酸盐/spox/morp底物中morp浓度的相关性。
-图8显示了化学发光信号与鲁米诺/过硼酸盐/spox/咪唑底物中咪唑浓度的相关性。
-图9显示了鲁米诺/过硼酸盐/spox/morp和鲁米诺/过硼酸盐/spox/咪唑底物中化学发光信号的ph相关性。
-图10显示了化学发光信号与l-012/过硼酸盐/spox底物中spox浓度的相关性。
-图11显示了l-012/过硼酸盐/spox底物中化学发光信号的ph相关性。
-图12显示了化学发光信号与l-012/过硼酸盐/spox/morp底物中morp浓度的相关性。
-图13显示了用鲁米诺/spox和l-012/spox底物vs.鲁米诺/sptz底物获得的人ikbα的蛋白质印迹。
-图14显示了用鲁米诺/spox和l-012/spox底物vs.鲁米诺/sptz底物获得的人ikbα的蛋白质印迹。
-图15显示了如实施例11所述制备的底物l/spox6的化学发光信号vs.4℃下储存时间的图。
-图16显示了如实施例11所述制备的底物l012/spox的化学发光信号vs.4℃下储存时间的图。
具体实施方式
在以下描述中,给出了大量具体细节以提供对实施方案的透彻理解。该实施方案可以在没有一个或多个特定细节的情况下实施,或者可以使用其他方法、组分、材料等实施。在其他情况下,未详细示出或描述众所周知的结构、材料或操作以避免模糊实施方案的各个方面。
整个本说明书中提及“一个实施方案”或“实施方案”指结合该实施方案描述的特定特征、结构或特性包括在至少一个实施方案中。因此,在整个本说明书中各处出现的短语“在一个实施方案中”或“在实施方案中”不一定都指同一实施方案。此外,特定特征、结构或特性可以在一个或多个实施方案中以任何合适的方式组合。
这里提供的标题仅为方便的目的,而并不解释实施方案的范围或含义。
本发明涉及一种用于进行测定样品中分析物的分析的试剂盒,其中该试剂盒包含化学发光的二酰肼、过氧化物氧化剂、增强剂和共增强剂,其中该增强剂为阴离子n-烷基吩噁嗪,并且该共增强剂选自4-二烷基氨基吡啶和n-唑。
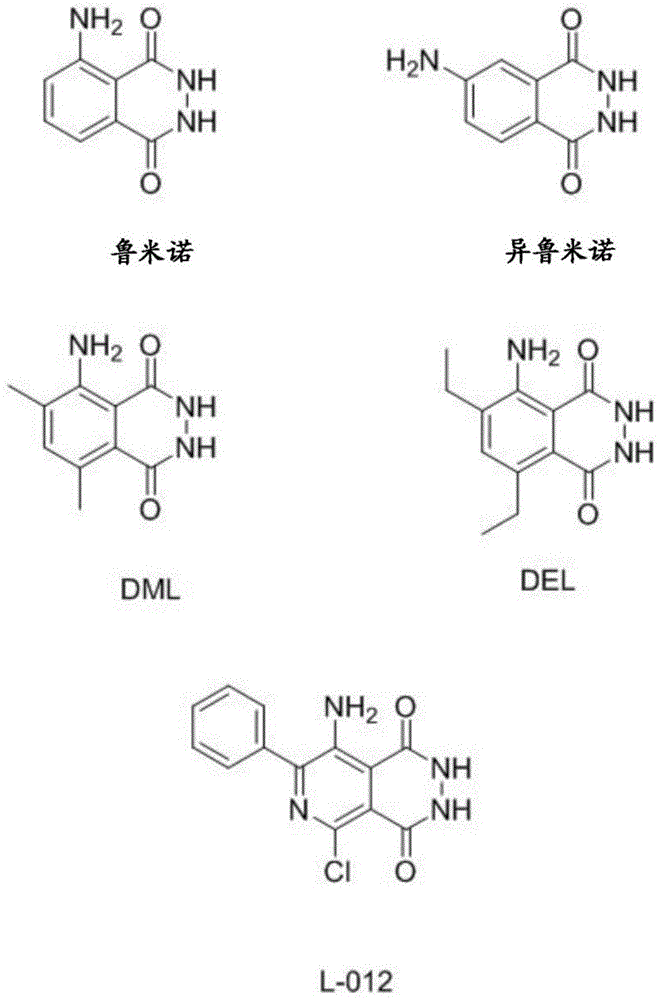
在一个实施方案中,化学发光的二酰肼选自鲁米诺、异鲁米诺、5-氨基-6,8-二甲基-2,3-二氢酞嗪-1,4-二酮(dml)、5-氨基-6,8-二乙基-2,3-二氢酞嗪-1,4-二酮(del)和8-氨基-5-氯-7-苯基吡啶并[3,4-d]哒嗪-1,4(2h,3h)-二酮(l-012)。这些化学发光二酰肼的化学结构显示于图1中。优选地,化学发光二酰肼选自鲁米诺和8-氨基-5-氯-7-苯基吡啶并[3,4-d]哒嗪-1,4(2h,3h)-二酮(l-012)。
在一个实施方案中,阴离子n-烷基吩噁嗪选自3-(10h-吩噁嗪-10-基)丙烷-1-磺酸(spox)、4-(10h-吩噁嗪-10-基)丁烷-1-磺酸(sbox)、3-(10h-吩噁嗪-10-基)丙酸(cpox)和4-(10h-吩噁嗪-10-基)丁酸(cbox)及其盐。这些n-烷基吩噁嗪的化学结构显示于图2中。优选地,阴离子n-烷基吩噁嗪选自3-(10h-吩噁嗪-10-基)丙烷-1-磺酸(spox)和3-(10h-吩噁嗪-10-基)丙酸(cpox)。
本发明的共增强剂属于两类不同的化合物,4-二烷基氨基吡啶类(如us7,803,573所述)和n-唑类(如us9,040,252所述)。在4-二烷基氨基吡啶类中,优选的化合物是4-吗啉代-吡啶(morp)、4-二甲氨基吡啶(dmap)和4-吡咯烷基吡啶(ppy)。在n-唑类中,优选的化合物是咪唑和1-甲基-咪唑。
根据本发明的过氧化物氧化剂可以是过氧化氢或过氧化氢的任何复合物(其在水溶液中溶解时释放过氧化氢),例如过硼酸盐、过碳酸盐或摩尔比1:1的脲/过氧化氢复合物。在一个优选实施方案中,过氧化物氧化剂选自过氧化氢、脲/过氧化氢复合物、过硼酸盐、过碳酸盐。优选地,过硼酸盐和过碳酸盐为碱金属或碱土金属盐。
在进一步的实施方案中,试剂盒进一步包含过氧化物酶。
过氧化物酶是适用于化学发光分析的任何过氧化物酶。根据一个实施方案,过氧化物酶选自辣根过氧化物酶(例如sigmavia或ix型)或阴离子过氧化物酶,例如大豆过氧化物酶和甘薯过氧化物酶。
过氧化物酶可以与用于待检测分析物的检测试剂缀合或不缀合。过氧化物酶(或其缀合物)可由最终使用者添加。
过氧化物酶的增强化学发光底物的有限储存稳定性可解释为两个主要原因:(1)增强剂的氧化;(2)过氧化氢的分解。在这两个原因中,第一个,增强剂的氧化,是最重要的。底物的其他组分,例如环状二酰肼、共增强剂和缓冲剂对通过分子氧或过氧化物的氧化也基本稳定,即使在碱性溶液中。
增强剂的氧化可通过与分子氧或过氧化物的反应发生。这些氧化反应通常随着ph值的增加而加快,并且被痕量金属离子(尤其是铁和铜)催化。
某些种类的增强剂,例如酚类增强剂,甚至被分子氧快速氧化。事实上,含有鲁米诺和酚类增强剂的溶液必须在4℃下储存,因为如果在室温下储存即使一天,它们失去大部分活性。
n-烷基吩噻嗪类增强剂,例如3-(10′-吩噻嗪基)丙烷-1-磺酸(sptz),即使在室温下保持的碱性溶液中,对于分子氧的氧化也稳定很长时间。然而,它们在过氧化物存在下缓慢分解(图3)。增强剂和过氧化物浓度同时降低导致性能的下降。
相反,本发明人发现,即使在碱性溶液中,阴离子n-烷基吩噁嗪增强剂对通过过氧化物的氧化也极其稳定(图4)。
这一发现有力地表明,影响增强化学发光底物的储存稳定性的主要因素是对于增强剂本身的氧化的稳定性。相反,giri在美国专利no.6,602,679和woerner在美国专利申请2007/0264647中仅依赖于添加过氧化物稳定剂来提高增强化学发光底物的储存稳定性,而忽略了增强剂的作用。
在此基础上,本发明人开发了其中阴离子n-烷基吩噻嗪作为增强剂被阴离子n-烷基吩噁嗪替代的化学发光底物,实施例2-10。实施例11中公开了基于鲁米诺或l-012的化学发光底物的优化制剂,其中3-(10′-吩噁嗪基)丙烷-1-磺酸(spox)作为增强剂,且morp或咪唑作为共增强剂。就初始化学发光信号(图13)和蛋白质印迹免疫分析(图14)而言,这些底物的性能类似于或优于以sptz作为增强剂的参考底物,l/sptz1和l/sptz2(实施例2)。
在4℃和23℃下对实施例11的底物进行稳定性研究。在混合所有组分后立即记录初始化学发光信号。结果见表i和图13(4℃)以及表ii(23℃。在这两种情况下,含有spox作为增强剂的底物比含有sptz的底物稳定得多。
表i
表ii
对最有希望的底物进行更长时间的监测。图15总结了l/spxo6的结果。该底物在4℃下储存211天(7个月)后,信号下降约15%。对于l012/spox底物发现甚至更好的储存稳定性,见图16。在这种情况中,在4℃下储存585天(近20个月)后,观察到信号仅下降8%。
在一个实施方案中,试剂盒包含化学发光的环状二酰肼、过氧化物氧化剂、增强剂和共增强剂,其中化学发光的环状二酰肼存在于第一小瓶中,和过氧化物氧化剂存在于第二小瓶中,并且其中增强剂和共增强剂存在于第一小瓶或第二小瓶或两者中。含有过氧化物氧化剂的第二小瓶不含过氧化物氧化剂的任何稳定剂。试剂盒试剂以液态或固态存在于小瓶中。如果试剂盒试剂为固态,它们可以以粉末或片剂的形式存在,并且必须在使用时通过加入水或缓冲溶液以液相进行重构。增强剂和共增强剂,以及其他添加剂如螯合剂和稳定剂,可以添加到化学发光的环状二酰肼或过氧化物氧化剂小瓶或两者中,条件是该稳定剂不是过氧化物氧化剂的稳定剂。两个小瓶还可包含缓冲物质,其在混合时生成具有适合进行所述分析的ph值的化学发光底物或“工作溶液”。通过混合上述所列化合物获得的工作溶液是长期稳定的(通常为6个月或更长时间),并且不含过氧化物氧化剂的任何稳定剂。
在一个实施方案中,化学发光环状二酰肼、过氧化物氧化剂、增强剂、共增强剂在单一小瓶中配制,并且不存在过氧化物氧化剂的任何稳定剂。
过氧化物酶或其缀合物(如果存在于试剂盒中)不与其底物组分(即过氧化物氧化剂)一起储存,而是在不同的小瓶中储存。
根据进一步的实施方案,本公开涉及一种用于进行检测样品中分析物的化学发光分析的方法。
术语“分析”指分析物的检测、半定量和定量。通常,分析的实施需要将光输出与使用的过氧化物酶的量相关联。因此,检测或测量光发射,使得分析物的存在和/或量与光的产生相关联。
根据本公开,分析的实施需要将通过与过氧化物酶反应的化学发光环状二酰肼、增强剂、共增强剂和过氧化物氧化剂的化学发光反应产生的光输出与任何反应伴体(即化学发光的环状二酰肼、过氧化物酶、过氧化物氧化剂、增强剂和共增强剂中的任何一种)的量相关联。根据优选实施方案,光输出与所使用的过氧化物酶的量相关。
用于进行检测样品中分析物的化学发光分析的方法包括以下步骤:
(i)通过将化学发光环状二酰肼、增强剂、共增强剂和过氧化物氧化剂混合在一起获得化学发光底物,其中所述增强剂为阴离子n-烷基吩噁嗪,和所述共增强剂选自4-二烷基氨基吡啶和n-唑,并且其中所述化学发光底物不含过氧化物氧化剂的任何稳定剂,
(ii)使目标分析物已固定于其上的固体支持物与化学发光底物反应,
(iii)将用于目标分析物的检测试剂添加到固体支持物,其中检测试剂与过氧化物酶缀合,和
(iv)记录通过过氧化物酶与化学发光底物的化学发光反应产生的输出光信号,该信号与目标分析物的存在/量相关。
在一个实施方案中,化学发光二酰肼选自鲁米诺、异鲁米诺、5-氨基-6,8-二甲基-2,3-二氢酞嗪-1,4-二酮(dml)、5-氨基-6,8-二乙基-2,3-二氢酞嗪-1,4-二酮(del)和8-氨基-5-氯-7-苯基吡啶并[3,4-d]哒嗪-1,4(2h,3h)-二酮(l-012)。优选地,化学发光二酰肼选自鲁米诺和8-氨基-5-氯-7-苯基吡啶并[3,4-d]哒嗪-1,4(2h,3h)-二酮(l-012)。
在一个实施方案中,阴离子n-烷基吩噁嗪选自3-(10h-吩噁嗪-10-基)丙烷-1-磺酸(spox)、4-(10h-吩噁嗪-10-基)丁烷-1-磺酸(sbox)、3-(10h-吩噁嗪-10-基)丙酸(cpox)和4-(10h-吩噁嗪-10-基)丁酸(cbox)及其盐。优选地,阴离子n-烷基吩噁嗪选自3-(10h-吩噁嗪-10-基)丙烷-1-磺酸(spox)和3-(10h-吩噁嗪-10-基)丙酸(cpox)。
在4-二烷基氨基吡啶类中,优选的共增强剂是4-吗啉代-吡啶(morp)、4-二甲基氨基吡啶(dmap)和4-吡咯烷基吡啶(ppy)。在n-唑类中,优选的共增强剂是咪唑和1-甲基-咪唑。
根据本发明的过氧化物氧化剂可以是过氧化氢或过氧化氢的任何复合物(其在水溶液中溶解时释放过氧化氢),例如过硼酸盐、过碳酸盐或摩尔比1:1的脲/过氧化氢复合物。在一个优选实施方案中,过氧化物氧化剂选自过氧化氢、脲/过氧化氢复合物、过硼酸盐、过碳酸盐。优选地,过硼酸盐和过碳酸盐为碱金属或碱土金属盐。
过氧化物酶是适用于化学发光分析中的任何过氧化物酶。根据一个实施方案,过氧化物酶选自辣根过氧化物酶(例如sigmavia或ix型)或阴离子过氧化物酶,例如大豆过氧化物酶和甘薯过氧化物酶。
根据一个实施方案,化学发光底物中化学发光环状二酰肼的浓度在0.01mm至10mm之间,优选在0.05mm至5.0mm之间。
根据一个实施方案,化学发光底物中的阴离子n-烷基吩噁嗪增强剂的浓度在0.01-3mm之间,优选在0.03-1.0mm之间。
根据一个实施方案,化学发光底物中的共增强剂的浓度在0.05至25mm之间,优选在0.1至12mm之间。
根据一个实施方案,化学发光底物中过氧化物的浓度在0.1至8mm之间,优选在0.25至4mm之间。
根据一个实施方案,化学发光底物的ph为6.0至9.5,优选6.5至9.0。
根据一个优选实施方案,化学发光底物(不含过氧化物氧化剂的任何稳定剂),其具有6.0至9.5之间,优选6.5至9.0之间的ph值,包含:
i)浓度在0.01mm至10mm之间,优选在0.05mm至5mm之间的化学发光环状二酰肼;
ii)浓度为0.01-3mm,优选0.03-1mm的阴离子n-烷基吩噁嗪增强剂;
iii)浓度为0.05-25mm,优选0.1-12mm的共增强剂;和
iv)浓度在0.1至8mm之间,优选在0.25至4.0mm之间的过氧化物氧化剂。
在进行检测目标分析物的分析(无论是定性的还是定量的)时,过氧化物酶是与用于待检测分析物的检测试剂的缀合物的形式。根据待检测的分析物的种类,检测试剂可选自蛋白质、抗体、核苷酸、寡核苷酸或核酸分子。与过氧化物酶缀合的检测试剂可以是(a)能够特异性结合分析物的检测试剂,或(b)能够与特异性结合分析物的检测试剂结合的二级检测试剂。在后一种情况下,将特异性结合分析物的检测试剂添加到化学发光底物或目标分析物已固定于其上的固体支持物,随后将能够结合该检测试剂的二级检测试剂添加到固体支持物。
本发明的化学发光反应可应用于分析物的检测和定量,例如利用分析物(例如蛋白质或核酸分子)和固体支持物(例如膜或微孔板)之间键的形成,和使用过氧化物酶作为示踪剂。通过向固体支持物(先前与含分析物的样品反应)加入本文公开的化学发光底物,和随后向固体支持物加入含过氧化物酶的溶液开始发光反应。光的发射持续,且可以通过胶片、照相机或其他仪器进行测量。
基于根据本公开的化学发光底物的化学发光分析包括用于蛋白质的斑点印迹和蛋白质印迹分析以及用于核酸的dna印迹和rna印迹分析。
基于根据本公开的化学发光底物的印迹分析使用凝胶电泳以将待测试样品中存在的目标分析物(蛋白质或核酸分子)与其他组分(其他蛋白质或其他核酸分子)分离。然后将分析物和其他组分转移到膜上,在膜上使用本文所公开的化学发光底物和能够特异性结合目标分析物的检测试剂对其进行探测(检测),其中检测试剂与过氧化物酶缀合。
基于本发明的化学发光底物的化学发光分析也包括酶免疫分析(eia),例如elisa分析。酶免疫分析尤其适用于检测样品中以极少量存在的分析物,例如肿瘤标志物、甲状腺激素、病毒蛋白(例如,hiv、hcv、hpv蛋白)或类固醇激素(例如,雌二醇、醛固酮)。进行用于检测分析物的elisa分析涉及至少一种对目标分析物具有特异性的检测试剂。样品内的分析物非特异性地(通过吸附到固体支持物表面)或特异性地(通过对同一分析物特异性的另一种检测试剂捕获到固体支持物表面,在“夹心elisa”中)固定在固体支持物(通常聚苯乙烯微孔板)上。将分析物固定在固体支持物表面上后,加入检测试剂,从而与分析物形成复合物。检测试剂可以作为示踪剂与过氧化物酶共价连接,或者其自身可以通过二级检测试剂检测,该二级检测试剂通过(生物)缀合(例如通过生物素或链霉亲和素)与过氧化物酶连接。在各步骤之间,通常用温和的洗涤剂溶液清洗平板以去除任何未特异性结合的蛋白质或抗体。在最后的洗涤步骤后,通过加入本文所述的化学发光底物和(在检测试剂未直接与过氧化物酶缀合的情况下)含有与二级检测试剂缀合的过氧化物酶的溶液以产生光信号来对平板显色,该光信号指示样品中分析物的量。
以下实施例用于说明本发明的具体方面。然而,它们并非旨在限制本发明。
实施例
本申请中使用的所有试剂均购自sigma-aldrich、tcieurope和panreac。
根据neumannh,klauss,klawonnm,struebingd,huebners,goerdesd,vonwangelinaj,lalkm和bellerm(2004)zeitschriftfürnaturforschungb,59:431-438合成5-氨基-6,8-二甲基-2,3-二氢酞嗪-1,4-二酮(dml)和5-氨基-6,8-二乙基-2,3-二氢酞嗪-1,4-二酮(del)。
根据kulysj,vidziunaiter,janciener和palaimaa(2006)electroanalysis18:1771-1777合成spox和cpox增强剂。
在uv-visvarian-cary100bio上进行分光光度测量。化学发光测量在发光模式(无发射滤波器)下使用微孔板、多标签光谱仪、victor3(perkin-elmer)进行。使用黑色96孔微孔板(optiplate-96f)。
用缓冲液将15μl辣根过氧化物酶(hrp)储备液(20mg/l)稀释至50ml(浓度:6ng/ml)制备hrp测试溶液。每个孔加入28μlhrp(228μl最终孔内体积)。因此,每个孔的最终hrp量为168pg。
实施例1-过硼酸钠氧化sptz和spox的动力学
制备了以下溶液:
sptz溶液
[sptz]=0.05mm
[过硼酸钠]=4mm
在300mmtris缓冲液,ph8.73中
spox溶液
[spox]=0.05mm
[过硼酸钠]=4mm
在300mmtris缓冲液,ph8.73中
向1cm的石英比色皿中加入2ml等份的任一溶液。将比色皿插入保持在35℃的恒温比色皿架中。在254nm(sptz)和312nm(spox)下对氧化动力学进行64小时的分光光度监测。结果见图3(sptz溶液)和图4(spox溶液)。
实施例2-参考化学发光底物
如下制备两种化学发光参考底物:
l/sptz1底物
[鲁米诺]=5.0mm
[过硼酸钠]=4mm
[sptz]=1.5mm
在150mmtris缓冲液,ph9.0中。
初始信号设置为100rlu(相对光单位)
l/sptz2底物
[鲁米诺]=5.0mm
[过硼酸钠]=4.0mm
[sptz]=3.0mm
[morp]=3.0mm
在125mmtris缓冲液,ph9.0中。
l/sptz2的初始信号比l/sptz1高10倍。
实施例3-化学发光信号与鲁米诺/过硼酸盐/spox底物中spox浓度的依赖性
制备具有以下组成的一系列化学发光底物:
[鲁米诺]=5.0mm
[过硼酸钠]=4mm
[spox]=0-3.0mm[增强剂]
在125mmtris缓冲液,ph9.0中
200μl的这些底物置于黑色96-孔微孔板中。向每个孔中加入30μlhrp溶液(20mg/l溶液的1/3700),然后将板放入wallacvictor-3读板仪中。
用设定为100rlu的参考底物l/sptz1(实施例2)标准化的初始化学发光信号相对于spox浓度作图,如图5所示。
实施例4-鲁米诺/过硼酸盐/spox底物中化学发光信号的ph相关性
制备具有以下组成的一系列化学发光底物:
[鲁米诺]=5.0mm
[过硼酸钠]=4.0mm
[spox]=0.3mm(增强剂)
ph7.80-9.30125mmtris缓冲液
200μl的这些底物置于黑色96-孔微孔板中。向每个孔中加入30μlhrp溶液(20mg/l溶液的1/3700),然后将板放入wallacvictor-3读板仪中。
用设定为100rlu的参考底物l/sptz1(实施例2)标准化的初始化学发光信号相对于ph值作图,如图6所示。
实施例5-化学发光信号与鲁米诺/过硼酸盐/spox/morp底物中morp浓度的相关性
制备具有以下组成的一系列化学发光底物:
[鲁米诺]=5.0mm
[过硼酸钠]=4.0mm
[spox]=3.0mm(增强剂)
[morp]=0-10mm(共增强剂)
在ph9.0,125mmtris缓冲液中
200μl的这些底物置于黑色96-孔微孔板中。向每个孔中加入30μlhrp溶液(20mg/l溶液的1/3700),然后将板放入wallacvictor-3读板仪中。
用设定为100rlu的参考底物l/sptz1(实施例2)标准化的初始化学发光信号相对于morp浓度作图,如图7所示。
实施例6-化学发光信号与鲁米诺/过硼酸盐/spox/咪唑底物中咪唑浓度的相关性
制备具有以下组成的一系列化学发光底物:
[鲁米诺]=0.15mm
[过硼酸钠]=4.0mm
[spox]=0.3mm(增强剂)
[咪唑]=0-20mm(共增强剂)
在ph9.0,125mmtris缓冲液中
200μl的这些底物置于黑色96孔微孔板中。向每个孔中加入30μlhrp溶液(20mg/l溶液的1/3700),然后将板放入wallacvictor-3读板仪中。
用设定为100rlu的参考底物l/sptz1(实施例2)标准化的初始化学发光信号相对于咪唑浓度作图,如图8所示。
实施例7-鲁米诺/过硼酸盐/spox/morp和鲁米诺/过硼酸盐/spox/咪唑底物中化学发光信号的ph相关性
制备具有以下组成的两个系列的化学发光底物:
共增强剂=morp
[鲁米诺]=5.0mm
[过硼酸钠]=4.0mm
[spox]=0.3mm(增强剂)
[morp]=3.0mm(共增强剂)
ph7.80-9.40125mmtris缓冲液
共增强剂=咪唑
[鲁米诺]=5.0mm
[过硼酸钠]=4.0mm
[spox]=0.3mm(增强剂)
[咪唑]=8.0mm(共增强剂)
ph7.80-9.40125mmtris缓冲液
200μl的这些底物置于黑色96-孔微孔板中。向每个孔中加入30μlhrp溶液(20mg/l溶液的1/3700),然后将板放入wallacvictor-3读板仪中。
用设定为100rlu的参考底物l/sptz1(实施例2)标准化的初始化学发光信号相对于ph值作图,如图9所示。
实施例8-化学发光信号与l-012/过硼酸盐/spox底物中spox浓度的相关性
制备具有以下组成的一系列化学发光底物:
[l-012]=0.15mm
[过硼酸钠]=4.0mm
[spox]=0-0.4mm(增强剂)
在ph6.9,125mmtris缓冲液中
200μl的这些底物置于黑色96-孔微孔板中。向每个孔中加入30μlhrp溶液(20mg/l溶液的1/3700),然后将板放入wallacvictor-3读板仪中。
用设定为100rlu的参考底物l/sptz1(实施例2)标准化的初始化学发光信号相对于咪唑浓度作图,如图10所示。
实施例9-l-012/过硼酸盐/spox底物中化学发光信号的ph相关性
制备具有以下组成的一系列化学发光底物:
[l-012]=0.15mm
[过硼酸钠]=4.0mm
[spox]=0.3mm(增强剂)
ph6.30-7.60125mmtris缓冲液
200μl的这些底物置于黑色96-孔微孔板中。向每个孔中加入30μlhrp溶液(20mg/l溶液的1/3700),然后将板放入wallacvictor-3读板仪中。
用设定为100rlu的参考底物l/sptz1(实施例2)标准化的初始化学发光信号相对于ph值作图,如图11所示。
实施例10-化学发光信号与l-012/过硼酸盐/spox/morp底物中morp浓度的相关性
制备具有以下组成的一系列化学发光底物:
[l-012]=0.15mm
[过硼酸钠]=4.0mm
[spox]=0.15mm(增强剂)
[morp]=0-3.0mm
ph6.9,125mmtris缓冲液
200μl的这些底物置于黑色96-孔微孔板中。向每个孔中加入30μlhrp溶液(20mg/l溶液的1/3700),然后将板放入wallacvictor-3读板仪中。用设定为100rlu的参考底物l/sptz1(实施例2)标准化的初始化学发光信号相对于咪唑浓度作图,如图12所示。
实施例11-鲁米诺/spox和l-012/spoxvs.鲁米诺/sptz底物
基于鲁米诺、以spox为增强剂的三种化学发光底物如下制备:
1.l/spox2
[鲁米诺]=4.0mm
[过硼酸钠]=4.0mm
[spox]=1.0mm(增强剂)
[morp]=5.0mm(共增强剂)
在ph9.00,150mmtris缓冲液中
共增强剂=咪唑
2.l/spox6
[鲁米诺]=3.8mm
[过硼酸钠]=1.6mm
[spox]=0.34mm(增强剂)
[咪唑]=12.0mm(共增强剂)
在ph9.00,150mmtris缓冲液中
3.l/spox10
[鲁米诺]=3.8mm
[过硼酸钠]=1.6mm
[spox]=0.34mm(增强剂)
[咪唑]=12.0mm(共增强剂)
在ph8.20,150mmtris缓冲液中
4.l/spox16
[鲁米诺]=1.6mm
[过硼酸钠]=1.6mm
[spox]=0.34mm(增强剂)
[咪唑]=12.0mm(共增强剂)
在ph8.85,1m磷酸盐/磷酸氢盐缓冲液中
5.l012/spox
[l-012]=0.6mm
[过硼酸钠]=1.75mm
[spox]=0.74mm(增强剂)
[morp]=1.75mm(共增强剂)
在ph7.650mm/30mmtris/磷酸氢盐缓冲液中
记录这些底物每一种以及实施例2的鲁米诺/sptz参考底物(l/sptz1和l/sptz2)的初始化学发光信号水平。结果以条形图绘制,如图13所示。
实施例12-鲁米诺/spox、l-012/spox与鲁米诺/sptz化学发光底物在蛋白质印迹分析中的性能比较
一系列鲁米诺/spox化学发光底物与鲁米诺/sptz底物进行比较。底物在蛋白质印迹分析中测试以检测hela细胞裂解物中的hdac-1。一系列2倍稀释的细胞裂解物(5至0.078μg)/(2.5至0.039μg)在4-20%的mini-proteantgx预制凝胶上运行,并使用
当然,尽管本发明的原理保持相同,但是在不脱离本发明范围的情况下,构造和实施方案的细节可以相对于已经通过示例方式描述和说明的情况发生广泛的变化。
- 还没有人留言评论。精彩留言会获得点赞!