一种纳米絮凝剂的制备及其污水处理应用的制作方法
本发明涉及一种纳米絮凝剂的制备方法及其污水处理应用,属于污水处理和高分子材料改性技术领域。
背景技术:
水中的污染物成分复杂,既可能存在无机污染物,也可能同时存在有机污染物。由于采矿业、电池业的发展,土壤中、水中的无机污染物重金属铅离子广泛存在。铅在生态系统和人体内积累将造成巨大危害。而双酚a是一种有机污染物,是一种内分泌干扰化合物,可影响高等动物多方面的生理代谢,因双酚a广泛应用于各种塑料制品的生产而在环境中的含量剧增。
常用的废水处理方法有化学沉淀法、离子交换法、膜分离法、吸附法,絮凝法等。其中胶束增效超滤法(meuf)是一种利用表面活性剂双亲分子结构特性来实现分离水中污染物的方法。虽然meuf能去除水中的金属离子和有机物,但是由于需要用超滤膜进行过滤,污染物保留在一个浓缩的溶液中,存在膜易堵塞、后操作复杂、能耗较高等缺点。吸附胶束絮凝法(adsorptivemicellarflocculation,amf)是另一种可处理含多种复杂污染物的废水处理方法。amf法基于阴离子表面活性剂十二烷基硫酸钠(sds)在水中形成胶束,先增溶水中的低分子量的有机污染物,然后利用铝离子、铁离子与阴离子结合形成絮凝沉淀,以去除污染物。federico等利用amf法处理含苯酚的废水,获得较高的去除率。虽然amf法无需超滤膜,吸附过程快,但是易形成污染物残留,导致二次污染,另外它无法处理饮用水,对金属阳离子去污能力有限。因此,制备一种操作简单,成本低,无污染的絮凝剂是亟待解决的问题。
利用无毒且可降解的天然高分子材料来制备胶束絮凝剂来吸附污染物是一种新的研究方法。新型的纳米絮凝剂不仅可有效去除重金属阳离子,还可去除小分子有机污染物,纳米絮凝剂的制备具有操作简单、条件温和、后处理容易的优点,该方法还未见文献报道。
技术实现要素:
本发明所要解决的问题是,提供一种操作简单、条件温和、后处理容易、成本低、无污染的絮凝剂及其制备方法。本专利以海藻酸钠为原料,标记为sa,经氧化开环后,与脂肪胺发生偶联反应,合成了一种新型的纳米絮凝剂,标记为sadc。sa是一种天然高分子,其来源丰富、价格低廉、易降解、生物相容性好,是一种无毒无害的天然环保材料。由于sa分子链上本身已经具有亲水的羧酸基团,经接枝脂肪胺后,絮凝剂能在水溶液中通过自组装形成纳米胶束。与现有絮凝剂相比,操作简单、条件温和、后处理容易、成本低、无污染。
本发明的第一个目的是,提供一种纳米絮凝剂,所述为脂肪胺改性海藻酸钠的纳米粒子,所述脂肪胺改性海藻酸钠的分子主链是海藻酸钠线性聚合物,侧链偶联脂肪胺,在水溶液中通过自组装形成的纳米粒子,优选为为棒状型。
在一种实施方式中,所述纳米絮凝剂用于污水处理。
本发明的第二个目的是提供一种纳米絮凝剂的制备方法,将海藻酸钠改性后与脂肪胺发生偶联反应,合成了一种新型的纳米絮凝剂,包括以下步骤:
(1)在海藻酸钠的乙醇溶液中加入高碘酸钠水溶液,室温避光反应7~9小时后,再加入乙二醇终止反应,过滤产物,用乙醇洗涤产物,干燥后得到氧化海藻酸钠;将其溶解于去离子水中配成水溶液,作为下一步使用;
(2)将脂肪胺溶于有机溶剂配成溶液,在40~60℃水浴条件下,在搅拌下将脂肪胺溶液缓慢加入到上述氧化海藻酸钠水溶液中,反应10~12h后冷却至室温,得到反应液;
(3)将步骤(2)中的反应液在冰水浴中冷却,边搅拌边加入还原剂,在24~30℃水浴条件下继续反应12h,停止反应,按反应液的2~3倍量加入无水乙醇,4℃静置6~8h,将沉淀干燥,得到改性海藻酸钠纳米絮凝剂前体;
(4)将上述改性海藻酸钠纳米絮凝剂前体溶于极性有机溶剂,配成浓度为25w%的溶液,然后在搅拌下缓慢滴加到去离子水中,直至稳定的纳米粒子出现,得到改性海藻酸钠纳米絮凝剂。
在一种实施方式中,步骤(1)中,海藻酸钠的乙醇溶液中海藻酸钠的浓度为8w%~16w%,高碘酸钠水溶液浓度为6w%~10w%,海藻酸钠的乙醇溶液与高碘酸钠水溶液体积比1:1。
在一种实施方式中,步骤(2)中,脂肪胺包括碳原子数8~12的伯胺。
在一种实施方式中,步骤(2)中,有机溶剂为异丙醇、四氢呋喃,二氧六环或n,n-二甲基甲酰胺中的一种或两种。
在一种实施方式中,步骤(2)中,所述氧化海藻酸钠结构单元数与脂肪胺的摩尔数比为1:1~1:2。
在一种实施方式中,步骤(3)中,所述还原剂包括甲基硼氢化钠或硼氢化钠,还原剂的添加量为海藻酸钠的15~20w%,目的是将c=n双键还原为饱和键。
在一种实施方式中,步骤(4)中,极性有机溶剂包括无水乙醇、n,n-二甲基甲酰胺或二甲亚砜,所述脂肪胺改性海藻酸钠溶液浓度为25~30w%。
本发明的第三个目的是提供上述方法得到的絮凝剂。
在一种实施方式中,所述的一种纳米絮凝剂或按照所述方法制备的纳米絮凝剂,在污水处理方面的应用,在污水中添加纳米絮凝剂,除去重金属离子和/或有机物质。
本发明具有如下有益效果:
1.本发明提供的纳米絮凝剂是国内外的首次报道,为污水处理提供了新的解决方式。
2.制备方法简单,通过严格控制工艺参数和条件,成功制备的纳米絮凝剂具有纳米尺寸,与污染物接触面大,提高了对污染物的去除率,可以同时去除重金属阳离子和小分子有机污染物,大大扩展了其在废水处理领域的应用范围。
3.原料海藻酸钠是一种天然高分子来源丰富、价格低廉,所制备的纳米絮凝剂易降解、生物相容性好、后续操作简单,是一种无毒无害的绿色环保型污水处理剂。
附图说明
图1本发明纳米絮凝剂的红外光谱图
图2本发明纳米絮凝剂的1h-nmr图
图3本发明纳米絮凝剂的热重分析tga图
图4本发明纳米絮凝剂及其与pb2+絮凝物的光电子能谱图
图5本发明纳米絮凝剂吸附bpa前后形貌的扫描电镜观察,(a)吸附前;(b)吸附后
图6ph值对本发明纳米絮凝剂吸附pb2+、bpa的影响
图7pb2+和bpa溶液初始浓度对去除率的影响
具体实施方式
下面结合具体实施方式和附图,对本发明的技术方案做进一步详细描述。
实施例1:
步骤1,将9.9g海藻酸钠(0.05mol结构单元)粉末加入到100ml无水乙醇中,磁力搅拌分散均匀,加入100ml含0.03mol高碘酸钠水溶液,室温避光反应8小时,加入10ml乙二醇终止反应,过滤产物,并用70%乙醇洗三次,干燥后得到氧化海藻酸钠,标记为osa;将其溶解于240ml去离子水中配成水溶液,作为下一步使用;
步骤2,另外取9.36g(0.05mol)1-十二胺(标记为dc)溶解在20毫升二氧六环中,在50℃水浴条件下、在搅拌下将脂肪胺溶液缓慢加入到氧化海藻酸钠水溶液中,反应12h。停止反应,冷却至室温,得到反应液。
步骤3,将上述反应液在冰水浴中边搅拌边分批加入1.80g硼氢化钠,30℃水浴条件下继续反应12h。停止反应,按反应液的2倍量加入无水乙醇,4℃静置8h,将沉淀干燥,得到改性海藻酸钠纳米絮凝剂前体,计算产物增重率(pgr%),定义为:
式中:m、m0分别为改性后与改性前海藻酸钠的重量。
步骤4,将改性海藻酸钠纳米絮凝剂前体溶于二甲亚砜,配成浓度为25w%的溶液,然后在磁力搅拌下缓慢滴加到去离子水中,直至稳定的纳米粒子出现,得到改性海藻酸钠纳米絮凝剂,标记为sadc-1。
实施例2:
本实施例的步骤1与实施例1相同;
步骤2,取13.9g(0.075mol)1-十二胺(标记为dc)溶解在22毫升二氧六环中,在50℃水浴条件下、在搅拌下将脂肪胺溶液缓慢加入到氧化海藻酸钠水溶液中,反应12h。停止反应,冷却至室温,得到反应液。
步骤3,将上述反应液在冰水浴中边搅拌边分批加入1.76g硼氢化钠,30℃水浴条件下继续反应12h。停止反应,按反应液的2倍量加入无水乙醇,4℃静置8h,将沉淀干燥,得到改性海藻酸钠纳米絮凝剂前体,计算产物增重率(pgr%)。
步骤4,将改性海藻酸钠纳米絮凝剂前体溶于二甲亚砜,配成浓度为25w%的溶液,然后在磁力搅拌下缓慢滴加到去离子水中,直至稳定的纳米粒子出现,得到改性海藻酸钠纳米絮凝剂,标记为sadc-2。
实施例3:
本实施例的步骤1与实施例1相同;
步骤2,取18.35g(0.1mol)1-十二胺(标记为dc)溶解在24毫升二氧六环中,在50℃水浴条件下、在搅拌下将脂肪胺溶液缓慢加入到氧化海藻酸钠水溶液中,反应12h。停止反应,冷却至室温,得到反应液。
步骤3,将上述反应液在冰水浴中边搅拌边分批加入1.64g硼氢化钠,30℃水浴条件下继续反应12h。停止反应,按反应液的2倍量加入无水乙醇,4℃静置8h,将沉淀干燥,得到改性海藻酸钠纳米絮凝剂前体,计算产物增重率(pgr%)。
步骤4,将改性海藻酸钠纳米絮凝剂前体溶于二甲亚砜,配成浓度为25w%的溶液,然后在磁力搅拌下缓慢滴加到去离子水中,直至稳定的纳米粒子出现,得到改性海藻酸钠纳米絮凝剂,标记为sadc-3。
实施例4:
本实施例的步骤1与实施例1相同;
步骤2,取6.46g(0.05mol)1-辛胺,(标记为oa)溶解在15毫升二氧六环中,在50℃水浴条件下、在搅拌下将脂肪胺溶液缓慢加入到氧化海藻酸钠水溶液中,反应12h。停止反应,冷却至室温,得到反应液。
步骤3,将上述反应液在冰水浴中边搅拌边分批加入1.64g硼氢化钠,30℃水浴条件下继续反应12h。停止反应,按反应液的2倍量加入无水乙醇,4℃静置8h,将沉淀干燥,得到改性海藻酸钠纳米絮凝剂前体,计算产物增重率(pgr%)
步骤4,将改性海藻酸钠纳米絮凝剂前体溶于二甲亚砜,配成浓度为25w%的溶液,然后在磁力搅拌下缓慢滴加到去离子水中,直至稳定的纳米粒子出现,得到改性海藻酸钠纳米絮凝剂,标记为saoa-1。
实施例5:
本实施例与实施例4相同,但是在步骤2中将1.64g硼氢化钠改变为1.82g甲基硼氢化钠,其余方法相同,得到改性海藻酸钠纳米絮凝剂,标记为saoa-2。
实施例6:纳米絮凝剂的表征
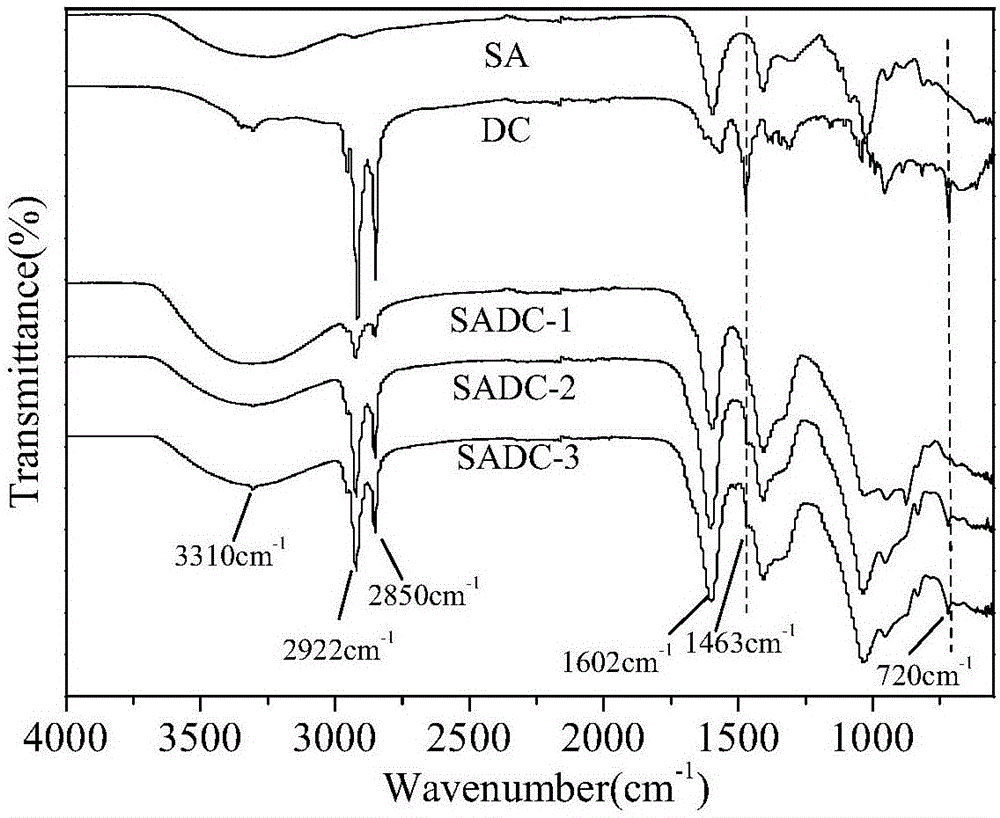
(1)红外光谱分析(ftir)
采用全反射傅里叶红外光谱仪对sa、dc、纳米絮凝剂sadc-1、sadc-2和sadc-3进行红外光谱分析,实验结果见图1。
图1中,3265cm-1峰为-oh和-nh的伸缩振动叠加峰,1602cm-1峰为-c=o的伸缩振动及-nh面内弯曲振动叠加峰。对比sa与纳米絮凝剂sadc-1、sadc-2和sadc-3的红外图谱,纳米絮凝剂sadc-1、sadc-2和sadc-3产生了新的吸收峰2922cm-1和2850cm-1,属于-ch3基团的特征吸收峰,分别由反对称伸缩振动与对称伸缩振动吸收产生;新出现的峰1463cm-1则归属于-ch2的弯曲振动,而新出现的峰720cm-1则归属于-nh面外弯曲振动吸收峰。由此可充分证明sa分子链上成功引入了dc。羧酸基团-coo-和长链烷基的同时存在,也说明纳米絮凝剂sadc-1、sadc-2和sadc-3是同时具有亲水基团和疏水基团的新型絮凝剂。
(2)核磁共振谱分析(1h-nmr)
测定了sa、dc、sadc系列絮凝剂的核磁共振氢谱,结果见图2。
由图2可知,对比sa、sadc的核磁氢谱,在纳米絮凝剂sadc-1、sadc-2和sadc-3的图谱中,出现了新的化学位移峰δ=0.81、δ=1.20、δ=2.55,这三个峰分别归属于-ch3,-(ch2)10-,以及与n原子相连的-ch2-,而sa核磁氢谱中,无此三个峰,充分证明絮凝剂分子链上成功有效的引入了dc。
(3)元素分析
采用元素分析仪,对絮凝剂样品中的c、n、s三种元素进行了测试,结果如表1所示。由表1可知,系列絮凝剂都含有一定比例的n元素,说明sa分子链上成功接枝上了dc。随着dc用量的增多,絮凝剂上的dc接枝率也越高。
表1纳米絮凝剂的制备
a):结构单元;b):本实施例中用oa代替dc
(4)tga热重分析
热重分析图(图3)显示了sa与纳米絮凝剂sadc-1、sadc-2、sadc-3的结构变化。sa在25-109℃温度范围内失重13%,失去的主要是结合水。经过一段稳定期后,sa在230-280℃温度范围内快速失重,这主要是由于sa的热分解失重。而sadc在25-108℃温度范围内重量保持稳定,说明纳米絮凝剂sadc-1、sadc-2和sadc-3含水量极少,而且在此温度范围内热稳定性好。这主要是因为纳米絮凝剂sadc-1、sadc-2和sadc-3分子链上的糖环被氧化开环之后,原有的强吸水性能被破坏,分子的结合水极少。在109-210℃温度范围内,纳米絮凝剂sadc-1、sadc-2和sadc-3样品缓慢失重10%,之后开始了快速失重,在355℃之前sadc的失重率都小于sa样品,说明sa在开环接枝dc后,纳米絮凝剂sadc-1、sadc-2和sadc-3的热稳定性优于sa。
实施例7:纳米絮凝剂的絮凝性能
将所得纳米絮凝剂配制成浓度为1%(w/w)的水溶液,pb2+储备液浓度1000mg/l,双酚a(bpa)储备液浓度300mg/l,可稀释成不同浓度的模拟废水。用1mol/lnaoh和1mol/lhcl溶液调节废水溶液ph值。所有絮凝实验在摇床上进行。方法如下:室温下,在配置好的模拟废水中加入设定量的絮凝剂,调节溶液ph值,以110r/min的速度震荡30min,离心分离,测定溶液中pb2+及bpa的含量。
重金属离子pb2+溶液浓度用原子吸收分光光度法测定,双酚a溶液浓度用分光光度法。絮凝剂对pb2+及bpa的去除率用式(1)计算:
式中,rr是pb2+或bpa的去除率(%),c0是絮凝前溶液中的pb2+或bpa浓度(mg/l),c是吸附后溶液中的剩余pb2+或bpa浓度(mg/l)。
(1)溶液ph值对絮凝效果的影响
以500mg/lpb2+溶液为模拟废水,分别将25mg实施例1、2或3中获得的纳米絮凝剂sadc-1、sadc-2或sadc-3添加入至模拟废水中,并分别在ph值2~6的条件下进行絮凝实验,结果如图6(a)所示。再以100mg/lbpa溶液为模拟废水,分别将50mg纳米絮凝剂sadc-1、sadc-2或sadc-3,并分别在ph值3~9的条件下进行絮凝实验,结果如图6(b)所示。
由图可知,随着溶液ph值的增加,絮凝剂对pb2+和bpa的去除率都逐渐增加。sa-bpa对pb2+的絮凝,主要是羧基-coo-与重金属离子的螯合作用进行絮凝的,随着ph降低,羧基-coo-被大量的氢离子h+质子化,无法与重金属离子螯合絮凝,重金属离子去除率低;而对bpa的絮凝作用,是纳米胶束内部的疏水基团对bpa的增溶作用。当ph值减小,h+浓度增大时,分子中的-nh-基团会变成-n+h2基团,胶束分子之间的静电斥力会增加,形成胶束的难度增大,因此对bpa的增溶作用降低,bpa的去除率会降低。
(2)污染物初始浓度对絮凝效果的影响
以初始浓度为100、200、400、600、800和1000mg/l的pb2+溶液为模拟废水,向模拟废水中添加纳米絮凝剂sadc-1、sadc-2或sadc-3(添加量是pb2+质量的2倍)进行絮凝实验,絮凝结果如图7(a)所示。
以初始浓度为10、20、40、60、80和100mg/l的双酚a(bpa)溶液为模拟废水进行絮凝实验,向模拟废水中添加纳米絮凝剂sadc-1、sadc-2和sadc-3(添加量是bpa质量的50倍)进行絮凝实验,絮凝结果如图7(b)所示。
由图7可知,随着污染物pb2+与bpa初始浓度增加,sadc对污染物pb2+与bpa的去除率都逐渐增加。这是因为,对pb2+絮凝的初始阶段,纳米絮凝剂sadc-1、sadc-2和sadc-3与污染物之间形成的是微小絮体。污染物初始浓度越高,初始形成的微小絮体也越多,也越容易聚集成大的絮体并沉淀,污染物的去除率也越高。而对bpa的絮凝过程中,bpa初始浓度越高,bpa分子越容易进入纳米胶束内核,因此bpa初始浓度越高,絮凝剂对污染物的去除率也越大。
(3)絮凝剂阳离子取代度对絮凝效果的影响
不同增重率(pgr)的纳米絮凝剂对pb2+、bpa絮凝结果如表3所示。由表3可知,纳米絮凝剂中增重率对pb2+及bpa的去除率变化规律相反,pgr越高,对pb2+的去除率越低,而对bpa的去除率却越高。
纳米絮凝剂对pb2+的絮凝,主要由分子链上的氧原子与pb2+之间进行电子流的转化进而螯合絮凝。pgr越高,纳米絮凝剂分子链上的-oh被dc取代就越多,-oh基团就会越少,因而对pb2+的去除率就越低。而sadc对bpa的絮凝原理,则是因为sadc在溶液中形成的纳米胶束颗粒的增溶作用,dc越多,所能增溶的bpa越多,所以去除率也越高。
表3纳米絮凝剂sadc接枝度对pb2+和bpa去除率的影响
注:m(sadc):m(pb2+)=2:1,m(sadc):m(bpa)=50:1
(4)光电子能谱分析
利用光电子能谱(xps)分别测试了sadc-3絮凝pb2+前后部分原子轨道结合能的变化,宽谱扫描结果见图4。原子失电子伴随着结合能增加,而得电子伴随着结合能减少,通过分析絮凝前后原子轨道结合能的变化,可以了解絮凝过程中氧原子与金属离子之间的电子流变化,结果显示如表2所示。纳米絮凝剂絮凝pb2+后,o1s轨道的结合能升高了0.48ev,而pb-4f7/2与pb-4f5/2轨道结合能分别减少了1.01ev和1.17ev。因此,纳米絮凝剂中的o原子贡献了电子,而pb2+接受电子。另外,c1s和n1s结合能变化非常小,说明不参与螯合絮凝过程。由此可以得出结论,絮凝过程是从非金属原子(氧)到金属原子pb2+之间的电子流形成了稳定的螯合作用。由于纳米絮凝剂分子单元中-coo-基团和-oh基团都含有o原子,因此,可以推断,-coo-基团和-oh基团都参与了与pb2+的螯合絮凝过程。
表2.纳米絮凝剂吸附pb2+前后轨道结合能变化(ev)
(5)扫描电镜观察(sem)
sadc分子链一端含有亲水基团-coo-,一段含有疏水基团十二烷基,在水溶液中形成胶束。改性海藻酸钠纳米絮凝剂sadc-3的形貌如图5(a)所示,絮凝bpa之后的形貌如图5(b)所示。观察到改性海藻酸钠纳米絮凝剂在水溶液中形成了约100nm的棒状胶束。在胶束内部的非极性区域,bpa富集于其中,纳米胶束粒子外形也发生变化,此即为sadc纳米胶束对bpa的增溶作用。
以上实施例仅用以说明本发明的技术方案而非限制,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!